22
IV.
HASIL DAN PEMBAHASAN
Metode yang direkomendasikan untuk menganalisis komponen kimia yang terkandung dalam produk pangan ialah metode yang telah divalidasi atau diverifikasi (EURACHEM Guide 1998). Metode analisis serat pangan yang digunakan dalam penelitian ini ialah enzimatik-gravimetri berdasarkan AOAC OfficialMethod 985.29; 993.19; dan 991.42 (1999) dan metode Asp (1992).
Prinsip analisis serat pangan secara enzimatik gravimetri ialah hidrolisis karbohidrat yang dapat dicerna, lemak, dan protein menggunakan enzim. Molekul yang tidak larut maupun yang tidak terhidrolisis dipisahkan melalui penyaringan sebagai residu. Residu serat tersebut kemudian dikeringkan serta ditimbang. Selanjutnya residu hasil penimbangan tersebut dianalisis kadar protein dan abunya. Kadar serat pangan diperoleh setelah residu dikurangi kadar protein dan kadar abu. Kekurangan metode enzimatik-gravimetri ialah memiliki prosedur yang sangat panjang dan tidak praktis sehingga memerlukan waktu yang lama (Ceirwyn 1999).
Matriks sampel yang digunakan dalam penelitian ini antara lain kacang kedelai, kacang tanah, oat, serta wortel. Keempat sampel yang dipilih ialah sampel yang mewakili kelompok bahan pangan dalam piramida makanan. Matriks sampel tersebut antara lain merupakan makanan tinggi protein, lemak, karbohidrat, serta kelompok sayur dan buah.
Sebelum sampel dianalisis kadar serat pangannya, sampel yang mengandung kadar air yang tinggi terlebih dahulu dikeringkan. Proses pengeringan sampel berbeda satu sama lain. Sampel wortel memiliki kadar air yang tinggi dan komponen yang sensitif terhadap panas. Oleh karena itu proses pengeringan wortel dilakukan menggunakan oven vakum pada suhu 70oC selama lima jam hingga kadar air kurang dari 5%. Untuk sampel yang mengandung kadar lemak yang tinggi (> 10%), seperti kacang kedelai (17.00%) dan kacang tanah (47.90%), maka kedua sampel tersebut terlebih dahulu dihilangkan lemaknya dengan proses ekstraksi menggunakan pelarut petroleum eter. Sampel hasil ekstraksi kemudian dikeringkan dengan menggunakan oven pada suhu 105oC selama 12 jam untuk menghilangkan pelarut petroleum eter. Sampel kacang kedelai dan kacang tanah Sementara oat tidak dihilangkan lemaknya karena kadar lemaknya kurang dari 10%, yaitu 7%.
Wortel yang telah dikeringkan, kacang tanah dan kacang kedelai yang sudah dihilangkan lemaknya serta oat kemudian dikecilkan ukurannya menjadi 40-50 mesh. Sampel yang telah berbentuk bubuk kering selanjutnya dapat dianalisis kadar serat pangannya menggunakan metode AOAC dan Asp.
4.1
TOTAL SERAT PANGAN (TDF)
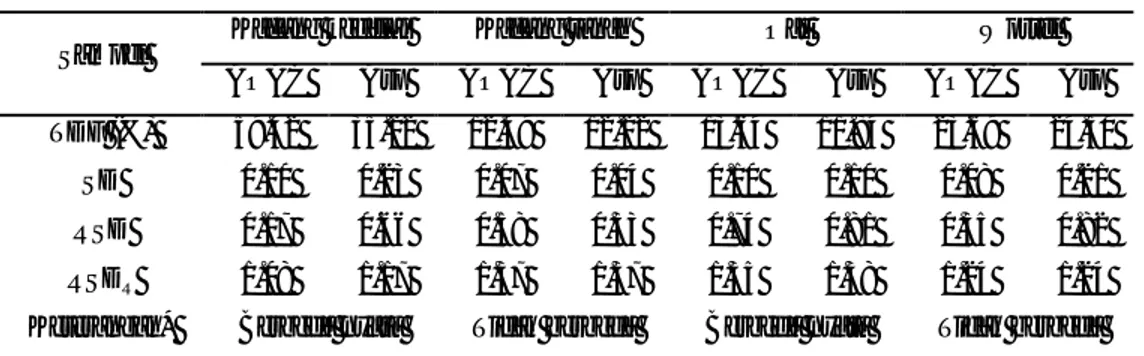
Kadar TDF sampel yang dianalisis menggunakan metode AOAC dan Asp dapat dilihat pada Tabel 6. Uji t dilakukan terhadap nilai rata-rata kadar TDF sampel yang diperoleh melalui analisis serat pangan metode AOAC dan Asp untuk melihat apakah terdapat perbedaan yang nyata diantara kedua kadar TDF tersebut. Selanjutnya, nilai kadar TDF yang diperoleh dibandingkan dengan rentang data sekunder yang diperoleh dari publikasi ilmiah (Redondo-Cuenca et al. 2006; Kutoz et al. 2003; Sanchez-Castillo et al. 1999; Englyst dan Hudson 1996; Prosky et al. 1988; AOAC 1995) yang dapat dilihat pada Tabel 7.
23 Tabel 6. Nilai TDF sampel menggunakan metode AOAC dan Asp
Sampel Kacang kedelai Kacang tanah Oat Wortel AOAC Asp AOAC Asp AOAC Asp AOAC Asp TDF (%) 59.42 35.22 12.49 12.22 13.64 11.84 23.69 24.30
SD 0.10 0.23 0.07 0.04 0.10 0.10 0.08 0.21 RSD 0.17 0.66 0.58 0.33 0.74 0.81 0.35 0.82 RSDR 1.08 1.17 1.37 1.37 1.35 1.38 1.24 1.24 Keterangan* Berbeda nyata Tidak berbeda Berbeda nyata Tidak berbeda
*Hasil uji t antara rata-rata TDF sampel metode AOAC dan Asp
Tabel 7. Data sekunder serat pangan pada kacang kedelai, kacang tanah, oat, dan wortel
Sampel Data sekunder
TDF (%) IDF (%) SDF (%) Kacang Kedelaia 30.03-49.02 22.52-36.765 7.54-12.31 Kacang Tanahb 8.07-13.74 7.13-12.13 0.94-1.41 Oatc 8.22-14.81 4.85–10.60 2.51–6.20 Worteld 23.25-30.30 9.20-11.72 11.53-21.10 a
Redondo-Cuenca et al. 2006; Kutoz et al. 2003
b
Sanchez-Castillo et al. 1999; Kutoz et al. 2003
cEnglyst dan Hudson 1996; Prosky et al. 1988 d
Englyst dan Hudson 1996; AOAC 1995
Kadar TDF kemudian dirata-ratakan dan ditentukan SD nya. Nilai RSD (Relative standard deviation) diperoleh dari nilai SD yang dinyatakan sebagai presentase dari rata-rata. Nilai RSD digunakan untuk menguji apakah analisis memiliki repeatability yang baik dengan membandingkannya terhadap RSDR (Horwitz). RSD analisis dapat diterima jika nilainya kurang dari 2/3 RSDR.
Kadar TDF kacang kedelai dengan menggunakan metode AOAC ialah 59.42%, dengan nilai SD sebesar 0.10%. Nilai ini berbeda nyata jika dibandingkan dengan metode Asp, yaitu 35.22% dengan nilai SD sebesar 0.23%. Hal ini dikarenakan metode AOAC tidak dapat menghidrolisis protein dengan sempurna, sehingga pada sampel tinggi protein seperti kacang kedelai, hasil analisis menjadi tidak akurat. Kadar TDF kacang kedelai dengan menggunakan metode AOAC menjadi lebih tinggi karena protein yang tidak terhidrolisis terhitung sebagai serat pangan. Kacang kedelai memiliki kadar protein yang tinggi (47.90%) Menurut Manas et al. (1994) tingginya kandungan protein pada kacang kedelai dapat menyebabkan kesalahan positif karena protein terikat pada komponen serat pangan dengan kuat. Enzim yang
24 digunakan pada metode AOAC untuk menghidrolisis protein adalah protease dengan aktivitas enzim sebesar 50 U/ml, sementara pada metode Asp enzim protease yang digunakan adalah pepsin dengan aktivitas enzim sebesar 2755 U/mg. Rendahnya aktivitas enzim yang digunakan pada metode AOAC menyebabkan hidrolisis protein pada sampel tidak sempurna sehingga komponen protein terhitung sebagai serat pangan.
Kadar TDF oat metode AOAC ialah 13.64% dengan SD 0.10%. Sementara dengan metode Asp menghasilkan nilai 11.84% dengan SD 0.10%. Kadar TDF oat metode AOAC lebih tinggi dibandingkan metode Asp dan nilai keduanya berbeda secara signifikan setelah diuji menggunakan uji t.
Oat mengandung kadar lemak sebesar 7% (Tabel 4). Kadar lemak yang terdapat di dalam sampel oat tidak diekstrak terlebih dahulu menggunakan petroleum eter karena kadar lemak yang terdapat di dalam oat kurang dari 10%. Kadar TDF oat dengan menggunakan metode AOAC lebih tinggi dibandingkan dengan menggunakan metode Asp. Hal ini diduga karena pada metode AOAC masih terdapat lemak yang terikat pada matriks sampel. Lemak yang masih tersisa dikarenakan proses penghilangan lemak pada sampel hanya dilakukan dengan proses pencucian residu menggunakan aseton, sementara pada metode Asp penghilangan lemak dilakukan baik dengan proses pencucian maupun proses hidrolisis dengan menggunakan enzim pankreatin. Prosedur hidrolisis lemak ini tidak terdapat pada metode AOAC. Meskipun demikian, kadar TDF oat metode AOAC masih berada di dalam rentang data sekunder (8.22-14.81%), begitu pula dengan metode Asp.
Data sekunder diperoleh dari publikasi ilmiah mengenai kadar serat pangan pada sampel yang digunakan pada penelitian ini, yaitu kacang kedelai, kacang tanah, oat dan wortel. Data sekunder berupa rentang nilai karena berasal dari beberapa referensi ilmiah. Kadar serat pangan yang diperoleh dari referensi menggunakan baik metode enzimatik-kimia maupun enzimatik-gravimetri. Metode enzimatik-kimia yang digunakan ialah metode Englyst (Redondo-Cuenca et al. 2006; Sanchez-Castillo et al. 1999; Englyst dan Hudson 1996). Enzim yang digunakan pada tahap isolasi serat pangan ialah α-amilase tahan panas, pankreatin, dan pullulanase untuk hidrolisis pati dan protein. Residu yang diperoleh berupa polisakarida dan oligosakarida selanjutnya ditambahkan HCL 5 M dan H2SO4 12 M untuk menghasilkan monosakarida-monosakarida. Monosakarida yang telah terpisah kemudian diidentifikasi menggunakan HPLC. Penjumlahan monosakarida yang teridentifikasi merupakan kadar TDF. Metode enzimatik-gravimetri yang digunakan ialah metode Prosky (Kutoz et al. 2003; Prosky et al. 1988) dan metode AOAC (AOAC 1995). Metode Prosky menggunakan enzim yang sama dengan metode Asp, yaitu pepsin dan pankreatin, sementara metode AOAC menggunakan enzim protease dan amiloglukosidase.
Kecenderungan nilai serat pangan yang diperoleh menggunakan metode enzimatik-gravimetri lebih kecil dibandingkan metode enzimatik-kimia pada semua sampel. Hal ini diduga karena pada metode enzimatik-gravimetri terdapat serat pangan yang ikut terlarut ke dalam filtrat pada proses filtrasi sehingga hasilnya lebih kecil dibandingkan metode enzimatik-kimia.
25
4.2
SERAT PANGAN TIDAK LARUT (IDF) DAN SERAT PANGAN
LARUT (SDF)
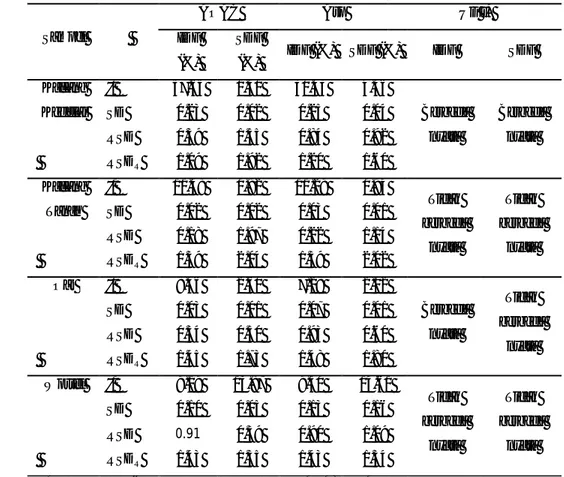
Uji t terhadap kadar IDF memiliki kecenderungan yang sama seperti yang terjadi pada analisis TDF terhadap semua sampel. Sampel yang memiliki nilai yang berbeda secara signifikan antara metode AOAC dan Asp ialah kacang kedelai dan oat. Sementara sampel kacang tanah dan wortel memiliki nilai yang tidak berbeda nyata. Uji t terhadap kadar SDF menghasilkan nilai yang berbeda nyata hanya pada sampel kacang kedelai, sementara kadar SDF sampel kacang tanah, oat, dan wortel tidak berbeda nyata.
Kadar IDF kacang kedelai dengan metode AOAC ialah 57.65%, dengan nilai SD sebesar 0.23%. Nilai ini berbeda nyata jika dibandingkan dengan metode Asp, yaitu 30.43% dengan nilai SD sebesar 0.25%. Kadar SDF kacang kedelai metode AOAC ialah 1.31% dengan SD 0.02%. Nilai ini juga berbeda nyata jika dibandingkan dengan metode Asp, yaitu 4.36% dengan SD sebesar 0.04%. Seperti yang telah dijelaskan pada sub-bab sebelumnya bahwa kadar protein tidak dapat dihidrolisis dengan sempurna pada metode AOAC, terutama pada sampel tinggi protein seperti kacang kedelai. Perbedaan aktivitas enzim protease yang digunakan pada metode AOAC dan Asp menghasilkan kadar IDF dan SDF yang berbeda.
Tabel 8. Nilai IDF dan SDF sampel menggunakan metode AOAC dan Asp
Sampel
AOAC Asp Uji t*
IDF (%) SDF (%) IDF (%) SDF (%) IDF SDF Kacang Kedelai x̅ 57.65 1.31 30.43 4.36 Berbeda nyata Berbeda nyata SD 0.23 0.02 0.25 0.04 RSD 0.39 1.55 0.84 0.92 RSDR 1.09 1.92 1.20 1.60 Kacang Tanah x̅ 11.48 0.92 11.29 0.94 Tidak berbeda nyata Tidak berbeda nyata SD 0.02 0.02 0.03 0.01 RSD 0.18 1.97 0.22 1.14 RSDR 1.39 2.04 1.39 2.02 Oat x̅ 8.46 2.60 7.28 2.02 Berbeda nyata Tidak berbeda nyata SD 0.03 0.01 0.07 0.01 RSD 0.34 0.50 0.93 0.60 RSDR 1.45 1.73 1.48 1.80 Wortel x̅ 9.19 13.87 9.50 14.61 Tidak berbeda nyata Tidak berbeda nyata SD 0.10 0.05 0.13 0.16 RSD 0.91 0.39 0.90 1.09 RSDR 1.43 1.35 1.43 1.34 *Uji t antara rata-rata serat pangan sampel metode AOAC dan Asp x̅ = Rata-rata
26 Sampel lain yang memiliki kadar IDF yang berbeda nyata antara metode AOAC (8.46%) dan Asp (7.28%) ialah oat. Seperti yang telah dijelaskan sebelumnya pada sub-bab TDF, kadar IDF menggunakan metode AOAC dan Asp berbeda secara signifikan karena masih terdapat lemak pada sampel yang terhitung sebagai serat pangan. Lemak yang terhitung sebagai serat pangan terdapat pada residu serat yang tidak larut air (IDF). Oleh karena itu, kadar SDF oat tidak berbeda nyata antara metode AOAC dan Asp karena tidak terdapat lemak pada residu serat larut (SDF). Proses pelarutan lemak pada tahap pencucian menggunakan aseton pada metode AOAC lebih baik dilakukan dengan volume yang lebih besar, misalnya 4 x 10 ml.
Tabel 9 dan 10 menunjukkan data serat pangan sampel yang diperoleh melalui metode AOAC dan Asp. Data serat pangan pada tabel menunjukkan adanya selisih antara nilai TDF dan penjumlahan antara SDF dan IDF. Nilai serat pangan yang diperoleh dari penjumlahan antara SDF dan IDF selalu lebih kecil jika dibandingkan dengan nilai TDF, baik pada metode AOAC maupun metode Asp. Hal ini diduga karena analisis SDF baik menggunakan metode AOAC maupun Asp menghasilkan data yang lebih rendah. Adapun faktor yang menyebabkan perbedaan hasil tersebut terjadi pada tahap pemisahan IDF dan SDF melalui proses penyaringan. Hal ini diduga karena pada analisis kadar TDF hanya dilakukan satu kali penyaringan, dan residu dianggap sebagai kadar serat pangan total. Akan tetapi, pada analisis IDF dan SDF dilakukan dengan menggunakan dua kali penyaringan, sehingga terdapat kemungkinan kesalahan pada proses. Kemungkinan terdapat SDF yang terikat pada IDF sehingga tidak terhitung sebagai SDF setelah tahap pemisahan. Selain itu, jika dilihat dari
repeatability analisis SDF menggunakan baik metode AOAC maupun Asp, keduanya menunjukkan repeatability yang jelek sementara repeatability analisis TDF dan IDF cukup baik. Pembahasan mengenai repeatability secara lebih detail terdapat di sub-bab selanjutnya.
Tabel 9. Data serat pangan sampel dengan metode AOAC
Sampel
AOAC
TDF (%) SDF + IDF (%) Selisih Keterangan*
Kacang Kedelai 59.42 58.95 0.47 Tidak berbeda nyata
Kacang Tanah 12.49 12.36 0.13 Tidak berbeda nyata
Oat 13.64 11.05 2.59 Berbeda nyata
Wortel 23.69 23.06 0.63 Tidak berbeda nyata *
Hasil Uji t antaranilai TDF (%) dan SDF+IDF (%)
Selain alasan yang bersifat teknis, alasan ketidakakuratan analisis SDF lainnya terkait dengan kesimpulan yang dikemukakan oleh Manas dan Saura-Calixto (1993) bahwa presipitasi SDF menggunakan etanol masih kurang akurat. Ketidakakuratan analisis SDF tersebut disebabkan oleh dua hal, yaitu adanya komponen non-serat (mineral) yang juga mengalami presipitasi, dan adanya komponen SDF yang tidak mengalami presipitasi secara
27 sempurna seperti pektin. Senyawa pektin hanya mampu mengendap sebanyak 84-89 %, tergantung pada pH larutan. Selain itu, inulin atau senyawa turunannya seperti
fructooligosaccharida (FOS) tidak dapat terendapkan oleh etanol karena memiliki bobot molekul yang rendah. Hal ini menjadikan komponen tersebut tidak terhitung sebagai serat pangan (BeMiller 2010).
Kesalahan yang terjadi pada analisis SDF dapat menyebabkan ketidakakuratan analisis. Salah satu cara untuk meminimalisir kesalahan tersebut yaitu dengan meningkatkan kualitas proses presipitasi. Proses presipitasi komponen SDF dapat ditingkatkan dengan beberapa cara antara lain memperpanjang waktu presipitasi serta mengatur pH larutan sesuai dengan komposisi dan karakter fisiko-kimia sampel (Manas dan Saura-Calixto 1993).
Uji t dilakukan untuk melihat apakah terdapat perbedaan yang signifikan antara antara nilai TDF dan penjumlahan IDF dan SDF. Perbedaan yang signifikan hanya terjadi pada sampel oat, baik yang dianalisis menggunakan metode AOAC maupun Asp. Perbedaan tersebut terjadi karena sebagian besar SDF yang terkandung dalam oat merupakan jenis β -glukan yang diduga tidak dapat dipresipitasi dengan sempurna oleh larutan alkohol 95%.
Tabel 10. Data serat pangan sampel dengan metode Asp
Sampel
Asp
TDF (%) SDF + IDF (%) Selisih Keterangan*
Kacang Kedelai 35.22 34.79 0.43 Tidak berbeda nyata
Kacang Tanah 12.22 12.12 0.10 Tidak berbeda nyata
Oat 11.84 9.31 2.53 Berbeda nyata
Wortel 24.30 24.11 0.19 Tidak berbeda nyata *
Hasil Uji t antaranilai TDF (%) dan SDF+IDF (%)
Apabila sebuah laboratorium hanya ingin mengetahui kadar serat total dalam bahan pangan, maka analisis yang dilakukan ialah analisis TDF. Akan tetapi apabila suatu sampel ingin diketahui kadar SDF dan IDFnya, maka analisis yang dilakukan terhadap sampel tersebut ialah analisis SDF dan IDF secara terpisah. Nilai TDF dapat diperoleh melalui penjumlahan antara kadar IDF dan SDF. Metode tersebut dapat dilihat di lampiran 3.
4.3
VERIFIKASI METODE TERHADAP ASPEK REPEATABILITY
Laboratorium yang telah memilih metode yang telah tervalidasi selanjutnya melakukan proses verifikasi metode untuk melihat apakah metode yang diadopsi dapat diterapkan di laboratorium yang bersangkutan. Salah satu aspek yang umum digunakan dalam verifikasi metode ialah aspek repeatability (Mullins 2003). Repeatability menunjukkan presisi hasil analisis. Aspek ini memungkinkan variasi terkecil yang dapat ditemukan pada sebuah
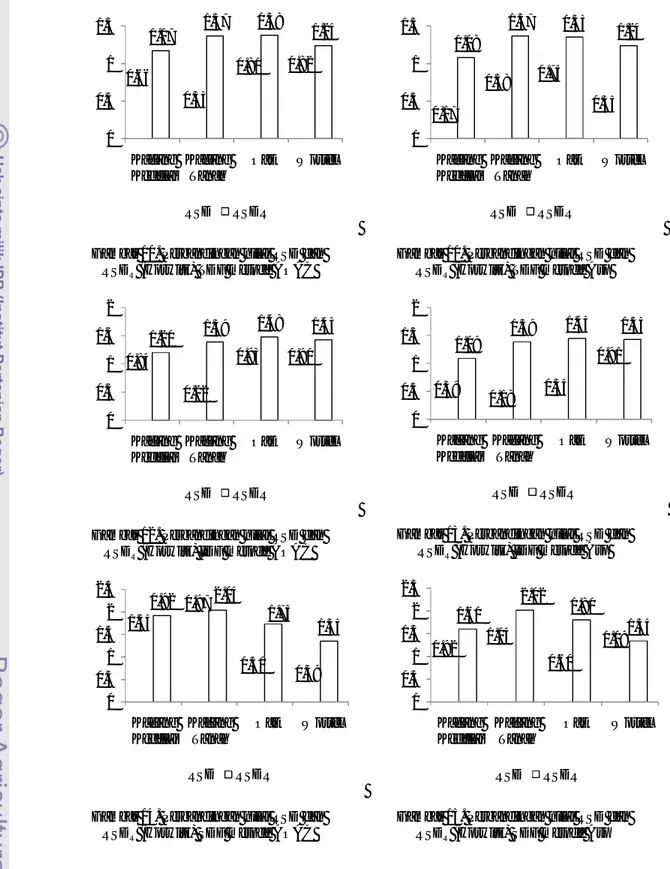
28 analisis. Perbandingan nilai RSD dan RSDR disajikan dalam bentuk diagram pada Gambar 10-15.
Gambar 10. Perbandingan nilai RSD dan RSDR (Horwitz) TDF metode AOAC
Gambar 12. Perbandingan nilai RSD dan RSDR (Horwitz) IDF metode AOAC
Gambar 14. Perbandingan nilai RSD dan RSDR (Horwitz) SDF metode AOAC
Gambar 11. Perbandingan nilai RSD dan RSDR (Horwitz) TDF metode Asp
Gambar 13. Perbandingan nilai RSD dan RSDR (Horwitz) IDF metode Asp
Gambar 15. Perbandingan nilai RSD dan RSDR (Horwitz) SDF metode Asp 0.66 0.33 0.81 0.82 1.17 1.37 1.38 1.24 0 0.5 1 1.5 Kacang Kedelai Kacang Tanah Oat Wortel RSD RSDR 0.84 0.22 0.93 0.90 1.20 1.39 1.48 1.43 0 0.5 1 1.5 2 Kacang Kedelai Kacang Tanah Oat Wortel RSD RSDR 1.55 1.97 0.50 0.39 1.92 2.04 1.73 1.35 0 0.5 1 1.5 2 2.5 Kacang Kedelai Kacang Tanah Oat Wortel RSD RSDR 0.17 0.58 0.74 0.35 1.08 1.37 1.35 1.24 0 0.5 1 1.5 Kacang Kedelai Kacang Tanah Oat Wortel RSD RSDR 0.39 0.18 0.34 0.91 1.09 1.39 1.45 1.43 0 0.5 1 1.5 2 Kacang Kedelai Kacang Tanah Oat Wortel RSD RSDR 0.92 1.14 0.60 1.09 1.60 2.02 1.80 1.34 0 0.5 1 1.5 2 2.5 Kacang Kedelai Kacang Tanah Oat Wortel RSD RSDR
29
Analisis yang memiliki repeatability yang baik jika memiliki nilai RSD yang lebih kecil dibandingkan RSDR, maksimal sebesar 2/3 RSDR (Pomeranz dan Meloan 1994; Garfield 2000).
Analisis terhadap TDF dan IDF pada metode AOAC dan Asp memiliki repeatability yang baik karena nilai RSD maksimal 2/3 RSDR. Akan tetapi, analisis SDF pada kedua metode memiliki
repeatability yang buruk karena terdapat analisis yang memiliki nilai RSD lebih dari 2/3 RSDR, yaitu
kacang kedelai dan kacang tanah metode AOAC serta wortel pada metode Asp.
Seperti yang telah dijelaskan pada sub-bab IDF dan SDF, permasalahan utama analisis SDF terletak pada proses presipitasi. Oleh karena itu, proses presipitasi harus dijadikan titik kritis analisis. Selain itu, beberapa peneliti menyarankan bahwa nilai SDF lebih baik diperoleh melalui teknik by difference setelah diperoleh nilai TDF dan IDF (Aman dan Graham 1987; Englyst dan Cummings 1988; Prosky et al. 1992). Kedua hal tersebut merupakan solusi ketidakakuratan analisis SDF.
4.4
VERIFIKASI METODE TERHADAP ASPEK SELEKTIVITAS
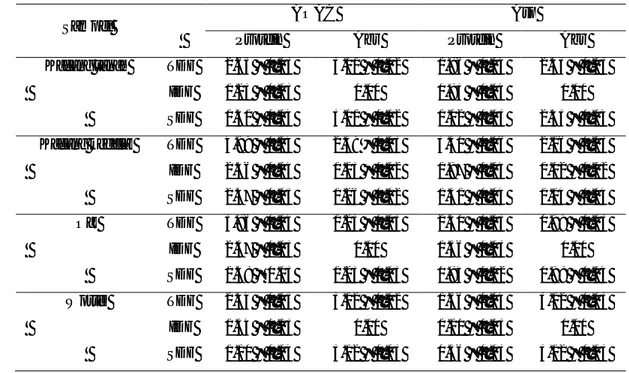
Verifikasi metode terhadap aspek selektivitas dilakukan dengan membandingkan data kontaminan (impurities) yang terdapat di dalam residu akhir serat pangan yang diperoleh melalui metode AOAC dan Asp. Tabel 11 menunjukkan data kontaminan yang terdapat pada analisis serat pangan terhadap empat sampel menggunakan metode AOAC dan Asp. Kontaminan yang dibandingkan antara kedua metode ialah kadar protein dan abu.
Kadar protein pada residu akhir serat pangan menggunakan metode Asp lebih rendah dibandingkan metode AOAC. Hal ini berkaitan dengan tingginya aktivitas enzim yang digunakan untuk menghidrolisis protein dalam metode Asp. seperti yang telah dijelaskan sebelumnya bahwa aktivitas enzim protease yang digunakan pada metode Asp (2755 U/mg) lebih tinggi dibandingkan metode AOAC (50 U/ml).
Rendahnya aktivitas enzim yang digunakan untuk menghidrolisis protein pada metode AOAC karena metode ini dirancang untuk menganalisis serat pangan pada produk sayur dan buah. Sayur dan buah pada umumnya memiliki kadar protein yang rendah, sehingga enzim protease dengan aktivitas rendah dapat menghidrolisis protein dalam sampel. Oleh karena itu, untuk sampel yang memiliki kadar protein tinggi seperti kacang kedelai, dapat menghasilkan kesalahan positif pada analisis serat pangan menggunakan metode AOAC. Data validasi metode analisis serat pangan AOAC dapat dilihat pada Lampiran 2.
Selain protein, mineral yang terdapat dalam residu akhir serat pangan juga merupakan kontaminan. Metode Asp menunjukkan kadar abu yang lebih rendah dibandingkan metode AOAC. Hal ini diduga karena adanya prosedur penurunan pH menjadi 4.5 sebelum proses presipitasi SDF pada metode Asp. Mineral lebih larut pada pH larutan yang rendah sehingga dapat dihilangkan melalui proses pencucian residu (Manas et al. 1994).
30
35.12 ± 0.02a 12.20 ± 0.12a 11.75 ± 0.03a 24.00 ± 0.04a 35.22 ± 0.23a 12.22 ± 0.04a 11.84 ± 0.10a 24.30 ± 0.21a 0.00 5.00 10.00 15.00 20.00 25.00 30.00 35.00 40.00 Kacang Kedelai Kacang Tanah Oat Wortel TD F (% ) Sampel Alkohol 78% Alkohol 95% (Asp)Tabel 11. Kadar protein dan abu pada residu akhir analisis serat pangan
Sampel AOAC Asp
Protein Abu Protein Abu
Kacang tanah TDF 2.65 ± 0.03 3.01 ± 0.02 1.86 ± 0.04 2.43 ± 0.03 IDF 1.23 ± 0.03 0.00 0.83 ± 0.04 0.00 SDF 1.41 ± 0.04 3.01 ± 0.02 1.02 ± 0.03 2.43 ± 0.04 Kacang kedelai TDF 4.99 ± 0.04 2.39 ± 0.03 3.30 ± 0.06 2.16 ± 0.03 IDF 2.46 ± 0.04 1.13 ± 0.02 1.97 ± 0.04 1.02 ± 0.02 SDF 2.47 ± 0.05 1.26 ± 0.02 1.31 ± 0.04 1.14 ± 0.04 Oat TDF 3.86 ± 0.04 1.23 ± 0.03 2.40 ± 0.03 0.99 ± 0.03 IDF 2.37 ± 0.03 0.00 1.56 ± 0.03 0.00 SDF 1.48 ± 0.03 1.23 ± 0.03 0.84 ± 0.02 0.98 ± 0.04 Wortel TDF 2.44 ± 0.05 3.12 ± 0.02 1.66 ± 0.04 3.12 ± 0.03 IDF 1.34 ± 0.03 0.00 1.10 ± 0.03 0.00 SDF 1.10 ± 0.04 3.12 ± 0.03 0.56 ± 0.03 3.12 ± 0.03
4.5
RUGGEDNESS TEST
Ruggedness test dilakukan bertujuan membandingkan dua hasil analisis serat pangan yang menggunakan konsentrasi etanol yang berbeda dalam proses presipitasi SDF. Seluruh sampel yang dipresipitasi menggunakan etanol 78% menghasilkan data yang tidak berbeda nyata jika dibandingkan dengan hasil analisis menggunakan etanol 95% pada metode Asp (Gambar 16). Oleh karena itu, dalam analisis TDF menggunakan metode Asp, etanol 78% dapat digunakan sebagai agen presipitasi.