ADSORPSI Pb(II) MENGGUNAKAN ZEOLIT ALAM
TERMODIFIKASI ASAM FOSFAT
IIS SUBARIYAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Adsorpsi Pb(II) Menggunakan Zeolit Alam Termodifikasi Asam Fosfat adalah karya saya dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini.
Bogor, Agustus 2011
ABSTRACT
IIS SUBARIYAH. Adsorption of Pb(II) Using Natural Zeolite Modified Phosphoric Acid. Under direction of ETI ROHAETI and SRI SUGIARTI.
In this study, both of natural zeolite, which were obtained from Sukabumi and Lampung have been modified, using H3PO4 and NaHCO3 solution. Analysis of the zeolites using XRD, BET, SEM-EDS and Cation Exchange Capacity (CEC) showed that there are differences between zeolite before modified and the one after modification. Application of the modified zeolites as an adsorbent for Pb(II) in solution showed; the optimum adsorption capacity reached at pH of 5 and 0.2 g of adsorbent. Based on the dynamic study, both type of adsorbents for Pb(II) sorption were following pseudo second order kinetic and Langmuir equation as chemosorption. Additionally, the thermodynamic determination revealed that the adsorption were exothermic.
RINGKASAN
IIS SUBARIYAH. Adsorpsi Pb(II) Menggunakan Zeolit Alam Termodifikasi Asam Fosfat. Dibimbing oleh ETI ROHAETI dan SRI SUGIARTI.
Timbal (Pb) merupakan salah satu logam berat yang biasa menjadi salah satu kontaminan dalam limbah cair kegiatan industri, misalnya pada industri: pengecoran dan pemurnian, baterai, bahan bakar, kabel, serta bahan kimia yang menggunakan bahan pewarna. Keracunan Pb dapat menyebabkan gangnguan kesehatan seperti gangguan fungsi hati, ginjal, keterlambatan perkembangan mental, kemandulan dan gangguan sistem syaraf. Oleh karena itu perlu ada upaya untuk mengurangi keberadaan kontaminan ini dalam limbah atau lingkungan. Berbagai metode telah dikembangkan untuk upaya penanganan hal tersebut, salah satunya adalah adsorpsi dengan zeolit.
Meskipun telah banyak dilakukan penelitian tentang adsorpsi Pb(II) dari larutan air menggunakan zeolit alam, tetapi setiap zeolit yang berbeda asalnya memerlukan penelitian tersendiri. Adsorpsi Pb(II) dengan klinoptilolit yang dimodifikasi dengan HCl dan Na-klinoptilolit menunjukkan bahwa adsorpsi Pb(II) terjadi secara spontan. Stabilitas dan kapasitas tukar kation (KTK) zeolit alam jenis klinoptilolit asal Meksiko yang dimodifikasi dengan larutan asam fosfat telah dilaporkan. Hasil penelitian menunjukkan bahwa pH larutan fosfat mempengaruhi stabilitas dan KTK dari klinoptilolit. Pada pH 4-6, perubahan kristalinitas ini tidak teramati dan jumlah aluminium mirip dengan klinoptilolit tanpa modifikasi, serta adanya kenaikan KTK dari 1.10 menjadi 1.26 mek/g. Zeolit-Y termodifikasi asam fosfat mampu menjerap ion Cu2+ dari larutan dan kapasitas adsorpsinya meningkat 67% dibanding dengan zeolit tanpa modifikasi.
Penelitain ini terdiri atas tiga tahap, yaitu perlakuan adsorben zeolit, karakterisasi adsorben dan percobaan adsorpsi. Pembuatan adsorben zeolit diawali dengan preparasi zeolit alam asal Sukabumi dan Lampung, dilanjutkan dengan aktivasi dan memodifikasinya dengan H3PO4 serta mengubahnya dalam bentuk Na-zeolit dengan menambahkan NaHCO3 jenuh. Tahap selanjutnya adalah karakterisasi adsorben yang dilakukan dengan XRD (X-Ray Diffraction), SEM-EDS (Scanning Electron Microscopy-Electron Dispersive Spectroscopy), metode BET (Brunauer-Emmett-Teller) dan penentuan KTK (Kapasitas Tukar Kation) dengan metode ammonium asetat. Tahap ketiga adalah percobaan adsorpsi Pb(II) dengan adsorben hasil modifikasi.
mg/g dan 128.16 mg/g. Hasil analisis unsur dengan EDS juga menunjukkan adanya unsur P pada zeolit termodifikasi, yaitu 0.07% dalam Z-PNa2-S dan 0.02% dalam Z-PNa2-L.
Karakterisasi adsorben dengan metode BET, menghasilkan adanya kenaikan luas permukaan dan volume total pori setelah dilakukan modifikasi, sedangkan rata-rata diameter pori mengalami penurunan. Hal ini diduga bahwa gugus fosfat terjerap dalam rongga zeolit sehingga ukuran pori menjadi lebih kecil dari sebelum modifikasi. Hasil analisis XRD menunjukkan adanya perubahan kristalinitas zeolit sebelum dan sesudah modifikasi, yang diduga karena pengaruh dari pengotor. Difraktogram hasil analisis XRD juga masih menunjukkan puncak-puncak utama penciri klinoptilolit dan mordenit. Analisis morfologi permukaan zeolit sebelum dan sesudah modifikasi dilakukan SEM yang menunjukkan bahwa setelah modifikasi bentuk struktur kristal zeolit tampak lebih jelas.
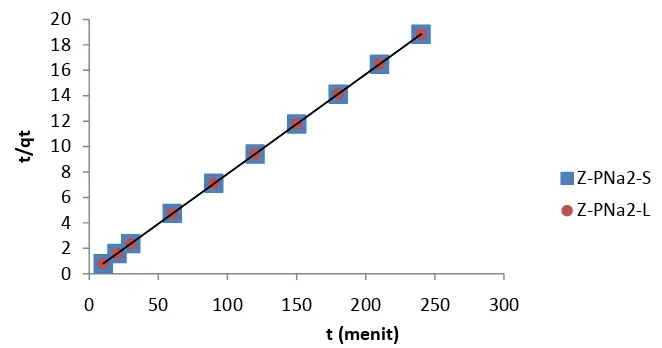
Hasil pengukuran KTK dengan metode ammonium asetat menunjukkan bahwa modifikasi dengan asam asetat dapat menaikkan KTK. Zeolit Sukabumi mengalami kenaikan KTK dari 92.60 menjadi 179.90 mek/100g dan zeolit Lampung dari 93.03 menjadi 149.62 mek/100g. Pada modifikasi zeolit dengan asam fosfat, setiap mol asam fosfat yang teradsorpsi dalam zeolit menyediakan dua mol proton yang dapat dipertukarkan dengan Na+ dengan basa lemah seperti NaHCO3. Bentuk Na-zeolit mempunyai dua Na+ yang dapat dipertukarkan dengan ion NH4+ pada penentuan KTK dengan metode ammonium asetat dibandingkan zeolit tanpa modifikasi, dan semakin banyak ion Na+ yang dipertukarkan maka makin besar nilai KTKnya
Zeolit Z-PNa2-S dan Z-PNa2-L hasil modifikasi digunakan unruk percobaan adsorpsi Pb(II) dengan mempelajari pengaruh dari bobot adsorben, pH, waktu kontak, konsentrasi awal dan suhu. Pada bobot adsorben 0.2 g diperoleh kapasitas adsorpsi sebesar 12.28 mg/g (%adsorpsi = 99.67%) untuk Z-PNa2-S dan 12.24 mg/g (%adsorpsi = 99.29%) untuk Z-PNa2-L. Faktor pH, waktu kontak dan suhu tidak memberikan pengaruh yang signifikan terhadap kenaikan kapasitas adsorpsi untuk konsentrasi awal 50 mg/L. Adsorpsi Pb(II) dengan Z-PNa2-S maupun Z-PNa2-L mengikuti persamaan kinetika orde kedua semu dan model isoterm Langmuir. Hasil perhitungan parameter termodinamika menunjukkan bahwa adsorpsi Pb(II) dengan Z-PNa2-S maupun Z-PNa2-L adalah adsorpsi kimia, spontan di lingkungan dan eksotermis.
© Hak Cipta Milik IPB, tahun 2011
Hak Cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruhnya karya tulis ini tanpa mencantumkan atau menyebutkan sumber.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
ADSORPSI Pb(II) MENGGUNAKAN ZEOLIT ALAM
TERMODIFIKASI ASAM FOSFAT
IIS SUBARIYAH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Kimia
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
HALAMAN PENGESAHAN
Judul Tesis : Adsorpsi Pb(II) Menggunakan Zeolit Alam Termodifikasi Asam Fosfat
Nama : Iis Subariyah
NRP : G451090081
Program Studi : Kimia
Disetujui Komisi Pembimbing
Dr. Eti Rohaeti Sri Sugiarti, Ph.D Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Kimia
Prof. Dr. Purwantiningsih Sugita, MS Dr. Ir. Dahrul Syah, M.Sc.Agr.
PRAKATA
Puji dan syukur saya panjatkan kehadirat Allah SWT atas rahmat dan karunia-Nya sehingga karya ilmiah ini dapat diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari sampai bulai Mei 2011 ini ialah Adsorpsi Pb(II) Menggunakan Zeolit Alam Termodifikasi Asam Fosfat.
Ucapan terima kasih yang tulus kepada Dr. Eti Rohaeti selaku Ketua Komisi Pembimbing dan Sri Sugiarti, Ph.D selaku Anggota Komisi Pembimbing, atas segala curahan waktu, bimbingan, arahan, serta dorongan moral kepada saya. Ucapan terima kasih juga saya sampaikan kepada Dr. Iskandar sebagai dosen penguji luar komisi dan Dr. Dyah Iswantini Pradono, M.Agr selaku wakil dari departemen yang telah memberikan saran pada penulisan karya ilmiah ini. Ungkapan terima kasih juga disampaikan kepada suami saya serta seluruh keluarga, atas segala doa dan kasih sayangnya dan kepada Kementerian Agama Republik Indonesia yang telah mendanai pendidikan penulis selama menjalani program pascasarjna Kimia.
Semoga karya ilmiah ini bermanfaat
Bogor, Agustus 2011
RIWAYAT HIDUP
DAFTAR ISI
Halaman
DAFTAR GAMBAR ……… xi
DAFTAR TABEL ……… xii
DAFTAR LAMPIRAN ………. xiii
PENDAHULUAN Latar Belakang ……… 1
Perumusan Masalah ……… 3
Tujuan……….. 3
Manfaat ………... 4
Hipotesis ………. 4
TINJAUAN PUSTAKA Zeolit ………... 5
Timbal ………. 10
Isoterm Adsorpsi ………. 11
Kinetika Adsorpsi ………... 13
Parameter Termodinamika ……….. 13
BAHAN DAN METODE Waktu dan Tempat Penelitian ………. 15
Bahan dan Alat ..………. 15
Metode Penelitian ………... 15
HASIL DAN PEMBAHASAN Adsorben Zeolit ……….. 19
Karakterisasi Adsorben ……….. 21
Percobaan Adsorpsi ……… 28
SIMPULAN DAN SARAN Simpulan ……… 39
Saran ……….. 39
DAFTAR PUSTAKA ……… 41
DAFTAR GAMBAR
Halaman
1 Kerangka struktur zeolit ……… 5
2 Struktur kristal klinoptilolit ……… 8
3 Struktur kristal mordenit ……… 9
4 Skema reaksi modifikasi zeolit-PNa2 ……… 21
5 Difraktogram XRD zeolit Sukabumi ……… 22
6 Difraktogram XRD zeolit Lampung ……… 22
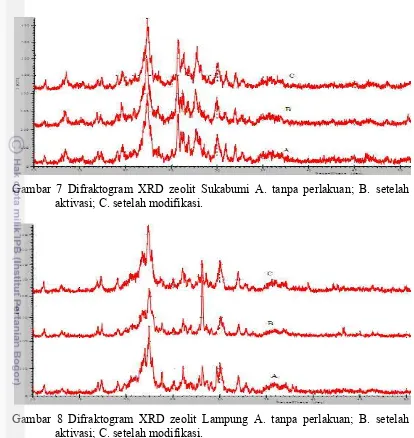
7 Difraktogram XRD zeolit Sukabumi A. tanpa perlakuan; B. setelah aktivasi; C. setelah modifikasi ……… 25
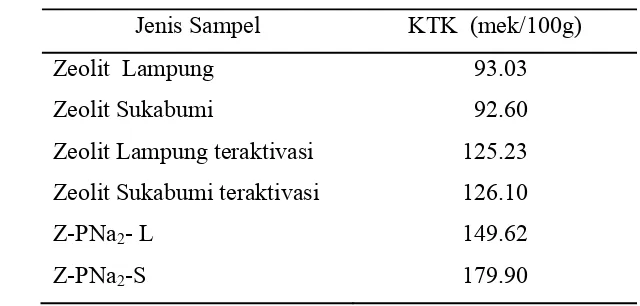
8 Difraktogram XRD zeolit Lampung A. tanpa perlakuan; B. setelah aktivasi; C. setelah modifikasi ……… 25
9 SEM zeolit Sukabumi perbesaran 1000x: a. tanpa perlakuan; b. setelah aktivasi; c. setelah modifikasi ……….. 26
10 SEM zeolit Lampung perbesaran 1000x: a. tanpa perlakuan; b. setelah aktivasi; c. setelah modifikasi ……… 26
11 Kapasitas adsorpsi Z-PNa2-S dan Z-PNa2-L pada variasi bobot ……….. 28 12 Kapasitas adsorpsi Z-PNa2-S dan Z-PNa2-L pada variasi pH 29 13 Kapasitas adsorpsi Z-PNa2-S dan Z-PNa2-L pada variasi waktu ………. 30 14 Plot kinetika orde pertama semu adsorpsi Pb(II) oleh Z-PNa2 -S dan Z-PNa2-L ……… 31
15 Plot kinetika orde kedua semu adsorpsi Pb(II) oleh Z-PNa2-S dan Z-PNa2-L ……… 31
16 Isoterm adsorpsi Pb(II) oleh Z-PNa2-S dan Z-PNa2-L ……… 33
17 Isoterm Langmuir adsorpsi Pb(II) oleh Z-PNa2-S dan Z-PNa2-L ………... 34 18 Isoterm Freundlich adsorpsi Pb(II) oleh Z-PNa2-S dan Z-PNa2-L ………. 34 19 Efek variasi suhu pada adsorpsi Pb(II) oleh Z-PNa2-S dan Z-PNa2-L ……… 36 20 Hubungan antara 1/T dan ln Kd untuk Z-PNa2-S dan
Z-PNa2-L ………
DAFTAR TABEL
Halaman
1 Hasil karakterisasi zeolit Lmpung dan Sukabumi ……… 7 2 Komponen kimia zeolit Lampung dan Sukabumi ……… 8 3 Hasil pengukuran luas permukaan, volume pori dan diameter
pori sebelum dan sesudah modifikasi zeolit Sukabumi dan Lampung ………..
23
4 Hasil pengukuran KTK ……… 27
5 Perbandingan konstanta laju orde pertama dan kedua semu … 32 6 Parameter isoterm Langmuir dan Freunlich ……… 34 7 Data parameter termodinamika adsorpsi Pb(II) dengan
DAFTAR LAMPIRAN
Halaman
1 Bagan alir penelitian ……….. 46
2 Preparasi zeolit alam ………. 47
3 Aktivasi zeolit alam ………... 47 4 Modifikasi zeolit alam dengan asam fosfat ………... 48
5 Penentuan KTK ………. 49
6 Percobaan adsorpsi ……… 50
7 Penentuan kadar fosfat ……….. 51 8 Data hasil pengukuran KTK ……….. 52 9 Data hasil adsorpsi Pb(II) oleh Z-PNa2-S pada variasi bobot
adsorben ……… 54
10 Data hasil adsorpsi Pb(II) oleh Z-PNa2-L pada variasi bobot
adsorben ……… 55
11 Data hasil adsorpsi Pb(II) oleh Z-PNa2-S pada variasi pH …... 56 12 Data hasil adsorpsi Pb(II) oleh Z-PNa2-L pada variasi pH …... 57 13 Data hasil adsorpsi Pb(II) oleh Z-PNa2-S pada variasi waktu .. 58 14 Data hasil adsorpsi Pb(II) oleh Z-PNa2-L pada variasi waktu .. 60 15 Persamaan linear laju reaksi adsorpsi Pb(II) ………. 62 16 Data hasil adsorpsi Pb(II) oleh Z-PNa2-S pada variasi
konsentrasi ………...
63
17 Data hasil adsorpsi Pb(II) oleh Z-PNa2-L pada variasi konsentrasi ...
64
18 Data hasil analisis isoterm Langmuir dan Freundlich adsorpsi
Pb(II) oleh Z-PNa2-S ……… 65 19 Data hasil analisis isoterm Langmuir dan Freundlich adsorpsi
PENDAHULUAN
Latar Belakang
Kondisi lingkungan dapat tercemar akibat terbuangnya sejumlah polutan berbahaya. Logam berat adalah salah satu polutan yang merupakan ancaman potensial untuk kualitas air, tanah, tanaman, hewan dan kesehatan manusia. Sebagai unsur, logam berat tidak dapat dihancurkan secara kimia. Adanya unsur logam seperti timbal (Pb), kadmium (Cd), arsen (As), merkuri (Hg), dan kromium (Cr), bahkan pada konsentrasi sangat rendah (<2 ppb) tidak diinginkan karena toksisitasnya (Senthilkumar & Saraswathi, 2009). Menurut Hamidpour (2010) timbal (Pb) bersama-sama dengan kadmium (Cd) dan merkuri (Hg) merupakan kelompok “tiga besar” logam berat yang mempunyai potensial berbahaya bagi manusia dan lingkungan.
Timbal (Pb) merupakan salah satu logam berat yang biasa menjadi salah satu kontaminan dalam limbah cair dari industri. Industri yang berpotensi sebagai sumber pencemaran Pb adalah semua industri yang memakai Pb sebagai bahan baku maupun bahan tambahan, misalnya: industri pengecoran, industri baterai, industri bahan bakar, industri kabel, dan industri kimia yang menggunakan bahan pewarna. Keracunan Pb dapat menyebabkan gangnguan kesehatan seperti gangguan fungsi hati, ginjal, keterlambatan perkembangan mental, kemandulan dan gangguan sistem syaraf (Gunay et al. 2007).
Menurut Keputusan Menteri Kesehatan RI No. 907 tahun 2002 tentang syarat-syarat dan pengawasan air minum, bahwa persyaratan kualitas air minum, kadar ion Pb maksimum yang diperbolehkan adalah 0.01 mg/L. Keputusan Menteri Negara Lingkungan Hidup No. 51 tahun 1995 tentang baku mutu limbah cair bagi kegiatan industri, kadar maksimum ion Pb dalam limbah cair adalah 0.1 mg/L dan beban pencemaran maksimum 0.002 g/ton. WHO (2004) mensyaratkan batas maksimum ion Pb dalam air minun 0.010 mg/L.
2
(Wingenfelder et al. 2005; Wang et al. 2008). Proses adsorpsi melibatkan adanya adsorben yang mengikat molekul oleh gaya tarik-menarik antarmolekul, pertukaran ion, dan ikatan kimia. Menurut Wang & Peng (2010) keberhasilan teknik ini sebagian besar tergantung pada pengembangan adsorben yang efisien. Adsorben yang digunakan harus memenuhi kriteria yang dibutuhkan, diantaranya mempunyai daya serap yang besar terhadap solut, zat padat yang mempunyai luas permukaan yang besar, tidak larut dalam zat cair yang akan diadsorpsi, tidak beracun dan mudah didapat serta, memiliki harga yang relatif murah. Karbon aktif, mineral lempung, zeolit, biomaterial, dan beberapa limbah padat industri telah banyak digunakan sebagai adsorben untuk adsorpsi ion dan nonionik dalam pengolahan air limbah.
Zeolit alam merupakan mineral aluminosilikat terhidrasi dengan struktur berpori dengan sifat fisiko kimia yang penting, misalnya tukar kation, penyaring molekul, katalisis, dan adsorpsi. Zeolit alam tanpa modifikasi dan termodifikasi telah dilaporkan untuk adsorpsi senyawa anion dan organik dari sistem air (Wang & Peng, 2010). Meskipun telah banyak dilakukan penelitian tentang adsorpsi Pb(II) dari larutan air menggunakan zeolit alam, tetapi setiap zeolit yang berbeda asalnya memerlukan penelitian tersendiri (Buasri et al. 2008). Buasri et al. (2008) melaporkan penggunaan zeolit jenis klinoptilolit untuk penghilangan Pb(II) dengan percobaan adsorpsi secara tumpak. Kapasitas adsorpsi yang didapatkan sebesar 53.73 mg/g pada suhu 70°C dan isoterm adsorpsi mengikuti model isoterm Langmuir. Wang & Ariyanto (2007) juga melaporkan penggunaan zeolit alam jenis klinoptilolit sebagai adsorben Pb(II). Untuk sistem tunggal, adsorpsi ion Pb mengikuti model isoterm Freundlich, kinetika orde pertama semu dan kapasitas adsorpsi sebesar 21.74 mg/g.
3
mengikuti orde pertama semu dan kedua semu. Gunay et al. (2007) juga melaporkan parameter termodinamika ΔG0 = -8.89 kJ/mol yang menunjukkan bahwa adsorpsi Pb(II) terjadi secara spontan.
Hernandez-Beltran et al. (2008) melaporkan stabilitas dan kapasitas tukar kation (KTK) dari klinoptilolit asal Meksiko yang dimodifikasi dengan larutan asam fosfat. Hasil penelitian menunjukkan bahwa pH larutan fosfat mempengaruhi stabilitas dan KTK dari klinoptilolit. Pada pH 4-6, perubahan kristalinitas tidak teramati dan terjadi kenaikan KTK dari 1.10 menjadi 1.26 mek/g. Panneerselvam et al. (2008) memodifikasi zeolit-Y dengan asam fosfat untuk menjerap ion Cu2+ dari larutan air, dan diperoleh bahwa kapasitas adsorpsinya meningkat 67% dibanding dengan zeolit tanpa modifikasi. Efek pH, waktu kontak, model kinetika, isoterm adsorpsi dan parameter termodinamika juga dilaporkan. Penyerapan Cu2+ mengikuti model kinetika orde dua semu, isoterm Langmuir dan dari parameter termodinamika diketahui bahwa proses berjalan secara spontan.
4
Perumusan Masalah
Zeolit alam termodifikasi asam fosfat berpotensi sebagai adsorben Pb(II) dalam media berair. Hal ini diduga disebabkan adanya gugus fosfat yang mampu mengikat Pb(II) melalui proses adsorpsi dalam media berair. Hingga saat ini studi dinamika yang meliputi kinetika dan ekuilibrium adsorpsi Pb(II) dalam media berair dengan zeolit termodifikasi asam fosfat belum pernah dilakukan. Oleh karena itu, pada penelitian ini telah dilakukan modifikasi zeolit alam asal Sukabumi dan Lampung dengan asam fosfat. Zeolit hasil modifikasi diaplikasikan untuk adsorpsi Pb(II) dalam media air serta dipelajari karakteristik adsorpsimya.
Tujuan
Penelitian ini bertujuan memodifikasi zeolit asal Lampung dan Sukabumi dengan asam fosfat untuk meningkatkan kapasitas tukar kation. Selain itu, untuk mempelajari karakteristik adsorpsi kedua zeolit tersebut terhadap ion Pb(II).
Manfaat
Dari penelitian ini diharapkan dapat diketahui seberapa besar potensi zeolit alam asal Lampung dan Sukabumi termodifikasi asam fosfat dalam menjerap ion logam Pb (II) sehingga dapat mengurangi potensi pencemaran lingkungan akibat limbah logam berat.
Hipotesis
1. Zeolit alam termodifikasi asam fosfat mempunyai kapasitas tukar kation tinggi dibandingkan yang tanpa dimodifikasi.
TINJAUAN PUSTAKA
Zeolit
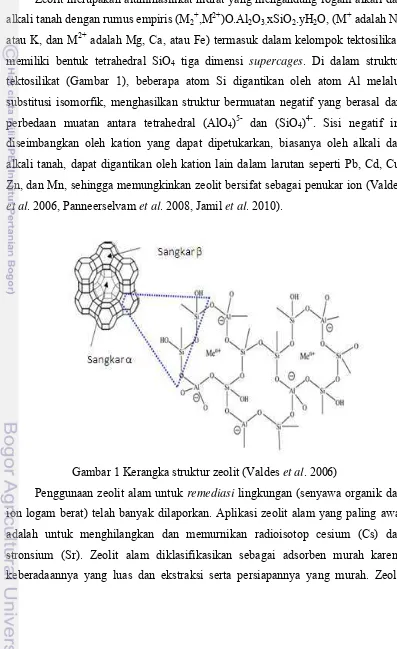
Zeolit merupakan aluminasilikat hidrat yang mengandung logam alkali dan alkali tanah dengan rumus empiris (M2+,M2+)O.Al2O3.xSiO2.yH2O, (M+ adalah Na atau K, dan M2+ adalah Mg, Ca, atau Fe) termasuk dalam kelompok tektosilikat, memiliki bentuk tetrahedral SiO4 tiga dimensi supercages. Di dalam struktur tektosilikat (Gambar 1), beberapa atom Si digantikan oleh atom Al melalui substitusi isomorfik, menghasilkan struktur bermuatan negatif yang berasal dari perbedaan muatan antara tetrahedral (AlO4)5- dan (SiO4)4-. Sisi negatif ini diseimbangkan oleh kation yang dapat dipetukarkan, biasanya oleh alkali dan alkali tanah, dapat digantikan oleh kation lain dalam larutan seperti Pb, Cd, Cu, Zn, dan Mn, sehingga memungkinkan zeolit bersifat sebagai penukar ion (Valdes et al. 2006, Panneerselvam et al. 2008, Jamil et al. 2010).
Gambar 1 Kerangka struktur zeolit (Valdes et al. 2006)
6
alam juga memberikan ketertarikan yang tersendiri bagi kalangan ilmuwan, terutama karena sifatnya seperti kemampuan pertukaran ion dan luas permukaan yang tinggi. Zeolit menawarkan potensi untuk berbagai kegunaan seperti penyaring molekul, penukar ion, adsorben, katalis, bahan pengisi deterjen, penghilang kation dari sumber pembuangan asam dan air limbah industri. Zeolit memiliki afinitas yang kuat untuk ion logam berat (Jamil et al. 2010).
Menurut Wang & Peng (2010) zeolit mempunyai kemampuan penukar ion dengan medium eksternal, yang merupakan karakteristik zeolit. Pada umumnya reaksi pertukaran ion antara larutan yang mengandung kation AzA+ dan bentuk B zeolit (B merupakan kation dengan valensi zB) dituliskan dalam persamaan reaksi berikut:
L adalah bagian dari unit kerangka zeolit yang bermuatan negatif. Sifat pertukaran ion zeolit alam tergantung pada beberapa faktor, termasuk struktur rangka, ukuran dan bentuk ion, kerapatan muatan dari kerangka anionik, muatan ion dan konsentrasi larutan elektolit luar. Karena kondisi pembentukannya zeolit alam mempunyai komposisi kimia dan kapasitas tukar kation yang berbeda-beda.
Dalam penelitian ini digunakan zeolit alam asal Lampung dan asal Cikembar, Sukabumi. Menurut Las (2005) zeolit Lampung kemurnian dan sifat penukar ionnya lebih baik dari zeolit Tasikmalaya dan Sukabumi. Rohaeti (2007) telah melakukan karakterisasi zeolit Lampung dan Sukabumi dengan hasil tertera pada Tabel 1 dan Tabel 2.
7
Struktur Klinoptilolit tidak hancur setelah pemanasan selama 12 jam pada suhu 750°C. Namun, struktur Klinoptilolit yang mengandung kapur akan hancur antara suhu 450-550°C.
Tabel 1 Hasil Karakterisasi zeolit Lampung dan Sukabumi
Parameter Asal zeolit
Lampung Sukabumi Volume pori (mL/g) Luas pori (m2/g) Sumber: Rohaeti (2007)
8
Tabel 2 Komponen kimia zeolit Lampung dan Sukabumi
Komponen Kadar dalam % berat
Lampung Sukabumi SiO2
Al2O3 Fe2O3 TiO2 CaO MgO Na2O K2O Hilang pijar
70.55 11.89 1.85 0.08 4.85
- 1.61 1.81 7.36
68.75 12.91 1.3 0.08 5.23 0.53 1.94 1.94 7.18 Sumber: Rohaeti (2007)
Gambar 2 Struktur kristal klinoptilolit
9
Berbagai metode dikembangkan untuk meningkatkan selektivitas dan daya adsorpsi zeolit alam maupun sintetik. Salah satu cara yang sedang berkembang adalah dengan modifikasi permukaan zeolit. Modifikasi dapat dilakukan dengan memberikan perlakuan kimia seperti direaksikan dengan asam. Memodifikasi adsorben dengan asam paling umum dan terbukti efektif dalam meningkatkan kapasitas dan efisiensi adsorben. Selama proses perlakuan dengan asam, ion H+ akan menggantikan kation-kation yang tidak terikat secara kuat di dalam kerangka zeolit dan mengatur kembali letak atom yang dapat dipertukarkan. Modifikasi asam menyebabkan terjadinya dekationisasi yang menyebabkan bertambahnya luas permukaan zeolit karena berkurangnya pengotor yang menutupi pori-pori zeolit. Luas permukaan yang bertambah diharapkan meningkatkan kemampuan zeolit dalam proses adsorpsi (Tarlan-Yel & Onen 2010; Wang et al. 2010; Pentrak et al. 2009).
Tarlan-Yel & Onen (2010) memodifikasi zeolit alam dengan asam nitrat untuk menghilangkan sianida bebas dan kompleks Cu-sianida dengan kapasitas adsorpsi mencapai 96%. Zeolit P termodifikasi asam hidroksamik digunakan oleh Haron et al. (2009) untuk menjerap Cu dalam larutan. Penjerapan Cu(II) mengikuti model isoterm Langmuir dengan kapasitas maksimum 33.32 mg/g pada suhu 25°C dan meningkat 48.12 mg/g pada suhu 70°C. Modifikasi zeolit alam
Gambar 3 Struktur kristal mordenit
10
jenis klinoptilolit dengan HCl untuk menyerap ion logam berat (Pb2+, Cu2+, Ni2+, dan Cd2+) dalam larutan telah diteliti oleh Sprynskyy et al. (2006). Panneerselvam et al. 2008 memodifikasi zeolit Y dengan asam fosfat sebagai adsorben Cu dalam larutan, dan kapasitas adsorpsi meningkat sekitar 67% dibandingkan zeolit alam tanpa modifikasi.
Timbal
Logam timbal (Pb) merupakan logam yang sangat populer dan banyak dikenal oleh masyarakat awam. Hal ini disebabkan oleh banyaknya Pb yang digunakan di industri nonpangan dan paling banyak menimbulkan keracunan pada makhluk hidup. Pb adalah sejenis logam yang lunak dan berwarna cokelat kehitaman, serta mudah dimurnikan dari pertambangan. Dalam pertambangan, logam ini berbentuk sulfida logam (PbS), yang sering disebut galena. Senyawa ini banyak ditemukan dalam pertambangan di seluruh dunia. Bahaya yang ditimbulkan oleh penggunaan Pb ini adalah sering menyebabkan keracunan (Astawan 2008).
Kadar Pb yang secara alami dapat ditemukan dalam bebatuan sekitar 13 mg/kg. Khusus Pb yang tercampur dengan batu fosfat dan terdapat didalam batu pasir kadarnya lebih besar yaitu 100 mg/kg. Pb yang terdapat di tanah berkadar sekitar 5-25 mg/kg dan di air bawah tanah berkisar antara 1-60 µg/L. Secara alami Pb juga ditemukan di air permukaan. Kadar Pb pada air telaga dan air sungai adalah sebesar 1-10 µg/liter. Dalam air laut kadar Pb lebih rendah dari dalam air tawar. Laut yang dikatakan terbebas dari pencemaran mengandung Pb sekitar 0,07 µg/L. Secara alami Pb juga ditemukan di udara yang kadarnya berkisar antara 0.0001- 0.001 µg/m3 (Sudarmaji 2006).
11
enzim. Efek logam Pb pada kesehatan manusia adalah menimbulkan kerusakan otak, kejang-kejang, gangguan tingkah laku, dan bahkan kematian.
Timbal merupakan logam penting dari sudut pandang toksikologi lingkungan, logam ini sampai ke udara dan air dari banyak sumber seperti peleburan timah, produsen baterai, industri kertas dan pulp, bahan bakar perahu dan kapal, amunisi industri, dan lain-lain. Efek toksisitas timbal seperti pada sistem saraf, sistem sirkulasi darah, sistem kardiovaskular, organ vital seperti otak dan ginjal, serta mengganggu pengembangan IQ dan lain-lain telah banyak dilaporkan (Gupta & Bhattacharyya, 2008). Konsentrasi ion Pb mencapai 200-500 mg/L dalam limbah cair industri, nilai tersebut sangat tinggi untuk standar kualitas air dan harus dikurangi sampai 0.1-0.05 mg/L (Ghassabzadeh et al. 2010).
Isoterm adsorpsi
Isoterm adsorpsi menyatakan hubungan spesifik antara konsentrasi sorbent (fasa teradsorpsi) dan terdistribusinya pada permukaan adsorben pada suhu konstan. Kesetimbangan adsorpsi biasanya digambarkan dengan persamaan isoterm, di mana parameter-parameternya menunjukkan sifat permukaan dan afinitas dari adsorben. Beberapa penelitian dilakukan untuk menyelidiki isoterm adsorpsi antara ion logam pada pH optimum, jumlah adsorben dan waktu kontak dengan mengubah konsentrasi ion awal dalam larutan dalam rentang 5-50 mg/L (Gupta & Bhattacharyya, 2008; Ghassabzadeh et al. 2010). Terdapat beberapa jenis persamaan isoterm adsorpsi. Tipe isoterm adsorpsi yang sering digunakan secara luas adalah (Subramanyam & Das, 2009):
(a) Isoterm Langmuir
12
teradsorpsi. Persamaan isoterm adsorpsi Langmuir dapat dituliskan sebagai berikut (Gupta & Bhattacharyya, 2008; Ghassabzadeh et al. 2010):
= (1) dengan qe = jumlah adsorbat yang teradsorpsi per unit bobot adsorben pada kesetimbangan (mg/g), qm = kapasitas adsorpsi maksimum (mg/g), Ce = konsentrasi kesetimbangan adsorbat dalam larutan (mg/L), b = konstanta yang berhubungan dengan energi bebas adsorpsi (L/mg).
(b) Isoterm Freundlich
Persamaan isoterm adsorpsi Freundlich didasarkan pada asumsi, (1) terbentuknya adsorpsi beberapa lapisan (multilayer) dari molekul-molekul adsorbat pada adsorben, (2) bagian tapak aktif pada permukaan adsorben bersifat heterogen, dan (3) hanya melibatkan gaya Van der Waals sehingga adsorbat dapat bergerak dari satu bagian permukaan ke bagian permukaan lain dari adsorben. Persamaan isoterm adsorpsi Freundlich dapat dituliskan sebagai berikut (Gupta & Bhattacharyya, 2008; Ghassabzadeh et al. 2010):
= (2) dengan KF = konstanta, yang menggambarkan kapasitas adsorpsi relatif dari adsorben ((mgg-1)(mgl-1)n), n = konstanta yang menggambarkan intensitas adsorpsi. Gambar persamaan linear Langmuir dan Freundlich diperoleh dengan memplot berturut-turut Ce/qe vs Ce dan log qe vs log Ce, dan dengan persamaan tersebut koefisien dapat dicari.
Persamaan Langmuir juga digunakan untuk memperoleh nilai RL, yang menggambarkan dimensi parameter kesetimbangan atau faktor pemisahan dengan persamaan (Ghassabzadeh et al. 2010):
13
Kinetika Adsorpsi
Untuk menentukan orde kinetika adsorpsi biasanya digunakan persamaan model kinetika orde pertama semu dan orde kedua semu. Persamaan Lagergren, pertama diterapkan dengan asumsi kinetika orde pertama semu, di mana jumlah ion logam melebihi jumlah tempat adsorpsi di permukaan adsorben. Nilai konstanta rata-rata orde pertama, k1, diperoleh dari persamaan berikut (Mohan et
al. 2006; Fan et al. 2008; Gupta & Bhattacharyya, 2011) :
= − (4) Integrasi persamaan (4) dari qt = 0 pada t = 0 adalah:
= − (5) atau − = − (bentuk linear) (6)
= − (bentuk non linear) (7) di mana nilai k1 dapat ditentukan dari slope grafik log (qe – qt) versus t. Jika validitasnya rendah, kinetika adsorpsi dapat dicoba untuk mekanisme orde dua semu dengan persamaan (Mohan et al. 2006; Fan et al. 2008; Gupta & Bhattacharyya, 2008):
= − (8) dengan k2 adalah konstanta rata-rata orde kedua. Bentuk integrasi dari persamaan (8) adalah:
= + (9) nilai k2 dapat ditentukan dengan memplot grafik t/qt versus t.
Parameter termodinamika
14
sebagai berikut (Fan et al. 2008; Gupta & Bhattacharyya, 2008; Ghassabzadeh et al. 2010):
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai dari bulan Januari sampai Mei 2011 yang dilakukan di Laboratorium Kimia Analitik IPB, Laboratorium Kimia Fisik IPB, Laboratorium Kimia Organik IPB, Laboratorium Bersama IPB, Balitbang Kehutanan Bogor, Lemigas Jakarta dan Laboratorium Geologi Quarterner PPGL (Pusat Penelitian Geologi Kelautan) Bandung.
Bahan dan Alat
Bahan yang digunakan pada penelitian ini di antaranya adalah zeolit alam asal Sukabumi dan Lampung, Pb(NO3)2, HCl, H3PO4, NaHCO3, CH3COONa, NH4COOH, NaOH. Larutan stok terdiri dari 1000 mg Pb(II) per liter dibuat dengan melarutkan 1.5985 g Pb(NO3)2 dalam 1 L air bebas ion dan digunakan sebagai larutan adsorbat (Sprynskyy et al. 2006).
Alat yang digunakan di antaranya pH meter Toa HM-20S, sentrifuse Kokusan H-107, shaker Titramax 101, SSA (Spektroskopi Serapan Atom) Shimadzu AA-7000, SEM-EDS (Scanning Electron Microscopy-Electron Dispersive Spektroscopy) JEOLJSM-6360 LA, dan XRD (X-ray Diffraction) Shimadzu 7000, alat BET (Brunauer-Emmett-Teller) Quantachrome.
Metode Penelitian
Penelitian ini terdiri tiga tahap, yaitu pembuatan adsorben zeolit, karakterisasi adsorben sebelum dan sesudah modifikasi dan percobaan adsorpsi Pb(II) dengan adsorben tersebut (Lampiran 1).
Adsorben zeolit
16
Aktivasi zeolit alam: 100 gram sampel dilarutkan dalam 2000 mL HCl 1 M. Campuran diaduk dengan pengaduk magnet selama 3 jam, kemudian dibilas dengan akuades sampai pH netral dan dikeringkan dalam oven pada suhu 130°C selama 3 jam (Cakicioglu-Ozkan & Ulku 2005; Trisunaryati et al 2005; Sastiono 1993) (Lampiran 3).
Zeolit modifikasi asam fosfat: 100 g zeolit alam dalam 2000 mL akuabides dicampur dengan 13.10 g asam fosfat. Campuran diaduk dengan magnetik stirer pada suhu 60°C selama 3 jam kemudian dikeringkan dalam oven pada suhu 120°C selama 3 jam. Zeolit modifikasi asam fosfat dicampur dengan 1500 mL larutan NaHCO3 jenuh dan diaduk dengan magnetik stirer pada suhu 60°C selama 3 jam untuk mendapatkan bentuk dinatrium, disaring, dicuci dengan akuades dan dikeringkan dalam oven pada suhu 120°C selama 3 jam. Zeolit hasil modifikasi selanjutnya disebut zeolit-PNa2 (Panneerselvam et al. 2008). Di mana untuk zeolit asal Sukabumi disebut Z-PNa2-S dan Z-PNa2-L untuk zeolit asal Lampung (Lampiran 4).
Karakterisasi adsorben
Analisis XRD dilakukan untuk mengetahui kristalinitas, SEM untuk mengetahui morfologi, EDS untuk mengetahui kandungan unsur P dalam zeolit setelah modifikasi¸ metode BET untuk mengukur luas permukaan, volume total pori dan rata-rata diameter pori dan uji KTK menggunakan metode ammonium asetat (Olu-Owolabi & Unuabonah 2010): 2 gram sampel ditambahkan 50 mL larutan CH3COONa 1 M dikocok dengan shaker selama 60 menit pada kecepatan 200 rpm. Filtrat disaring, residu dicuci beberapa kali dengan air bebas ion untuk menghilangkan sisa natrium asetat, kemudian dikering-udarakan. Sampel ditambakan 50 mL larutan CH3COONH4 1 M (pH 7), dikocok dengan shaker, filtrat disaring dan ditampung. Langkah ini diulang tiga kali. Kadar Na dalam filtrat diukur dengan SSA (Spektroskopi Serapan Atom) (Lampiran 5).
Percobaan adsorpsi
17
Campuran digoyangkan dengan shaker pada kecepatan 150 rpm, suhu dijaga agar konstan selama interval waktu yang ditentukan. Setelah tercapai kesetimbangan campuran disentrifugasi dan ion logam yang tertinggal dalam filtrat dianalisis dengan SSA. Percobaan diulang dengan variasi bobot adsorben (0.05-0.5 g), konsentrasi adsorbat (30-300 mg/L), pH larutan (2-6), waktu kontak (10-240 menit) dan suhu (303-318 K). Untuk menjaga pH larutan, ditambahkan NaOH 0,01N atau HNO3 0,01N sebelum adsorpsi, dan pH dikontrol sebelum dan sesudah adsorpsi (Gupta & Bhattacharyya 2008; Panneerselvam et al. 2008; Gunay et al. 2007) (Lampiran 6).
Efisiensi adsorpsi dihitung dengan persamaan:
% = × (13)
Jumlah logam yang teradsorpsi dari larutan air pada saat kesetimbangan
ditentukan dengan persamaan: = (14)
HASIL DAN PEMBAHASAN
Adsorben Zeolit
Preparasi zeolit alam
Penelitian ini diawali dengan preparasi adsorben zeolit. Preparasi awal dilakukan dengan menghaluskan zeolit asal Sukabumi dan Lampung sehingga lolos ayakan 40 mesh, yang diukur dengan SEM mempunyai kisaran ukuran butir 0.003-0.425 mm baik untuk zeolit asal Sukabumi maupun Lampung. Pencucian dilakukan dengan akuades untuk menghilangkan kotoran pada permukaan zeolit. Untuk menghilangkan air dilakukan pemanasan dalam oven pada suhu 110°C selama 24 jam. Pemanasan pada suhu 105°C sampai kurang lebih 250°C akan menyebabkan air yang terkandung di dalam rongga kristal zeolit menguap. Fungsi dari dehidrasi tersebut adalah untuk mempertinggi keaktifan zeolit, yang disebabkan terbukanya pori-pori atau saluran pada kristal. Sedikit banyaknya air yang dapat dikeluarkan tergantung dari tingkat suhu dan lamanya waktu pemanasan (Sastiono 1993). Zeolit hasil preparasi awal kemudian disimpan dalam eksikator sebelum pemakaian selanjutnya, hal ini untuk menghindari penyerapan air kembali oleh zeolit.
Aktivasi zeolit alam
Zeolit alam umumnya masih mempunyai kemampuan rendah baik sebagai penjerap maupun penukar ion. Untuk meningkatkan mutu zeolit alam diperlukan proses aktivasi. Aktivasi kimia dapat dilakukan dengan penambahan asam. Pada penelitian ini untuk proses aktivasi digunakan HCl 1N. Penggunaan konsentrasi ini sesuai hasil yang dilaporkan Sastiono (1993), yang melakukan aktivasi zeolit jenis mordenit dan klinoptilolit dan diperoleh hasil KTK dari zeolit tersebut meningkat. Tapi penggunaan HCl lebih dari 1N telah menurunkan nilai KTK.
20
yang tidak terikat secara kuat di dalam kerangka zeolit dan mengatur kembali letak atom yang dapat dipertukarkan (Tarlan-Yel & Onen 2010; Wang et al. 2010; Pentrak et al. 2009).
Zeolit modifikasi asam fosfat
Zeolit yang telah diaktivasi, menjadi bentuk H-zeolit kemudian dimodifikasi dengan asam fosfat (Pannerselvam et al. 2008). Pada modifikasi ini gugus fosfat yang memiliki empat atom oksigen diharapkan mampu meningkatkan muatan negatif total pada zeolit sehingga mampu meningkatkan kapasitas adsorpsinya terhadap ion logam. Selain itu, penggunaan asam fosfat ini mempunyai beberapa alasan, yaitu (1) fosfat merupakan pengelat yang paling banyak di alam, (2) bisa bersifat asam keras maupun asam lunak tergantung kondisi reaksi, (3) pada adsorben yang dimodifikasi dengan asam fosfat, anion-anion fosfat pada permukaan adsorben menjadi bersifat basa lunak dibandingkan dengan anion sulfat dan flourida, sehingga anion fosfat memiliki afinitas yang tinggi terhadap kation-kation lunak (Wang et al. 2010).
Beberapa penelitian modifikasi adsorben dengan asam fosfat dalam suasana asam mampu mengikat kation-kation lunak. Hal ini diduga adanya media asam mampu mengubah sifat basa keras pada asam fosfat menjadi basa lunak. Olu-Owolabi & Unuabonah (2010) memodifikasi bentonit dengan asam fosfat untuk mengadsorpsi Zn(II) dan Cu(II). Unuabonah et al. (2007) memodifikasi kaolinit untuk mengadsorpsi Pb(II). Menurut teori HSAB (Hard and Soft Acid Bases) bahwa Zn(II), Cu(II) dan Pb(II) merupakan kelompok asam lunak (Lippard & Berg 1994). Oleh karena itu, modifikasi zeolit dengan asam fosfat diharapkan akan mempunyai afinitas yang tinggi terhadap ion Pb(II). Modifikasi montmorillonit dengan asam fosfat juga dapat meningkatkan afinitasnya terhadap unsur radioaktif cesium (Cs) (Wang et al. 2010).
21
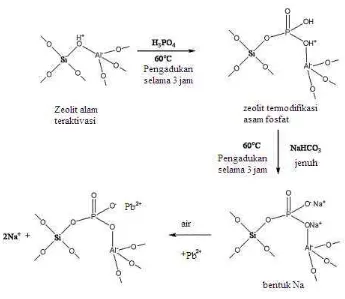
Gambar 4 Skema reaksi modifikasi zeolit PNa2 (Panneerselvam et al. 2008)
Keberhasilan dari modifikasi dapat dilihat dari kapasitas adsorpsi zeolit terhadap asam fosfat yang digunakan. Hasil perhitungan menunjukkan kapasitas adsorpsi zeolit Sukabumi dan Lampung terhadap asam fosfat berturut-turut adalah 127.80 mg/g dan 128.16 mg/g. (Lampiran 7). Hasil analisis unsur dengan EDS menunjukkan adanya unsur P pada zeolit termodifikasi yaitu kadar unsur P dalam Z-PNa2-S dan Z-PNa2-L berturut-turut 0.07% dan 0.02%.
Karakterisasi adsorben
22
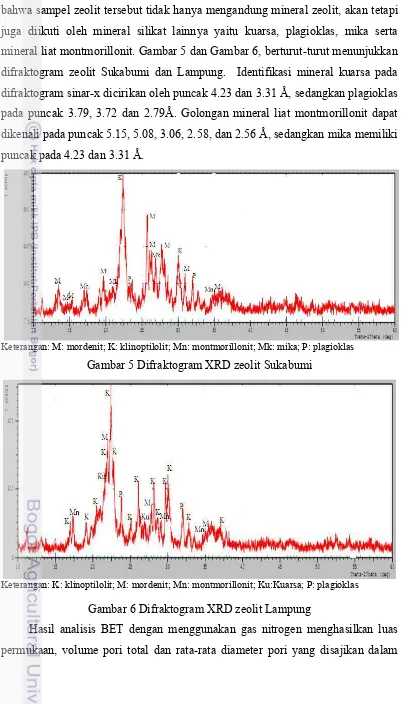
bahwa sampel zeolit tersebut tidak hanya mengandung mineral zeolit, akan tetapi juga diikuti oleh mineral silikat lainnya yaitu kuarsa, plagioklas, mika serta mineral liat montmorillonit. Gambar 5 dan Gambar 6, berturut-turut menunjukkan difraktogram zeolit Sukabumi dan Lampung. Identifikasi mineral kuarsa pada difraktogram sinar-x dicirikan oleh puncak 4.23 dan 3.31 Å, sedangkan plagioklas pada puncak 3.79, 3.72 dan 2.79Å. Golongan mineral liat montmorillonit dapat dikenali pada puncak 5.15, 5.08, 3.06, 2.58, dan 2.56 Å, sedangkan mika memiliki puncak pada 4.23 dan 3.31 Å.
Keterangan: M: mordenit; K: klinoptilolit; Mn: montmorillonit; Mk: mika; P: plagioklas
Gambar 5 Difraktogram XRD zeolit Sukabumi
Keterangan: K: klinoptilolit; M: mordenit; Mn: montmorillonit; Ku:Kuarsa; P: plagioklas
Gambar 6 Difraktogram XRD zeolit Lampung
23
Tabel 3. Luas permukaan dan volume pori total mengalami kenaikan, hal ini menunjukkan bahwa dengan adanya aktivasi dan modifikasi telah menghilangkan pengotor yang ada pada zeolit. Sedangkan untuk rata-rata diameter pori mengalami penurunan, hal ini diduga bahwa gugus fosfat terjerap dalam rongga zeolit sehingga ukuran pori menjadi lebih kecil dari sebelum modifikasi.
Tabel 3 Hasil pengukuran luas permukaan, volume pori dan diameter pori sebelum dan sesudah modifikasi zeolit Sukabumi dan Lampung
Parameter
Zeolit Sukabumi Zeolit Lampung Sebelum
XRD digunakan untuk menganalisis kristalinitas zeolit sebelum dan sesudah perlakuan. Hal ini dapat membantu mengidentifikasi kerusakan struktur zeolit setelah diaktivasi dengan HCl 1N dan dimodifikasi dengan asam fosfat serta mengubahnya dalam bentuk Na-zeolit. Difraktogram zeolit Sukabumi dan Lampung sebelum dan sesudah perlakuan ditunjukkan pada Gambar 7 dan Gambar 8, berturut-turut. Hasil difraktogram yang diperoleh pada zeolit Sukabumi terlihat tidak terjadi perubahan puncak-puncak difaktogram yang signifikan, hanya terjadi perubahan intensitas.
24
menunjukkan bahwa perlakuan dengan asam fosfat pada zeolit jenis mordenit dapat meningkatkan struktur kristalin dibandingkan yang amorf. Mordenit tergolong sangat tahan terhadap asam, dengan terjerapnya fosfat dalam zeolit yang membentuk ikatan baru Si-O-P-O-Al (Gambar 4) sehingga jarak Si-Al menjadi lebih jauh yang memungkinkan struktur zeolit menjadi fleksibel dan bentuk kristalnya menjadi lebih teratur. Perlakuan dengan basa NaHCO3 setelah modifikasi asam fosfat beberapa puncak mordenit intensitasnya meningkat sesuai yang dilaporkan oleh Sastiono (1993) yang memberikan perlakuan terhadap mordenit dengan basa.
Gambar 7 yang menunjukkan difraktogram zeolit Lampung terlihat ada perubahan intensitas untuk puncak-puncak penciri klinoptilolit. Kristalinitas zeolit Lampung tanpa perlakuan adalah 84.70% dan meningkat setelah dilakukan aktivasi dengan HCl 1N menjadi 90.42%. Hal ini diduga karena jumlah beberapa senyawa pengotor yang mengalami penurunan intensitas dan bahkan ada yang hilang. Senyawa pengotor seperti kuarsa (2θ = 20.95°, d = 4.23Å) dan montmorillonit (2θ = 20.10°, d = 3.06Å dan 2θ = 34.69°, d = 2.58Å) menjadi hilang. Senyawa pengotor lain seperti plagioklas (2θ = 32.02°, d = 2.79Å; (2θ = 23.85°, d = 3.72Å) mengalami penurunan intensitas. Tetapi salah satu puncak penciri utama klinoptilolit (2θ = 28.19°, d = 3.16Å) mengalami kenaikan intensitas yang signifikan yaitu dari 39% menjadi 100%.
25
Gambar 7 Difraktogram XRD zeolit Sukabumi A. tanpa perlakuan; B. setelah aktivasi; C. setelah modifikasi.
Gambar 8 Difraktogram XRD zeolit Lampung A. tanpa perlakuan; B. setelah aktivasi; C. setelah modifikasi.
Morfologi
27
Dalam penelitian digunakan metode ammonium asetat (Olu-Owolabi & Unuabonah, 2010) dengan amberlit sebagai kontrolnya (Lampiran 8). Hasil pengukuran KTK disajikan dalam Tabel 4. Hasil pengukuran KTK diperoleh bahwa aktivasi dengan pencucian menggunakan HCl 1N telah meningkatkan nilai KTK baik untuk zeolit Sukabumi maupun Lampung. Perlakuan dengan HCl 1N dengan waktu pengocokan yang berbeda dapat meningkatkan KTK zeolit asal Sukabumi dari 74.90-90.34 mek/100g telah dilaporkan oleh Sastiono (1993).
Tabel 4 Hasil pengukuran KTK
Jenis Sampel KTK (mek/100g)
Zeolit Lampung 93.03
Zeolit Sukabumi 92.60
Zeolit Lampung teraktivasi 125.23 Zeolit Sukabumi teraktivasi 126.10
Z-PNa2- L 149.62
Z-PNa2-S 179.90
28
Percobaan Adsorpsi
Efek variasi bobot adsorben
Jumlah ion Pb(II) yang teradsorpsi per satuan massa dari zeolit menurun dengan naiknya massa zeolit PNa2 yang ditunjukkan oleh kapasitas adsorpsinya (Gambar 11). Hasil serupa juga telah dilaporkan oleh Gupta & Bhattacharyya (2008) yang mempelajari adsorpsi Pb(II) menggunakan kaolinit dan montmorillonit. Hal ini disebabkan oleh dua alasan: (i) jumlah adsorben yang besar secara efektif mengurangi kejenuhan sisi aktif adsorpsi per satuan massa sehingga kapasitas adsorpsi berkurang dengan naiknya jumlah adsorben, dan (ii) jumlah adsorben yang besar menimbulkan agregasi partikel, mengakibatkan penurunan area permukaan total sehingga interaksi adsorben dan adsorbat menurun (Gupta & Bhattacharyya 2008).
Hasil perhitungan kapasitas adsorpsi untuk Z-PNa2-S dan Z-PNa2-L tidak menunjukkan perbedaan yang signifikan (Lampiran 9 dan 10). Pada bobot adsorben 0.2 g diperoleh kapasitas adsorpsi sebesar 12.28 mg/g (%adsorpsi = 99.67%) untuk Z-PNa2-S dan 12.24 (%adsorpsi = 99.29%) untuk Z-PNa2-L. Oleh sebab itu untuk percobaan selanjutnya digunakan bobot adsorben sebesar 0.2 g.
Efek pH
Efek dari pH larutan adsorbat terhadap kapasitas adsorpsi dari Z-PNa2-S dan Z-PNa2-L ditunjukkan pada Gambar 12. pH larutan merupakan parameter
0,00
29
operasional penting dalam proses adsorpsi karena akan berpengaruh pada kelarutan ion logam, konsentrasi kounter ion pada gugus fungsional adsorben (karboksilat, fosfat dan asam amino) dan derajat ionisasi dari adsorben selama reaksi serta kompetisi ion logam dalam pengikatan (Jiang et al. 2009, Fan et al. 2008). Gambar 12 menunjukkan bahwa kenaikan pH sampai dengan pH 5 menghasilkan peningkatan kapasitas adsorpsi baik untuk Z-PNa2-S maupun Z-PNa2-L. Pada pH 6 kapasitas adsorpsi kedua adsorben menurun, hal ini dimungkinkan pada pH 6 telah terjadi proses desorpsi. Hal serupa juga dilaporkan oleh Fan et al. (2008) yang menggunakan Penicillium simplicissimum sebagai adsorben ion Pb(II).
Kapasitas adsorpsi baik Z-PNa2-S maupun Z-PNa2-L terbesar pada pH 5 yaitu berturut-turut 12.78 mg/g dan 12.80 mg/g dengan efisiensi adsorpsi sebesar 99.47% dan 99.40%. Pada pH yang sama menunjukkan bahwa kapasitas adsorpsi untuk Z-PNa2-L lebih besar dari Z-PNa2-S walaupun perbedaannya hanya sedikit. Sisi aktif pada zeolit termodifikasi bersifat asam keras, dengan adanya media yang dibuat asam maka sisi aktif fosfat menjadi bersifat asam lunak sehingga mempunyai afinitas yang tinggi terhadap ion Pb(II) yang bersifat basa lunak. Pada pH 5 zeolit termodifikasi mempunyai kapasitas adsorpsi yang stabil, hal ini diduga terjadinya reaksi kompotitif antara proton dan pembentuka kompleks fosfat (Xie et al. 2011). Kapasitas dan efisiensi adsorpsi dari kedua adsorben pada saat kesetimbangan tidak berubah secara signifikan dengan kenaikan pH (Lampiran 11 dan 12). Bahkan pada nilai pH yang rendah efisiensi adsorpsi masih
12,64
30
tinggi, hal ini menyebabkan nilai pH larutan meningkat selama percobaan karena hidrolisis dari adsorben (Bektas & Kara 2004). Hasil serupa dilaporkan oleh Bektas & Kara (2004) yang menggunakan Na-klinoptilolit untuk mengadsorpsi Pb(II).
Efek waktu kontak dan penentuan kinetika adsorpsi
Efek waktu kontak terhadap adsorpsi Pb(II) dengan kedua adsorben Z-PNa2-S maupun Z-PNa2-L dapat terlihat pada Gambar 13. Lamanya waktu kontak ternyata tidak memberikan pengaruh yang signifikan terhadap kapasitas dan efisiensi adsorpsi dari adsorben. Kedua adsorben tersebut memiliki perbedaaan kapasitas dan efisiensi adsorpsi yang tidak begitu signifikan pula (Lampiran 13 dan 14). Dari waktu 10 sampai 120 menit kapasitas adsorpsi untuk Z-PNa2-S meningkat dari 12.62 menjadi 12.74 mg/g dan efisiensi adsorpsi dari 98.44 menjadi 98.94%, dan setelah 120 menit kapasitas adsorpsinya menjadi konstan. Untuk Z-PNa2-L kapasitas adsorpsi dari waktu 10 menit sampai 150 menit meningkat dari 12.61 menjadi 12.73 mg/g dengan efisiensi adsorpsi 98.02 menjadi 98.87% dan setelah 150 menit kapasitas adsorpsinya menjadi konstan. Hal ini disebabkan karena permukaan adsorben yang telah jenuh atau terjadi kesetimbangan.
Pencapaian kesetimbangan dipengaruhi oleh beberapa faktor termasuk sifat adsorben dan adsorbat, serta interaksi antara keduanya (Gupta & Bhattacharyya 2008). Buasri et al. (2008) melaporkan bahwa adsorpsi Pb(II) dengan klinoptilolit
12,6
31
mencapai kesetimbangan setelah 120 menit untuk konsentrasi awal 800 mg/L. Adsorpsi Pb(II) dengan montmorillonit mencapai kesetimbangan setelah 180 menit untuk konsentrasi awal 50 mg/L (Gupta & Bhattacharyya 2008).
Kinetika adsorpsi menjelaskan laju pengambilan zat terlarut oleh adsorben selama waktu kontak reaksi penjerapan. Mekanisme kinetika yang mengendalikan proses adsorpsi Pb(II) oleh Z-PNa2-S dan Z-PNa2-L dianalisis dengan model kinetika orde pertama dan kedua semu (Lampiran 15). Model kinetika adsorpsi Pb(II) oleh Z-PNa2-S dan Z-PNa2-L ditunjukkan pada Gambar 14 dan 15, berturut-turut serta parameter kinetika yang ditentukan dari kemiringan dan intersepnya berdasarkan persamaan 6 dan 9 (Lampiran 16) disajikan pada Tabel 5.
-8
Gambar 14 Plot kinetika orde pertama semu adsorpsi Pb(II) oleh Z-PNa2-S dan Z-PNa2-L
32
Tabel 5 Perbandingan konstanta laju orde pertama dan kedua semu
Adsorben
qe percobaan
(mg/g)
Orde pertama semu Orde kedua semu
k1
Keterangan: qe: kapasitas adsorpsi; k1: konstanta laju orde pertama semu; k2: konstanta laju kedua
semu
Tabel 5 menunjukkan bahwa koefisien korelasi orde kedua semu lebih besar daripada orde pertama semu untuk kedua adsorben. Dengan menggunakan persamaan kinetika adsorpsi model orde kedua semu, parameter yang akan didapat adalah konstanta adsorpsi (k2) dan kapasitas adsorpsi hitung (qeh). Nilai qeh (teoritis) model orde kedua semu lebih mendekati nilai qe percobaan. Sehingga pada penelitian ini adsorpsi Pb(II) dengan Z-PNa2-S dan Z-PNa2-L mengikuti model kinetika orde kedua semu. Hasil serupa juga dilaporkan oleh oleh Sprynskyy et al. (2006) dan Bektas & Kara (2004) yang menggunakan klinoptiolit dan Na-klinoptilolit untuk menjerap Pb(II). Model kinetika orde kedua semu berdasarkan asumsi bahwa pembatas laju adalah adsorpsi kimia antara adsorben dan adsorbat (Mohan et.al 2006). Persamaan orde kedua semu juga diasumsikan sebagai jenis khusus dari kinetika Langmuir, bahwa (i) konsentrasi adsorbat konstan dalam selang waktu tertentu dan (ii) jumlah sisi aktif tergantung pada jumlah adsorbat yang teradsorpsi pada saat kesetimbangan (Gupta & Bhattacharyya 2011).
Efek konsentrasi awal dan isoterm adsorpsi
33
driving force yang dimiliki untuk mengatasi hambatan transfer massa dari ion logam dari fasa larutan ke fasa padatan sehingga mengakibatkan makin tingginya probabilitas tumbukan antara ion Pb(II) dan sisi aktif adsorben (Jiang, et al 2009). Isoterm adsorpsi mengungkapkan hubungan khusus antara konsentrasi adsorbat, tingkat penyerapannya ke permukaan adsorben pada suhu konstan, sifat serta afinitas adsorben (Jiang et al. 2010; Ghassabzadeh et al. 2010). Kesetimbangan adsorpsi isoterm adsorpsi pada pH 5 dan suhu kamar diperlihatkan pada Gambar 16.
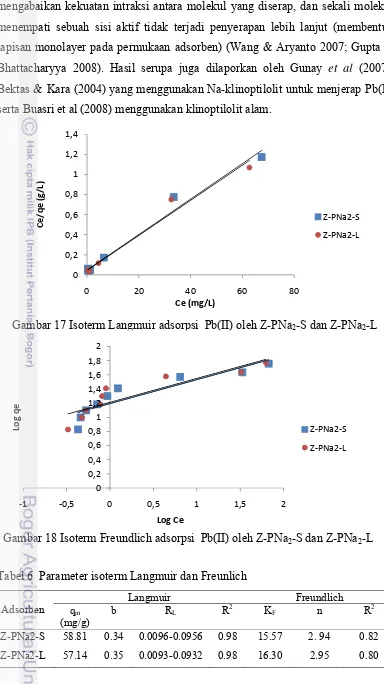
Pada penelitian ini, data hasil percobaan adsorpsi isotermal Pb(II) dengan Z-PNa2-S maupun Z-PNa2-L dianalisis dengan dua model isoterm adsorpsi yaitu model Langmuir dan Freundlich (Lampiran 19). Isoterm Langmuir berdasarkan adsorpsi monolayer pada sisi aktif adsorben yang homogen, sebaliknya isoterm Freundlich menggambarkan adsorpsi pada permukaan multilayer (heterogen) dengan energi adsorpsi seragam. Kedua isoterm adsorpsi Pb(II) dengan Z-PNa2-S dan Z-PNa2-L disajikan dalam Gambar 17 dan 18, berturut-turut. Parameter isoterm adsorpsi disajikan pada Tabel 6.
Pada adsorpsi Pb(II) dengan Z-PNa2-S maupun Z-PNa2-L nilai korelasi model Langmuir lebih besar dibandingkan model Freundlich, menunjukkan bahwa proses adsorpsi didominasi oleh adsorpsi monolayer (homogen). Isoterm Langmuir pada awalnya dikembangkan untuk menggambarkan adsorpsi kimia pada satu sisi aktif adsorpsi yang berbeda. Model ini didasarkan pada asumsi yang
0 10 20 30 40 50 60 70
0 20 40 60 80
qe (mg/g)
Ce (mg/L)
Z-PNa2-S
Z-PNa2-L
34
mengabaikan kekuatan intraksi antara molekul yang diserap, dan sekali molekul menempati sebuah sisi aktif tidak terjadi penyerapan lebih lanjut (membentuk lapisan monolayer pada permukaan adsorben) (Wang & Aryanto 2007; Gupta & Bhattacharyya 2008). Hasil serupa juga dilaporkan oleh Gunay et al (2007), Bektas & Kara (2004) yang menggunakan Na-klinoptilolit untuk menjerap Pb(II) serta Buasri et al (2008) menggunakan klinoptilolit alam.
Tabel 6 Parameter isoterm Langmuir dan Freunlich
Adsorben Z-PNa2-L 57.14 0.35 0.0093-0.0932 0.98 16.30 2.95 0.80
0 Gambar 17 Isoterm Langmuir adsorpsi Pb(II) oleh Z-PNa2-S dan Z-PNa2-L
35
Dengan menggunakan persamaan isoterm Langmuir, parameter yang sangat penting yang biasa didapat adalah kapasitas adsorpsi maksimum (qm) teoritik. Tabel 6 menunjukkan bahwa Z-PNa2-S dan Z-PNa2-L memiliki qm yang tidak jauh berbeda untuk konsentrasi awal 30-50 mg/L.
Parameter lain yang dapat diperoleh dari persamaan Langmuir adalah nilai RL yang merupakan parameter kesetimbangan atau dimensi adsorpsi. Jika RL>1 proses adsorpsi bersifat unfavorable sebab adsorpsi pada zat padat relatif rendah; RL = 1 proses adsorpsi linear, yang mengandung arti jumlah adsorbat sebanding dengan konsentrasinya dalam fluida; 0< RL<1 proses adsorpsi favorable, adsorpsi relatif tinggi pada adsorben terjadi pada konsentrasi rendah, dan RL = 0 proses adsorpsi tidak dapat balik (irreversible) (Ghassabzadeh et al. 2010). Dalam isoterm Freundlich, nilai n dalam rentang 1-10 menunjukkan bahwa proses adsorpsi favorable (Fan et al. 2008). Tabel 4 menunjukkan bahwa nilai RL adsorpsi Pb(II) dengan Z-PNa2-S dan Z-PNa2-L memiliki rentang nilai 0< RL<1 serta nilai n dari isoterm Freundlich lebih besar dari 1 yang menunjukkan bahwa proses adsorpsi relatif tinggi pada adsorben terjadi pada konsentrasi rendah. Adsorpsi Pb(II) dengan perlit dan kitosan terimmobilisasi pada bentonit juga memberikan hasil yang serupa dengan nilai RL 0.26-0.95 dan
0.0002–0.0020 serta nilai n>1 (Ghassabzadeh et al. 2010; Futalan et al. 2011).
Efek suhu dan parameter termodinamika
36
Parameter termodinamika ∆H, ∆S dan ∆G untuk proses adsorpsi ditentukan dengan memplot ln Kd vs 1/T (Gambar 20, Tabel 7 dan Lampiran 22). Untuk kedua adsorben nilai ∆H negatif menunjukkan bahwa interaksi yang terjadi bersifat eksotermik. Nilai ∆H untuk interaksi Pb(II)-Z-PNa2-S adalah -40 kJ/mol dan Pb(II)-Z-PNa2-L adalah -47.08 kJ/mol. Entalpi adsorpsi fisika berkisar 5-40 kJ/mol dan adsorpsi kimia berkisar 40-800 kJ/mol (Chang et al. 2006). Oleh karena itu adsorpsi Pb(II) baik dengan Z-PNa2-S maupun Z-PNa2-L termasuk dalam kategori adsorpsi kimia. Besarnya ∆S untuk adsorpsi Pb(II) dengan Z-PNa2-S dan Z-PNa2-L berturut-turut adalah -0.10 kJ/mol dan -0.12 kJ/mol. Hal ini menunjukkan bahwa distribusi Pb(II) dalam fase air jauh lebih tidak teratur dibandingkan pada fase padat (permukaan adsorben), sehingga Pb(II) memiliki afinitas kuat terhadap adsorben (Gupta & Bhattacharyya 2008; Jiang et al. 2009).
12,62
300 305 310 315 320
qe (mg/g)
0,0031 0,00315 0,0032 0,00325 0,0033 0,00335
ln Kc
1/T (1/K)
Z-PNa2-S
Z-PNa2-L
Gambar 19 Efek variasi suhu pada adsorpsi Pb(II) oleh Z-PNa2-S dan Z-PNa2-L
37
Tabel 7 Data parameter termodinamika adsorpsi Pb(II) dengan Z-PNa2-S dan Z-PNa2-L
Adsorben ∆H (kJ/mol)
∆S
(kJ/mol) ∆G (kJ/mol)
303 K 308 K 313 K 318 K Rata-rata Z-PNa2-S -40.00 -0.10 -8.70 -8.18 -7.66 -7.15 -7.92 Z-PNa2-L -47.08 -0.12 -8.86 -8.23 -7.60 -6.97 -7.92
SIMPULAN DAN SARAN
Simpulan
Modifikasi zeolit dengan asam fosfat mampu meningkatkan KTK zeolit alam asal Sukabumi dan Lampung. Zeolit Sukabumi mengalami kenaikan KTK dari 92.60 menjadi 179.90 mek/100g dan zeolit Lampung dari 93.03 menjadi 149.62 mek/100g. Proses adsorpsi Pb(II) dengan Z-PNa2-S dan Z-PNa2-L tidak terlalu dipengaruhi oleh faktor pH, waktu dan suhu karena kapasitas adsorpsinya menunjukan perubahan yang tidak signifikan dengan adanya faktor tersebut. Proses adsorpsi Pb(II) dengan Z-PNa2-S dan Z-PNa2-L mengikuti model isoterm Langmuir dan kinetika reaksi orde kedua semu sehingga proses adsorpsi cenderung terjadi secara kimia, spontan di lingkungan dan bersifat eksotermis.
Saran
DAFTAR PUSTAKA
Amri A, Supratno, Fahrurozi M. 2004. Kesetimbangan adsorpsi optimal campuran biner Cd (II) dan Cr (III) dengan zeolit alam terimpreganasi 2-merkaptobenzotiazol. Jurnal Natur Indonesia. 6: 111-117.
Astawan M. 2008. Bahaya logam berat dalam makanan. [terhubung berkala]. http://www.bmf.litbang.depkes.go.id. 3 Nopember 2010.
Berber-Mendoza MS, Leyva-Ramos R, Alonso-Davila P, Fuentes-Rubio L, Guerrero-Coronado RM. 2006. Comparison of isotherm for the ion exchange of Pb(II) from aqueous solution onto homoionic clinoptilolite. Journal of Colloid and Interface Science 301: 40-45.
Bektas N, Kara S. 2004. Removal of lead from aqueous solutions by natural clinoptilolite: equilibrium and kinetic studies. Separation and Purification Technology 39: 189-200.
Buasri A, Chaiyut N, Phattarasirichot K, Yongbut P, Nammueng L. 2008. Use of natural clinoptilolite for the removal of lead(II) from wastewater in batch experiment.Chiang Mai J. Sci. 35: 447-456.
Cakicioglu-Ozkan F, Ulku S. 2005. The effect of HCl treatment on water vapor adsorption characteristics of clinoptilolite rich natural zeolite. Microporous and Mesoporous Materials 77: 47-53.
Can O, Balköse D, Ulku S. 2010. Batch and column studies on heavy metal removal using a local zeolitic tuff. Desalination 259: 17–21.
Chang YC, Chen DH. 2006. Recovery of gold (III) ions by a chitosan coated magnetic nano-adsorbent. Gold Bulletin 39: 98-102
Fan T, Liu Y, Feng B, Zeng G, Yang C, Zhou M, Zhou H, Tan Z, Wang X. 2008. Biosorption of cadmium (II), zinc(II), and lead(II) by Penicillium simplicissimum: Isotherm, kinetics and thermodynamics. Journal of Hazardous Materials 160: 655-661.
Futalana CM, Kanb CC, Dalidac ML, Hsienb KJ, Pascuad C, Wan MW. 2011. Comparative and competitive adsorption of copper, lead, and nickel using chitosan immobilized on bentonite. Carbohydrate Polymers 83: 528–536. Ghassabzadeh H, Torab-Mostaedi M, Mohaddespour A, Maragheh MG, Ahmadi
42
Ghiara RM, Petti C, Franco E, Lonis R, Luxoro S, Gnazzo L. 1999. Occurrence of clinoptilolite and mordenite in tertiary calc-alkaline pyroclastites from Sardinia (Italy). Clays and Clay Minerals 47: 319-328.
Gunay A, Arslankaya E, Tosun I. 2007. Lead removal from aqueous solution by natural and pretreated clinoptilolite: Adsorption equilibrium and kinetics. Journal of Hazardous Materials 146: 362-371.
Gupta SS, Bhattacharyya KG. 2008. Immobilization of Pb(II), Cd(II) and Ni(II) ion on kaolinite and montmorillonite surface from aqueous medium. Journal of Environmental Management 87: 46-58.
Gupta SS, Bhattacharyya KG.2011. Kinetics of adsorption of metal on inorganic materials: A review. Advances in Colloid and Interface Science. 162: 39-58. Hamidpour M, Kalbasi M, Afyuni M, Shariatmadari H, Holmc PE, Hansenc
HCB. 2010. Sorption hysteresis of Cd(II) and Pb(II) on natural zeolite and bentonite. Journal of Hazardous materials. 181: 686-691.
Haron MJ, Shafie NA, Yusof NA, Kassim A, Yunus WMZW, Talebi SM. 2009. Sorption Cu (II) by chemically grafted hydroxamic acid-zeolite. The Malaysian Journal of Analytic Sciencel 13: 52-62.
Hernandes-Beltran NA, Olguin MT, Rosas-Aburto A. 2008. Effect of acid phosphate media on stability of clinoptilolit-rich tuff. Journal Inclusion Phenomena Macrocyclic Chemistry 61:93-100.
Ingelzakis VJ, Loizidou MD, Grigoropoulou HP. 2003. Ion exchange of Pb2+, Cu2+, Fe3+, and Cr3+ on natural clinoptilolite: selectivity determination and influence of acidity on metal uptake. Journal of Colloid and Interface Science 261: 49–54.
IZA Commission on Natural Zeolites. 2010.Index of Natural Zeolites Datasheets. [terhubung berkala]. http://www.iza-online.or/natura/index.htm. 16 Desember 2010.
Jamil TS, Ibrahim HS, El-Maksoud IHA, El-Wakeelet ST. 2010. Application of zeolite prepared from Egyptian kaolin for removal of heavy metal: I. Optimum conditions. Desalination 258: 34-40.
Jiang M, Wang Q, Jin X, Chen Z. 2009. Removal of Pb(II) from aqueous solution using modified and unmodified kaolinite clay. Journal of Hazardous Materials. 170: 332-339.
43
Keputusan Menteri Negara Lingkungan Hidup No. 51 tahun 1995 tentang baku mutu limbah cair bagi kegiatan industri. Jakarta: Pemerintah Republik Indonesia.
Korkuna O, Leboda R, Skubiszewska-Zieba J, Vrublevs’ka T, Gun’ko VM, Ryczkowski J. 2006. Structural and physicochemical properties of natural zeolites: clinoptilolite and mordenite. Microporous and Mesoporous Materials 87: 243–254.
Lippard SJ, Berg JM. 1994. Principles of bioinorganic chemistry. California. Mill Valley.
Mohan D, Pittman Jr CU, Steele PH. 2006. Single, binary and multi-component adsorption of copper and cadmium from aqueous solutions on Kraft lignin-abiosorbent. Journal of Colloid and Interface Science 297: 489-504.
Olu-Owolabi BI, Unuabonah EI 2010. Kinetic and thermodynamics of the removal of Zn2+ and Cu2+ from aqueous solution by sulphate and phosphate-modified bentonite clay. Journal of Hazardous Materials 184: 731-738 Panneerselvam P, Thinakarana N, Thiruvenkataravi KV, Palanichamyb M,
Sivanesana S. 2008. Phosphoric acid modified-Y zeolites: A novel, efficient and ion exchanger. Journal of Hazardous Materials 159: 427-434.
Pentrak M, Madejova J, Komadel P. 2009. Acid and alkali treatment of kaolins. Clay Minerals 44: 511–523.
PPPTM. 1997. Bahan galian industri. Bandung. PPPTM
Rohaeti E. 2007. Pencegahan pencemaran lingkungan oleh logam berat krom limbah cair penyamakan kulit (studi kasus di kabupaten Bogor) [disertasi]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Sastiono A. 1993. Perilaku mineral zeolit dan pengaruhnya terhadap perkembangan tanah [disertasi]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Senthilkumar S, Saraswathi R. 2009. Electrochemical sensing of cadmium and lead ions at zeolite-modified electrodes: Optimization and field measurement. Sensors and Actuators B: Chemical 141: 65–75.
Sprynskyy M, Buszewski B, Terzyk AP, Namiesnik J. 2006. Study of the selection mechanism of heavy metal (Pb2+, Cu2+, Ni2+, and Cd2+) adsorption on clinoptilolite.Journal of Colloid and Interface Science 304: 21–28. Subramanyam B, Das A. 2009. Linearized and non-linearized isotherm models
44
Sudarmaji, Mukono J, Corie. 2006. Toksikologi logam berat B3 dan dampaknya bagi kesehatan. Jurnal Kesehatan Lingkungan 2: 129-142.
Tarlan-Yel E, Onen, V. 2010. Perfomance of natural zeolite and sepiolite in the removal cyanide and copper-complexed cyanide ([Cu(CN)3]2-). Clays and
Clay Minerals 58: 110–119.
Trisunaryati W, Triwahyuni E, Sudiono S. 2005. Preparasi, modifikasi dan karakterisasi katalis Ni-Mo/zeolit alam dan Mo-Ni/zeolite alam. Teknoin 10: 269-282.
Unuabonah EI, Adebowale KO, Olu-Owolabi BI. 2007. Kinetic and thermodynamic studies of the adsorption lead (II) ions onto phosphate-modified kaolinite clay. Journal of Hazardous Materials. 144: 386-395. Valdes MG, Perez-Cordoves AI, Diaz-Garcia ME. 2006. Zeolites and
zeolit-based materials in analytical chemistry. Trends in Analytical Chemistry 25: 24-30.
Wang S, Ariyanto E. 2007. Competitive adsorption of malachite blue and Pb ions on natural zeolite. Colloids and Interface Science 314: 25-31.
Wang S, Peng Y. 2010. Natural zeolite as effective adsorbent in water and wastewater treatment. Chemical Engineering Journal 156: 11-24.
.
Wang S, Terdkiatburana T, Tade MO. 2008. Adsorption of Cu(II), Pb(II) and humic acid on natural zeolite tuff in single and binary systems. Separation and Purification Technology 62: 64–70.
Wang TH, Liu TY, Wu DC, Li MH, Chenb JR, Tenga SP. 2010. Performance of phosphoric acid activated montmorillonite as buffer materials for radioactive waste repositoryJournal of Hazardous Materials 173: 335–342. Wingenfelder et al. 2005. Adsorption of Pb and Cd by amine-modified Zeolite.
Water Research 39: 3287–3297
World Health Organization. 2004. Gudeline for drinking water. Geneva. WHO. Xie G, Shang X, Liu R, Hu J, Liao S. 2011. Synthesis and characterization of a
46
Lampiran 1 Bagan Alir Penelitian
Preparasi zeolit alam asal Lampung dan Sukabumi
Modifikasi dengan asam fosfat, dan pengubahan
ke bentuk zeolit PNa2 Karakterisasi
XRD, SEM-EDS, luas permukaan,
penentuan KTK
Zeolit termodifikasi asam fosfat
Percobaan Adsorpsi ion logam Pb
Aktivasi zeolit alam asal Lampung dan Sukabumi
Efek pH 2-6
Efek konsentrasi adsorbat dan penentuan isoterm
adsorpsi 30-300 mg/L Efek waktu kontak
dan penentuan kinetika adsorpsi
10-240 menit Efek bobot
adsorben 0.05-0.5 g
Efek suhu dan penentuan
parameter termodinamika
47
Lampiran 2 Preparasi zeolit alam
(Amri et al. 2004; Berber-Mendoza et al. 2006; Can et al. 2010; Jamil et al. 2010)
Lampiran 3 Aktivasi zeolit alam
(Cakicioglu-Ozkan & Ulku 2005; Trisunaryati et al. 2005; Sastiono 1993) Zeolit alam asal Lampung dan Sukabumi
Dicuci dengan akuades
Digiling dan diayak lolos ayakan 40 mesh
Dikeringkan dalam oven pada suhu 110°C selama 24 jam
Residu dicuci dengan akuades sampai bebas Cl Diaduk dengan pengaduk magnet, 3 jam
Dioven 130°C 3 jam 100 g Zeolit
alam
2000 mL HCl 5M
+
48
Lampiran 4 Modifikasi zeolit alam dengan asam fosfat (Pannerselvam et al. 2008)
Diaduk dengan pengaduk magnet, 3 jam pada suhu 60°C
Residu dioven 120°C selama 3 jam 100 g Zeolit alam
teraktivasi
2000 mL akuabides
+
+ 13.1 g H3PO4
(7.78 mL)
1500 mL NaHCO3 jenuh disaring
Residu dicuci dengan akuades sampai pH netral
+
Diaduk dengan pengaduk magnet, 3 jam pada suhu 60°C
Dioven 120°C selama 3 jam
49
Lampiran 5 Penentuan KTK (Olu-Owolabi & Unuabonah 2010)
50 mL CH3COONH4 1 M (pH 7)
Dikocok dengan shaker selama 1 jam pada 200 rpm
Residu dicuci dengan air bebas ion untuk menghilangkan sisa natrium asetat 2 g sampel
zeolit
50 mL
CH3COONa 1M
+
+
Residu dikeringkan-udarakan
Dikocok dengan shaker selama 1 jam pada 200 rpm
Filtrat ditampung
Diulang 3 kali
50
Lampiran 6 Percobaan adsorpsi
(Gupta & Bhattacharyya 2008; Panneerselvam et al. 2008; Gunay et al. 2007)
50 mL larutan logam dengan konsentrasi tertentu
Digoyangkan dengan shaker dengan kecepatan 150 rpm selama waktu tertentu
Erlenmeyer 100 mL
Disentrifuse 0.05 g Zeolit-PNa2 +
Supernatant diukur dengan SSA
51
Lampiran 7 Penentuan kapasitas adsorpsi zeolit terhadap asam fosfat Kurva kalibrasi
Sampel Konsentrasi
(mg/L) Absorbansi
Zeolit Sukabumi 8.00 0.239 Zeolit Lampung 7.10 0.210
Konsentrasi awal fosfat: 6550 mg/L, Volume larutan asam fosfat = 2L, bobot zeolit 100 gram
Zeolit Sukabumi (pengenceran 20 kali), konsentrasi fosfat sisa: 160.062 mg/L Konsentrasi fosfat yang teradsorpsi: 6550 – 160.062 = 6389.938 mg/L Kapasitas adsorpsi zeolit Sukabumi terhadap fosfat = . =
. /
52
Lampiran 8 Data hasil pengukuran KTK
Jenis Sampel Ulangan bobot sampel (g)
Konsentrasi Na+ terukur dengan SSA (ppm)
KTK (mek/100g)
Rerata KTK (mek/100g)
KTK terkoreksi (mek/100g)
Zeolit Sukabumi 1 2.0004 137.81 74.88
84.18 92.60
2 2.0003 172.04 93.48
Zeolit teraktivasi Sukabumi 1 2.0003 198.60 107.92 114.64 126.10
2 2.0005 223.35 121.36
Zeolit termodifikasi Sukabumi (Z-PNa2-S)
1 2.0004 295.58 160.61 163.54 179.90
2 2.0002 306.35 166.48
Zeolit Lampung 1 2.0004 124.95 67.77 84.58 93.03
2 2.0002 186.58 101.39
Zeolit teraktivasi Lampung 1 2.0002 210.49
114.38
113.85 125.23
2 2.0004 208.54 113.32
Zeolit termodifikasi Lampung (Z-PNa2-L)
1 2.0002 239.72 130.27 136.02 149.62
2 2.0003 260.89 141.76
Amberlit (kontrol) (teoritis 440 mek/100 g)
1 2.0002 730.78 397.12 395.57
2 2.0001 725.02 394.01
53
Contoh perhitungan KTK untuk amberlit:
Volume filtrat yang mengandung Na+ = 250 mL
Sampel amberlit 1: 730.78 mg/L x 0.25 L = 182.695 mg = 7.943 mmol Na+ = 7.943 mek KTK = 7.943 x 100/2.0002 g = 397.12 mek/100 g
Sampel amberlit 2: 725.02 mg/L x 0.25 L = 181.26 mg = 7.8807 mmol Na+ = 7.8807 mek KTK = 7.8807 x 100/2.0001 g = 394.01 mek/100 g
KTK rata-rata = 395.57 mek/100 g
% kesalahan pengukuran metoda yang digunakan: (440 – 395.57)/440 x 100% = 10 % Faktor koreksi: 10% dari KTK terukur, maka KTK yang terukur akan ditambah 10%.