UIN SYARIF HIDAYATULLAH JAKARTA
UJI ANTIFERTILITAS EKSTRAK ETANOL 70% BIJI
JARAK PAGAR (
Jatropha curcas
L. ) PADA TIKUS
JANTAN GALUR
Sprague Dawley
SECARA
IN VIVO
SKRIPSI
Diajukan sebagai salah satu syarat untuk
memperoleh gelar Sarjana Farmasi
WIDYA DWI ARINI
NIM : 108102000056
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
ABSTRAK
Nama : Widya Dwi Arini Program Studi : Farmasi
Judul : Uji Antifertilitas Ekstrak Etanol 70% Biji Jarak Pagar (Jatropha curcas L.) Pada Tikus Jantan Galur Sprague Dawley Secara In Vivo
Penelitian ini dilakukan untuk menguji efek antifertilitas ekstrak etanol 70% biji jarak pagar (Jatropha curcas L.) pada tikus jantan. Ekstrak diberikan secara oral sekali sehari dalam 48 hari. Sampel terdiri dari 20 ekor tikus jantan galur Sprague Dawley yang dibagi 4 kelompok yaitu kelompok kontrol (Na CMC 1%), kelompok perlakuan I (5mg/kg BB), II (25 mg/kg BB), dan III (50 mg/kg BB). Kemudian hasil dianalisis dengan menggunakan analisis One Way ANOVA dan dilanjutkan dengan uji Multiple Comparisons. Hasil penelitian menunjukkan bahwa pemberian ekstrak etanol 70% biji jarak pagar dengan dosis 5 mg/kg BB, 25 mg/kg BB, dan 50 mg/kg BB memberikan penurunan yang bermakna terhadap konsentrasi spermatozoa, bobot testis, dan diameter tubulus seminiferus dibandingkan dengan kontrol (p ≤ 0,05). Jumlah spermatosit pakiten dan jumlah sel Sertoli dihitung pada seluruh tahapan dan jumlah spermatosit pakiten per jumlah sel Sertoli masing-masing dihitung dalam tahap II,VII dan XII dari siklus epitel seminiferus. Hasil menunjukkan perbedaan yang bermakna antara kelompok kontrol dan kelompok perlakuan dosis 25 mg/kg BB dan 50 mg/kg BB, yaitu terjadi penurunan jumlah spermatosit pakiten pada kelompok perlakuan (p ≤ 0,05). Terjadi penurunan jumlah sel Sertoli secara bermakna pada dosis 5 mg/kg BB dan 25 mg/kg BB. Dari beberapa hasil pengamatan tersebut, disimpulkan bahwa ekstrak etanol 70% biji jarak pagar dapat mempengaruhi spermatogenesis tikus. Hasil penelitian ini diharapkan dapat dikembangkan sebagai bahan kontrasepsi pria.
vi ABSTRACT
Nama : Widya Dwi Arini Program Studi : Farmasi
Judul : Uji Antifertilitas Ekstrak Etanol 70% Biji Jarak Pagar (Jatropha curcas L.) Pada Tikus Jantan Galur Sprague Dawley Secara In Vivo
This study was aimed to find out anti-fertility effects of 70% ethanolic extract of
Jatropha curcas seeds of male rats. The extract was given orally once a day for 48 days. The sample consisted of 20 Sprague Dawley male rats that were divided four groups: control group (CMC Na 1%), treatment I (5 mg/Kg BW), II (25 mg/Kg BW), and III (50 mg/Kg BW). The result of experiment was analyzed by using One Way ANOVA and by Multiple Comparisons test. The results showed that 70% ethanolic extract of Jatropha curcas seed in dosage 5 mg/Kg BW, 25 mg/Kg BW, and 50 mg/Kg BW resulted significant decrease to sperm concentration, testis weight, and diameter of seminiferous tubules compared with
control (p ≤ 0,05). The number of pachytene spermatocytes and Sertoli cells were counted in all stages and number of pachytene spermatocytes per Sertoli cells were counted in stages II,VII and XII of the cycle of the seminiferous epithelium. The results showed significant difference between the control and the treatment dosage 25 mg/Kg BW and treament 50 mg/Kg BW groups. There were decreased the number of pachyten spermatocytes in treatment groups (p ≤ 0,05). A decline in the number of Sertoli cells was significantly in dosage 5 mg/kg BW and 25 mg/kg BW. This concluded that the 70% ethanolic extract of Jatropha curcas seed influenced the spermatogenesis of rat. It is hoped that the results of this study can be used to develop a male contraceptive method.
KATA PENGANTAR
Alhamdulillahirabbil`alamiin, segala puji dan syukur penulis panjatkan
kehadirat Allah SWT yang telah melimpahkan rahmat dan ridho-Nya sehingga
penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini hingga selesai.
Skripsi yang berjudul ”Uji Antifertilitas Ekstrak Etanol 70% Biji Jarak Pagar (Jatropha curcas L.) Pada Tikus Jantan Galur Sprague Dawley Secara
In Vivo”disusun dalam rangka memenuhi persyaratan untuk memperoleh gelar
Sarjana Farmasi pada Fakultas Kedokteran Dan Ilmu Kesehatan Universitas Islam
Negeri Syarif Hidayatullah Jakarta.
Dalam proses penelitian dan penyusunan skripsi ini penulis menyadari ada
beberapa pihak yang sangat memberikan kontribusi kepada penulis. Maka, pada
kesempatan ini penulis ingin menyampaikan rasa terima kasih dan penghargaan
sebesar-besarnya kepada :
1. Prof. Dr. (hc) dr. M. K. Tadjudin, Sp.And selaku Dekan Fakultas
Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta dan
sebagai pembimbing, terima kasih atas arahan, bimbingan dan kesabaran
dalam meluangkan waktu, pikiran dan tenaganya untuk membimbing
penulis selama ini.
2. Drs. Umar Mansur M.Sc, Apt selaku Ketua Program Studi Farmasi
Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta
3. Dr. Azrifitria, M.Si, Apt sebagai pembimbing, terimakasih telah banyak
memberikan ilmu, pengarahan dan bimbingan kepada penulis selama
menyusun skripsi ini.
4. Bapak dan Ibu Dosen Program Studi Farmasi Fakultas Kedokteran dan
Ilmu Kesehatan yang telah memberikan ilmunya kepada penulis.
5. Kedua orang tua, yang telah memberikan dorongan, semangat, dan
pengertiannya bagi penulis baik secara moril dan materiil.
6. Seluruh kakak-kakak laboran yang telah membantu penulis selama
viii
7. Enrico S. Caesar, penyemangat yang selalu mendoakan, mengisi
warna-warni kehidupan, setia dan selalu sabar mendengar keluh kesah penulis
dalam menyelesaikan penelitian ini.
8. Teman seperjuangan sepenelitian Rr.Alvira Widjaya, terima kasih atas
bantuan, motivasi, dan kebersamaannya selama penelitian.
9. Sahabat-sahabat tersayang yang selalu ada (Vira, Sivia, Septi, Ade, Indah,
Pura) yang tak henti memberikan doa, semangat, masukan untuk
kelancaran penyusunan skripsi.
10.Teman-teman Alcoolique ( Dian, Dwinur, Ayu, dll ) dan Beta Laktam yang tidak dapat saya sebutkan satu persatu, terima kasih telah memberikan doa,
dukungan, dan persaudaraan selama ini untuk penulis.
11.Pihak-pihak yang tidak dapat disebutkan satu-satu oleh penulis, yang telah
membantu penyelesaian skripsi.
Akhirnya dengan segala kerendahan hati, penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan, maka penulis mengharapkan kritik dan saran
pembaca yang bersifat membangun guna memperbaiki kemampuan penulis.
Jakarta, November 2012
x DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSYARATAN ORISINALITAS ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
ABSTRAK ... v
ABSTRACT ... vi
KATA PENGANTAR ... vii
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI... ix
2.3.3. Destilasi uap ... 12
2.3.4. Cara Ekstraksi lainnya ... 12
2.3.4.1. Ekstraksi berkesinambungan ... 12
2.3.4.2. Super kritikal kabondioksida ... 13
2.3.4.3. Ekstraksi ultrasonik ... 13
2.3.4.4. Ekstraksi energi listrik ... 13
2.4. Tinjauan Hewan Percobaan... 13
2.4.1. Klasifikasi Tikus Putih (Rattus norvegicus) ... 13
2.4.2. Biologis Tikus Putih (Rattus norvegicus) ... 14
2.5. Sistem Reproduksi Jantan ... 15
3.3.Rancangan Penelitian ... 25
3.4.Kegiatan Penelitian ... 26
3.4.1. Pemeriksaan Simplisia ... 26
3.4.2. Penyiapan Simplisia ... 26
3.4.3. Pembuatan Ekstrak ... 26
3.4.4. Penapisan Fitokimia ... 27
3.4.5. Pengujian Parameter Spesifik dan Non Spesifik ... 29
3.4.5.1. Identitas ekstrak ... 29
3.4.5.2. Organoleptik ... 29
3.4.5.3. Susut pengeringan... 29
3.4.5.4. Kadar abu ... 30
3.4.6. Persiapan Hewan Uji ... 30
3.4.7. Pemberian Perlakuan ... 31
3.4.8. Pembuatan Preparat ... 31
3.4.9. Pengukuran Parameter Uji ... 31
3.4.9.1. Pengukuran Bobot Testis ... 31
3.4.9.2. Pengukuran Konsentrasi Spermatozoa ... 31
3.4.9.3. Pengukuran Diameter Tubulus Seminiferus ... 33
3.4.9.4. Perhitungan Perbandingan Jumlah Spermatosit PakitenTerhadap Jumlah Sel Sertoli ... 33
xii
BAB 4. HASIL DAN PEMBAHASAN ... 35
4.1. Hasil Penelitian ... 35
4.1.1. Ekstraksi ... 35
4.1.2. Penapisan Fitokimia ... 35
4.1.3. Parameter Standar ... 35
4.1.4. Pengukuran Berat Badan Tikus ... 36
4.1.5. Pengukuran Bobot Testis ... 36
4.1.6. Perhitungan Konsentrasi Spermatozoa ... 38
4.1.7. Pengukuran Diameter Tubulus Seminiferus ... 39
4.1.8. Perhitungan Perbandingan Jumlah Spermatosit Pakiten Terhadap Jumlah Sel Sertoli ... 40
4.2. Pembahasan ... 43
BAB 5. KESIMPULAN DAN SARAN ... 54
5.1.Kesimpulan ... 54
5.2.Saran ... 54
DAFTAR PUSTAKA ... 55
DAFTAR TABEL
Tabel Halaman
2.1. Data Biologis Tikus ... ... 15
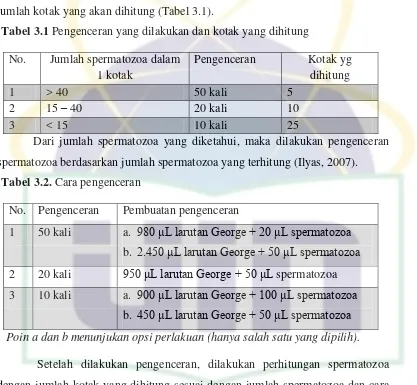
3.1. Pengenceran yang Dilakukan dan Kotak yang Dihitung………... ... 32
3.2. Cara Pengenceran ... ... 32
3.3. Rumus Konsentrasi Spermatozoa... ... 33
4.1. Hasil Penapisan Fitokimia Ekstrak etanol 70 % Biji Jarak Pagar ... 35
4.2. Parameter Standar Simplisia dan Ekstrak ... 35
4.3. Rata-rata Berat Badan Tikus Tiap Kelompok ... 36
4.4. Rata-rata Bobot Testis Tikus ... 37
4.5. Rata-rata Konsentrasi Spermatozoa Tikus ... 38
4.6. Rata-rata Diameter Tubulus Seminiferus ... 39
4.7. Rata-rata Jumlah Spermatosit Pakiten per Jumlah Sel Sertoli ... 40
4.8. Rata-rata Jumlah Spermatosit Pakiten ... 41
xiv
DAFTAR GAMBAR
Gambar Halaman
1. Bunga, buah dan biji Jatropha curcas L ... 8
2. Anatomi sistem reproduksi tikus jantan ... 16
3. Spermatozoa tikus... ... 18
4. Tahapan dari siklus sel spermatogenesis pada tikus ... 20
5. Poros hipotalamus – hipofisis – gonad ... 22
6. Grafik rata-rata berat badan tikus tiap kelompok ... 36
7. Grafik hasil rata-rata bobot testis setelah pemberian ekstrak etanol 70% biji jarak pagar selama 48 hari ... 37
8. Grafik hasil rata-rata konsentrasi spermatozoa (juta/mL) setelah pemberian ekstrak etanol 70% biji jarak pagar selama 48 hari ... 38
9. Grafik hasil rata-rata diameter tubulus seminiferus setelah pemberian ekstrak etanol 70% biji jarak pagar selama 48 hari ... 39
10.Grafik hasil rata-rata perbandingan jumlah spermatosit pakiten terhadap jumlah sel Sertoli setelah pemberian ekstrak etanol 70% biji jarak pagar selama 48 hari ... 40
11.Grafik hasil rata-rata jumlah spermatosit pakiten setelah pemberian ekstrak etanol 70% biji jarak pagar selama 48 hari ... 42
12.Grafik hasil rata-rata jumlah sel Sertoli setelah pemberian ekstrak etanol 70% biji jarak pagar selama 48 hari ... 42
13.Biji jarak pagar ... 65
14.Serbuk simplisia biji jarak pagar ... 65
15.Tikus putih jantan galur Sprague Dawley ... 65
16.Etanol 70% ... 65
17.Ekstrak kental etanol 70% biji jarak pagar... 65
18.Larutan Na CMC 1%... 65
19.Ekstrak yang telah disuspensikan dalam Na CMC 1% ... 65
20.Larutan George ... 65
21.Larutan NaCl fisiologis ... 65
22.Alat pencekok oral ... 65
23.Seperangkat alat bedah ... 65
24.Timbangan berat badan hewan uji (Ohauss) ... 65
25.Vacum rotary evaporator (Eyela) ... 66
26.Oven (Memmert) ... 66
27. Tanur (Thermo Scientific)... 66
28.Timbangan analitik (AND GH-202... 66
29.Freeze dry (Eyela FDU 1200))... 66
30.Mikropipet ukuran 10-20 µL ... 66
31.Mikropipet ukuran 200 µL ... 66
32. Haemositometer Improved Neubeur ... 66
33.Mikroskop optik (Motic BA310) ... 66
34.Penimbangan serbuk simplisia biji jarak pagar ... 67
36.Penyaringan maserat ... 67
42.Penimbangan berat badan hewan uji ... 67
43.Pemberian ekstrak secara oral menggunakan alat pencekok oral ... 67
44.Pembiusan hewan uji ... 67
45.Pembedahan hewan uji ... 67
46.Pengeluran cairan sperma dari kauda epididimis dengan bantuan cairan NaCl ... 68
47.Pencucian organ testis dengan larutan NaCl fisiologis ... 68
48.Epididimis ... 68
49.Organ testis dan epididimis ... 68
50.Penimbangan organ testis ... 68
51.Pengawetan organ testis ... 68
52.Pengambilan cairan spermatozoa ... 68
53.Pengenceran spermatozoa dengan larutan George ... 68
54.Spermatozoa pada kamar haemositometer ... 68
55.Pengamatan spermatozoa di bawah mikroskop dengan perbesaran 400x ... 68
56.Kontrol,tahap II, Perbesaran 400x... 100
57.Kontrol,tahap VII, Perbesaran 400x ... 100
58.Kontrol,tahap XII, Perbesaran 400x ... 100
xvi
DAFTAR LAMPIRAN
Halaman
1. Hasil Determinasi Tanaman ... 63
2. Hasil Penapisan Fitokimia Ekstrak Etanol 70% Biji Jarak Pagar .... 64
3. Gambar Bahan dan Alat Penelitian ... 65
4. Gambar Kegiatan Penelitian Uji Antifertilitas Ekstrak Etanol 70% Biji Jarak Pagar ... 67
5. Pemeriksaan Parameter Ekstrak ... 69
6. Alur penelitian ... 70
7. Perhitungan Dosis Uji Ekstrak Biji Jarak ... 71
8. Berat Badan Tikus Jantan... 72
9. Hasil Pengukuran Bobot Testis ... 74
10.Hasil Perhitungan Konsentrasi Spermatozoa ... 75
11.Hasil Pengukuran Diameter Tubulus Seminiferus ... 76
12.Hasil Perhitungan Jumlah Spermatozoa Pakiten per Jumlah Sel Sertoli ... 77
13.Hasil Perhitungan Jumlah Spermatosit Pakiten ... 78
14.Hasil Perhitungan Jumlah Sel Sertoli ... 79
15.Analisis Data Bobot Testis ... 80
16.Analisis Data Konsentrasi Spermatozoa ... 83
17.Analisis Data Diameter Tubulus Seminiferus ... 86
18.Analisis Data Jumlah Spermatosit Pakiten per Jumlah Sel Sertoli. .. 89
19.Analisis Data Jumlah Spermatosit Pakiten ... 94
20.Analisis Data Jumlah Sel Sertoli ... 97
21.Histologi Tubulus Seminiferus Testis Tikus Kontrol ... 100
22.Histologi Tubulus Seminiferus Testis Tikus Perlakuan Ekstrak Etanol 70% Biji Jarak Pagar (5 mg/kg BB) ... 101
23.Histologi Tubulus Seminiferus Testis Tikus Perlakuan Ekstrak Etanol 70% Biji Jarak Pagar (25 mg/kg BB) ... 102
BAB 1
PENDAHULUAN
1. 1. LATAR BELAKANG
Masalah kependudukan tetap menjadi isu yang sangat penting dan
mendesak, utamanya yang berkaitan dengan aspek pengendalian kuantitas
penduduk, peningkatan kualitas penduduk dan pengarahan mobilitas penduduk,
jika dikaitkan dengan potensi ancaman ledakan penduduk kedepan. Saat ini
penduduk dunia telah mencapai 7 milyar jiwa atau bertambah 1 milyar jiwa
hanya dalam waktu 10 tahun (pada tahun 2000 jumlah penduduk dunia sekitar 6
milyar). Berdasarkan hasil sensus 2010, penduduk Indonesia bertambah 32,5 juta
jiwa, dan rata-rata pertumbuhan 1,49 persen. Apabila laju pertambahan
penduduk masih 1,49 persen seperti sekarang, maka jumlah penduduk Indonesia
pada tahun 2045 menjadi 450 juta jiwa. Hal ini berarti, 1 dari 20 penduduk dunia
adalah orang Indonesia (BKKBN, 2012). Proyeksi tersebut kemungkinan tidak
akan banyak berubah jika pengelolaan program Keluarga Berencana (KB)
dilaksanakan dengan optimal. Namun jumlah tersebut sangat mungkin
meningkat, apabila intensitas dan frekuensi pengelolaan program KB menurun.
Di Indonesia, program pembangunan nasional KB mempunyai arti yang
sangat penting dalam upaya mewujudkan manusia Indonesia sejahtera disamping
program pendidikan dan kesehatan. Peserta KB di Indonesia masih didominasi
oleh perempuan. Pemerintah dengan berbagai sumber daya yang ada telah
berupaya untuk meningkatkan kesertaan pria dalam ber-KB, namun hasilnya
belum seperti yang diharapkan (BKKBN, 2008). Bentuk partisipasi pria dalam
ber-KB adalah menggunakan salah satu cara atau metode pencegahan kehamilan,
seperti kondom, vasektomi, serta KB alamiah yang melibatkan pria/suami
(metode sanggama terputus dan metode pantang berkala) (Bhakti Ekarini, 2008).
Kontrasepsi untuk pria yang dianggap sudah mantap adalah kondom dan
vasektomi. Namun penggunaan kondom sebagai alat kontrasepsi menimbulkan
keluhan psikologik, sedangkan vasektomi walaupun merupakan kontrasepsi yang
yang tidak menginginkan anak lagi, tetapi banyak tidak disukai pria, karena
mereka beranggapan bahwa dengan vasektomi akan menghilangkan keperkasaan
mereka. Oleh karena itu, para pakar berusaha untuk mencarikan cara yang aman
untuk para pria tetapi tidak akan merasa dihilangkan sifat keperkasaannya. Salah
satu cara adalah beralih ke tanaman (Hartini, 2011). Pada beberapa dekade
terakhir ini, banyak penelitian difokuskan kepada perkembangan efektivitas dan
keamanan kontrasepsi pria. Idealnya kontrasepsi pria itu harus memiliki khasiat jangka lama, tetapi bersifat reversibel dalam hal menyebabkan azoospermia
(tidak adanya sperma didalam semen) (BKKBN, 2006).
Untuk saat sekarang masyarakat lebih memilih alternatif menggunakan
obat tradisional karena dianggap relatif lebih murah, efisien dan lebih aman dari
efek samping dibandingkan dengan obat sintetik (Andria, 2012). Hal ini
mengingat bahwa di Indonesia kaya akan sumber daya tanaman obat, sehingga
mempunyai peluang untuk memperoleh kontrasepsi pria yang berasal dari
tanaman.
Di Indonesia, terdapat beberapa jenis tanaman yang telah diteliti efeknya
terhadap organ reproduksi jantan. Beberapa tanaman tersebut adalah ekstrak
metanol batang manggarsih dimana selama 35 hari mampu menyebabkan
penurunan jumlah spermatosit sekunder dan jumlah spermatozoa mencit namun
tidak mampu menyebabkan penurunan berat testis, diameter tubulus seminiferus
testis, jumlah spermatosit primer, dan jumlah spermatid (Ulimaz, 2010). Dari
penelitian Yurnadi dkk (2002) diketahui bahwa penyuntikan ekstrak biji pepaya
selama 20 hari pada berbagai dosis terhadap tikus belum dapat menurunkan
konsentrasi spermatozoa vas deferen, akan tetapi dapat menurunkan populasi sel
spermatogonium A dan spermatosit primer preleptoten. Selain itu, pada tanaman
Momordica charantia L. dengan pemberian selama 20 hari memberikan hasil penurunan pada jumlah spermatozoa dan pada 40 hari memberikan hasil
penurunan jumlah spermatozoa yang lebih banyak. Namun, pada pemberian
Salah satu tanaman tradisional yang diharapkan dapat menjadi
antifertilitas adalah jarak pagar (Jatropha curcas L.). Tanaman jarak pagar memilki nilai pengobatan yang besar. Ekstrak tanaman dapat digunakan untuk
mengobati alergi, luka bakar, peradangan, kusta, leucoderma, kudis dan cacar
(Sachdeva et al., 2012). Penggunaan obat tradisional untuk ekstrak dari biji jarak pagar diantaranya sebagai pencahar, abortivum, antipiretik, antihelmentik, serta
pengobatan gout dan gonorrhea (Barceloux, 2008). Menurut Ejelonu et al., (2010), hasil skrining fitokimia dari biji jarak pagar positif mengandung
terpenoid, alkaloid, cardenolid, dan steroid.
Secara empiris, beberapa negara seperti, Kamboja, Vietnam dan India
telah menggunakan biji jarak sebagai bahan yang dapat menyebabkan aborsi. Di
negara Sudan Selatan, biji jarak juga digunakan sebagai bahan kontrasepsi oral
(Cambie and Brewis, 1999). Penelitian dari Goonasekera et al., (1995) menyatakan bahwa pemberian buah jarak pagar secara oral dengan ekstrak yang
berbeda (metanol, petroleum eter dan diklorometana) pada tikus hamil untuk
beberapa periode waktu menunjukkan sifat aborsi. Berdasarkan hasil survey
berbagai tanaman di India, buah dan biji Jatropha curcas L. menunjukkan aktivitas antifertilitas (Pokharkar et al., 2010). Secara ilmiah, dilaporkan bahwa dengan pemberian ekstrak etanol biji jarak pagar diberikan secara oral
mempunyai aktivitas antifertilitas pada tikus betina (Ahirwar et al., 2010). Di samping itu, buah dari tanaman jarak pagar juga mampu menurunkan motilitas
dan jumlah sperma serta memiliki aktivitas sebagai abortivum (Shweta et al., 2011).
Penelitian tentang tanaman jarak pagar berpotensi sebagai antifertilitas
secara tradisional belum banyak diteliti di Indonesia. Selain itu, penggunaan biji
jarak pagar pada sistem reproduksi pria belum dilaporkan. Oleh karena itu,
penelitian ini adalah untuk menguji aktivitas antifertilitas dari ekstrak etanol 70%
biji jarak pagar (Jatropha curcas L.) pada fungsi reproduksi tikus jantan ditinjau dari konsentrasi sperma, berat testis, ukuran diameter tubulus seminiferus testis,
1. 2. RUMUSAN MASALAH
Berdasarkan uraian dari latar belakang, maka rumusan masalah adalah
sebagai berikut :
1. Sampai saat ini penggunaan kontrasepsi pria masih kondom dan
vasektomi, belum ada antifertilitas yang penggunaannya secara oral.
2. Belum banyak tumbuhan di Indonesia yang diteliti sebagai obat
antifertilitas.
3. Sampai saat ini belum ada penelitian yang membuktikan bahwa biji jarak
pagar (Jatropha curcas L.) mempunyai efek antifertilitas pada tikus jantan.
1. 3. TUJUAN PENELITIAN
Tujuan dari penelitian uji antifertilitas ekstrak etanol 70% biji jarak
pagar (Jatropha curcas L.) pada tikus jantan galur Sprague Dawley secara in vivo
sebagai berikut :
1. Untuk menguji pemberian ekstrak etanol 70% biji jarak pagar (Jatropha curcas L.) terhadap konsentrasi spermatozoa dan bobot testis tikus jantan galur Sprague Dawley secara in vivo.
2. Untuk menguji pemberian ekstrak etanol 70% biji jarak pagar (Jatropha curcas L.) terhadap tahapan spermatogenesis dan diameter tubulus seminiferus pada tikus jantan galur Sprague Dawley secara in vivo.
1. 4. HIPOTESIS
Hipotesis dari penelitian uji antifertilitas ekstrak etanol 70% biji jarak
pagar (Jatropha curcas L.) pada tikus jantan galur Sprague Dawley secara in vivo
sebagai berikut :
1. Pemberian ekstrak etanol 70% biji jarak pagar (Jatropha curcas L.) dapat menurunkan konsentrasi spermatozoa dan bobot testis tikus jantan galur
Sprague Dawley secara in vivo.
2. Pemberian ekstrak etanol 70% biji jarak pagar (Jatropha curcas L.) dapat mengganggu tahapan spermatogenesis dan mempunyai efek terhadap
berkurangnya diameter tubulus seminiferus dan pada tikus jantan galur
1. 5. MANFAAT PENELITIAN
Memberikan informasi kepada masyarakat luas tentang manfaat biji
jarak pagar (Jatropha curcas L.) sebagai obat antispermatogenik dan memberikan informasi yang bermanfaat dalam pengembangan ilmu reproduksi
6 BAB 2
TINJAUAN PUSTAKA
2.1. Jarak Pagar (Jatropha curcas L.) 2.1.1. Sejarah dan Sinonim
Genus Jatropha memiliki 175 spesies, dari jumlah ini lima spesies
tumbuh di Indonesia, yaitu J. curcas L. dan J. gossypiifolia yang sudah digunakan sebagai tanaman obat sedangkan J. integerrima Jacq., J. multifida dan J. podagrica Hook. digunakan sebagai tanaman hias (Heller, 1996).
Tanaman jarak pagar mulai banyak ditanam di Indonesia semenjak masa
penajajahan Jepang. Pada waktu itu, rakyat diperintah oleh pemerintah Jepang
untuk membudidayakan tanaman jarak. Oleh karenanya, dalam waktu singkat
tanaman jarak menyebar cukup luas, khususnya di Jawa Tengah dan Jawa Timur.
Wilayah Jawa Tengah meliputi daerah Semarang serta Solo dan sekitarnya.
Sementara, wilayah Jawa Timur meliputi Madiun, Lamongan, Besuki, dan
Malang. Dalam perkembangan selanjutnya, tanaman jarak meluas sampai di
Kawasan Indonesia Timur, seperti Nusa Tenggara, Sulawesi, dan sebagainya.
Jadi, nama-nama lokal untuk jarak pagar dapat ditemukan di daerah-daerah
(Nurcholis dan Sumarsih, 2007). Meskipun banyak terdapat di Indonesia,
tanaman jarak pagar bukan berasal dari Indonesia. Tanaman ini berasal dari
Meksiko dan Amerika Tengah, tetapi tumbuh di sebagian besar negara tropis.
Tanaman ini tumbuh di Amerika Tengah, Amerika Selatan, Asia Tenggara, India,
dan Afrika (Heller, 1996).
Jatropha berasal dari kata Yunani, iatrós yang berarti medis dan trophé
yang berarti makanan (Bartoli, 2008). Di Indonesia, jarak pagar juga dikenal
dengan nama jarak kosta, jarak paer, atau jarak wolanda. Nama tanaman jarak
pagar dengan daerahnya antara lain: physic nut, purging nut (English);
pourghère, pignon d’Inde (French); purgeernoot (Dutch); Purgiernuß, Brechnuß
(German); purgueira (Portuguese); fagiola d’India (Italian); dand barrî, habel
meluk (Arab);bagbherenda, jangliarandi, safed arand (Hindi); kadam (Nepal);
(Côte d’Ivoire); kpoti (Togo); tabanani (Senegal); mupuluka (Angola); butuje (Nigeria) (Heller, 1996).
2.1.2. Klasifikasi
Tanaman jarak pagar mempunyai nama latin Jatropha curcas L. Dalam sistematika (taksonomi) tumbuhan, kedudukan tanaman jarak pagar
diklasifikasikan sebagai berikut :
Kingdom : Plantae
Subkingdom : Trachebionta (tumbuhan vascular)
Superdivision : Spermatophyta (tumbuhan berbiji)
Division : Magnoliophyta (tumbuhan berbunga)
Class : Magnoliopsida (Dicotyledonae)
Subclass : Rosidae
Order : Euphorbiales
Family : Euphorbiaceae
Genus : Jatropha L.
Species : Jatropha curcas L. (Bartoli, 2008).
2.1.3. Morfologi
Jarak pagar berupa pohon kecil atau perdu. Tanaman ini dapat mencapai
umur 50 tahun. Tinggi tanaman pada kondisi normal adalah 1,5-5 meter.
Percabangannya tidak teratur, bulat dan tebal. Kulit batang berwarna
keabu-abuan atau kemerah-merahan. Apabila ditoreh, batang mengeluarkan getah
seperti latex berwarna putih atau kekuning-kuningan (Nurcholis dan Sumarsih,
2007).
Daun jarak pagar cukup besar, panjang helai 6-16 cm dan lebar 5-15 cm.
Helaian daun berbentuk bulat telur dengan pangkal berbentuk jantung, bersudut
atau berlekuk 3-5 dan tepi daun gundul. Warna daun hijau atau hijau muda.
Bunga jarak pagar mulai muncul saat tanaman mulai berumur 3-4 bulan.
Pembungaan umunya terjadi pada musim kemarau. Walaupun demikian, pada
musim hujan juga dapat berbunga. Bunga terdiri atas bunga jantan dan bunga
bertangkai tebal dan berambut seperti sarang laba-laba. Ukurannya lebih besar
daripada bunga jantan (Nurcholis dan Sumarsih, 2007).
Bjji yang sudah tua berbentuk bulat panjang. Ukuran panjang rata-rata
18 mm (berkisar antara 11-30 mm) dan lebar rata-rata 10 mm (berkisar antara
7-11 mm). Biji jarak bercangkang tipis. Kulit atau cangkang biji yang sudah tua
bagian luar berwarna hitam kotor dan setelah kering penuh retak-retak kecil. Jika
belum tua, warna biji lebih cerah atau kecokelat-cokelatan dengan permukaan
halus. Jika kulit buah telah kering, biji dapat terlepas sendiri dari buah. Biji
matang ditandai dengan perubahan warna kulit buah dari hijau menjadi kuning
(Nurcholis dan Sumarsih, 2007).
Buah jarak pagar banyak dihasilkan pada musim kering pada saat jumlah
daun berkurang karena banyak yang kering atau gugur. Sekitar 2-3 bulan setelah
pemupukan, pada umumnya tanaman dewasa sudah berbuah. Buah tersusun
dalam tandan buah. Setiap tandan berisi 10 buah atau lebih. Bentuk buah
membulat, berukuran panjang 2-3 cm. Permukaan buah rata (halus). Apabila
buah mengering dan kemudian pecah menurut ruang, dalam setiap buah terdapat
3 biji (Nurcholis dan Sumarsih, 2007).
2.1.4. Kandungan Bahan Aktif
Kandungan kimia dalam biji jarak pagar adalah senyawa seperti
flavonoid, viteksin, isoviteksin (Aregheore et al., 2003), beta-sitosterol, Jatropha
factor C-1, Jatropha factor C-2, dan curcin (Mastiholimath, 2008). Terdapat juga beberapa senyawa yang terkandung dalam biji jarak seperti saponin, tripsin
inhibitor, amilase inhibitor (Punsuvona et al., 2012).
Setiap 100 g biji mengandung 6,6 g H2O, 18,2 g protein, 3,8 g lemak,
33,5 g total karbohidrat, 15,15 g serat dan 4,5 g abu. Biji dilaporkan juga
mengandung glukosa, fruktosa, galaktosa, asam oleat, asam linoleat, asam
miristat, asam palmitat, asam stearat, protein, minyak, dan curcin (Mahmud,
2007). Senyawa toksik dalam biji jarak pagar adalah lektin dan phorbolester.
Senyawa lektin maupun phorbolester dapat terdegradasi sehingga toksisitasnya
berkurang bahkan hilang, yaitu dengan pemanasan dan dengan reaksi kimia
(Muliani, 2011).
2.1.5. Kegunaan
Olahan dari semua bagian tanaman termasuk biji, daun dan kulit kayu,
segar atau sebagai rebusan digunakan dalam pengobatan tradisional. Minyak dari
biji memiliki tindakan pencahar yang kuat dan juga banyak digunakan untuk
penyakit kulit dan untuk meredakan rasa sakit seperti yang disebabkan oleh
rematik. Getah yang keluar dari batang digunakan untuk menghentikan
pendarahan dari luka. Rebusan dari daun digunakan untuk batuk dan sebagai
antiseptik setelah kelahiran (Heller, 1996). Lateks memiliki sifat antibiotik
terhadap beberapa bakteri ; diterapkan langsung pada luka dan dapat digunakan
sebagai antiseptik seperti pada ruam, luka bakar, dan infeksi kulit (Bartoli, 2008).
Dengan menggunakan ekstrak dari biji jarak pagar dapat mengobati
penyakit seperti hernia, kanker, gonorhoea. Hal ini yang pernah dicoba oleh
penduduk di Colombia untuk mengobati penyakit kelamin. Di Mesir, biji
digunakan untuk pengobatan arthritis, gout dan jaundice. Biji tanaman ini juga
telah digunakan secara tradisional untuk pengobatan banyak penyakit termasuk
sebagai agensia aborsi, sedangkan di Sudan telah menggunakan biji jarak sebagai
agensia kontrasepsi (Cambie and Brewis, 1999).
2.2. Simplisia dan Ekstrak 2.2.1. Simplisia
Simplisia tumbuhan obat merupakan bahan baku proses pembuatan
ekstrak, baik sebagai bahan obat atau produk. Dalam buku Materia Medika
lndonesia ditetapkan definisi bahwa simplisia adalah bahan alamiah yang
dipergunakan sebagai obat yang belum mengalami pengolahan apapun juga dan
kecuali dikatakan lain, berupa bahan yang telah dikeringkan (Depkes RI, 2000).
Simplisia dibedakan simplisia nabati, simplisia hewani, dan simplisia
pelikan (mineral). Simplisia nabati adalah simplisia yang berupa tumbuhan utuh,
bagian tumbuhan atau eksudat tumbuhan. Eksudat tumbuhan ialah isi sel yang
secara spontan keluar dari tumbuhan atau isi sel yang dengan cara tertentu
dikeluarkan dari selnya atau senyawa nabati lainnya yang dengan cara tertentu
dipisahkan dari tumbuhannya dan belum berupa senyawa kimia murni (Depkes
RI, 2000).
2.2.2. Ekstrak
Ekstrak adalah sediaan kental yang diperoleh dengan mengekstraksi
senyawa aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut
yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa
atau serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang
telah ditetapkan (Depkes RI, 2000).
Ada beberapa jenis ekstrak yakni : ekstrak cair, ekstrak kental dan
ekstrak kering. Ekstrak cair adalah sediaan dari simplisia nabati yang
mengandung etanol sebagai pelarut atau sebagai pengawet. Jika tidak dinyatakan
lain pada masing-masing monografi tiap mL ekstrak mengandung senyawa aktif
dari 1 g simplisia yang memenuhi syarat. Ekstrak cair jika hasil ekstraksi masih
bisa dituang biasanya kadar air lebih 30%. Ekstrak kental jika memilki kadar air
antara 5-30%. Ekstrak kering jika mengandung kadar air kurang dari 5%
2.3. Ekstraksi 2.3.1. Cara dingin 2.3.1.1. Maserasi
Maserasi adalah proses pengekstrakan simplisia dengan menggunakan
pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur
ruangan (kamar). Secara teknologi termasuk ekstraksi dengan prinsip metode
pencapaian konsentrasi pada keseimbangan. Maserasi kinetik berarti dilakukan
pengadukan yang kontinu (terus-menerus). Remaserasi berarti dilakukan
pengulangan penambahan pelarut setelah dilakukan penyaringan rnaserat
pertama, dan seterusnya (Depkes RI, 2000).
2.3.1.2. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai
sempurna (exhaustive extraction) yang umumnya dilakukan pada temperatur ruangan. Proses terdiri dari tahapan pengernbangan bahan, tahap maserasi antara,
tahap perkolasi sebenarnya (penetesan/penampungan ekstrak), terus menerus
sampai diperoreh ekstrak (perkolat) yang jumlahnya 1- 5 kali bahan (Depkes RI,
2000).
2.3.2 Cara panas 2.3.2.1. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik
didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan
dengan adanya pendingin balik. Umumnya dilakukan pengulangan proses pada
residu pertama sampai 3-5 kali sehingga dapat termasuk proses ekstraksi
sempurna (Depkes RI, 2000).
2.3.2.2. Soxhlet
Soxhlet adalah ekstraksi menggunakan pelarut yang selalu baru yang
umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan
2.3.2.3. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur ruangan (kamar), yaitu secara umum
dilakukan pada temperatur 40-50oC (Depkes RI, 2000).
2.3.2.4. Infus
lnfus adalah ekstraksi dengan pelarut air pada temperatur penangas air
(bejana infus tercelup dalam penangas air mendidih, temperatur terukur 96-980C)
selama waktu tertentu (15 - 20 menit) (Depkes RI, 2000).
2.3.2.5. Dekok
Dekok adalah infus pada waktu yang lebih lama (>300C) dan
temperatur sampai titik didih air (Depkes RI, 2000).
2.3.3. Destilasi uap
Destilasi uap adalah ekstraksi senyawa kandungan menguap (minyak
atisiri) dari bahan (segar atau simplisia) dengan uap air berdasarkan peristiwa
tekanan parsial senyawa kandungan menguap dengan fase uap air darl ketel
secara kontinu sampai sempurna diakhiri dengan kondensasi fase uap campuran
(senyawa kandungan menguap ikut terdestilasi) menjadi destilat air bersama
senyawa kandungan yang memisah sempurna atau memisah sebagian (Depkes
RI, 2000).
Destilasi uap, bahan (simplisia) benar-benar tidak tercelup ke air yang
mendidih, namun dilewati uap air sehingga senyawa kandungan menguap ikut
terdestilasi. Destilasi uap dan air, bahan (simplisia) bercampur sempurna atau
sebagian dengan air mendidih, senyawa kandungan menguap tetap kontinu ikut
terdestilasi (Depkes RI, 2000).
2.3.4. Cara ekstraksi lainnya
2.3.4.1. Ekstraksi berkesinambungan
Proses ekstraksi yang dilakukan berulang kali dengan pelarut yang
berbeda atau resirkulasi cairan pelarut dan prosesnya tersusun berturutan
dan dirancang untuk bahan dalam jumlah besar yang terbagi dalam beberapa
bejana ekstraksi (Depkes RI, 2000).
2.3.4.2. Super kritikal karbondioksida
Penggunaan prinsip superkritik untuk ekstraksi serbuk simplisia, dan
umumnya digunakan gas karbondioksida. Dengan variabel tekanan dan
temperatur akan diperoleh spesifikasi kondisi polaritas tertentu yang sesuai untuk
melarutkan golongan senyawa kandungan tertentu. Penghilangan cairan pelarut
dengan mudah dilakukan karena karbondioksida menguap dengan mudah
sehingga hampir langsung diperoleh ekstrak (Depkes RI, 2000).
2.3.4.3. Ekstraksi Ultrasonik
Getaran ultrasonik (>20.000 Hz) memberikan efek pada proses
ekstrak dengan prinsip rneningkatkan permiabilitas dinding sel, menimbulkan
gelembung spontan sebagai stres dinamik serta menimbulkan fraksi interfase.
Hasil ekstraksi tergantung pada frekuensi getaran, kapasitas alat dan lama proses
ultrasonikasi (Depkes RI, 2000).
2.3.4.4. Ekstraksi energi listrik
Energi listrik digunakan dalam bentuk medan listrik, medan magnet
serta "electric-discharges" yang dapat mempercepat proses dan meningkatkan hasil dengan prinsip menimbulkan gelembung spontan dan menyebarkan
gelombang tekanan berkecepatan ultrasonik (Depkes RI, 2000).
2.4. Tinjauan Hewan Percobaan
2.4.1. Klasifikasi Tikus Putih (Rattus norvegicus)
Menurut Krinke (2000), klasifikasi tikus putih (Rattus norvegicus) adalah sebagai berikut:
Kingdom : Animalia
Phylum : Chordata
Subphylum : Vertebrata
Class : Mammalia
Order : Rodentia
Genus : Rattus
Species : norvegicus
2.4.2. Biologis Tikus Putih (Rattus norvegicus)
Hewan laboratorium atau hewan percobaan adalah hewan yang sengaja
dipelihara dan diternakkan untuk dipakai sebagai hewan model guna mempelajari
dan mengembangkan berbagai macam bidang ilmu dalam skala penelitian atau
pangamatan laboratorik. Tikus termasuk hewan mamalia, oleh sebab itu
dampaknya terhadap suatu perlakuan mungkin tidak jauh berbeda dibanding
dengan mamalia lainnya. Selain itu, penggunaan tikus sebagai hewan percobaan
juga didasarkan atas pertimbangan ekonomis dan kemampuan hidup tikus hanya
2-3 tahun dengan lama produksi 1 tahun (Smith dan Mangkoewidjojo, 1988).
Kelompok tikus laboratorium pertama-tama dikembangkan di Amerika
Serikat antara tahun 1877 dan 1893. Keunggulan tikus putih dibandingkan tikus
liar antara lain lebih cepat dewasa, tidak memperlihatkan perkawinan musiman,
dan umumnya lebih cepat berkembang biak. Kelebihan lainnya sebagai hewan
laboratorium adalah sangat mudah ditangani, dapat ditinggal sendirian dalam
kandang asal dapat mendengar suara tikus lain dan berukuran cukup besar
sehingga memudahkan pengamatan. Secara umum, berat badan tikus
laboratorium lebih ringan dibandingkan berat badan tikus liar. Biasanya pada
umur empat minggu beratnya 35-40 g, dan berat dewasa rata-rata 200-250 g,
tetapi bervariasi tergantung pada galur. Galur Sprague Dawley merupakan galur yang paling besar diantara galur yang lain (Smith dan Mangkoewidjojo, 1988).
Terdapat beberapa galur tikus yang sering digunakan dalam penelitian.
Galur-galur tersebut antara lain : Wistar, Sprague-Dawley, Long Evans, dan Holdzman. Dalam penelitian ini digunakan galur Sprague-Dawley dengan ciri-ciri berwarna putih, berkepala kecil dan ekornya lebih panjang daripada
badannya (Smith dan Mangkoewidjojo 1988). Tikus ini pertama kali diproduksi
oleh peternakan Sprague Dawley. Tikus Sprague Dawley merupakan jenis outbred tikus albino serbaguna secara ekstensif dalam riset medis. Keuntungan
utamanya adalah ketenangan dan kemudahan penanganannya. Adapun data
Tabel 2.1. Data biologis tikus (Smith dan Mangkoewidjojo, 1988).
2.5. Sistem Reproduksi Tikus Jantan
Sistem reproduksi tikus jantan terdiri atas testis dan skrotum, epididimis,
duktus deferens, kelenjar aksesori (kelenjar vesikulosa, prostat dan
bulbouretralis), uretra dan penis. Selain uretra dan penis, semua struktur ini
berpasangan. Duktus yang menjadi testis, duktuli eferentes bersama duktus Lama hidup 2-3 tahun, dapat sampai 4 tahun
Lama produksi ekonomis 1 tahun
Lama bunting 20-22 hari
Umur dewasa 40-60 hari
Umur dikawinkan 10 minggu (jantan dan betina)
Siklus kelamin Poliestrus
Siklus estrus (berahi) 4-5 hari
Lama estrus 9-20 jam
Perkawinan Pada waktu estrus
Ovulasi 8- 11 jam sesudah timbul estrus, spontan
Fertilisasi 7-10 jam sesudah kawin
Implantasi 5-6 hari sesudah fertilisasi Berat dewasa 300-400 g jantan; 250-300 g betina Suhu (rektal) 36-39oC (rata-rata 37,5oC)
Pernapasan 65-115/menit, turun menjadi 50 dengan anestesi, naik sampai 150 dalam stress Denyut jantung 330-480/menit, turun menjadi 250 dengan
anestesi, naik sampai 550 dalam stress Tekanan Darah 90-180 sistol, 60-145 diastol, turun menjadi
80 sistol, 55 diastol dengan anestesi
Konsumsi oksigen 1,29-2,68 mL/g/jam
Sel darah merah 7,2-9,6 x 106/mm3
epididimis, suatu duktus konvolusi bergelung untuk membuat epididimis, suatu
organ yang terletak pada permukaan posterior testis (Fawcett, 2002).
Dari epididimis, duktus deferen yang lurus panjang naik dari skrotum
dan melalui aknalis inguinalis masuk ke dalam pelvis, tempat duktus ini berlanjut
dengan duktus ejakulatorius, suatu segmen terminal dari system duktus yang membuka ke arah uretra prostatic. Berhubungan dengan sistem duktus adalah
tiga kelenjar asesorius, vesikula seminalis, prostat, dan kelenjar bulboureta. Spermatozoa dari epididimis, bersama dengan hasil sekretorius kelenjar ini,
merupakan semen yang dikeluarkan melalui uretra penis (Fawcett, 2002).
Gambar 2. Anatomi sistem reproduksi tikus jantan (Suckow, 2006).
Pada hewan yang melakukan fertilisasi secara interna organ
reproduksinya dilengkapi dengan adanya organ kopulatori, yaitu suatu organ
yang berfungsi menyalurkan spermatozoa dari organisme jantan ke betina.
Peranan hewan jantan dalam hal reproduksi terutama adalah memproduksi
spermatozoa dan sejumlah kecil cairan untuk memungkinkan sel spermatozoa
masuk menuju rahim (William, 2005).
Ketiga kelenjar asesorius mensekresi zat-zat makanan bagi spermatozoa.
kantung kemih. Dinding vesikula seminalis menghasilkan zat makanan yang
merupakan sumber makanan bagi sperma. Kelenjar Cowper (kelenjar bulbouretra) merupakan kelenjar yang salurannya langsung menuju urethra.
Kelenjar Cowper menghasilkan getah yang bersifat alkali (basa). Prostat terletak di pelvis, tepatnya di posterior dan inferior vesika urinaria dekat dengan rektum.
Fungsi dari kelenjar prostat adalah memproduksi cairan prostat yang
mengandung kolesterol, garam dan fosfolipid yang merupakan komponen utama
dari semen yang bersifat basa (William, 2005).
Testis memiliki dua fungsi, yaitu sebagai tempat spermatogenesis dan
produksi andogen. Oleh sebab itu, maka testis dapat juga dikatakan sebagai
kelenjar ganda karena secara fungsional bersifat endokrin dan juga eksokrin.
Fungsi endokrin terletak pada sel Leydig yang menghasilkan androgen, terutama
testosteron. Fungsi eksokrin terletak pada epitelium seminiferus yang
menghasilkan spermatozoa (Fawcett, 2002).
Spermatogenesis terjadi di dalam suatu struktur yang disebut tubulus
seminiferus. Tubulus ini berlekuk-lekuk dalam lobul yang semua duktusnya
kemudian meninggalkan testis dan masuk ke dalam epididimis. Produksi
androgen terjadi di dalam kantung dari sel khusus yang terdapat di daerah
interstitial antara tubulus. Tubulus seminferus dilapisi oleh epitelium bertingkat
yang sangat kompleks yang mengandung sel spermatogenik dan sel-sel yang
menunjang. Sel-sel penunjang berjenis tunggal disebut dengan sel Sertoli
(Heffner & Schust, 2005).
Tubulus seminiferus di kelilingi oleh membran basal. Di dekat membran
basal ini terdapat sel progenitor untuk produksi spermatozoa. Epitel yang
mengandung spermatozoa yang sedang berkembang di sepanjang tubulus disebut
epitel seminiferus atau epitel germinal. Pada potongan melintang testis,
spermatosit dalam tubulus berada dalam berbagai tahap pematangan. Di antara
spermatosit terdapat sel Sertoli. Sel ini berperan secara metabolik dan struktural
untuk menjaga spermatozoa yang sedang berkembang. Sel Sertoli memfagosit
sitoplasma spermatid yang telah dikeluarkan. Sel ini merupakan satu-satunya sel
membran basal pada satu kutubnya dan mengelilingi spermatozoa yang sedang
berkembang pada kutub yang lain. Sel Sertoli memilki jari-jari sitoplasma yang
besar dan kompleks yang dapat mengelilingi banyak spermatozoa dalam satu
waktu (Heffner & Schust, 2005).
Sel ini juga berfungsi pada proses aromatisasi prekursor androgen
menjadi estrogen, suatu produk yang menghasilkan pengaturan umpan balik lokal
pada sel Leydig yang memproduksi androgen. Selain itu, sel Sertoli juga
menghasilkan protein pengikat androgen. Produksi androgen sendiri terjadi di
dalam kantong dari sel khusus (sel Leydig) yang terdapat di daerah interstitial
antara tubulus-tubulus seminiferus (Heffner & Schust, 2005).
2.5.1. Produksi Sperma
Produksi sperma tiap hari per testis pada tikus adalah 35,4 x 106/mL,
tidak berbeda signifikan dengan manusia yakni sebesar 45,5 x 106/mL. Tubulus
seminiferus tikus lebih tebal dari manusia yakni 347 + 5 µm vs 262 + 9 µm ,
tetapi pembatas tubulus pada tikus lebih jauh tipis dibanding manusia (1,4 + 1
µm vs 15,9 + 3,4 µm). Epitel seminiferus tikus mengandung 40% lebih sel
spermatogenik dari volumenya, dua kali lebih banyak dari epitel seminiferus
manusia (Ilyas, 2007).
Spermatozoa pada tikus lebih panjang dibandingkan dengan spesies
mamalia lainnya, termasuk manusia dan hewan domestik lainnya. Kepala sperma
pada tikus berbentuk kail hal ini sama seperti pada hewan pengerat lainnya
(Krinke, 2000).
2.5.2. Spermatogenesis Pada Tikus
Dasar pengetahuan yang cukup telah dibangun tentang spermatogenesis
pada tikus. Sel primodial germinal yang telah berhenti bermigrasi diliputi oleh sel
Sertoli dan membran basal yang menonjol dalam tubulus seminiferus pada alat
kelamin tikus jantan. Sel kelamin jantan tetap tidak aktif sampai sebelum masa
pubertas, yaitu dimana sekitar 50 hari setelah kelahiran. Pada tahap itu mereka
mulai membelah dan menjadi spermatogonium, dan kemudian terus membelah
sampai hewan kehilangan kemampuan untuk memproduksi spermatozoa (Krinke,
2000).
Sel-sel spermatogenik berkembang dalam tubulus seminiferus testis
melalui suatu perkembangan yang komplek yang disebut dengan
spermatogenesis. Spermatogenesis memerlukan suatu seri komplek dimana
spermatozoa dihasilkan melalui tahap mitosis, meiosis, dan diferensiasi sel untuk
menjadi spermatozoa matang. Perubahan morfologi dari spermatid menjadi
spermatozoa disebut dengan spermiogenesis. Selanjutnya spermatozoa
dilepaskan ke dalam lumen tubulus. Proses pelepasan tersebut dikenal dengan
proses spermiasi (Ilyas, 2007).
Spermatogonium secara garis besar diklasifikasikan ke dalam tiga jenis:
tipe A, tipe intermediet dan tipe B. Tipe spermatogonia A ini dibagi lagi menjadi tipe AO (disebut juga sel induk) dan tipe Al-A4. Tipe spermatogonium AO tetap
pada membran basal di tubulus seminiferus dan memiliki kemampuan untuk
membelah menjadi dua sel anak, salah satunya menjadi spermatogonium A1,
yang seterusnya lebih lanjut dalam proses spermatogenesis, sedangkan yang
lainnya sebagai sel induk. Pada tikus, spermatogonium A1 kemudian memiliki
enam pembelahan mitosis, dan kemudian mereka menjadi spermatosit
preleptotene. Kemudian spermatosit dalam fase meiosis, di mana berkembang menjadi leptotene, zygotene dan pakiten untuk menjadi spermatosit sekunder di komponen adluminal dari sel Sertoli dalam tubulus seminiferus. Selama fase
meiosis, setiap spermatosit membelah menjadi empat spermatid haploid, yang
kemudian menjadi: spermatid fase golgi (1 – 3), terdapatnya granul akrosom;
menutupi 1/3 bagian nukleus; fase akrosom (8 – 14), nukleus dan head cap
memanjang; fase maturasi (15 – 18) nukleusnya menjadi lebih pendek dan
sitoplasma terkondensasi di sepanjang ekor yang telah mulai memanjang; hingga
dihasilkannya spermatozoa (19) yang dilepaskan ke lumen dengan ekor
menghadap ke lumen (Krinke, 2000).
Gambar 4. Tahapan dari siklus sel spermatogenesis pada tikus, dimulai dari kiri bawah searah jarum jam. A, tipe spermatogonium A; In , spermatogonium tipe intermediet; B, tipe spermatogonium B; R, spermatosit primer resting; L, spermatosit leptotene; Z, spermatosit zygotene; P(I), P(VII), P (XII), spermatosit pachytene awal, pertengahan dan akhir. Angka romawi menunjukkan tahap di mana mereka ditemukan; Di, diplotene; II, spermatosit sekunder; 1-19, tahap spermiogenesis.Tabel di tengah memberikan komposisi sellular dari tahapan siklus pada epitel seminiferus (l-XIV). M superscript
Dari gambar diatas terlihat pada stage II tampak spermatid yang telah berekor yaitu spermatid yang telah mengalami maturasi. Sedangkan spermatozoa
hanya ditemukan pada stage VII dan pada stage XII tidak ditemukannya lagi spermatid yang matur (tidak berekor).
Pada tikus, 14 tahapan siklus spermatogenesis terjadi di dalam tubulus
seminiferus. Tubulus memiliki susunan ruas, dan setiap potongan melintang
tubulus menunjukkan tahapan yang seragam yang melibatkan empat atau lima
generasi di sel germinal dengan sesuai. Tubulus seminiferus di tikus
dikarakterisasi oleh struktur ruas, sedangkan pada manusia dan hewan domestik
lainnya biasanya menunjukkan pola mosaik di beberapa tahap. Pada tikus,
dibutuhkan 12 hari untuk menyelesaikan satu siklus yang terdiri dari 14 tahap.
Spermatogonium tikus membutuhkan empat siklus sampai akhirnya membentuk
spermatozoa, sehingga diperlukan 48 hari untuk menyelesaikan seluruh tahap
spermatogenesis (Krinke, 2000).
2.5.3. Peran Hormon Pada Spermatogenesis
Proses spermatogenesis dipengaruhi oleh hormon-hormon yang
dihasilkan oleh organ hipotalamus, hipofisis dan testis sendiri. Testis
memproduksi sejumlah hormon jantan yang kesemuanya disebut androgen. Yang
paling poten dari androgen adalah testosteron. Fungsi testosteron adalah
merangsang pendewasaan spermatozoa yang terbentuk dalam tubulus
seminiferus, merangsang pertumbuhan kelenjar-kelenjar asesori dan merangsang
pertumbuhan sifat jantan (Partodihardjo, 1980).
Spermatogenesis dan pematangan sperma sewaktu bergerak di sepanjang
epididimis dan vas deferens memerlukan androgen. Androgen juga mengontrol
pertumbuhan dan fungsi vesikula seminalis serta kelenjar prostat.
Spermatogenesis hampir seluruhnya terjadi dibawah pengaruh hormon-hormon
yang berasal dari hipofisa, terutama FSH. Hal ini mirip dengan apa yang terjadi
pada ovarium, dimana terjadi pembentukan folikel di bawah pengaruh FSH.
Spermiogenesis adalah lanjutan spermatogenesis yang berlangsung di bawah
peranan LH dan testosteron. Tanpa testosteron spermatozoa tidak dapat mencapai
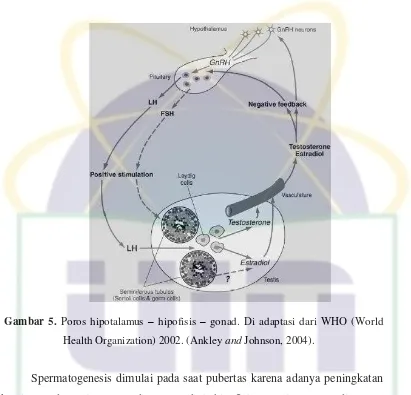
Gambar 5. Poros hipotalamus – hipofisis – gonad. Di adaptasi dari WHO (World
Health Organization) 2002. (Ankley and Johnson, 2004).
Spermatogenesis dimulai pada saat pubertas karena adanya peningkatan
sekresi gonadotropin (FSH dan LH) dari hipofisis anterior. FSH dianggap
hormon penting untuk induksi spermatogenesis dan merangsang secara langsung
pada tubulus seminiferus, karena spermatogenesis lengkap pada tikus
hypophysectomise dipulihkan oleh pemberian FSH dalam kombinasi dengan LH dan testosteron. Di sisi lain, efek spermatogenesis dari LH, kadang-kadang
disebut Interstitial Cell Stimulating Hormone (ICSH) pada pria, karena tindakan androgenik pada sel-sel Leydig di interstitial, dianggap dimediasi oleh androgen,
setidaknya pada tikus. Dalam konteks ini, sekresi LH juga merangsang sintesis
testosteron di sel Leydig pada testis (Krinke, 2000).
Aksi FSH pada spermatogenesis mungkin dimediasi oleh sel Sertoli,
karena hormon peptida tidak dapat secara langsung mencapai spermatosit dan
spermatid melintasi sawar darah testis, yang terbentuk selama 16 - 19 hari setelah
kelahiran. Sebaliknya, testosteron dapat dengan mudah melewati sawar darah
dilaporkan bahwa tingkat testosteron pada tikus dewasa di dalam cairan
interstisial (lebih dari 50 ng/mL) jauh lebih tinggi dibanding pada testis (sekitar
30ng/mL) maupun cairan vena perifer (kurang dari 10 ng/mL), menunjukkan aksi
parakrin atau autokrin dari testosteron pada spermatogenesis di testis. Adanya
reseptor androgen pada sel germinal masih kontroversial, sementara ini reseptor
tersebut telah ditemukan dalam sel Leydig, sel peritubular, sel Sertoli dan lapisan
otot pembuluh darah pada sebagian arteri dalam testis tikus (Krinke, 2000).
Salah satu peran untuk sel Sertoli adalah produksi androgen yang
mengikat protein, dimana dirangsang oleh FSH dan testosteron. Ini juga telah
menunjukkan bahwa terdapat beberapa faktor yang tidak diketahui yang
dikeluarkan dari sel Sertoli, sebagai respon untuk merangsang FSH dan
24 BAB 3
METODE PENELITIAN
3.1. Tempat dan Waktu Penelitian
Penelitian ini berlangsung dalam waktu 6 bulan, terhitung dari bulan Mei
2012 sampai dengan Oktober 2012. Penelitian ini dilakukan di Laboratorium
Product Natural Analysis dan di Laboratorium Farmakologi, Fakultas
Kedokteran dan Ilmu Kesehatan, UIN Syarif Hidayatullah Jakarta.
3.2. Alat dan Bahan 3.2.1. Hewan Uji
Hewan uji yang akan digunakan dalam penelitian ini adalah tikus putih
jantan galur Sprague-Dawley, sehat, fertil, berumur 9 minggu dengan berat 250-350 gram yang diperoleh dari Badan Pengawasan Obat Makanan.
3.2.2. Bahan Uji
Bahan uji yang akan digunakan adalah biji dari tanaman jarak pagar
(Jatropha curcas L.) diperoleh dari Kebun Induk Jarak Pagar Balitri Sukabumi. Sebelum dilakukan penelitian, tanaman di determinasi terlebih dahulu di
Herbarium Bogoriense Bidang Botani Pusat Penelitian Biologi-LIPI Bogor.
3.2.3. Bahan Kimia
Bahan-bahan yang dipergunakan dalam penelitian ini adalah pakan tikus
berupa pellet, aquades, larutan NaCl fisiologis, Na CMC, alkohol 70%, 80%, dan
96% , etanol 70% dan 95%, ammoniak 1 % dan 25 %, larutan HCl, kloroform,
pereaksi Dragendroff, pereaksi Mayer, serbuk Mg, amil alkohol, larutan NaOH, FeCl3, eter, petroleum eter, larutan Hematoksilin, larutan Bouin (asam pikrat,
formaldehid 4%, asam asetat), larutan xilol, larutan Eosin, larutan George,
paraffin.
3.2.4. Alat
Alat yang digunakan dalam penelitian ini meliputi : labu erlenmeyer,
gelas ukur, ayakan mesh 40, timbangan analitik (AND GH-202), mortir, tabung
perangkat rotary evaporator vacuum (Eyela), oven (Memmert), tanur (Thermo Scientific), freeze dry (Eyela FD 1200), botol sampel, kandang hewan, tempat makan dan minum tikus, timbangan hewan (Ohauss), alat pencekok oral (sonde), beaker glass, obyek glass, kertas saring, Hemositometer Improved Neubeur, pipet tetes, mikro pipet (Eppendorf Research plus), seperangkat alat bedah, dan
mikroskop optik (Motic BA310).
3.3. Rancangan Penelitian
Penelitian ini merupakan eksperimen murni dengan rancangan penelitian
yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan beberapa
kondisi perlakuan.
Perlakuan di kelompokkan menjadi 4 kelompok dengan masing-masing
terdiri dari 5 ekor tikus putih jantan strain Sprague Dawley (WHO, 2000). Perlakuan yang digunakan adalah kontrol (tanpa perlakuan) dan tikus yang diberi
ekstrak biji jarak pagar (Jatropha curcas L.) dengan 3 dosis yang berbeda. Acuan dosis yang digunakan berdasarkan penelitian yang dilakukan oleh Ahirwar et al., (2010). Perhitungan dosis dapat dilihat pada lampiran 7. Perlakuan yang
digunakan terdiri dari:
1. Kelompok I : Kelompok pembanding tanpa perlakuan sebanyak 5 ekor tikus
diberi pembawa (Na CMC 1%) sebanyak 1 mL serta makan dan minum.
2. Kelompok II : Kelompok perlakuan sebanyak 5 ekor tikus yang diberi
suspensi ekstrak biji jarak pagar (Jatropha curcas L.) dengan dosis rendah yaitu 5 mg/kg BB, makan dan minum.
3. Kelompok III : Kelompok perlakuan sebanyak 5 ekor tikus yang diberi
suspensi ekstrak jarak pagar (Jatropha curcas L.) dengan dosis sedang yaitu 25 mg/kg BB, makan dan minum.
4. Kelompok IV : Kelompok perlakuan sebanyak 5 ekor tikus yang diberi
3.4. Kegiatan Penelitian
3.4.1. Pemeriksaan Simplisia (Determinasi)
Sebelum dilakukan penelitian, biji jarak pagar terlebih dahulu di
determinasi di Herbarium Bogoriense Bidang Botani Pusat Penelitian
Biologi-LIPI Bogor untuk memastikan kebenaran simplisia.
3.4.2. Penyiapan Simplisia
Biji jarak pagar yang telah dikeringkan dengan kadar air sebesar 8,15 %
diperoleh dari Kebun Induk Jarak Pagar Balitri Sukabumi. Sebanyak 1,5 kg biji
jarak pagar yang telah dikeringkan kemudian dirajang atau diblender. Kemudian
dilakukan pengayakan dengan menggunakan ayakan mesh 40 sehingga
dihasilkan serbuk simplisia sebanyak 674 gram. Serbuk simplisia disimpan
dalam wadah yang kering, tertutup rapat dan terlindung dari cahaya.
3.4.3. Pembuatan Ekstrak
Pada pembuatan ekstrak biji jarak pagar digunakan metode ekstraksi cara
dingin dengan maserasi dan menggunakan etanol 70% sebagai pelarut.
Serbuk simplisa sebanyak 674 gram ditimbang kemudian dimaserasi
dengan pelarut etanol 70% hingga sampel terendam. Pelarut diganti setiap 3 hari
sekali. Jumlah pelarut etanol 70% yang digunakan sebanyak 5400 mL. Hasil
maserasi disaring sehingga diperoleh filtrat. Proses maserasi ini diulang hingga
dihasilkan maserat yang berwarna pucat (lebih bening daripada maserat awal).
Total maserat yang diperoleh yaitu sebanyak 4350 mL, kemudian dipekatkan
dengan menggunakan rotary evaporator sampai diperoleh ekstrak sebanyak 128,8437 gram.
Namun, ekstrak yang dihasilkan belum cukup kental sehingga ekstrak
kemudian di freeze dry hingga dihasilkan ekstrak yang lebih kental sebanyak 46,6285 gram. Ekstrak yang dihasilkan selanjutnya disimpan dan digunakan
3.4.4. Penapisan Fitokimia
Pada penapisan fitokimia dilakukan pemeriksaan terhadap kandungan
golongan senyawa kimia dari ekstrak etanol 70% biji jarak pagar seperti alkaloid,
flavonoid, saponin, tanin, dan steroid/terpenoid.
1. Identifikasi Golongan Alkaloid
Metoda Culvernor-Fitzgerald
Gerus 2-4 g material tumbuhan yang telah bersih potong-potong masukan
kedalam mortar dan tambahkan kloroform secukupnya dan pasir bersih,
kemudian digerus. Tambahkan 10 mL kloroform amoniakal diaduk rata.
Campuran disaring kedalam tabung reaksi dengan cara memerasnya pakai kain
kasa untuk memindahkan ekstrak. Kemudian tambahkan 0.5 mL I M asam sulfat
dan kocok baik-baik, biarkan beberapa saat. Pipet lapisan atas yang jemih
kedalam 2 tabung reaksi kecil. Salah satunya diberikan pereaksi Dragendorff"s
dan tabung lainnya pereaksi Mayer's (2-3 tetes). Reaksi positif apabila menunjukkan endapan kuning jingga (orange) dengan pereaksi Drogendorff's
dan endapan putih dengan pereaksi Mayer's. Catatan hasil sebagai berikut: (+) sedikit keruh
(++) sangat keruh
(+++) terjadi endapan (Chairul, 2003).
2. Identifikasi Golongan Flavonoid
Ekstrak lebih kurang 10 g material tumbuhan dengan etanol 80 %, saring dan
keringkan diatas penangas air. Kemudian lemaknya dihilangkan dengan
pencucian heksana beberapa kali sehingga warna pigmen hilang atau larutan
heksana tidak berwarna lagi. Panaskan residu yang bebas lemak diatas penangas
air untuk memindah sisa heksana. Tambahkan residu dengan 20 mL etanol dan
pindahkan masing-masing 10 mL kedalam 2 tabung reaksi. Masing-masing
tabung reaksi ditambahkan 0.5 mL asam klorida pekat dan dilakukan uji dengan
pereaksi Wilstatter (Chairul, 2003).
Pereaksi Wilstatter
Salah satu tabung reaksi yang telah berisikan asam klorida pekat ditambahkan
menit. Apabila terbentuk warna, diencerkan dengan air secukupnya dan
tambahkan 1 mL oktil alkohol. Kocok kuat-kuat dan biarkan dan amati
perubahan wama pada masing-masing lapisan pelarut. Apabila terjadi
pembentukan atau perubahan warna menunjukkan reaksi positif terhadap
flavonoida (Chairul, 2003).
3. Identifikasi Golongan Saponin
Uji busa/buih (The Froth Test)
Buat 10 mL ekstrak etanol 80 % dari material tumbuhan (lebih kurang 2 g)
dan masukkan kedalam tabung reaksi yang mempunyai ukuran. Masing-masing
tabung tambahkan 10 mL air, tutup dan kocok kuat-kuat selama 30 detik dan
biarkan selama 30 min. Apabila busa/ buih yang terjadi lebih besar 3 cm dari
permukaan larutan setelah 30 min, berarti material tumbuhan mengandung positif
saponin. Untuk material tumbuhan yang menghasilkan sedikit busa/buih,
tambahkan sedikit larutan Na2CO3. Kondisi busa/buih tetap stabil dan keras
menunjukkan adanya asam-asam lemak bebas (Chairul, 2003).
4. Identifikasi Golongan Tanin dan Polifenol
Pembuatan ekstrak
Ekstrak lebih kurang 10 g material tumbuhan dengan etanol 80 %, saring dan
keringkan diatas penangas air. Residu ekstrak larutkan dengan 20 mL air panas,
tambahkan ekstrak 5 tetes larutan NaCI. Bagi ekstrak kedalam 2 tabung reaksi,
satu tabung digunakan sebagai kontrol dan lainnya untuk uji ferri klorida (FeC13)
(Chairul, 2003).
LIB gelatin
Salah satu tabung reaksi ditambahkan 3 tetes larutan gelatin dan amati
endapan protein yang terjadi dan bandingkan dengan kontrol (Chairul, 2003).
Pereaksi ferri klorida (FeCl3)
Tabung reaksi lainnya ditambahkan 3 tetes pereaksi ferri klorida (FeC13),
dimana tanin terhidrolisa memberikan wama biru atau biru-hitam, sedangkan
kondensasi tanin menberikan warna biru-hijau dan bandingkan dengan kontrol
5. Identifikasi Golongan Steroid dan Triterpenoid
Pada uji dengan menggunakan pereaksi Lieberman-Buchard, adanya steroid menunjukkan warna biru-kehijauan sedangkan triterpenoid menunjukkan warna
merah, merah muda, atau ungu. Namun sebagai catatan saat pekerja di lapangan
menguji baik secara langsung pada simplisia maupun pada ekstrak terdapat
variansi warna yang dihasilkan, tergantung pada cara bagaimana test tersebut
dilakukan (Fransworth, 1996).
3.4.5. Parameter Spesifik dan Non Spesifik (Depkes RI, 2000). 3.4.5.1. Identitas Ekstrak
Deskripsi tata nama :
Nama ekstrak.
Nama latin tumbuhan (sistematika botani). Bagian tumbuhan yang digunakan.
Nama Indonesia tumbuhan.
3.4.5.2. Organoleptik
Penggunaan pancaindera mendeskripsikan bentuk, warna, bau, rasa
sebagai berikut :
Bentuk : padat, serbuk-kering, kental, cair. Warna : kuning, coklat, dll.
Bau : aromatik, tidak berbau, dll. Rasa : pahit, manis, kelat, dll.
3.4.5.3. Susut Pengeringan
Ekstrak ditimbang secara seksama sebanyak 1 g sampai 2 g dan
dimasukkan ke dalam botol timbang dangkal bertutup yang sebelumnya telah
dipanaskan pada suhu 1050C selama 30 menit dan telah ditara. Sebelum
ditimbang, ekstrak diratakan dalam botol timbang dengan menggoyangkan botol
hingga merupakan lapisan setebal lebih kurang 5 mm sampai 10 mm. Jika
ekstrak yang diuji berupa esktrak kental, ratakan dengan batang pengaduk.
Kemudian dimasukkan ke dalam ruang pengering, buka tutupnya, keringkan
dalam keadaan tertutup mendingin dalam desikator hingga suhu kamar. Jika
ekstrak sulit kering dan mencair pada pemanasan, ditambahkan 1 g silica
pengering yang telah ditimbang secara seksama setelah dikeringkan dan
disimpan dalam eksikator pada suhu kamar. Campurkan silica tersebut secara
rata dengan esktrak pada saat panas, kemudian keringkan kembali pada suhu
penetapan hingga bobot tetap (Depkes RI, 2000).
3.4.5.4. Kadar Abu
Lebih kurang 2 g sampai 3 g ekstrak yang telah digerus dan ditimbang
secara seksama dimasukkan ke dalam krus slilikat yang telah dipijarkan dan
ditara, ratakan. Pijarkan perlahan-lahan hingga arang habis, dinginkan, timbang.
Jika cara ini arang tidak dapat dihilangkan, tambahkan air panas, saring melalui
kertas saring bebas abu. Pijarkan sisa kertas dan kertas saring dalam krus yang
sama. Masukkan filtrat ke dalam krus, uapkan, pijarkan hingga bobot tetap,
timbang. Hitung kadar abu terhadap bahan yang telah dikeringkan di udara
(Depkes RI, 2000).
3.4.6. Persiapan Hewan Uji
Sebelum percobaan, dilakukan uji fertilitas pada tikus putih jantan
dengan cara mengawinkan seluruh tikus putih jantan umur 9 minggu (umur siap
dikawinkan) yang akan digunakan dalam penelitian ini secara alami dengan tikus
betina. Kemudian di amati apakah terjadi kehamilan pada tikus betina. Jika
terjadi kehamilan maka menunjukkan bahwa tikus jantan yang akan digunakan
sebagai hewan uji adalah tikus yang fertil.
Disiapkan tempat pemeliharaan hewan coba yang meliputi kandang,
sekam, tempat makan dan minum tikus. Tikus diaklimatisasi selama 7 hari pada
kondisi laboratorium, agar dapat menyesuaikan diri dengan lingkungannya yang
baru. Selama proses adaptasi, diberi makan dan minum standar ad libitum, dilakukan pengamatan kondisi umum serta ditimbang berat badannya. Tikus
yang digunakan adalah tikus yang sehat yakni berat badan selama aklimatisasi
tidak mengalami perubahan lebih dari 10% dan secara visual menunjukkan