MINIREFERAT FM
BEDAH PADA FETUS
OLEH:
DUDY ALDIANSYAH
PEMBIMBING :
Dr. MAKMUR SITEPU, SpOG
D EP ARTEMEN OB S TETRI D AN GIN EKOLOGI
FAKU LTAS KED OKTERAN
U N IVERS ITAS S U MATERA U TARA
RS U P. H . AD AM MALIK - RS U D . D r. P IRN GAD I
MED AN
DAFTAR ISI
Halaman
DAFTAR ISI...i
DAFTAR SINGKATAN ... iii
BAB I PENDAHULUAN ... 1
BAB II ANESTESI PADA BEDAH FETUS... 3
Anestesi pada Bedah Fetus Terbuka ... 3
Anestesi pada Bedah Fetus dengan Pendekatan Invasif yang Minimal ... 4
BAB III DIAGNOSIS DAN PERSIAPAN ... 5
BAB IV TEKNIK BEDAH FETUS ... 7
Teknik Bedah Terbuka (Open Fetal Procedures) ... 7
Prosedur Bedah Fetus dengan Pendekatan Invasif yang Minimal (Minimally Invasive Fetal Procedures/FETENDO)... 9
BAB V PRA OPERASI DAN PASCA OPERASI ... 11
Masalah-masalah Fetus yang Dapat Dilakukan Pembedahan Koreksi Sebelum Lahir ... 11
Perawatan Pasca Operasi... 12
Persalinan Prematur... 13
BAB VI OBSTRUKSI TRAKTUS URINARIUS ... 15
BAB VII MALFORMASI ADENOMATOID KISTIK KONGENITAL... 17
BAB VIII HERNIA DIAFRAGMA KONGENITAL ... 20
BAB IX TERATOMA SAKROKOKSIGEUS... 26
BAB X SINDROMA TWIN-TO-TWIN TRANFUSION ... 30
BAB XI BLOKADE JANTUNG KONGENITAL ... 33
BAB XII STENOSIS AKUADUKTUS... 35
BAB XIII OBSTRUKSI KATUP AORTA / PULMONAL... 37
BAB XIV ATRESIA / STENOSIS TRAKEA... 38
BAB XV MYELOMENINGOCELE ... 40
BAB XVI BIBIR DAN LANGIT-LANGIT SUMBING... 45
BAB XVII TWIN REVERSED ARTERIAL PERFUSION SEQUENCE ... 46
BAB XVIII TRANSPLANTASI STEM CELL ... 49
BAB XIX KESIMPULAN ... 51
DAFTAR SINGKATAN
AFP Alpha Feto Protein
bpm beat per minute
CCAM/L Congenital Cystic Adenomatoid Malformation/of The Lung
CDH Congenital Diaphragmatic Hernia
CHAOS Congenital High Airway Obstruction
CHD Congenital Heart Disease
CNS Central Nervous System
CSF Cerebrospinal Fluid
CVS Chorionic Villus Sampling
ECG Electrocardiogram
ECMO Extra Corporeal Membrane Oxygenation
EFE Endocardial Fibroelastosis
EXIT Ex Utero Intrapartum Treatment
FETENDO Fetal Endoscopy
FHR Fetal Heart Rate
IUMR Intra Uterine Myelomeningocele Repair
LHR Lung-to-Head Ratio
MRI Magnetic Resonance Imaging
NLS Neonatal Lupus Syndrome
PLUG Plug The Lung Until It Grows
SCT Sacroccocygeal Terratoma
SLPC Selective Fetoscopic Laser Photocoagulation of Chorionic Plate
TRAP Twin Reversed Arterial Perfusion
TTTS Twin-to-Twin Transfusion Syndrome
UCSF University California San Francisco
USG Ultrasonography
BAB I
PENDAHULUAN
Bedah pada fetus masih dirintis dan dilakukan hanya pada beberapa senter di dunia ini. Karena akan menimbulkan resiko substansial pada fetus dan ibu, pembedahan dipertimbangkan untuk memperbaiki luaran pada fetus serta dibandingkan dengan komplikasi yang dapat terjadi, dan apabila segera tidak dilakukan operasi dapat membahayakan fetus. Setiap prosedur pembedahan terlebih dahulu diuji keberhasilannya dengan menggunakan hewan percobaan. Prosedur-prosedur pembedahan tersebut itu harus dievaluasi dengan ketat sebelum diterapkan secara luas pada manusia.1
Sekitar 3% bayi-bayi yang lahir di Amerika Serikat setiap tahunnya mempunyai defek kelahiran yang kompleks. Orang tua bayi sering dibingungkan dengan pilihan untuk menggugurkan janin atau merawat janin dengan kondisi apa adanya setelah lahir. Defek kelahiran tertentu, diperberat dengan proses persalinan dan kelahiran. Setelah bayi lahir dapat timbul kecacatan yang nyata secara progresif atau kematian. Teknik Bedah Fetus menawarkan intervensi awal untuk menangani defek-defek tersebut sebelum menjadi lebih serius dan membahayakan janin.2
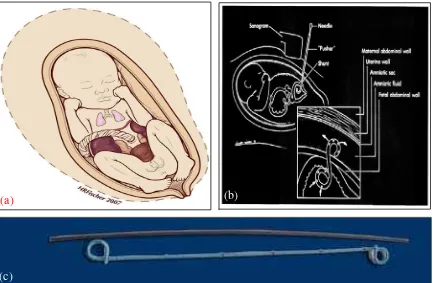
Sejarah mencatat prosedur invasif pada fetus yang pertama dilakukan pada tahun 1960-an, yaitu kateterisasi pada pembuluh darah fetus untuk transfusi pertukaran dan kemudian prosedur itu ditinggalkan. Pada tahun 1970-an, pengalaman bertambah dengan perkembangan teknologi ultrasonografi yang mengarah ke diagnosa yang lebih akurat pada defek-defek anatomi yang dijumpai sebelum bayi
(a) (b)
BAB II
ANESTESI PADA BEDAH FETUS
Anestesi pada bedah fetus berbeda dengan pembedahan maternal biasa (misalnya, seksio sesarea) dan terapi fetus (misalnya, reduksi cairan amnion). Pada bedah fetus, fetus dan ibu merupakan resipien yang aktif, sedangkan dalam bedah maternal, ibu merupakan resipien yang aktif dan fetus bersifat pasif. Pada terapi fetus, ibu bersifat pasif dan fetus merupakan resipien yang aktif.6
Anestesi Pada Bedah Fetus Terbuka
Bedah fetus terbuka membutuhkan anestesi general, karena baik ibu dan fetus harus dianestesi dan uterus dalam keadaan atonia. Ibu diberikan indomethacin (50 mg supositoria rektum) sebagai tokolitik, setelah induksi anestesi general, pasien dipantau dengan menggunakan monitor. Sebuah kateter lumbal epidural dimasukkan, untuk manajemen pasca operatif. Posisi ibu yaitu miring ke sebelah kiri. Hemodinamik fetus dipantau dengan ekokardiogram fetus yang kontinyu. Tekanan
sistolik maternal dipertahankan >100 mmHg dengan ephedrine intravena. Total cairan intravena (NaCl 0,9%) terbatas pada 500 mL, jika kehilangan darah tidak melebihi 100 mL untuk mencegah edema pulmonum pasca operatif. Ukuran insisi uterus dibatasi, untuk mencegah kehilangan cairan karena evaporasi pada fetus, perdarahan uterus, dan kontraksi uterus pasca operatif. Hampir semua pasien mengalami kontraksi uterus prematur selama periode pasca operatif, sehingga memerlukan pemberian infus sulfas magnesikus yang kontinyu. Sulfas magnesikus dan indomethacin diberikan selama 2-3 hari, diikuti dengan terbutaline subkutaneous dan nifedipin oral sampai bayi lahir. Kadang-kadang diperlukan nitrogliserin intravena sebagai tokolitik. Aktivitas uterus dan hemodinamik fetus dipantau secara kontinyu selama 3 hari pasca operasi. Panjang rawat inap pasca operasi rata-rata satu minggu, dan kadang-kadang diperlukan tirah baring pada sisa waktu kehamilan.6
Anestesi Pada Bedah Fetus Dengan Pendekatan Invasif Yang Minimal
BAB III
DIAGNOSIS DAN PERSIAPAN
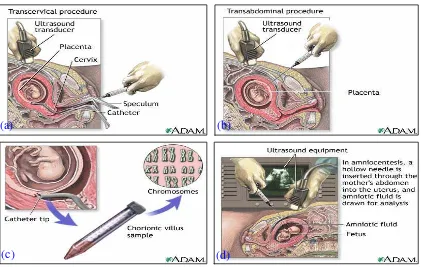
Dalam mendeteksi defek-defek sebelum kelahiran bayi dapat melalui penggunaan pencitraan yang rumit dan teknik-teknik diagnostik seperti :7
Ultrasonografi. Teknik pencitraan yang menggunakan mesin yang
mentransmisikan gelombang suara dengan frekuensi tinggi untuk memvisualisasikan struktur-struktur di tubuh manusia, termasuk uterus dan fetus. Ultrasonografi digunakan untuk menentukan ukuran, posisi, dan usia kehamilan; untuk mengukur jumlah cairan amnion, dan menilai abnormalitas kongenital fetus. Chorionic Villus Sampling (CVS). Sel-sel dikumpulkan dari plasenta dengan
sebuah alat yang dimasukkan melalui cerviks kemudian memasuki uterus atau jarum yang dimasukkan melalui abdomen. Sel-sel kemudian dianalisa untuk kemungkinan adanya kelainan genetik.
Uji Alpha-fetoprotein (AFP). AFP merupakan sebuah protein yang dihasilkan oleh fetus yang berkembang. Jumlah AFP yang banyak di peredaran darah ibu dapat mengindikasikan abnormalitas fetus tertentu.
Amniocentesis. Sebuah jarum dimasukkan ke dalam abdomen ibu kemudian
memasuki uterus untuk memperoleh sampel cairan amnion. Sel-sel fetus di dalam cairan amnion kemudian dianalisa untuk kemungkinan adanya kelainan genetik.
Kecurigaan pada penyakit fetus selalu meningkat dengan adanya polihidramnion
atau oligohidramnion maternal pada pemeriksaan ultrasonografi rutin selama visite prenatal. Evaluasi medis pada fetus termasuk visite prenatal, ekokardiografi untuk menilai fungsi kardiovaskuler, ultrasonografi yang menyeluruh untuk menggambarkan defek dan keparahan hidrops dan magnetic resonance imaging untuk memperjelas anatomi. Sebuah analisis kariotipe (CVS, amniosentensis) fetus dilakukan untuk defek yang disebabkan oleh sindroma genetik. Ibu menjalani riwayat dan pemeriksaan fisisk yang lengkap, analisis kimiawi darah, hitung darah lengkap, foto thoraks dan elektrokardiogram.6
kematian fetus atau kecacatan yang nyata serta dapat diatasi dengan bedah pada fetus.7
Orang tua pasien juga menjalani evaluasi psikososial. Setelah evaluasi ini, tim fetus berkumpul untuk mendiskusikan hal apa yang dapat dilakukan pada pembedahan. Tim terdiri dari ahli bedah pediatri, ahli perinatologi, ahli anestesi, radiologi, ahli genetika, perawat, pekerja sosial dan penasehat keuangan. Tim kemudian bertemu dengan orang tua untuk mendiskusikan prosedur dan resiko. Orang tua diberikan waktu untuk mempertimbangkan resiko dan keuntungan bedah pada fetus serta mendiskusikan luaran fetus. Untuk hasil pembedahan yang terbaik membutuhkan intervensi dini pada kehamilan sebelum terjadi kerusakan yang ireversibel. Setelah usia gestasi 30 minggu, selalu terlambat untuk dilakukan bedah pada fetus.7
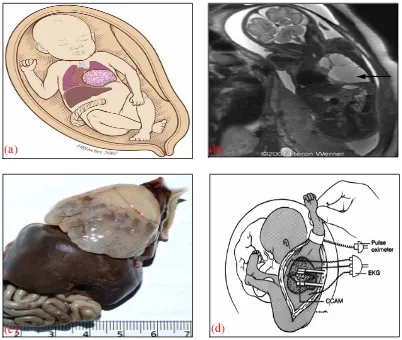
(a) (b)
(c) (d)
BAB IV
TEKNIK BEDAH FETUS
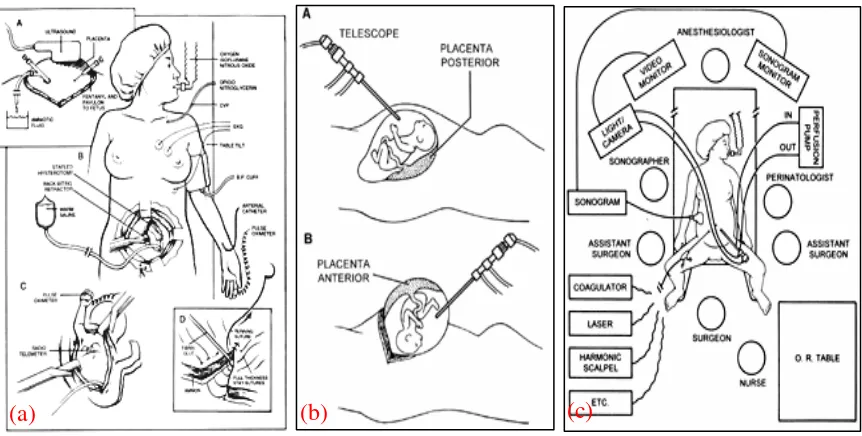
Dijumpai banyak teknik-tenik bedah pada fetus, tetapi secara garis besar dapat digolongkan dalam dua kategori, yaitu teknik bedah terbuka (open fetal procedure) dan bedah fetus dengan pendekatan invasif yang minimal (minimally invasive fetal surgery/ FETENDO) yang telah dilakukan selama 25 tahun pada percobaan-percobaan dan praktek klinis. Di meja operasi, ibu diposisikan untuk menghindari kompresi vena cava inferior oleh uterus gravidus. Ibu dan janin yang dikandungnya, dianestesi dan pemantauan ibu dilakukan dengan memakai monitor ditambah dengan kateter vena dan arteri sentral.10
Teknik Bedah Terbuka (Open Fetal Procedures)
Uterus dipaparkan melalui insisi abdomen transversal rendah. Sonografi intraoperatif dengan probe yang steril, digunakan untuk menentukan posisi fetus dan lokasi plasenta. Cairan amnion diaspirasi melalui trokar yang dipasang dibawah panduan
sonografi, dan uterus dibuka dengan stapler Lactomer absorbable yang khusus, sebagai hemostatik, dan menyegel membran amnion pada myometrium. Klem-klem reverse-bitting ditempatkan disekeliling insisi, dan fetus dan uterus terus-menerus
diirigasi dengan cairan NaCl 0,9% hangat.11
(a) (b)
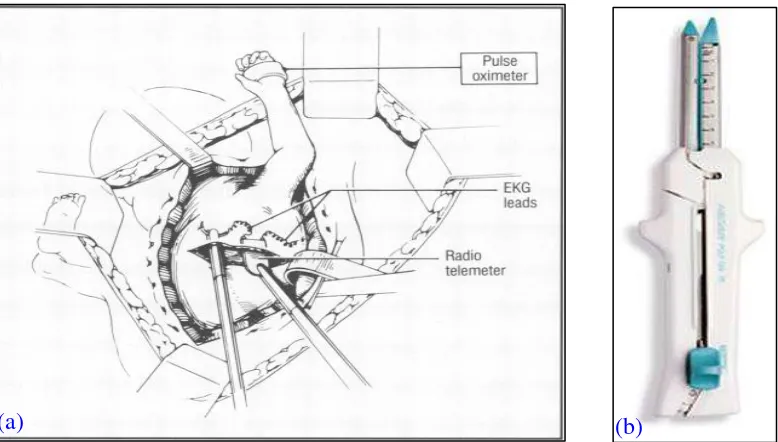
Gambar 3. (a) Sebuah radiotelemeter yang memungkinkan pemantauan intraoperatif dan pasca operatif dalam bentuk elektrokardiogram (EKG) dan denyut jantung. Baru-baru ini, transduksi tekanan intra-amniotik telah digunakan untuk pemantauan persalinan secara kontinyu (dari Harrison dan Adzick). (b) Sebuah stapler LACTOMER absorbable copolymer yang digunakan pada prosedur bedah fetus terbuka.11,12
Prosedur Bedah Fetus dengan meminimalkan pendekatan invasif (Minimally
Invasive Fetal Procedures / FETENDO)
FETENDO menggunakan intervensi fetoskopik yang dikembangkan pada tahun 1990-an untuk menghindari insisi pada uterus, dan diharapkan untuk meminimalkan persalinan prematur. Kemampuan untuk melihat fetus melalui endoskopi yang kecil, telah dilakukan selama beberapa dekade, dan telah dikembangkan instrumen yang sangat kecil untuk memantau secara fetoskopik langsung serta ditampilkan pada monitor televisi. Visualisasi fetus secara real-time baik dengan endoskopi, maupun dengan ultrasonografi. Intervensi FETENDO dapat dilakukan melalui kulit ibu (perkutaneous) atau, pada beberapa keadaan membutuhkan insisi kecil pada abdomen ibu (mini laparotomi). 13
FETENDO kurang invasif dibandingkan bedah fetus terbuka. Sehingga lebih mudah pada pemulihan pasca operasi dan mengurangi kejadian persalinan prematur. Sayangnya, tidak dapat menghilangkan kejadian prematur seluruhnya dan juga perlunya monitoring dan pemberian tokolitik. FETENDO secara teknik sangat sulit dan membutuhkan alat-alat dan teknik-teknik yang baru untuk memungkinkan melihat fetus melalui cairan amnion, mempertahankan posisi fetus, dan memungkinkan koreksi pada fetus.13
Ibu diposisikan dan tanda-tanda vital dipantau dengan monitor, anestesi dan insisi
pada abdomen ibu dilakukan untuk memaparkan uterus. Mapping dengan
ultrasonografi intraoperatif untuk menentukan posisi plasenta dan memandu penempatan trokar. Irigasi yang kontinyu untuk mengoptimalkan visualisasi dilakukan dengan menggunakan sistem pompa irigasi. Fetus dipantau dengan menggunakan ultrasonografi. Sebuah telemeter miniatur dapat ditempatkan di dalam kavum amnion melalui tempat masuknya trokar. Setiap tempat tusukan uterus ditutup dengan dua jahitan absorbable dan lem fibrin.10
(c) (b)
(a)
BAB V
PRA OPERASI DAN PASCA OPERASI
Masalah-Masalah Fetus Yang Dapat Dilakukan Pembedahan Koreksi Sebelum
Lahir
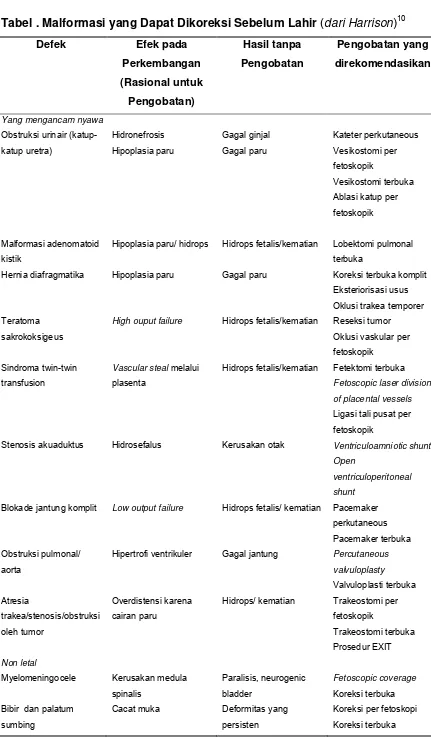
Tabel . Malformasi yang Dapat Dikoreksi Sebelum Lahir (dari Harrison)10
Defek Efek pada
Perkembangan (Rasional untuk Pengobatan) Hasil tanpa Pengobatan Pengobatan yang direkomendasikan
Yang mengancam nyawa
Obstruksi urinair (katup-katup uretra) Hidronefrosis Hipoplasia paru Gagal ginjal Gagal paru Kateter perkutaneous Vesikostomi per fetoskopik Vesikostomi terbuka Ablasi katup per fetoskopik
Malformasi adenomatoid kistik
Hipoplasia paru/ hidrops Hidrops fetalis/kematian Lobektomi pulmonal terbuka
Hernia diafragmatika Hipoplasia paru Gagal paru Koreksi terbuka komplit Eksteriorisasi usus Oklusi trakea temporer Teratoma
sakrokoksigeus
High ouput failure Hidrops fetalis/kematian Reseksi tumor Oklusi vaskular per fetoskopik
Sindroma twin-twin transfusion
Vascular steal melalui plasenta
Hidrops fetalis/kematian Fetektomi terbuka Fetoscopic laser division
of placental vessels
Ligasi tali pusat per fetoskopik
Stenosis akuaduktus Hidrosefalus Kerusakan otak Ventriculoamniotic shunt Open
ventriculoperitoneal
shunt
Blokade jantung komplit Low output failure Hidrops fetalis/ kematian Pacemaker perkutaneous Pacemaker terbuka Obstruksi pulmonal/
aorta
Hipertrofi ventrikuler Gagal jantung Percutaneous valvuloplasty Valvuloplasti terbuka Atresia trakea/stenosis/obstruksi oleh tumor Overdistensi karena cairan paru
Hidrops/ kematian Trakeostomi per fetoskopik
Trakeostomi terbuka Prosedur EXIT Non letal
Myelomeningocele Kerusakan medula
spinalis
Paralisis, neurogenic bladder
Fetoscopic coverage
Koreksi terbuka Bibir dan palatum
sumbing
Cacat muka Deformitas yang
persisten
Perawatan Pasca Operasi
Manajemen pasca operasi dilakukan di Unit Perawatan Intensif Fetus. Dilakukan pemantauan tekanan darah, tekanan vena sentral, urine output, dan saturasi oksigen secara berkala. Kesejahteraan janin dan aktivitas uterus dipantau secara eksternal dengan tokodinamometer dan dengan sebuah radiotelemeter yang diimplantasikan pada waktu pembedahan yang berfungsi secara kontinyu merekam EKG fetus, temperatur, dan tekanan intraamniotik. Analgesia pasien yang terkontrol dengan pemakaian anestesi epidural yang kontinyu berguna untuk menurunkan stress pada ibu dan membantu sebagai tokolisis. Ketika persalinan terkontrol dan fetus dalam keadaan stabil. Pasien ditransfer ke ruang rawat inap obstetri dimana pemantauan dengan radiotelemeter dilanjutkan sampai pasien diperbolehkan untuk pulang (biasanya dalam satu minggu). Pemulihan pasca operasi dapat mencapai 5 sampai 10 hari. Pasien akan dimonitor ketat untuk meyakinkan bahwa tidak akan timbul
persalinan prematur. Beberapa tanda-tanda persalinan prematur termasuk kontraksi, kram, nyeri punggung belakang, perdarahan pervaginam, dan keluarnya cairan dari vagina. Obat-obat tokolitik diberikan untuk menunda atau menghentikan persalinan. Tokolitik seperti terbutaline, indomethacin atau sulfas magnesikus. Antibiotik digunakan untuk mencegah infeksi pasca pembedahan. Pemantauan dilanjutkan sebagai pasien rawat jalan dan pemberian tokolisis dilanjutkan serta pemeriksaan ultrasonografi fetus dilakukan sedikitnya dalam seminggu sekali. Seksio cesarea dilakukan ketika membran ruptur atau persalinan tidak terkontrol, biasanya dalam usia kehamilan 36 minggu. Partus spontan pervaginam dapat dilakukan pada pasien-pasien dengan prosedur FETENDO.10
Persalinan Prematur
Walaupun rejimen inhalasi halogen menghasilkan anestesi yang memuaskan bagi ibu dan fetus, kedalaman anestesi diperlukan untuk memperoleh relaksasi uterus intraoperatif dan harus berhati-hati karena dapat menimbulkan depresi myokardium maternal serta berpengaruh pada perfusi plasenta. Indomethacin dapat
menyempitkan ductus arteriosus fetus, dan kombinasi sulfas magnesikus dengan
BAB VI
OBSTRUKSI TRAKTUS URINARIUS
Obstruksi uretra fetus dapat merusak ginjal karena peningkatan tekanan intrarenal yang lama, sehingga dapat menghambat perkembangan paru (hipoplasia pulmonum) disebabkan terjadinya oligohidramnion, hal ini dapat dikurangi dengan dekompresi traktus urinarius sebelum lahir. Pada kebanyakan kasus, dijumpai malformasi traktus urinarius mayor dikarenakan aneuplody atau gangguan genetik serta selalu mempunyai prognosis yang buruk. Malformasi seperti displasia kistik dan agenesis renal tidak dapat dikoreksi. Sebaliknya, janin-janin dengan lesi-lesi obstruksi traktus urinarius terisolasi mempunyai prognosis yang lebih baik setelah operasi korektif. Diperkirakan kejadiannya sekitar 1 dari 5000 kelahiran hidup.1,10
Kriteria untuk pemilihan pasien sebagai kandidat operasi harus berdasarkan pemeriksaan elektrolit urin fetus dan kadar β2 mikroglobulin serta gambaran
ultrasonografi pada ginjal fetus. Dari semua fetus dengan dilatasi traktus urinarius, sebanyak 90% tidak memerlukan intervensi. Fetus-fetus dengan hidronefrosis bilateral karena obstruksi uretra yang akan mengakibatkan terjadinya oligohidramnion harus segera membutuhkan penanganan. Jika paru-paru fetus matang, fetus dapat dilahirkan lebih dini untuk kemudian dilakukan dekompresi pasca natal. Jika paru-paru tidak matang, dapat dilakukan dekompresi in utero dengan pemasangan shunt kateter perkutaneous di bawah panduan ultrasonografi, melalui prosedur vesikostomi fetus terbuka atau dengan bantuan vesikostomi per
fetoskopik, atau dengan pemasangan sebuah wire mesh stent yang dapat
memecahkan masalah teknis yang biasanya ditemukan pada pemasangan shunt (malfungsi, tercabut, gangguan dinding abdomen).1,10
endoskopi fetus telah dievaluasi oleh Quintero dkk, pada tahun 2000, untuk kasus-kasus dengan komplikasi, dimana pemasangan shunt sendiri tidak cukup.1
Pemilihan fetus sebagai kandidat untuk operasi diperlukan untuk menghindari intervensi yang berlebihan. Tidak jelas apakah dekompresi dapat mengembalikan fungsi ginjal yang sudah rusak.10
(b)
(a)
(c)
BAB VII
MALFORMASI ADENOMATOID KISTIK KONGENITAL
Malformasi Adenomatoid Kistik Kongenital pada Paru/ Congenital Cystic
Adenomatoid Malformation of The Lung (CCAML/CCAM), merupakan sebuah anomali paru yang sangat jarang terjadi. Perkiraan insidensnya adalah 1 dalam 25.000 – 35.000 kelahiran hidup (Etchest dkk., 1994 ; Morikawa dkk., 2003).14,16
Malformasi Adenomatoid Kistik Kongenital/ Congenital Cystic Adenomatoid
Malformation (CCAM) sering muncul berupa massa yang benigna pada fetus atau anak-anak. Prognosis tergantung dari ukuran massa (Adzick dkk. 1985 ; 1998) dan gangguan fisiologi sekunder. Massa yang besar dapat menyebabkan pergeseran mediastinum, hipoplasia jaringan paru, polihidramnion, dan gangguan jantung yang akan mengakibatkan terjadinya hidrops fetalis dan kematian janin in utero. Kompresi esofagus oleh massa thoraks mengakibatkan berkurangnya kemampuan fetus untuk menelan cairan amnion, sehingga akan mengakibatkan terjadinya polihidramnion.
Fetus dengan massa yang besar disertai dengan keadaan hidrops fetalis mempunyai resiko yang sangat tinggi untuk terjadinya kematian. Thorakosentesis fetus saja tidak efektif karena cairan kista dapat bereakumulasi cepat. Pemasangan shunt thorakoamniotik tidak berhasil, kurang dari empat pasien yang dilakukan prosedur ini, dekompresi jangka panjang dicapai hanya pada satu fetus.1,20
(a) (b)
(d) (c)
USG, amniocentesis, ekokardiografi
Skema 1. Algoritma manajemen pada fetus dengan CCAM, (diadaptasi dari Adzick)1
Lesi yang terisolasi Anomali lain atau Preeklampsia
Evaluasi prognostik Usia Gestasi Pergeseran Mediastinum
Plasentomegali Hidrops
Tidak ada Hidrops
Ultrasonografi dan Konseling Hidrops
24-32 minggu
< 24 minggu > 32 minggu
Konseling Tidak ada Hidrops
Reseksi In Utero
Lahirkan pada waktu aterm atau reseksi eks utero Lahirkan preterm atau
reseksi eks utero Lahirkan mendekati
BAB VIII
HERNIA DIAFRAGMA KONGENITAL
Hernia diafragma kongenital/ Congenital Diaphragmatic Hernia (CDH) diperkirakan terjadi pada satu dari setiap 2500 - 3000 bayi hidup yang baru lahir. Berdasarkan jumlah kelahiran di Amerika Serikat pada tahun 2003, yaitu 4.091.063 jiwa, sekitar 1.500 sampai dengan 1.600 bayi lahir dengan CDH setiap tahunnya. CDH terhitung sekitar 8% dari semua kelainan kongenital. Defek ini merupakan hasil pada kegagalan fusi dari empat komponen diafragma (septum transversum, membran pleuroperitoneal, mesenterium dorsal dari esofagus, dan dinding tubuh) pada usia kehamilan 8 minggu. Kebanyakan defek dijumpai pada aspek posterolateral (hernia Bochdalek), tetapi dapat terjadi pada sisi kanan atau lokasi sentral (hernia Morgagni). Defek ini memungkinkan migrasi organ intraabdominal ke rongga thoraks selama perkembangan fetus, menyebabkan terganggunya perkembangan paru. Dan kemudian menyebabkan terjadinya hipoksemia yang berat dan hipertensi pulmonal yang persisten setelah bayi lahir.21,22
Hernia diafragma kongenital merupakan defek anatomi sederhana yang dapat dikoreksi setelah lahir dengan mendorong viscera yang mengalami herniasi dari
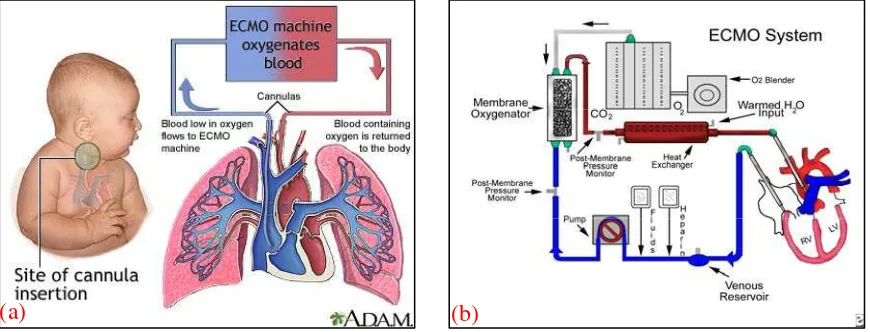
thoraks dan menutup diafragma. Walaupun dengan perawatan pasca natal yang terbaik, banyak bayi yang dilahirkan dengan hernia diafragma kongenital mati karena paru-parunya terlalu hipoplastik untuk bertahan hidup di lingkungan ekstrauterin. Janin dengan CDH yang kurang parah dapat bertahan hidup dengan perawatan pasca natal yang moderen, termasuk ventilasi mekanik frekuensi tinggi, nitrat oksida, dan oksigenasi membran ekstrakorporal/ Extracorporeal Membrane Oxygenation (ECMO). Banyak senter yang melaporkan peningkatan angka ketahanan hidup selama dekade terakhir, angka mortalitas tetap bervariasi di antara senter-senter yang berbeda. Penelitian multisenter menduga adanya mortalitas yang tersembunyi pada fetus yang sekarat sebelum lahir. Keseluruhan angka mortalitas CDH adalah 30-60%.10,21
hemithoraks bagian kiri dapat ditangani dengan sempurna dengan melakukan koreksi in utero.10
(a) (b)
Gambar 8. (a) ECMO digunakan pada bayi yang sakit parah karena masalah pernafasan atau jantung. Mesin ECMO mengalirkan darah melalui paru-paru buatan kemudian kembali ke aliran darah bayi. (b) Sistem Mesin ECMO.22,23
Karena ketahanan hidup neonatus yang menderita CDH berhubungan dengan bukan hanya sekedar pada ukuran paru, usaha untuk memprediksi ketahanan hidup fetus berdasarkan ukuran paru, ultrasonografi atau magnetic resonance imaging (MRI), atau pasca natal berdasarkan pada temuan foto thoraks, semuanya mempunyai keterbatasan. Rasio paru terhadap kepala/ lung-to-head ratio (LHR) dideskripsikan pertama kali oleh Metkus dkk, pada tahun 1996 dan masih digunakan sekarang, dalam usaha untuk menghubungkan ukuran paru kanan yang diukur pada fetus yang
menderita CDH sebelah kiri terhadap sebuah standar pertumbuhan (head
circumference). Pada penelitian mereka, LHR diukur pada usia kehamilan 24 sampai
diafragma yang adekuat untuk penjahitan primer. Pasien dengan CDH tingkat ini mempunyai prognosis yang baik, dengan resiko mortalitas dan kebutuhan untuk ECMO yang minimal. Pasien dengan usus dan tambahan gaster di rongga thoraks (termasuk juga spleen), tetapi liver tetap berada di dalam abdomen digolongkan sebagai CDH intermedier dan dengan resiko yang intermedier. Pasien dengan usus, gaster, spleen, dan liver di rongga thoraks, mempunyai resiko yang lebih parah dan dijumpainya resiko peningkatan morbiditas, mortalitas, dan kebutuhan untuk ECMO. Semua pasien yang mempunyai tingkat CDH yang berat tidak mempunyai diafragma yang cukup untuk penutupan primer dan membutuhkan tambalan yang luas. Pasien-pasien dengan resiko tinggi serta mempunyai bagian liver yang terbesar di rongga thoraks berhubungan dengan LHR yang rendah.10,21
Usaha untuk meningkatkan perkembangan dan ukuran paru dengan intervensi prenatal telah dilakukan selama 20 tahun. Konsepnya adalah memperbaiki CDH di dalam fetus, mengembalikan fetus ke uterus untuk perkembangan dan pertumbuhan paru yang lebih lanjut, dan melahirkan fetus yang dikoreksi secara elektif pada waktu mendekati usia kehamilan aterm. Setelah penelitian pada hewan percobaan, koreksi CDH dengan bedah fetus terbuka pertama kali dilakukan oleh Harrison pada tahun 1990. Bagaimanapun masalah-masalah teknis terhadap koreksi adalah iritabilitas uterus dan persalinan prematur. Akhirnya, pada 21 fetus yang menjalani koreksi bedah fetus terbuka, tetapi hanya 5 fetus yang bertahan hidup.21
intensif dengan perkiraan mortalitas sekitar 58%, dengan juga mempertimbangkan morbiditas dan biaya, dan (3) mengusahakan intervensi prenatal.10,21
Pada fetus-fetus dengan herniasi liver, telah dikembangkan dan diuji secara klinis sebuah pendekatan yang baru untuk memperbaiki perkembangan paru. Pada fetus domba telah dicoba dengan cara menghalangi saluran keluar-masuk cairan paru dengan oklusi trakea yang terkontrol dengan memperluas paru-paru yang hipoplastik dan mendorong viscera masuk ke dalam abdomen. Teknik ini dinamakan PLUG (Plug the Lung Until It Grows) atau “sumbat paru sampai dia tumbuh”, dengan cara membuat oklusi temporer pada trakea fetus untuk mengakselerasi pertumbuhan paru fetus, hal ini dapat mengurangi hipoplasia pulmonal yang fatal disebabkan oleh CDH yang parah. Dahulu teknik ini dilakukan dengan bedah fetus terbuka, sekarang telah dikembangkan teknik bedah fetus FETENDO dengan komplikasi persalinan prematur dan morbiditas maternal yang rendah.21,22
Persalinan dilakukan dengan seksio cesarea, dan selanjutnya balon trakea yang
menutup trakea, diangkat dengan menggunakan metode Ex Utero Intrapartum
Treatment Procedure (EXIT). Fetus dilahirkan melalui seksio cesarea, di mana hanya kepala, leher, dan bagian tubuh sebelah atas yang dipaparkan. Pada waktu ini dapat dilakukan bronkoskopi dengan mengangkat atau mendeflasi balon trakea. Bayi kemudian diintubasi dan diberikan surfaktan ketika masih terjadi pertukaran gas melalui sirkulasi umbilikus. Ketika saturasi oksigen meningkat, tali pusat dapat di
potong dan bayi dilahirkan.10,21
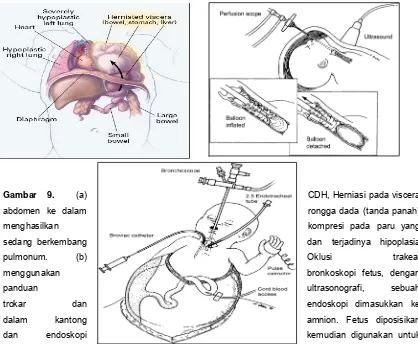
Gambar 9. (a) CDH, Herniasi pada viscera
abdomen ke dalam rongga dada (tanda panah)
menghasilkan kompresi pada paru yang
sedang berkembang dan terjadinya hipoplasia
pulmonum. (b) Oklusi trakea,
menggunakan bronkoskopi fetus, dengan
panduan ultrasonografi, sebuah
trokar dan endoskopi dimasukkan ke
dalam kantong amnion. Fetus diposisikan
dan endoskopi kemudian digunakan untuk
BAB IX
TERATOMA SAKROKOKSIGEUS
Teratoma Sakrokoksigeus (SCT) merupakan tumor yang paling sering muncul pada bayi yang baru lahir, dengan perkiraan kejadiannya adalah sekitar 1 dari 35.000 sampai 40.000 kelahiran hidup. Kebanyakan teratoma sakrokoksigeus didiagnosa pada neonatus, tidak mempunyai kecenderungan menjadi ganas, dan prognosis cenderung membaik setelah reseksi.26
Tumor kongenital ini terdiri dari beberapa jaringan yang berasal dari tiga lapisan germinal dan timbul dari sel-sel totipotensial di dalam pembuluh Hensen yang berasal dari sel-sel germinal primordial pada daerah sakrum. Teratoma-teratoma ini penuh dengan vaskularisasi, dengan sejumlah shunting arteriovenosa yang akan mengakibatkan vascular steal syndrome atau perdarahan. Morbiditas dan mortalitas perinatal sangat tinggi berkaitan dengan anemia fetus, gagal jantung, dan hidrops (Altman, dkk, 1974). Tumor yang dideteksi dini selalu agresif, angka ketahanan hidup kurang dari 10% pada fetus yang diidentifikasi sebelum usia kehamilan 30 minggu, dibandingkan dengan 75% dimana tumor itu ditemukan di kemudian hari (Malone dkk, 1990).26,27
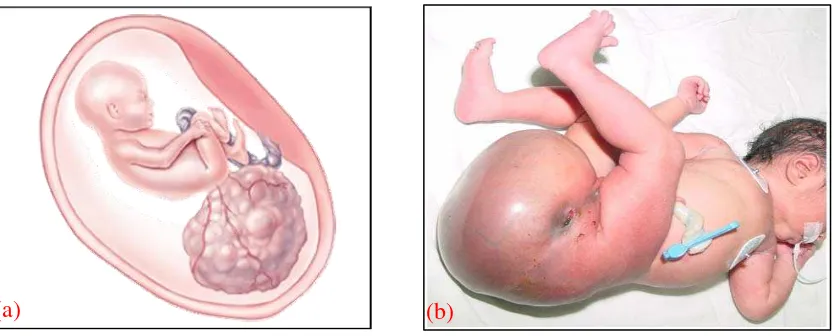
(a) (b)
Gambar 10. (a) Teratoma sakrokoksigeus in utero, (b) Bayi dengan teratoma sakrokoksigeus, yang meluas dari sakrum sampai bagian atas paha.26,28
Teratoma sakrokosigeus telah diklasifikasikan berdasarkan dengan adanya bagian tumor di luar dan di dalam tubuh fetus. Ada empat kelompok klasifikasi :27
Altman Tipe I, seluruh tumor berada di eksternal, tampak pada waktu lahir, serta lebih mudah direseksi. Altman Tipe I biasanya tidak menyebar.
Altman Tipe II, mempunyai bagian eksternal dan internal. Bagian internal terbatas pada daerah pelvis. Tipe ini akan menyebar pada sekitar 6 % kasus.
Altman Tipe III, juga mempunyai bagian eksternal dan internal, tetapi bagian internal meluas ke daerah abdomen. Altman Tipe II dan III, tampak pada waktu lahir, tetapi reseksi lebih sulit dilakukan dan membutuhkan akses dari punggung dan dari depan bayi. Altman Tipe III akan menyebar pada sekitar 20% kasus. Altman Tipe IV, seluruhnya berada pada bagian internal. Dapat tidak terdiagnosa
untuk beberapa waktu. Kemudian, simtom-simtom dapat muncul dan memerlukan pemeriksaan pada waktu diagnosa ditegakkan. Tipe ini akan menyebar pada sekitar 8 % kasus.
Perkembangan fetal hidrops dan plasentomegali, akan menimbulkan sindroma cermin maternal, sebuah penyakit yang potensial berbahaya, dimana kondisi ibu merupakan cermin terhadap sakitnya bayi (Maternal Mirror Syndrome). Pada ibu akan timbul secara progresif gejala-gejala preeklampsia, termasuk muntah-muntah, hipertensi, proteinuria, dan edema perifer serta pulmonal, semua dapat disebabkan faktor-faktor vasoaktif atau toksin-toksin endotel yang dilepaskan dari plasenta yang edema. Tumor “mencuri” darah dari sirkulasi fetus, menyebabkan jantung bekerja ekstra keras dan membuat kemungkinan terjadinya gagal jantung. Gagal jantung
merupakan perwujudan dari hidrops, sebuah akumulasi cairan di dalam tubuh fetus, hidrops dengan teratoma sakrokoksigeus selalu fatal apabila didiagnosa sebelum usia kehamilan 30 minggu.26,27
Resiko-resiko lain termasuk :26,27
Persalinan prematur karena polihidramnion dengan atau tidak disertainya massa tumor.
Anemia fetus yang disebabkan perdarahan spontan dari tumor atau ruptur tumor selama persalinan.
Ultrasonografi doppler berwarna, secara jelas mendemonstrasikan kegagalan high output sekunder karena vascular steal syndrome. Temuan ini, bersamaan dengan
fakta bahwa pada fetus-fetus imatur akan timbul plasentomegali, ketebalan plasenta meningkat dari 40 ke 60 mm (normal adalah 25 mm) dalam satu minggu, dan fetus yang hidrops akan selalu mengalami kematian. Diduga reseksi tumor in utero menghilangkan hidrops dan mencegah kematian fetus. Eksisi teratoma fetus akan mengakibatkan sembuhnya hidrops, tetapi reseksi harus dilakukan sebelum terjadinya plasentomegali dan sindroma cermin maternal. Panduan sonografi yang kurang invasif atau teknik videofetoskopik dapat segera digunakan untuk meligasi pembuluh-pembuluh darah tumor secara selektif dan menginterupsi vascular steal syndrome.26,27
Dengan prognosis yang sangat jelek untuk lesi dini yang agresif, eksisi pembedahan prenatal telah dilakukan, tetapi kebanyakan tidak berhasil (Langer, dkk, 1989). Prosedur reseksi tumor in utero sebaiknya dilakukan pada usia kehamilan 20-25 minggu. Hidrops fetalis (retensi cairan karena kegagalan jantung high output) merupakan indikasi untuk dilakukannya bedah pada fetus. Jika teratoma sakrokoksigeus kecil, persalinan pervaginam pada waktu kehamilan aterm dapat direncanakan. Bagaimanapun juga jika SCT sangat besar atau dijumpai kelebihan cairan amnion, dianjurkan untuk dilakukan seksio cesarea,jika kondisi hidrops fetalis membahayakan fetus, intervensi segera direkomendasikan, dan apabila fetus cukup
bulan, dilakukan seksio cesarea segera, serta apabila fetus tidak siap untuk dilahirkan, bedah fetus untuk mengangkat tumor sakrokoksigeus direkomendasikan.26,27
Skema 2. Algoritma Penanganan SCT.26
(a)
(b)
[image:31.595.112.481.63.143.2] [image:31.595.113.478.183.442.2]BAB X
SINDROMA TWIN-to-TWIN TRANSFUSION
Sindroma Twin-to-Twin Transfusion/Twin-to-Twin Transfusion Syndrome (TTTS) merupakan akibat dari transfusi darah intrauterin dari satu kembar (donor) ke kembar yang lain (resipien). TTTS hanya terjadi pada kembar mozigotik (identik) dengan sebuah plasenta yang monokorionik. Donor sering lebih kecil, dengan berat badan kurang dari 20%, dibandingkan dengan berat badan resipien. Kembar yang sebagai donor sering anemik dan resipien sering pletorik dengan perbedaan hemoglobin lebih dari 5 g/dL.29
Transfusi darah berasal dari kembar yang sebagai donor ke kembar yang sebagai resipien, yang terjadi melalui anastomosis vaskuler plasenta. Anastomosis vaskuler yang paling sering terjadi adalah anastomosis arteri ke vena melalui kotiledon plasenta yang dipakai bersama-sama.29
(b)
[image:32.595.86.518.379.611.2](c) (a)
Gambar 12. (a) TTTS. (b) TTTS dikarakterisasikan sebagai shunting arteriovenosa pada kotiledon plasenta yang dipakai bersama-sama oleh kedua fetus. (c) Tipe-tipe shunting pada TTTS.32,33
plasentasi monokorionik, monoamniotik mempunyai resiko untuk terjadinya TTTS. Gambaran klinis TTTS merupakan hasil dari hipoperfusi pada kembar donor dan hiperperfusi pada kembar resipien. Kembar donor menjadi hipovolemik dan oliguria atau anuria. Oligohidramnion muncul pada kantong amnion pada kembar donor. Oligohidramnion yang berat dapat ditemukan pada fenomena kembar yang berdempet dimana kembar tersebut tampaknya pada posisi yang terfiksir terhadap dinding uterus. Ultrasonografi dapat gagal dalam memvisualisasikan kandung kemih fetus karena tidak adanya urin. Kembar yang sebagai resipien dapat menjadi hipervolemik dan poliuria. Polihidramnion muncul pada kantong amnion pada kembar resipien. Masing-masing kembar dapat menjadi hidrop fetalis. Kembar donor dapat menjadi hidropik karena anemia dan gagal jantung high-output. Kembar resipien dapat menjadi hidropik karena hipervolemia. Kembar resipien dapat juga menjadi hipertensi, kardiomegali hipertrofi, disseminated intravascular coagulation, dan hiperbilirubinemia setelah lahir.29
Kembar monozigotik terjadi kira-kira 3-5 dari 1000 kehamilan. Kembar monozigotik dapat mempunyai plasenta monokorionik atau dikorionik. Sekitar 75% kembar monozigotik adalah monokorionik. Hanya kembar monokorionik yang beresiko untuk terjadinya TTTS. TTTS terjadi sekitar 5-38% pada kembar monokorionik.29
TTTS yang berat mempunyai angka mortalitas fetal atau neonatal sekitar 60-100%. TTTS yang ringan dan sedang, sering terjadi persalinan prematur. Kematian fetus
pada satu kembar berhubungan dengan sekuele neurologi pada 25% kembar yang selamat. Ketidakstabilan tekanan darah fetus dapat mengakibatkan iskemia otak baik pada kembar donor maupun resipien. Iskemia otak fetus dapat menghasilkan leukomalacia periventrikuler, porencephaly, mikrocephaly dan cerebral palsy. Makin prematur usia kembar pada waktu lahir, makin tinggi tingkat morbiditas dan mortalitas pasca natal.29
Prosedur penanganan yang umum adalah dengan melakukan amniocentesis reduksi serial. Prosedur ini adalah dilakukan dengan cara drainase cairan amnion pada kembar resipien, selanjutnya, hal ini akan memperbaiki sirkulasi pada kembar donor. Menghentikan anastomosis vaskuler plasenta dapat memperbaiki luaran pada kasus-kasus yang berat. Hal ini dilakukan dengan mengoklusi sirkulasi umbilikus perkutaneous, dengan memotong pembuluh-pembuluh darah plasenta yang
abnormal secara per endoskopi dengan menggunakan probe laser (Selective
fetus yang abnormal melalui histerotomi. Semua teknik ini terbukti berhasil pada uji coba yang kecil, dan pendekatan yang optimal belum lagi dapat ditentukan.29,31
(b) (a)
[image:34.595.86.520.107.280.2]BAB XI
BLOKADE JANTUNG KONGENITAL
Blokade jantung kongenital merupakan kelainan yang sangat jarang. Insidensnya
sekitar 1 dari 22.000 kelahiran hidup. Blokade jantung kongenital berhubungan
dengan penyakit lupus neonatus dan dianggap merupakan suatu keadaan pasif pada
penyakit autoimun maternal dengan autoantibodi-autoantibodi terhadap
antigen-antigen SS-A/Ro dan SS-B/La, antigen-antigen-antigen-antigen ini selanjutnya melintasi plasenta,
yang kemudian dapat menimbulkan trauma jaringan yang dimediasi imun pada
jantung fetus. Secara histologi, dijumpai pergantian fibro-fatty pada sambungan atrial
ke nodus atrioventrikuler setelah usia kehamilan 16 minggu. Antibodi-antibodi dapat
menyebabkan myokarditis inflamasi, fibrosis dan kardiomiopati dengan onset yang
lambat. Blokade jantung kongenital yang dimediasi autoimun ini, merupakan penyakit
yang secara potensial fatal dengan mortalitas yang tinggi pada tahun-tahun pertama
kehidupan. Peneliti-peneliti lain menjumpai blokade jantung kongenital yang tidak
berhubungan dengan antibodi-antibodi SS-A/Ro dan SS-B/La. Wanita dengan titer
serum antibodi anti Ro, beresiko 3% mempunyai bayi dengan sindroma lupus
neonatus/ Neonatal Lupus Syndrome (NLS). Angka rekurensi sekitar 18%. Perlunya
dilakukan ekokardiogram serial, agar diagnosa dapat ditegakkan lebih awal,
sehingga dapat segera dilakukan terapi yang agresif seperti jika ada tanda-tanda
gangguan sistem konduksi seperti interval PR yang memanjang.34,35,37
Pasien-pasien dengan blokade jantung kongenital berhubungan dengan penyakit
struktur jantung yang mempunyai morbiditas dan mortalitas yang tinggi, serta lebih
ditentukan oleh penyakit struktur jantung kongenital yang mendasari dibandingkan
hanya karena oleh gangguan pacemaker. Bentuk yang paling umum dari penyakit
jantung kongenital yang berhubungan dengan blokade jantung, termasuk isomerisme
atrium kiri, sering diikuti dengan sebuah defek septum atrioventrikuler, juga dengan
transposisi levo arteri-arteri besar. Ketika diagnosa ditegakkan pada periode pasca
natal, sekitar sepertiga kasus-kasus dari penyakit sistem konduksi kongenital
berhubungan dengan penyakit struktur jantung. Diagnosis blokade jantung
kongenital yang disebabkan penyakit struktur jantung, ditemukan kira-kira setengah
pada kasus-kasus in utero, dan dijumpainya hubungan antara blokade jantung
kongenital dengan gagal jantung kongestif in utero, oleh karena itu, prognosisnya
jelek. Jika blokade jantung didiagnosa sebagai bradikardia selama periode fetus,
untuk mortalitas prenatal tergantung adanya penyakit struktur jantung dan sebuah
denyut jantung dengan nilai yang kritis, yaitu kurang dari 55 bpm. Dijumpainya
hidrops fetalis merupakan suatu pertanda prognosis yang buruk. Pada kasus-kasus
yang berat, dijumpai mortalitas sekitar 85% pada periode neonatal.10,37
Menurut Jaeggi dkk., tahun 2002, mortalitas pada blokade atrioventrikuler komplit
pada fetus adalah 43% (13 dari 15 total kematian adalah fetus), pada tingkat
neonatus adalah 6%, serta tidak dijumpai pada anak-anak. Pada hidrops fetalis
dijumpai mortalitas 100%. Dengan fibroelastosis endokardial (EFE), dijumpai juga
mortalitas 100%. Dan jika denyut jantung janin fetus (FHR) kurang dari 55 bpm,
mayoritas akan mati (9 dari 15). Menurut Kertesz dkk., tahun 1997, dalam
kasus-kasus blokade atrioventrikuler komplit fetus yang bervariasi, dijumpai 30% sampai
dengan 50% kasus-kasus yang berhubungan dengan penyakit jantung kongenital.
Dari ini, hanya 14% yang bertahan hidup pada periode neonatal dibandingkan 85%
yang bertahan hidup pada blokade atrioventrikuler kongenital komplit yang
terisolasi.37
Angka ketahanan hidup pada bayi-bayi yang lahir dengan blokade jantung kongenital
yang tidak disertai dengan penyakit struktur jantung adalah sekitar 85%. Malahan
hampir semua pasien-pasien ini membutuhkan implantasi pacemaker. Pemasangan
pacemaker dilakukan bila gagal jantung low-output tidak dapat dipulihkan dengan
pemakaian β-agonis atau dengan pemakaian steroid untuk meningkatkan denyut
jantung. Pacemaker dipasang dengan teknik bedah fetus terbuka atau perkutaneous.
Secara eksperimen terbukti efektif tetapi hanya sedikit yang baru diterapkan pada
BAB XII
STENOSIS AKUADUKTUS
Hidrosefalus kongenital merupakan suatu malformasi yang serius pada sistim saraf pusat / Central Nervous System (CNS), terjadi sekitar satu dari 1000 fetus. Stenosis akuaduktus bertanggung jawab pada sekitar 20% kasus-kasus hidrosefalus. Cairan cerebrospinal yang diproduksi oleh dua pasang ventrikel lateral yang simetris pada otak. Dari tempat ini kemudian mengalir ke ventrikel ketiga melalui foramen Monro dan kemudian menuju ke ventrikel keempat. Saluran sempit yang menghubungkan ventrikel ketiga dan keempat disebut akuaduktus Sylvius. Obstruksi kongenital pada saluran ini disebut stenosis akuaduktus. Stenosis akuaduktus merupakan penyebab
yang paling sering terjadinya ventrikulomegali (33-43%) dan hidrosefalus. Pada 70% kasus-kasus dengan stenosis akuaduktus, sebuah lesi obstruktif dapat diidentifikasi, sisanya, diagnosis ditegakkan dengan menyingkirkan penyebab-penyebab terjadinya ventrikulomegali dan hidrosefalus yang lain, khususnya malformasi pada cerebellum dan spina. Diagnosis antenatal yang dini masih merupakan sebuah tantangan, karena diagnosis ventrikulomegali atau hidrosefalus tidak muncul sampai usia gestasi 18 minggu. Stenosis akuaduktus selalu didiagnosa pada kehamilan trimester kedua atau ketiga. Penyebabnya belum diketahui secara pasti. Kemungkinan 1–2% dari semua kasus-kasus stenosis akuaduktus disebabkan karena kelainan X-linked. Mungkin, seperempat kasus-kasus pada fetus laki-laki disebabkan mutasi gen pada kromosom X. Seperti pada semua penyakit X-linked resesif, hanya jenis kelamin laki-laki yang terkena, tetapi penyakit tersebut ditransmisikan melalui perempuan ke dalam keluarga. Sebagai tambahan, X-linked yang diwariskan, sebuah pola autosomal resesif telah diidentifikasi pada keluarga yang mana kedua jenis kelamin terkena kelainan ini. Sekalipun demikian, diagnosis prenatal rutin belum tersedia.38,39 Prognosis stenosis akuaduktus tergantung hal-hal berikut ini, perluasan ventrikulomegali, dan progresifitas penyakit. Setelah lahir, bayi yang menderita kelainan ini diperlukan pemasangan shunt, yakni implantasi secara bedah sebuah tube plastik kecil yang dapat mengalirkan cairan yang berlebihan dari otak ke peritoneum atau vena. Pengobatan hidrosefalus harus menunggu sampai lahir. Penanganan in utero tidak memperbaiki luaran neurologi tetapi memperbaiki luaran ketahanan hidup. 65% kasus-kasus yang ditangani secara antenatal mempunyai
sedang berkembang. Tetapi, shunt ventrikulo-amniotik yang ditempatkan secara perkutaneous tidak memperbaiki luaran penyakit.10,39
[image:38.595.86.544.109.432.2](a)
Gambar 14. (a) Stenosis akuaduktus. (b)
& (c) Gambaran sonografi
BAB XIII
OBSTRUKSI KATUP AORTA / PULMONAL
Penyakit jantung kongenital/ Congenital Heart Disease (CHD) merupakan defek
kelahiran yang paling serius pada manusia, terjadi sekitar 1 dari 100-150 kelahiran
hidup. Kebanyakan bentuk dari defek jantung berhubungan dengan morfogenesis
yang abnormal selama perkembangan janin. Beberapa defek strukur jantung
sederhana yang dapat menganggu perkembangan janin, dan sangat baik bila
dilakukan koreksi prenatal. Obstruksi pada darah yang mengalir melalui katup
pulmonal atau aorta mengganggu perkembangan ventrikel atau paru, serta
vaskularisasi sistemik, dengan memperbaiki obstruksi anatomi sehingga dapat
memungkinkan perkembangan janin yang normal. Katup-katup jantung fetus yang
mengalami stenosis dapat didilatasi dengan menggunakan balon kateter yang
ditempatkan perkutaneous. Beberapa senter telah mengembangkan teknik ini untuk
mengkoreksi defek pada jantung fetus. Walaupun intervensi jantung pada fetus belum merupakan suatu alternatif yang konvensional dibandingkan dengan koreksi neonatal, tetapi telah dilaporkan beberapa keberhasilan penggunaan teknik pendekatan kardiak in utero. Valvuloplasti balon yang dipandu dengan ultrasonografi telah berhasil dilakukan pada 7 dari 12 fetus manusia dengan obstruksi katup aorta yang parah, tetapi hanya satu fetus yang bertahan hidup untuk jangka panjang.10,41
[image:39.595.92.512.494.647.2](a)
Gambar 15. (a) Jantung fetus normal pada usia
BAB XIV
ATRESIA / STENOSIS TRAKEA
Atresia trakea kongenital sangat jarang terjadi dan merupakan suatu kelainan yang letal.Insidens atresia esofagus adalah 1 dari 3000 kelahiran hidup dan atresia trakea kurang dari 1 dari 50.000 kelahiran hidup. Pada gambaran sonografi prenatal
dijumpai massa paru bilateral yang hiperekoik disertai dengan ascites. Pada embryo, esofagus dan traktus respiratorius berasal dari asal yang sama yaitu foregut anterior. Abnormalitas kongenital yang melibatkan trakea selalu dihubungkan dengan anomali esofagus. Bagaimanapun juga atresia trakea bagian bawah tanpa anomali esofagus, sangat jarang terjadi, dan hanya sedikit yang dilaporkan di dalam literatur.44
Mortalitas pada fetus yang terdeteksi pada waktu prenatal mendekati 100%. Mayoritas atresia trakea berhubungan dengan fistula esofagus. Dengan adanya fistula esofagus, pembesaran paru tidak terjadi, cairan paru dapat lolos ke traktus gastrointestinalis. Atresia trakea atau laring merupakan bagian yang penting dari Sindroma Fraser, yang termasuk selain itu adalah, agenesis renal, mikroptalmia, kriptotalmos, dan polidaktili atau sindaktili. Deteksi sindroma ini penting karena dapat diturunkan secara autosomal dan mempunyai dampak yang nyata pada kehamilan berikutnya. Stenosis trakea lebih sering disebabkan oleh faktor-faktor ekstrinsik seperti tumor-tumor pada leher.44
Fetus dengan atresia/stenosis trakea dikenal juga sebagai sindroma obstruksi saluran nafas atas/ Congenital High Airway Obstruction Syndrome (CHAOS), dimana dijumpai overdistensi paru karena cairan paru. Fetal trakeostomi dapat mencegah timbulnya hidrops fetalis.10
(a)
[image:41.595.88.518.79.291.2]BAB XV
MYELOMENINGOCELE
Myelomeningocele merupakan sebuah anomali spinal kongenital yang kompleks dan menyebabkan berbagai derajat malformasi medula spinalis, atau myelodisplasia. Sering disebut juga sebagai spina bifida dan diklasifikasikan sebagai sebuah defek tabung saraf (yakni, struktur embrionik yang berkembang pada medula spinalis dan otak). Defek tabung saraf merupakan suatu hasil dari proses teratogenik yang menyebabkan gagalnya proses penutupan dan terjadinya diferensiasi yang abnormal pada tabung saraf embrio selama usia gestasi 4 minggu pertama. Defek tabung saraf yang paling sering adalah anenchepali dan myelomeningocele. Anencephali merupakan hasil dari gagalnya penutupan ujung rostral pada tabung saraf, menghasilkan formasi yang tidak sempurna pada otak dan tengkorak. Myelomeningocele disebabkan oleh kegagalan penutupan ujung caudal pada tabung saraf, menghasilkan lesi atau kantong yang terbuka, yang mengandung medula spinalis yang displastik, akar saraf, meningen, batang vertebra, dan kulit.46
Myelomeningocele berhubungan dengan perkembangan yang abnormal pada tabung saraf kranium, yang menghasilkan beberapa karakteristik anomali CNS. Malformasi Chiari tipe II dikarakteristikkan sebagai hipoplasia cerebelum dan dengan derajat yang bervariasi pada pergeseran caudal dari batang otak bagian bawah ke kanalis servikalis yang lebih atas melalui foramen magnum. Deformitas ini menghalangi aliran dan absorpsi cairan cerebrospinal (CSF) dan menyebabkan hidrosefalus, yang terjadi lebih dari 90% pada janin dengan myelomeningocele. Myelomeningocele sering terjadi dengan anomali multipel sistem organ. Anomali yang paling sering ditemukan bersamaan dengan myelomeningocele adalah facial
clefts, malformasi jantung, dan anomali traktus genitourinarius.46
pelayanan antenatal yang tersebar luas di Amerika Serikat, dan membaiknya pemberian nutrisi pada wanita-wanita yang hamil. Jumlah myelomeningocele bervariasi luas di antara negara-negara dan wilayah-wilayah geografi di dalam suatu negara. Defek tabung saraf terjadi (per 10.000 kelahiran hidup) bervariasi dari 0,9 di Kanada dan 0,7 di Prancis Tengah, kemudian 7,7 di Uni Emirat Arab dan 11,7 di Amerika Selatan. Status sosioekonomi yang jelek berhubungan dengan resiko yang tinggi pada banyak populasi. Secara keseluruhan insidensnya adalah 1 dari 2000 kelahiran hidup.46,47
Angka mortalitas untuk bayi-bayi dengan myelomeningocele meningkat pada populasi yang beresiko pada tahun-tahun pertama kehidupan. Angka mortalitas yang dilaporkan pada bayi-bayi yang tidak ditangani adalah 90-100% berdasarkan beberapa penelitian yang dilakukan selama bertahun-tahun. Kebanyakan bayi-bayi yang tidak ditangani akan mati dalam tahun-tahun pertama kehidupan. Kematian dalam 2 tahun pertama kehidupan pada yang tidak diobati, disebabkan karena hidrosefalus dan infeksi intrakranial.46
Pengukuran serum alfa-fetoprotein maternal (AFP), telah digunakan sejak akhir tahun 1970-an. Sampel darah diambil pada awal trimester kedua, dan jika fetus mempunyai sebuah spina bifida yang terbuka, kadar AFP meningkat pada 70-75% kasus. Karena banyak kemungkinan terjadinya hasil yang positif palsu, pemeriksaan serum maternal AFP harus dikonfirmasi dengan amniocentesis untuk menilai cairan
amnion, yaitu dengan adanya acethylcholinesterase pada cairan amnion, sebuah enzim nervus spesifik. Myelomeningocele dapat dideteksi pada 99% fetus yang terkena penyakit ini, melalui kombinasi antara kedua tes ini.46
Beberapa senter menggunakan ultrasonografi fetus sebagai alat skrining primer untuk defek tabung saraf yang selalu dilakukan pada sekitar usia kehamilan 18 minggu. Prosedur ini dapat menghindari resiko abortus pada prosedur amniocentesis, tetapi diagnosa yang akurat tergantung ketrampilan dan pengalaman operator serta kualitas alat ultrasonografi.46
Secara eksperimen, pembedahan pada fetus domba, telah menunjukkan bahwa penutupan medula spinalis yang terpapar dapat menurunkan tingkat displastik medula spinalis dan memelihara fungsi neurologi, terutama dengan melindungi medula spinalis dari trauma dan cairan amnion. Beberapa peneliti menduga bahwa penutupan defek akan mencegah perkembangan malformasi batang otak tipe II Chiari. Efek pencegahannya diduga adalah hasil dari pengembalian semula jumlah cairan cerebrospinal, yang diperlukan untuk kebutuhan aliran darah serta perkembangan vaskularisasi dan jantung fetus yang normal.47
Pada temuan yang lain, diduga banyak defisit yang berhubungan dengan myelomeningocele dapat dikurangi dengan penutupan dini pada defek. Pertanyaan apakah pembedahan fetus untuk myelomeningocele, menguntungkan pada manusia apa tidak, tidak mudah untuk dijawab. Bedah pada fetus menempatkan ibu dan fetus pada resiko komplikasi termasuk tingginya angka persalinan prematur. Kemungkinan adanya komplikasi yang tidak terduga dilaporkan oleh Mazzola dkk, dengan gambaran kehilangan fungsi neurologi dalam tahun-tahun pertama kehidupan pada tiga anak yang telah menjalani koreksi in utero. Tiga-tiganya mempunyai kista dermoid inklusi dan retensi sakral pada medula spinalis.47,49
Sekarang, penutupan defek myelomeningocele dilakukan melalui histerotomi, pada usia gestasi 22-25 minggu, walaupun di masa depan, penutupan dapat dilakukan pada usia gestasi yang lebih awal, untuk lebih meningkatkan luaran janin. Bedah
fetus in utero pada myelomeningocele telah dilakukan lebih dari 220 kali, terutama pada empat senter di Amerika Serikat, dengan keuntungan dan resiko yang belum pasti.47
Teknik penutupan defek in utero yang lain adalah Koreksi Myelomeningocele Intra Uterin/ Intra Uterine Myelomeningocele Repair (IUMR). IUMR telah berhasil dilakukan dari setting laboratorium ke setting klinik selama 20 tahun terakhir. Di seluruh dunia, lebih dari 270 prosedur yang telah dilakukan. Hal ini dapat menguntungkan bagi luaran fetus, tetapi belum terbukti secara statistik. Usaha di masa depan harus memfokuskan pada teknik operasi yang lebih baik agar luaran fetus dapat diperbaiki lebih baik dan resiko dapat diminimalisir. Langkah berikutnya
adalah kemungkinan prosedur IUMR dibantu dengan penggunaan computer
p selama 2 tahun setelah lahir.47,48
[image:45.595.95.510.79.279.2]
Gambar 17. Perkembangan medula spinalis pada fetus.48
Gambar 18. (a) Myelomeningocele dengan pergeseran vermis cerebelum ke bawah. (b) Reseksi
myelomeningocele Intra Uterin per endoskopi (IUMR).47,48
(b)
[image:45.595.91.508.346.543.2]BAB XVI
BIBIR DAN LANGIT-LANGIT SUMBING
Observasi bahwa penyembuhan luka fetus in utero dapat tidak disertai pembentukan
jaringan parut telah meningkatkan kemungkinan untuk mengkoresi bibir sumbing
(cleft lift) dan langit-langit (palatum) untuk menghindari terbentuknya jaringan parut,
restriksi pertumbuhan mid facial, dan deformitas nasal sekunder. Bagaimanapun juga
secara teori, keuntungan untuk melakukan koreksi belum terbukti secara klinis dan
BAB XVII
TWIN REVERSED ARTERIAL PERFUSION SEQUENCE
Twin Reversed Arterial Perfusion (TRAP) Sequence, terjadi hanya pada kehamilan monokorionik dan komplikasinya sekitar 1 persen dari kehamilan kembar monokorionik, dengan insidens 1 dari 35.000 kelahiran hidup. Pada sekuensi TRAP
ini, kembar yang akardiakus/ acephalik menerima semua suplai darah dari kembar yang normal, yang disebut ”pump twin”. Istilah ”reversed perfusion” atau perfusi yang terbalik digunakan untuk menggambarkan skenario keadaan ini, karena darah yang memasuki kembar yang akardiakus/ acephalik melalui aliran darah yang terbalik pada arteri umbilikalis dan keluar melalui vena umbilikalis, yang berlawanan dengan suplai darah yang normal pada fetus.50
Karena sirkulasi yang abnormal dan peningkatan kebutuhan darah yang ekstrim, akibatnya kembar yang abnormal mengganggu jantung pump twin, sehingga terjadi gagal jantung, yang merupakan hal fatal pada sekuensi TRAP. Jika gagal jantung tidak ditangani, pump twin akan mati dalam 50 sampai 75 persen kasus. Hal ini terutama ketika kembar akardiakus/ acephalik lebih besar dari 50 persen dari ukuran pump twin pada perkiraan taksiran berat badan janin.50
Peningkatan kebutuhan jantung pada pump twin, menimbulkan peningkatan cardiac output dan aliran darah ke ginjal, kemudian akan mengakibatkan overproduksi urin fetus (sumber primer berasal dari cairan amnion) dan akhirnya terjadi polihidramnion, yang mengakibatkan terjadinya persalinan prematur.50
Sangat penting untuk menyingkirkan abnormalitas kromosom sebelum melakukan prosedur fetoskopik pada sekuensi TRAP karena insidens abnormalitas kromosom pada pump twin sebanyak 9%. Perbedaan pada berat fetus antara kedua kembar merupakan suatu nilai luaran yang prediktif. Ketika kembar akardiakus/ acephalik
melebihi 50% berat pump twin, kematian terjadi pada 64 kasus. Jika berat kembar akardiakus/ acephalik melebihi 75% berat pump twin, kematian terjadi dalam 95% kasus.50
oklusi dan pemotongan tali pusat karena resiko terlilitnya kedua tali pusat. Ekokardiografi fetus sangat penting untuk memantau pump twin, berguna untuk mengetahui adanya tanda-tanda dekompensasi jantung atau perlunya dilakukan intervensi segera.50
Plihan terapi termasuk seksio parva (seleksi untuk mengangkat kembar yang anomali) dan embolisasi yang dipandu dengan ultrasonografi yang digunakan untuk menghentikan hubungan vaskuler antara kembar yang abnormal dengan twin pump. Kedua prosedur ini mempunyai resiko yang nyata untuk kemungkinan terjadinya kematian kedua fetus. Pendekatan secara fetoskopik telah menjadi pilihan yang utama, McCurdy dkk. 1993, adalah orang pertama yang melaporkan sebuah kasus dengan ligasi umbilikal per fetoskopi untuk mengkoreksi kelainan ini pada usia gestasi 19 minggu, prosedur ini biasanya dilakukan pada usia kehamilan 18-25 minggu. Sekarang telah digunakan teknik yang lebih kurang invasif untuk mengoklusi aliran darah pada kembar yang abnormal, yaitu dengan menggunakan teknologi radiofrekuensi (Radiofrequency Ablation/ RFA) yang menimbulkan panas sehingga mengkauter jaringan. Pendekatan ini membutuhkan panduan ultrasonografi yang kontinyu dengan menggunakan alat berupa jarum 1,5 mm, yang dipasang pada kembar yang abnormal mendekati dari mana pembuluh darah umbilikus yang abnormal memasuki abdomen. Wayar yang sangat halus keluar dari ujung jarum dimana gelombang radio dengan frekuensi tinggi melewati dan menimbulkan panas
(a) (b)
(c)
[image:49.595.109.489.38.437.2]BAB XVIII
TRANSPLANTASI STEM CELL
Karena imonukompetensi pada fetus manusia tidak berkembang sampai usia kehamilan 18 minggu, dianggap fetus akan lebih mentoleransi terhadap antigen asing yang dikenalkan sebelum waktu itu. Untuk alasan ini, transplantasi sel stem hemapoetik fetus dapat mengatasi beberapa penyakit hematologi atau bertindak sebagai media penghantar pada transfer gen untuk pengobatan penyakit-penyakit
genetik yang lain. 55
Transplantasi hematopoietik stem cell in utero dilakukan untuk mengatasi kelainan imunodefisiensi kongenital yang terpilih (yaitu, imunodefisiensi kombinasi yang berat, penyakit granulomatosa kronis, sindroma hiper IgM, dan lain-lain), serta hemoglobinopati (yaitu, penyakit anemia bulan sabit dan thalassemia). Wanita hamil yang mengandung fetus dengan resiko menderita kelainan ini, membutuhkan konseling untuk kemungkinan dilakukannya transplantasi prenatal untuk mengatasi penyakit-penyakit ini, dan sebelumnnya dilakukan pemeriksaan CVS pada usia kehamilan 10 minggu untuk diagnosis dini prenatal.55
Transplantasi stem cell in utero dapat dipertimbangkan apabila dicurigai adanya riwayat keluarga yang menderita penyakit-penyakit tersebut. Pemeriksaan ultrasonografi untuk ”dating” usia gestasi yang akurat, hal tersebut penting untuk penentuan waktu transplantasi, karena hal ini akan mempengaruhi keberhasilan transplantasi. Banyak diagnosis penyakit dapat dibuat dengan analisis genetik pada sel-sel trofoblas yang dikultur dari CVS.53
Setelah diagnosis ditegakkan, pilihan terapi tergantung pada penyakit dan bersifat individual terhadap fetus. Pilhan kuratif misalnya adalah transplantasi sum-sum tulang in utero.55
(a)
(b)
Gambar 20. (a) Variasi dan hambatan pada transplantasi fetus. Sumber –sumber sel donor yang
bervariasi telah digunakan pada transplantasi in utero, tetapi kebanyakan kasus-kasus menggunakan
jaringan janin yang berasal dari abortus elektif atau sum-sum tulang orang tua janin. (b) Stem cells
[image:51.595.103.510.39.207.2]BAB XIX
KESIMPULAN
Ibu dan fetus dipertimbangkan untuk pembedahan hanya ketika resiko kematian atau cacat yang berat pada fetus lebih besar dibandingkan tanpa intervensi dan resiko pada ibu tetap rendah. Beberapa anomali kongenital didiagnosa in utero berkembang menjadi hidrops dengan keseluruhannya terjadi kematian fetus. Anomali-anomali ini dipertimbangkan untuk intervensi bedah fetus. Kontraindikasi pada bedah fetus termasuk penyakit genetik yang letal atau mencacatkan pada fetus, anomali struktur yang lain pada fetus, penyakit medis yang serius pada ibu (contohnya, preeklampsia, atau sindroma cermin maternal). Setelah bedah fetus terbuka, kehamilan ini dan semua kehamilan selanjutnya membutuhkan persalinan dengan seksio cesarea, karena insisi histerotomi tidak diperbolehkan untuk dilakukan partus percobaan. Sebagai perbedaan, bedah pada fetus yang menggunakan teknik invasif yang minimal memungkinkan persalinan pervaginam. Karena bedah fetus dapat membahayakan kehamilan dapat menempatkan ibu dan fetus pada resiko, hal ini harus dipertimbangkan pada senter-senter tertentu dengan penerapan klinis yang berhati-hati. Senter pengobatan fetus membutuhkan kerjasama antara bedah anak,
DAFTAR PUSTAKA
1. Harrison, Michael R., et al., Fetal Surgical Therapy, The Lancet, Vol. 343, Apr 9, ProQuest Medical Library, available at www.proquest.com, 1994 : 897-902.
2. Fetal Surgery, Encyclopedia of Surgery, Answers.com, available at www.answers.com, 2007.
3. Cunningham, F. Gary, et al., Fetal Surgery : Prenatal Diagnosis and Fetal Therapy, Williams Obstetrics, 22nd ed, McGraw-Hill International, New York, 2005 : 332-4.
4. UCSF, Fetal Surgery, The Fetal Treatment Center, available at fetus.ucsfmedicalcenter.org, last updated 7/2/2007.
5. Chlidren’s Hospital, UCSF, available at perc.ucsf.edu, 2007.
6. Myers, Laura B, et al., Anesthesia for Fetal Surgery, Review Article, Paediatric Anesthesia, Vol.12, available at www.blackwell-synergy.com, 2002 : 569-78.
7. Fetal Surgery, Diagnosis/Preparation, Encyclopedia of Surgery, Advameg Inc., available at www.surgeryencyclopedia.com, 2007.
8. Levine, Douglas A., Chorionic Villus Sampling, Transcervical Procedure & Transvaginal Procedure, Memorial Sloan-Kettering Cancer Center, available at www.clarian.org, New York, 1/6/2007.
9. Robertson, Audra, Amniocentesis, Medical Encyclopedia, Medline Plus, available at www.nlm.nih.gov, last updated, 26 November 2007.
10. Albanese, Craig T., Harrison, Michael R., Surgical Treatment for Fetal Disease, The State of the Art, Annals of the New York Academy of Sciences Vol. 847, New York Academy of Sciences, available at www.annalsnyas.org, 1998 : 74-85.
11. Harrison, Michael R., Fetal Surgery, In Fetal Medicine [Special Issue], West J Med, Vol. 159, available at www.pubmedcentral.nih.gov., 1993 : 341-9.
12. POLY GIA 75-0.60 (Single Use Stapler with Absorbable Staples),
Autosuture, Tyco Healthcare Group LP., United States Surgical, available at www.autosuture.com, 2007.
13. Techniques of Fetal Intervention, UCSF, The Fetal Treatment Centre, available at fetus.ucsfmedicalcentre.org, last updated 7/2/2007.
14. Obstructive uropathy, University of Michigan, Fetal Diagnosis & Treatment Center, available at www.med.umich.edu, 2007.
16. Double pigtail ureteral stent in vivo analysis techniques-surgical operations, available at focosi.immunesig.org, 2005.
17. Harrison, Michael R, et al., Antenatal Intervention for Congenital Cystic Adenomatoid Malformation, The Lancet, Vol. 336, ProQuest Medical Library, available at www.proquest.com, Oct 20, 1990 : 965, 966.
18. Werner, Heron, et al., Fetal Case of Congenital Cystic Adenomatoid Malformation of The Lung, Type I, available at www.thefetus.net, Rio de Janeiro, 2007.
19. Asabe, Koushi et al., Fetal Case of Congenital Cystic Adenomatoid
Malformation of The Lung : Fetal Therapy and A Review of The Published Reports in Japan, Case Report, Congenital Anomalies, Vol. 45, available at www.blackwell-synergy.com, 2005 : 96-101.
20. Congenital Cystic Adenomatoid Malformation (CCAM), University of Michigan, Fetal Diagnosis & Treatment Center, available at www.med.umich.edu, 2007.
21. Kays, David W., Congenital Diaphragmatic Hernia : Real Improvements in Survival, Article, NeoReviews, Vol. 7, No. 8, American Academy of Pediatrics, available at neoreviews.aappublications.org, 2006 : 428-39.
22. Grethel, Erich J., Nobuhara, Kerilyn K., Fetal Surgery for Congenital Diaphragmatic Hernia, Review Article, Journal of Paediatrics and Child Health, Vol. 42, Paediatrics and Child Health Division (Royal Australasian College of Physicians), available at www.blackwell-synergy.com, 2006 : 79-85.
23. Lewis, Rachel A., ECMO, available at www.lifespan.org, last updated 12/4/2006.
24. Rodriquez, Edwin, et al., Extracorporal Membrane Oxygenation, emedicine, available at www.emedicine.com, last updated June 14, 2006.
25. Adzick, N. Scott, et al., Pediatric Surgery, First of Two Parts, Review Article, Medical Progress, N Engl J Med, Vol. 342, No. 22, available at www.blackwell-synergy.com, 2000 : 1652.
26. Sacroccocygeal Teratoma (SCT), The Children’s Hospital of Philadelphia, The Center for Fetal Diagnosis and Treatment, available at www.chop.edu, 2007.
27. Children’s Hospital of Wisconsin, Sacroccocygeal Teratoma, available at www.chw.org, 2008.
28. Bhat, Rani Akhil, et al., Fetal Sacrococcygeal Teratoma, The Internet Journal of Gynecology and Obstetrics, Vol. 4, No. 2, available at www.ispub.com, 2005.
30. Fisk, Nichols M, et al., Twin-Twin Transfusion-As Good as It Gets ?, N Engl J Med, Vol. 351, No. 2, July 8th , 2004, available at www.nejm.org, 2004 : 183. 31. Walker, Susan P, et al., Twin-to-Twin Transfusion Syndrome : Is The Future
Getting Brighter?, Australian and New Zealand Journal of Obstetrics and Gynaecology, Vol. 47, available at www.blackwell-synergy.com, 2007 : 158-68.
32. Twin-Twin Transfusion Syndrome, Fetal Care Center of Cincinnati, available at www.fetalcare.org, 2007.
33. Twin-Twin Transfusion Syndrome, The Free Dictionary, Farley Inc., available at medical-dictionary.thefreedictionary.com, 2007.
34. Eronen M, et al., Relationship of Maternal Autoimmune Response to Clinical Manifestations in Children with Congenital Complete Heart Block, Acta Paediatr, Vol. 93, Taylor & Francis healthsciences, available at www.blackwell-synergy.com, 2004 : 803-4.
35. Breur, Johannes M.P.J., et al., Pacemaker Therapy in Isolated Congenital Complete Atrioventricular Block, Journal of Pacing and Clinical Electrophysiology, Vol. 25, No. 12, Futura Publishing Company, Inc., New York, available at www.blackwell-synergy.com, 2002 : 1685.
36. Dell’orfano, Joseph et al., The Monolithic Fetal Pacemaker : Prototype Lead Design for Closed Thorax Deployment, Pace and Electrophysiology, 2002, Vol. 26, available at www.blackwell-synergy.com, 2002 :805-6.
37. DM. Friedman., et al., A Review of Congenital Heart Block, Cardiol, Vol. 16, available at www.health.gov.mt, 2003 : 36-48.
38. Levitsky, David B., et al., Fetal Aqueductal Stenosis Diagnosed
Sonographically : How Grave Is The Prognosis?, AJR, Vol. 164, available at www.ajronline.org ,1995 : 725-30.
39. Prefumo, Federico, Aqueductal Stenosis, Fetal Medicine Unit, available at www.fetalmedicine.ac.uk., London, 1999 : 1-2.
40. Hydrocephalus, Stenosis Aqueductal, Fetal Care Center of Cincinnati, available at www.fetalcarecenter.org, 2007.
41. Wittkopff, M. Meyer., Interventional Fetal Cardiac Therapy-Possible Perspectives and Current Shortcomings, Ultrasound Obstet Gynecol, Vol. 20, available at www. blackwell-synergy.com, 2002 : 527.
42. Normal Fetal Heart, Tiny Tickers, The Tiny Heart Charity, available at www.echocarity.org.uk, 2007.
44. Scott, James N., et al., Tracheal Atresia : Ultrasonoraphic and Pathologic Correlation, Case Report, J Ultrasound Med, Vol. 18, available at www.jultrasoundmed.org, 1999 : 375-7.
45. The EXIT Procedure : Principles, Pitfalls and Progress, Fetal Care Center of Cincinnati, available at www.fetalcarecenter.org, 2007.
46. Kolaski, Kat, et al., Myelomeningocele, emedicine, last updated April 26th , 2006, available at www.emedicine.com, 2006 : 1-17.
47. Jobe, Alan H., Fetal Surgery for Myelomeningocele, Perspective, N Engl J Med, Vol. 347, No. 4, July 25, 2002 available at www.nejm.org, 2002 : 230-1.
48. Tulipan, Noel, Intrauterine Closure of Myelomeningocele : An Update, Neurosurg Focus, Vol. 16, No. 2, available at www.medscape.com, 2004.
49. Mazzola, Catherine A, et al., Dermoid Inclusion Cysts and Early Spinal Cord Tethering After Fetal Surgery for Myelomeningocele, Brief Report, N Engl J Med, Vol. 347, No. 4, July 25, 2002, available at www.nejm.org, 2002 : 256-9.
50. Twin Reversed Arterial Perfusion Sequence (TRAP), The Children’s Hospital of Philadelphia, The Center for Fetal Diagnosis and Treatment, available at www.chop.edu, 2007.
51. Twin Reversed Arterial Perfusion Sequence (TRAP), University of Michigan, Fetal Diagnosis & Treatment Center, available at www.med.umich.edu, 2007.
52. Twin Reversed Arterial Perfusion Sequence (TRAP), Multiple Pregnancy, available at www.centrus.com, 2007.
53. Twin Reversed Arterial Perfusion Sequence (TRAP), Fetal Care Center of Cincinnati, available at www.fetalcarecenter.org, 2007.
54. H. Lee Moffitt Cancer Center and Research Institute, Stem Cell
Transplantation, Cancer Control, Vol. 11, No. 2, available at doctor.medscape.com, 2004.