PENINGKATAN PRODUKSI TELUR IKAN NILEM
Osteochilus
hasselti
SEBAGAI SUMBER KAVIAR MELALUI KOMBINASI
OODEV, rGH DAN MINYAK IKAN PADA PAKAN
RADHI FADHILLAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa Tesis berjudul Peningkatan Produksi Telur Ikan Nilem (Osteochilus hasselti) Sebagai Sumber Kaviar Melalui Kombinasi Oodev, rGH dan Minyak Ikan Pada Pakan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Maret 2016
Radhi Fadhillah
RINGKASAN
RADHI FADHILLAH. Peningkatan Produksi Telur Ikan Nilem (Osteochilus hasselti) Sebagai Sumber Kaviar Melalui Kombinasi Oodev, rGH dan Minyak Ikan Pada Pakan. Dibimbing oleh AGUS OMAN SUDRAJAT dan MUHAMMAD AGUS SUPRAYUDI.
Ikan nilem (Osteochilus hasselti) merupakan salah satu spesies ikan air tawar asli Indonesia yang telurnya digemari masyarakat, karena memiliki cita rasa yang lezat serta berpeluang dijadikan pengganti kaviar dari ikan sturgeon. Namun saat ini, pemanfaatan telur ikan nilem untuk dijadikan kaviar masih belum maksimal disebabkan produksi telur pada petani tambak masih tergolong rendah dibanding di alam. Peningkatan kematangan gonad secara hormonal dan pengkayaan nutrisi merupakan salah satu metode yang efektif dalam proses peningkatan produksi dan kualitas telur. Oleh sebab itu, penelitian ini dilakukan bertujuan untuk mengevaluasi penambahan oodev dan rGH serta minyak ikan ke dalam pakan agar dapat meningkatkan proses kematangan gonad dan kualitas telur ikan nilem.
Penelitian ini dilaksanakan pada bulan Januari - Maret 2015. Rancangan yang digunakan adalah rancangan acak lengkap (RAL) dengan empat perlakuan dan 20 ekor ulangan individu. Ikan nilem yang digunakan berukuran 135±27,25 g dipelihara dalam hapa berukuran 2×2×1m dengan kepadatan 20 ekor hapa-1. Perlakuan yang digunakan yaitu OMiGH (Oodev+Minyak Ikan+rGH ); OMi: (Oodev+Minyak Ikan); OGH: (Oodev+rGH); GHMi: (rGH+Minyak Ikan); Kontrol: (Pakan Komersil). Dosis hormon yang digunakan yaitu Oodev 1 mL kg-1 ikan, rGH 0,1 mg kg-1 ikan dan dosis minyak ikan yaitu 30 g kg-1 pakan. Pemeliharaan ikan dilakukan selama 42 hari. Pemberian pakan selama pemeliharaan diberikan sebanyak tiga kali sehari pada pukul 07.00, 12.00 dan 17.00 WIB dengan feeding rate (FR) pakan sebesar 3% dari bobot biomassa ikan. Parameter yang diamati yaitu profil estradiol-17β dalam darah, Hepatosomatic Indeks (HSI), Gonadosomatic Indeks (GSI), pertambahan bobot (gonad-somatik), diameter telur, fekunditas, proksimat telur, dan analisis asam lemak telur ikan.
Hasil pengamatan kualitas telur dari hasil proksimat menunjukkan bahwa penambahan hormonal dan nutrisi pada pakan dapat meningkatkan protein telur pada ikan nilem sampai hari ke 42 sebesar 32,07%. Hasil analisis asam lemak juga menunjukkan bahwa melalui kombinasi hormon dan nutrisi ke dalam pakan dapat meningkatkan nilai Monounsaturated Fatty Acids (MUFA) pada telur ikan nilem sebesar 13,77%. Berdasarkan beberapa parameter di atas menunjukkan bahwa kombinasi Oodev, rGH dan Minyak Ikan pada ikan nilem dapat meningkatkan produksi dan kualitas telur ikan nilem serta berpeluang dijadikan sumber kaviar.
SUMMARY
RADHI FADHILLAH. The increasing Fish Eggs Production of Nilem (Osteochilus hasselti) As a Caviar Source Through Combination Oodev, rGH And Fish Oil In Feed. Supervised by AGUS OMAN SUDRAJAT and MUHAMMAD AGUS SUPRAYUDI
Nilem (Osteochilus hasselti) is a freshwater fish species native to Indonesia whose eggs favored by people, because it has delicious taste as well as the opportunity to substitute caviar from sturgeon. Nowadays, utilization of nilem eggs as caviar still not maximized due to low eggs production in farmers pond compared to naturally. The effective methods in process of increasing eggs production and its quality could be reached with hormonal by increase gonadal maturation and nutrient enrichment. Therefore, this research aim to evaluate the Oodev and rGH addition with fish oil added to the feed in order to increase the process of nilem gonad maturation and eggs quality.
This research was conducted in January - March 2015. The experimental was arranged in completely randomize design with five treatments and 20 fishes as replications. Fishes with initial body weight 135 ± 27.25 g maintained in hapa measuring 2×2×1m with 20 fishes hapa-1 density. The treatment used were OMiGH (Oodev+Fish Oil+rGH); OMi: (Oodev+Fish Oil); OGH: (Oodev+rGH); GHMi: (rGH+Fish Oil); Controls: (Commercial Feed). Dose of hormones used consist of Oodev 1 mL kg-1 fish, rGH 0,1 mg kg-1 of fish and fish oil doses 30 g kg-1 feed. Fishes were reared for 42 days. During maintenance period, fishes were given feed three times a day at 07:00 am, 12:00 am and 17:00 pm with feeding rate (FR) of 3% of fish weight biomass. Parameters observed that estradiol-17β profile in blood, Hepatosomatic Index (HSI), Gonadosomatic Index (GSI), weight gain (gonad-somatic), the diameter of the eggs, fecundity, egg proximate, and analysis of fatty acidscontent of fish eggs.
The results showed that the addition of Oodev hormone, rGH and fish oil (OMiGH) could accelerated the gonad maturity process of nilem marked by increase estradiol-17β concentrations in the blood on day 28 amounted 1,324 ng mL-1. The peak increase of HSI at each treatment occurs on day 28 except the control which was still increasing. The highest value of GSI was observed on day 28 at OMiGH treatment obtained 23.567%, while on day 42 obtained at OGH treatment as much as 25.309%. The statistical results showed that the addition of Oodev hormone, rGH and fish oil into nilem’s feed affect fish weight gain (P <0.05) significantly. Gonad weight percentage was highest at OMiGH treatment with 73,03% of the fish weight gain of 60.33 g tail-1. Statistical test results at day 28 showed OMiGH treatment could affected nilem eggs diameter (P <0.05). The highest fecundity observation obtained on day 28 at OMiGH treatment as much as 290265 grain kg-1, while on day 42 the highest fecundity obtained at OGH treatment which amounted 266517 grain kg-1
feeds could increase nilem egg production and its quality as well as the opportunity as caviar source.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Ilmu Akuakultur
RADHI
FADHILLAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2016
PENINGKATAN PRODUKSI TELUR IKAN NILEM
Osteochilus
hasselti
SEBAGAI SUMBER KAVIAR MELALUI KOMBINASI
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini yang berjudul Peningkatan Produksi Telur Ikan Nilem (Osteochilus hasselti) Sebagai Sumber Kaviar Melalui Kombinasi Oodev, rGH dan Minyak Ikan Pada Pakan dapat terselesaikan. Karya ilmiah ini bersumber dari hasil penelitian yang dilaksanakan sejak bulan Januari - Maret 2015 di Balai Besar Perikanan Budidaya Air Tawar (BBPBAT) Sukabumi.
Terima kasih penulis ucapkan kepada Bapak Dr Ir Agus Oman Sudrajat dan Bapak Dr Ir Muhammad Agus Suprayudi selaku pembimbing yang telah memberikan bimbingan dan arahan kepada penulis selama penyusunan perencanaan penelitian hingga penyelesaian tesis ini. Terima kasih juga penulis sampaikan kepada bapak Dr Ir Odang Carman, M.Sc selaku dosen penguji tamu dan selaku Ketua Program Studi Ilmu Akuakultur ibu Dr Dinamella Wahjuningrum, M.Si yang telah memberikan masukan dan saran dalam perbaikan penulisan tesis ini.
Penghargaan tak terhingga penulis sampaikan kepada Bapak (Alm) M. Amin Idris dan Ibu Chadidjah serta kakak-kakak yang selama ini telah memberikan doa, perhatian, nasihat, motivasi dan kasih sayang yang tulus kepada penulis selama ini. Terima kasih kepada bapak Ir. Agus Sasongko, M.Si dan bapak Boedi Rahman, M.Si selaku pembimbing lapang atas segala kebaikan serta arahan yang telah bapak berikan. Tidak lupa juga terima kasih yang sebesar-besarnya kepada teman-teman Akuakultur 2013 dan keluarga Aceh yang ada di Bogor yang telah membantu serta memberikan semangat dalam proses penelitian sampai selesainya tesis ini.
Semoga Allah SWT membalas kebaikan yang berlipat ganda kepada semua pihak yang telah memberikan bimbingan, bantuan dan motivasi kepada Penulis. Amin.
Bogor, Maret 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Rumusan Masalah 2
Hipotesis 3
Tujuan 3
Manfaat 3
2 METODE 4
Tempat dan waktu 4
Rancangan Penelitian 4
Hewan Uji 4
Pemeliharaan Ikan 4
Parameter Uji 5
Analisis Data 7
3 HASIL DAN PEMBAHASAN
Hasil 8
Pembahasan 14
4 SIMPULAN DAN SARAN 18
Simpulan 18
Saran 18
DAFTAR PUSTAKA 19
LAMPIRAN 23
DAFTAR TABEL
1 Pertambahan Bobot Ikan Nilem Selama Pemeliharaan (gonad dan
somatik) 10
2 Fekunditas Telur Ikan Nilem Selama Pemeliharaan 11
3 Proksimat Telur Ikan Nilem 12
4 Kandungan Asam Lemak Telur Ikan Nilem Pada Akhir Pemeliharaan 12
DAFTAR GAMBAR
1 Modifikasi Diagram Alur Mekanisme Kerja Hormon dan Nutrisi
Perlakuan Induksi Maturasi 3
2 Konsentrasi Estradiol-17β Ikan Nilem Pada Setiap Perlakuan 8 3 Nilai Hepatosomatic Index Ikan Nilem Selama Pemeliharaan 9 4 Nilai Gonadosomatic Index Ikan Nilem Selama Pemeliharaan 9 5 Persentase Pertambahan (Gonad dan Somatik) Ikan Nilem Selama
Pemeliharaan 10
6 Diameter Telur Ikan Nilem Selama Pemeliharaan 11 7 Histologi Gonad Ikan Nilem hari 0 (awal) dan Gonad Ikan Hari
ke-42 13
DAFTAR LAMPIRAN
1 Gambaran Gonad Ikan Nilem Hari ke-28 dan Hari ke-42 Pemeliharaan 23 2 Analisis Ragam dan Uji Lanjut Duncan dari Hasil Parameter Uji
Diameter Telur 24
3 Analisis Ragam Dan Uji Lanjut Duncan Dari Hasil Parameter Uji
Pertambahan Bobot Ikan Nilem 25
1 PENDAHULUAN
Latar Belakang
Ikan nilem (Osteochilus hasselti) merupakan salah satu spesies ikan air tawar asli Indonesia yang telurnya digemari masyarakat, karena memiliki citarasa yang lezat serta berpeluang dijadikan pengganti kaviar dari ikan sturgeon (Acipencer sturio dan Acipencer huso) (Subagja et al. 2007). Kaviar merupakan makanan yang bersumber dari telur ikan sturgeon dan ikan salmon yang telah mengalami proses fermentasi (Bledsoe et al. 2003; Caprino et al. 2008). Makanan mewah dan khas yang berasal dari Rusia dan Iran ini merupakan produk yang memiliki nilai gizi tinggi serta kaya akan Vitamin A dan Vitamin B kompleks (Altug dan Bayrak 2003; Russianfoods 2014). Menurut Guinnessworldrecords (2013), kaviar termasuk makanan termahal di dunia yang harganya mencapai $34.500 atau Rp.414 juta kg-1. Peningkatan permintaan yang tinggi terhadap telur penghasil kaviar menyebabkan terjadinya eksploitasi yang berlebihan terhadap ketersediaan stok ikan sturgeon di alam (Caprino et al. 2008).
Beberapa aspek yang menyebabkan ikan nilem berpotensi dijadikan kaviar yaitu berat gonad dapat mencapai 18-26% dari berat tubuhnya (Soeminto et al. 2000). Tingkat kematangan gonad ikan nilem lebih cepat dibandingkan ikan sturgeon. Masa kematangan gonad ikan nilem untuk dapat menghasilkan telur dicapai pada umur 1-1,5 tahun sedangkan ikan sturgeon selama 14 tahun. Selain itu masa rematurasi yang dibutuhkan ikan nilem hanya selama 3 bulan (Novianto 2013). Kandungan protein telur ikan nilem lebih tinggi dibandingkan dengan kandungan protein telur ikan sturgeon yaitu sebesar 25,39% (Caprino et al. 2008).
Pada saat ini, potensi pemanfaatan telur ikan nilem untuk dijadikan kaviar masih belum dapat dimaksimalkan. Hal ini dikarenakan tingkat produksi yang dihasilkan secara buatan masih tergolong rendah. Peningkatan produksi telur sangat erat kaitannya dengan proses kecepatan pematangan gonad ikan. Pematangan gonad secara hormonal merupakan salah satu metode yang efektif dalam meningkatkan kematangan gonad. Beberapa penelitian telah dilakukan dalam meningkatkan masa kematangan gonad secara hormonal yaitu pada ikan patin siam (Pangasianodon hypophthalmus) (Rachman 2013; Dewi 2015), Belut sawah (Monopterus albus) (Putra 2013), dan ikan sidat (Anguilla bicolor) (Sugati 2013).
Oodev merupakan premiks hormon yang mengandung pregnant mare serum gonadotropin (PMSG) dan antidopamin. Beberapa penelitian telah membuktikan kinerja dari hormon ini dalam meningkatkan kematangan gonad. Farastuti (2014) melaporkan, hasil induksi oodev sebesar 0,5 mL kg-1 bobot ikan dapat mempercepat kematangan gonad ikan tor soro dalam waktu 2 minggu. Penyuntikan oodev sebesar 10 IU kg-1 induk ikan nila dapat meningkatkan kinerja reproduksi mencapai 300% dan meningkatkan fekunditas telur sebesar 2065 butir ekor-1 (200 g) (Rahmatia 2013). Nainggolan et al. (2014) menyatakan, suplementasi Spirulina platensis sebanyak 3% dan penyuntikan oodev dengan 15 IU kg-1 dapat meningkat kematangan gonad dan meningkatkan fekunditas ikan lele (Clarias sp.) sebesar 48953 butir kg-1.
2
neuroendokrin dalam mengendalikan hormon pertumbuhan dan reproduksi (Hull dan Harvey 2002; Cao et al. 2014). Hormon recombinant growth hormone (rGH) merupakan cDNA GH (growth hormone) dari berbagai spesies vertebrata, termasuk jenis ikan yang diproduksi dalam jumlah besar menggunakan bioreaktor
Escherichia coli (Alimuddin et al. 2010). Menurut Sirotkin (2005), hormon GH dapat digunakan untuk meningkatkan reproduksi yaitu spermatogenesis dan
oogenesis, ovulasi, perkembangan embrio, dan kelangsungan hidup. Namun, ketersediaan GH pada ikan sangat sedikit dan terbatas (Tsai et al. 1995). Untuk mengatasinya, dapat memanfaatkan rGH (GH eksogenous) yang menunjukkan fungsi yang sama dengan GH endogenous yang terdapat pada ikan (Acosta et al. 2007). Pemberian rekombinan GH (rGH) dapat meningkatkan pertumbuhan ikan seperti pada ikan grass carp (Ctenopharyngodon idella) (Lin et al. 1995), ikan baronang (Siganus guttatus) (Funkenstein et al. 2005) dan ikan nila (Oreochromis niloticus) (Acosta et al. 2007). Cao et al. (2014) melaporkan, peningkatan ekspresi gen-rGH pada gonad ikan mas transgenik lebih tinggi dibandingkan pada organ-organ lainnya seperti otot, hati dan darah. Penelitian pemberian hormon rGH secara oral dengan dosis 0,1 mg kg-1 bobot udang selama 14 hari dapat meningkatkan fekunditas pada udang vaname sebesar 86% dibandingkan ablasi (Qonitah 2013).
Asam lemak esensial berasal dari minyak ikan mempunyai peran penting terhadap penampilan reproduksi ikan, baik dalam pembentukan gonad maupun pematangan gonad. Kenaikan asam lemak esensial sampai dengan batas tertentu pada induk akan mempengaruhi kualitas telur, larva, dan proses pematangan gonad ikan (Fernandez et al. 1998). Hasil penelitian Darwisito (2006) menunjukkan penambahan minyak ikan kedalam pakan sebanyak 30 gr kg-1 pakan dapat meningkatkan fekunditas telur ikan nila sebesar 600,20±7,66 butir ekor-1 dan Sink et al. (2010) melaporkan penambahan minyak ikan 10% pada pakan dapat meningkatkan fekunditas telur ikan baung (Ictalurus punctatus
)
sebesar 6420 butir kg-1 ikan. Selain itu Keong dan Wang (2011), melaporkan penambahan minyak ikan sebesar 9,16% pada pakan induk ikan nila (O. niloticus) dapat meningkatkan fekunditas telur sebesar 870±73 butir ekor-1 ikan.Berdasarkan hal tersebut, maka dibutuhkan suatu kajian dalam meningkatkan produksi dan kualitas telur ikan nilem melalui penambahan kombinasi oodev, rGH dan minyak ikan kedalam pakan.
Rumusan Masalah
3
perkembangan telur. Alur mekanisme kerja hormon pada perlakuan lebih jelas ditunjukkan pada Gambar 1. Minyak ikan digunakan sebagai sumber utama asam lemak (n-3) yang bertujuan untuk menambah nutrisi dalam proses pembentukan telur sehingga dapat meningkatkan kualitas telur ikan nilem. Oleh karena itu, diharapkan kombinasi premiks oodev dan rGH serta penambahan minyak ikan ke dalam pakan dapat mempercepat pematangan gonad, sehingga dapat meningkatkan produksi dan kualitas telur pada ikan nilem.
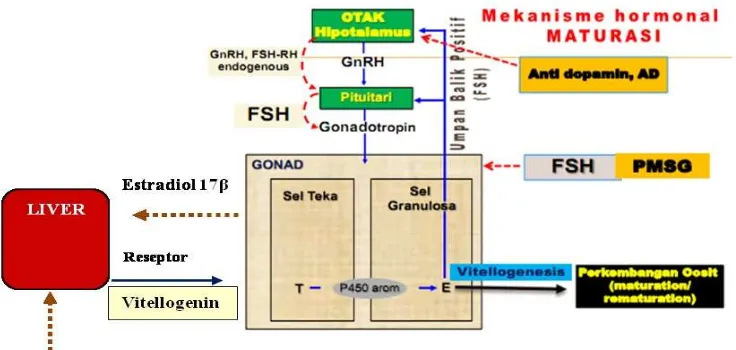
Berikut ini merupakan gambar skema mekanisme hormonal dan nutrisi terhadap percepatan kematangan gonad ikan (Gambar 1).
Gambar 1. Modifikasi diagram alur mekanisme kerja hormon dan nutrisi perlakuan induksi maturasi (Sudrajat 2010).
Hipotesis
Penambahan kombinasi Oodev, rGH (recombinant growth hormone) dan minyak ikan ke dalam pakan dapat meningkatkan produksi dan kualitas telur pada ikan nilem.
Tujuan
Penelitian ini bertujuan untuk mengevaluasi pengaruh pemberian hormon oodev dan recombinant growth hormone (rGH) dan minyak ikan ke dalam pakan terhadap peningkatan produksi dan kualitas telur pada ikan nilem.
Manfaat
Manfaat penelitian ini yaitu menghasilkan metode dalam mempercepat
kematangan gonad sehingga dapat meningkatkan produksi dan kualitas telur ikan nilem.
2 METODE
Tempat dan Waktu
Penelitian ini dilaksanakan pada bulan Januari – Maret 2015, di Balai Besar Perikanan Budidaya Air Tawar (BBPBAT) Sukabumi. Analisis histologi dilakukan di Laboratorium Histologi dan Fisiologi Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Analisis proksimat asam lemak telur dan dilakukan di Laboratorium Kimia Terpadu Institut Pertanian Bogor.
Prosedur Penelitian Rancangan Penelitian
Hormon yang digunakan dalam penelitian ini yaitu Oodev (oocyte development) dan rGH (recombinant growth hormone). Penambahan nutrisi yang digunakan pada penelitian ini yaitu minyak ikan (Mi). Penelitian ini menggunakan metode eksperimental rancangan acak lengkap (RAL) dengan empat perlakuan dan 20 ekor ulangan individu. Dosis hormon yang digunakan yaitu Oodev 1 mL kg-1 ikan, rGH 0,1 mg kg-1 ikan (Qonitah 2013 dan Muhammad 2014) dan dosis kolam Balai Besar Perikanan Budidaya Air Tawar (BBPBAT) Sukabumi.
Pemeliharaan Ikan
Ikan nilem yang telah diperoleh terlebih dahulu diadaptasi di hapa selama kurang lebih selama 3 hari, hal ini bertujuan menghindari ikan mengalami stres yang diakibatkan perubahan tempat pemeliharaan sebelumnya. Pakan yang diberikan selama masa adaptasi yaitu pakan komersil protein 30%.
Setelah adaptasi ikan nilem dipelihara dalam hapa yang berukuran 2×2×1m dengan kepadatan 20 ekor hapa-1 selama 42 hari. Pemberian pakan diberikan 3 kali sehari (jam 07.00; 12.00; 17.00 WIB) sebanyak 3% dari bobot biomassa ikan.
Pembuatan dan Pemberian Pakan Oodev, rGH dan Minyak Ikan.
5
OMi; oodev 1 mL kg-1 ikan dan rGH 0,1 mg kg-1 ikan untuk perlakuan OGH; rGH 0,1 mg kg-1 ikan dan minyak ikan 30 g kg-1 pakan untuk perlakuan GHMi. Pelarut oodev dan rGH yaitu larutan NaCl konsentrasi 0,9%, serta pelarut yang digunakan untuk minyak ikan yaitu larutan etanol.
Metode pembuatan pakan yang mengandung hormon dilakukan dalam 2 tahap. Tahap pertama yaitu pencampuran minyak ikan dengan larutan etanol, kemudian disemprot pada pakan selanjutnya dikeringkan. Tahap kedua yaitu pencampuran hormon dengan larutan fisiologis kemudian ditambahkan putih telur (binder) sebanyak 1 butir kg-1 pakan dan selanjutnya disemprotkan ke pakan. Pakan yang telah dicampur minyak ikan dan hormon tersebut dikering-anginkan.
Pembuatan pakan dilakukan dua minggu sekali.
Parameter Uji
Parameter yang diuji selama penelitian terdiri dari performa reproduksi dan kualitas telur ikan nilem. Pengamatan performa reproduksi diamati melalui parameter profil estradiol-17β dalam darah, gonadosomatic index (GSI),
Hepatosomatic index (HSI), pertambahan bobot (gonad-somatik), diameter telur, fekunditas dan histologi gonad. Pengamatan kualitas telur diamati melalui analisis proksimat dan asam lemak.
Pertambahan Bobot
Pengukuran bobot dilakukan pada ikan nilem bertujuan untuk mengamati pertumbuhan bobot ikan nilem (Osteochilus hasselti) selama pemeliharaan. Pengujian pertumbuhan bobot ikan selama pemeliharaan digunakan persamaan sebagai berikut.
PB = Bt– B0 Keterangan: PB : Pertambahan bobot
Bt : bobot rata-rata ikan nilem pada akhir penelitian B0 : bobot rata-rata ikan nilem pada awal penelitian
Gonadosomatic Index (GSI)
Pengukuran Gonadosomatic Index dilakukan pada 0, 14, 28 dan H-42. Ikan nilem sebelum dibedah ditimbang bobot tubuh terlebih dahulu, selanjutnya dilakukan pengambilan dan penimbangan gonad. Gonadosomatic Index (GSI) diukur melalui persamaan menurut Crim et al. (1988).
GSI % =Wg g
W (g) x 100 Keterangan: GSI : Gonadosomatic Index
Wg : Bobot gonad (g) W : Bobot tubuh ikan (g)
Hepatosomatic Index (HSI)
Pengukuran Hepatosomatic Index dilakukan melalui penimbangan berat hati. Pengukuran HSI dilakukan pada H-0, H-14, H-28, dan H-42. Kemudian di analisis dengan menggunakan persamaan (Busacker et al. 1990).
6
Keterangan: HSI : Hepatosomatic Index
Wg : Bobot hati (g) W : Bobot tubuh ikan (g)
Diameter Telur
Diameter telur diukur di bawah mikroskop dengan menggunakan mikrometer dengan pembesaran 10 kali. Pengamatan diameter telur dilakukan pada hari ke-28 dan hari ke-42.
Fekunditas
Fekunditas diasumsikan sebagai jumlah telur yang terdapat dalam ovari. Fekunditas dihitung pada akhir penelitian dengan menggunakan metode sub-contoh bobot gonad atau disebut metode gravimetrik. Cara memperoleh telur yaitu mengambil ikan betina dengan mengangkat seluruh gonadnya dari dalam perut ikan dan ditimbang. Kemudian gonad tersebut diambil sebagian untuk ditimbang dengan menggunakan timbangan elektrik, selanjutnya butiran telur dihitung. Fekunditas dihitung dengan persamaan berikut.
Keterangan : F : Fekunditas (butir); G : Bobot tubuh (g);
Q : Bobot gonad contoh (g);
n : Jumlah telur pada gonad contoh (butir).
Histologi Gonad
Pengambilan sampel untuk histologi gonad dilakukan pada awal penelitian dan akhir penelitian. Histologi gonad dilakukan berdasarkan metode Gunarso (1989). Ikan dibedah dan diambil gonad nya, kemudian difiksasi dalam larutan
buffered neutral formalin (BNF) (campuran asam pikrat, formalin dan asam asetat dengan perbandingan 15:5:1) selama 24 jam. Berikutnya dipindahkan kedalam alkohol 70% untuk disimpan sebelum dilakukan pembuatan preparat.
Profil Hormon
Pengukuran konsentrasi estradiol-17β dalam darah dilakukan pada awal H-0, H-14, H-28 dan H-42. Ikan yang akan diambil sampel darahnya, terlebih dahulu dibius dengan menggunakan anestesi MS-222. Selanjutnya, darah diambil pada bagian pangkal ekor sebanyak 1mL dengan menggunakan syringe volume 3mL yang sudah dicuci dengan anti koagulan (larutan citrate-phosphate-dextrose), kemudian dimasukkan ke dalam microtube volume 1,5 ml dan disimpan dalam
cool box. Sampel darah di sentrifuse pada kecepatan 10000 rpm selama 10-50 menit. Supernatan plasma darah diambil dan dimasukkan ke dalam microtube
baru. Bila pengukuran supernatan plasma tidak dilakukan secara langsung, sampel disimpan dalam freezer pada suhu minus 4 0C.
Analisis Proksimat Telur Ikan
Analisis proksimat telur ikan uji meliputi kandungan protein, lemak, abu, dan kadar air. Analisis proksimat untuk protein kasar dilakukan dengan metode
7
menggunakan pemanasan dalam tanur pada suhu 400-600 0C, kadar air dengan menggunakan metode pemanasan dalam oven pada suhu 105-110oC. Prosedur tahapan uji dilampirkan pada lampiran 4.
Analisis Kandungan Asam Lemak
Pengambilan sampel telur dilakukan pada akhir penelitian. Kandungan asam pada telur dianalisis dengan metode GC (Gas Chromatography).
Analisis Data
Data yang diperoleh dari hasil penelitian ditabulasi menggunakan program
microsoftexcel 2007. Untuk parameter pertambahan bobot dan diameter telur ikan nilem (Osteochilus hasselti) dianalisis menggunakan sidik ragam ANOVA dengan selang kepercayaan 95% menggunakan program SPSS 16.0. Jika data yang diperoleh menunjukkan hasil yang berbeda nyata, maka dilanjutkan dengan uji
3 HASIL DAN PEMBAHASAN
Hasil
Penambahan kombinasi hormon Oodev dan rGH (recombinant growth hormone) serta penambahan minyak ikan kedalam pakan dapat mempengaruhi performa reproduksi dan kualitas telur ikan nilem (O. hasselti). Hal ini dapat dilihat dari hasil pengamatan estradiol-17β, gonadosomatic index (GSI) dan
hepatosomatic index (HSI), pertambahan bobot (gonad dan somatik), diameter telur, fekunditas, proksimat telur, kandungan asam lemak, dan histologi gonad.
Profil Estradiol-17β
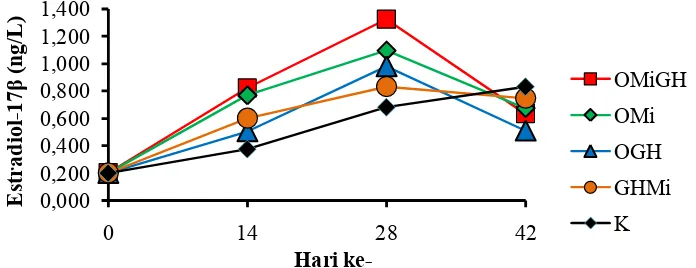
Hasil pengamatan konsentrasi hormon estradiol-17β pada ikan nilem menunjukkan bahwa semua perlakuan mengalami peningkatan (Gambar 2).
Gambar 2. Konsentrasi estradiol 17-β Ikan Nilem pada setiap perlakuan. OMiGH (Oodev+Minyak Ikan+rGH); OMi (Oodev+Minyak Ikan); OGH (Oodev + rGH); GHMi (rGH+Minyak Ikan); dan Kontrol (K).
Pada awal pengamatan sebelum penyuntikan konsentrasi estradiol-17β sebesar 0,201 ng mL-1. Konsentrasi estradiol-17β mengalami peningkatan sampai hari ke-28, namun terjadi penurunan pada akhir penelitian, kecuali pada perlakuan kontrol. Hari ke-14 perlakuan OMiGH (Oodev+Minyak Ikan+rGH) menunjukkan konsentrasi estradiol-17β tertinggi yaitu 0,769 ng mL-1 dan terendah terdapat pada perlakuan kontrol sebesar 0,375 ng mL-1. Hari ke-28 konsentrasi estradiol-17β tertinggi terdapat pada perlakuan OMiGH yaitu 1,324 ng mL-1 dan terendah terdapat pada perlakuan kontrol sebesar 0,681 ng mL-1. Konsentrasi estradiol-17β pada setiap perlakuan mengalami penurunan kecuali, pada perlakuan kontrol yang masih mengalami peningkatan sebesar 0,830 ng mL-1. Berdasarkan hasil yang telah diperoleh penambahan oodev, minyak ikan dan rGH ke dalam pakan dapat meningkatkan konsentrasi estradiol-17β dibandingkan dengan kontrol.
9
Hepatosomatic Index (HSI) dan Gonadosomatic Index (GSI)
Pengamatan HSI pada ikan nilem dapat dilihat pada Gambar 3. Nilai HSI pada hari ke-28 setiap perlakuan mengalami peningkatan. Nilai HSI tertinggi terdapat pada perlakuan OMiGH sebesar 1,642% diikuti oleh perlakuan GHMi sebesar 1,600%, OMi sebesar 1,525%, kontrol sebesar 1,372% dan terendah terdapat pada perlakuan OGH hanya sebesar 1,360%. Pada akhir penelitian (hari ke-42) pada setiap perlakuan mengalami penurunan namun pada perlakuan kontrol masih mengalami peningkatan mencapai 1,689%.
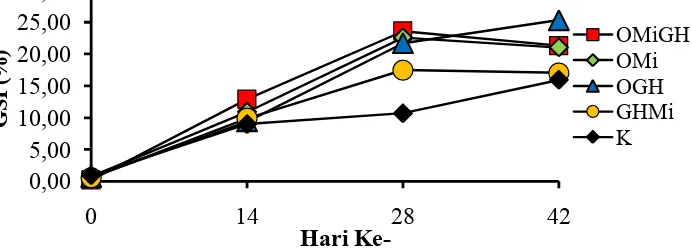
Pengamatan nilai GSI ikan nilem menunjukkan bahwa semua perlakuan mengalami peningkatan sampai hari ke-28 (Gambar 4). Peningkatan nilai GSI tertinggi pada hari ke-28 terdapat pada perlakuan OMiGH sebesar 23,56% kemudian diikuti perlakuan OMi (Oodev+Minyak Ikan) sebesar 22,57%, OGH (Oodev + rGH) sebesar 21,68%, GHMi (rGH + Minyak Ikan) sebesar 17,45% dan terendah terdapat pada perlakuan kontrol hanya sebesar 10,67%.
Pada akhir penelitian perlakuan OGH dan kontrol masih mengalami peningkatan GSI sebesar 25,30% dan 15,92%, namun terjadinya penurunan nilai GSI pada perlakuan OMiGH, OMi dan OGH sebesar 21,28%, 20,99% dan 17,02%.
Gambar 4. Nilai Gonadosomatic Index (GSI) Ikan Nilem Selama Pemeliharaan. OMiGH(Oodev+Minyak Ikan + rGH); OMi (Oodev + Minyak Ikan); OGH (Oodev + rGH); GHMi (rGH + Minyak Ikan); dan Kontrol (K). Gambar 3. Nilai Hepatosomatic Index (HSI) Ikan Nilem Selama Pemeliharaan.
10
Pertambahan Bobot (Gonad dan Somatik)
Hasil pengamatan pertambahan bobot (somatik dan gonad) selama penelitian disajikan pada Tabel 1.
Keterangan: Superskrip yang berbeda pada kolom yang sama menunjukkan perbedaan yang nyata (P<0,05). OMiGH (Oodev+Minyak Ikan+rGH); OMi (Oodev+Minyak Ikan); OGH (Oodev+rGH); GHMi (rGH+Minyak Ikan); dan Kontrol (K).
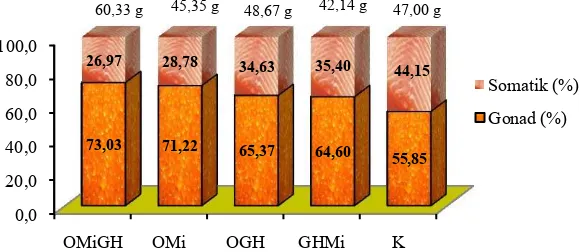
Hasil pengamatan persentase pertambahan (gonad dan somatik) ikan nilem selama pemeliharaan ditunjukkan pada Gambar 5. Pertambahan bobot ikan tertinggi selama penelitian terdapat pada perlakuan OMiGH sebesar 60,33 g ekor-1 dan terendah terdapat pada perlakuan OMi sebesar 45,35 g ekor-1. Hasil statistik menunjukkan bahwa dengan adanya penambahan rGH pada perlakuan yang ditambahkan Oodev dan minyak ikan berpengaruh nyata terhadap pertambahan bobot ikan dibanding kontrol (P<0,05).
Pertambahan bobot ikan selama pemeliharaan terbagi atas pertumbuhan gonad dan pertumbuhan somatik. Persentase bobot gonad tertinggi terdapat pada perlakuan OMiGH sebesar 73,03% dari pertambahan bobot ikan sebesar 60,33 g ekor-1 dan persentase gonad terendah terdapat pada perlakuan kontrol sebesar 55,85% dari pertambahan bobot ikan sebesar 47,00 g ekor-1 (Gambar 5). Berdasarkan data tersebut dapat diketahui bahwa pengaruh penambahan hormon oodev, rGH dan minyak ikan ke dalam pakan dapat meningkatkan pertumbuhan Pemeliharaan. OMiGH (Oodev+Minyak Ikan+rGH); OMi (Oodev + Minyak Ikan); OGH (Oodev+rGH); GHMi (rGH+Minyak Ikan); dan (K) Kontrol.
11
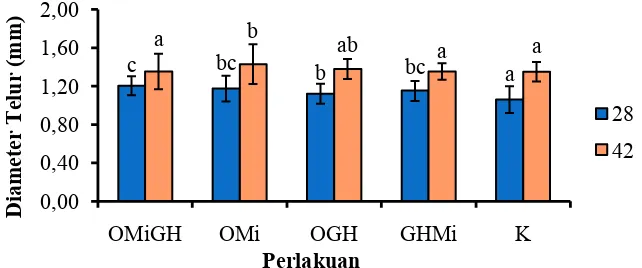
Diameter Telur
Hasil pengamatan ukuran diameter telur berdasarkan 30 sampel oosit pada setiap perlakuan diperoleh nilai rata-rata diameter telur. Pengamatan ukuran diameter telur diamati pada hari ke-28 dan ke-42 (Gambar 6). Analisis statistik menunjukkan bahwa kombinasi oodev, rGH dan minyak ikan kedalam pakan berpengaruh nyata terhadap diameter telur dibanding dengan kontrol (p<0,05) (Lampiran 2).
Diameter tertinggi pada pengamatan hari ke-28 terdapat pada perlakuan OMiGH sebesar 1,204±0,098 mm dan terendah terdapat pada perlakuan kontrol sebesar 1,060±0,138 mm. Hasil pengamatan pada hari ke-42 menunjukkan nilai diameter telur tertinggi terdapat pada perlakuan OMi sebesar 1,463±0,106 mm dan terendah terdapat pada perlakuan OMiGH sebesar 1,345±0,191 mm.
Gambar 6. Diameter Telur Ikan Nilem Selama Pemeliharaan. OMiGH (Oodev + Minyak Ikan+rGH); OMi (Oodev+ Minyak Ikan); OGH (Oodev + rGH); GHMi (rGH + Minyak Ikan); dan Kontrol (K).
Fekunditas
Hasil pengamatan fekunditas atau jumlah telur selama penelitian disajikan pada Tabel 2. Pengamatan fekunditas dilakukan pada hari ke-28 dan hari ke-42. Berdasarkan pengamatan fekunditas telur menunjukkan bahwa perlakuan penambahan hormon dan minyak ikan kedalam pakan berpengaruh nyata terhadap peningkatan fekunditas telur ikan nilem. Fekunditas tertinggi pada hari 28 terdapat pada perlakuan OMiGH yaitu sebesar 290625±78608 butir kg-1 dan perlakuan terendah terdapat pada perlakuan kontrol sebesar 123525±15652 butir kg-1.
Tabel 2. Fekunditas Telur Ikan Nilem Selama Pemeliharaan (butir kg-1)
Perlakuan Fekunditas Telur (butir kg
12
Keterangan: OMiGH (Oodev+Minyak Ikan+rGH); OMi (Oodev+Minyak Ikan); OGH (Oodev+
rGH); GHMi (rGH+Minyak Ikan); K(Kontrol); MUFA (Monounsaturated Fatty
Acid); dan PUFA (Polyunsaturated Fatty Acid).
.
Namun pada hari ke-42 perlakuan OMiGH dan OMi mengalami penurunan fekunditas. Fekunditas tertinggi pada hari ke-42 terdapat pada perlakuan OGH sebesar 266517±8134 butir kg-1 dan terendah terdapat pada perlakuan kontrol sebesar 175129±8644 butir kg-1.
Proksimat Telur
Hasil pengamatan proksimat telur ikan nilem pada Tabel 3 menunjukkan bahwa perlakuan kombinasi Oodev dan minyak ikan (OMi) dapat meningkatkan protein telur ikan nilem sebesar 32,07% dibanding kontrol sebesar 29,39%.
Tabel 3. Proksimat Telur Ikan Nilem
Proksimat (%)
Perlakuan
OMiGH OMi OGH GHMi K
Protein 30,08±0,71 32,07±0,37 30,11±0,21 30,51±0,55 29,39±0,24 Lemak 1,46±0,23 0,75±01,19 1,50±0,37 0,90±0,04 1,57±0,29 Abu 1,65±0,16 1,72±0,00 1,64±0,04 1,73±0,04 1,63±0,02 Kadar Air 58,37±0,49 58,33±0,23 59,41±0,06 58,41±0,23 58,38±0,50
Keterangan: OMiGH (Oodev + Minyak Ikan + rGH); OMi (Oodev + Minyak Ikan); OGH (Oodev + rGH); GHMi (rGH + Minyak Ikan); dan Kontrol (K).
Kandungan lemak tertinggi pada telur ikan nilem selama pemeliharaan terdapat pada perlakuan kontrol sebesar 1,57% dan terendah terdapat pada perlakuan OMi sebesar 0,75%. Sedangkan analisis kandungan kadar air yang tertinggi terdapat pada perlakuan OGH sebesar 59,41% dan terendah terdapat pada perlakuan OMi sebesar 58,33%.
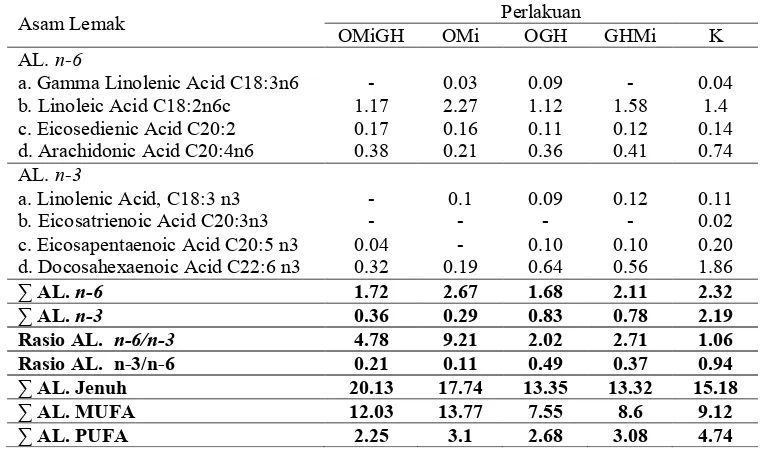
Kandungan Asam Lemak
Hasil pengamatan kandungan asam lemak telur ikan nilem selama pemeliharaan disajikan pada Tabel 4.
Tabel 4. Kandungan Asam Lemak Telur Ikan Nilem Pada Akhir Pemeliharaan
13
Hasil pengamatan analisis asam lemak telur ikan nilem, kandungan asam lemak Monounsaturated Fatty Acid (MUFA) tertinggi terdapat pada perlakuan OMi dan OMiGH sebesar 13,77% dan 12,03%.
Kandungan total n-3 (omega 3) tertinggi pada telur ikan nilem selama pemeliharaan 42 hari terdapat pada perlakuan kontrol sebesar 2,32% dan terendah terdapat pada perlakuan OMi sebesar 0,29%. Namun, jika dilihat dari kandungan omega 6, penambahan hormonal dan minyak ikan mampu meningkat kandungan omega 6 pada telur ikan nilem sampai pada hari ke-42.
Hasil perbandingan rasio asam lemak omega 3 dan omega 6 menunjukkan perlakuan kontrol memiliki rasio tertinggi sebesar 0,94 dan terendah perlakuan OMi sebesar 0,11. Namun, berbeda halnya pada rasio n-6/n3 perlakuan OMi menunjukkan nilai tertinggi sebesar 9,11 dan terendah terdapat pada perlakuan kontrol sebesar 1,06
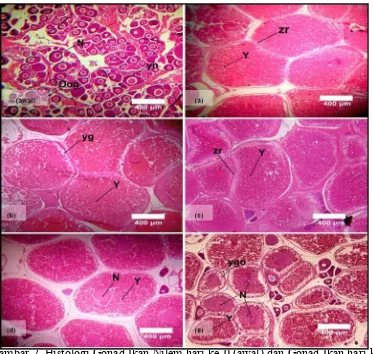
Histologi Gonad
Perkembangan dan pertumbuhan sel telur dapat diketahui melalui struktur histologi gonad sehingga dapat dilihat adanya pengaruh penambahan hormon oodev, rGH dan minyak ikan terhadap perkembangan dan pertumbuhan sel telur pada ikan nilem. Hasil Pengamatan struktur histologi gonad disajikan pada Gambar 7 berikut ini.
14
Hasil histologi pada hari ke-0 (Gambar 7) menunjukkan telur berada pada stadia awal atau fase 1 (Oogonia). Hal ini ditandai dengan sel telur yang belum terdiferensiasi yang memiliki nukleus besar dan sitoplasma yang sangat kecil.
Histologi gonad pada hari ke-42 menunjukkan sel telur telah berada pada fase tingkat kematangan gonad (TKG) akhir TKG IV dan V. Hal ini dapat dilihat pada perlakuan OMiGH, OMi, OGH dan GHMi inti telur mengalami pergerakan ke tepi dan peleburan serta didominasi oleh kuning telur. Pada perlakuan OMiGH dan OMi beberapa telur telah mengalami atresia ditandai dengan terjadinya penyerapan kembali kuning telur oleh folikel. Namun, perlakuan kontrol (Gambar 7e) memperlihatkan bahwa telur berada pada fase vitelogenesis yang ditandai dengan posisi inti telur masih berada di tengah. Berdasarkan hasil histologi menunjukkan penambahan hormon oodev, rGH dan minyak ikan dapat mempercepat pertumbuhan dan perkembangan gonad dibanding kontrol.
Pembahasan
Peningkatan produksi telur diamati dari parameter kadar estradiol-17β, HSI, GSI, diameter telur, fekunditas telur serta parameter tambahan yaitu pengamatan pertumbuhan somatik dan gonad serta histologi gonad. Sedangkan, untuk mengukur kualitas telur diamati dari parameter proksimat dan kandungan asam lemak.
Pengamatan konsentrasi estradiol-17β dalam darah menunjukkan terjadinya peningkatan sampai pada hari ke-28 pada setiap perlakuan (Gambar 2). Peningkatan konsentrasi estradiol-17β dengan penambahan oodev, rGH dan minyak ikan kedalam pakan cenderung lebih tinggi dibandingkan kontrol. Hal ini menunjukkan penambahan hormon dan nutrisi kedalam pakan dapat mempercepat kematangan gonad ikan dibandingkan dengan kontrol. Meningkatnya
estradiol-17β pada perlakuan yang ditambahkan oodev disebabkan oleh adanya pengaruh dari hormon PMSG dan Antidopamin (AD) dalam oodev. Peningkatan
estradiol-17β mengindikasikan terjadinya proses vitelogenesis dalam gonad. Nagahama et al (1991) menyatakan bahwa penggunaan PMSG pada ikan medaka (Oryzias latipes) dapat memacu produksi estradiol-17β dalam darah. Selain Oodev, penambahan rGH juga dapat meningkatkan estradiol-17β. Sesuai dengan pernyataan Van Der Kraak dan Wade (1994), bahwa GH juga memberikan potensi pada GTH II dalam menstimulasi produksi estradiol pada ikan koki (Carassius auratus), hal ini didukung oleh Weber et al. (2007) yang menjelaskan bahwa GH dapat meningkatkan IGF-1. Peningkatan IGF-1 akan menstimulasi produksi testosteron dan estradiol melalui fragmen ovari pada ikan white perch (Morone americana).
15
Fluktuasi kadar hormon estradiol-17ß juga erat kaitannya dengan tinggi rendahnya nilai HSI dan GSI. Lee dan Young (2002) menyatakan perubahan konsentrasi estradiol-17ß dalam darah berhubungan dengan perkembangan oosit dan peningkatan gonadosomatic index (GSI). Tyler (1991) menyatakan bahwa pada beberapa jenis ikan selama pertumbuhan oosit terjadi peningkatan GSI hingga 20% atau lebih, hal ini disebabkan oleh terjadinya proses transportasi vitelin menuju hati. Aktivitas vitelogenesis ini menyebabkan nilai hepatosomatic index (HSI) dan gonadosomatic index (GSI) ikan akan meningkat (Cerda et al.1996).
Hepatosomatic index (HSI) merupakan rasio hati dengan bobot tubuh ikan. HSI juga salah satu cara untuk mengetahui fase perkembangan gonad ikan dalam siklus hidupnya. Berdasarkan hasil pengamatan (Gambar 3), terjadinya peningkatan HSI setiap perlakuan pada hari ke-0 sampai hari ke-28 dan menurun pada hari ke-42, namun pada kontrol masih mengalami peningkatan sampai hari ke-42. Peningkatan nilai HSI sangat erat kaitannya dengan kandungan hormon estradiol-17β dalam darah. Hal ini disebabkan estradiol-17β dapat menstimulasi hati dalam proses sekresi vitelogenin sebagai prekursor pembentukan prakuning telur. Penurunan nilai HSI terjadi pada semua perlakuan kecuali pada perlakuan kontrol. Hal ini terjadi karena oosit sudah hampir mencapai ukuran maksimum sehingga sintesis vitelogenin menurun. Setelah vitelogenin terbentuk di hati, akan disalurkan ke gonad untuk perkembangan telur. Hal ini menyebabkan bobot hati menurun dilihat dari penurunan nilai HSI.
Hasil pengamatan GSI selama penelitian menunjukkan bahwa penambahan kombinasi oodev, rGH, dan minyak ikan ke dalam pakan dapat meningkatkan nilai GSI secara signifikan pada hari ke-28 jika dibandingkan dengan kontrol (Lampiran 1). Berdasarkan Gambar 4 dapat dilihat bahwa peningkatan GSI tertinggi terdapat pada hari ke-28 setiap perlakuan. Akan tetapi pada perlakuan OGH (Oodev+rGH) dan kontrol masih mengalami peningkatan nilai GSI sampai pada hari ke-42. Peningkatan nilai GSI pada perlakuan OGH dan kontrol pada hari ke-42 menunjukkan terjadinya keterlambatan perkembangan gonad pada perlakuan. Peningkatan nilai GSI pengaruhi oleh hormon PMSG dalam oodev kemudian akan meningkatkan konsentrasi follicle stimulating hormone (FSH) dalam darah sehingga yang mampu mengaktifasi gonad untuk mensintesis estradiol-17β. Hormon estrogen, terutama estradiol-17β dapat mempengaruhi sintesis vitelogenin, serta mendukung hingga fase maturasi (Donaldson dan Hunter.1983). Penurunan nilai GSI pada hari ke-42 terjadi pada perlakuan OMiGH, OMi, dan GHMi hal ini menunjukkan bahwa ikan pada perlakuan tersebut telah mengalami proses vitelogenesis, sehingga aktifitas pertumbuhan oosit berhenti, selanjutnya terjadi proses pematangan sebelum ovulasi dan menyebabkan pertumbuhan gonad mulai berhenti. Hal ini didukung dari hasil histologi Gambar 7a dan 7b yang menunjukkan dengan ditandai telah terjadinya peleburan inti sel pada telur dan didominasi oleh kuning telur. Sedangkan, pada perlakuan OGH dan Kontrol masih mengalami peningkatan nilai GSI. Peningkatan nilai GSI pada perlakuan OGH memperlihatkan bahwa perlakuan tersebut masih mengalami proses pematangan akhir (Gambar 7c).
16
energi yang lebih tinggi dalam proses pembentukan telur sehingga dapat meningkatkan persentase pertumbuhan gonad. Hasil pengamatan menunjukkan bahwa adanya pengaruh penambahan oodev, rGH, dan minyak ikan ke dalam pakan terhadap pertumbuhan gonad dan pertumbuhan somatik pada ikan nilem. Hal ini dapat dilihat dari persentase pertumbuhan gonad pada perlakuan OMiGH dan OMi lebih tinggi sebesar 73,03% dan 71,22% dari total pertambahan bobot ikan. Peningkatan persentase pertumbuhan gonad pada perlakuan OMiGH dan OMi diduga disebabkan oleh adanya pengaruh oodev dan nutrisi dari minyak ikan dalam pakan sehingga keseluruhan hasil metabolisme tubuh dimanfaatkan dalam proses perkembangan gonad.
Peningkatan persentase pertumbuhan gonad dipengaruhi oleh kandungan hormon PMSG dan antidopamin yang terdapat dalam oodev. Pregnant Mare Serum Gonadotropin (PMSG) berfungsi dalam meningkatkan FSH dan LH didalam tubuh ikan, serta mendorong kerja fisiologis yang berporos pada hipotalamus dan pituitari dalam mendukung pematangan gonad (Balomba et al. 1992). Sedangkan antidopamin berperan dalam menghambat kerja dopamin sehingga kerja fisiologi kelenjar hipotalamus dalam mensekresikan hormon gonadotropin tetap berlangsung (Sudrajat 2010). Setelah itu, gonadotropin akan merangsang ovarium untuk melakukan proses pematangan telur pada ikan.
Penambahan hormon rGH merupakan salah satu yang menyebabkan pertumbuhan ikan meningkat. Secara alami GH terlibat di dalam pengaturan pertumbuhan somatik dan metabolisme protein, lipid, karbohidrat dan mineral (Bolander 2004). Pierce et al. (2011) menjelaskan bahwa hormon pertumbuhan berperan dalam pertumbuhan dan perkembangan pada kelompok vertebrata, baik secara langsung maupun tidak langsung. Mekanisme secara langsung adalah GH akan langsung mempengaruhi pertumbuhan organ tanpa perantara insulin growth faktor-1 (IGF-1) di dalam hati. Mekanisme tidak langsung adalah mekanisme GH dalam mempengaruhi pertumbuhan yang dimediasi oleh IGF-1 dalam hati (Wong
et al. 2006; Debnanth 2010). GH juga mempunyai peranan penting dalam proses reproduksi (Naderet al.1999). Meningkatnya persentase pertumbuhan gonad pada perlakuan yang dikombinasikan rGH diduga GH mampu menstimulasi sekresi estradiol-17β dalam darah sehingga sekresi vitelogenin dalam hati juga meningkat (Singh et al. 1988). Peningkatan vitelogenin menyebabkan proses vitelogenesis dan perkembangan oosit lebih cepat.
Pengaruh penambahan nutrisi pada pakan melalui minyak ikan juga dapat meningkatkan proses percepatan pembentukan telur ikan sehingga dapat meningkatkan persentase gonad di dalam tubuh ikan. Menurut Izquierdo et al.
(2001) menerangkan bahwa asam lemak esensial yang berperan dalam menutrisi induk ikan serta mempengaruhi penampilan reproduksi ikan baik untuk dalam proses pembentukan telur maupun pematangan gonad (Izquierdo et al. 2001). Keberadaan asam lemak esensial pada membran sel juga mempengaruhi sifat fluiditas membran sel yang berfungsi sebagai prekursor senyawa prostaglandin yang berperan sebagai hormon gonadotropin dalam proses pembentukan telur (Djojosoebagio 1996).
17
ukuran oosit. Minyak ikan salah satu nutrien yang ditambahkan kedalam pakan yang mengakibatkan peningkatan diameter telur pada ikan selama pemeliharaan. Hasil pengamatan diameter telur menunjukkan penambahan oodev dan minyak ikan (OMi) memiliki ukuran diameter telur tertinggi sebesar 1.463± 0,106 mm. Oodev juga memberikan pengaruh terhadap diameter telur karena FSH yang terkandung didalamnya mampu memberi signal lebih cepat pada gonad yang selanjutnya memberi perintah pada hati untuk segera melakukan proses vitelogenesis.
Fekunditas merupakan jumlah telur yang dihasilkan oleh suatu indukan ikan (butir kg-1). Hasil uji statistik menunjukkan bahwa kombinasi oodev, minyak ikan dan rGH berpengaruh nyata terhadap fekunditas dibandingkan dengan kontrol (Lampiran 3). Hasil pengamatan fekunditas tertinggi terdapat di hari ke-28 pada perlakuan OMiGH, OMi dan GHMi sebesar 290265 butir kg-1, 248052 butir kg-1 dan 205614 butir kg-1. Berdasarkan hasil tersebut penambahan minyak ikan pada perlakuan dapat meningkatkan fekunditas pada ikan nilem selama pemeliharaan. Sesuai penelitian Darwisito (2008) melaporkan penambahan minyak ikan (30 g kg-1 pakan) dan vitamin E (150 mg kg-1 pakan) dapat meningkat fekunditas tertinggi pada ikan nila (O. niloticus). Zhang et al. (2013) melaporkan bahwa penambahan minyak ikan sebesar 6% dapat meningkatkan GSI pada ikan bayam-bayam (Scatophagus argus) pada minggu ke 8 sebesar 9,17%. Fekunditas juga dipengaruhi oleh besar kecilnya nilai GSI ikan, semakin berat bobot gonad maka semakin banyak jumlah telur yang diproduksi didalam gonad.
Hasil analisis proksimat pada telur ikan nilem selama pemeliharaan terdapat perbedaan pada setiap perlakuan. Pengamatan kualitas telur terbaik diduga terdapat pada perlakuan yang ditambahkan oodev, rGH dan minyak ikan (OMiGH) pada hari ke-28. Namun dari hasil proksimat pada hari ke-42, kandungan protein tertinggi terdapat pada perlakuan oodev dan minyak ikan (OMi) sebesar 32,07% (Tabel 3). Hal ini menunjukkan bahwa penambahan oodev dan minyak ikan ke dalam pakan dapat meningkatkan kandungan protein telur ikan nilem sampai hari ke-42. Darwisito (2008) melaporkan penambahan vitamin E dan minyak ikan sebanyak 30 g kg-1 pakan dapat meningkatkan performa reproduksi serta meningkatkan kualitas telur dan larva pada ikan nila (O. niloticus). Akan tetapi, apabila diamati dari kandungan lemak telur ikan nilem tidak terdapat perbedaan yang signifikan antara perlakuan kombinasi oodev, minyak Ikan dan rGH dengan perlakuan kontrol.
18
4 SIMPULAN DAN SARAN
SIMPULAN
Berdasarkan hasil penelitian dapat disimpulkan bahwa:
1. Kombinasi Oodev, recombinant growth hormone (rGH) dan Minyak Ikan kedalam pakan dapat mempercepat kematangan gonad selama 28 hari dan meningkatkan nilai GSI pada ikan nilem dibanding kontrol.
2. Kombinasi oodev, rGH dan minyak ikan dapat meningkatkan kualitas telur ikan nilem.
SARAN
19
DAFTAR PUSTAKA
Acosta J, Morales R, Morales A, Alonso M, Estrada MP. 2007. Pichia pastoris
expressing recombinant tilapia growth hormone accelerates the growth of tilapia. Biotechnology Lett. 29: 1671-1676.
Ahliana Hadra Fi. 2015. Induksi Maturasi Gonad Ikan Sidat (Anguilla bicolor bicolor) Secara Hormonal dengan Menggunakan PMSG, AD, dan rGH. [tesis]. Bogor (ID): Institut Pertanian Bogor.
Alimuddin, I. Lesmana, A.O. Sudrajat, O. Carman, I. Faizal. 2010. Production and bioactivity potential of three recombinant growth hormones of farmed fish. Indonesia Aquaculture J. 5:11-16
Altug G, Bayrak Y. 2003. Microbiological analysis of caviar from Russia and Iran. Elsevier Science Ltd. Food Microbiology 20 : 83–86
Anido VR, Evoy Z-F, Alexandre SG, Sueli RB, Debora MF. 2015. Characterization of the ovary fatty acids composition of Rhamdia quelen
(Quoy & Gaimard) (Teleostei: Siluriformes), throughout their reproductive cycle. Journal of Neotropical Ichthyology, 13(2): 453-460 Bledsoe GE, Bledsoe CD, Reco B. 2003. Caviar and Fish Roe Products. Food
Science and Nutrition, 43(3): 317-356
Balomba D, Matton P, Estrada R, and Dufour JJ. 1992. Effect of pregnant mare’s serum gonadotropin on follicular population and ovulation rates in prepubertal gilts with two morphologically different ovarium types. J. Anim. Sci. 70 : 1916 – 1992
Busacker GP, Adelman IR, Goolish EM. 1990. Growth. in: Schreck C.B, Moyle PB. (Eds.), Methods for Fish Biology. American Fisheries Society, Bethesda (MD), pp. 363 – 387.
Bolander FF. 2004. Molecular Endocrinology, 3rd ed. London, Elsevier Academic Press
Cao M, Chen ji, Peng wei, Wang Y, Liao L, Li Yongming, Trudeau V.L, Zhu Z, Hu, Wei H. 2014. Effects of growth hormone over-expression on reproduction in the common carp Cyprinus carpio L. General and Comparative Endocrinology 195 : 47–57.
Caprino F, Moretti VM, Bellagamba F, Turchini GM, Busetto ML, Giani I, Paleari MA, Pazzaglia M. 2008. Fatty Acid Composition and Volatile Compounds of Caviar From Framed White Sturgeon (Acipenser transmontanus). Journal of Analytica Chimica Acta 617: 139-147
Cerda J, Calman BG, LaFleur Jr GJ, Limesand S. 1996. Pattern of vitellogenesis and follicle maturational competence during the ovarian follicular cycle of fundulus heteroclitus. General and Comparative Endocrinology, 103: 24–35
Crim LW, Shenwood NM, Wilson CE. 1988. Sustained Hormon Release II, Effectiveness of LHRH analog (LHRH) Administration by Either Single Time Injection or Cholesterol Pellet Implantation on Plasma Gonadotropin Levels in a Bioassay Model Fish The Juvenile Rainbow Trout. Aquaculture 74:87-95
20 Meningkatkan Performan Reproduksi Ikan Patin Siam (Pangasius manodon hypophthalmus). [tesis]. Bogor (ID): Institut Pertanian Bogor. Djojosoebagio S. 1996. Fisiologi Kelenjar Endokrin. UI – Press, Jakarta, 501 hal. Donaldson EM and. Hunter GA. 1983. Induced final maturation, ovulation and
spermiationin cultured fish. P : 354 – 390. In W.S. Hoar, D.J. Randall, and E.M. Donaldson (Eds), Fish physiology, Vol. XB, Academic Press. Canada.
Farastuti ER. 2014. Induksi maturasi gonad, ovulasi dan pemijahan pada ikan tor soro (tor soro) menggunakan Kombinasi hormon. [tesis]: Bogor (ID). Institut Pertanian Bogor.
Fernandez-Palacios H, Izquierdo MS, Gonzalez M, Robaina L, Valencia A. 1998. Combined effect of dietary α-tocopherol and 3-HUFA on egg quality of gilthead seabream broodstock Sparus aurata. Aquaculture 161: 475–476 Funkenstein B, Dyman A, Lapidot Z, de Jesus-Ayson EG, Gertler A, Ayson FG.
2005. Expression and purification of a biologically active recombinant rabbitfish (Siganus guttatus) growth hormone. Aquaculture 250: 504-515.
Guinnessworldrecords, 2013. The Record Of Iranian Beluga Most Expensive
Caviar On The World. Tersedia
pada[http://www.guinnessworldrecords.com/records-4000/most-expensive-caviar/] diunduh di [Bogor, 13 Oktober 2014]
Gunarso W. 1989. Mikroteknik. PAU, Ilmu Hayat. Institut Pertanian Bogor, Bogor.
Hull KL, Harvey S. 2002. GH as a co-gonadotropin: the relevance of correlative changes in GH secretion and reproductive state. Journal. Endocrinol.
172: 1–19.
Izquierdo, M.S, H. Fernandez-Palacios, A.G.J. Tacon. 2001. Effect of broodstock nutrition on reproductive performance of fish. Aquaculture 197: 25-42. Keong W dan Wang Y. 2011. Inclusion of crude palm oil in the broodstock diets
of female Nile tilapia, Oreochromis niloticus, resulted in enhanced reproductive performance compared to broodfish fed diets with added fish oil or linseed oil. Aquaculture. 314 :122–131
Lee WK, Young SW. 2002. Relationship between ovarian development and serum levels of gonadal steroid hormones, and induction of oocyte maturation and ovulation in the cultured female Korean spotted sea bass
Lateolabrax moculatus (Jeom-nong-oe). Aquaculture, 207: 169-183 Lin HR, Zhang Q, Peter RE. 1995. Effects of recombinant tuna growth hormone
21
Muhammad. 2014. Respons Pertumbuhan dan Reproduksi Ikan Nila Yang Diberi Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang. [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Nader MR, Miura T, Ando N, Miura C, Yamauchi K. 1999. Recombinant human insulin-like growth factor I stimulates all stages of 11-ketotestosterone induced spermatogenesis in the Japanese eel (Anguilla japonica) in vitro.
Biology of Reproduction. 61: 944–947
Nagahama Y, Matsuhisa A, Iwamatsu T, Sakai N, Fukada S. 1991. A mechanism for the action of pregnant mare serum gonadotropin on aromatase activity in the ovarian follicle of the medaka (Oryzias latipes). Journal of Experimental Zoology 259: 53-58
Nainggolan A, Sudrajat AO, Utomo BY, Harris E. 2014. Ovarian Maturation in Asian Catfish (Clarias sp.) by Combination Oodev and Nutrition Addition Spirulina plantesis. IJSBAR. 15 (1): 564-583
Novianto. 2013. Perkembangan Oosit Induk Ikan Nilem (Osteochilus Vittatus Val. 1842) Yang Diberi Hormon Estradiol-17β Dan Pakan Berprotein Nabati. [tesis]. Universitas Jenderal Soedirman (Unsoed)
Pierce AL, Breves JP, Moriyama S, Hirano T, Grau EG. 2011. Differential regulation of Igf1 and Igf2 mRNA level in tilapia hepatocytes: effects of insulin and cortisol on GH sensitivity. Journal of Endocrinology, 211:201-210.
Putra WK. Atmaja. 2013. Induksi Maturasi Belut Sawah (Monopterus Albus) Secara Hormonal. [tesis]. Bogor (ID): Institut Pertanian Bogor.
Qonitah AM. 2013. Rekayasa Hormonal Pada Udang Vaname Selama 14 Hari Sebagai Pengganti Teknik Ablasi Mata Dalam usaha percepatan Pematangan Gonad. [skripsi]. Bogor (ID): Institut Pertanian Bogor. Rachman B. 2013. Manipulasi Hormonal Pada Pematangan Gonad Ikan Patin
Siam (Pangasianodon hypophthalmus). [tesis]. Bogor (ID). Institut Pertanian Bogor.
Rahmatia F. 2013. Kajian Kombinasi Penambahan Spirulina platensis pada Pakan dan Penyuntikan Oodev Terhadap Kinerja Reproduksi Ikan Nila. [Tesis]: Bogor (ID). Institut Pertanian Bogor.
Russianfoods, 2014. Complete Roe-down on Caviar. Tersedia pada [http://www.russianfoods.com/en/complete-roe-down-on-caviar/]
diunduh di [Bogor, 13 Oktober 2014]
Sartika D. 2008. Pengaruh Asam Lemak Jenuh, Tidak Jenuh dan Asam Lemak Trans terhadap Kesehatan. Jurnal Kesehatan Masyarakat. 2 (4): 154-160.
Singh H, Grif fith RW, Takahashi A, Kawauchi H, Thomas P, Stegeman JJ. 1988.
Regulation of gonadal steroidogenesis in Fundulus heteroclitus by recombinant salmon growth hormone and prolactin. Gen Comp Endocrinol. 72:144–53.
Sink TD, Locmann RT, Pohlensz C, Bluentello A, Gatlin D. 2010. Effects of dietary protein source and protein–lipid source interaction on channel catfish (Ictalurus punctatus) egg biochemical composition, egg production and quality, and fry hatching percentage and performance.
22
Sirotkin AV. 2005. Control of reproductive processes by growth hormone: extra- and intracellular mechanism. Review. The veterinary Journal. 170 (3): 307-317.
Soeminto, P. Susatyo dan M. Santoso. 2000. Pembentukan jantan homogamet (xx) lewat ginogenesis dan pemberian andriol pada ikan nilem. Laporan penelitian Fakultas Biologi, UNSOED, Purwokerto.
Subagja J, Rudhy Gustiano, Winarlin. 2007. Pelestarian Ikan Nilem (Osteochilus Hasselti C.V) Melalui Teknologi Pembenihannya. Makalah Lokakarya Nasional Pengelolaan Dan Perlindungan Sumberdaya Genetik Di Indonesia
Sudrajat A O. 2010. Diktat kuliah endokrinologi. Fakultas Perikanan dan Ilmu Kelautan, IPB, Bogor.
Sugati A. 2013. Induksi Maturasi Ikan Sidat (Anguilla bicolor) Dengan Menggunakan Kombinasi Hormon Berbeda. [skripsi]. Bogor (ID). Institut Pertanian Bogor
Takeuchi T. 1988. Laboratory work Chemical Evaluation of Dietary Nutrients, in: Watanabe T. Fish Nutrition and Mariculture. Tokyo (JP): Tokyo symposium on the reproductive physiology of fish. Norwich.
Van Der Kraak G, Wade MG. 1994. A comparison of signal transduction pathways mediating gonadotropin actions in vertebrates. In: Davey KB, Peter RE, Tobe SS, editors. Perspectives in comparative endocrinology. Ottawa: National Research Council of Canada,:59–63.
Weber GM, Moore AB, Sullivan CV. 2007. In vitro actions of insulin-like growth factor-I on ovarian follicle maturation in white perch (Morone americana). Gen Comp Endocrinol. 151: 180-187.
Wong AOL, Hong Z, Yonghua J, Wendy K, Ko W. 2006. Feedback regulation of growth hormone and secretion in fish and the emerging concept of intrapituitary feedback loop (review). Comp Biochem Physiol 144: 284-305.
Zairin M. 2003. Endokrinologi dan perannya bagi masa depan perikanan Indonesia. Orasi ilmiah guru besar tetap ilmu fisiologi reproduksi dan endokrinologi hewan air. Bogor (ID): Institut Pertanian Bogor
24
Within Groups 1991025.567 145 13731.211 Total 2352566.860 149
D42 Between Groups 137412.563 4 34353.141 3.315 .012 Within Groups 1502440.201 145 10361.657
Total 1639852.765 149
Means for groups in homogeneous subsets are displayed.
25
Lampiran 3. Analisis Ragam Dan Uji Lanjut Duncan Dari Hasil Parameter Uji Pertambahan Bobot Ikan Nilem
Test of Homogeneity of Variances Pertambahan bobot
Levene Statistic df1 df2 Sig.
.701 4 68 .594
ANOVA Pertambahan bobot
Sum of Squares df Mean Square F Sig. Between Groups 2830.432 4 707.608 3.775 .008 Within Groups 12745.595 68 187.435
Total 15576.027 72
Pertambahan Bobot Duncan
Perlakuan N
Subset for alpha = 0.05
1 2
GHMi 14 42.1429
OMi 14 45.3571
K 15 47.0000
OGH 15 48.6667
OMiGH 15 60.3333
Sig. .248 1.000
26
Lampiran 4. Prosedur Analisis Proksimat Telur Ikan
A. Kadar Protein Tahap Oksidasi
1. Sampel ditimbang sebanyak 0.5 gram dan dimasukkan ke dalam labu Kjedhal. 2. Katalis (K2SO4+CuSo4.5H2O) dengan rasio 9:1 ditimbang sebanyak 3 gram
dan dimasukkan ke dalam labu Kjedhal.
3. 10 ml H2SO4 pekat ditambahkan ke dalam labu Kjedhal dan kemudian labu tersebut dipanaskan dalam rak oksidasi/digestion pada suhu 400oC selama 3-4 jam sampai terjadi perubahan warna cairan dalam labu menjadi hijau bening. 4. Larutan didinginkan lalu ditambahkan air distilasi 100 ml. Kemudian larutan
dimasukkan ke dalam labu takar dan diencerkan dengan akuades sampai volume larutan mencapai 100 ml. Larutan sampel siap didistilasi.
Tahap Distilasi
1. Beberapa tetes H2SO4 dimasukkan ke dalam labu, sebelumnya labu diisi setengahnya dengan akuades untuk menghindari kontaminasi oleh ammonia lingkungan. Kemudian dididihkan selama 10 menit.
2. Erlenmeyer diisi 10 ml H2SO4 0.05 N dan ditambahkan 2 tetes indicator methyl
red diletakkan di bawah pipa pembuangan kondensor dengan cara dimiringkan sehingga ujung pipa tenggelam dalam cairan.
3. 5 ml larutan sampel dimasukkan ke dalam tabung distilasi melalui corong yang kemudian dibilas dengan akuades dan ditambahkan 10 ml NaOH 30% lalu dimasukkan melalui corong tersebut dan ditutup.
4. Campuran alkaline dalam labu distilasi disuling menjadi uap air selama 10 menit terjadi pengembunan pada kondensor.
5. Labu erlenmeyer diturunkan hingga ujung pipa kondensor berada di leher labu, diatas permukaan larutan. Kondensor dibilas dengan akuades selama 1-2 menit.
Tahap Titrasi
1. Larutan hasil distilasi dititrasi dengan larutan NaOH 0.05 N. 2. Volume hasil titrasi dicatat.
3. Prosedur yang sama juga dilakukan pada blanko.
Kadar Protein (%) = 0.0007 * x (Vb – Vs) x 6.25 ** x 20 x 100% S
Keterangan : Vb = Volume hasil titrasi blanko (ml) Vs = Volume hasil titrasi sampel (ml) S = Bobot sampel (gram)
* = Setiap ml 0.05 NaOH ekivalen dengan 0.0007 gram Nitrogen ** = Faktor Nitrogen
B. Kadar Lemak
Metode ekstraksi Soxhlet
27
2. Sampel ditimbang sebanyak 3-5 gram (A), dan dimasukkan ke dalam selongsong tabung filter dan dimasukkan ke dalam soxhlet dan pemberat diletakkan di atasnya.
3. N-hexan 100-150 ml dimasukkan ke dalam soxhlet sampai selongsong terendam dan sisa N-hexan dimasukkan ke dalam labu.
4. Labu yang telah dihubungkan dengan soxhlet dipanaskan di atas water bath
sampai cairan yang merendam sampel dalam soxhlet berwarna bening. 5. Labu dilepaskan dan tetap dipanaskan hingga N-hexan menguap.
6. Labu dan lemak yang tersisa dipanaskan dalam oven selama 15-60 menit, kemudian didinginkan dalam desikator selama 15-30 menit dan ditimbang (X2)
Metode Folch
1. Labu silinder dioven terlebih dahulu pada suhu 110oC selama 1 jam, didinginkan dalam desikator selama 30 menit kemudian ditimbang (X1). 2. Sampel ditimbang sebanyak 2-3 gram (A) dan dimasukkan ke dalam gelas
homogenize dan ditambahkan larutan kloroform / methanol (20xA) , sebagian disisakan untuk membilas pada saat penyaringan.
3. Sampel dihomogenizer selama 5 menit setelah itu disaring dengan vacuum silinder kemudian dievaporator sampai kering. Sisa kloroform / methanol yang terdapat dalam labu ditiup dengan menggunakan vacuum setelah itu ditimbang (X2)
Kadar Lemak (%) = X2–X1x 100% A
C. Kadar Air
1. Cawan dipanaskan dalam oven pada suhu 100oC selama 1 jam dan kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X1)
2. Bahan ditimbang 2-3 gram (A)
3. Cawan dan bahan dipanaskan dalam oven pada suhu 110oC selama 4 jam kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X2)
Kadar Air (%) = (X1+A)-X2 x 100%
D. Kadar Abu
1. Cawan dipanaskan dalam oven pada suhu 100oC selama 1 jam dan kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X1)
2. Bahan ditimbang 2-3 gram (A)
3. Cawan dan bahan dipansakan dalam tanur pada suhu 600oC sampai menjadi abu kemudian dimasukkan dalam desikator selam 30 menit dan ditimbang (X2) Kadar Abu (%) = X2–X1x 100%
28
RIWAYAT HIDUP
Penulis dilahirkan di Meulaboh pada tanggal 1 Agustus 1989 dari pasangan Bapak (Alm) M. Amin Idris dan Ibu Chadidjah. Penulis merupakan anak kelima dari lima bersaudara. Penulis menyelesaikan pendidikan sekolah menengah atas di SMA Negeri 1 Meulaboh, pada tahun 2007. Pada tahun yang sama, penulis lulus seleksi masuk Universitas Teuku Umar Negeri (UTU) melalui jalur SPMB (Seleksi Penerimaan Mahasiswa Baru) pada program studi Budidaya Perikanan Fakultas Perikanan dan Ilmu Kelautan. Pendidikan sarjana diselesaikan pada tahun 2012. Pada Tahun 2013, penulis mendapat kesempatan menempuh pendidikan Magister di Sekolah Pascasarjana IPB, pada program studi Ilmu Akuakultur melalui program Beasiswa Pendidikan Pascasarjana Dalam Negeri DIKTI.