PENGARUH INDUKSI HORMON OOCYTE DEVELOPER (OODEV) TERHADAP KEMATANGAN GONAD CALON INDUK IKAN NILEM
(Osteochilus hasselti)
Oleh :
EVA DWI CHOLIFAH SIDOARJO – JAWA TIMUR
FAKULTAS PERIKANAN DAN KELAUTAN UNIVERSITAS AIRLANGGA
Yang bertanda tangan di bawah ini :
N a m a : Eva Dwi Cholifah N I M : 141211133002
Tempat, tanggal lahir : Sidoarjo, 15 Februari 1994
Alamat : Jl. Ngelom Megare RT/RW 01 No. 585, Kec. Taman, Kab. Sidoarjo, Jawa Timur. Telp./HP 08563107877 Judul Skripsi : Pengaruh Induksi Hormon Oocyte Developer (Oodev)
Terhadap Kematangan Gonad Calon Induk Ikan Nilem (Osteochilus
hasselti)
Pembimbing : 1. Dr. Endang Dewi Masithah, MP., Ir. . Shofy 2. Dr. Epy Muhammad Luqman,Drh.,Msi
Menyatakan dengan sebenarnya bahwa hasil tulisan laporan Skripsi yang saya buat adalah murni hasil karya saya sendiri (bukan plagiat) yang berasal dari Dana Penelitian : Mandiri / Proyek Dosen / Hibah / PKM (coret yang tidak perlu).
Di dalam skripsi / karya tulis ini tidak terdapat keseluruhan atau sebagian tulisan atau gagasan orang lain yang saya ambil dengan cara menyalin atau meniru dalam bentuk rangkaian kalimat atau simbol yang saya aku seolah-olah sebagai tulisan saya sendiri tanpa memberikan pengakuan pada penulis aslinya, serta kami bersedia :
1. Dipublikasikan dalam Jurnal Ilmiah Perikanan dan Kelautan Fakultas Perikanan dan Kelautan Universitas Airlangga;
2. Memberikan ijin untuk mengganti susunan penulis pada hasil tulisan skripsi / karya tulis saya ini sesuai dengan peranan pembimbing skripsi;
3. Diberikan sanksi akademik yang berlaku di Universitas Airlangga, termasuk pencabutan gelar kesarjanaan yang telah saya peroleh (sebagaimana diatur di dalam Pedoman Pendidikan Unair 2010/2011 Bab. XI pasal 38 – 42), apabila dikemudian hari terbukti bahwa saya ternyata melakukan tindakan menyalin atau meniru tulisan orang lain yang seolah-olah hasil pemikiran saya sendiri.
SKRIPSI
PENGARUH INDUKSI HORMON OOCYTE DEVELOPER (OODEV)
TERHADAP KEMATANGAN GONAD CALON INDUK IKAN NILEM (Osteochilus hasselti)
Skripsi sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Perikanan pada Program Studi S-1 Budidaya Perairan Fakultas Perikanan dan Kelautan
Universitas Airlangga
Oleh :
EVA DWI CHOLIFAH NIM : 141211133002
SKRIPSI
PENGARUH INDUKSI HORMON OOCYTE DEVELOPER (OODEV)
TERHADAP KEMATANGAN GONAD CALON INDUK IKAN NILEM (Osteochilus hasselti)
Oleh :
EVA DWI CHOLIFAH NIM : 141211133002
Telah diujikan pada
Tanggal : 24 Agustus 2016
KOMISI PENGUJI SKRIPSI
Ketua : Dr. Laksmi Sulmartiwi, S.Pi., M.P. Anggota : Dr. Endang Dewi Masithah, Ir, M.P
Dr. Epy Muhammad Luqman, Drh.,M.Si Dr. Widjiati, Drh., M.Si.
RINGKASAN
EVA DWI CHOLIFAH. Pengaruh Induksi Hormon Oocyt Developer (oodev) Terhadap Kematangan Gonad Pada Calon Induk Ikan Nilem (Osteochilus hasselti). Dosen Pembimbing I Dr. Endang Dewi Masithah, MP., Ir. dan Dosen Pembimbing II Dr. Epy Muhammad Luqman,Drh.,Msi
Ikan nilem (Osteochilus hasselti) merupakan salah satu komoditas budidaya air tawar yang mempunyai nilai ekonomis tinggi. Menurut Data Departemen Kelautan dan Perikanan pada tahun 2013 mencantumkan nilai produksi ikan nilem di Indonesia pada tahun 2009, 2010 dan 2011 bersifat fluktuatif. Produksi yang diperoleh yaitu 167.461.235 kg, 385.701.378 kg, dan 308.763.779 kg. Kendala produksi ikan nilem yang fluktuatif menyebabkan penyediaan benih tidak sepanjang tahun. Upaya mengatasi kendala tersebut adalah adanya ketersediaan induk matang gonad. Mempercepat perkembangan gonad ikan nilem, perlu adanya induksi hormonal, pada penelitian ini menggunakan hormon Oodev.
SUMMARY fluctuation nilem fish production was caused by the supply, which is not annually done. One of the efforts to overcome these obstacles is the availability of the mature brood gonad. To accelerate nilem fish gonad development, it needs hormonal induction. Which Oodev hormone was administrated used oodev hormone is a combination of pregnant mare`s serum gonadotropin (PMSG) and Antidopamin (Farastuti, 2014).
KATA PENGANTAR
Segala puji dan syukur penulis ucapkan atas kehadirat Allah SWT yang telah memberikan limpahan rahmat dan hidayahnya, sehingga penelitian ini dapat terselesaikan. Penelitian ini dibuat untuk mengetahui pengaruh induksi hormon
Oocyte developer (Oodev) terhadap kematangan gonad pada calon induk ikan
nilem (Osteochilus hasselti) yang diharapkan dapat bermanfaat bagi peningkatan produktifitas perikanan di Indonesia. Pada kesempatan ini tidak lupa penulis mengucapkan terimakasih yang sebesar–besarnya kepada semua pihak yang telah memberikan ijin dan bantuan fasilitas dalam penyelesaian penelitan ini.
Penulis menyadari bahwa Skripsi ini masih belum sempurna, sehingga kritik dan saran yang membangun sangat penulis harapkan demi perbaikan dan kesempurnaan Skripsi ini lebih lanjut. Akhirnya penulis berharap semoga Karya Ilmiah ini dapat bermanfaat untuk memberikan informasi serta perkembangan ilmu dan teknologi di bidang perikanan Indonesia.
Sidoarjo, September 2016
UCAPAN TERIMA KASIH
Puji syukur kehadirat Tuhan Yang Maha Esa atas berkat rahmat dan kasih sayang-Nya sehingga dengan izin-Nya penulis dapat menyelesaikan skripsi yang berjudul Pengaruh Induksi Hormon Oocyte Developer (Oodev) Terhadap Kematangan Gonad Calon Induk Ikan Nilem (Osteochilus hasselti).
Pada kesempatan ini, penulis ingin mengucapkan banyak terima kasih kepada pihak yang telah membantu dalam penyusunan skripsi ini baik secara langsung maupun tidak langsung, antara lain :
Dekan Fakultas Perikanan dan Kelautan Universitas Airlangga Surabaya,
Ibu Dr. Mirni Lamid, drh., M.P. atas kesempatan yang diberikan kepada penulis
untuk mengikuti pendidikan di Fakultas Perikanan dan Kelautan Universitas Airlangga Surabaya.
Ibu Dr. Endang Dewi Masithah, M.P., Ir.dan Bapak Dr. Epy Muhammad Luqman,Drh.,M.Si selaku dosen pembimbing pertama dan selaku dosen pembimbing kedua yang selama ini telah memberikan ilmu, saran, motivasi, bimbingan, dan masukan serta telah banyak memberikan literatur dalam skripsi saya.
Bapak Abdul Manan, S.Pi., M.Si. selaku dosen wali yang telah memberikan motivasi bagi saya selama menempuh kuliah. Seluruh staf pengajar di Fakultas Perikanan dan Kelautan Universitas Airlangga atas bantuan dalam penelitian dan wawasan ilmu selama mengikuti pendidikan di Fakultas Perikanan dan Kelautan Universitas Airlangga Surabaya, semoga penulis bisa mengamalkan ilmu yang telah diberikan.
Bapak Boedi Rachman, S.Pi., M.Si. selaku dosen pembimbing lapangan di Balai Besar Balai Besar Perikanan Budidaya Air Tawar Sukabumi.
Seluruh Staf Kependidikan, Bagian Akademik, Bagian Keuangan, Bagian Tata Usaha, dan Bagian sistem Informasi yang telah banyak membantu penulis selama belajar di Fakultas Perikanan dan Kelautan Universitas Airlangga.
Orang tua penulis, Mustaqim Choiri (Alm) dan Ibu Nunuk Dwi Hartini, S.Pd. dan kakak penulis, Rizal dan Riska serta keluarga yang selalu memberikan dukungan, doa, bimbingan, dan motivasi yang tiada henti kepada penulis untuk menjadi lebih baik.
Sahabat terkasih : Elly, Farah, Dimas, Intan, Gigih, Miko, Stella, Dian, Hito, Syifa, Pita, Nunuk, Reni, Pipin, Anita, Umi, Nur, Parida, kak Rillo, Hamidah, Sakina dan Hilda sebagai saudara seperjuangan yang telah memberikan banyak bantuan dan semangat untuk selalu menjadi lebih baik. Teman-teman angkatan 2012 dan teman-teman penulis lain yang belum disebutkan.
DAFTAR ISI
Halaman
RINGKASAN ... iv
SUMMARY ... vi
KATA PENGANTAR ... vii
UCAPAN TERIMA KASIH ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
SINGKATAN DAN ARTI LAMBANG ... xiv
I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 3
1.3 Tujuan ... 3
1.4 Manfaat ... 3
2.1 Hormon Oodev (Oocyte Developer) ... 4
4.3.1 Rancangan Penelitian ... 17
4.3.2 Prosedur Kerja ... 18
4.3.3 Parameter Pengamatan ... 19
A. Parameter Utama ... 19
B. Parameter Pendukung ... 20
V HASIL DAN PEMBAHASAN ... 22
5.1 Hasil ... 22
5.1.1 Laju Pertumbuhan Spesifik ... 22
5.1.2 Indeks Kematangan Gonad ... 23
5.1.3 Diameter telur ... 25
5.1.4 Kualitas Air ... 26
5.2 Pembahasan ... 27
VI SIMPULAN DAN SARAN ... 37
5.1 Simpulan ... 37
5.2 Saran ... 37
DAFTAR PUSTAKA ... 38
DAFTAR TABEL
Tabel Halaman
1. Perlakuan dosis hormon yang diterapkan 17
2. Data laju pertumbuhan spesifik 22
3. Indeks kematangan gonad 24
4. Diamater telur 26
DAFTAR GAMBAR
Gambar Halaman
DAFTAR LAMPIRAN
Lampiran Halaman
1. Dokumentasi Penelitian... 44
2. Gambaran Gonad Ikan Nilem ... 45
3. Data Pertumbuhan Rata-Rata Bobot Pada Setiap Perlakuan... 48
4. Analisis Varian Laju Pertumbuhan Spesifik... 49
5. Data Rata-Rata Indeks Kematangan Gonad... 51
6. Analisis Varian Indeks Kematangan Gonad... 52
7. Data Rata-Rata Diameter Telur... 53
8. Analisis Varian Diameter Telur... 54
9. Gambaran Diameter Telur Ikan Nilem ... 56
SINGKATAN DAN ARTI LAMBANG
Oodev = Oocyte developer
PMSG = Pregnant Mare`s Serum Gonadotropin
AD = Anti Dopamin
FSH = Follicle Stimulating Hormone
LH = Luteinizing Hormone
IKG = Indeks Kematangan Gonad
FSH-RH = Follicle Stimulating Hormone Releasing Hormone
LH-RH = Luteinizing Hormone Releasing Hormone
GTH = Gonadotropin Hormone
MIS = Maturation Inducting Steroid
LPS = Laju Pertumbuhan Spesifik
SGR = Spesific Growth Rate
GNRH = Gonadotrophin Releasing Factor
GRIH = Gonadotropin Release Inhibiting Factor
TKG = Tingkat Kematangan Gonad
PGV = Perpheral Germinal Vesicle
I PENDAHULUAN
1.1 Latar Belakang
Ikan nilem (Osteochilus hasselti) merupakan salah satu komoditas budidaya air tawar yang mempunyai nilai ekonomis tinggi. Kusdiarti (2011) menyatakan ikan nilem memiliki ketahanan terhadap penyakit, sintasan dan reproduksi yang tinggi serta mempunyai beragam potensi antara lain ikan terapi, restocking pada perairan umum dan telurnya dapat dimanfaatkan sebagai bahan caviar ikan air tawar (Subagja dkk., 2006). Produk olahan ikan nilem yang diminati oleh masyarakat adalah pindang dan snack baby fish (Rahardjo dan Marliani, 2007).
Menurut Data Departemen Kelautan dan Perikanan pada tahun 2013 mencantumkan nilai produksi ikan nilem di Indonesia pada tahun 2009, 2010 dan 2011 bersifat fluktuatif. Produksi yang diperoleh yaitu 167.461.235 kg, 385.701.378 kg, dan 308.763.779 kg. Kendala produksi ikan nilem yang fluktuatif menyebabkan penyediaan benih tidak sepanjang tahun. Fluktuasi produksi ikan nilem sangat terkait dengan jumlah pembesaran yang rendah. Sumantadinata (1983) menjelaskan bahwa secara alami proses pemijahan ikan nilem betina dapat dipijahkan dari umur satu hingga satu setengah tahun dengan berat badan sekitar 100 gr dan lebih banyak terjadi pada musim penghujan saja (Cholik et al., 2005).
nilem. Menurut Tang dan Affandi (2004) bahwa strategi kematangan gonad dapat dilakukan dengan memanipulasi hormonal.
Hormon yang digunakan dalam manipulasi hormonal adalah oocyte developer (Oodev) yang berasal dari campuran pregnant mare`s serum gonadotropin (PMSG) dan antidopamin (AD) (Farastuti, 2014). Hormon Oodev merupakan hormon yang dapat merangsang perkembangan oosit pada ikan-ikan belum matang gonad (Sihaloho, 2014).
Metode yang digunakan adalah metode penyuntikan, metode ini dianggap lebih efektif karena pregnant mare`s serum gonadotropin (PMSG) dan antidopamin dapat langsung masuk ke pembuluh darah ikan untuk kemudian dapat mempercepat kematangan gonad (Sihaloho, 2014). Antidopamin pada hormon Oodev berfungsi memblok dopamin sehingga sekresi gonadotropin di otak tidak terhambat (Ahlina, 2015).
Pada penelitian Farastuti (2014) memperlihatkan bahwa penggunaan Oodev dengan dosis 1 mL/kg bobot biomas telah mampu mematangkan gonad (maturasi) ikan torsoro dalam waktu 1 minggu dan penelitian Sihaloho (2014) menyatakan bahwa hormon Oodev dapat mematurasi ikan patin dengan dosis 0,25 mL/kg bobot biomas dalam waktu 2 minggu.
kematangan gonad calon induk betina ikan nilem sehingga dapat mengatasi kendala benih ikan nilem sepanjang tahun.
1.2 Rumusan Masalah
Berdasarkan latar belakang diatas sehingga masalah pada penelitian ini dapat dirumuskan sebagai berikut :
1. Apakah induksi hormon Oodev mampu mempercepat kematangan gonad pada calon induk ikan nilem?
2. Berapa dosis optimum hormon Oodev dalam mempercepat kematangan gonad pada calon induk ikan nilem?
1.3 Tujuan Penelitian
Adapun tujuan penelitian ini adalah untuk mengetahui :
1. Mengetahui pengaruh induksi hormon Oodev untuk mempercepat kematangan gonad pada calon induk ikan nilem.
2. Mengetahui dosis optimum hormon Oodev dalam mempercepat kematangan gonad pada calon induk ikan nilem.
1.4 Manfaat Penelitian
II TINJAUAN PUSTAKA
2.1Hormon Oodev (Oocyte Developer)
Hormon adalah zat kimia spesifik yang dihasilkan oleh kelenjar tubuh (glandula endrokrin) yang langsung masuk ke dalam aliran darah dan dibawa ke jaringan tubuh untuk membantu dan mengatur fungsi fisiologis (Sturkie, 1987). Semua hormon bersifat khas dan selektif dalam pengaruhnya terhadap organ sasaran yang ditentukan secara genetik (Nalbandov, 1964). Hormon Oodev merupakan kombinasi hormon pregnant mare’s serum gonadotropin (PMSG) dan antidopamin (AD) (Ahlina, 2015). Pada hormon Oodev memiliki PMSG yang mengandung gonadotropin berupa follicle stimulating hormone (FSH) dan sedikit
luteinizing hormone (LH). PMSG yang mengandung FSH akan mengaktivasi
gonad untuk mensintesis estradiol 17β dan mengaktivasi hati untuk aktivitas
vitelogenesis (Nagahama, 1983). Hormon Oodev juga menstimulasi sekresi gonadotropin karena ada antidopamin yang berfungsi untuk memblok dopamin. Pemberian antidopamin ini akan menstimulasi perilisan FSH dari pituitari (Rafiuddin, 2014).
2.2Dopamin dan Antidopamin
aktifator modulasi neuronal yang mampu mengatur beberapa fungsi fisiologis tubuh seperti kematangan gonad (Callier et al., 2003) dijelaskan lebih lanjut bahwa modulasi akan berlangsung jika ada rangsangan sensorik pada retina atau organ penciuman menyebabkan hipotalamus mengatur perilaku seksual dan kelenjar hipofisis akan mengatur pelepasan prolaktin. Menurut Mylonas dan Zohar (2001), di luar musim pemijahan ikan maka dopamin akan menghambat neurotransmitter saat melakukan instruksi kepada hipotalamus dalam mensekresi gonadotropin pada proses kematangan gonad.
Vidal et al., (2004) menyatakan salah satu upaya yang dapat dilakukan dalam kematangan gonad agar kerja fisiologis kelenjar hipotalamus dalam menghasilkan gonadotropin endogen (Gth) tetap berlangsung tanpa dipengaruhi oleh rangsangan sensorik adalah pemberian antidopamin. Chen dan Fernal (2008) menyatakan bahwa antidopamin adalah bahan kimia yang dapat menghentikan kerja dopamin. Pengaruh antidopamin akan merangsang hipofisa untuk menghasilkan gonadotropin yaitu FSH endogeneus yang memiliki fungsi dalam pematangan awal atau vitelogenesis (Ahlina, 2015). 2.3Klasifikasi
Gambar 1. Ikan nilem (Osteochilus hasselti) (Rachman dkk., 2015)
2.4 Morfologi
Morfologi ikan nilem dicirikan dengan ujung mulut runcing dengan moncong (rostral) terlipat, terdapat sungut peraba pada sudut–sudut mulut. Bentuk tubuh agak pipih, dan bintik hitam besar pada ekor. Sirip punggung terdiri dari tiga jari– jari keras dan 12–18 jari–jari lunak. Sirip ekor berbentuk simetris dan sirip dubur terdiri dari tiga jari–jari keras dan lima jari–jari lunak serta jumlah sisik–sisik gurat sisi berkisar antara 33–36 keping (Susanto, 2006).
Hardjamulia dan Atmawinata (1980) menyebutkan bahwa spesies ikan nilem dapat dibedakan dari warna sisik pada dasar sirip punggung yaitu coklat kehitaman yang biasa disebut Osteochilus hasselti sedangkan hitam kehijauan adalah Osteochilus vitatus. Rata–rata ikan nilem mempunyai panjang berkisar antara 25–32 cm dengan bobot 150–310 gr.
2.5 Tingkat Kematangan Gonad (TKG)
bertambah berat diikuti dengan semakin bertambah besar ukurannya termasuk diameter telur. Peningkatan ukuran gonad disebabkan oleh perkembangan stadia oosit. Pertambahan berat gonad pada ikan betina sebesar 10-25% dari berat tubuh (Effendie, 2002).
Dasar yang dipakai untuk menentukan tingkat kematangan gonad dengan cara morfologi ialah bentuk, ukuran, panjang, berat, warna dan perkembangan isi gonad yang dapat dilihat. Menurut Nikolsky (1969) dalam Effendie (1997) tingkat kematangan gonad ikan betina secara morfologi dan histologi adalah sebagai berikut :
a. Tingkat I : Ovari masih kecil seperti benang, warna ovari merah muda dan memanjang di rongga perut.
b.Tingkat II : Ukuran ovarium bertambah besar, warna ovari menjadi coklat muda, butiran telur belum terlihat.
c. Tingkat III : Ukuran ovari relatif besar dan mengisi hampir sepertiga rongga perut. Butiran-butiran telur telihat jelas dan berwarna kuning
muda.
d.Tingkat IV : Gonad mengisi penuh rongga perut, semakin pejal dan warna butiran telur kuning tua. Butiran telur besarnya hampir sama dan mudah dipisahkan. Secara histologi inti terlihat jelas dan sebaan kuning telur mendominasi oosit.
2. 6 Indeks Kematangan Gonad (IKG)
dan tingkat perkembangan ovarium, secara kuantitatif dapat dinyatakan dengan suatu Indeks Kematangan Gonad (IKG). Nilai IKG untuk mengetahui tingkat kematangan gonad saja tidak cukup memberikan informasi karakteristik aktivitas reproduksi. Pengamatan ukuran oosit dapat memberikan informasi lebih jelas tentang tingkatan aktivitas reproduksi (Tyler et al., 1991). Hubungan indeks kematangan gonad dengan tingkat kematangan gonad (TKG) diamati berdasarkan ciri-ciri morfologi kematangan gonad.
2.7 Hormon Oocyt Developer (Oodev) dalam Proses Vitelogenin
Oocyte developer (Oodev) yang berasal dari kombinasi pregnant mare’s
serum gonadotropin (PMSG) dan antidopamin (AD) (Farastuti, 2014). Hormon
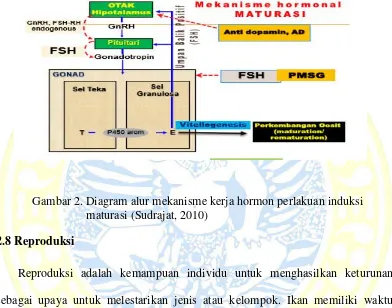
Oodev adalah hormon yang dapat merangsang perkembangan oosit pada ikan-ikan belum matang gonad dalam proses vitelogenin. Vitelogenesis diartikan-ikan sebagai proses deposisi protein vitelogenin dari hati ke dalam sitoplasma oosit. Mekanisme Oodev jika disuntikkan pada ikan akan menyebabkan perilisan gonadotropin endogen (Gth) dari hipotalmus seperti FSH-RH dan LH-RH serta terjaga konsentrasi FSH dan LH analog yang terdapat pada tubuh (Jalabert, 2005). Menurut Donaldson et al., (1983), pertumbuhan sel interestial ovarium dan pemasakan folikel akan mengalami pertambahan diameter dan kematangan telur hingga tahap siap untuk di ovulasikan atau ikan siap dipijahkan (dilihat pada Gambar 2).
yang dihasilkan oleh ovarium. Semakin banyak volume hormon estradiol 17β yang diproduksi di dalam gonad akan meningkatkan ukuran oosit yang selanjutnya akan meningkatkan volume dan bobot gonad ikan tersebut menyebabkan kematangan gonad (Arukwe dan Goksoyr, 2003).
Gambar 2. Diagram alur mekanisme kerja hormon perlakuan induksi maturasi (Sudrajat, 2010)
2.8 Reproduksi
Reproduksi adalah kemampuan individu untuk menghasilkan keturunan sebagai upaya untuk melestarikan jenis atau kelompok. Ikan memiliki waktu reproduksi yang berbeda-beda tergantung pada jenis, kebiasaan hidup dan habitat. Ikan nilem tergolong ikan yang memijah secara musiman. Di alam umumnya hanya pada saat musim penghujan saja (Cholik et al, 2005). Tipe reproduksi ikan nilem adalah partial spawner atau multiple spawner. Ikan nilem berpijah di perairan dikaitkan dengan fluktuasi tingginya permukaan air akibat hujan atau banjir (Junaidi dkk., 2015).
disukai ikan nilem berupa perairan jernih yang berarus lambat. Pemijahan ikan nilem berlangsung pada malam hari dengan suhu air berkisar antara 18–24o
C telur-telur yang telah terbuahi akan menetas dalam waktu 15–17 jam (Rachman dkk., 2015).
2.9 Kualitas Air
III KERANGKA KONSEPTUAL DAN HIPOTESIS
3.1 Kerangka Konseptual
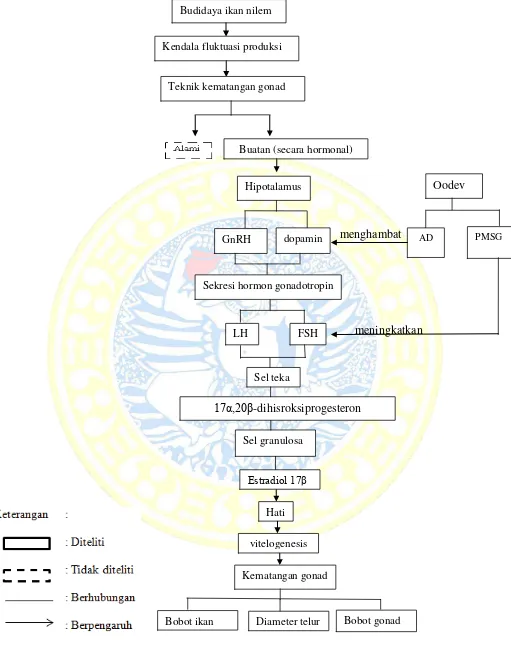
Ikan nilem (Osteochilus hasselti) merupakan komoditas air tawar yang banyak memiliki keunggulan komparatif. Beberapa potensi menguntungkan yang dimiliki adalah sumber protein hewani, pembersih badan air dan penyeimbang ekosistem perairan, sehingga ikan nilem dari berbagai ukuran banyak dibudidayakan maupun dijadikan sebagai bahan makanan olahan. Permintaan benih ikan nilem yang tinggi pada saat ini tidak dapat tersedia sepanjang tahun, hal ini disebabkan ikan nilem memijah hanya pada musim penghujan (Cholik et al., 2005). Upaya yang dapat dilakukan untuk mengatasi kendala tersebut adalah mempercepat waktu kematangan gonad melalui manipulasi hormonal menggunakan hormon maturasi oocyte developer (Oodev).
Oocyte developer (Oodev) yang berasal dari campuran pregnant mare`s
serum gonadotropin (PMSG) dan antidopamin (AD) (Farastuti, 2014).
enzim 20β-hidroksi steroid dehidrogenase. Selanjutnya steroid akan merangsang pembentukan faktor perangsang kematangan (Zairin, 2003).
Mekanisme hormonal Oodev yakni PMSG sebagai FSH yang berasal dari luar merangsang gonad untuk pematangan awal melalui perangsangan pada sel teka. Setelah itu testosteron masuk kedalam lapisan granulosa dan terjadi proses pengubahan testosteron menjadi estradiol-17β oleh enzim aromatase. Selanjutnya estradiol-17β akan merangsang hati untuk mensintesis vitelogenin yang merupakan bakal kuning telur. Saat sekresi FSH ditekan, maka LH akan meningkat. Kadar FSH dan LH dalam plasma darah ikan nilem dapat ditentukan sebagai indikator fase pertumbuhan gonad ikan nilem.
Faktor yang menentukan pendewasaan kelamin pada ikan nilem yaitu dopamin. Dopamin memberi kontribusi bagi gonad untuk menghambat fungsi estradiol 17β. Dopamin perlu dihambat dengan zat anti dopamin. Antidopamin sebagai neurotransmitter berfungsi untuk menghambat kerja dopamin, agar merangsang produksi FSH dan LH di kelenjar hipofisis. Selanjutnya, oosit akan dirangsang untuk mensintesis testosteron dan mengubahnya menjadi estradiol 17β dengan bantuan enzim aromatase.
penyerapan vitelogenin adalah oosit akan tumbuh membesar sampai kemudian berhenti bila telah mencapai ukuran yang maksimum. Keadaan ini disebut fase dorman, dimana telur hanya menunggu sinyal lingkungan untuk memijah.
Aktifitas vitelogenesis ini menyebabkan nilai GSI ikan meningkat (Cerda
et al., 1996). Sintesis vitelogenin dipengaruhi oleh estradiol-17β yang merupakan
menghambat
meningkatkan
Gambar 3. Bagan kerangka konseptual Kendala fluktuasi produksi
Teknik kematangan gonad
Buatan (secara hormonal)
Hipotalamus Oodev
PMSG AD
GnRH dopamin
Sekresi hormon gonadotropin
LH FSH
Sel teka
17α,20β-dihisroksiprogesteron
Sel granulosa
Estradiol 17β
Hati
vitelogenesis
Kematangan gonad
3.2 Hipotesis
Adapun hipotesis dari penelitian ini adalah: 1. Tingkat kematangan gonad
H0 : Penggunaan Oodev tidak mampu mempercepat kematangan gonad pada calon induk ikan nilem.
H1: Penggunaan Oodev mampu mempercepat kematangan gonad pada calon induk ikan nilem.
2. Dosis hormon Oodev
H0 : Tidak ada dosis Oodev optimum dalam mempercepat kematangan gonad pada calon induk ikan nilem.
IV METODOLOGI
4.1 Tempat dan Waktu Penelitian
Penelitian telah dilaksanakan pada bulan Januari 2016 sampai Maret 2016 di Balai Besar Perikanan Budidaya Air Tawar Sukabumi (BBPBAT), Jawa Barat.
4.2 Materi Penelitian 4.2.1 Alat
Peralatan yang digunakan dalam penelitian ini adalah syringe 1 mL dan 2,5
mL, sprayer bervolume 50 mL, kateter, timbangan digital, timbangan analitik,
aerasi, pompa air, selang pompa, selang aerasi, aerator, pipet, object glass, mikroskop, penggaris, DO meter, termometer, pH paper dan happa pemeliharaan berukuran 1,25 x 1,25 x 1 m3, kolam dilengkapi dengan saluran pemasukan air (inlet) dan saluran pembuangan (outlet). Debit air sekitar 25 cm3/detik.
4.2.2 Bahan
Bahan yang digunakan meliputi 40 ekor calon induk betina ikan nilem (belum pernah memijah) dengan bobot berkisar antara 100 gr, hormon oocyte
developer (Oodev) sebanyak 75 mL/kg dan pelet.
4.3 Metode Penelitian
pengamatan dan pencatatan secara langsung terhadap gejala-gejala subjek yang diteliti (Suryabrata, 2002).
4.3.1 Rancangan Penelitian
Rancangan penelitian yang digunakan adalah Rancangan Acak Lengkap (RAL), sebab dalam penelitian ini semua dikondisikan sama kecuali perlakuan (Kusriningrum, 2008). Penelitian ini terdiri dari lima perlakuan dengan empat ulangan, setiap ulangannya terdapat 10 ekor ikan uji. Perlakuaan tanpa dikenai induksi hormon Oodev sebagai kontrol sebagai P0, perlakuan pertama (P1) menggunakan dosis 0,25 mL/kg, perlakuan kedua (P2) menggunakan dosis 0,50 mL/kg, perlakuan ketiga (P3) menggunakan dosis 0,75 mL/kg, dan perlakuan keempat (P4) menggunakan dosis 1 mL/kg.
Tabel 1.Perlakuan dosis hormon yang akan diterapkan
Perlakuan ke Dosis
Perubahan yang diamati dalam penelitian ini adalah laju pertumbuhan spesifik, diameter telur dan indeks kematangan gonad.
Variabel dalam penelitian ini adalah sebagai berikut. Variabel bebas : dosis oocyte developer (Oodev)
Variabel kontrol : peralatan penelitian, pakan yang digunakan, calon induk ikan nilem yang digunakan, dan parameter kualitas air.
4.3.2 Prosedur Kerja
Penelitian yang dilakukan menggunakan 40 ekor calon induk ikan nilem yang belum pernah memijah dan telah dipelihara di Balai Besar Perikanan Budidaya Air Tawar Sukabumi (BBPBAT), Jawa Barat. Umur calon induk ikan nilem yang diteliti adalah 16 bulan dan bobot berkisar antara 100 gram, dibagi ke dalam lima perlakuan dengan empat ulangan.
Ikan nilem dimasukkan ke bak aklimatisasi. Ikan nilem dibiarkan terlebih dahulu satu hari tanpa diberi pakan. Pemberian pakan dilakukan pada hari berikutnya selama satu minggu. Aklimatisasi dilakukan dengan tujuan adaptasi lingkungan, pakan dan seleksi. Setelah satu minggu, dipilih induk sebanyak 40 ekor sebagai ikan uji.
Manajemen pemberian pakan dengan FR 3% per hari dari bobot tubuh total calon induk ikan nilem. Pakan yang digunakan berupa pelet terapung yang diberikan sebanyak tiga kali sehari yaitu pada pukul 09.00 WIB, pukul 12.00 WIB dan pukul 15.00 WIB. Masing-masing ulangan terdiri dari 10 ekor ikan. Setiap ulangan, ikan dibedakan dengan memberi tanda (marker) berupa tali plastik pada tulang keras sirip dorsal dengan warna yang berbeda. Setiap calon induk ikan nilem diberikan tanda agar mudah dalam memantau perkembangan dari masing-masing ikan percobaan pada setiap perlakuan.
masa maturasi (matang gonad). Kematangan gonad ikan dicirikan dengan perkembangan diameter rata-rata telur dan pola distribusi ukuran telur (Chinabut
et al., 1991). Sampling diameter telur untuk menentukan TKG mulai dilakukan
pada hari ke-7. Penyuntikan dilakukan secara intarmuscullar pada otot punggung. Pelaksanaan penyuntikan dimulai pada hari-1 dan selanjutnya dilakukan setiap 7 hari sekali mengacu pada penelitian Farastuti (2014). Kanuliasi untuk mengetahui perkembangan diameter telur dilakukan mulai hari ke-10, hari ke-14, hari ke-23, dan hari ke-30. Penyuntikan dihentikan saat ikan telah mempunyai tanda-tanda mengalami kematangan gonad. Percobaan berlangsung selama 4 minggu.
4.4 Parameter yang Diamati A. Parameter Utama
4.4.1 Laju Pertumbuhan Spesifik
Sampling laju pertumbuhan spesifik dimulai pada hari ke-1 kemudian sampling dilakukan setiap 7 hari sekali hingga berakhir masa maturasi, selanjutnya penimbangan dilakukan bersamaan dengan waktu penyuntikan. Laju pertumbuhan spesifik ikan uji dihitung dengan menggunakan rumus dari Dawes (1981).
Laju pertumbuhan spesifik = x 100%
Keterangan:
LPS : Laju pertumbuhan spesifik (%) t : lama pemeliharaan (hari)
4.4.2 Indeks Kematangan Gonad (IKG)
Perhitungan indeks kematangan gonad (IKG) dihitung berdasarkan suatu nilai dalam persen sebagai hasil dari perbandingan berat gonad dengan berat tubuh ikan termasuk gonad dikalikan dengan 100 persen sebanyak 1 ekor per perlakuan. Perhitungan IKG dihitung dengan rumus :
IKG = x 100%
Keterangan : IKG = indeks kematangan gonad (%) Bg = bobot gonad (gram)
Bt = bobot tubuh (gram) 4.4.3 Diameter Telur
Sampel telur diambil dengan kanulator diambil sebanyak 30 butir dan difiksasi dengan formalin bufer fosfat 10%. Diameter telur diukur menggunakan mikroskop binokuler Olympus type SZX16 perbesaran lensa 100 kali dan sambungan lup. Hasil pengamatan diarahkan dengan remote Olympus U–RVL–T yang ditampilkan pada monitor komputer menggunakan program software DP 2 BSW. Angka pengamatan yang tampak pada monitor menunjukan nilai diameter telur dan melakukan pengamatan secara kondisi visual kematangan telur.
B. Parameter Pendukung 4.4.4 Kualitas Air
4.5 Analisis Data
Data perhitungan laju perumbuhan spesifik diolah dengan menggunakan ANOVA (Analysis of Variance) dan dilanjutkan dengan uji jarak berganda Duncan dengan program SPSS ver. 23 for windows. Data indeks kematangan gonad (IKG) dan diameter telur dibahas secara deskriptif dengan bantuan program Ms.Esxel 2010. Alur penelitian dapat ditunjukkan pada gambar 4.
Penyuntikan dimulai hari ke 7 (penyuntikan setiap 7 hari)
V. HASIL DAN PEMBAHASAN
5.1 Hasil
5.1.1 Laju Pertumbuhan Spesifik
Pada penelitian ini laju pertumbuhan spesifik calon induk ikan nilem pada masing-masing perlakuan dihitung sesuai hingga berakhir masa maturasi. Pertambahan bobot tubuh ikan nilem dianalisis secara ANOVA. Hasil analisis menyatakan bahwa seluruh perlakuan berbeda nyata terhadap pertambahan bobot tubuh dibandingkan dengan kontrol. Pada akhir penelitian, diperoleh data laju pertumbuhan spesifik calon induk ikan nilem pada masing-masing perlakuan yang ditunjukkan pada Lampiran 3. Rata-rata persentase laju pertumbuhan spesifik calon induk ikan nilem selama penelitian ditunjukkan pada Tabel 2.
Tabel 2. Data laju pertumbuhan spesifik
Dosis Laju pertumbuhan spesifik (%) ± SD
Keterangan : Superskrip berbeda dalam satu baris menunjukkan ada perbedaan yang nyata (p<0,05).
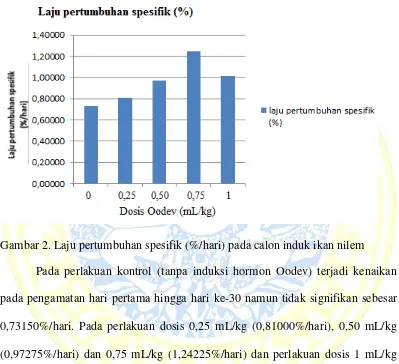
Rata-rata laju pertumbuhan spesifik terendah pada perlakuan dosis 0 mL/kg atau kontrol (0,73150%/hari). Rata-rata laju pertumbuhan spesifik selama penelitian dapat ditunjukkan dengan Diagram. Diagram rata-rata laju pertumbuhan spesifik selama penelitian dapat ditunjukkan Gambar 2.
Gambar 2. Laju pertumbuhan spesifik (%/hari) pada calon induk ikan nilem Pada perlakuan kontrol (tanpa induksi hormon Oodev) terjadi kenaikan pada pengamatan hari pertama hingga hari ke-30 namun tidak signifikan sebesar 0,73150%/hari. Pada perlakuan dosis 0,25 mL/kg (0,81000%/hari), 0,50 mL/kg (0,97275%/hari) dan 0,75 mL/kg (1,24225%/hari) dan perlakuan dosis 1 mL/kg (1,01300%/hari). Hal ini menunjukkan telah terjadi penurunan laju pertumbuhan spesifik pada dosis 1 mL/kg dibandingkan dosis 0,75 mL/kg.
5.1.2 Indeks Kematangan Gonad
tertuju pada perkembangan gonad (Mylonas et al., 2010). Perhitungan indeks kematangan gonad dilakukan pada tiap perlakuan. Pada perlakuan dengan dosis 0,25 mL/kg hingga 1 mL/kg terjadi pertambahan indeks kematangan gonad berbeda dengan tanpa perlakuan atau tanpa diberi induksi hormon Oodev tidak mengalami perubahan yang signifikan. Data indeks kematangan goand dapat ditunjukkan pada Lampiran 5.
Hasil analysis of variance (ANOVA) yang dilakukan akhir pengamatan menunjukkan bahwa setiap perlakuan induksi hormon Oodev memberikan pengaruh yang berbeda nyata terhadap indeks kematangan gonad ikan nilem (p<0,05). Hasil uji statistik selengkapnya dapat dilihat pada Tabel 3.
Tabel 3. Indeks kematangan gonad
Keterangan : Superskrip berbeda dalam satu baris menunjukkan ada perbedaan yang nyata (p<0,05).
Menurut Effendi (1979) indeks kematangan gonad adalah nilai kuantitatif yang digunakan untuk melihat gambaran perubahan gonad sebagai akibat tingkat perkembangan ovarium. Perkembangan nilai IKG terjadi dikarenakan adanya perkembangan garis tengah telur sebagai hasil pengendapan kuning telur, hidrasi dan pembentukan butir-butir minyak (Effendi, 1997).
Pada penelitian ini terlihat bahwa penyuntikan hormon Oodev memberikan pengaruh terhadap perkembangan gonad. Diagram indeks kematangan gonad dapat ditunjukkan Gambar 3.
Pada perlakuan kontrol (tanpa induksi hormon Oodev) terjadi peningkatan yang tidak terlalu siginifikan terhadap indeks kematangan gonad yaitu 1,1000±0,0391% sedangkan pada perlakuan dosis 0,25 mL/kg hingga 0,75 mL/kg terjadi kenaikan, perlakuan dosis 0,25 mL/kg diperoleh 3,6650±0,0946%, perlakuan dosis 0,50 mL/kg sebesar 3,7800±0,0734%, dan perlakuan dosis 0,75 mL/kg didapatkan hasil 3,8575±0,1173%, kemudian pada perlakuan 1 mL/kg mengalami penurunan yakni 3,8150±0,0806%.
Gambar 3. Indeks kematangan gonad (%) calon induk ikan nilem betina pada masing–masing perlakuan selama penelitian
5.1.3 Diameter Telur
pengamatan telur pada calon induk nilem betina yang diinduksi hormon Oodev mengalami fase maturasi (matang gonad) mulai terjadi pada hari ke-10 untuk perlakuan 4 pada dosis 1 mL/kg, disusul secara berturut–turut perlakuan 3 dosis 0,75 mL/kg pada hari ke-14, perlakuan 2 dosis 0,50 mL/kg pada hari ke-23 dan perlakuan 1 dosis 0,25 mL/kg pada hari ke-30, sedangkan pada kontrol belum ditemukan butiran–butiran kuning telur pada gonad.
Analisis statistik menunjukkan bahwa induksi hormon Oodev berpengaruh nyata terhadap diameter telur dibanding dengan kontrol (p<0,05) (Lampiran 8). Telur merupakan hasil akhir dari proses gametogenesis setelah oosit mengalami fase pertumbuhan yang sangat bergantung pada adanya hormon gonadotropin. Perkembangan diameter telur pada oosit telesotei ini umumnya disebabkan adanya akumulasi kuning telur (Ismail et al. 2011).
Diameter tertinggi terdapat pada perlakuan dosis 0,75 mL/kg sebesar 1,1075±0,0095 mm dan terendah terdapat pada perlakuan kontrol sebesar 0,0000±0,0000 mm. Diagram diameter telur dapat ditunjukkan Tabel 4.
Tabel 4. Diameter telur
Gambar 4. Ukuran diameter telur calon induk ikan nilem betina 5.1.4 Kualitas Air
Pengukuran kualitas air seperti suhu, pH dan oksigen terlarut (DO) dilakukan pada awal dan akhir penelitian. Pengukuran suhu menggunakan termometer, pengukuran pH menggunakan pH pen, dan pengukuran oksigen menggunakan DO test kit. Kisaran data kualitas air selama penelitian ditunjukkan pada Tabel 5. Data kualitas air selama penelitian ditunjukkan pada Lampiran 10.
Tabel 5. Kisaran parameter kualitas air
Parameter Kisaran
Oksigen terlarut (mg/l) 0,39-1,37
Suhu(ᵒC) 28,1-28,2
pH 6,7-6,9
5.2 Pembahasan
Untuk mempercepat perkembangan gonad ikan nilem, perlu adanya induksi hormonal, pada penelitian ini menggunakan hormon Oodev. Hormon Oodev merupakan kombinasi hormon yang mengandung pregnant mare’s serum
gonadotropin (PMSG) dan antidopamin (Fadhillah, 2016). Pada penelitian ini
menggunakan parameter laju pertumbuhan spesifik, indeks kematangan gonad dan diameter telur.
Hasil pada perlakuan dosis hormon Oodev 0,75 mL/kg merupakan dosis yang stabil kenaikan laju pertumbuhan spesifik, nilai indeks kematangan gonad dan ukuran diameter telur. Kemudian pada perlakuan dosis 1 mL/kg menjadi urutan kedua dosis hormon Oodev untuk mempercepat tahap matang gonad, selanjutnya perlakuan dosis 0,50 mL/kg dan 0,25 mL/kg. Perlakuan kontrol atau tanpa diinduksi hormon Oodev pada calon induk ikan nilem belum mengalami matang gonad.
induksi hormon Oodev terhadap pertambahan laju pertumbuhan spesifik calon induk ikan nilem betina karena menurut Effendi (1979) perkembangan gonad hingga stadium matang, bobot ikan akan mencapai 10-25% dari bobot tubuh ikan.
Pengaruh perkembangan gonad ini yang menyebabkan naiknya laju pertumbuhan spesifik. Peningkatan bobot juga dipengaruhi oleh proses perkembangan gonad yang berdampak pada konsumsi energi sehingga memerlukan energi yang lebih banyak untuk pembentukan gamet pada calon induk. Laju pertumbuhan spesifik (LPS) atau Spesific Growth Rate (SGR) ikan sangat bervariasi. Macam-macam faktor laju pertumbuhan spesifik ikan antara lain faktor luar merupakan faktor yang mempengaruhi pertumbuhan, seperti kandungan oksigen terlarut, suhu air, amonia, salinitas dan fotoperiod. Fakor dalam yaitu faktor yang sukar dikontrol, seperti seks, umur, keturunan, parasit dan penyakit, selain faktor luar dan dalam terdapat faktor lain yang dapat memacu pertumbuhan ikan yaitu aspek fisiologi pakan dan pencernaan. Lambatnya laju pertumbuhan disebabkan oleh dua faktor utama, yaitu kondisi ekternal pakan, dimana sumber nutrien yang terkandung di dalam formulasi pakan belum lengkap bagi ikan, sehingga tidak dapat memacu pertumbuhan pada tingkat optimal. Faktor internal ikan sehubungan dengan kemampuan ikan dalam memanfaatkan dan mencerna pakan untuk pertumbuhan bobot tubuh (Amin, 1998).
awal yang dipengaruhi oleh induksi hormon Oodev karena aktivitas metabolisme reproduksi ikan sebagian besar tertuju pada proses perkembangan gonad (Mylones et al., 2010). Pada hasil pengamatan menunjukkan nilai IKG yang berbeda karena dosis yang berbeda, hal ini karena hormon Oodev yang mempunyai daya kerja dominan FSH yang bekerja optimum pada calon induk ikan nilem pada perkembangan gonad tahap awal (GTH I). Peningkatan nilai IKG dapat disebabkan oleh perkembangan oosit yang berisi vitelogenin. Vitelogenin yaitu bakal kuning telur yang merupakan komponen utama dari oosit yang sedang berkembang. Saat proses vitelogenisis berlangsung maka granula kuning telur bertambah dalam jumlah dan ukuran sehingga volume oosit menjadi membesar, seiring dengan adanya perkembangan oosit yang ditandai dengan semakin meningkatnya IKG.
Ukuran rata-rata diameter telur ikan nilem yang diamati selama penelitian menunjukkan perkembangan karena diinduksi oleh hormon Oodev. Oocyte
developer (Oodev) yang berasal dari campuran pregnant mare`s serum
gonadotropin (PMSG) dan antidopamin (AD) (Farastuti, 2014). Mekanisme
hormonal Oodev yakni PMSG sebagai FSH yang berasal dari luar merangsang gonad kemudian gonadotropin releasing hormone (GnRH) akan merangsang hipofisa untuk sekresi hormon gonadotropin yang memiliki fungsi yaitu pematangan awal atau vitelogenesis.
Antidopamin pada hormon Oodev merupakan salah satu zat kimia yang dapat menghentikan kerja dopamin, sedangkan dopamin itu sendiri merupakan penghambat aktivitas pelepasan hormon GnRH dari hipotalamus. Dopamin menghambat pematangan gonad dengan menjadi gonadotropin-release inhibiting
factor (GRIH) (Dufour et al., 2005). Antidopamin sebagai neurotransmitter yang
Metoklopramid yang terkandung dalam senyawa antidopamin memberikan pengaruh untuk memblok reseptor melalui peningkatan pembakaran neuro dopaminergik (Mabudi et al., 2013).
Nagahama (1983) mengungkapkan bahwa alur mekanisme FSH yang terbawa oleh darah dan masuk ke dalam gonad selajutnya akan menginduksi lapisan sel teka untuk memproduksi testosteron, dan secara parakrin testosteron akan masuk ke sel granulosa kemudian dikoversi oleh enzim aromatase menjadi estradiol 17β. Estradiol 17β merupakan hormon yang sangat penting yang
dihasilkan oleh ovari terutama pada ikan betina yang sedang mengalami proses vitelogenesis. Estradiol 17β menglami peningkatan secara bertahap pada fase
vitelogenesis sejalan dengan peningkatan diameter telur. Peningkatan konsentrasi estradiol 17β dalam darah akan memacu hati melakukan proses vitelogenesis dan
selanjutnya akan mempercepat proses pematangan gonad oleh karena itu, kadar estradiol 17β dalam darah dapat digunakan sebagai indikator dari pematangan gonad (Zairin et al., 1992).
Berkaitan dengan tingkat kematangan telur adalah kadar estradiol 17β
akan menurun menjelang kematangan akhir. Menurut Singh dan Singh (1990) pada saat ovarium mencapai tingkat kematangan akhir, sintesis estradiol 17β akan menurun karena hal ini merupakan umpan balik negatif estrogen terhadap hormon yang menstimulasi sintesis estradiol 17β, lebih lanjut Zohar dan Mylonas (2001)
mengemukakan bahwa secara alami konsentrasi hormon estradiol 17β tinggi pada
Vesicle) dan kemudian mengalami penurunan pada fase pGV(peripheral
Germinal Vesicle).
Tingkat kematangan gonad ikan nilem pada awal penelitian (hari ke-0) 100% ikan nilem dalam TKG I yaitu tahap dara dengan ciri-ciri gonad yang masih kecil, berwarna putih abu-abu, bobot gonad 0,01-0,06 gr dan telur belum terbentuk. Menurut Effendie (2002) menyatakan bahwa TKG I yaitu tahap dara yang ditandai organ seksual sangat kecil berdekatan di bawah tulang punggung, ovarium transparan, tidak berwarna sampai abu-abu dan belum terbentuk telur. Tingkat kematangan gonad ikan nilem pada masing-masing perlakuan munujukkan hasil antara lain TKG pada perlakuan 4 dosis 1 mL/kg telah menunjukkan tahap TKG IV pada hari ke-10, pada perlakuan 3 dosis 0,75 mL/kg menunjukkan tahap TKG IV pada hari ke-14, kemudian pada perlakuan 2 dosis 0,50 mL/kg terjadi tahap TKG IV pada hari ke-23 dan terakhir pada hari ke-30 di perlakuan 1 dosis 0,25 mL/kg menunjukkan tahap TKG IV. Tingkat kematangan gonad (TKG) IV yaitu tahap bunting dengan ciri-ciri gonad berwarna kuning dan terbentuk telur berdiameter sekitar 1,1 mm, sedangkan pada perlakuan 0 mL/kg atau kontrol hanya dominan ada yang TKG II.
terbaik menggunakan dosis 1 mL/kg pada dosis perlakuan 3 dalam waktu 1 minggu.
Vitelogenesis merupakan suatu penggabungan protein-protein vitelogenin oleh oosit dan memprosesnya menjadi protein kuning telur sehingga menyebabkan peningkatan ukuran gonad ikan betina hingga maturasi akhir (Libzens et al., 2010). Penggunaan hormon Oodev yang mengandung PMSG dan antidopamin ternyata dapat mengningkatkan produksi telur dengan menginduksi kematangan gonad (Farastuti, 2014). Berdasarkan hasil pengamatan bahwa kisaran rata-rata diameter telur setelah diinduksi hormon oodev sebesar 1,1075±0,0095 mm. Peningkatan ukuran diameter telur ini disebabkan karena penyerapan glikolipoprotein dalam jumlah besar yang disebut vitelogenesis. Glikopopretein dibuat di liver dibawah kontrol hormon steroid yang terdapat pada ovarian folikel. Glikopoprotein ini jug berperan dalam perkembangan telur. pada keadaan ini telur dalam tahap oosit sekunder dan dapat terlihat dengan ukuran beraneka macam. Rata-rata diameter telur saat matang gonad pada penelitian ini sekitar 1,1 mm. Menurut Subagja dkk., (2006) menyatakan tingkat kematangan gonad dicirikan dengan diameter oosit mencapai 1,1 mm.
alami pada ikan nilem mengalami kematangan gonad dalam waktu 3 bulan (Subagja dkk., 2006) .
Hasil pengamatan yang didapatkan dari beberapa parameter diatas membuktikan bahwa induksi menggunakan hormon Oodev untuk kematangan gonad calon induk ikan nilem dapat mempercepat kematangan gonad. Pada perlakuan hormon Oodev dosis 0,75 mL/kg menunjukkan hasil lebih baik dibandingkan pada perlakuan dosis di atas 0,75 mL/kg hal ini dikarenakan dosis yang berlebihan dapat menghambat kerja organ target menyebabkan proses umpan balik negatif dari sekresi hormon gonadotropin akibat tingginya kandungan FSH yang dilepas. Nagahama dan Yamashita (2008) menyebutkan adanya kemungkinan mekanisme feedback negatif sehingga kandungan FSH yang cukup tinggi dapat menekan kerja LH endogen selanjutnya akan menekan gonadotropin untuk menghentikan sintesis estradiol 17β. Induksi hormon yang
berlebihan dapat mengganggu keseimbangan jumlah hormon dalam tubuh ikan, sehingga kelebihan hormon dikeluarkan oleh tubuh melalui sistem sekresi (Mylones et al., 2010). Pada berbagai dosis 0,25 mL/kg, 0,50 mL/kg, 0,75 mL/kg dan 1 mL/kg telah mengakibatkan kematangan gonad, namun perlakuan Oodev dosis 0,75 mL/kg diduga sebagai dosis yang optimum untuk mempercepat kematangan gonad.
untuk kehidupan ikan nilem. Hasil pengukuran kualitar air selama penelitian adalah suhu 28,1-28,2°C, pH 6,7-6,9 dan DO 0,39-1,37 ppm. Hasil pengukuran kualitas air pada penelitian ini umumnya masih berada dalam batas toleransi hidup bagi ikan. Menurut pendapat Boyd (1990) menyatakan suhu optimum bagi ikan pada umumnya berkisar 26-32°C. Kisaran pH selama penelitian 6,7-6,9 masih bisa ditoleransi, nilai pH yang terlalu rendah dan terlalu tinggi dapat mematikan ikan, pH yang ideal dalam budidaya perikanan adalah 5-9 (Syafriadiman et al., 2005).
VI KESIMPULAN DAN SARAN
6.1 Kesimpulan
Kesimpulan dari penelitian ini adalah :
1. Hormon Oodev mampu mempercepat kematangan gonad pada calon induk ikan nilem.
2. Dosis optimum hormon Oodev dalam mempercepat kematangan gonad calon induk ikan nilem adalah 0,75 mL/kg bobot dalam waktu 14 hari.
6.2 Saran
DAFTAR PUSTAKA
Ahlina, H. 2015. Induksi Maturasi Gonad Ikan Sidat (Anguilla bicolor bicolor) secara Hormonal dengan Menggunakan PMSG, AD dan rGH. Thesis. Bogor (ID): Institut Pertanian Bogor.
Arukwe A. and Goksoyr A. 2003. Eggshell and Egg Yolk Protein in Fish, Hepatic Protein for The Next Generation : Oogenetic, Population, and Evolutionary Implications of Endocrine Discruption. 2 : 4.
Bolamba D, Matton P, Estrada R, Dufour JJ. 1992. Effect of Pregnant Mare Serum Gonadotropin on Follicular Population and Ovulation Rates in Prepubertal Gilts With Two Morphologically Different Ovarium Types. Journal Of Animal Science.70: 1916-1992.
Boyd C.E. 1990. Water Quality Management in Pond Fish. Research and Development Series No. 22. International for Aquaculture. Agriculture Experiment Station, Auburn Alabama.
Callier S, Marina S, Stephanie LC, Delphine P, Jean DV and Philippe V. 2003. Evolution and cell biology of dopamine receptors in vertebrates. review, biology of the cell. Institut of neurobiology Alfred Fessand CNRS. France.
Chen CC, Fernald RD. 2008. GnRH and GnRH Receptors: Distribution, Function and Evolution. Journal of Fish Biology73: 1099–1120.
Chinabut S., P.Chanratchakool and M. Primpol.1991.Histopathological Studies of Infected Walking Catfish (Clarias macrocephalus). Gunther. In: Proceedings of The Seminar on Fisheries Department of Fisheries, Bangkok. 330-340 pp.
Cholik F, R.P. Poernomo dan A. Jauzi. 2005. Aquakultur : Tumpuan Harapan Masa Depan Bangsa. Masyarakat Perikanan Nusantara dan Taman Akuarium Air Tawar – TMII, Jakarta.
Dawes J.C. 1981. Marine Biology. John Wiley and Sons, New York.
Donaldson E, M. And Hunter G, A. 1983. Induced Final Maturation, Ovulation and Spermation in Cultured Fish. Fish Physiology. Academic Press. New York
Dufour S., F.A. Weltzien, M-E. Sebert, N. Le Belle, B. Vidal, P. Vernier, and C. Pasqualini. 2005. Dopaminergic Inhibition of Reproduction in Teleost Fishes. Ecophysiological and Evolutionary Implications. New York Academy of Sciences.
Dufour S, Sebert M E, Weltzien F A, Rousseau K, Pasqualini C. 2010. Neuroendocrine Control by Dopamine of Teleost Reproduction. Journal of Fish Biology. 76: 129-160.
Effendie MI. 1997. Biologi Perikanan. Yayasan Pustaka Nusantara, Yogyakarta. 5 Hlm.
.1979. Metode Biologi Perikanan. Yayasan Dewi Sri, Bogor. 112 Hlm.
. 2002. Biologi Perikanan. Yayasan Pustaka Tama, Yogyakarta.
Fadhillah, Radhi. 2016. Peningkatan Produksi Telur Ikan Nilem (Osteochilus
hasselti) Sebagai Sumber Kaviar Melalui Kombinasi Oodev, rGH dan
MinyakIkan Pada Pakan. Tesis. Institut Pertanian Bogor, Bogor.
Farastuti, Eko R. 2014. Induksi Maturasi Gonad, Ovulasi dan Pemijahan Pada Ikan Torsoro (Tor soro) Menggunakan Kombinasi Hormon. Tesis. Institut Pertanian Bogor, Bogor.
Hardjamulia A, dan Atmawinata S. 1980. Teknik Hipofisasi Beberapa Jenis Ikan Air Tawar. Lokakarya Nasional Teknologi Tepat Guna Bagi Pengembangan Perikanan Budidaya Air Tawar Bogor, Bogor. 1-16 Hlm. Ismail M. F. S, Siraj S. S, Daud S. K, Harmin S. A. 2011. Association of Annual
Hormone Profile With Gonad Maturity of Mahseer (Tor tambroides) in Captivity. General and Comparative Endocrinology,170: 125-130.
Jalabert B. 2005. Particularities of Reproduction and Oogenesis in Teleost Fish Compared to Mammals. Reproduction Natural Development. 45: 261-279. Junaidi Azrita dan Hafrijal Syandri. 2015. Fecundity of Bonylip Barb
(Osteochilus vittatus Cyprinidae) in Different Waters Habitats. International
Journal of Fisheries and Aquatic Studies.
Kusriningrum, R. 2008. Perancangan Percobaan. Universitas Airlangga. Surabaya. 43-51 Hal.
Libzens E, Young G, Bobe J, Cerdà J. 2010. Oogenesis in Teleosts: How Fish Eggs Are Formed. General and Comparative Endocrinology165: 367-389. Nalbandov, A. V. 1964. Reproductive Physiologis. 2nd Ed. W. H. Freeman & Co.,
San Fransisco.
Nagahama Y. 1983. The Functional Morphology of Teleost Gonads. In W. S. Hoar, D.J. Randall dan E.M. Donaldson. Fish Physiology.Volume IX B. Academic Press. 223-275 pp.
Nagahama Y, Yamashita M. 2008. Regulation of Oocyte Maturation in Fish. Development, Growth and Differentiation. 50 : 195- 219.
Nikolsky, G. V. 1969. Theory of Fish Population Dynamic, as The Biological Bacground of Rational Exploitation and The Management of Fishery Resources.
Rachman B., Agus Sasongko dan Dwi Hani Y. 2015. Inovasi Produksi Telur Pada Ikan Nilem (Osteochilus hasellti) Melalui Induksi Hormon dan Pengkayaan Nutrisi. Tehnikal Report. Balai Besar Perikanan Budidaya Air Tawar Sukabumi, Sukabumi.
Rafiuddin, Muhammad Ahya. 2014. Kloning, Karakterisasi dan Rekayasa Ekspresi Gen Follicle Stimulating Hormone Subunit Β Pada Ikan Patin Siam Pangasianodon Hypopthalmus untuk Mempercepat Maturasi Gonad. Tesis. Sekolah Pascasarjana Institut Pertanian Bogor,Bogor.
Rahardjo, A.A. dan Marliani, L. 2007. Nilem Diolah Naik Derajat. Trubus. Http://www.trubus.com. Diakses 10 Desember 2015.
Rochmatin, Yuliani Siti, Anhar Solichin, dan Suradi Wijaya Saputra. 2014. Aspek Pertumbuhan dan Reproduksi Ikan Nilem (Osteohilus hasselti) di Perairan Rawa Pening Kecamatan Tuntang Kabupaten Semarang. Diponegoro Journal of Maquarea Management of Aquatic Resources.
Saanin, H. 1984. Taksonomi dan Kunci Identifikasi Ikan jilid I dan II. Bina Tjipta, Bandung.
Singh, P.B. and Sigh, V. 1990. Seasonal Correlaton Changes Between Sex Steroid and Lipid Level in The Fresh Water Female Catfish (Heteropneustes
fossils). Journal Fish Biology. 37: 793-802.
Sihaloho, Ovie Indria Serena. 2014. Induksi Pematangan Gonad Calon Induk Ikan Patin Siam (Pangasianodon hypophthalmus) ukuran 3 Kg Menggunakan Oodev Melalui Penyuntikan. Tesis. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, Bogor. Sturkie, P. D. 1987. Avian Physiology. Springerverlag, New York.
Subagja, J., R. Gustiano dan L. Winarlin. 2006. Pelestarian Ikan Nilem
(Osteochilus hasselti C.V.) Melalui Teknoogi Pembenihannya. Lokakarya
Nasional Pengeloaan dan Perlindungan Sumber Daya Genetik di Indonesia: Manfaat Ekonomi untuk Mewujudkan Ketahanan Nasional. P 279-286. Sudrajat A.O, 2010. Pengantar Endrokrinologi. Materi Mata Kuliah
Endokrinologi. Institut Pertanian Bogor, Bogor.
Sukendi. 2008. Peran Biologi Reproduksi Ikan dalam Biotehnologi Pembenihan. Jurusan budidaya perairan, Fakultas perikanan dan Ilmu kelautan, Universitas Riau. Pekanbaru, Riau.
Sumantadinata, K. 1983. Pengembangbiakan Ikan-Ikan Pemeliharaan di Indonesia. P.T. Sastra Hudaya. Cetakan 2. Yogyakarta.
Suryabrata, S. 2002. Metodologi Penelitian. PT. Raja Grafindo Persada, Jakarta. Susanto. 2001 . Budidaya Ikan Air Tawar. Penebar Swadaya, Jakarta.
. 2006 . Budidaya Ikan Air Tawar. Penebar Swadaya, Depok.
Swanson P. 2008. Endocrine Regulation of Reproduction. http: // www .north west fishery sciense center . noaa . gov / research / divisions/ reutd/ phys_endo / endocrine . cfm Diakses 21 September2015.
Syafriadiman, Pamukas, N. A., Hasibuan, S. 2005. Prinsip Dasar Pengelolaan Kualitas Air. Mina Mandiri Press. Pekanbaru. 131 Hlm.
Tampubolon RV, Sukimin S, Rahardjo MF. 2002. Aspek Biologi Reproduksi dan Pertumbuhan Ikan Lemuru Sardirtella longiceps CV di perairan teluk Sibolga. Jurnal Ikhtiologi Indonesia. 2 : 1-7.
Tyler, C.R., J.P. Sumpter, H. Kawauchi, and P. Swanson. 1991. Involvement of Gonadotropin in The Uptake of Vitellogenin Into Vitellogenic Oocytes of The Rainbow Trout, Oncorhynchus mykiss. General and Comparative Endocrilogy. 84: 291-299.
Vidal V, Catherine P, Nadine L B, Claire H, Holland, Miskal S, Philippe V, Yonathan Z and Sylvie D. 2004. Dopamine Inhibits Luteinizing Hormone Synthesis and Release In The Juvenile European Eel: A Neuroendocrine Lock For The Onset Of Puberty. Journal. Biology Of Reproduction. University of Maryland Biotechnology Institute, Baltimore, Maryland, United States of America.
Willougbhy, S. 1999. Manual Of Salmonid Farming. Black Well Science. London.
Yaron Z. 1995. Endocrine Control Of Gametogenesis and Spawning Induction in The Carp. Aquaculture, 129 : 49 – 73.
Zairin M. Furukawa, and Aida. 1992. Induction of Ovulation by hCG Injection in Tropical Walking Catfish Clarias batrachus Reared Under. 23-250C. Nippon Suisan Gakkaishi. 58:1681-1685.
Lampiran 1. Dokumentasi Penelitian
Gambar Calon Induk Dara Keterangan : Calon Induk Dara (A) Perut Kempis
(B) Urogenital Tampak Masih Menutup
Lampiran 2. Gambaran Gonad Ikan Nilem
P0 : Perlakuan menggunakan dosis 0 mL/kg hari ke-30 belum mengalami kematangan gonad.
P2 : Perlakuan menggunakan dosis 0,50 mL/kg hari ke-23 telah mengalami kematangan gonad.
Lampiran 3. Data Pertumbuhan Rata-Rata Bobot Pada Setiap Perlakuan (g) Perlakuan Bobot Tubuh Awal (g) Bobot Tubuh Akhir (g)
Post Hoc Tests
Homogeneous Subsets LPS
Duncana
Perlakuan N
Subset for alpha = 0.05
1 2 3
0 ml/kg 4 ,73150
0,25 ml/kg 4 ,81000
0,50 ml/kg 4 ,97275
1 ml/kg 4 1,01300
0,75 ml/kg 4 1,24225
Sig. ,253 ,551 1,000
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 4,000.
Lampiran 7. Data Rata-Rata Diameter Telur (µm)
No. Perlakuan 1(µm) Perlakuan 2(µm) Perlakuan 3 (µm) Perlakuan 4(µm)
1 1101,31 1101,61 1151,13 1101,09
Post Hoc Tests
Homogeneous Subsets Diameter Telur
Duncana
Perlakuan N
Subset for alpha = 0.05
1 2
0 mL/kg 4 ,0000
0,25 mL/kg 4 1,1025
0,50 mL/kg 4 1,1050
1 mL/kg 4 1,1050
0,75 mL/kg 4 1,1075
Sig. 1,000 ,299
Lampiran 9.Gambaran Diameter Telur Ikan Nilem
a. Gambar diameter telur pada perlakuan 1
c. Gambar diameter telur pada perlakuan 3
Lampiran 10. Gambaran Diameter Telur Ikan Nilem
Waktu Parameter Pengamatan
Minggu ke-1 DO (mg/l) 0,39
pH 6,7
Suhu (ᵒC) 28,1
Minggu ke-4 DO (mg/l) 1,37
pH 6,9