KINERJA PERTUMBUHAN IKAN JELAWAT
Leptobarbus hoeveni
Blkr
SABARIAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SELEKSI BAKTERI PROBIOTIK
DARI SALURAN PENCERNAAN UNTUK MENINGKATKAN
KINERJA PERTUMBUHAN IKAN JELAWAT
Leptobarbus hoeveni
Blkr
SABARIAH
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama : Sabariah
NIM : C151070151
Disetujui
Komisi Pembimbing
Dr. Dedi Jusadi Dr. Widanarni
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Ilmu Akuakuktur
Prof. Dr. Enang Harris Prof. Dr. Ir. Khairil Anwar Notodiputro, MS.
Jelawat FishLeptobarbus hoeveni Blkr. Under supervision of DEDI JUSADI and WIDANARNI.
The effect of probiotics isolated from jelawat fish gut Leptobarbus hoeveni supplemented into the diet on enzym activities, growth performance of jelawat fish and digestibility was investigated. A triplicate experiment was conducted using 6-7 g jelawat fish. Each fish was fed on the diet supplemented with either probiotics produce amylase (U4), produce lypase (S1), produce protease (U12), produce protease, lypase and amylase (U7) or control (no supplementation of probiotics). Regardless of the strain, the application of probiotics significantly increased the bacteria population in the fish gut, thereby digestibility and protein retention, food conversion ratio and growth of fish significantly improved. On the other hand, fish fed on the diet supplemented with U4 probiotics had the best growth performance. Therefore, U4 is the best probiotics isolated from the jelawat fish gut to use as a supplementary diet for jelawat fish.
RINGKASAN
SABARIAH. Seleksi Bakteri Probiotik dari Saluran Pencernaan untuk Meningkatkan Kecernaan Pakan dan Pertumbuhan Ikan Jelawat Leptobarbus hoeveni Blkr. Dibimbing oleh DEDI JUSADI dan WIDANARNI.
Kualitas pakan sangat menentukan laju pertumbuhan ikan. Pakan yang dikonsumsi oleh ikan tidak semuanya dapat dicerna namun ada yang dikeluarkan dalam bentuk limbah berupa feses dan sisa metabolisme lain seperti urin dan amoniak. Besarnya pakan yang dikeluarkan menjadi feses tergantung dari kesesuaian komponen pakan dengan kemampuan enzimatik di saluran pencernaan ikan atau daya cerna. Pakan yang berkualitas selain dihasilkan dari sumber bahan pakan juga dapat dihasilkan dengan penambahan enzim dalam pakan. Peningkatan enzim pencernaan dengan memanfaatkan bakteri saluran pencernaan pada ikan telah banyak dilaporkan. Adanya informasi tentang peranan bakteri dalam saluran pencernaan yang memiliki kemampuan enzimatis atau mampu menyumbangkan enzim kecernaan sehingga membantu proses penyerapan makanan. Berdasarkan informasi tersebut dibuat suatu rancangan penelitian untuk menyeleksi bakteri dari saluran pencernaan ikan jelawat sebagai probiotik untuk meningkatkan kinerja pertumbuhan ikan jelawat.
Penelitian ini dilakukan dalam dua tahap secara in vitro dan in vivo. Penelitian in vitro meliputi isolasi bakteri kandidat probiotik, seleksi bakteri kandidat probiotik yang terdiri dari 1) uji aktivitas proteolitik, lipolitik dan amilolitik, 2) uji pertumbuhan bakteri, 3) uji ketahanan terhadap asam lambung dan garam empedu, 4) uji penempelan, 5) uji aktivitas antagonistik terhadap bakteri patogen. Uji in vivo meliputi: 1) Uji patogenitas bakteri kandidat probiotik serta 2) uji pakan percobaan pada kinerja pertmbuhan. 3) Uji daya cerna pakan dan uji aktivitas enzim saluran pencernaan. Penelitian kinerja pertumbuhan menggunakan Rancangan Acak Lengkap dengan 5 perlakuan dan 3 ulangan. Pakan yang diujikan terdiri dari A) pakan komersial yang tidak ditambahkan probiotik, B) pakan komersial yang ditambah isolat terbaik penghasil protease (isolat U12), C) pakan komersial yang ditambah isolat terbaik penghasil lipase (isolat S1), dan D) pakan komersial yang ditambah isolat terbaik penghasil amilase (isolat U4), E) pakan komersial yang ditambah isolat terbaik penghasil protease, lipase dan amilase (U7).
oleh perlakuan U4 yaitu pemberian pakan yang ditambah isolat yang memiliki aktivitas enzim amilase tertinggi. Kecernaan yang tinggi menyebabkan protein dan energi nutrien pakan yang dapat diserap ikan akan lebih tinggi sehingga energi akan lebih banyak tersimpan untuk pertumbuhan. Perlakuan U4 juga menunjukkan hasil konversi pakan yang paling baik dibandingkan lainnya. Enzim amilase lebih efektif pada ikan jelawat untuk mencerna pakan. Penambahan probiotik pada pakan komersial terhadap ikan uji juga memberikan pengaruh yang nyata pada populasi bakteri di saluran pencernaan ikan uji dibandingkan kontrol. Hal ini memacu peningkatan aktivitas enzim endogenous yang diproduksi oleh bakteri dalam saluran pencernaan. Enzim amilase yang disekresikan oleh isolat U4 mampu meningkatkan kinerja pertumbuhan ikan jelawat.
Kelangsungan hidup ikan uji memberikan hasil yang tidak berbeda nyata antar perlakuan. Hal ini mungkin diakibatkan oleh kuantitas serta kualitas pakan yang diberikan cukup untuk mempertahankan kebutuhan pokok ikan serta lingkungan yang terjaga dengan baik selama pemeliharaan.
© Hak Cipta Milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
Dengan ini saya menyatakan bahwa tesis
Seleksi Bakteri Probiotik dari
Saluran Pencernaan untuk Meningkatkan Kecernaan Pakan dan Pertumbuhan
Ikan Jelawat
Leptobarbus hoeveni
Blkr.
adalah karya saya dengan arahan dari komisi
pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana
pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun
tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam
Daftar Pustaka di bagian akhir tesis ini.
Bogor, Maret 2010
PRAKATA
Puji yukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga
karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian ini adalah
probiotik dengan judul Seleksi Bakteri Probiotik dari Saluran Pencernaan untuk
Meningkatkan Kecernaan Pakan dan Pertumbuhan Ikan Jelawat
Leptobarbus hoeveni
Blkr.
Terima kasih penulis ucapkan kepada Dr. Dedi Jusadi dan Dr. Widanarni selaku
pembimbing, serta Dr. Bambang Priyo Utomo selaku dosen penguji yang telah banyak
membantu serta memberikan saran. Di samping itu, penghargaan penulis sampaikan
kepada Bapak Ranta. Ungkapan terima kasih penulis sampaikan kepada orang tua, suami
dan putra tersayang Dimas Sakti Maulana, Dino Prasetyo dan Darnas Seto Mulyo serta
kakak dan abang atas doa, cinta dan kasih sayang, pengertian serta dorongan yang selalu
diberikan. Terima kasih juga disampaikan kepada teman-teman AKU (Mulyati, Suryati,
Mulyasari, Suryansyah, Dominggas, Ratnawati, Dian Retnosari, Denny S, Tita N,
Swastika Dita, Indra L, Alias R, Deisi H, Didik A, Limin S, Ellen S, Ujang D, Darmi,
Mirna F, Dasu R, Afrizal H, Adang S, Purnamawati, ibu Yulintin, ibu Indira, ibu Ayu,
mbak Hesti, Pak Otik, pak Gufron, Pak Andi dan teman-teman AKU lainnya (S2 dan S3
angkatan 2007, 2008 dan 2009). Terima kasih kepada teman-teman di SUPM Negeri
Pontianak. Ucapan terima kasih juga disampaikan kepada semua pihak yang telah
membantu, baik secara langsung maupun tidak langsung.
Penulis menyadari bahwa tesis ini masih jauh dari kesempurnaan, untuk itu saran
dan kritik yang bermanfaat akan penulis terima dengan lapang dada. Semoga karya
ilmiah ini bermanfaat. Amin.
Bogor, Maret
Sabariah
Penulis dilahirkan di Teluk Pakedai (Kalimantan Barat) pada tanggal
10 Juni 1975 dari Ayah H. Ambo' Dallek (Almarhum) dan Ibu Hj.
Rahmah. Penulis merupakan putra ke lima dari tujuh bersaudara.
Pada tahun 1994 penulis lulus dari SUPM Negeri Pontianak dan
diterima sebagai tenaga honorer pada SUPM Negeri Bone Sulawesi
Selatan. Pada tahun 1999 melanjutkan studi S1 di Fakultas Perikanan
dan Ilmu Kelautan Univ. Muhammadiyah Pontianak dan lulus pada
tahun 2003. Tahun 2003 diterima menjadi PNS menjadi guru di
SUPM Negeri Pontianak. Pada tahu
n
7 penulis melanjutkan
studi pada Ilmu Akuakultur, Sekolah Pascasarjana IPB.
i
DAFTAR ISI
Halaman
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
DAFTAR LAMPIRAN ... v
PENDAHULUAN Latar Belakang ………... 1
Perumusan Masalah ………... 2
Tujuan dan Manfaat Penelitian ………... 3
TINJAUAN PUSTAKA Lingkungan Hidup dan Kebiasaan Makan Ikan Jelawat ... 4
Pencernaan Ikan Jelawat....………... 5
Jenis-jenis Probiotik ... 7
Mekanisme Kerja Bakteri Probiotik ... 9
METODE PENELITIAN Waktu dan Tempat Penelitian ... 11
Tahapan Penelitian... 11
Isolasi dan Pemurnian Bakteri Kandidat Probiotik ... 11
Seleksi Bakteri ... 12
Pengujian Aktivitas Proteolitik, Lipolitik dan Amilolitik.... 12
Penentuan Fase Pertumbuhan Bakteri ... 12
Uji Ketahanan terhadap Asam Lambung dan Garam Empedu ... 13
Uji Penempelan ... 13
Uji Aktivitas Antagonistik terhadap Bakteri Patogen ... 14
Uji Patogenisitas Bakteri Kandidat Probiotik pada Ikan Jelawat.. 14
Pakan Percobaan pada Ikan Jelawat... 15
Uji Pertumbuhan pada Ikan Jelawat... 16
Uji Daya Cerna Pakan... 18
Analisis Data ... 19
HASIL DAN PEMBAHASAN Hasil ... 20
Isolasi dan Pemurnian Bakteri Kandidat Probiotik ... 20
Seleksi Bakteri ... 20
Aktivitas Proteolitik, Lipolitik dan Amilolitik... 20
Fase Pertumbuhan Bakteri ... 21
Ketahanan terhadap Asam Lambung dan Garam Empedu ... 23
Penempelan Bakteri ... 24
Aktivitas Antagonistik terhadap Bakteri Patogen ... 24
Patogenisitas Bakteri Kandidat Probiotik pada Ikan Jelawat .. 25
Pertumbuhan Ikan Jelawat... 26
Aktivitas Enzim Saluran Pencernaan ... 27
Pembahasan ………... 28
KESIMPULAN DAN SARAN Kesimpulan ... 32
Saran ... 32
DAFTAR PUSTAKA ... 33
iii
DAFTAR TABEL
Halaman
1. Hasil analisa proksimat pakan komersil yang digunakan... 15
2. Laju pertumbuhan harian (LPH ), jumlah konsumsi pakan (JKP), ekonversi pakan (FCR), retensi protein (RP), kecernaan pakan (KP) dan kelangsungan hidup (SR) pada ikan jelawa... 26
DAFTAR GAMBAR
Halaman
1. Skema tata letak akuarium ... 16
2. Hasil aktivitas proteolitik, lipolitik dan amilolitik ... 20
3. Diameter hidrolisis enzim oleh isolat proteolitik, lipolitik dan amilolitik. 21 4. Kurva nilai kerapatan optik (Optical Density) ... 22
5. Selisih log (cfu/ml) jumlahbakteri pada pH 2.5 dengan pH normal ... 23
6. Selisih log (cfu/ml) jumlahbakteri pada pH 7.5 dengan pH normal ... 23
7. Hasil uji penempelan isolat bakteri pada lempeng baja ... 24
8. Aktivitas antagonistik isolat kandidat probiotik terhadap A. hydrophila.. 25
9. Perubahan bobot rata-rata individu ikan jelawat (g) perlakuan kontrol (tanpa probiotik), U12 (protease), S1 (lipase), U4 (amilase) dan U7 (protease, lipase dan amilase) ... 26
v
DAFTAR LAMPIRAN
Halaman
1. Uji hidrolisis kasein, lemak dan pati ... 38
2. Prosedur penambahan bakteri kandidat probiotik pada pakan komersil yang digunakan………... 39
3. Hasil analisa proksimat pakan penelitian (% bobot kering) ... 39
4. Prosedur analisis nilai kecernaan pakan (Takeuchi. 1988)... 40
5. Prosedur memperoleh ekstrak enzim usus ikan jelawat ... 41
6. Uji aktivitas enzim amilase, protease dan lipase ……….. 42
7. Nilai kerapatan Optik (Optical density) ….. 44
8. Hasil pengujian ketahanan isolat mikrab amilolitik, proteolitik dan lipolitik terhadap asam lambung dan garam empedu ... 45
9. Hasil uji penempelan isolat bakteri amilolitik, proteolitik dan lipolitik pada lempeng baja ... 46
10. Aktivitas antagonistik terhadap bakteri patogen ……….. 46
11. Perhitungan laju konsumsi pakan, laju pertumbuhan harian, efisiensi pakan, kelangsungan hidup dan kecernaan pakan ikan jelawat... 47
12. Perhitungan retensi protein ... 48
13. Analisis ragam laju konsumsi harian ikan jelawat selama pemeliharaan ... 49
14. Analisis ragam dan uji Duncan laju pertumbuhan harian ikan jelawat selama pemeliharaan ... 49
15. Analisis ragam dan uji Duncan retensi protein (%) ikan jelawat selama pemeliharaan ... 50
16. Analisis ragam dan uji Duncan konversi pakan (%) ikan jelawat selama pemeliharaan ... 50
17. Analisis ragam dan uji Duncan kecernaan protein (%) ikan jelawat selama pemeliharaan ... 51
18. Analisis ragam dan uji Duncan kecernaan total (%) ikan jelawat selama pemeliharaan ... 51
20. Analisis ragam dan uji Duncan populasi bakteri probioik pada
ikan jelawat diakhir pemeliharaan ... 53
21. Analisis ragam dan uji Duncan aktivitas enzim protease ikan jelawat selama pemeliharaan ... 53
22. Analisis ragam dan uji Duncan aktivitas enzim lipase ikan jelawat
selama pemeliharaan ... 54
PENDAHULUAN
Latar Belakang
Ikan jelawat Leptobarbus hoeveni Blkr adalah jenis ikan air tawar lokal
yang digemari oleh masyarakat Riau, Jambi, Sumatera Selatan, Kalimantan
Tengah dan Kalimantan Barat (Said 1999). Namun kemungkinan diduga
karena kecernaan pakan ikan jelawat rendah, sehingga pertumbuhan ikan
jelawat menjadi lambat. Hasil penelitian Truong et al. (2003) dengan lama
pemeliharan 60 hari pada fase fingerling dari berat 1,39 g dan panjang 5,10 cm
menghasilkan berat 2,54 g dan panjang rata-rata 6,26 cm.
Salah satu yang dapat dilakukan untuk meningkatkan pertumbuhan
adalah dengan meningkatkan kecernaan pakan melalui penambahan bakteri
probiotik. Macey dan Coyne (2005) mengemukakan bahwa probiotik yang
mempunyai pengaruh positif bagi inangnya mempunyai beberapa kriteria,
antara lain tidak bersifat patogen; sebaiknya merupakan mikroflora normal
usus agar lebih mudah menyesuaikan diri dengan lingkungan usus; toleran
terhadap asam lambung dan garam empedu; memiliki kemampuan untuk
menempel dan mengkoloni sel usus; dan memiliki pengaruh yang
menguntungkan terhadap kesehatan. Produk probiotik diharapkan mempunyai
sel hidup yang besar yakni berkisar antara 107 sampai 109 cfu/ml. Berdasarkan
hasil penelitian Murni (2004) penambahan bakteri probiotik Bacillus sp. dalam
pakan buatan mampu meningkatkan laju pertumbuhan ikan gurami, karena
aktivitas enzim pencernaan meningkat, yaitu aktivitas enzim protease
meningkat dari 0,55 menjadi 0,86 unit/menit/ml dan aktivitas enzim amilase
meningkat dari 663,7 menjadi 851,8 unit/menit/ml. Menurut Fardiaz (1992)
sebagian dari Bacillus sp. mempunyai sifat proteolitik yang dapat
mensekresikan enzim protease, sebagian mempunyai sifat lipolitik yang dapat
mensekresikan enzim lipase dan bersifat amilolitik yang dapat mensekresikan
enzim amilase. Keberadaan enzim-enzim ini dapat membantu meningkatkan
Beberapa jenis bakteri yang terdapat dalam saluran pencernaan hewan
memiliki peran penting dalam rangka meningkatkan pemanfaatan pakan,
kesehatan ikan, dan perbaikan mutu lingkungan dan mikroorganisme
(Kesarcodi-Watson et al. 2008). Selain itu, beberapa bakteri flora pada saluran
pencernaan memainkan peran yang cukup penting dan menghasilkan beberapa
jenis enzim dalam saluran pencernaan yang kemungkinan turut berperan
dalam metabolisme inang. Karena itu perlu pengkajian bakteri yang terdapat
dalam saluran pencernaan ikan jelawat untuk mengetahui potensi enzimnya
dalam memacu pertumbuhan ikan jelawat.
Perumusan Masalah
Ikan jelawat dikelompokkan dalam ikan pemakan tumbuhan
(herbivora). Hasil identifikasi pakan di dalam saluran pencernaannya, pakan
yang ditemukan adalah biji-bijian, buah-buahan dan tumbuhan air (Balitkanwar
1996). Jenis pakan ini mempunyai kandungan serat yang tinggi, sehingga sulit
dicerna dan menyebabkan pertumbuhan ikan jelawat lambat.
Penambahan bakteri probiotik dalam pakan buatan akan mempengaruhi
kinerja atau aktivitas enzim pencernaan, sehingga proses pencernaan dan
penyerapan nutrien pakan oleh tubuh ikan akan lebih baik, yang pada akhirnya
pertumbuhan ikan jelawat menjadi lebih cepat. Namun tidak setiap probiotik
sesuai untuk semua spesies ikan, hal ini berhubungan dengan aktivitas enzim
yang bervariasi.
Secara alami aktivitas enzim pencernaan pada ikan berhubungan
dengan jenis ikannya. Helver (2002) dan Krogdahl et al. (2005) menyatakan
bahwa pada ikan herbivora aktivitas enzim amilase lebih tinggi daripada
aktivitas enzim protease dan lipase. Demikian juga aktivitas enzim protease
dan lipase ikan omnivora dan karnivora lebih tinggi daripada enzim amilase.
Pada ikan jelawat diharapkan probiotik yang diberikan dapat meningkatkan
aktivitas enzim sesuai dengan kebutuhannya. Oleh karena itu perlu penelitian
bakteri probiotik yang sesuai dan dapat meningkatkan aktivitas enzim
percernaan untuk dicampur dalam pakan buatan ikan jelawat, sehingga dapat
3
Tujuan dan Manfaat Penelitian
Tujuan dari penelitian ini adalah untuk memperoleh bakteri dari saluran
pencernaan ikan jelawat yang dapat meningkatkan aktivitas enzim pencernaan
yang menghasilkan kecernaan pakan tinggi sehingga dapat meningkatkan
pertumbuhan ikan jelawat.
Manfaat dari hasil penelitian ini diharapkan dapat memberikan
informasi jenis-jenis bakteri probiotik dari saluran pencernaan yang mampu
TINJAUAN PUSTAKA
Lingkungan Hidup dan Kebiasaan Makan Ikan Jelawat
Menurut Said (1999) ikan jelawat merupakan ikan asli perairan umum
yang penyebarannya hampir di seluruh Sumatera, Kalimantan, sebagian Jawa
dan Sulawesi Utara. Sunarno (1989), mengatakan bahwa ikan jelawat tersebar
di perairan-perairan sungai dan daerah genangan atau rawa di Kalimantan dan
Sumatera serta kawasan Asia Tenggara dan lainnya seperti Malaysia, Thailand,
Vietnam, dan Kamboja. Selanjutnya Asyari dan Gaffar (1993) menyatakan
bahwa ikan jelawat banyak di temui di sungai-sungai dan daerah genangan
kawasan tengah hingga hilir, bahkan di bagian muara sungai, dan pada saat air
menyusut benih ikan jelawat beruaya ke arah bagian hulu sungai. Said (1999)
menambahkan bahwa habitat yang di sukai ikan jelawat adalah anak-anak
sungai yang berlubuk dan berhutan di bagian pinggirnya.
Ikan jelawat memerlukan kondisi fisika dan kimia air yang optimal.
Pada umumnya ikan jelawat hidup di perairan yang bersuhu 25–27oC, oksigen
terlarut 4–9 ppm dan pH air 6,3–7,5 (Arifin et al. 1992). Namun untuk hidup
normal dan tumbuh baik, ikan ini memerlukan suhu 26–28,5oC (Ondara dan
Sunarno 1987a), oksigen terlarut 5–7 ppm (Arifin et al. 1992) dan pH air 7,0–
7,5 (Ondara dan Sunarno 1987b). Walaupun diperlukan pH air yang relatif
normal untuk hidup dan tumbuh baik, ikan jelawat juga ditemukan hidup pada
perairan yang sedikit asam (Arifin et al. 1992).
Ikan jelawat yang berukuran besar bersifat omnivora yang cenderung
herbivora (Sunarno 1991). Hasil pemeriksaan usus ikan jelawat pada beberapa
perairan yang dilakukan oleh Said (1999), menunjukkan bahwa makanan ikan
jelawat terdiri dari biji-bijian, buah-buahan dan tumbuhan air. Ikan jelawat
yang di pelihara dalam kolam dapat memakan singkong, daun singkong, daun
pepaya, ampas dan bungkil kelapa, cincangan daging ikan, ikan rucah, usus
ayam dan pakan buatan berbentuk pelet (Sunarno dan Reksalegora 1982).
Berdasarkan bentuk mulutnya, ikan jelawat lebih menyukai makanan
yang melayang dengan cara menyambar makanan, tetapi ikan jelawat dapat
5
dan Reksolegora (1982) menyatakan bahwa ikan jelawat yang diberi pakan
berbentuk pelet cenderung tumbuh lebih cepat dari pada yang diberi pakan
berbentuk gumpalan. Ikan jelawat yang berukuran fingerling dapat mencapai
berat 0,6-0,9 kg/ekor selama delapan bulan, lama pemeliharaan ikan konsumsi
4-6 bulan dengan ukuran benih pada saat penebaran antara 12-15 cm.
Sedangkan lama pemeliharaan untuk mencapai induk ± 12 bulan (Sunarno
1989).
Pencernaan Ikan Jelawat
Pencernaan merupakan suatu proses yang berlangsung terus-menerus.
Pada umumnya pencernaan makanan adalah proses hidrolisa protein menjadi
asam amino atau polipeptida sederhana dan karbohidrat menjadi gula
sederhana serta dari lipid menjadi gliserol dan asam lemak (Mohanta et al.
2007).
Produksi sari makanan dan hidrolisa nutrien makro pada sistem
pencernaan ikan dimungkinkan dengan adanya enzim pencernaan, seperti
protease, amilase, karbohidrase dan lipase serta asam lambung.
Kesarcodi-Watson et al. (2008) menyatakan bahwa dalam saluran pencernaan ikan,
makanan dicerna dan kemudian diserap melalui dinding usus dan masuk ke
dalam sistem peredaran darah.
Enzim merupakan katalisator biologis yang dihasilkan oleh sel
makhluk hidup untuk membantu proses biokimia. Fungsi katalisator menurut
Winarno (1991) adalah untuk mempercepat reaksi kimia dengan membebaskan
energi pengaktifan. Aktivitas enzim dipengaruhi oleh suhu dan pH. Aslamyah
(2006) mengatakan bahwa enzim pencernaan yang dihasilkan oleh lambung
ikan aktif pada pH 2–4. Kehadiran enzim dalam saluran pencernaan sangat
mempengaruhi daya cerna ikan terhadap makanan.
Selain enzim dalam saluran pencernaan, kecernaan pakan juga dapat
dibantu oleh adanya bakteri dalam usus. Bakteri penghasil enzim akan
membantu ikan mencerna pakan dengan bantuan enzim yang dihasilkan oleh
bakteri tersebut yaitu protease, lipase dan amilase. Pakan dicerna secara
sehingga energi yang dihasilkan dapat digunakan untuk memacu pertumbuhan
ikan (Wirawati 2002).
Daya cerna ikan terhadap suatu jenis makanan bergantung kepada
faktor fisik dan kimia makanan, jenis makanan, umur ikan, sifat fisik dan kimia
air serta jumlah enzim pencernaan pada sistem gastrointestinal (Aslamyah
2006).
Enzim protease, lipase dan amilase mempengaruhi pencernaan
makanan di usus (Murni 2004). Proteolitik merupakan enzim yang berperan
dalam hidrolisis protein. Menurut Mohanta et al. (2007) enzim yang paling
banyak berperan dalam hidrolisis karbohidrat yaitu amilase seperti yang
ditunjukkan oleh ikan mas.
Proses kerja enzim dalam pencernaan ikan hampir semuanya sama.
Enzim amilase dan lipase tidak hanya terdapat pada ikan herbivora saja, tetapi
juga pada ikan karnivora. Keberadaan enzim-enzim pencernaan berhubungan
dengan makanan. Helver (2002) menyatakan bahwa pada ikan herbivora
aktivitas enzim amilase lebih tinggi daripada protease dan lipase, demikian
halnya ikan omnivora dan karnivora aktivitas enzim protease dan lipase lebih
tinggi daripada enzim amilase. Daya cerna ikan terhadap suatu makanan
bervariasi dari spesies satu ke spesies yang lain. Secara umum daya cerna
untuk protein berkisar antara 70 – 90 % dan untuk karbohidrat bervariasi dari
5–15 % untuk tepung selulosa dan glukosa 1 %. Menurut Mohanta et al.
(2007) daya cerna ikan terhadap karbohidrat sangat rendah dan tergantung pada
spesies ikannya.
Keberadaan enzim dalam makanan akan meningkatkan daya cerna ikan
terhadap bahan makanan. Helver (2002) menyatakan bahwa enzim eksogenik
(berasal dari makanan) sangat berarti bagi pertumbuhan larva atau benih ikan
yang mekanisme sekresinya belum berkembang. Menurut Gatesoupe (1999) di
dalam saluran pencernaan ikan terdapat bakteri yang menghasilkan enzim
pencernaan yang dapat merombak nutrien makro yang masuk melalui pakan
untuk kebutuhan bakteri itu sendiri dan memudahkan makanan diserap oleh
7
Menurut Murni (2004) enzim berperan dalam mengubah laju reaksi,
sehingga kecepatan reaksi yang diperlihatkan dapat dijadikan ukuran keaktifan
enzim. Affandi et al. (1992) menyatakan bahwa aktivitas enzim dapat
dinyatakan antara lain dalam bentuk unit enzim. Aktivitas enzim bergantung
pada konsentrasi enzim dan substrat, suhu, pH dan inhibitor. Enzim
pencernaan yang disekresikan ke dalam rongga saluran pencernaan berasal dari
mukosa lambung, pankreas dan mukosa usus. Enzim-enzim ini berperan
sebagai katalisator dalam hidrolis protein, lemak dan karbohidrat menjadi
bahan-bahan yang sederhana. Mukosa lambung menghasilkan enzim protease
dengan suatu aktivitas proteolitik optimalnya pada pH rendah. Cairan
pankreatik kaya akan tripsin, yaitu suatu protease yang aktivitas optimalnya
sedikit di bawah pH biasa, disamping itu juga mengandung amilase, maltase
dan lipase (Murni 2004).
Penelitian Truong et al. (2003) menunjukkan bahwa kecernaan bahan
kering, protein, lemak, karbohidrat dan energi pada ikan jelawat 48 g
masing-masing sebesar 70,15%; 85,79%; 95,18%; 58,59% dan 76,21%. Law (1986)
yang melakukan pengamatan kecernaan pakan ikan jelawat pada berbagai
faktor memberikan informasi bahwa kecernaan nutrien, terutama karbohidrat,
mempunyai korelasi positif dengan ukuran ikan. Selanjutnya dikatakan bahwa
sebagian besar nutrien tepung ikan dapat dicerna oleh ikan jelawat, dan bungkil
kelapa lebih mudah dicerna daripada kacang kedele dan jagung.
Materi pakan yang telah dicerna selanjutnya akan diserap oleh tubuh.
Adanya penyerapan materi ini akan merubah komposisi tubuh ikan yang dapat
menunjukkan adanya pertumbuhan. Menurut Gatesoupe (1999) bahwa faktor
yang mempengaruhi komposisi tubuh ikan adalah ukuran, umur, jenis pakan
dan tingkat kehidupan tertentu.
Jenis-jenis Probiotik
Kesarcodi-Watson et al. (2008) menyatakan bahwa probiotik
merupakan makanan tambahan dalam bentuk mikrob hidup, yang memberi
pengaruh menguntungkan bagi inang dengan meningkatkan keseimbangan
Menurut Gatesoupe (1999) pada hewan akuatik, tidak hanya saluran
pencernaan yang penting, tetapi juga air yang menjadi habitatnya. Pendapat di
atas didukung oleh Kesarcodi-Watson et al. (2008) bahwa pada hewan akuatik
selain saluran pencernaan, air disekeliling organisme tersebut juga memegang
peranan penting. Oleh karena itu probiotik untuk hewan akuatik adalah agen
mikrob hidup yang memberikan pengaruh menguntungkan pada inang dengan
memodifikasi komunitas mikrob atau berasosiasi dengan inang, menjamin
perbaikan dalam penggunaan pakan atau memperbaiki nilai nutrisinya,
memperbaiki respon inang terhadap penyakit atau memperbaiki kualitas
lingkungannya.
Pemanfaatan beberapa bakteri yang berada dalam wadah budidaya dan
tubuh organisme akuatik seperti ikan dan udang sebagai probiotik telah
dilakukan dan mampu menunjukkan pengaruh positif terhadap pertumbuhan
dan kesehatan melalui peningkatan keseimbangan bakteri dalam tubuh
(Nikoskelainen et al. 2003; Villamil et al. 2003; Vine et al. 2004). Beberapa
jenis bakteri yang mampu berperan sebagai probiotik pada organisme akuatik
yaitu V. alginolyticus, V. harveyi, Pseudomonas sp. Nitrobacter sp. untuk
udang, Nitrosomonas sp. dan Bacillus sp. untuk kepiting, V. pelagis, Bacillus
toyoi,. Lactobacillus plantarum, L. helveticus dan Streptococcus lactis untuk
ikan turbot, Alteromonas sp. untuk Oyster, Rodobacter sp. Vibrio sp. untuk
scalop (Gatesoupe 1999)). Bakteri yang dominan terdapat pada air tawar
antara lain Aeromonas sp. Plesiomonas, Clostridium sp. Penelitian dengan
kultur Lactobacillus sp. 0,2% dan Bacillus subtilis 0,1% yang masing-masing
ditambahkan ke dalam pakan menunjukkan adanya peningkatan bobot dan
efisiensi pakan pada ikan Rainbow trout. Kultur Bacillus subtilis dalam pakan
ayam membantu meningkatkan jumlah Lactobacillus sp. di dinding usus yang
pada gilirannya dapat menekan mikroorganisme yang tidak diinginkan seperti
E. coli (
Balca´zar
et al
. 2006
).Nur dan Fatah (2000) melaporkan bahwa pengkayaan rotifer dengan
bakteri probiotik Bacillus sp. pada pakan larva udang menunjukkan tidak ada
perbedaan nyata terhadap penambahan panjang larva udang yang diberi
9
(2003) mengemukakan bahwa penambahan probiotik Bacillus sp. melalui
naupli Artemia memberikan pengaruh nyata dan signifikan terhadap
perkembangan larva udang windu. Percobaan serupa telah dibuktikan oleh
Hariyati et al. (1998) dengan mengaplikasikan bakteri probiotik melalui media
pemeliharaan, yang menunjukkan bahwa penggunaan jasad renik (probion)
dapat difungsikan langsung sebagai makanan. Gatesoupe (1999) melaporkan
bahwa probiotik merupakan sumber vitamin dan asam amino esensial bagi
larva. Selanjutnya Gullian et al. (2004) menyatakan bahwa manfaat probiotik
adalah meningkatkan resistensi terhadap infeksi penyakit, meningkatkan laju
pertumbuhan, memperbaiki konversi pakan, memperbaiki sistem pencernaan,
penyerapan makanan yang lebih baik dan melengkapi nutrien esensial.
Mekanisme Kerja Bakteri Probiotik
Menurut Verschuere et al. (2000) mekanisme kerja bakteri probiotik
dapat dibagi menjadi beberapa cara, yaitu (1) produksi senyawa inhibitor; (2)
kompetisi terhadap senyawa kimia atau sumber energi (nutrisi); (3) kompetisi
terhadap tempat pelekatan; (4) peningkatan respon imun (kekebalan); (5)
perbaikan kualitas air; (6) interaksi dengan fitoplankton.
Substansi antibakterial telah dihasilkan oleh beberapa bakteri yang
diisolasi dari saluran pencernaan ikan budidaya air tawar terhadap beberapa
strain patogen antara lain A. hydrophila (Sugita et al. 1996).
Probiotik untuk akuakultur umumnya hanya diseleksi berdasarkan
kemampuannya menghasilkan senyawa antibakteri, walaupun demikian
pelekatan pada mukosa usus juga penting agar mereka tetap berada pada usus
inang. Kompetisi terhadap tempat pelekatan terjadi antara kandidat probiotik
(API-AP5) yang diisolasi dari ikan badut (Amphiprion percula L) terhadap
bakteri patogen A. hydrophila dan V. Alginolyticus. Kandidat probiotik
tersebut mempunyai kemampuan untuk melekat pada mukosa usus ikan dan
berkompetisi dengan bakteri patogen, sehingga dengan penambahan bakteri
probiotik akan mengurangi pelekatan bakteri patogen (Vine et al. 2004).
Perbaikan kualitas air dengan penggunaan bakteri probiotik seperti
dengan meningkatnya perombakan bahan organik dalam wadah pemeliharaan
ikan.
Interaksi bakteri probiotik-fitoplankton secara tidak langsung dapat
meningkatan pertumbuhan dan kelangsungan hidup organisme budidaya. Hasil
penelitian Douillet dan Langdon (1994) menunjukkan bahwa penambahan
bakteri galur CA2 (belum diketahui spesiesnya) ke dalam kultur alga dapat
meningkatkan nilai nutrisi dari alga tersebut dan selanjutnya dapat
11
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dimulai dengan tahap isolasi dan seleksi bakteri kandidat
probiotik yang dilakukan di Laboratorium Kesehatan Ikan, Departemen
Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan IPB, dengan
menggunakan ikan jelawat yang berasal dari Unit Pembenihan Ikan Sentral
Anjongan Kalimantan Barat. Tahap isolasi dan seleksi bakteri kandidat
probiotik ini dilakukan mulai bulan Desember 2008 sampai Februari 2009.
Tahap selanjutnya yaitu percobaan pemeliharaan ikan jelawat yang dilakukan
di Laboratorium Lapangan, Fakultas Perikanan dan Ilmu Kelautan IPB dari
bulan April sampai Juni 2009.
Tahapan Penelitian
Isolasi dan Pemurnian Bakteri Kandidat Probiotik
Bakteri diisolasi dari saluran pencernaan (usus) 10 ekor ikan jelawat
berukuran 15 g/ekor yang dipelihara di Laboratorium Lapangan, Fakultas
Perikanan dan Ilmu Kelautan, IPB. Usus ditimbang dan diukur panjangnya,
kemudian digerus dan setiap 1 g diencerkan dengan 9 ml larutan fisiologis
(NaCl 0,85%) steril. Pengenceran berseri dilakukan dari 10-2 sampai 10-10
dengan cara mengambil 0,1 ml dari tempat penggerusan dan dimasukkan pada
eppendorf sebagai pengenceran pertama, selanjutnya dari eppendorf pertama
diambil sebanyak 0,1 ml untuk pengenceran kedua dan seterusnya hingga
pengenceran terakhir yaitu pengenceran ke sepuluh. Inokulum yang dikultur
dengan metode cawan sebar pada media TSA adalah pengenceran ke sembilan
dan ke sepuluh. Kultur ini kemudian diinkubasi pada suhu 29oC selama 24 jam
agar bakteri tumbuh.
Isolat yang digunakan adalah isolat yang tumbuh secara terpisah. Isolat
diambil dengan jarum ose yang digoreskan di media TSA pada cawan petri,
kemudian diinkubasi pada suhu 29oC selama 24 jam. Dari media TSA pada
tabung reaksi. Metode purifikasi dilakukan berulang-ulang dengan teknik dan
media yang sama sampai didapatkan koloni bakteri tunggal dan seragam.
Seleksi Bakteri
Percobaan ini bertujuan untuk menemukan bakteri yang berpotensi
tinggi untuk dipilih sebagai probiotik. Seleksi bakteri dilakukan melalui
tahapan 1) pengujian aktivitas amilolitik, proteolitik, dan lipolitik; 2) fase
pertumbuhan bakteri; 3) ketahanan terhadap asam lambung dan garam empedu;
4) uji penempelan dan 5) pengujian aktivitas antagonistik dengan bakteri
patogen.
Pengujian Aktivitas Proteolitik, Lipolitik dan Amilolitik
Pengujian ini bertujuan untuk mengukur besarnya kemampuan aktivitas
proteolitik, lipolitik dan amilolitik dari masing masing isolat yang diuji melalui
uji hidrolisis kasein, lemak dan pati (Lampiran 1). Hidrolisis protein ditandai
dengan adanya zona bening di sekeliling isolat yang ditumbuhkan pada media
agar dengan penambahan kasein. Hasil hidrolisis lemak ditandai dengan
adanya warna kehijauan pada isolat yang ditumbuhkan pada media agar dengan
penambahan lemak (minyak zaitun) dan hidrolisis pati (amilum) ditandai
dengan perubahan warna zona isolat menjadi kuning cerah pada media agar
dengan penambahan pati.
Penentuan Fase Pertumbuhan Bakteri
Pencapaian fase ekponensial bakteri dapat ditentukan dengan fase
pertumbuhan bakteri. Persiapan kultur dilakukan dengan cara
menginokulasikan 0,1 ml isolat bakteri ke dalam 10 ml media kultur cair dan
diinkubasi selama 24 jam pada suhu 29°C. Sediaan ini disebut kultur segar
yang kemudian diambil 1 ml dan diinokulasikan ke dalam media kultur steril
100 ml dan diinkubasi kembali pada suhu 29°C. Pertumbuhan bakteri diamati
setiap 2 jam dengan mengukur nilai kerapatan atau optical density (OD)
dengan menggunakan alat spektrofotometer, dengan panjang gelombang 620
13
Uji Ketahanan terhadap Asam Lambung dan Garam Empedu
Untuk bertahan dalam lambung dan saluran pencernaan yang ber-pH
rendah diuji dengan ketahanan asam lambung dan garam empedu. Metode ini
mengacu pada Ngatirah et al. (2000) yaitu dengan menginokulasikan 1 ml
isolat bakteri ke dalam satu seri tabung yang berisi 9 ml larutan media steril
dengan pH 2,5 (diatur dengan penambahan HCL) dan pH 7,5 (diatur dengan
penambahan NaOH) dan selanjutnya diinkubasi pada suhu 29°C. Selanjutnya
sel bakteri yang tumbuh dihitung dengan metode hitungan cawan setiap 2, 4, 6
dan 8 jam. Ketahanan terhadap asam lambung dan garam empedu ditentukan
oleh selisih jumlah koloni antara kontrol (pH 7,0) dan perlakuan (pH 2,5 dan
pH 7,5). Semakin kecil selisihnya maka semakin tahan terhadap asam
larnbung dan garam empedu.
Uji Penempelan
Uji ini mengacu pada metode berdasarkan Dewanti dan Wong (1993)
yang menggunakan lempeng baja. Terlebih dahulu lempeng baja disterilkan
dengan cara direndam dalam larutan deterjen yang dipanaskan sampai
mencapai suhu 40-45°C selama 24 jam, kemudian lempeng baja dibilas dengan
air panas 40-50°C sampai bersih lalu dikeringanginkan, selanjutnya diautoklaf
pada suhu 1210C selama 20 menit.
Pengujian dilakukan dengan cara meletakkan lempeng baja di dalam
erlenmeyer 1 L dengan posisi berdiri. Erlenmeyer sebelumnya telah diisi
dengan 250 ml TSB steril dan telah diinokulasi 1 ml kultur segar bakteri.
Erlenmeyer ditutup dengan alumunium foil dan ditempatkan dalam shaker
selama 24 jam pada suhu 29°C. Setelah 24 jam lempeng baja dibilas dengan
larutan buffer fosfat (BF). Kemudian permukaan lempeng diseka secara merata
dengan menggunakan swab. Swab dimasukkan ke dalam tabung reaksi yang
berisi 10 ml BF dan divortex selama 1 menit. Selanjutnya dilakukan
pengenceran serial dan dihitung populasi bakteri dengan metode hitungan
cawan.
Jumlah bakteri yang tumbuh pada media dalam erlenmeyer juga
diencerkan dengan 9 ml buffer fosfat. Selanjutnya dilakukan penghitungan
populasi bakteri yang tumbuh dengan metode hitung cawan. Bakteri yang
mampu membentuk biofilm dengan baik akan mampu menempel pada substrat
yaitu usus.
Uji Aktivitas Antagonistik terhadap Bakteri Patogen
Bakteri hasil isolasi diuji kemampuannya dalam menghambat
pertumbuhan bakteri Aeromonas hydrophila dengan metode Kirby-Bauer (Lay,
1994). Biakan cair bakteri kandidat probiotik dan bakteri A. hydrophila yang
diinkubasi pada suhu 29OC dan berumur 24 jam diencerkan hingga memiliki
konsentrasi yang sama (107 cfu/ml).
Bakteri A. hydrophila dalam media cair diambil sebanyak 0,1 ml, lalu
disebarkan dengan batang penyebar pada media TSA pada cawan petri.
Selanjutnya masing-masing bakteri kandidatprobiotik diambil dan dimasukkan
dalam eppendorf dan kertas cakram (diameter 6 mm) direndam dalam
eppendorf berisi suspensi bakteri kandidat probiotik tersebut selama beberapa
saat. Kertas cakram kemudian diambil dengan menggunakan pinset steril dan
ditempatkan pada cawan petri yang telah disebari bakteri A. hydrophila. Setiap
cawan petri ditempatkan 3 kertas cakram yang berasal dari satu bakteri
kandidat probiotik dan ditambah dengan satu kertas cakram yang telah
direndam dengan larutan fisiologis sebagai kontrol. Masing-masing isolat
bakteri kandidat probiotik diuji daya hambatnya dengan bakteri A. hydrophila
yang digunakan dengan tiga kali ulangan. Isolat yang menghasilkan zona
bening berarti menunjukkan kemampuan menghambat bakteri A. hydrophila.
Uji Patogenisitas Bakteri Kandidat Probiotik pada Ikan Jelawat
Uji patogenisitas dilakukan untuk melihat apakah bakteri yang
diberikan bersifat patogen atau tidak terhadap ikan jelawat. Uji ini dilakukan
dengan cara menyuntikkan bakteri kandidat probiotik secara intramuskular
dengan konsentrasi 107 cfu/ml. Ikan dipelihara selama 7 hari dan diamati setiap
hari. Pada akhir pemeliharaan tingkat kelangsungan hidup ikan jelawat
15
larutan fisiologis. Kandidat probiotik yang akan digunakan adalah bakteri yang
tidak bersifat patogen yakni bakteri yang tidak menyebabkan ikan jelawat sakit
dan mati pada saat uji patogenisitas ini.
Pakan Percobaan pada Ikan Jelawat
Pakan yang digunakan yaitu pakan komersial (Tabel 1) dan
ditambahkan kandidat probiotik. Sebelum dicampurkan ke dalam pakan
dilakukan kultur cair yang ditempatkan dalam shaker dengan suhu 29°C
dengan kecepatan 180 rpm dan dilakukan pemanenan sesuai waktu pencapaian
fase eksponensial. Hasil kultur bakteri yang didapat dipindahkan ke dalam
tabung ulir dan disentrifuse selama 15 menit dengan kecepatan 4000 rpm. Hasil
endapan bakteri probiotik inilah yang dicampurkan ke dalam pakan (Lampiran
2). Probiotik sebanyak 10 g/kg (Wang 2007) ditambahkan ke dalam pakan
dengan cara disemprotkan secara merata menggunakan spuit dengan
menambahkan 2% kuning telur. Kemudian pakan dianalisa proksimat kembali
[image:32.612.145.530.421.508.2]dengan hasil seperti terlihat pada Lampiran 3.
Tabel 1 Hasil analisa proksimat pakan komersil yang digunakan
Komposisi Kandungan (%)
Protein 36,96 Lemak 3,50
Serat kasar 1,37
Kadar Abu 11,67
Kadar Air 7,80
Pakan yang diberikan pada percobaan ini terdiri dari
1. Pakan komersial yang tidak ditambahkan probiotik.
2. Pakan komersial yang ditambah isolat terbaik penghasil protease (isolat
U12).
3. Pakan komersial yang ditambah isolat terbaik penghasil lipase (isolat S1).
4. Pakan komersial yang ditambah isolat terbaik penghasil amilase (isolat
U4).
5. Pakan komersial yang ditambah isolat terbaik penghasil protease, lipase
Selanjutnya pakan ini diberikan pada ikan jelawat selama percobaan
pemeliharaan untuk selanjutnya dilakukan uji pertumbuhan, uji daya cerna dan
uji aktivitas enzim saluran pencernaan.
Uji Pertumbuhan pada Ikan Jelawat
Pemeliharaan ikan dilakukan pada wadah akuarium yang berukuran 50
x 50 x 40 cm sebanyak 15 buah. Sisi bagian luar akuarium ditutup dengan
plastik hitam untuk memberikan rasa aman ikan dari gangguan luar. Sebelum
digunakan, semua peralatan diberi desinfektan dengan kaporit. Akuarium diisi
air yang berasal dari tandon dengan ketinggian 70%. Air dari tandon disaring
terlebih dahulu dan diaerasi tinggi. Air disterilkan selama 3 hari dan pada hari
ke empat ikan dimasukkan ke dalam akuarium.
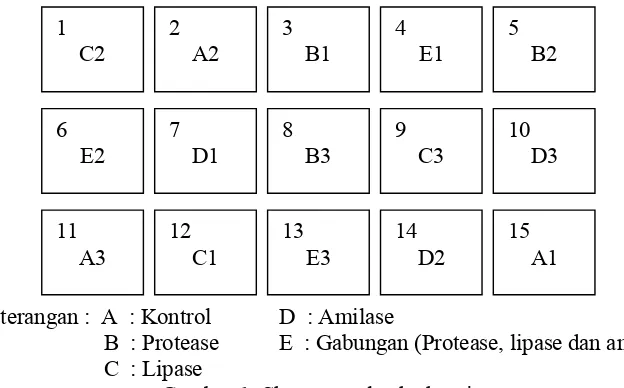
Keterangan : A : Kontrol D : Amilase
[image:33.612.159.471.304.498.2]B : Protease E : Gabungan (Protease, lipase dan amilase) C : Lipase
Gambar 1 Skema tata letak akuarium.
Ikan jelawat dengan bobot rata-rata 5,69 ± 0,04 g ditebar dengan
kepadatan 10 ekor per wadah. Pemeliharaan ikan dilakukan selama 60 hari dan
diberi pakan satiation sebanyak tiga kali sehari, yaitu pukul 07.00, 12.00 dan
17.00. Penggantian air dilakukan setiap hari sebanyak 10% dan penyiponan
dilakukan setiap pagi hari untuk membersihkan sisa pakan dan feses. Jumlah
pakan yang diberikan selama pemeliharaan ditimbang dan dicatat untuk
menghitung konversi pakan dan Untuk mengetahui laju pertumbuhan ikan
dilakukan sampling setiap 10 hari sekali. Untuk menghitung retensi protein,
17
kualitas air dilakukan pada awal, tengah dan akhir pemeliharaan meliputi pH
(6,94-7,42), suhu (29-310C), dissolve oksigen (DO) (4,1-5,65 mg/l) dan
amoniak (0,017-0,107 mg/l). Pada uji pertumbuhan ini dianalisis beberapa
parameter yaitu :
1. Laju Pertumbuhan Harian
Laju pertumbuhan harian dihitung dengan menggunakan rumus yang
dikemukakan oleh Huisman (1976) :
% 100
1⎥ ×
⎦ ⎤ ⎢ ⎣ ⎡ − = t Wo Wt α
Keterangan: α = Laju pertumbuhan harian (%) Wt = Bobot akhir (g)
W0 = Bobot awal (g)
t = Waktu
2. Jumlah Konsumsi Pakan
Jumlah konsumsi pakan merupakan jumlah pakan yang dikonsumsi oleh
ikan selama pemeliharaan. Jumlah konsumsi pakan dapat dihitung dengan
cara menimbang jumlah pakan yang dikonsumsi ikan setiap harinya selama
masa pemeliharaan.
3. Konversi Pakan
Konversi pakan dihitung menggunakan rumus yang dikemukakan NRC
(1983)
) ) ((Wt D Wo
F FCR
− + =
Keterangan : FCR = Konversi pakan
F = Bobot pakan yang diberikan selama percobaan (g) Wt = Bobot ikan pada akhir penelitian (g)
Wo = Bobot ikan pada awal penelitian (g)
D = Jumlah bobot ikan yang mati selama penelitian (g) 4. Retensi Protein
Retensi protein dihitung dengan rumus yang dikemukakan oleh Takeuchi
(1988):
=
×
100
%
Pe
Pu
RP
Keterangan : RP = Retensi protein
5. Kelangsungan Hidup
Perhitungan kelangsungan hidup berdasarkan rumus (Effendi, 2002).
% 100 × =
No Nt SR
Keterangan : SR = Kelangsungan hidup ikan (%)
Nt = Jumlah ikan yang hidup pada akhir penelitian (ekor)
No = Jumlah ikan yang hidup pada awal penelitian
(ekor)
6. Populasi Bakteri Probiotik
Pengamatan populasi bakteri dalam saluran pencernaan ikan dilakukan
pada akhir penelitian. Hasil yang diperoleh dibandingkan dengan kontrol
secara deskriptif.
Uji Daya Cerna Pakan
Pengujian daya cerna pakan dilakukan secara terpisah dari uji
pertumbuhan. Pakan yang akan digunakan dihaluskan menjadi serbuk dan
ditambahkan 0,6 % Cr2O3 sebagai indikator kecernaan dan CMC sebesar 20
g/kg pakan sebagai perekat (Watanabe 1988). Selanjutnya pakan serbuk dibuat
pelet lagi dan dikeringkan. Pakan diberikan pada ikan selama seminggu dan
pada hari ketujuh dilakukan pengumpulan feses ikan dengan cara menyipon
akuarium dengan selang kecil dan ditampung dalam ember. Selanjutnya
disaring dan feses yang terkumpul ditempatkan pada botol film untuk
selanjutnya dianalisa. Feses yang terkumpul dikeringkan dalam oven bersuhu
110°C selama 4-6 jam. Selanjutnya dilakukan analisa kandungan Cr2O3
terhadap feses yang sudah dikeringkan (Lampiran 4).
Nilai kecernaan dihitung berdasarkan Takeuchi (1988) :
Kecernaan protein (%) = 1-(a'/a )/(b'/b) x 100
Kecernaan Total (%) = 1-(a'/a ) x 100
Keterangan :
a = % Cr2O3 dalam pakan
a" = % Cr2O3 dalam feses
b' = % protein dalam feses
19
Uji Aktivitas Enzim Saluran Pencernaan
Uji aktivitas enzim dilakukan pada saluran pencernaan ikan di akhir
penelitian. Hal ini dilakukan untuk mengetahui ada atau tidaknya pengaruh dari
penambahan probiotik pada pakan yang diberikan dibandingkan kontrol. Ikan
diambil sebanyak 2 ekor dari setiap akuarium kemudian dibedah untuk diambil
saluran pencernaannya. Preparasi ekstrak enzim saluran pencernaan ikan ini
dilakukan pada suhu 4°C (Lampiran 5). Saluran pencernaan ikan kemudian
dicuci dengan akuades dan dikeringkan dengan kertas penghisap. Selanjutnya
usus ditimbang dan dihomogenkan dengan menambahkan larutan buffer 10 ml.
Setelah homogen lalu disentrifuse selama 20 menit pada 1200 rpm untuk
mendapatkan supernatan yang akan digunakan pada pengujian selanjutnya
yaitu aktivitas enzim (Lampiran 6).
Analisis Data
Penelitian ini dilakukan menggunakan rancangan acak lengkap (RAL)
yang terdiri dari empat perlakuan dan tiga ulangan. Data yang diperoleh
dianalisa dengan menggunakan analisis sidik ragam pada tingkat kepercayaan
95% dan dilanjutkan dengan uji Duncan untuk melihat pengaruh antar
perlakuan terhadap masing-masing peubah yang diamati (Mattjik dan
HASIL DAN PEMBAHASAN
Hasil
Isolasi dan Pemurnian Bakteri Kandidat Probiotik
Bakteri yang berhasil diisolasi dari saluran pencernaan ikan jelawat
sebanyak 40 isolat. Morfologi koloni isolat tersebut pada media TSA berwarna
putih, krem, transparan, kuning dan kuning krem dengan bentuk bundar, tak
beraturan, menyebar, membulat dan menyebar tidak rata.
Seleksi Bakteri
Aktivitas Proteolitik, Lipolitik dan Amilolitik
Hasil uji aktivitas proteolitik, lipolitik dan amilolitik terhadap bakteri
kandidat probiotik disajikan pada Gambar 2. Hasil uji aktivitas proteolitik
ditandai dengan adanya zona bening di sekeliling koloni isolat, aktivitas
lipolitik ditunjukkan dengan adanya warna hijau di sekeliling koloni isolat dan
aktivitas amilolitik ditandai zona kuning bening di daerah isolat yang
ditumbuhkan.
[image:37.612.191.522.432.537.2]aktivitas proteolitik aktivitas lipolitik aktivitas amilolitik
Gambar 2 Hasil aktivitas proteolitik, lipolitik dan amilolitik.
Hasil uji aktivitas proteolitik, lipolitik dan amilolitik memperlihatkan
bahwa hampir semua isolat positif menghidrolisis sumber karbonnya, yang
ditandai dengan adanya zona bening dan warna hijau di sekitar koloni. Hal
tersebut menunjukkan bahwa makromolekul yang menjadi sumber karbon
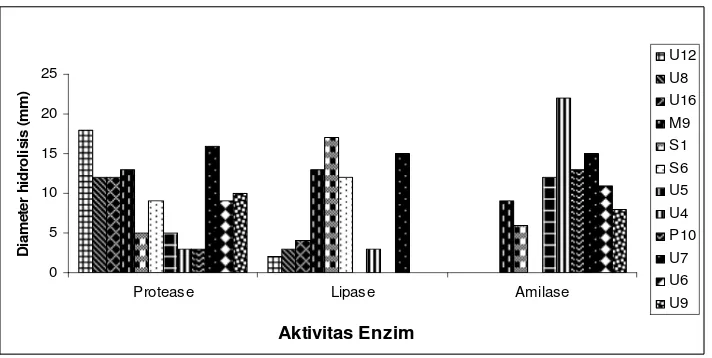
sudah dimanfaatkan sebagai sumber energi oleh bakteri. Aktivitas proteolitik
terbesar diperlihatkan oleh isolat U12 dengan diameter 18 mm, aktivitas
21
koloni yang berwarna hijau terang, aktivitas amilolitik terbesar diperlihatkan
oleh isolat U4 dengan diameter 22 mm, sedangkan isolat yang mampu
menghasilkan gabungan protease, lipase dan amilase terbesar diperlihatkan
oleh isolat U7 (Gambar 3). Isolat-isolat tersebut selanjutnya diuji lanjut
berdasarkan tahapan seleksi bakteri probiotik. Adanya kemampuan
menghidrolisi protein, lemak dan pati ini menunjukkan bahwa isolat-isolat
tersebut mampu memanfaatkan sumber energi yaitu kasein, lemak dan pati
yang ditambahkan pada media menjadi sumber karbon.
Aktivitas Enzim 0 5 10 15 20 25
Protease Lipase Amilase
[image:38.612.149.505.235.414.2]D iam et er h id ro li s is ( m m ) U12 U8 U16 M9 S1 S6 U5 U4 P10 U7 U6 U9
Gambar 3 Diameter hidrolisis enzim oleh isolat proteolitik, lipolitik dan amilolitik.
Fase Pertumbuhan Bakteri
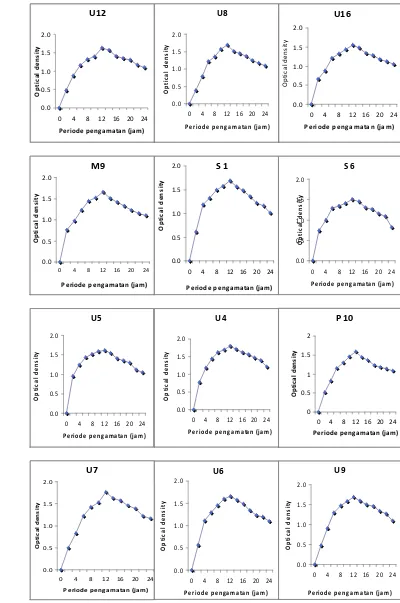
Pengamatan fase pertumbuhan bakteri dilakukan dengan mengamati
perubahan populasi dan nilai kerapatan optik (Optical Density = OD)
(Lampiran 7). Hal ini berhubungan dengan panen sel yang tepat untuk
memproduksi suatu produk atau senyawa metabolit, antara lain enzim,
antibakterial, vitamin, asam organik, asam lemak, asam amino dan peptida.
Menurut Irianto (2003) fase exsponensial tercepat merupakan bakteri yang
cukup baik digunakan sebagai probiotik. Hasil pengamatan menunjukkan
bahwa isolat U4, U12, S1 dan U7 memiliki fase pertumbuhan tercepat yakni
masing-masing mencapai akhir fase eksponensial pada jam ke-12 dan mulai
U12 0.0 0.5 1.0 1.5 2.0
0 4 8 12 16 20 24
P e riode pe ng a m a ta n (ja m )
Op ti ca l de n s it y U8 0.0 0.5 1.0 1.5 2.0
0 4 8 12 16 20 24
P e riode pe ng a m a ta n (ja m )
Op ti c a l de n s it y U16 0.0 0.5 1.0 1.5 2.0
0 4 8 12 16 20 24
P e riode pe ng a m a ta n (ja m )
Op ti ca l de ns it y M9 0.0 0.5 1.0 1.5 2.0
0 4 8 12 16 20 24
P e riode pe ng a m a ta n (ja m )
Op ti c a l de n s it y S 1 0.0 0.5 1.0 1.5 2.0
0 4 8 12 16 20 24
P e riode pe ng a m a ta n (ja m )
Op ti c a l de ns it y S 6 0.0 0.5 1.0 1.5 2.0
0 4 8 12 16 20 24
P e riode pe ng a m a ta n (ja m )
Op ti ca l de ns it y U5 0.0 0.5 1.0 1.5 2.0
0 4 8 12 16 20 24
P e riode pe ng a m a ta n (ja m )
Op ti c a l de n s it y U4 0.0 0.5 1.0 1.5 2.0
0 4 8 12 16 20 24
P e riode pe ng a m a ta n (ja m )
Op ti c a l de ns it y P 10 0 0.5 1 1.5 2
0 4 8 12 16 20 24 P e riode pe ng a m a ta n (ja m )
Op ti c a l de n s it y U7 0.0 0.5 1.0 1.5 2.0
0 4 8 12 16 20 24 P e riode pe ng a m a ta n (ja m )
Op ti c a l de ns it y U6 0.0 0.5 1.0 1.5 2.0
0 4 8 12 16 20 24
P e riode pe ng a m a ta n (ja m )
Op ti c a l de ns it y U9 0.0 0.5 1.0 1.5 2.0
0 4 8 12 16 20 24
P e riode pe ng a m a ta n (ja m )
[image:39.612.124.524.79.682.2]Op ti c a l de ns it y
23
Ketahanan terhadap Asam Lambung dan Garam Empedu
Toleransi terhadap asam merupakan salah satu syarat penting suatu
isolat untuk dijadikan kandidat probiotik. Hasil dari pengujian ketahanan asam
lambung dan garam empedu masing-masing disajikan pada Gambar 5, Gambar
[image:40.612.139.518.170.571.2]6 dan Lampiran 8.
[image:40.612.144.516.174.346.2]Gambar 5 Selisih log (cfu/ml) jumlahbakteri pada pH 2.5 dengan pH normal.
Gambar 6 Selisih log (cfu/ml) jumlah bakteri pada pH 7,5 dengan pH normal.
Hasil pengujian terhadap asam lambung menunjukkan bahwa isolat
U12, S1, U4 dan U7 memiliki selisih terkecil yang berarti lebih tahan terhadap
pH asam lambung dibandingkan isolat lainnya. Isolat harus tahan terhadap pH
asam lambung untuk mampu bertahan hidup dalam saluran pencernaan.
Apabila sel bakteri terpapar pada kondisi yang sangat asam maka membran sel
dapat mengalami kerusakan dan berakibat pada hilangnya
komponen-0,0 0,2 0,4 0,6 0,8 1,0 1,2 1,4
U12 U8 U16 M9 S1 S6 U5 U4 P10 U7 U6 U9
Isolat P o pu lasi b a k ter i ( L o g cf u/ m l)
2 jam 4 jam 6 jam 8 jam
pH 2.5 0,0 0,2 0,4 0,6 0,8 1,0 1,2 1,4
U12 U8 U16 M9 S1 S6 U5 U4 P10 U7 U6 U9
Isolat P o p u la si b a kt er i (L o g c fu /m l)
2 jam 4 jam 6 jam 8 jam
2.78 1.16 1.27 1.57 2.49 1.69 1.10 2.87 2.16 2.64 2.21 2.32 0 1 1 2 2 3 3 4
U12 U8 U16 M9 S1 S6 U5 U4 P10 U7 U6 U9
Isolat Bakteri J um lah popul as i bak ter i/m m
2 (x
1
0
8 )
komponen intraseluler seperti Mg, K dan lemak dari sel tersebut, dan pada
akhirnya kerusakan ini dapat mengakibatkan kematian sel. Hasil pengujian
terhadap garam empedu menunjukkan bahwa isolat U4 merupakan isolat yang
paling mampu beradaptasi karena selisih log populasinya paling kecil diantara
semua isolat.
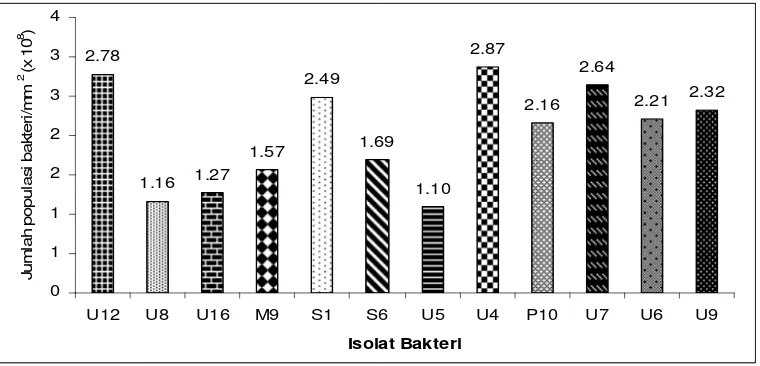
Penempelan Bakteri
Faktor penempelan atau adherence factor merupakan faktor yang
dimiliki oleh bakteri untuk menempel dan membentuk biofilm pada permukaan
padat. Ha1 yang mempengaruhi sifat penempelan bakteri pada permukaan
padat adalah sifat hidrofobisitas antar sel bakteri, jarak antar sel dan adanya
reseptor pada sel inang. Uji penempelan terhadap kandidat probiotik
memberikan hasil yang berbeda pada setiap kandidat probiotik seperti
ditunjukkan pada Gambar 7 dan Lampiran 9. Untuk kandidat probiotik terpilih
(U12, S1, U4 dan U7) menunjukkan adanya kemampuan menempel pada
substrat. Isolat U4 memiliki jumlah koloni 2,9 x 108 koloni /mm2 yang artinya
[image:41.612.151.531.406.589.2]isolat ini mampu menempel dengan baik.
Gambar 7 Hasil uji penempelan isolat bakteri pada lempeng baja.
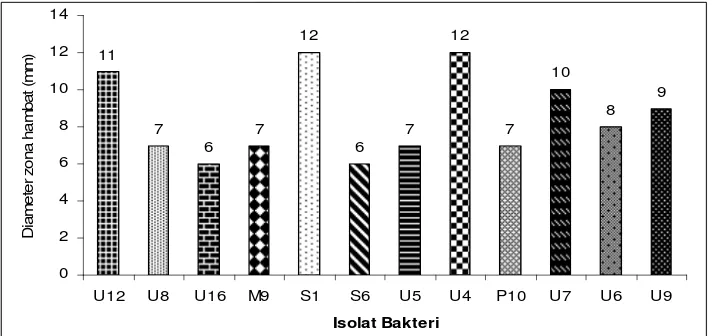
Aktivitas Antagonistik terhadap Bakteri Patogen
Hasil uji aktivitas antagonistik membuktikan bahwa isolat bakteri
25 11 7 6 7 12 6 7 12 7 10 8 9 0 2 4 6 8 10 12 14
U12 U8 U16 M9 S1 S6 U5 U4 P10 U7 U6 U9
Isolat Bakteri D iam ete r z o n a ham bat (m m )
yaitu A. hydrophila dimana aktivitas ini ditandai dengan adanya zona hambat
di sekeliling isolat yang ditanam.
Hasil pengukuran zona hambat isolat kandidat probiotik disajikan
pada Gambar 8 dan Lampiran 10. Zona hambat terbaik dihasilkan oleh isolat
bakteri proteolitik yaitu U12 dengan diameter 11 mm, isolat bakteri lipolitik
yaitu S1 dengan diameter 12 mm dan isolat amilolitik yaitu isolat U4 dengan
diameter 12 mm serta isolat bakteri gabungan proteolitik, lipolitik dan
amilolitik yaitu isolat U7 dengan diameter 10 mm. Kandidat probiotik
diharapkan mampu menekan atau memiliki aktivitas antagonistik terhadap
bakteri patogen dalam saluran pencernaan. Aktivitas antagonistik tersebut
dapat terjadi karena kandidat probiotik mampu menghasilkan senyawa
antibakteri. Pada penelitian ini aktivitas antagonistik bakteri kandidat probiotik
[image:42.612.149.505.335.503.2]ditujukan untuk bakteri patogen ikan jelawat yaitu A. hydrophila.
Gambar 8 Aktivitas antagonistik isolat kandidat probiotik terhadap A. hydrophila.
Patogenisitas Bakteri Kandidat Probiotik pada Ikan Jelawat
Hasil yang didapat dari uji patogenisitas membuktikan bahwa kandidat
probiotik yang terpilih (U12, S1, U4 dan U7) tidak bersifat patogen. Hal ini
dibuktikan dari hasil kelangsungan hidup ikan jelawat 100 %. Ikan jelawat
yang disuntik dengan isolat bakteri kandidat probiotik mampu bertahan hidup
selama masa uji dan kondisi tubuhnya tidak ada perbedaan dengan ikan kontrol
atau yang disuntik dengan larutan fisiologis. Dengan hasil ini maka kandidat
probiotik dapat diaplikasikan sebagai probiotik melalui penambahan pada
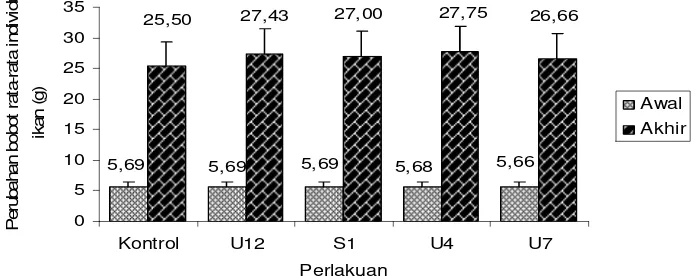
Kinerja Pertumbuhan Ikan Jelawat
Hasil penelitian menunjukkan adanya pertumbuhan pada ikan jelawat.
Perubahan bobot biomassa ikan jelawat setelah 60 hari terlihat pada Gambar 9.
5,66 5,68 5,69 5,69 5,69 26,66 27,75 27,00 27,43 25,50 0 5 10 15 20 25 30 35
Kontrol U12 S1 U4 U7
[image:43.612.154.503.161.301.2]Perlakuan P er ub ahan b obot r a ta-rat a indi v id u ik an ( g ) Awal Akhir
Gambar 9 Perubahan bobot rata-rata individu ikan jelawat (g) perlakuan kontrol (tanpa probiotik), U12 (protease), S1 (lipase), U4 (amilase) dan U7 (protease, lipase dan amilase).
Hasil uji kinerja pertumbuhan disajikan pada Tabel 2, Lampiran 11
dan 12 yang meliputi beberapa parameter yang dianalisis. Pemberian pakan
yang ditambah bakteri kandidat probiotik yang memiliki aktivitas enzim
memberikan pengaruh yang nyata (P≤0.05) terhadap pertumbuhan ikan jelawat
dibandingkan dengan pertumbuhan ikan jelawat yang diberikan pakan kontrol
atau tanpa penambahan probiotik.
Tabel 2 Laju pertumbuhan harian (LPH), jumlah konsumsi pakan (JKP), konversi pakan (FCR), retensi protein (RP), kecernaan protein (KP), kecernaan total (KT) dan kelangsungan hidup (SR) pada ikan jelawat
Parameter Perlakuan
kontrol U12 S1 U4 U7
LPH (%) 2,53 ± 0,02a 2,66 ± 0,02c 2,63 ± 0,01b 2,68 ± 0,01c 2,60 ± 0,03b
JKP (%) 419,13 ± 3,57a 420,7 ± 21,16a 413,18 ± 3,66a 419,14 ± 4,68a 418,71 ± 24,55a
FCR (%) 2,12 ± 0,03a 1,94 ± 0,09b 1,94 ± 0,02b 1,90 ±0,04b 2,00 ± 0,07b
RP (%) 18,62± 0,04a 18,42 ± 0,76a 18,86 ± 0,59a 22,30±1,18b 20,99 ± 1,24c
KP (%) 88,62±0,84a 91,31±0,56b 90,40±0,88b 92,70±0,35c 91,44±0,63b
KT (%) 77,97±0,91a 81,42±1,24b 81,13±0,71b 82,57±0,83c 82,14±0,45bc
SR (%) 100 100 100 100 100
27
Hasil terbaik laju pertumbuhan ikan jelawat ditunjukkan oleh perlakuan
U4 yaitu pemberian pakan yang ditambah isolat yang memiliki aktivitas enzim
amilase dan perlakuan U12 yaitu pemberian pakan yang ditambah isolat yang
memiliki aktivitas enzim protease. Laju pertumbuhan ikan jelawat pada kedua
perlakuan ini relatif sama dan lebih baik dibandingkan perlakuan lainnya. Hal
ini juga didukung dengan nilai kecernaan protein yang lebih tinggi
(92,70±0,35). Semua perlakuan dengan penambahan probiotik juga
menunjukkan hasil konversi pakan yang lebih baik dibandingkan kontrol.
Kelangsungan hidup selama pemeliharaan ikan jelawat menunjukkan tidak ada
perbedaan yang nyata antara perlakuan dengan kontrol (Lampiran 13, 14, 15,
16, 17 dan 18).
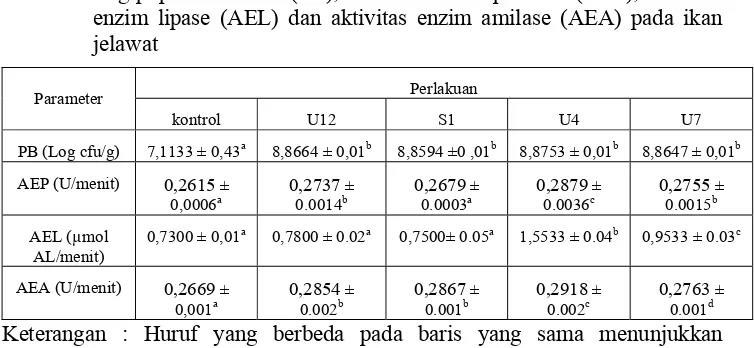
Aktivitas Enzim Saluran Pencernaan
Berdasarkan hasil analisis aktivitas enzim pada saluran pencernaan ikan
jelawat menunjukkan bahwa aktivitas enzim protease, lipase dan amilase
(Lampiran 19) bakteri mampu menghidrolisis protein, lemak dan karbohidrot
pada uji in vitro. Sehingga pada saat uji in vivo dengan ditambahkan dalam
pakan mampu meningkatkan kecernaan pakan pada ikan jelawat.
Tabel 3 menunjukkan terdapat perbedaan yang signifikan antar
perlakuan jumlah populasi bakteri pada saluran pencernaan ikan jelawat, yaitu
aktivitas enzim protease, aktivitas enzim lipase dan aktivitas enzim amilase.
Populasi bakteri disaluran pencernaan ikan jelawat pada akhir penelitian
menunjukkan adanya perbedaan yang nyata antara perlakuan penambahan
probiotik dengan kontrol (Lampiran 20, 21, 22 dan 23). Hal ini memicu
peningkatan aktivitas enzim endogenous yang diproduksi oleh bakteri dalam
saluran pencernaan. Ini membuktikan bahwa populasi bakteri yang lebih tinggi
pada saluran pencernaan ikan uji pada perlakuan U12, S1, U4 dan U7 dapat
meningkatkan aktivitas enzim protease, lipase dan amilase pada saluran
Tabel 3 Log populasi bakteri (PB), aktivitas enzim protease (AEP), aktivitas enzim lipase (AEL) dan aktivitas enzim amilase (AEA) pada ikan jelawat
Parameter Perlakuan
kontrol U12 S1 U4 U7
PB (Log cfu/g) 7,1133 ± 0,43a 8,8664 ± 0,01b 8,8594 ±0 ,01b 8,8753 ± 0,01b 8,8647 ± 0,01b
AEP (U/menit) 0,2615 ±
0,0006a 0,27370.0014 ± b 0,26790.0003 ± a 0,28790.0036 ± c 0,27550.0015 ± b
AEL (µmol AL/menit)
0,7300 ± 0,01a 0,7800 ± 0.02a 0,7500± 0.05a 1,5533 ± 0.04b 0,9533 ± 0.03c
AEA (U/menit) 0,2669 ±
0,001a
0,2854 ±
0.002b
0,2867 ±
0.001b
0,2918 ±
0.002c
0,2763 ±
0.001d
Keterangan : Huruf yang berbeda pada baris yang sama menunjukkan perbedaan antar perlakuan (p≤0,05).
Pembahasan
Seleksi bakteri probiotik dari saluran pencernaan ikan jelawat
menghasilkan bakteri kandidat probiotik yang mampu menghasilkan enzim
sebagai katalisator dalam hidrolisis nutrien pakan ikan yaitu enzim protease
(U12), enzim lipase (S1) dan enzim amilase (U4) ataupun ketiga enzim baik
protease, lipase dan amilase (U7). Isolat U12 adalah bakteri yang mampu
mensekresikan enzim protease yang akan merombak protein menjadi asam
amino. Isolat S1 yaitu bakteri yang mampu mensekresikan enzim lipase yang
akan mencerna trigliserida dan menghasilkan asam lemak rantai panjang dan
gliserol. Sedangkan isolat U4 adalah bakteri yang mampu mensekresikan
enzim amilase yang akan mendegradasi pati menjadi maltosa dan glukosa yang
kemudian diangkut ke dalam sitoplasma sel dan digunakan sebagai sumber
karbon dan energi (Atlas et al. 1984).
Syarat lain suatu bakteri dapat dijadikan kandidat probiotik adalah
mampu bertahan pada paparan pH asam dan basa dengan selisih populasi yang
kecil antara pH normal dengan pH asam dan pH basa. Hal ini sangat penting
karena bakteri probiotik harus mampu bertahan pada pH asam lambung dan
setelah itu probiotik akan berhadapan dengan garam empedu yang ber pH basa.
Bakteri yang mampu bertahan pada pH rendah atau asam dinyatakan bersifat
asam atau resisten terhadap asam lambung dan yang berhasil bertahan pada pH
[image:45.612.145.522.91.265.2]29
Jacobsen et al. 1999). Keempat bakteri kandidat probiotik yang terpilih
rata-rata memiliki ketahanan terhadap pH asam dan basa dan tetap hidup sampai
akhir pengamatan 8 jam. Hal ini diduga karena isolat diseleksi dari saluran
pencernaan yang sudah beradaptasi dengan kondisi asam lambung dan garam
empedu pada saluran pencernaan.
Peran lainnya yang harus dimiliki suatu bakteri untuk dapat dijadikan
kandidat bakteri probiotik yaitu mampu menghasilkan senyawa antibakteri
sehingga dapat menghambat perkembangan bakteri patogen pada ikan jelawat
dan mampu menjaga keseimbangan bakteri dalam saluran pencernaan.
Selain itu, supaya mampu hidup dan bertahan dengan baik pada
saluran pencernaan maka kandidat probiotik harus mempunyai kemampuan
menempel sehingga mampu mengkolonisasi substrat dengan baik. Apabila
tidak mampu mengkolonisasi maka akan terlepas oleh konstraksi usus
(Havenaar et al. 1992). Kandidat probiotik yang terpilih memiliki jumlah
koloni yang relatif tinggi menempel pada substrat.
Penambahan probiotik pada pakan komersial terhadap ikan uji juga
memberikan pengaruh yang nyata pada populasi bakteri di saluran pencernaan
ikan uji. Hal ini memicu peningkatan aktivitas enzim endogenous yang
diproduksi oleh bakteri dalam saluran pencernaan (Ziaei-Nejad et al. 2006). Ini
dibuktikan dengan populasi bakteri yang lebih tinggi pada saluran pencernaan
ikan uji pada perlakuan U12, S1, U4 dan U7 dibandingkan kontrol.
Peningkatan populasi bakteri sejalan dengan aktivitas enzim protease, lipase
dan amilase pada saluran pencernaan ikan jelawat.
Isolat U4 memiliki nilai laju pertumbuhan, Konsumsi pakan dan FCR
yang tidak berbeda nyata dengan isolat U12. Namun nilai kecernaan protein,
kecernaan total dan retensi protein pada isolat U4 lebih tinggi dibandingkan
dengan isolat U12. Nilai kecernaan total yang tinggi pada isolat U4
menunjukkan bahwa isolat ini mampu menghasilkan enzim-enzim yang dapat
membantu ikan untuk mencerna pakan. Pakan yang telah dicerna akan dengan
mudah diserap dan digunakan oleh ikan untuk sumber energi dan
pertumbuhannya sehingga hanya sedikit sisa pakan yang terbuang dalam
mengotori lingkungan perairan sebagai media budidaya ikan, sehingga semakin
sedikit feces yang dihasilkan akan mempertahankan kualitas lingkungan
budidaya ikan yang tetap baik. Oleh karena itu penggunaan probiotik ini selain
dapat meningkatkan kecernaan ikan juga dapat menjaga kondisi lingkungan
perairan yang lebih baik sehingga dapat menjaga kesehatan ikan dan
menyebabkan pertumbuhan ikan yang lebih optimal.
Menurut Handayani et al. (2000) bahwa bakteri pengurai yang ikut
termakan akan membantu proses pencernaan dalam saluran pencernaan udang
karena bakteri ini mampu memproduksi enzim protease, amilase serta lipase
dan meningkatkan keseimbangan bakteri dalam saluran pencernaan. Kecernaan
pakan meningkat dengan adanya penambahan probiotik dalam pakan
dibandingkan dengan pakan tanpa penambahan probiotik. Enzim-enzim khusus
yang dimiliki oleh bakteri ini sangat membantu dalam pemecahan molekul
kompleks menjadi molekul sederhana sehingga akan mempermudah
pencernaan lanjutan dan penyerapan oleh saluran pencernaan ikan. Perlakuan
U4 memiliki aktivitas enzim protease, lipase dan amilase lebih tinggi
dibandingkan perlakuan lainnya, namun pada aktivitas enzim protease hasil
yang diperoleh tidak menunjukkan berbedaan yang signifikan dengan
perlakuan U12. Hal ini membuktikan bahwa ikan jelawat selain dapat
mencerna karbohidrat dengan baik, sesuai sifat ikan pada umumnya juga dapat
mencerna protein, karena ikan membutuhkan protein untuk pertumbuhannya.
Ikan jelawat termasuk ikan yang bersifat pemakan tumbuhan
(herbivora). Menurut Krogdahl et al. (2005) ikan herbivora cenderung
memiliki aktivitas enzim amilase lebih tinggi daripada aktivitas enzim protease
dan lipase. Pada perlakuan U4 dimana aktivitas enzim protease, lipase dan
amilase pada saluran pencernaan yang lebih tinggi dibandingkan perlakuan
lainnya menunjukkan bahwa aktivitas amilase yang tinggi sesuai dengan sifat
ikan jelawat yang herbivora sedangkan aktivitas protease tidak dipengaruhi
oleh pola makan ikan jelawat tersebut. Tingginya aktivitas enzim amilase pada
saluran pencernaan ikan jelawat didukung oleh tingginya enzim amilase yang
disekresikan oleh isolat U4 pada saat uji in vitro. Oleh karena itu enzim
31
lipase. Tingginya aktivitas enzim amilase ini dipengaruhi oleh jumlah enzim
yang dihasilkan oleh bakteri amilase dan substrat yang sesuai, sehingga
populasi bakteri tumbuh lebih tinggi dibanding bakteri pada perlakuan yang
lain.
Dari hasil penelitian ini kelangsungan hidup ikan uji memberikan hasil
yang tidak berbeda nyata antar perlakuan. Hal ini mungkin diakibatkan oleh
kuantitas serta kualitas pakan yang diberikan cukup untuk mempertahankan
kebutuhan pokok ikan serta lingkungan yang terjaga dengan baik selama
KESIMPULAN DAN SARAN
Kesimpulan
Dari saluran pencernaan ikan jelawat diperoleh bakteri kandidat
probiotik yang mampu mensekresikan enzim protease (U12), lipase (S1),
amilase (U4) dan ketiganya (U7). Penambahan probiotik U4 pada pakan
mampu meningkatkan kecernaan total, kecernaan protein dan retensi pr