EKSPLORASI GEN
CYTOCHROME OXIDASE SUBUNIT I
(COI) DARI KERANG MUTIARA (
Pinctada fucata
)
YANG
BERASAL DARI LOKASI GEOGRAFIS YANG BERBEDA
YUYUN QONITA
DEPARTEMEN MANAJEMEN SUMBER DAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi berjudul Eksplorasi Gen
Cytochrome Oxidase Subunit I (COI) dari Kerang Mutiara (Pinctada fucata) yang Berasal dari Lokasi Geografis yang Berbeda adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Juli 2014
Yuyun Qonita
ABSTRAK
YUYUN QONITA. Eksplorasi Gen Cytochrome Oxidase Subunit I (COI) dari Kerang Mutiara (Pinctada fucata) yang Berasal dari Lokasi Geografis yang Berbeda. Dibimbing oleh YUSLI WARDIATNO dan NURLISA A BUTET.
Pinctada fucata merupakan salah satu spesies kerang penghasil mutiara di dunia. Kerang ini dapat ditemukan di Teluk Persia (Uni Emirat Arab) dan Selat Semau, Nusa Tenggara Timur (Indonesia). Meskipun potensi pengembangan P. fucata di Indonesia relatif tinggi, eksplorasi terhadap kerang mutiara jenis ini belum banyak dilakukan. Tujuan dari penelitian ini adalah untuk mengeksplorasi urutan basa nukleotida gen Cytochrome Oxidase Subunit I (COI) dari kerang mutiara Pinctada fucata yang berasal dari Teluk Persia (Uni Emirat Arab) dan Selat Semau, Nusa Tenggara Timur (Indonesia). Hasil analisis urutan basa nukleotida gen COI P. fucata yang berasal dari kedua wilayah menunjukkan bahwa terdapat 33 situs mutasi yang terdiri dari 16 situs mutasi insersi dan 17 situs mutasi delesi. Perbedaan urutan basa nukleotida gen COI P. fucata yang berasal dari kedua wilayah ini dapat menjadi identitas molekuler yang dapat memberikan perlindungan terhadap sumber daya kerang mutiara (P. fucata) dan produk mutiara yang dihasilkannya. Autentifikasi P. fucata dapat dilakukan berdasarkan urutan basa nukleotida gen COI untuk mencegah perdagangan ilegal. Kata kunci: gen COI, Nusa Tenggara Timur, Pinctada fucata, Teluk Persia
ABSTRACT
YUYUN QONITA. Exploration of Cytochrome Oxidase Subunit I (COI) Gene from Pearl Oyster (Pinctada fucata) Originating from Different Geographic Locations. Supervised by YUSLI WARDIATNO and NURLISA A BUTET.
Pinctada fucata is one of the marine bivalves producing pearl which has been utilized and cultured in some countries. These oysters can be found in the Persian Gulf (United of Emirates Arab) and Semau Strait, East Nusa Tenggara (Indonesia). Despite the high potential for the development of P. fucata fishery and culture in Indonesia, the exploration of these oysters has not been conducted. The aim of this research is to explore Cytochrome Oxidase Subunit I (COI) gene sequences of pearl oyster (Pinctada fucata)originating from Persian Gulf (United of Emirates Arab) and Semau Strait, East Nusa Tenggara (Indonesia). The results of the analysis of P. fucata COI gene sequences from both regions shows that there are 33 mutation sites consisting of 16 insertion mutation sites and 17 deletion mutation sites. The difference of P. fucata COI gene sequences from both regions may be a molecular identity that can provide protection of the species and its pearl production. Species authentication of P. fucata may be determined using COI gene sequence in order to prevent illegal trading.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada
Departemen Manajemen Sumber Daya Perairan
EKSPLORASI GEN
CYTOCHROME OXIDASE SUBUNIT I
(COI) DARI KERANG MUTIARA (
Pinctada fucata
)
YANG
BERASAL DARI LOKASI GEOGRAFIS YANG BERBEDA
YUYUN QONITA
DEPARTEMEN MANAJEMEN SUMBER DAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Eksplorasi Gen Cytochrome Oxidase Subunit I (COI) dari Kerang Mutiara (Pinctada fucata) yang Berasal dari Lokasi Geografis yang Berbeda
Nama : Yuyun Qonita
NIM : C24100019
Program studi : Manajemen Sumber Daya Perairan
Disetujui oleh
Dr Ir Yusli Wardiatno, MSc Pembimbing I
Dr Ir Nurlisa A. Butet, MSc Pembimbing II
Diketahui oleh
Dr Ir Mohammad Mukhlis Kamal, MSc Ketua Departemen
PRAKATA
Puji dan syukur Penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya, sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian ini adalah Eksplorasi Gen Cytochrome Oxidase Subunit I
(COI) dari Kerang Mutiara (Pinctada fucata) yang Berasal dari Lokasi Geografis yang Berbeda.
Penulis menyampaikan terima kasih kepada:
1. Institut Pertanian Bogor yang telah memberikan kesempatan untuk studi. 2. Program kerja sama penelitian Institut Pertanian Bogor dan Ehime
University, Jepang yang telah mendanai penelitian ini.
3. PT Timor Otsuki Mutiara, Kupang, NTT yang telah membantu kelancaran penelitian ini.
4. Dr Ir Yusli Wardiatno, MSc selaku ketua komisi pembimbing dan Dr Ir Nurlisa A. Butet, MSc selaku anggota komisi pembimbing yang telah memberi arahan dan masukan dalam penulisan karya ilmiah ini.
5. Dr Ir Mohammad Mukhlis Kamal, MSc selaku penguji tamu dan Ali Mashar SPi, MSi selaku komisi pendidikan Departemen Manajemen Sumber Daya Perairan atas saran dan masukan dalam penulisan karya ilmiah ini.
6. Dr Ir Ario Damar, MSc selaku dosen pembimbing akademik. 7. Ayah, ibu, dan keluarga yang telah memberikan dukungan dan doa. 8. Tim penelitian Institut Pertanian Bogor di Kupang
9. Tim Laboratorium Biologi Molekuler Departemen Manajemen Sumber Daya Perairan yang telah memberikan semangat.
10. Teman-teman terbaik mahasiswa Manajemen Sumber Daya Perairan angkatan 47.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2014
DAFTAR ISI
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
DAFTAR ISTILAH vii
PENDAHULUAN
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
METODE
Waktu dan Tempat 3
Bahan 3
Analisis Data 4
HASIL DAN PEMBAHASAN
Hasil 5
Pembahasan 8
KESIMPULAN DAN SARAN
Kesimpulan 10
Saran 11
DAFTAR PUSTAKA 11
LAMPIRAN 13
DAFTAR GAMBAR
1 Pinctada fucata dari Teluk Persia (kiri), P. fucata dari Selat Semau,
NTT (kanan) 3
2 Hasil ekstraksi DNA total Pinctada fucata dari Teluk Persia (kiri), dan
P. fucata dari Selat Semau, NTT (kanan) pada gel agarosa 1.2% 5 3 Visualisasi produk PCR pada gel agarosa 1%, kolom kiri sampai
kanan: marker 1 kb, Pf UE, Pf ID 6
4 Konstruksi filogeni berdasarkan gen COI pada famili Pteriidae (Pinctada fucata), Arcidae (Anadara antiquata, Anadara transversa, Arca ventricosa, Arca navicularis), dan Pectinidae (Perna viridis, Perna indica, Perna perna) 8
DAFTAR LAMPIRAN
1 Peta lokasi pengambilan contoh Pinctada fucata 13 2 Situs mutasi basa nukleotida gen COI Pinctada fucata yang berasal
dari Teluk Persia (Uni Emirat Arab) dan P. fucata yang berasal dari
Selat Semau (Indonesia) 14
3 Situs nukleotida spesifik gen COI Pinctada fucata yang berasal dari Teluk Persia (Uni Emirat Arab) dan P. fucata yang berasal dari Selat
DAFTAR ISTILAH
DNA barcoding : sistem yang dirancang untuk melakukan identifikasi secara cepat dan akurat berdasarkan urutan basa nukleotida dari gen penanda pendek yang telah terstandarisasi.
BLASTn : (Basic Local Alignment Search Tool-nucleotide) pilihan menu dari situs NCBI (National Center for Biotechnology Information) yang digunakan untuk memastikan kebenaran suatu spesies dan mengetahui kedekatan suatu spesies dengan spesies lain.
Complex life history : satu spesies yang memiliki beberapa stadia hidup dengan morfologi yang berbeda.
Complex species : satu spesies yang diklasifikasikan ke dalam beberapa nama spesies akibat keragaman morfologi.
Conserve : urutan basa nukleotida yang dipertahankan dalam jangka waktu yang sangat panjang pada suatu spesies;
basa nukleotida yang bersifat tetap dari setiap spesies dalam satu situs hasil pensejajaran.
Cryptic species : dua atau lebih spesies berbeda yang diklasifikasikan ke dalam satu spesies yang sama akibat karakteristik morfologi yang samar/mirip.
GenBank : situs NCBI yang memuat informasi dasar mengenai bioteknologi (termasuk informasi dasar DNA).
Phenotypic plasticity : satu spesies dengan beberapa bentuk tubuh yang berbeda akibat adaptasi terhadap lingkungan.
Sexual dimorphisme : satu spesies dengan morfologi yang berbeda antara jantan dan betina.
Singleton : satu basa nukleotida yang berbeda dari spesies lain dalam satu situs hasil pensejajaran.
PENDAHULUAN
Latar Belakang
Kerang mutiara merupakan salah satu komoditas laut yang memiliki nilai ekonomis tinggi. Kerang penghasil mutiara dari genus Pinctada yang dikenal di dunia adalah P. maxima, P. margaritifera, dan P. fucata. Saat ini, spesies yang paling banyak dikembangkan di Indonesia adalah P. maxima, yang mampu menghasilkan mutiara dengan ukuran terbesar. Meskipun demikian, spesies lainnya tetap memiliki potensi yang besar untuk dikembangkan. Kerang mutiara
P. fucata atau yang populer disebut sebagai Akoya pearl oyster, sebagai penghasil mutiara akoya, tersebar di perairan Indonesia, termasuk di Selat Semau, Nusa Tenggara Timur. Selain terdapat di perairan Indonesia, kerang mutiara P. fucata
juga tersebar di wilayah pesisir Uni Emirat Arab, khususnya di Teluk Persia. Di Teluk Persia, P. fucata telah banyak dikembangkan sebagai kerang penghasil mutiara.
Indonesia memiliki potensi yang besar dalam pengembangan mutiara akoya, namun kajian terhadap sumber daya P. fucata di Indonesia belum banyak dilakukan hingga saat ini. Pemanfaatan sumber daya P. fucata sebagai penghasil mutiara juga belum banyak dilakukan oleh masyarakat Indonesia. Oleh karena itu, upaya eksplorasi dan pengembangan kerang mutiara akoya (P. fucata) perlu dilakukan.
Tahap identifikasi merupakan tahap awal yang sangat penting dalam penentuan strategi pengembangan dan pengelolaan P. fucata di Indonesia. Teknik identifikasi berdasarkan karakteristik morfologi rentan terhadap kesalahan identifikasi akibat adanya fenomena cryptic species dan complex species. Cryptic species adalah dua atau lebih spesies yang sulit dibedakan secara morfologi dan sering ditemukan pada organisme yang hidup di laut (Knowlton 2000; Bickford et al. 2006). Oleh karena itu, diperlukan suatu teknik identifikasi yang lebih akurat, yaitu teknik identifikasi berdasarkan marka molekuler.
Menurut Vrijenhoek (2009), teknik identifikasi secara molekuler mampu menyelesaikan permasalahan identifikasi terhadap cryptic species dan kesamaan taksonomi akibat adanya phenotypic plasticity, sexual dimorphisme, dan complex life history. Salah satu teknik identifikasi molekuler yang populer digunakan adalah DNA barcoding. DNA barcoding merupakan sistem yang dirancang untuk mengidentifikasi spesies secara cepat dan akurat dengan menggunakan daerah gen yang terstandarisasi sebagai penanda spesies (Hebert et al. 2005). Sumber DNA pada hewan eukariot terbagi menjadi DNA inti dan DNA mitokondria (Duryadi 1994). DNA mitokondria yang banyak digunakan sebagai penanda adalah Cytochrome Oxidase Subunit I (COI). Menurut Hebert et al.
(2003a), keragaman sekuens gen COI mampu menjadi dasar dalam sistem DNA
barcoding hewan.
2
yang memiliki kekerabatan dekat, namun dapat pula membuat filogeografi dari spesies yang sama (Cox dan Hebert 2001 in Hebert et al. 2003b).
Eksplorasi gen COI melalui DNA barcoding memiliki peran penting dalam langkah awal pengelolaan serta perlindungan komoditas kerang mutiara maupun produk mutiara yang dihasilkannya. Perlindungan terhadap sumber daya dapat dilakukan dengan teknik DNA barcoding yang mampu memberikan identitas terhadap suatu komoditas berdasarkan urutan basa nukleotidanya. Berdasarkan DNA barcoding, dapat diketahui asal-usul suatu sumber daya dan dapat dilakukan validasi terhadap negara asal dari sumber daya tersebut (Nielsen dan Kjaer 2008), sehingga suatu negara dapat melakukan klaim kepemilikan dari komoditas perdagangan yang diproduksinya.
Perumusan Masalah
Indonesia memiliki potensi yang besar untuk mengembangkan mutiara akoya, namun pengembangan dan pemanfaatan kerang mutiara P. fucata belum banyak dilakukan di Indonesia. Tahap identifikasi merupakan tahap awal yang penting dalam upaya pengembangan dan pengelolaan sumber daya hayati. Fenomena cryptic species dan complex species dapat menyebabkan kesalahan identifikasi secara morfologi. Oleh karena itu, dibutuhkan teknik identifikasi yang lebih akurat, yaitu identifikasi berdasarkan marka molekuler. Teknik identifikasi yang digunakan adalah teknik DNA barcoding yang dilakukan dengan mengkarakterisasi gen COI dari P. fucata. Marka molekuler ini juga mampu memberikan perlindungan terhadap sumber daya kerang mutiara dan produk mutiara P. fucata berdasarkan identitas gen COI. Berdasarkan identitas molekuler tersebut, dapat diketahui asal wilayah dari suatu sumber daya, sehingga negara dapat melakukan klaim terhadap suatu komoditas perdagangan. Hal ini sangat dibutuhkan mengingat kerang mutiara P. fucata terdapat di beberapa negara di dunia, termasuk Indonesia dan Uni Emirat Arab. Selain itu, banyaknya kegiatan ekspor-impor kerang mutiara antarnegara akan meningkatkan kemungkinan terjadinya kerancuan identitas kerang mutiara dan produk mutiara yang dihasilkannya, sehingga dibutuhkan sebuah teknik pemberian identitas melalui DNA barcoding.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengeksplorasi urutan basa nukleotida gen
3
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Desember 2013 hingga Mei 2014. Penelitian dilakukan di Laboratorium Biologi Molekuler Perairan Departemen Manajemen Sumber Daya Perairan dan Laboratorium Terpadu Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Bahan
Bahan yang digunakan dalam penelitian ini adalah jaringan insang serta otot kaki dari kerang mutiara P. fucata. Contoh kerang mutiara (Gambar 1) diambil dari dua wilayah yang berbeda, yaitu Selat Semau, Nusa Tenggara Timur (Indonesia) dan Teluk Persia (Uni Emirat Arab) (Lampiran 1). Jumlah contoh yang digunakan dalam penelitian ini adalah 18 contoh P. fucata yang berasal dari Teluk Persia dan 2 contoh P. fucata yang berasal dari Selat Semau.
Gambar 1 Pinctada fucata dari Teluk Persia (kiri), P. fucata dari Selat Semau, NTT (kanan)
Isolasi dan ekstraksi DNA
Isolasi dan ekstraksi DNA dilakukan terhadap jaringan insang dan otot kaki
P. fucata yang berasal dari Teluk Persia (Uni Emirat Arab) dan Selat Semau, NTT (Indonesia), masing-masing sejumlah 18 dan 2 contoh. Sebelum dilakukan isolasi dan ekstraksi, contoh yang telah diawetkan di dalam alkohol 96% dibersihkan dan dicuci terlebih dahulu menggunakan akuades. Jaringan tubuh kerang kemudian diisolasi dan diekstraksi menggunakan kit komersial Gene Aid. Prosedur isolasi dan ekstrasi yang dilakukan mengikuti manual pabrik dengan beberapa prosedur yang telah dimodifikasi.
Uji kualitas DNA
4
1.2% yang direndam dengan buffer 1xTAE (40 mM Tris-asetat, 1 mM EDTA) dan dialiri listrik 100 volt selama 30 menit. Sebelumnya, gel agarosa telah diwarnai dengan ethidium bromide (EtBr). Penggunaan EtBr bertujuan untuk memberikan warna pada DNA, sehingga pita DNA dapat terlihat saat dilakukan visualisasi di bawah sinar UV. Volume DNA total yang digunakan dalam pengujian ini adalah 2.5 μL. Setelah DNA dimigrasikan dengan aliran listrik, gel agarosa kemudian diamati dan divisualisasikan di bawah sinar UV. DNA total dengan kualitas baik akan memiliki pita DNA yang tebal saat divisualisasikan di bawah sinar UV.
Amplifikasi DNA dengan metode PCR
Amplifikasi DNA dilakukan dengan metode PCR (Polymerase Chain Reaction) menggunakan kit komersial Kapa Extra Hot Start, sehingga prosedur amplifikasi mengikuti manual pabrik. Fragmen DNA yang diamplifikasi adalah gen COI. Primer yang digunakan merupakan primer universal untuk beberapa jenis kerang, termasuk P. fucata,yang didesain oleh Butet (2013, unpublish data). Amplifikasi DNA dilakukan dalam beberapa tahap, yaitu predenaturasi pada suhu 95 oC selama 3 menit, denaturasi pada suhu 95 oC selama 1 menit, annealing pada suhu 52 oC selama 1 menit, elongasi pada suhu 72 oC selama 1 menit, post-elongasi pada suhu 72 oC selama 5 menit, dan penyimpanan pada suhu 15 oC selama 10 menit. Amplifikasi dengan metode PCR dilakukan dalam 35 siklus di mana tahap denaturasi, annealing, dan elongasi diulang sebanyak 35 kali.
Sekuensing DNA P. fucata gen COI
Produk PCR yang memiliki kualitas baik dapat dilanjutkan ke tahap sekuensing atau pembacaan sekuens DNA. Sekuensing dilakukan oleh jasa perusahaan sekuensing berdasarkan pada metode Sanger (1977).
Analisis Data
Pensejajaran urutan nukleotida gen COI P. fucata
Hasil sekuensing diedit secara manual berdasarkan primer forward dan
reverse untuk mendapatkan urutan basa nukleotida gen COI dari P. fucata.
Urutan basa nukleotida P. fucata kemudian disejajarkan dengan spesies lainnya (ingroup dan outgroup) menggunakan metode Clustal W pada software MEGA 5.0 (Tamura 2011). Urutan basa nukleotida gen COI P. fucata yang berasal dari Teluk Persia (UEA) disejajarkan dengan P. fucata yang berasal dari Selat Semau, NTT (Indonesia) sebagai ingroup, sedangkan urutan nukleotida gen COI dari beberapa spesies famili Arcidae dan Pectinidae disejajarkan sebagai outgroup. Urutan basa nukleotida dari anggota famili Arcidae dan Pectinidae didapatkan dari GenBank. Spesies dari famili Arcidae yang digunakan adalah Anadara transversa (GQ166572.1), Anadara antiquata (HQ258850.1), Arca ventricosa
(AB076935.1), dan Arca venicularis (AB076935.1), sedangkan spesies yang digunakan dari famili Pectinidae adalah Perna viridis (JX676167.1), Perna indica
5 Jarak Genetik
Analisis jarak genetik dari urutan basa nukleotida gen COI intraspesies dan interspesies dilakukan menggunakan metode pairwise distance yang terdapat pada program MEGA 5.0 (Tamura et al. 2011). Jarak genetik intraspesies menunjukkan jarak genetik P. fucata yang berasal dari kedua wilayah yang berbeda, sedangkan jarak genetik interspesies menunjukkan jarak genetik antara P. fucata dan spesies lainnya dari famili Arcidae dan Pectinidae.
Analisis Filogeni
Analisis filogeni dilakukan menggunakan metode bootstrapped Neighbour Joining Tree dengan 1000 kali pengulangan pada software MEGA 5.0 (Tamura 2011). Pohon filogeni dikonstruksi berdasarkan jarak genetik antarspesies. Konstruksi pohon filogeni berfungsi untuk mengetahui hubungan kekerabatan antarspesies.
HASIL DAN PEMBAHASAN
Hasil
DNA total
Isolasi dan ekstraksi dilakukan terhadap jaringan insang dan otot kaki P. fucata yang berasal dari Teluk Persia (UEA) dan Selat Semau, NTT (Indonesia), masing-masing sebanyak 18 dan 2 contoh. Jaringan insang dipilih karena memiliki tekstur yang lembut sehingga memudahkan dalam proses penggerusan, sedangkan otot kaki dipilih karena mengandung jumlah sel yang relatif tinggi.
Berdasarkan isolasi dan ekstraksi DNA yang dilakukan, diperoleh DNA total dengan kualitas yang baik sebanyak 1 contoh, baik untuk P. fucata yang berasal dari Teluk Persia, UEA (Pf UE) dan P. fucata yang berasal dari Selat Semau, Indonesia (Pf ID). DNA total dengan kualitas baik ditunjukkan oleh keberadaan pita DNA yang terang dan tebal (Gambar 2).
Gambar 2 Hasil ekstraksi DNA total Pinctada fucata dari Teluk Persia (kiri), dan
6
DNA total P. fucata yang berasal dari perairan Indonesia berhasil diisolasi dan diekstraksi dari jaringan insang, sedangkan DNA total P. fucata yang berasal dari Teluk Persia diisolasi dan diekstraksi dari otot kaki. DNA total dengan kualitas yang baik dapat dijadikan cetakan DNAdalam tahap amplifikasi gen COI yang dilakukan menggunakan metode PCR.
Amplifikasi DNA gen COI
Amplifikasi gen COI dari kedua DNA total P. fucata dilakukan dengan metode PCR pada suhu penempelan primer (annealing) 52 oC. Amplifikasi gen COI menghasilkan produk PCR dengan kualitas yang baik. Gen COI yang berhasil teramplifikasi memiliki panjang urutan basa nukleotida berkisar antara 500-750 pb (Gambar 3). Selanjutnya, proses sekuensing akan dilakukan terhadap kedua produk PCR yang memiliki kualitas baik. Tahap sekuensing dilakukan untuk mendapatkan urutan basa nukleotida gen COI P. fucata.
Gambar 3 Visualisasi produk PCR pada gel agarosa 1%, kolom kiri sampai kanan: marker 1 kb, Pf UE, Pf ID
Sekuensing DNA dan pensejajaran urutan basa nukleotida gen COI P. fucata
Sekuensing gen COI P. fucata dilakukan menggunakan metode Sanger (1977). Sekuensing dilakukan melalui dua arah, yaitu forward dan reverse. Urutan basa nukleotida gen COI yang berupa urutan forward dan reverse
disejajarkan dan diedit secara manual, sehingga didapatkan panjang basa nukleotida gen COI untuk contoh P. fucata yang berasal dari Teluk Persia (UEA) dan Selat Semau, NTT (Indonesia), masing-masing adalah 360 pb dan 543 pb.
Komposisi urutan basa nukleotida gen COI dari kedua contoh P. fucata
7 Urutan basa nukleotida gen COI dari kedua contoh P. fucata (famili Pteriidae) disejajarkan dengan outgroup (famili Arcidae dan Pectinidae) yang diperoleh dari GenBank. Berdasarkan hasil pensejajaran, diperoleh nilai
conserved sebesar 18.3% (75/409), variable sebesar 71.8% (294/409) dan
singleton sebesar 51.3% (210/409).
Analisis jarak genetik dan filogeni gen COI P. fucata
Perhitungan jarak genetik dilakukan antara spesies P. fucata dan spesies bivalvia lainnya dari famili Arcidae dan Pectinidae. Perhitungan jarak genetik menunjukkan bahwa jarak genetik antara spesies P. fucata yang berasal dari Teluk Persia (UEA) dan P. fucata yang berasal dari Selat Semau, NTT (Indonesia) lebih rendah dari jarak genetik antara P. fucata dan spesies outgroup dari famili Arcidae dan Pectinidae (Tabel 1).
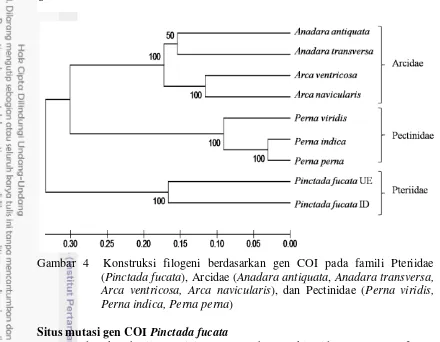
Data jarak genetik dijadikan sebagai dasar dalam analisis filogeni. Analisis filogeni dilakukan untuk mengetahui hubungan kekerabatan antarspesies. Analisis filogeni menunjukkan pemisahan yang nyata antara famili Pteriidae, Arcidae, dan Pectinidae (Gambar 4). Pohon filogeni yang dikonstruksi berdasarkan metode pairwise-distance menghasilkan tiga nodus. Nodus pertama terdiri dari anggota famili Pteriidae (kedua contoh P. fucata), nodus kedua terdiri dari anggota famili Arcidae (Anadara transversa, Anadara antiquata, Arca ventricosa, dan Arca navicularis), dan nodus ketiga terdiri dari anggota famili Pectinidae (Perna viridis, Perna indica, dan Perna. perna).
Tabel 1 Jarak genetik fragmen gen COI pada Pinctada fucata yang berasal dari Teluk Persia (UEA), P. fucata yang berasal dari Selat Semau (Indonesia), Anadara antiquata, A transversa, Arca ventricosa, Arca navicularis, Perna viridis, Perna indica, dan Perna perna
PF UEa Pf ID Aa At Av An Pv Pi Pp
Pf UE
Pf ID 0.333
Aa 0.702 0.641
At 0.687 0.616 0.308
Av 0.697 0.697 0.394 0.333
An 0.712 0.652 0.348 0.303 0.232
Pv 0.672 0.652 0.606 0.571 0.626 0.545
Pi 0.652 0.652 0.591 0.591 0.636 0.576 0.167
Pp 0.662 0.667 0.606 0.611 0.641 0.611 0.197 0.061 a
Pf UE: Pinctada fucata dari UEA, Pf ID: P. fucata dari Indonesia, Aa: Anadaraantiquata, At:
Anadara transversa, Av: Arca ventricosa, An: Arca navicularis, Pv: Perna viridis, Pi: Perna
8
Gambar 4 Konstruksi filogeni berdasarkan gen COI pada famili Pteriidae (Pinctada fucata), Arcidae (Anadara antiquata, Anadara transversa, Arca ventricosa, Arca navicularis), dan Pectinidae (Perna viridis, Perna indica, Perna perna)
Situs mutasi gen COI Pinctada fucata
Berdasarkan hasil pensejajaran urutan basa nukleotida gen COI P. fucata
yang berasal dari Teluk Persia (UEA) dan Selat Semau (Indonesia), diperoleh situs mutasi pada gen COI P. fucata sebanyak 33 situs. Situs mutasi yang ditemukan terdiri dari 16 situs mutasi insersi dan 17 situs mutasi delesi (Lampiran 2).
Nukleotida spesifik gen COI Pinctada fucata
Berdasarkan hasil pensejajaran gen COI P. fucata dengan gen COI famili Arcidae dan Pectinidae, diperoleh 70 situs spesifik pada P. fucata (Lampiran 3). Situs spesifik ini merupakan penciri yang membedakan spesies P. fucata dengan spesies lainnya dari famili Arcidae.dan Pectinidae. Keberadaan situs spesifik ini menunjukkan adanya evolusi dari spesies P. fucata.
Pembahasan
9 penempelan primer forward dan reverse di kedua ujung DNA terjadi pada tahap
annealing. Oleh karena itu, dibutuhkan suhu annealing yang optimal untuk proses penempelan primer tersebut.
Urutan basa nukleotida gen COI P. fucata yang berasal dari Teluk Persia (UEA) dan Selat Semau, NTT (Indonesia) didominasi oleh basa nukleotida adenin dan timin. Komposisi basa nukleotida A-T pada P. fucata yang berasal dari Teluk Persia dan Selat Semau, masing-masing adalah 56.2% dan 57.9%. Menurut Jusuf (2011), ikatan hidrogen A-T terdiri dari 2 ikatan hidrogen yang bersifat lebih lemah dibandingkan dengan ikatan hidrogen G-C yang memiliki 3 ikatan hidrogen. Oleh karena itu, ikatan basa nukleotida A-T lebih mudah untuk terpisah, sehingga menyebabkan spesies P. fucata memiliki kemungkinan mutasi yang relatif tinggi.
Urutan basa nukleotida gen COI P. fucata digunakan dalam analisis filogeni untuk mengetahui hubungan kekerabatan antara P. fucata dan spesies bivalvia lainnya (Anadara transversa, Anadara antiquata, Arca ventricosa, Arca navicularis, Perna viridis, Perna indica, Perna perna). Konstruksi pohon filogeni memperlihatkan pemisahan yang jelas antara famili Pteriidae (P. fucata) dengan famili Arcidae (Anadara transversa, Anadara antiquata, Arca ventricosa, Arca navicularis) dan famili Pectinidae (Perna viridis, Perna indica, Perna perna). Pohon filogeni dikonstruksi berdasarkan jarak genetik antarindividu. Semakin berbeda urutan basa nukleotida antarindividu, semakin besar pula jarak genetik antarindividu. Selanjutnya, semakin besar jarak genetik antarindividu, semakin jauh pula hubungan kekerabatan antara keduanya.
Konstruksi pohon filogeni memperlihatkan adanya tiga nodus. Nodus pertama terdiri dari P. fucata yang berasal dari perairan UEA dan P. fucata yang berasal dari perairan Indonesia. Nodus kedua terdiri dari anggota famili Arcidae, yaitu Anadara transversa, A. antiquata, Arca ventricosa, dan Arca navicularis,
sedangkan nodus ketiga terdiri dari anggota famili Pectinidae, yaitu P. viridis, P. indica, dan P. perna. Pemisahan ini terjadi akibat adanya situs spesifik pada gen COI yang menjadi penciri bagi P. fucata. Keberadaan situs spesifik yang berjumlah 70 situs nukleotida mampu membedakan antara P. fucata dan spesies lainnya dari famili Arcidae dan Pectinidae.
10
antara UEA dan Indonesia menyebabkan pertukaran haplotip tidak dapat terjadi antara kedua populasi dan menyebabkan tidak adanya konektivitas antara kedua populasi.
Teluk Persia terletak pada 23.9-30.3 oLU, sedangkan Selat Semau, NTT terletak pada 10.1-10.3 oLS. Hal ini menyebabkan Teluk Persia beriklim subtropis, sedangkan Selat Semau, NTT beriklim tropis. Lokasi geografis dengan iklim yang berbeda menyebabkan perbedaan kondisi lingkungan perairan, sehingga P. fucata melakukan strategi adaptasi yang berbeda pula untuk tetap bertahan hidup dan bereproduksi. Salah satu strategi adaptasi yang dilakukan adalah melalui mekanisme molekuler, sehingga gen COI P. fucata dari Teluk Persia (UEA) dan Selat Semau, NTT (Indonesia) memiliki karakter molekuler yang berbeda. Hal ini terbukti dari adanya perbedaan urutan basa nukleotida gen COI pada P. fucata yang berasal dari kedua wilayah tersebut.
Perbedaan urutan gen COI antara P. fucata yang berasal dari Teluk Persia (UEA) dan Selat Semau, NTT (Indonesia) dapat menjadi penciri khusus bagi masing-masing populasi untuk mengetahui asal wilayah keduanya. Adanya perbedaan tersebut mengindikasikan bahwa gen COI dapat menjadi suatu identitas molekuler dan alat autentifikasi bagi sumber daya P. fucata dan mutiara yang dihasilkannya untuk mencegah perdagangan ilegal dan pencurian mutiara. Berdasarkan identitas molekuler tersebut, suatu negara dapat melakukan klaim perdagangan terhadap sumber daya P. fucata dan produk mutiaranya.
Adanya situs mutasi dan perbedaan urutan basa nukleotida gen COI dari kedua contoh mengindikasikan bahwa P. fucata yang berasal dari Teluk Persia (UEA) dan Selat Semau (Indonesia) memiliki keragaman nukleotida yang berbeda.
P. fucata yang berasal dari Selat Semau (Indonesia) memiliki urutan basa nukleotida gen COI yang khas. Keragaman nukleotida suatu spesies penting untuk dipertahankan bagi kelestarian spesies tersebut. Semakin tinggi keragaman nukleotida, semakin tinggi pula keragaman genetik yang dimiliki. Keragaman genetik memiliki peran penting dalam kebugaran (fitness) dan ketahanan suatu populasi. Keragaman genetik mampu menyediakan keragaman respon yang penting untuk menjaga fungsi ekosistem dan adaptasi spesies terhadap perubahan lingkungan (Ehlers et al. 2008). Oleh karena itu, kondisi perairan Selat Semau yang belum banyak terkontaminasi oleh polutan harus tetap dipertahankan. Kegiatan antropogenik yang membuang limbah di sepanjang pesisir juga perlu dibatasi dalam upaya mempertahankan kondisi perairan Selat Semau yang berperan sebagai habitat kerang mutiara P. fucata. Terjaganya kondisi habitat menjadi faktor penting dalam pemeliharaan keragaman genetik P. fucata, sehingga populasi P. fucata di Selat Semau dapat tetap lestari.
KESIMPULAN DAN SARAN
Kesimpulan
Karakterisasi gen COI berhasil dilakukan pada kerang mutiara P. fucata
11 yang berasal dari Teluk Persia (UEA) dan P. fucata yang berasal dari Selat Semau, NTT (Indonesia) memiliki perbedaan urutan basa nukleotida gen COI. Perbedaan urutan basa nukleotida gen COI ini dapat menjadi penciri bagi masing-masing populasi, sehingga suatu negara dapat melakukan klaim perdagangan terhadap sumber daya P. fucata dan mutiara yang dihasilkannya berdasarkan urutan basa nukleotida gen COI.yang dimilikinya.
Saran
Pengambilan contoh P. fucata yang berasal dari wilayah geografis yang lebih bervariasi diperlukan untuk memberikan pembuktian yang lebih menyeluruh mengenai perbedaan urutan basa nukleotida gen COI P. fucata. Penelitian lanjutan dengan melakukan cloning gen COI P. fucata juga perlu dilakukan untuk mendapatkan urutan basa nukleotida utuh dari gen COI P. fucata.
DAFTAR PUSTAKA
Bickford D, Lohman DJ, Sodhi NS, Ng PKL, Meler R, Winker K, Ingram KK, Das I. 2006. Cryptic species as a window on diversity and conservation.
Ecology and Evolution. 22:148-155.doi:10.1016/j.tree.2006.11.004.
Duryadi D. 1994. Peran DNA mitokondria (mtDNA) dalam studi keragaman genetik dan biologi populasi pada hewan. J Hayati. 1(1):1-4.
Ehlers A, Worm B, Reusch TBH. Importance of genetic diversity in eelgrass
Zostera marina for its resilience to global warming. Mar Ecol Prog Ser. 355: 1-7
Hebert PDN, Ratnasingham S, deWaard JR. 2003a. Barcoding animal life: cytochrome c oxidase subunit 1 divergences among closely related species.
Proc. R. Soc. Lond. 270:96–99. doi:10.1098/rsbl.2003.0025.
Hebert PDN, A Cywinska, Ball S. L, deWaard JR. 2003b. Biological identification through DNA barcodes. Proc. R. Soc. Lond. 270:313-321. doi:10.1098/rspb.2002.2218.
Hebert PDN, Gregory T R. 2005. The Promise of DNA Barcoding for Taxonomy.
Syst. Biol. 54(5):852-859. doi:10.1080/10635150500354886.
Jusuf M. 2001. Genetika I: Struktur dan Ekspresi Gen. Jakarta (ID):Sagung Seto. Knowlton N, Weigt LA. 1998. New dates and new rates for divergence across the
Isthmus of Panama. Proc. R. Soc.Lond. 265:2257-2263.
Knowlton N. 2000. Molecular genetic analyses of species boundaries in the sea.
Hydrobiologi. 420:73-90.
Moreira PA, Fernandes GW, Collevatti RG. 2009. Fragmentation and spatial genetic structure in Tabebuia ochracea (Bignoniaceae) a seasonally dry Neotropical tree. Forest Ecology and Management. 258:2690-2695. doi:10.1016/j.foreco.2009.09.037
12
Pereira JC, Chaves R, Bastos E, Leitao A, Pinto HG. 2011. An efficient method for genomic DNA extraction from different molluscs species. Int J Mol Sci.
12:8086-8095. doi:10.3390/ijms12118086.
Popa OP, Murariu D, Popa LO. 2007. Comparison of four DNA extraction methods from invasive freshwater bivalve species (mollusca: bivalvia) in Romanian fauna. Grigore Antipa. L:527-536.
Sanger F, Nicklen S, Coulson AR. 1977. DNA sequencing with chainterminating inhibitors. Proc Natl Acad Sci USA. 74: 5463-5467.
Tamura K, Dudley J, Nei M, Kumar S. 2011. Mega 5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. J Mol Biol Evol. 28 (10): 2731–2739. doi:10.1093/molbev/msr121.
Vrijenhoek RC. 2009. Cryptic species, phenotypic plasticity, and complex life histories: Assessing deep-sea faunal diversity with molecular markers.
13
LAMPIRAN
Lampiran 1 Peta lokasi pengambilan contoh Pinctada fucata
Peta lokasi pengambilan contoh P. fucata di Teluk Persia (Uni Emirat Arab)
14
17