EVALUASI KINERJA PERTUMBUHAN BENIH LELE
Clarias gariepinus
PADA SISTEM BUDIDAYA BIOFLOK
YANG DIBERI PAKAN DENGAN KADAR PROTEIN BERBEDA
NOVIATI ROHMATUL KHASANAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis yang berjudul Evaluasi Kinerja Pertumbuhan Benih Lele (Clarias gariepinus) pada Sistem Budidaya Bioflok yang Diberi Pakan dengan Kadar Protein Berbeda adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2016
RINGKASAN
NOVIATI ROHMATUL KHASANAH. Evaluasi Kinerja Pertumbuhan Benih Lele (Clarias gariepinus) pada Sistem Budidaya Bioflok yang Diberi Pakan dengan Kadar Protein Berbeda. Dibimbing oleh Nur Bambang Priyo Utomo, Mia Setiawati, dan Munti Yuhana.
Kadar protein pakan yang tinggi berbanding lurus dengan harga pakan yang cukup mahal. Harga beli benih tidak sebanding dengan harga jual benih relatif murah sehingga upaya penurunan protein dilakukan guna mengefisienkan pakan yang diberikan. Protein pakan yang mampu diretensi oleh ikan hanya 25% dari total pakan yang dimakan dan 75% sisanya diekskresikan melalui insang dan urin dalam bentuk amonia sehingga timbul masalah limbah budidaya. Teknologi bioflok merupakan teknologi dalam bidang akuakultur yang dapat dipergunakan sebagai alternatif dalam masalah limbah budidaya serta struktur bioflok mampu menyumbangkan nilai protein sebesar 30 - 35%. Sumbangan protein bioflok tersebut dapat dijadikan alternatif penambah kebutuhan nutrisi pada benih ikan lele.
Rancangan penelitian yang digunakan adalah rancangan acak lengkap dengan 4 perlakuan dan 3 ulangan, yaitu: A (38%), B (34%), C (30%), D (26%). Pakan uji digunakan dalam bentuk pellet. Penambahan sumber karbon berupa molase dengan C/N rasio 15 diberikan 1 kali sehari setelah 2 jam pemberian pakan di pagi hari. Pakan diberikan pada pukul 08.00 dan pukul 16.00 sebanyak 5% dari biomasa benih lele. Benih lele yang digunakan berukuran berat rata-rata 0,83 ± 0,01 g dan panjang rata-rata 4,64 ± 0,04 cm dipelihara di akuarium berukuran 60 x 40 x 35 cm3 sebanyak 15 unit yang dilengkapi dengan tiga titik aerasi. Masing-masing akuarium diisi air sebanyak 60 L dan setiap akuarium diberi 1 liter air dari limbah budidaya lele dengan padat tebar benih 90 ekor/akuarium. Inokulasi bakteri heterotrof berupa Staphylococcus lentus L1k dilakukan pada setiap perlakuan dengan kepadatan 104 CFU/mL setiap satu minggu sekali. Parameter uji meliputi parameter kinerja pertumbuhan, parameter bioflok, parameter kesehatan dan parameter kualitas air. Parameter kinerja pertumbuhan meliputi laju pertumbuhan harian, panjang total, koefisien keragaman panjang, efisiensi pakan, jumlah konsumsi pakan, retensi protein, retensi lemak, dan tingkat kelangsungan hidup. Parameter bioflok meliputi nutrient flok, volume flok, padatan tersuspensi total, volatil tersuspensi total, kelimpahan bakteri total di media air, kelimpahan bakteri L1k di media air, dan kelimpahan bakteri di usus. Parameter kesehatan meliputi hematokrit, hemoglobin, total eritrosit, dan total leukosit. Parameter kualitas air meliputi TAN, amonia, pH, suhu dan oksigen terlarut.
sampai akhir penelitian, kelimpahan bakteri L1k di media air menunjukkan tren yang sama dengan kelimpahan bakteri total di media air, kelimphan bakteri L1k dan kelimpahan bakteri total di usus tertinggi pada perlakuan B (4,39 Log CFU/mL dan 7,98 Log CFU/mL). Nilai hematokrit tertinggi pada perlakuan A (27,67%), total eritrosit tertinggi pada perlakuan B(2,39 x 106 sel/mm3), nilai hemoglobin dan total leukosit tidak berbeda nyata antara perlakuan (P>0,05). Berdasarkan hasil tersebut dapat diambil kesimpulan bahwa kadar protein pakan 34% dapat menggantikan kadar protein pakan 38% pada pendederan benih lele berukuran 4 - 5 cm melalui sistem budidaya bioflok.
SUMMARY
NOVIATI ROHMATUL KHASANAH. Evaluation of growth performance Catfish fry (Clarias gariepinus) in biofloc-based system on different dietary protein level. Supervised by Nur Bambang Priyo Utomo, Mia Setiawati and Munti Yuhana.
The high dietary protein level is directly correlated simoultanesly to the feed price. On the other hand, the relatively low price of the fry make more efforts to lower the protein and to search for feed subtitution in order to gain efficien. There are only 25% of protein retentioned out of the total feed consumed and the rest of 75% will be excreted through the urine and the gills in the form of ammonia. This aquaculture waste has many implications occurred. Biofloc-based technology is one of improving technology in aquaculture study that can be used as problem solving for waste management in aquaculture. The microbial composition of biofloc contributes the increase value of proteins by 30-35%. Additionally; the biofloc role in protein contribution is important for supplement which support the needs of nutrition oncatfish fry.
The experiments were performed using a completely randomized design, consisted of 4 different treatments, i.e feed with various protein levels of 38%(A), 34%(B), 30%(C), and 26%(D) as crumbele feed. The molasses was added as organic carbon source with the C/N (carbon/nitrogen) ratio of 15 was administrated once a day after 2 hours feeding in the morning. Feeding was conducted at 8 am and 4 pm at 5% of the biomass weight. Catfish with initial weight of 0,83 ± 0,01 g and length of 4,64 ± 0,04 cm were cultured in tank size 60x40x35 cm3 for 15 unit with three points aeration. Every tank filled with 60 L of water and added by 1 L of liquid waste of cultured catfish fry each tank with density of 90 fish each tank for 35 days. Inoculation of heterotrophic bacterial cells of Staphylococcus lentus L1k included performed of 104 CFU/mL every weeks. Parameters observed included growth performance parameters, biofloc parameters, imun parameters, and water quality parameters. Growth performance parameters consisted of the daily growth rate, total length, length coefficient correlation, efficiency of feed, feed consumption, protein retention, fat retention, survival rate. Biofloc parameters consisted of floc nutrient, floc volume, total suspended solid, volatile suspended solid, total bacteria density in water, L1k bacteria density in water, total bacterial density in intestine, L1k bacterial density in intestine. Imun parameters consisted of hermatocrite, hemoglobin, total erythrocytes, and total leukocytes. Water quality parameters consisted of TAN, amonia, pH, temperature and disolved oxigen.
showed similar trend compare with total bacteria density in water, the highest of L1k bacteria density dan total bacteria density in intestine on treatment B (4,39 Log CFU/mL dan 7,98 Log CFU/mL). The highest of value haematocyte on treatment A(27,67%), the highest of erytrocyte total on treatment B(2,39 x 106 sel/mm3), the haemoglobin and leucocyte total were not significantly different (P>0,05) compared to the other treatment. Based on the results, it can be concluded that 34% protein feed (C) can replace 38% protein feed (B) catfish fry size 4 - 5 cm through biofloc-based system.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
EVALUASI KINERJA PERTUMBUHAN BENIH LELE
Clarias gariepinus
PADA SISTEM BUDIDAYA BIOFLOK
YANG DIBERI PAKAN DENGAN KADAR PROTEIN BERBEDA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis ucapkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah yang berjudul Evaluasi Kinerja Pertumbuhan Benih Lele (Clarias gariepinus) pada Sistem Budidaya Bioflok yang Diberi Pakan dengan Kadar Protein Berbeda, berhasil diselesaikan dengan baik. Ucapan terimakasih penuliskan berikan kepada:
1. Dr Ir Nur Bambang Priyo Utomo, MSi, Dr Ir Mia Setiawati, MSi., Dr Munti Yuhana, SPi MSi selaku dosen pembimbing.
2. Dr Ir Odang Carman, MSc selaku dosen penguji luar komisi yang telah memberikan saran dan masukan untuk kesempurnaan tesis ini.
3. Dr Dinamella Wahjuningrum, SSi MSi selaku wakil Progam Studi Ilmu Akuakultur yang telah memberikan saran dan arahan selama sidang tesis ini.
4. Direktorat Jendral Pendidikan Tinggi yang telah memberikan beasiswa penuh selama menempuh pendidikan.
5. Suamiku Lukman Al Haries, SIP yang selalu memberikan cinta kasih, dukungan, semangat dan doa yang tiada henti serta anakku Keenan Al Rasyid yang telah memberikan kekuatan dan rasa syukur luar biasa. 6. Ibunda Siti Muslimah dan Ayahanda Imam Munjdali (Alm), Ibu mertua
Sukarni dan Ayah mertua Abdul Kodir, kakak Binti Solehah, SE dan Annakun Nurjanati, SE yang telah memberikan kasih sayang, dukungan semangat dan doa yang tulus.
7. Adik-adik Laboratorium Kesehatan Ikan (Hana, Mey, Shyfa yang telah ikhlas membantu selama penelitian), (Mita, Dian, Hesti, Acik, Ardana dan Dilla yang turut memberikan dukungan dan semangatnya).
8. Teman-teman Laboratorium Nutrisi Ikan atas kebersamaan selama penelitian
9. Rekan-rekan seperjuangan S2 Ilmu Akuakultur 2013 (Andre RS SPi MSi, Wildan N SPi, Kurnia F SPi, Nurin DA SPi, Fahmi SPi MSi, A Fahrul SPi MSi, Asep AA SPi MSi, Abung MS SPi MSi, Didi SSi MSi, Erni SPi MSi, Ikma SPi MSi, Rifki SPi MSi, Lukman A SPi MSi, Hilma PF SPi MSi, Putri SPi MSi, Windu S SPi MSi)
10.Rekan kos Bunda Lestari (Sekar Ayu C SPi MSi, Enggar Y Arini SSi, Ni Wayan Srimani P SSi, Fikriyatul Falasifah SSi dan Deti Triyani SSi) 11.Semua pihak yang tidak dapat disebutkan satu persatu yang telah
membantu dalam penyelesaian tesis ini.
Akhir kata semoga karya ilmiah ini memberikan manfaat dan inspirasi bagi seluruh pembacanya.
Bogor, September 2016
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
3 METODE 2
Waktu dan Tempat Penelitian 3
Rancangan Penelitian 3
Prosedur Penelitian 3
Parameter Uji 4
Analisis Data 7
4 HASIL DAN PEMBAHASAN 8
Hasil 8
Pembahasan 13
5 SIMPULAN DAN SARAN 18
Simpulan 18
Saran 18
DAFTAR PUSTAKA 18
LAMPIRAN 21
DAFTAR TABEL
1 Formulasi bahan baku pakan dalam (%) berat kering 3 2 Hasil analisis proksimat pakan dalam (%) berat kering 3 3 Analisis nutrien flok selama 35 hari pemeliharaan 8 4 Kelimpahan bakteri usus selama 35 hari pemeliharaan 11 5 Kualitas air media pemeliharaan benih lele selama 35 hari 11 6 Kinerja pertumbuhan pada benih lele selama 35 hari pemeliharaan 11 7 Analisis proksimat tubuh benih lele dalam berat kering (%) selama
35 hari pemeliharaan 12 8 Hematologi benih lele selama 35 hari pemeliharaan 12
DAFTAR GAMBAR
1 Volume flok selama 35 hari pemeliharaan 8
2 Padatan tersuspensi total selama 35 hari pemeliharaan 9 3 Padatan tersuspensi volatil selama 35 hari pemeliharaan 9 4 Kelimpaham bakteri L1k di media air selama 35 hari pemeliharaan 10 5 Kelimpahan bakteri total di media air selama 35 hari pemeliharaan 10
DAFTAR LAMPIRAN
1 Prosedur perhitungan jumlah karbon yang ditambahkan 22
2 Profil bioflok selama 35 hari pemeliharaan 24
3 Prosedur analisis proksimat pakan dan tubuh ikan 24
4 Prosedur pengukuran gambaran darah 26
5 Analisis statistik laju pertumbuhan harian, panjang total, koefisien
keragaman, efisiensi pakan, jumlah konsumsi pakan, retensi protein, retensi
lemak, tingkat kelangsungan hidup 28
6 Analisis statistik protein, lemak, abu, serat kasar, BETN dan gross energi
pada proksimat tubuh benih lele 33
7 Analisis statistik protein, lemak, abu, serat kasar, BETN dan gross energi
nutrien flok pada wadah pemeliharaan. 36
1
PENDAHULUAN
Latar Belakang
Protein merupakan salah satu nutrien dari pakan yang penting untuk pertumbuhan. Benih lele akan tumbuh optimal jika kandungan energi dari sumber protein pakan yang digunakan untuk pemeliharaan dasar tubuh telah tercukupi, sehingga kelebihan energi pakan akan digunakan sepenuhnya untuk pertumbuhan (Lovell 1988). Pelaku pembenihan umumnya menggunakan pakan dengan protein tinggi yaitu berkisar antara 38 - 40% untuk hasil produksi yang maksimal. Harga pakan dengan kadar protein tinggi tergolong mahal dan tidak sesuai dengan harga jual benih yang relatif rendah.
Ikan lele (Clarias gariepinus) merupakan ikan air tawar yang menjadi salah satu ikan konsumsi unggulan di Indonesia dengan permintaan pasar yang terus meningkat setiap tahun. Peningkatan permintaan tersebut menyebabkan kebutuhan benih lele juga mengalami peningkatan. Permintaan yang tinggi tersebut tidak diimbangi dengan stok benih yang memadai. Intensifikasi pembenihan merupakan salah satu solusi yang paling tepat, guna memenuhi permintaan benih yang terus menerus meningkat. Budidaya intensif berimplikasi pada penggunaan pakan buatan kaya protein yang semakin besar sehingga menimbulkan masalah budidaya yaitu berupa limbah akuakultur (Gunadi 2012). Limbah akuakultur tersebut berasal dari akumulasi residu organik dari pakan yang tidak termakan, feses serta kemampuan ikan dalam meretensi protein pakan yang masih relatif rendah yaitu, berkisar antara 20 - 25% dapat menimbulkan terbentuknya amonia berbahaya yang mencemari wadah budidaya (Avnimelech 2007). Oleh sebab itu, dibutuhkan solusi untuk mengatasi berbagai permasalahan pembenihan secara intensif.
Teknologi bioflok merupakan salah satu teknologi budidaya pengolahan limbah yang dapat dijadikan alternatif dalam mengatasi berbagai masalah intensifikasi pembenihan (De Schryver et al. 2008). Prinsip utama teknologi bioflok adalah manajemen kualitas air yang memanfaatkan kemampuan bakteri heterotrof dalam mengkonversi nitrogen organik dan anorganik melalui pemberian sumber karbon berupa molase dengan perbandingan C/N rasio 15 (Ekasari 2009). Keseimbangan C dan N menjadi kunci sukses pembentukan bioflok oleh bakteri heterotrof. Staphylococcus lentus L1k merupakan salah satu bakteri heterotof yang memiliki fungsi sebagai agen biokontrol dan bioremediasi yang berasal dari isolasi usus ikan lele (Firdaus 2012). Sebagai agen bioremediasi, L1k berperan dalam memperbaiki kualitas air dengan cara mereduksi konsentrasi amonia dalam wadah budidaya sehingga mendukung pertumbuhan benih lebih optimal. Pemberian bakteri heterotropik L1k dengan kepadatan 104 CFU/mL menunjukkan kinerja pertumbuhan benih lele terbaik pada sistem pemeliharaan bioflok (Salamah 2014).
pertumbuhan dan efisiensi pakan (Rangka dan Gunarto 2012), nutrien yang terkandung didalam bioflok memiliki kandungan protein yang cukup tinggi (Xu et al. 2012), pengurangan penggunaan kadar protein pakan tidak mengganggu pertumbuhan dan status kesehatan udang sehingga dapat dijadikan alternatif dalam penurunan kadar protein pakan, yang secara otomatis mampu menekan biaya produksi pembenihan (Xu dan Pan 2014). Penurunan protein pakan pada ikan air tawar menggunakan sistem bioflok belum banyak dilakukan oleh karena itu, perlu dilakukan penelitian untuk mengevaluasi kinerja pertumbuhan benih lele Clarias sp. yang diberi kadar protein pakan berbeda melalui sistem bioflok.
Perumusan Masalah
Permintaan benih lele terus mengalami peningkatan sehingga perlu intensifikasi pembenihan, untuk menunjang pertumbuhan budidaya intensif diperlukan pakan dengan kadar protein yang tinggi, sementara harga pakan dengan kadar protein tinggi relatif masih mahal serta kemampuan ikan dalam merentensi pakan hanya 25% dari total pakan yang dimakan dan sisanya diekskresikan melalui insang dan urin dalam bentuk amonia (NH3) yang tidak
terionisasi sehingga menimbulkan limbah budidaya. Solusi dari permasalahan tersebut adalah dilakukan upaya penurunan protein dengan menggunakan sistem bioflok. Teknologi bioflok tersebut selain mampu mengatasi limbah budidaya juga dapat menyumbang protein untuk menunjang pertumbuhan.
Tujuan Penelitian
Tujuan dari penelitian ini yaitu untuk mengevaluasi kinerja pertumbuhan benih lele (Clarias gariepinus) pada sistem budidaya bioflok yang diberi pakan dengan kadar protein berbeda.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi kepada pembudidaya benih lele mengenai pakan dengan protein tertentu yang menggunakan teknologi bioflok mampu memberikan efisiensi pakan yang tinggi.
2
METODE
Waktu dan Lokasi Penelitian
karbon di Laboratorium Ilmu Tanah, Fakultas Pertanian. Analisis Institut Pertanian Bogor.
Rancangan Penelitian
Penelitian dilakukan dengan metode eksperimental menggunakan Rancangan Acak Lengkap (RAL) dengan 4 perlakuan dan 3 ulangan sebagai berikut: Perlakuan A (pakan protein 38%), Perlakuan B (pakan protein 34%), Perlakuan C (protein 30%), Perlakuan D (pakan protein 26%). Bahan baku yang digunakan dalam penelitian ini meliputi tepung ikan, tepung tulang daging, tepung bungkil kedelai, tepung pollard, minyak jagung, minyak ikan, premix, dan CMC (Carboxy Methyl Cellulose). Bahan baku tersebut dicetak dalam bentuk pelet (Tabel 1.). Sedangkan hasil analisis proksimat pakan benih lele ditampilkan dalam (Tabel 2.) dibawah ini:
Tabel 1.Formulasi bahan baku pakan dalam (%) berat kering
Bahan baku A(38%) B(34%) C(30%) D(26%)
Tepung ikan 15,00 15,00 6,00 4,00
Tepungtulang daging 25,00 19,00 18,00 3,00
Tepung bungkil kedelai 35,00 28,00 27,00 33,00
Tepung pollard 15,00 28,00 39,00 50,00
Tabel 2. Hasil analisis proksimat pakan dalam (%) berat kering
Parameter Perlakuan Protein Pakan
A(38%) B(34%) C(30%) D(26%)
Protein (%) 38,01 34,23 30,19 26,10
Lemak (%) 7,11 5,7 4,30 3,33
Abu (%) 18,15 15,20 12,13 10,49
Serat Kasar (%) 6,53 8,11 9,33 11,52
Bahan Ekstrak Tanpa Nitrogen 30,44 37,34 44,02 48,52 GrossEnergi (kkal/kg)* 3948,57 3898,51 3827,50 3703,79
c/p ratio 10,38 11,38 12,67 14,18
Keterangan : *Gross energi protein 5,6 kkal/g, lemak 9,4 kkal/g, karbohidrat (BETN) 4,1 kkal/g (Watanabe, 1988)
Prosedur Penelitian
16.00. Ikan dipelihara selama 35 hari dan sebelum penimbangan bobot awal, benih dipuasakan terlebih dahulu selama 24 jam. Ikan sebanyak 15 ekor dibius kemudian disimpan ke dalam freezer untuk keperluan analisis proksimat ikan awal.
Penambahan sumber karbon dari molase diberikan 1 kali sehari setelah 2 jam pemberian pakan di pagi hari. Sumber karbon dimasukkan kedalam akuarium dengan C/N rasio 15 (De Schryver 2008). Inokulasi bakteri heterotrof berupa Staphylococcus lentus L1k dilakukan pada masing-masing perlakuan, dengan kepadatan 104 CFU/mL setiap satu minggu sekali (Salamah 2014).
Pada akhir pemeliharaan ikan sebanyak 10 ekor diambil dari setiap akuarium untuk uji hematologi dan diambil seberat 20 gram dari setiap akuarium untuk analisis proksimat tubuh. Bioflok diambil sebanyak 20 gr dari kolom air menggunakan plankton net untuk diuji proksimat nutrient flok.
Parameter Uji
Laju Pertumbuhan Harian
Laju pertumbuhan harian dihitung menggunakan rumus menurut Huissman (1987):
α % = { √� − }
Keterangan :
� = Laju pertumbuhan harian (%)
wt = Bobot rata-rata benih ikan pada akhir pemeliharaan (gram) wo = Bobot rata-rata benih ikan pada awal pemeliharaan (gram) t = Lama pemeliharaan (hari)
Pertumbuhan Panjang Mutlak
Panjang total tubuh ikan diukur menggunakan penggaris dan dihitung dengan rumus menurut Effendi (1979):
P (cm) = Pt – Po Keterangan:
P = Pertumbuhan panjang total (cm)
Pt = Panjang rata-rata ikan pada akhir pemeliharaan (cm) Po = Panjang rata-rata ikan pada awal pemeliharaan (cm)
Koefisien Keragaman Panjang
Variasi ukuran dalam penelitian ini berupa variasi panjang ikan, yang dinyatakan dalam koefisien keragaman (KK), dihitung menggunakan rumus Steel dan Torrie (1993) sebagai berikut:
Keterangan:
KK = Koefisien keragaman panjang (%) s = Simpangan baku
y = Rata-rata contoh
Efisiensi Pakan
Efisiensi pakan adalah perbandingaan biomassa ikan dengan jumlah pakan yang diberikan selama massa pemeliharaan dihitung dengan menggunakan rumus menurut Takeuchi (1988) yaitu:
EP (%) = + − �
Keterangan:
EP = Efisiensi pakan (%)
F = Jumlah pakan yang diberikan selama pemeliharaan (g) Wt = Bobot total ikan pada akhir pemeliharaan (g)
Wo = Bobot total ikan pada awal pemeliharaan (g) Wd = Bobot total ikan mati (g)
Retensi Protein
Retensi Protein dihitung dengan menggunakan rumus menurut Watanabe (1988) yaitu:
RP (%) = [ F − I /P] x 100 Keterangan:
RP = Retensi Protein (%)
F = Jumlah protein tubuh ikan pada akhir pemeliharaan (g) I = Jumlah protein tubuh ikan pada awal pemeliharaan (g)
P = Jumlah protein pakan yang dikonsumsi selama pemeliharaan (g)
Retensi Lemak
Retensi Lemak dihitung dengan menggunakan rumus menurut Watanabe (1988) yaitu:
RP (%) = [ F − I /P] x 100 Keterangan:
RP = Retensi Lemak (%)
F = Jumlah lemak tubuh ikan pada akhir pemeliharaan (g) I = Jumlah lemak tubuh ikan pada awal pemeliharaan (g)
P = Jumlah lemak pakan yang dikonsumsi selama pemeliharaan (g)
Tingkat Kelangsungan Hidup
Tingkat kelangsungan hidup/survival rate (SR), dihitung dengan rumus menurut Effendi (1979) yaitu:
100 No
Nt (%)
Keterangan :
SR = Tingkat kelangsungan hidup (%)
Nt = Jumlah ikan yang hidup pada akhir pengamatan (ekor) No = Jumlah ikan yang hidup pada awal uji tantang (ekor)
Proksimat
Proksimat dilakukan pada awal penelitian dan akhir penelitian. Proksimat yang dilakukan pada awal penelitian yaitu, pada proksimat bahan baku pakan, proksimat sumber karbon, proksimat tubuh ikan, dan proksimat pakan uji sedangkan yang dilakukan pada akhir penelitian yaitu, proksimat nutrien pada flok, proksimat tubuh ikan. Prosedur analisis proksimat pakan dan tubuh ikan tertera pada Lampiran 3.
Volume Flok
Volume flok merupakan representasi dari kepadatan partikel flok dalam suatu kolom air (Avnimelech 2012). Sebanyak 50 ml sampel air diendapkan selama 30 menit dalam tabung conical 50 ml. Volume flok yang mengendap dicatat dan selanjutnya dihitung dengan rumus :
� � �/� =�� �
Padatan Tersuspensi Total
Kertas saring sejumlah sampel dikeringkan dalam oven selama 24 jam kemudian didinginkan dalam desikator lalu ditimbang (X1). Sebanyak 50 ml air sampel disaring dengan milipore 0,45 µm kemudian siapkan cawan keramik dan dioven selama 24 jam lalu didinginkan dalam desikator lalu timbang. Kertas saring dimasukkan pada cawan yang telah ditimbang, oven pada suhu 100 oC selama 24 jam, kemudian didinginkan dalam desikator lalu timbang (X2), TSS dihitung berdasarkan pada rumus sebagai berikut:
�/� = � −�
� � � � � � �
Padatan Tersuspensi Volatil
Sampel dari pengukuran TSS yang sudah ditimbang (X2) dimasukkan ke dalam tanur pada suhu 600 oC selama 2 jam. Masing-masing cawan lalu dikeluarkan dari tanur, didinginkan dalam desikator kemudian ditimbang (X3), VSS dapat dihitung berdasarkan rumus sebagai berikut:
� �/� = X −X �
Populasi Bakteri
Total Kelimpahan Bakteri CFU/mL = jumlah koloni x faktor pengencerxml sampel
Analisis Hematologi
Parameter gambaran hematologi yang diamati meliputi kadar hematokrit, kadar hemaglobin, total eritrosit dan total leukosit. Prosedur pengamatan tertera pada Lampiran 4.
Kadar Hematokrit (He)
Kadar hematokrit dihitung berdasarkan Anderson dan Siwicki (1993) dengan rumus :
Hematokrit % =
Keterangan :
a = panjang bagian darah yang menggendap b = panjang total volume darah
Kadar hemoglobin (Hb)
Prosedur kadar hemoglobin digunakan metode Sahli (Wedemeyer dan Yasutake 1997) dengan melihat pada skala jalur kuning (g%) yang menunjukkan banyaknya hemoglobin dalam gram per 100 ml darah.
Total sel darah merah (total eritrosit)
Menurut Blaxhall dan Daisley (1973), total eritrosit dapat dihitung dengan rumus :
∑eritrosit = ∑sel terhitung faktor pengencer
Total sel darah putih (total leukosit)
Menurut Blaxhall dan Daisley (1973), total eritrosit dapat dihiting dengan rumus :
∑leukosit = ∑sel terhitung faktor pengencer
Analisis Data
3
HASIL DAN PEMBAHASAN
Hasil
Nutrien Flok
Nutrien flok yang terbentuk pada media pemeliharaan diuji pada akhir penelitian dan diambil dari kolom air. Uji nutrien flok yaitu meliputi protein, lemak, abu, serat kasar, dan BETN. Nutrien flok dapat dilihat pada Tabel 3. Tabel 3. Analisis nutrien flok selama 35 hari pemeliharaan
Komposisi Perlakuan pemberian kadar protein pakan yang berbeda (%)
A(38%) B(34%) D(30%) E(26%)
Protein (%) 33,06±1,26a 35,31±2,70a 32,80±1,80a 30,84±1,63a Lemak (%) 4,43±0,70a 4,48±0,51a 4,59±0,60a 4,35±0,15a Abu (%) 19,16±4,67a 16,49±1,44a 20,45±1,9 a 20,32±3,80a Serat kasar (%) 15,51±3,71a 13,17±1,17a 18,41±7,14a 16,97±7,84a BETN* 28,03±1,42a 29,21±1,96a 23,73±8,59a 27,50±9,98a GE (kkal/g)** 3338,11±167,41a 3512,57±135,57 a 3162,29±365,53a 3189,33±451,01a
Keterangan : * BETN = bahan ekstrak tanpa nitrogen, ** GE = Gross energi protein 5,6 kkal/g, lemak 9,4 kkal/g, karbohidrat (BETN) 4,1 kkal/g (Watanabe, 1988). Huruf yang sama pada baris yang sama menunjukkan pengaruh perlakuan yang tidak berbeda nyata (P>0,05). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku.
Tabel 3 menunjukkan bahwa flok yang terbentuk memiliki nilai protein yang cukup tinggi pada semua perlakuan. Hasil statistik menunjukkan semua perlakuan tidak berbeda nyata (p>0,05) baik pada analisis protein, lemak, abu, serat kasar, BETN dan SK. Kualitas protein nutrien flok pada perlakuan B lebih tinggi daripada perlakuan perlakuan lainnya. Hal yang sama juga terlihat pada perlakuan volume flok. Nilai volume flok dapat terlihat pada Gambar 1 di bawah ini.
Volume Flok
Data pada Gambar 1 memperlihatkan bahwa volume flok mengalami peningkatan di setiap minggu. Peningkatan drastis terlihat pada minggu ke-1 sampai minggu ke-2 dan minggu ke-2 sampai minggu ke-3 dan mulai stabil pada minggu ke-3 sampai minggu ke-5 pada semua perlakuan. Volume flok dapat dilihat pada Gambar 1.
Gambar 1. Volume flok selama 35 hari pemeliharaan
Padatan Tersuspensi Total
Total padatan tersuspensi diamati setiap minggu. Parameter ini digunakan untuk mengontrol padatan yang tersuspensi di dalam kolom air berupa bahan organik agar tidak melebihi ambang batas normal yang telah disarankan.
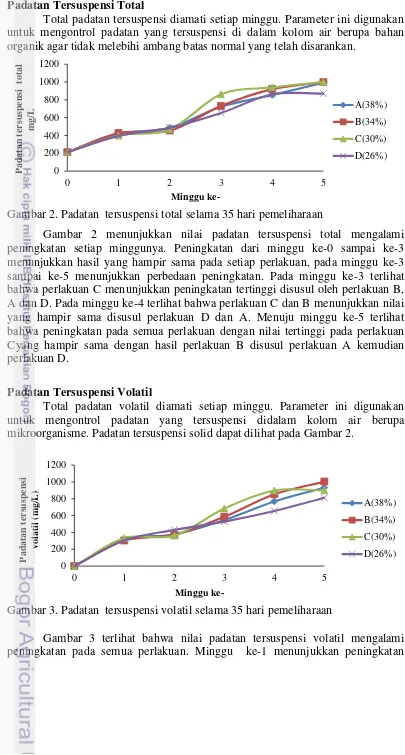
Gambar 2. Padatan tersuspensi total selama 35 hari pemeliharaan
Gambar 2 menunjukkan nilai padatan tersuspensi total mengalami peningkatan setiap minggunya. Peningkatan dari minggu ke-0 sampai ke-3 menunjukkan hasil yang hampir sama pada setiap perlakuan, pada minggu ke-3 sampai ke-5 menunjukkan perbedaan peningkatan. Pada minggu ke-3 terlihat bahwa perlakuan C menunjukkan peningkatan tertinggi disusul oleh perlakuan B, A dan D. Pada minggu ke-4 terlihat bahwa perlakuan C dan B menunjukkan nilai yang hampir sama disusul perlakuan D dan A. Menuju minggu ke-5 terlihat bahwa peningkatan pada semua perlakuan dengan nilai tertinggi pada perlakuan Cyang hampir sama dengan hasil perlakuan B disusul perlakuan A kemudian perlakuan D.
Padatan Tersuspensi Volatil
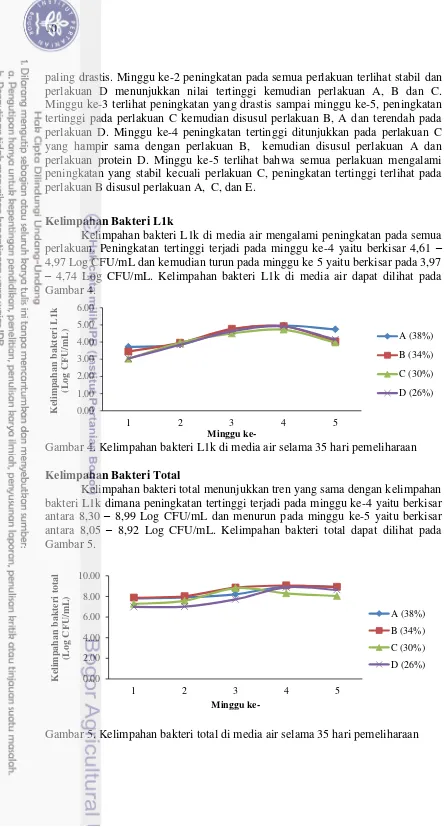
Total padatan volatil diamati setiap minggu. Parameter ini digunakan untuk mengontrol padatan yang tersuspensi didalam kolom air berupa mikroorganisme. Padatan tersuspensi solid dapat dilihat pada Gambar 2.
Gambar 3. Padatan tersuspensi volatil selama 35 hari pemeliharaan
Gambar 3 terlihat bahwa nilai padatan tersuspensi volatil mengalami peningkatan pada semua perlakuan. Minggu ke-1 menunjukkan peningkatan
paling drastis. Minggu ke-2 peningkatan pada semua perlakuan terlihat stabil dan perlakuan D menunjukkan nilai tertinggi kemudian perlakuan A, B dan C. Minggu ke-3 terlihat peningkatan yang drastis sampai minggu ke-5, peningkatan tertinggi pada perlakuan C kemudian disusul perlakuan B, A dan terendah pada perlakuan D. Minggu ke-4 peningkatan tertinggi ditunjukkan pada perlakuan C yang hampir sama dengan perlakuan B, kemudian disusul perlakuan A dan perlakuan protein D. Minggu ke-5 terlihat bahwa semua perlakuan mengalami peningkatan yang stabil kecuali perlakuan C, peningkatan tertinggi terlihat pada perlakuan B disusul perlakuan A, C, dan E.
Kelimpahan Bakteri L1k
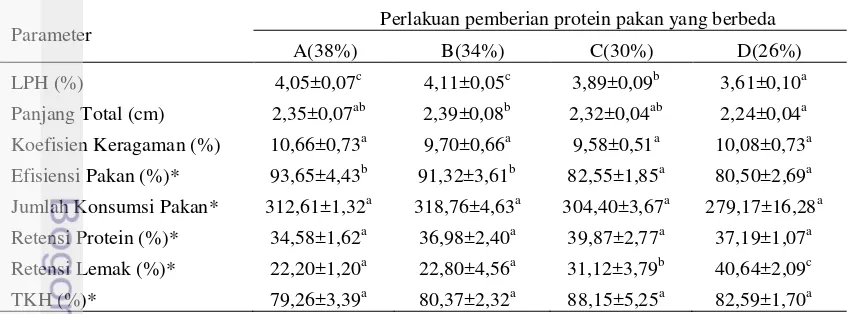
Kelimpahan bakteri L1k di media air mengalami peningkatan pada semua perlakuan. Peningkatan tertinggi terjadi pada minggu ke-4 yaitu berkisar 4,61 – 4,97 Log CFU/mL dan kemudian turun pada minggu ke 5 yaitu berkisar pada 3,97 – 4,74 Log CFU/mL. Kelimpahan bakteri L1k di media air dapat dilihat pada Gambar 4.
Gambar 4. Kelimpahan bakteri L1k di media air selama 35 hari pemeliharaan
Kelimpahan Bakteri Total
Kelimpahan bakteri total menunjukkan tren yang sama dengan kelimpahan bakteri L1k dimana peningkatan tertinggi terjadi pada minggu ke-4 yaitu berkisar antara 8,30 – 8,99 Log CFU/mL dan menurun pada minggu ke-5 yaitu berkisar antara 8,05 – 8,92 Log CFU/mL. Kelimpahan bakteri total dapat dilihat pada Gambar 5.
Gambar 5. Kelimpahan bakteri total di media air selama 35 hari pemeliharaan
Kelimpahan Bakteri Usus
Kelimpahan bakteri total di usus tertinggi pada perlakuan B(34%) yang berbeda nyata (P<0,05) dengan perlakuan lainnya. Begitu pula dengan kelimpahan bakteri L1k di usus menunjukkan bahwa perlakuan tertinggi pada perlakuan B(34%) yang berbeda nyata (P<0,05) dengan perlakuan lainnya. Kelimpahan bakteri di usus dapat dilihat pada Tabel 4.
Tabel 4. Kelimpahan bakteri usus selama 35 hari pemeliharaan
Bakteri Perlakuan pemberian protein berbeda
A(38%) B(34%) C(30%) D(26%)
L1k (Log CFU/mL) 4,05 ± 0,08b 4,39 ± 0,04c 3,17 ± 0,07a 3,06 ±0,15a Total (Log CFU/mL) 7,78 ± 0,01c 7,98 ± 0,15d 7,30 ± 0,09b 7,09 ± 0,08a
Huruf yang berbeda pada baris yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (P<0,05). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku.
Kualitas Air
Analisis kualitas air selama pemeliharaan meliputi kadar TAN, amonia, pH, suhu, dan DO disajikan pada Tabel 5.
Tabel5. Kualitas air media pemeliharaan benih lele selama 35 hari pemeliharaan
Parameter Perlakuan pemberian protein berbeda
A(38%) B(34%) C(30%) D(26%)
TAN (mg/L) 0,33-0,85 0,33-0,87 0,37-0,86 0,38-0,85 Amonia (mg/L) 0,0005-0,051 0,0006-0,056 0,0007-0,050 0,0006-0,060
pH 5,84-8,33 5,89-8,37 5,96-8,23 5,95-8,33
Suhu (oC) 27,9-28 27,9-28 27,9-28 27,9-28
DO (mg/L) 4,4-8,2 5-8,2 5,1-8,2 4,5-8,2
Kinerja Pertumbuhan
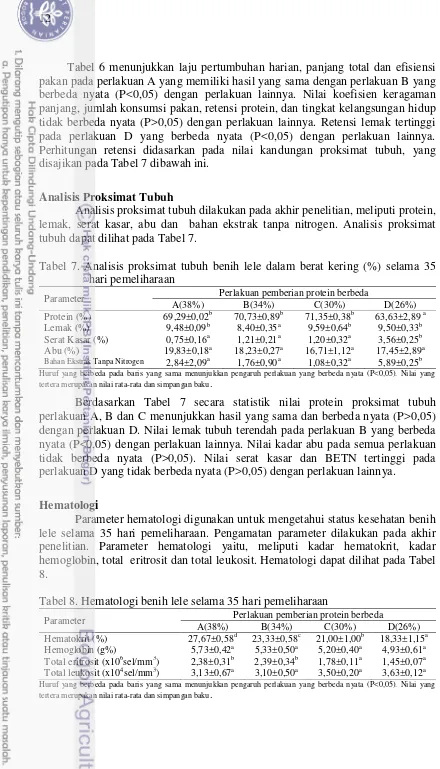
Kinerja pertumbuhan benih lele (Clariassp.) yang dipelihara selama 35 hari, yaitu meliputi laju pertumbuhan harian, panjang total, koefisien keragaman panjang, efisiensi pakan, jumlah konsumsi pakan, retensi protein, retensi lemak, dan tingkat kelangsungan hidup yang disajikan pada Tabel 6.
Tabel 6. Kinerja pertumbuhan pada benih lele selama 35 hari pemeliharaan
Parameter Perlakuan pemberian protein pakan yang berbeda
A(38%) B(34%) C(30%) D(26%)
LPH (%) 4,05±0,07c 4,11±0,05c 3,89±0,09b 3,61±0,10a Panjang Total (cm) 2,35±0,07ab 2,39±0,08b 2,32±0,04ab 2,24±0,04a Koefisien Keragaman (%) 10,66±0,73a 9,70±0,66a 9,58±0,51a 10,08±0,73a Efisiensi Pakan (%)* 93,65±4,43b 91,32±3,61b 82,55±1,85a 80,50±2,69a Jumlah Konsumsi Pakan* 312,61±1,32a 318,76±4,63a 304,40±3,67a 279,17±16,28a Retensi Protein (%)* 34,58±1,62a 36,98±2,40a 39,87±2,77a 37,19±1,07a Retensi Lemak (%)* 22,20±1,20a 22,80±4,56a 31,12±3,79b 40,64±2,09c TKH (%)* 79,26±3,39a 80,37±2,32a 88,15±5,25a 82,59±1,70a
Tabel 6 menunjukkan laju pertumbuhan harian, panjang total dan efisiensi pakan pada perlakuan A yang memiliki hasil yang sama dengan perlakuan B yang berbeda nyata (P<0,05) dengan perlakuan lainnya. Nilai koefisien keragaman panjang, jumlah konsumsi pakan, retensi protein, dan tingkat kelangsungan hidup tidak berbeda nyata (P>0,05) dengan perlakuan lainnya. Retensi lemak tertinggi pada perlakuan D yang berbeda nyata (P<0,05) dengan perlakuan lainnya. Perhitungan retensi didasarkan pada nilai kandungan proksimat tubuh, yang disajikan pada Tabel 7 dibawah ini.
Analisis Proksimat Tubuh
Analisis proksimat tubuh dilakukan pada akhir penelitian, meliputi protein, lemak, serat kasar, abu dan bahan ekstrak tanpa nitrogen. Analisis proksimat tubuh dapat dilihat pada Tabel 7.
Tabel 7. Analisis proksimat tubuh benih lele dalam berat kering (%) selama 35 hari pemeliharaan
Parameter Perlakuan pemberian protein berbeda
A(38%) B(34%) C(30%) D(26%)
Protein (%) 69,29±0,02b 70,73±0,89b 71,35±0,38b 63,63±2,89 a Lemak (%) 9,48±0,09b 8,40±0,35a 9,59±0,64b 9,50±0,33b Serat Kasar (%) 0,75±0,16a 1,21±0,21a 1,20±0,32a 3,56±0,25b Abu (%) 19,83±0,18a 18,23±0,27a 16,71±1,12a 17,45±2,89a
Bahan Ekstrak Tanpa Nitrogen 2,84±2,09a 1,76±0,90a 1,08±0,32a 5,89±0,25b Huruf yang berbeda pada baris yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (P<0,05). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku.
Berdasarkan Tabel 7 secara statistik nilai protein proksimat tubuh perlakuan A, B dan C menunjukkan hasil yang sama dan berbeda nyata (P>0,05) dengan perlakuan D. Nilai lemak tubuh terendah pada perlakuan B yang berbeda nyata (P<0,05) dengan perlakuan lainnya. Nilai kadar abu pada semua perlakuan tidak berbeda nyata (P>0,05). Nilai serat kasar dan BETN tertinggi pada perlakuan D yang tidak berbeda nyata (P>0,05) dengan perlakuan lainnya.
Hematologi
Parameter hematologi digunakan untuk mengetahui status kesehatan benih lele selama 35 hari pemeliharaan. Pengamatan parameter dilakukan pada akhir penelitian. Parameter hematologi yaitu, meliputi kadar hematokrit, kadar hemoglobin, total eritrosit dan total leukosit. Hematologi dapat dilihat pada Tabel 8.
Tabel 8. Hematologi benih lele selama 35 hari pemeliharaan
Parameter Perlakuan pemberian protein berbeda
A(38%) B(34%) C(30%) D(26%)
Hematokrit (%) 27,67±0,58d 23,33±0,58c 21,00±1,00b 18,33±1,15a Hemoglobin (g%) 5,73±0,42a 5,33±0,50a 5,20±0,40a 4,93±0,61a Total eritrosit (x106sel/mm3) 2,38±0,31b 2,39±0,34b 1,78±0,11a 1,45±0,07a Total leukosit (x104sel/mm3) 3,13±0,67a 3,10±0,50a 3,50±0,20a 3,63±0,12a
PEMBAHASAN
Pemberian kadar protein pakan yang berbeda pada benih lele yang diberi pakan 5% dari biomassa dan tanpa ganti air selama 35 hari memberikan dampak positif terhadap perbaikan kualitas airyang dapat dilihat melalui parameter bioflok. Parameter bioflok yang diamati adalah nutrient flok, volume flok, padatan tersuspensi total, padatan tersuspensi volatil, kelimphan bakteri L1k, kelimpahan bakteri total, total amonia nitrogen, amonia, pH, suhu dan kelarutan oksigen.
Hasil analisis proksimat nutrient flok (Tabel 3) menunjukkan hasil yang tidak berbeda nyata (P>0,05) terhadap semua perlakuan. Kualitas flok pada semua perlakuan adalah sama. Hal tersebut dikarenakan pemberian sumber karbon organik berupa molase memiliki perbadingan yang sama yaitu 15:1. Terbentuknya agregat flok menjadi kunci sukses keberhasilan sistem budidaya bioflok (Ekasari 2009).
Salah satu indikator flokulasi pada media pemeliharaan bioflok dapat dilihat dari volume flok. Hasil penelitian menunjukkan bahwa volume flok mengalami peningkatan setiap minggu. Pemberian kadar protein pakan yang berbeda memberikan hasil volume flok yang berbeda pula. Volume flok pada akhir penelitian pada semua perlakuan berkisar antara 83,33 - 95,33 mL/L. Volume flok tertinggi ditunjukkan oleh perlakuan B yang selaras dengan hasil proksimat nutrient flok dalam berat kering hasil tertinggi juga ditunjukkan oleh perlakuan B (Tabel 5) sehingga dapat dinyatakan bahwa tingginya kandungan flok berhubungan dengan nilai kinerja pertumbuhan, dimana nilai terbaik ditunjukkan oleh perlakuan B (Tabel 3). Hal tersebut sesuai dengan pendapat Bakar et al. (2015) bahwa pemberian sumber karbon dengan kandungan C/N rasio 15 pada budidaya ikan lele dapat membentuk flok sebesar 92,5 mL/L. Kepekatan bioflok pada kolam ikan lele maksimal 150 mL/L atau 15% dari volume air, jika melebihi akan menyebabkan nafsu makan menurun serta tidak lincah dan gesit (Suprapto dan Samtasir 2013). Kepekatan bioflok dapat diatur dengan membuang air media kemudian mengganti dengan air baru, ataupun juga dengan jalan memuasakan ikan dengan tujuan ikan tersebut memakan flok yang ada didalam kolom air pada wadah pemeliharaan.
setiap minggunya. Tingginya nilai PTV dikarenakan peningkatan aktivitas mikroba seperti bakteri heterotrof pada wadah budidaya, dimana bakteri heterotrof memanfaatkan sumber karbon organik berupa molase untuk megasimilasi nitrogen anorganik menjadi nitrogen organik dalam bentuk biomassa bakteri (Apriani 2015). Tingginya PTV berhubungan erat dengan kelimpahan bakteri pada media pemeliharaan, jika bahan organik tinggi maka kelimphan bakteri juga mengalami peningkatan (Ekasari 2009).
Kelimpahan bakteri total didalam media pemeliharaan menunjukkan hasil yang cukup stabil. Hasil tertinggi ditunjukkan oleh perlakuan B(34%). Hal tersebut membuktikan bahwa pemberian sumber karbon berupa molase mampu meningkatkan populasi sel bakteri heterotrof. Sesuai dengan pernyataan Buford et al. (2004) menyatakan bahwa penambahan sumber karbon dapat membantu proses transformasi dari nitrogen anorganik menjadi protein mikroba melalui peningkatan populasi sel mikroba heterotrof. Bakteri heterotrof yang digunakan dalam penelitian ini adalah Staphylococcus lentus L1k yang berasal dari isolasi usus ikan lele (Firdaus 2012).
Selaras dengan kelimpahan bakteri total, kelimpahan bakteri L1k menunjukkan hasil tertinggi pada perlakuan B(34%). Hal tersebut dikarenakan bakteri L1k merupakan bakteri heterotrof non patogenik yang mampu meningkatkan jumlah bakteri pada media pemeliharaan. Staphylococcus lentus L1k atau biasa disebut L1k merupakan bakteri probiotik proteolitik yang berasal dari isoloasi usus ikan lele (Firdaus 2012). Bakteri proteolitik adalah bakteri yang memproduksi enzim protease ekstraseluler, yaitu enzim pemecah protein yang diproduksi didalam sel untuk dilepaskan keluar sel. Tingginya bakteri probiotik tersebut menunjukkan bahwa bakteri probiotik mendominasi pada media pemeliharaan. Hal tersebut sesuai dengan pendapat Vine et al. (2004) yang menyatakan probiotik yang berada didalam tubuh ikan harus mampu bertahan hidup didalam mukosa usus dan berkembangbiak dengan pesat supaya tidak terbawa keluar bersama sisa-sisa metabolisme dalam tubuh ikan.
Kelimpahan bakteri usus total pada Tabel 4 diakhir penelitian menunjukkan peningkatan diseluruh perlakuan. Selaras dengan peningkatan total kepadatan bakteri dan total kepadatan bakteri L1k juga mengalami peningkatan. Perlakuan B(34%) menunjukkan hasil yang paling baik hal tersebut juga didukung oleh laju pertumbuhan hariannya dimana perlakuan B(34%) juga menunjukkan hasil terbaik (Tabel 3). Sesuai dengan pernyataan Hasibuan (2013) bahwa penambahan bakteri L1k pada pakan mampu memberikan performa pertumbuhan terbaik. Adanya bakteri probiotik didalam kumpulan flok mampu meningkatkan panjang dan densitas mikrovili usus sehingga luas permukaan penyerapan usus tersebut lebih baik dalam menyerap nutrien mikroba usus (Dimitroglou 2009).Selain itu L1k memiliki fungsi memperbaiki kualitas air terutama dalam upaya penurunan kadar amonia di dalam media air pemeliharaan.
flokulan bakteri heterotrof mampu mereduksi konsentrasi amonia (Avnimelech 2007). Adanya penambahan bakteri heterotrof berupa Staphylococcus lentus L1k memiliki peran sebagai agen bioremediasi yaitu, berperan dalam menurunkan kadar amonia didalam media pemeliharaan (Salamah 2014 dan Septi 2014). Hal tersebut juga didukung oleh pernyataan Bakar et al. (2015) bahwa penambahan sumber karbon berupa molase pada media pemeliharaan budidaya ikan lele yang menggunakan sistem bioflok mampu menurunkan kadar amonia sebesar 98,7%. Boyd dan Fast (1992) menyatakan bahwa, pH air pada media pemeliharaan kurang dari 4 atau diatas 10 dapat menyebabkan kematian ikan Nilai pH selama penelitian masih dalam kisaran normal yaitu berkisar antara 5,84 - 8,37 pada seluruh perlakuan. Suhu media pemeliharaan selama penelitian cenderung stabil yaitu berkisar antara 27,9 – 28 0C pada seluruh perlakuan. Kisaran suhu optimal pada budidaya ikan lele berkisar antara 25 – 30 0C. Kisaran oksigen terlarut selama penelitian berkisar antara 4,4 - 8,4 mg/L, kisaran tersebut masih dalam batas normal dikarenakan menurut Effendie (2003) bahwa, oksigen terlarut yang disarankan untuk budidaya ikan lele lebih dari 4 mg/L. Kualitas air yang masih dalam kisaran normal dalam media pemeliharaan dapat menunjang kinerja pertumbuhan yang optimal.
Penurunan kadar protein pakan sebesar 8% (dari 38% sampai 30%) (Tabel 6) tidak menganggu kinerja pertumbuhan. Hal tersebut sesuai dengan penelitian Ballester et al. (2010) menyatakan pengurangan kadar protein pakan sebesar 10% pada Farfantepenaeus paulensis yang dipelihara di lingkungan bioflok tidak mengganggu kinerja pertumbuhan. Hal tersebut dikarenakan penggunaan sistem bioflok pada media pemeliharaan memberikan tambahan nutrisi selain dari pakan (Crab 2010). Hal ini juga dibuktikan dengan adanya kandungan protein flok yang cukup tinggi pada analisis proksimat nutrien flok dalam berat kering yaitu berkisar antara 30,84 - 35,31 (Tabel 3). Panjang total benih lele selama penelitian cenderung sama pada semua perlakuan hal ini menunjukkan keseragaman ukuran.
Nilai koefisien keragaman panjang semakin kecil menunjukkan bahwa semakin baik pula keseragamannya. Secara statistik pada semua perlakuan menunjukkan hasil yang tidak berbeda nyata (p>0,05). Hal tersebut diduga bahwa keberadaan bioflok sebagai penyedia pakan secara in situ terbukti membantu benih lele menghindari persaingan dalam mendapatkan makanan. Menurut Lovell (1989), jika ukuran tidak seragam akan menyebabkan kesempatan untuk mendapatkan makanan yang berbeda, dimana benih yang berukuran lebih besar mendapatkan kesempatan makanan lebih banyak dibandingkan benih yang berukuran lebih kecil. Teknologi bioflok juga mampu meningkatkan efisiensi pemanfaatan oleh pakan (De Schryver et al. 2008; Ballester et al. 2010; Xu dan Pan 2014).
oleh pernyataan (Ekasari et al. 2010) bahwa bioflok dapat dijadikan tambahan nutrisi pada pakan budidaya dan dapat dibuktikan pada hasil protein analisis nutrient flok (Tabel 3) dan volume flok (Gambar 1) antar perlakuan tidak berbeda nyata (p>0,05). Seiring dengan hasil analisis statistik nutrien flok, retensi protein pada perlakuan kadar protein pakan yang berbeda menunjukkan hasil yang tidak berbeda nyata (p>0,05) antar perlakuan.
Nilai retensi protein menunjukkan hasil yang sama secara statistik atau tidak berbeda nyata antar perlakuan lainnya (P>0,05) sehingga, dapat diartikan bahwa kemampuan ikan dalam merentensi protein sama pada semua perlakuan. Hal tersebut terbukti dengan jumlah konsumsi pakan pada semua perlakuan secara statistik tidak berbeda nyata (P>0,05) (Tabel 6). Hal tersebut sesuai dengan pernyataan Xu et al. (2012) bahwa, adanya bioflok pada media pemeliharaan mampu meningkatkan retensi protein, kinerja pertumbuhan dan efisiensi pakan pada udang. Retensi lemak tertinggi terlihat pada perlakuan protein 26%, hal tersebut dikarenakan pakan perlakuan protein 26% mengandung kadar karbohidrat paling tinggi dan kadar protein paling rendah (Tabel 2). Hal tersebut sesuai dengan pendapat Ali dan Jauncey (2005) yang menyatakan bahwa yang menyebabkan lemak dalam tubuh meningkat adalah adanya penumpukan lemak didalam hati yang dikarenakan oleh pakan dengan protein yang rendah dan kelebihan energi dari karbohidrat pakan. Selain meningkatkan pertumbuhan penggunaan bioflok mampu meningkatkan tingkat kelangsungan hidup.
Tingkat kelangsungan hidup pada semua perlakuan menunjukkan hasil yang tidak berbeda nyata (p>0,05). Hal tersebut selaras dengan penelitian Xu dan Pan (2014) bahwa pemberian kadar protein pakan yang berbeda pada juvenil udang menggunakan teknologi bioflok menunjukkan hasil yang sama baiknya antar perlakuan. Hal yang sama juga disampaikan oleh Ballester et al. (2010) bahwa pemberian pakan dengan kadar protein pakan yang berbeda tidak menunjukkan perbedaan yang nyata antar perlakuan terhadap tingkat kelangsungan hidup pada Farfantepenaeus paulensis. Salamah (2014) menyatakan bahwa pemberian bakteri heterotropik L1k melalui pakan yang berbeda dalam lingkungan bioflok menghasilkan tingkat kelangsungan hidup sampai 92,67% pada benih ikan lele. Tingginya kelangsungan hidup dikarenakan adanya agregat flok yang terbentuk dalam wadah media sehingga meminimalisir kanibalisme (Tabel 6). Agregat flok tersebut mengandung poly-β-hydroxybutirate (PHB) berkisar antara 0,9 sampai 1,6% sangat cukup untuk memenuhi kebutuhan PHB pada ikan sebesar 1% (De Schryver et al. 2009). PHB merupakan produk yang dihasilkan dari berbagai jenis mikroorganisme sebagai bentuk simpanan energi (Defroirdet al. 2007). Adanya PHB mampu meningkatkan sistem imun ikan sehingga dapat mencegah masuknya patogen dalam tubuh. Hal tersebut dapat dibuktikan oleh hasil analisis hematologi (Tabel 8) menunjukkan bahwa benih yang dipelihara dalam lingkungan bioflok menunjukkan status kesehatan yang baik selama pemeliharaan.
mengemukakan bahwa nilai kadar hematokrit untuk ikan lele dengan berat lebih kurang 2,29 gram atau berukuran 5 - 8 cm berkisar lebih kurang 10,79% dan setelah dipelihara pada aplikasi bioflok kadar nilai hematokrit tertinggi meningkat menjadi 23,97%. Sejalan dengan pernyataan Hastuti dan Subandiyono (2011) bahwa penerapan sistem kolam biofiltrasi menunjukkan keadaan hematologi yang baik dengan nilai kadar hemtokrit 24,33%.
Hasil penelitian menunjukkan bahwa nilai kadar hematokrit sejalan dengan nilai kadar hemoglobin. Kadar hemoglobin paling tinggi yaitu, pada perlakuan A(38%) dapat dilihat pada Tabel 8. Hal tersebut sesuai dengan pernyataan Lagler et al. (1977) bahwa kadar hematokrit dalam darah berkorelasi kuat dengan kadar hemoglobin. Hasil penelitian pemberian pakan protein yang berbeda menunjukkan hasil kadar hemoglobin yang tidak berbeda nyata (P>0,05) antar perlakuan. Hal tersebut menunjukkan bahwa kapasitas pengangkutan oksigen didalam darah untuk mengedarkan nutrien sama baiknya sehingga dihasilkan energi yang sama pula.
Nilai kadar hematokrit dan hemoglobin berkorelasi kuat dengan jumlah eritrosit. Hasil penelitian menunjukkan bahwa nilai total eritrosit perlakuan A(38%) tidak berbeda nyata (P>0,05) dengan perlakuan B(34%). Nilai total eritrosit berkisar antara 1,45 - 2,39 x 106 sel/mm3dan masih dalam kisaran normal dan baik (Tabel 8). Hal tersebut sesuai dengan pernyataan Kumar et al. (2013) yang menyatakan bahwa kisaran jumlah eritrosit yang normal untuk ikan tawar yaitu 1,05 - 3,0 x 106 sel/mm3. Jumlah eritrosit dalam kisaran normal tersebut menunjukkan bahwa penurunan kadar protein dalam pakan tidak menyebabkan defisiensi nutrisi (Hasibuan 2013).
4
SIMPULAN DAN SARAN
Simpulan
Penggunaan pakan kadar protein 34% dapat digunakan sebagai pengganti pakan dengan kadar protein 38% pada pendederan benih lele berukuran 4 - 5 cm melalui sistem budidaya bioflok.
Saran
Perlu dilakukan penelitian lebih lanjut menggunakan benih lele berukuran 2 - 3 cm melalui pemberian kadar protein pakan berbeda yang dipelihara dengan sistem bioflok.
DAFTAR PUSTAKA
Ali MZ, Jauncey K. 2005. Approaches to optimizing dietary protein to energyratio for African catfish Clarias garipenus (Burchell, 1822). Journal of Aquaculture Nutrition.11: 95‒101.
Anderson DP, Siwicki AK. 1993. Basic hematology and serology for fish health progams. Paper presented in second symposium on diseases in asian aquaculture “Aquatic Animal Health and the Environment”. Phucket, Thailand. 25-29th October.
Apriani, I. 2015. Produksi benih ikan Patin (Pangasianodon hypophthalmus) penambahan sumber karbon berbeda pada sistem budidaya berbasis bioflok [Tesis]. Bogor (ID): Institut Pertanian Bogor.
Avnimelech Y. 2007. Feeding with microbial flocs by tilapia in minimal discharge bio-flocs technology ponds. Aquaculture.(264):140-147.
Avnimelech Y. 2012. Biofloc Technology - a practical guide book, 2nd ed. The World Aquaculture Society. Baton Rouge. Louisiana. USA.
Bakar NSA, Nasir NM, Lananan F, Hamid SHA, Lam SS, Jusoh A. 2015. Optimation of c/n ratios for nutrient removal in aquaculture system culturing African catfish, (Clarias gariepineus) utilizing bioflocs technology. International Biodeteration dan Biodegradation. (30):1-7. Ballester ELC, Abreu PC, Cavalli RO, Emerenciano M, Abreu L, Wasielesky, W.
2010. Effect of practical diet with different protein levels on the performance of Farfantepenaeus paulensis juvenils nursed in a zero exchange suspended microbial floc intensive system. Journal ofAquaculture nutrition. 16:163-172.
Blaxhall PD, Daisley KW. 1973. Routine haemotological methods for use with blood fish. Journal Fish Biology. 5: 771-781.
Boyd, C.E. and A.W. Fast. 1992. Pond Monitoring and Management. In. A.W. Fast and L.J. Lester (eds). Marine Shrimp Culture Principles and Practices. Elvesier Science Publishing Comp. Inc., New York, p 497
Crab R. 2010. Biofloc technology: sn integrate system for the removel of nutrients and simultaneous production of feed in aquaculture. [Thesis]. Ghent (BE): Gent University. 178.
Defoirdt T, Halet D, Vervaeren H, Boon N, Van de Wiele T, Sorgeloos P, Bossier P, Verstraete W. 2007. The bacterial storage compound of poly-b-hydrobutyrate protects Artemia fransiseana from pathogenic Vibrio campbellii. Environ.
Microbiol. 9(2):445-452.
De Schryver P, Crab R, Defroit T, Boon N, Verstraete W. 2008. The basic of bio-flocs technology: the added value for aquaculture. Journal of Aquaculture. 277:125-137.
De Schryver P, Verstraete W. 2009. Nitrogen removal from aquaculture pond water by heterotrophic nitrogen assimilation in lab-scale sequencing batch reactors. Bioresource Technology. 100:1162-1167.
Dimitroglou A, Merrifield DL, Moate R, Davies SJ, Spring P, Sweetman J, Bradley G. 2009. Dietary manan oligosaccharide supplementation modulates intestinalmicrobial ecology and improves gust morphology of rainbow trout, Onchorhynchus mykiss (Wallbaum). Journal of Animal Science. 87:3226-3234.
Effendie, M.I. 1979. Metode Biologi Perikanan. Yayasan Dewi Sri. Bogor.112 hal Effendie, H. 2003. Telaah Kualitas Air, Bagi Pengelolaan Sumber Daya dan
Lingkungan Perairan. Kanisius: Yogyakarta.
Ekasari J. 2009. Teknologi bioflok: teori dan aplikasi dalam perikanan budidaya sistem intensif. Jurnal Akuakultur Indonesia. 8(2):117-126.
Ekasari J, Crab R, Vertrace W. 2010. Primary nutritional content of bio-flocs cultured with different organic carbon sources and salinity. Journal HayatiBiosci. 17:125-130.
Firdaus R. 2012. Seleksi bakteri kandidat probiotik untuk penghambatan patogen Streptococcus agalactiae tipe non-hemolitik pada ikan nila Oreochromis niloticus secara in vitro dan in vivo. [Skripsi]. Bogor (ID): Institut Pertanian Bogor.
Gunadi B. 2012. Minimalisasi limbah nitrogen dalam budidaya ikan lele (Clarias gariepinus) dengan sistem akuakultur berbasis jenjang rantai makanan. [Desertasi]. Bogor (ID): Institut Pertanian Bogor.
Hasibuan UR. 2013. Aplikasi probiotik amilolitik NB21b dan proteolitik L1k melalui pakan untuk pengendalian Streptococcosis pada ikan nila Oreochromis niloticus. [Skripsi]. Bogor (ID): Institut Pertanian Bogor. Hastuti S dan Subandiyono. 2011. Performa hematologis ikan lele dumbo
(Clarias gariepineus) dan kualitas air media pada sistim budidaya dengan penerapan kolam biofiltrasi. Jurnal saintek perikanan. 6(2):1-5.
Heath. 1987. Water Pollution and Fish Physiology. Boston USA : CRC pres inc. Huissman EA. 1987. Principle of fish production. Departement of Fish Culture
and Fisheries, Wageningen Agricultural University, Netherlands.
Kumar S, Raman RP, Pandey PK, Mohanty S, Kumar A, Kumar K. 2013. Effect of orally administered azadirachtin on non-spesific immune parameters of goldfish Carasius auratus (Linn. 1758) and resistance against Aeromonas hydrophyla. Journal Fish and shellfish immunology. 34:564-574.
Lovell, T. 1989. Nutrition and feeding of fish. Auburn University. Published by Van Nostrand Reinhold. New York. USA. 260p. Nayak SK. 2011. Biology of eukaryotic probiotics. In Liong, M.T(Ed). Textbook of biology, genetics and health aspects, probiotics. London: Springer. 29-55.
Moyle PB, Cech Jr JJ. 1988. Fishes An Introduction to Icthyology. Prentice Hall, Inc. USA. 559.
Nayak SK. 2011. Biologi of eukaryotic probiotics. In Liong, M.T(Ed). Textbook of biology, genetics and health aspects, probiotics. London: Springer. 29-55. Rangka NA, Gunarto. 2012. Pengaruh penumbuhan bioflok pada budidaya udang vaname pola intensif di tambak. Jurnal Ilmiah Perikanan dan Kelautan.4(2):141-149.
Salamah. 2014. Kinerja Pertumbuhan Ikan Lele (Clarias sp.) Pada Sistem Budidaya Bioflok dengan Penambahan Isolat Bakteri Heterotropik L1k. [Tesis]. Bogor (ID): Institut Pertanian Bogor.
Steel GD, Torrie JH. 1993. Prinsip-prinsip dan prosedur statistika. Terjemahan PT. Gramedia Pustaka Utama, Jakarta
Septiani N, Maharani HW, Supono. 2014. Pemanfaatan Bioflok dari Limbah Budidaya Lele Dumbo (Clarias gariepineus) sebagai Pakan Nila (Oreochromis niloticus). Jurnal Rekayasa dan Teknologi Budidaya Perairan. 2(2):267-272.
Septi NA. 2014. Respons imun dan dinamika mikroba dalam budidaya ikan lele Clarias sp. Super intensif berbasis bioflok dengan penambahan bakteri L1k. [Skripsi]. Bogor (ID): Institut Pertanian Bogor.
Suprapto NS dan Samtasir LS. 2013. Biofloc-165 Rahasia Sukses Teknologi Bioflok. Depok (ID): Agro 165.
Vine NG, Leukes WD, Kaier H, Daya S, Baxter J, Hech T. 2004. Competition for attachmentic of aquaculture candidate probiotic and pathogen bacteria on fish intestinal mucus. Journal of Fish Diseases. 27:319-326.
Wedemeyer GA, Yasutake WT. 1977. Clinical methods for the assessment of the effects of environmental stress on fish health. Technical Paper of the U.S. Fish and Wildfield Service. 89:1-7.
Watanabe T. 1988. Fish nutrition and mariculture. JICA Text Book The General Aquaculture Course. Department of Aquatic Bioscience. Tokyo University Xu WJ, Qing PanI, Zhao HD, Huang J. 2012. Preliminary investigation into the
contribution of bioflocs on protein nutrion of Litopenous vannamei fed with different dietary protein levels in zero-water exchange culture tanks. Journal of Aquaculture. 350-353:147-153.
Lampiran 1. Prosedur perhitungan jumlah karbon yang ditambahkan
Asumsi yang dipergunakan untuk perlakuan A adalah Protein pakan 34,08%
Karbohidrat dalam pakan 27,49% Kadar nitrogen protein 16%
Kadar nitrogen (N) yang terbuang ke media budidaya 75% C/N rasio 15:1
Kadar karbon (C) dalam molase 80% Pemberian pakan 5% dari biomasa PA = Jumlah pakan yang diberikan
Misal jumlah pakan /hari PA
Jumlah C PA x 27,49% 0,2749 PA
Jumlah protein pakan 34,08% x PA 0,3408 PA
Jumlah N 0,3408 PB x 16% 0,05452 PA
Jumlah N yang dibuang 0,05452 PA x 75% 0,0408 PA Jumlah C yang ditambahkan 0,0408 PA x 15 0,6134 PA C dari molase 0,6134 PA - 0,2749 PA 0,3385 PA Jumlah molase 0,3385 PA x (100/80) 0,2708 PA
Asumsi yang dipergunakan untuk perlakuan B adalah Protein pakan 30,15%
Karbohidrat dalam pakan 33,48% Kadar nitrogen protein 16%
Kadar nitrogen (N) yang terbuang ke media budidaya 75% C/N rasio 15:1
Kadar karbon (C) dalam molase 80% Pemberian pakan 5% dari biomasa PB = Jumlah pakan yang diberikan
Jumlah pakan per hari dengan biomassa 5% Persamaan 1
Persamaan 2
Persamaan 3
Persamaan 4
Persamaan 5 Persamaan 1. x persentase kandungan protein pakan
Persamaan 2. x 16% presentase kandungan protein
Persamaan 3. x 75% nitrogen dalam pakan yang terbuang
Persamaan 4. x 16% ratio C/N yang ditentukan
Jumlah pakan PB
Jumlah C PB x 33,48% 0,3348PB
Jumlah protein pakan 30,15% x PB 0,3015PB
Jumlah N 0,3015 PB x 16% 0,0482PB
Jumlah N yang dibuang 0,0482PB x 75% 0,03618 PB Jumlah C yang ditambahkan 0,03618 PB x 15 0,5427 PB C dari molase 0,5427 PB - 0,3348 PB 0,2079 PB
Jumlah molase 0,2079 PB x (100/80) 0,2598 PB
Asumsi yang dipergunakan untuk perlakuan C adalah Protein pakan 26,60%
Karbohidrat dalam pakan 38,78% Kadar nitrogen protein 16%
Kadar nitrogen (N) yang terbuang ke media budidaya 75% C/N rasio 15:1
Kadar karbon (C) dalam molase 80% Pemberian pakan 5% dari biomasa PC = Jumlah pakan yang diberikan
Misal jumlah pakan PC
Jumlah C PC x 38,78% 0,3878 PC
Jumlah protein pakan 26,60% x PC 0,2660 PC
Jumlah N 0,2660 PC x 16% 0,0425 PC
Jumlah N yang dibuang 0,0425 PC x 75% 0,0318 PC Jumlah C yang ditambahkan 0,0318 PC x 15 0,477 PC
C dari molase 0,477 PC – 0,3878 PC 0,0892 PC
Jumlah molase 0,0892 PC X (100/80) 0,1115 PC
Asumsi yang dipergunakan untuk perlakuan D adalah Protein pakan 22,30%
Karbohidrat dalam pakan 41,46% Kadar nitrogen protein 16%
Kadar nitrogen (N) yang terbuang ke media budidaya 75% C/N rasio 15:1
Kadar karbon (C) dalam molase 80% Pemberian pakan 8% dan 5% dari biomasa PD = 8% dari biomassa
Misal jumlah pakan PD
Jumlah C PD x 43,46% 0,4146 PD
Jumlah protein pakan 22,3% x PD 0,2230 PD
Jumlah N 0,2230 PD x 16% 0,0373 PD
Jumlah N yang dibuang 0,0373 PD x 75% 0,0280 PD Jumlah C yang ditambahkan 0,0280 PD x 15 0,42 PD
C dari molase 0,42 PD – 0,4146 PD 0,0074 PD
Lampiran 2. Profil bioflok selama 35 hari pemeliharaan
Keterangan: a. perlakuan A (protein 38%), b. perlakuan B (protein 34%), c. perlakuan C (protein 30%), d. perlakuan D (protein 26%)
Lampiran 3. Prosedur analisis proksimat pakan dan tubuh ikan Kadar Air
Cara menghitung kadar air dalam sampel (pakan ikan) dimulai dengan dimasukannya cawan ke dalam oven bersuhu 110 oC selama 1 jam. Kemudian didinginkan mengunakan desikator selama ±30 menit. Kemudian cawan (bobot cawan dicatat untuk dimasukan perhitungan) dan 2g sampel ditimbang. Setelah itu sampel dimasukkan ke dalam cawan dan diletakkan ke dalam oven bersuhu 110
o
C selama 4 sampai 6 jam. Lalu cawan didinginkan mengunakan desikator dan ditimbang lagi. Rumus perhitungan kadar air ialah sebagai berikut:
Kadar air = + − �
Keterangan A = Bobot cawan (gram)
B= Bobot sampel per bahan (gram)
C= Bobot cawan dan sampel/bahan setelah di oven (gram) Kadar Abu
Cara perhitungan dan Analisa kadar abu diawali dengan memanaskan cawan didalam oven bersuhu 110 oC selama 1 jam. Lalu cawan didinginkan dalam deksikator selama 30 menit ±. Kemudian cawan dan 2 g sampel ditimbang (bobot cawan dicatat untuk dimasukan perhitungan). Cawan yang berisi sampel tersebut lalu dipanaskan dalam tanur bersuhu 600oC selama 4 Jam. Setelah itu cawan
b
d a
didinginkan pada desikator selama 30 menit. Rumus perhitungan kadar air ialah sebagai berikut:
Kadar air = − �
Keterangan A = Bobot awal cawan (gram) B= Bobot Sampel (gram)
C= Bobot akhir cawan dan sampel (gram) Kadar Protein
Perhitungan dan analisa kadar protein terbagi dalam tiga tahap, yaitu tahap oksidasi, titrasi, dan destilasi. Dalam tahap oksidasi, sampel uji dilumat hingga halus menggunakan mortar. Kemudian hasilnya ditimbang. Kemudian sample tersebut dimasukan kedalam labu kjehdal, yang didalamnya ditambahkan katalis sebanyak 3 gram dan batu didih sebanyak 2 butir. Setelah itu ditambahkan 10 ml H2SO4 pekat. Kemudia sampel tersebut dipanaskan di dalam tanur bersuhu 4000C
selama 3 hingga 4 jam hingga cairan berwarna hijau bening. Kemudian sampel didinginkan menggunakan diskator dan ditambakan aquades sebanyak 25 ml dan terbentuk larutan A. kemudian pada tahap destilasi, larutan A tadi ditambahkan dengan larutan H2SO4 0,05N sebanyak 10 ml dan 2 tetes MB. Setelah itu, diambil
5 ml sampel dan dimasukan ke dalam labu Kjehdal dan didesitruksi selama 10 menit. Larutan hasil yang dihasilakan dari proses tersebut kemudian dititrasi dengan larutan NaOH 0,05 hingga ada perubahan warna. Baru kemudian dicatat volume titrannya. Rumus perhitungan kadar protein ialah sebagai berikut:
Kadar Protein = . ∗ � � − � � � � . ∗ � �
Keterangan Vb = Volume titrasi blanko (ml) Vs = Volume titrasi sampel (ml) A = Bobot sampel (gram)
*1 = Setiap ml 0.05 N NaOH ekuivalen dengan0.0007 gram N *2 = Faktor nitrogen
F = Faktor Koreksi dari larutan NaOH (1) Kadar lemak
angka yang dihasilkan sebagai data untuk perhitungan kada lemak. Rumus perhitungan kadar lemak ialah sebagai berikut:
Kadar Lemak = X − X �
Keterangan X1 = Bobot awal labu (gram)
X2= Bobot akhir labu dan bahan (gram)
A= Bobot Sampel (gram) Kadar Serat Kasar
Perhitungan dan analisa kadar serat kasar diawali dengan memasukan kertas filter ke dalam oven selama 30 menit. Kemudian didinginkan dengan desikator lalu ditimbang. Setelah itu sebanyak 0,4 gram dan 50 ml H2SO4 0.3 N
dimasukan kedalam Erlenmeyer. Lalu erlenmayer dipanaskan selama 30 menit lalu ditambahkan lagi NaOH 1.5 N sebanyak 25 ml. setelah itu dipanaskan lagi selama 30 menit. Setelah itu sampel didalam Erlenmeyer disaring didalam corong Buchner. Lalu tambahkan secara berurutan ditambahkan 50 ml air panas, 50 ml H2SO4 0.3 N, 50 ml air panas dan 25 ml aseton. Setelah itu kertas saring dan
cawan porselen dimasukan kedalam oven selama 1 jam dan didinginkan di eksikator dan ditimbang. Kemudian di oven lagi baru setelah itu dimasukan ke dalam tanur bersuhu 6000C selama 2 hingga 3 jam. Dan setelahnya dimasukan kedalam esikator. Cawan dan kertas saring ditimbang lagi. Rumus perhitungan kadar serat kasar ialah sebagai berikut:
Kadar Lemak =X − X − X �
Keterangan X1 = Bobot kertas saring (gram)
X2= Bobot kertas saring,cawan, dan residu (gram)
X3= Bobot cawan dan abu (gram)
A= Bobot Sampel (gram)
Lampiran 4. Prosedur pengamatan gambaran darah Prosedur pengamatan kadar Hemoglobin (Hb)
(kuning). Hal ini menandakan banyaknya kadar hemoglobin dalam gram per 100 ml darah.
Prosedur pengamatankadar hematokrit (He)
Kadar hematokrit adalah banyaknaya sel adarh dalam cairan darah yang digambarkan dengan padatan atau endapan. Pengukuran Kadar hematokrit merujuk kepada Anderson dan Swicki (1993). Langkah pertama, ujung tabung mikrohematokrit dicelupkan ke dalam tabung yang berisis darah. Darah diambil sebanyak / bagian tabung. Kemudian Tabung yang telah berisi darah ujungnya ditutup menggunakan crytoceal (ujung tabung di tancapkan ke dalam crytoceal sedalam 1 mm hingga menyumbat tabung). Kemudian tabung mikrohematokrit di sentrifuge selama 5 menit pada kecepatan 5.000 rpm. Panjang bagian darah yang mengendap (a) dan panjang total volume darah yang ada di dalam tabung (b) kemudian diukur menggunakan penggaris.
Perhitungan total eritrosit
Cara menghitung Jumlah eritrosit merujuk kepada Blaxhall dan Daisley (1973). Langkah pertama, darah sampel dihisap menggunakan pipet yang berisi bulir pengaduk warna merah hingga skala 0,5 (pipet untuk mengukur sel darah merah). Kemudian ditambahkan larutan hayem hingga skala 101. Darah yang berada di dalam pipet diaduk (pipet digoyang oleh tangan dengan gerakan seperti angka 8) selama 3-5 menit hingga menjadi homogen. Dua tetes pertama larutan darah tersebut dibuang. Darah yang tersisa diteteskan pada haemocytometer yang diatasnya telah diletakan gelas penutup. Jumlah sela darah putih dihitung menggunakan bantuan microscop perbesaran 400x. perhitungan dilakukan pada 5 kotak besar haemocytometer.
Prosedur pengamatantotal leukosit
Lampiran 5. Analisis statistik kinerja pertumbuhan meliputi laju pertumbuhan harian, panjang total, koefisien keragaman, efisiensi pakan, jumlah konsumsi pakan, retensi protein, retensi lemak, tingkat kelangsungan hidup
Tingkat kelangsungan hidup
Lampiran 6. Analisis statistik protein, lemak, abu, serat kasar, BETN dan gross energi pada proksimat tubuh benih lele.
Within Groups 20.219 8 2.527 Within Groups 102519.877 8 12814.985
N 1 2
Lampiran 7. Analisis statistik protein, lemak, abu, serat kasar, BETN dan gross energi nutrien flok pada wadah pemeliharaan.
C 3 3162.286 Within Groups 766854.790 8 95856.849