EKSTRAKSI KOMPONEN BIOKATIF DAN AKTIVITAS
ANTIOKSIDAN DAUN LINDUR (Bruguiera gymnorrhiza)
SITI HAZAR
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Ekstraksi Komponen Bioaktif dan Aktivitas Antioksidan Daun Lindur (Bruguiera gymnorrhiza) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2014
Siti Hazar
ABSTRAK
SITI HAZAR. Ekstraksi Komponen Bioaktif dan Aktivitas Antioksidan Daun Lindur (Bruguiera gymnorrhiza). Dibimbing oleh NURJANAH dan AGOES MARDIONO JACOEB.
Lindur merupakan tanaman mangrove yang telah banyak dimanfaatkan sebagai obat, namun informasi mengenai senyawa obat dan potensi antioksidan yang terkandung didalamnya masih sangat terbatas. Penelitian ini bertujuan untuk menentukan komponen bioaktif dan aktivitas antioksidan daun lindur. Daun lindur segar memiliki kadar air sebesar 54,91%, abu 4,49%, lemak 1,87%, protein 4,45%, dan serat kasar 8,67% sedangkan daun lindur kering memiliki kadar air sebesar 9,78%, abu 8,19%, lemak 3,90%, protein 9,78%, dan serat kasar 18,05%. Rendemen tertinggi yaitu pada ekstrak metanol (15,79%), diikuti ekstrak etil asetat (2,85%), dan n-heksana (1,53%). Komponen bioaktif pada ekstrak daun lindur yaitu flavonoid, fenol hidrokuinon, tanin, saponin, dan streoid. Aktivitas antioksidan tertinggi yaitu pada ekstrak metanol dengan nilai IC50 sebesar
81,11 ppm, sedangkan aktivitas terendah pada ekstrak n-heksana dengan nilai IC50
815,67 ppm. Kadar total fenolik ekstrak n-heksana sebesar 12,41 mg GAE/g ekstrak; ekstrak etil asetat 97,57 mg GAE/g ekstrak; dan ekstrak metanol sebesar 30,07 mg GAE/g ekstrak.
Kata kunci : antioksidan, bioaktif, Bruguierra gymnorrhiza, daun.
ABSTRACT
SITI HAZAR. Extraction Bioactive Compound and Antioxidant Activity of Lindur Leave (Bruguiera gymnorrhiza). Supervised by NURJANAH and AGOES MOERDIONO JACOEB.
Lindur are mangrove plants that has been widely used as drug, yet informations on potential drug compounds and antioxidants contained in lindur were still limited. This study aimed to determine of bioactive compound and antioxidant activity of lindur leave. The result showed that lindur fresh leaves had a moisture content 54.91%, ash 4.49%, fat 1.87%, protein 4.45%, and crude fiber 8.67%. Lindur dried leaves had moisture content 9.78%, ash 8.19%, fat 3.90%, protein 9.78%, and crude fiber content 18.05%. The methanol extract had the highest yield (15.79%) compared to the ethyl acetate extract (2.85%), and n-hexane (1.53%). Bioactive compound found in lindur lindur leave extract was flavonoid, phenol hidroquinon, tannin, saponin, dan streoid. Methanol extract showed the highest antioxidant activity with IC50 values of 81.11 ppm, while the
n-hexane extract showed the lowest activity with IC50 values of 815.67 ppm. Total
phenolic extracts of n-hexane 12.41 mg GAE/g extract, ethyl acetate 97.57 mg GAE/g extract, and methanol 30.07 mg GAE/g extract.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
EKSTRAKSI KOMPONEN BIOKATIF DAN AKTIVITAS
ANTIOKSIDAN DAUN LINDUR (Bruguiera gymnorrhiza)
SITI HAZAR
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Ekstraksi Komponen Bioaktif dan Aktivitas Antioksidan Daun Lindur (Bruguiera gymnorrhiza)
Nama : Siti Hazar NIM : C34100051
Program Studi : Teknologi Hasil Perairan
Disetujui oleh
Prof Dr Ir Nurjanah, MS Dr Ir Agoes Mardiono Jacoeb, Dipl.-Biol. Pembimbing I Pembimbing II
Diketahui oleh
Dr Ir Joko Santoso, M.Si Ketua Departemen
x
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Allah SWT, atas berkat rahmat dan anugerah-Nya penulis dapat menyelesaikan karya ilmiah ini. Penelitian ini dilaksanakan pada bulan September 2013 hingga Januari 2014 dengan judul Ekstraksi Komponen Bioaktif dan Aktivitas Antioksidan Daun Lindur (Bruguiera gymnorrhiza). Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam penulisan skripsi, terutama kepada :
1. Prof Dr Ir Nurjanah, MS dan Dr Ir Agoes Mardiono Jacoeb, Dipl.-Biol. selaku dosen pembimbing yang telah memberikan bimbingan dan arahannya. 2. Dra. Ela Salamah, M.Si selaku dosen penguji atas arahannya.
3. Dr Ir Iriani Setyaningsih, M.Si selaku Ketua Program Studi Teknologi Hasil Perairan.
4. Dr Ir Joko Santoso M.Si selaku Ketua Departemen Teknologi Hasil Perairan. 5. Ayah Sutrisno dan Ibu Lie Kui Lian serta kakak dan adik Maria Ulfa, Arief
Rahman dan Annisa Rahman atas segala doa, dukungan, dan kasih sayangnya kepada penulis.
6. Staf dosen dan administrasi Departemen Teknologi Hasil Perairan. 7. Staf Laboratorium Departemen Teknologi Hasil Perairan
8. Staf Laboratorium Pusat Studi LPPM Biofarmaka IPB 9. Staf Laboratorium Kimia Analitik, FMIPA, IPB
10. Staf Laboratorium Pusat Antar Universitas (PAU) IPB.
11. Keluarga besar THP 47, terima kasih atas hari-hari menyenangkannya.
12. Semua pihak yang telah membantu dalam penelitian dan penulisan skripsi ini yang tidak dapat disebutkan satu persatu.
Semoga karya ilmiah ini bermanfaat dan dapat dijadikan acuan para pembaca dalam melakukan penelitian lanjutan mengenai daun lindur dimasa yang akan datang.
Bogor, April 2014
DAFTAR ISI
DAFTAR TABEL ... ii
DAFTAR GAMBAR ... ii
DAFTAR LAMPIRAN ... ii
PENDAHULUAN ... 1
Latar Belakang ... 1
Perumusan Masalah ... 2
Tujuan Penelitian ... 2
Manfaat Penelitian ... 2
Ruang Lingkup Penelitian ... 2
METODE PENELITIAN ... 3
Waktu dan Tempat ... 3
Bahan dan Alat ... 3
Tahapan Penelitian ... 3
HASIL DAN PEMBAHASAN ... 9
Kandungan Gizi Daun Lindur (B. gymnorrhiza) ... 9
Rendemen Ekstrak Kasar Daun Lindur ... 11
Komponen Bioaktif Ekstrak Kasar Daun Lindur ... 12
Aktivitas Antioksidan Ekstrak Kasar Daun Lindur ... 14
Kadar Total Fenol Ekstrak Kasar Daun Lindur ... 17
KESIMPULAN DAN SARAN ... 19
Kesimpulan ... 19
Saran ... 19
DAFTAR PUSTAKA ... 19
ii
DAFTAR TABEL
1 Komposisi kimia daun lindur ... 9
2 Komponen bioaktif ekstrak kasar daun lindur ... 12
3 Kadar total fenol ekstrak daun lindur ... 17
DAFTAR GAMBAR
1 Diagram alir tahapan penelitian ... 42 Rendemen ekstrak kasar daun lindur ... 11
3 Hubungan konsentrasi vitamin C dengan persen inhibisinya ... 14
4 Hubungan konsentrasi ekstrak dengan persen inhibisinya ... 15
5 Nilai IC50 rata-rata ekstrak kasar daun lindur dan vitamin C ... 16
DAFTAR LAMPIRAN
1 Daun lindur (Bruguiera gymnorrhiza) ... 242 Contoh perhitungan analisis proksimat daun lindur ... 24
3 Contoh perhitungan rendemen ekstrak ... 25
4 Hasil uji ANOVA rendemen ekstrak ... 25
5 Hasil uji Duncan rendemen ekstrak ... 26
6 Contoh perhitungan % inhibisi dan IC50 ... 26
7 Hasil uji ANOVA aktivitas antioksidan ekstrak ... 27
8 Hasil uji Duncan aktivitas antioksidan ekstrak ... 27
1
PENDAHULUAN
Latar Belakang
Masyarakat modern cenderung memiliki gaya hidup yang serba cepat dan instan, termasuk dalam hal pola makan. Pola makan yang tidak tepat akan menyebabkan akumulasi radikal bebas jangka panjang di dalam tubuh. Radikal bebas dapat disebabkan oleh hasil metabolisme tubuh dan luar tubuh misalnya asap rokok, polusi lingkungan, obat-obatan, pestisida, serta radiasi sinar ultraviolet.
Metabolisme yang terjadi di dalam tubuh melibatkan proses oksidasi dan reduksi. Proses oksidasi dapat menyebabkan terbentuknya suatu oksidan atau radikal bebas yang berbahaya bagi tubuh (Halliwel dan Gutteridge 2007). Radikal bebas merupakan molekul yang tidak stabil karena memiliki elektron yang tidak berpasangan pada orbital luarnya sehingga molekul ini dapat menyerang makromolekul sel. Makromolekul yang terserang oleh radikal bebas dapat mengalami oksidasi yang menyebabkan terjadinya kerusakan protein, DNA, penuaan dini, kanker, serangan jantung, dan penyakit degeneratif lainnya (Middleton et al. 2000). Radikal bebas dapat dihambat dengan antioksidan.
Antioksidan merupakan senyawa kimia yang dapat menyumbangkan elektron yang dikandungnya kepada radikal bebas untuk menghambat atau mencegah terjadinya oksidasi pada substrat yang mudah teroksidasi (Middleton et al. 2000). Tubuh manusia secara alami memproduksi antioksidan endogen yang mampu mengatasi efek radikal bebas, namun saat jumlah radikal bebas meningkat dibutuhkan pasokan antioksidan dari luar (eksogen) (Halliwel dan Gutteridge 2007). Antioksidan eksogen dapat diperoleh dalam bentuk sintetik (buatan) atau secara alami. Antioksidan buatan misalnya asam benzoat, BHA (Butylated Hydroxy Anisol), dan BHT (Butylated Hydroxy Toluene) dapat menimbulkan efek samping pada kesehatan tubuh. Hasil penelitian Andarwulan et al. (1996) menunjukkan bahwa BHA dan BHT dapat menyebabkan tumor dan kerusakan hati dalam penggunaan jangka panjang. Kekhawatiran terhadap efek samping tersebut yang menyebabkan sumber antioksidan alami sangat potensial untuk dikembangkan.
Antioksidan alami dapat diperoleh dari buah-buahan atau tumbuh-tumbuhan. Tumbuh-tumbuhan mengandung senyawa metabolit sekunder berupa
fenolik yang memiliki kemampuan menghambat kerja radikal bebas (Duenas et al. 2009). Salah satu tumbuhan yang potensial untuk dikembangkan
sebagai sumber antioksidan alami berasal dari ekosistem mangrove yaitu lindur (Bruguiera gymnorrhiza).
2
digunakan untuk mengobati luka bakar (Haq et al. 2011). Daun lindur diduga mengandung komponen bioaktif yang sangat berguna bagi tubuh dan potensial dijadikan sumber antioksidan alami karena telah banyak dimanfaatkan sebagai obat tradisional di kalangan masyarakat, namun masih belum cukup informasi untuk menjelaskan hal-hal tersebut secara ilmiah. Oleh karena itu, diperlukan pengujian mengenai kandungan gizi, senyawa bioaktif, aktivitas antioksidan, dan total fenol dari ekstrak daun lindur (B. gymnorrhiza) sebagai sumber antioksidan alami.
Perumusan Masalah
Akhir-akhir ini penggunaan senyawa antioksidan berkembang dengan pesat baik untuk makanan maupun pengobatan. Antioksidan yang banyak beredar di masyarakat menimbulkan efek samping yang berbahaya bagi kesehatan dalam penggunaan jangka waktu yang lama. Hal tersebut yang mendorong pencarian sumber antioksidan alami guna menggantikan peran antioksidan sintetik. Salah satu bahan alami hasil perairan yang diduga memiliki kandungan antioksidan adalah daun lindur (B. gymnorrhiza).
Hasil penelitian Khrueayu dan Pilantanapak (2012) menunjukkan adanya aktivitas anti jamur pada ekstrak daun B. gymnorrhiza. Namun, pemanfaatan daun lindur hingga saat ini belum optimal karena riset dan informasi ilmiah mengenai daun lindur masih terbatas. Penelitian ini perlu dilakukan untuk mengkaji lebih banyak mengenai komponen bioaktif dan aktivitas antioksidan ekstrak daun lindur berdasarkan pelarut yang digunakan pada ekstraksi bertingkat untuk dikembangkan sebagai bahan baku pangan, nutraceutical, dan pharmaceutical.
Tujuan Penelitian
Tujuan penelitian adalah untuk menentukan komponen bioaktif dan aktivitas antioksidan daun lindur (B. gymnorrhiza).
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai potensi daun lindur sebagai komoditi hasil perairan yang memiliki aktivitas antioksidan. Penelitian ini juga diharapkan mampu memperkaya nilai tambah terhadap potensi lain dari tanaman mangrove.
Ruang Lingkup Penelitian
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan September 2013 hingga Januari 2014. Proses preparasi dan ekstraksi sampel dilakukan di Laboratorium Karakteristik Bahan Baku Hasil Perairan. Analisis proksimat (kadar air, abu, protein, dan lemak) dilakukan di Biokimia Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan. Analisis serat kasar dilakukan di Laboratorium Pusat Antar Universitas (PAU) IPB. Proses evaporasi ekstrak dan analisis total fenol dilakukan di Laboratorium Kimia Analitik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam. Analisis fitokimia dan aktivitas antioksidan ekstrak dilakukan di Laboratorium Pusat Studi Biofarmaka, Institut Pertanian Bogor.
Bahan dan Alat
Bahan utama yang digunakan dalam penelitian ini adalah daun lindur (B. gymnorrhiza) tua (Lampiran 1) yang didapat dari Kawasan Konservasi Mangrove di Pantai Indah Kapuk, Jakarta Utara. Bahan lainnya yang digunakan yaitu bahan untuk analisis proksimat, bahan untuk uji fitokimia, bahan untuk uji aktivitas antioksidan dengan metode DPPH, dan bahan untuk uji kadar total fenol. Bahan untuk analisis aktivitas antioksidan yaitu kristal 1,1-diphenyl-2-pycril hydrazil (DPPH), etanol, dan vitamin C. Bahan untuk analisis total fenol yaitu etanol 95%, akuades, reagen Folin Ciocelteau 50%, Na2CO3 5%, dan larutan
standar (asam galat).
Alat yang digunakan pada penelitian ini meliputi alat untuk preparasi, wadah, timbangan digital, alumunium foil, blender, kertas saring Whatman 42, kompor listrik, tanur pengabuan, labu Kjeldahl, tabung soxhlet, spektrofotometer (Spectro UV Vis 2500), desikator, vortex, pipet, dan alat gelas lainnya misalnya tabung reaksi, beaker glass, sentrifuge, botol kaca, corong kaca, labu takar, dan labu Erlenmeyer.
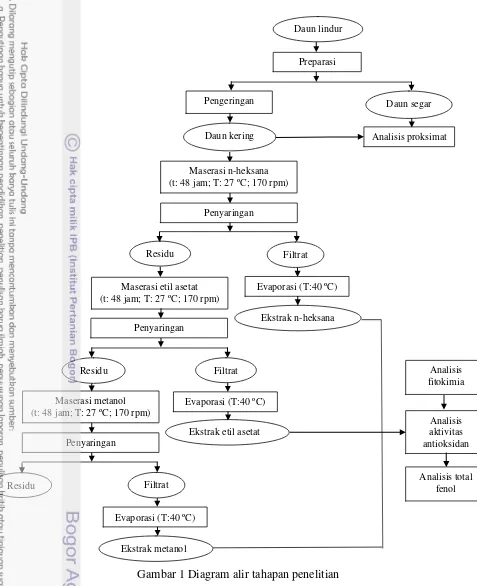
Tahapan Penelitian
4
Gambar 1 Diagram alir tahapan penelitian
Preparasi Sampel
Sampel daun lindur utuh ditimbang terlebih dahulu kemudian dipisahkan dari kotoran dan dicuci hingga bersih. Sampel selanjutnya dijemur di bawah sinar matahari hingga kering lalu dicacah. Ukuran sampel diperkecil dengan blender
Analisis Proksimat (SNI 01-2891-1992)
Analisis komposisi kimia daun lindur ditentukan dengan analisis proksimat meliputi kadar air, abu, lemak, protein, dan serat kasar.
a. Kadar air (SNI 01-2891-1992)
Cawan porselen mula-mula dipanaskan dalam oven pada suhu 105 oC
selama 1 jam, kemudian didinginkan dalam desikator selama 15 menit lalu ditimbang hingga beratnya konstan. Sampel sebanyak 5 gram dimasukkan ke dalam cawan, kemudian dikeringkan dalam oven pada suhu 105 oC selama 5 jam
atau hingga beratnya konstan. Cawan tersebut kemudian dimasukkan ke dalam desikator dan ditimbang kembali. Perhitungan kadar air adalah sebagai berikut:
Keterangan :
A = Berat cawan kosong (gram)
B = Berat cawan yang diisi dengan sampel (gram)
C = Berat cawan dengan sampel yang sudah dikeringkan (gram)
b. Kadar abu (SNI 01-2891-1992)
Cawan pengabuan dikeringkan di dalam oven selama 1 jam pada suhu 105 oC, kemudian didinginkan selama 15 menit di dalam desikator dan ditimbang hingga didapatkan berat yang konstan. Sampel sebanyak 5 gram dimasukkan ke dalam cawan pengabuan dan dipijarkan di atas kompor listrik hingga tidak berasap lagi. Cawan beserta isinya dimasukkan ke dalam tanur pengabuan pada suhu 600 oC selama 1 jam, kemudian didinginkan dalam desikator, lalu ditimbang. Kadar abu ditentukan dengan rumus:
Keterangan :
A = Berat cawan porselen kosong (gram) B = Berat cawan dengan sampel (gram)
C = Berat cawan dengan sampel setelah dikeringkan (gram)
c. Kadar protein (SNI 01-2891-1992)
Analisis protein terdiri dari tiga tahap yaitu destruksi, destilasi, dan titrasi. Pengukuran kadar protein dilakukan dengan metode Kjeldahl. Sampel ditimbang sebanyak 1 gram kemudian dimasukkan ke dalam labu Kjeldahl 100 mL lalu ditambah 0,25 gram selenium dan 3 mL H2SO4 pekat. Sampel didestruksi pada
suhu 410 oC selama kurang lebih 1 jam sampai larutan jernih lalu didinginkan.
Sebanyak 50 mL akuades dan 20 mL NaOH 40% ditambahkan ke dalam labu Kjeldahl (setelah dingin), kemudian dilakukan proses destilasi dengan suhu destilator 100 oC. Hasil destilasi ditampung dalam labu Erlenmeyer 125 mL yang berisi campuran 10 mL asam borat (H3BO3) 2% dan 2 tetes indikator bromcherosol green-methyl red yang berwarna merah muda. Setelah volume destilat mencapai 40 mL dan berwarna hijau kebiruan, maka proses destilasi dihentikan. Destilat selanjutnya dititrasi dengan HCl 0,1 N sampai terjadi perubahan warna merah muda. Volume titran dibaca dan dicatat. Larutan blanko dianalisis seperti sampel. Kadar protein dihitung dengan rumus:
% Kadar air = B - C x 100% B - A
6
Keterangan:
Faktor Konversi = 6,25
d. Kadar lemak (SNI 01-2891-1992)
Sampel sebanyak 5 gram dimasukkan ke dalam kertas saring dan pada kedua ujung bungkus ditutup dengan kapas bebas lemak dan selanjutnya dimasukkan ke dalam selongsong lemak. Selongsong lemak kemudian dihubungkan dengan labu lemak dan ruang ekstraktor dan disiram dengan pelarut lemak (n-heksana), kemudian direfluks selama 6 jam. Pelarut dalam labu lemak lalu didestilasi hingga semuanya menguap. Pelarut yang menguap pada saat didestilasi akan tertampung di ruang ekstraktor, kemudian dikeluarkan sehingga tidak kembali ke dalam labu lemak. Labu lemak selanjutnya dikeringkan dalam oven pada suhu 105 oC, lalu didinginkan dalam desikator hingga beratnya konstan. Kadar lemak dapat dihitung berdasarkan rumus:
Keterangan :
W1 = Berat sampel (gram)
W2 = Berat labu lemak kosong (gram) W3 = Berat labu lemak dengan lemak (gram)
e. Kadar serat kasar (SNI 01-2891-1992)
Sampel sebanyak 1 gram dilarutkan dengan 100 mL H2SO4 1,25%, lalu
dipanaskan hingga mendidih dan dilanjutkan dengan destruksi selama 30 menit. Filtrat kemudian disaring dengan bantuan corong Buchner. Residu hasil saringan dibilas dengan 20-30 mL air mendidih dan 25 mL air dingin sebanyak 3 kali. Residu kemudian destruksi kembali dengan NaOH 1,25% selama 30 menit, selanjutnya disaring kembali dan dibilas berturut-turut dengan 25 mL H2SO4,
25 mL air dingin sebanyak 3 kali, dan 25 mL alkohol. Residu dan kertas saring dipindahkan ke cawan porselen dan dikeringkan dalam oven 130 ºC selama 2 jam lalu ditimbang (W) dan dimasukkan dalam tanur 600 ºC selama 30 menit kemudian didinginkan dan ditimbang kembali (W0). Kadar serat kasar dapat dihitung berdasarkan rumus:
Keterangan:
W = bobot residu sebelum dibakar dalam tanur W0 = bobot residu setelah dibakar dalam tanur
Ekstraksi Bertingkat (Darusman et al. 1995)
Metode ekstraksi bertingkat menggunakan tiga macam pelarut berdasarkan tingkat kepolarannya, yaitu n-heksana p.a. (non polar), etil asetat p.a (semi polar) dan metanol p.a (polar). Sampel sebanyak 100 gram dimaserasi dengan pelarut n-heksana sebanyak 400 mL selama 48 jam dengan diberi goyangan menggunakan orbital shaker dengan kecepatan 170 rpm. Hasil maserasi yang berupa larutan kemudian disaring dengan kertas saring Whatman 42 sehingga diperoleh filtrat dan residu. Ekstraksi dengan pelarut n-heksana dilakukan berulang-ulang hingga warna filtrat bening. Residu hasil ekstraksi dengan n-heksana selanjutnya dilarutkan dengan etil asetat sebanyak 400 mL selama 48 jam dan diberi goyangan yang sama dengan maserasi sebelumnya, sedangkan filtrat yang diperoleh dievaporasi menggunakan rotary vacuum evaporator pada suhu 40 oC.
Hasil proses maserasi dengan etil asetat disaring dengan kertas saring Whatman 42. Ekstraksi dengan pelarut etil asetat dilakukan berulang-ulang hingga warna filtrat bening. Residu hasil ekstraksi dengan etil asetat selanjutnya dilarutkan dengan metanol sebanyak 400 mL selama 48 jam dan diberi goyangan yang sama dengan maserasi sebelumnya. Ekstraksi dengan pelarut metanol dilakukan berulang-ulang hingga warna filtrat bening. Filtrat kemudian dievaporasi menggunakan rotary vacuum evaporator pada suhu 40 oC. Hasil maserasi dengan pelarut metanol kemudian disaring dengan kertas saring Whatman 42. Filtrat ekstrak metanol yang diperoleh dievaporasi menggunakan
rotary vacuum evaporator pada suhu 40 oC, sedangkan residu yang tersisa dibuang. Berdasarkan proses ini, diperoleh ekstrak dengan pelarut n-heksana, etil asetat dan metanol. Hasil ekstrak yang diperoleh kemudian digunakan untuk pengujian fitokimia kualitatif dan kuantitatif, pengujian aktivitas antioksidan dan kadar total fenol ekstrak daun lindur.
Analisis Fitokimia (Harborne 1987)
Analisis fitokimia dilakukan untuk mengetahui ada tidaknya senyawa bioaktif yang terdapat pada sampel. Sampel yang diuji dalam bentuk ekstrak kasar. Uji fitokimia yang dilakukan meliputi uji alkaloid, uji steroid, flavonoid, saponin, fenol hidrokuinon, dan tanin.
a. Alkaloid
Sampel sebanyak 0,05 g dilarutkan dalam beberapa tetes asam sulfat 2 N kemudian diuji dengan tiga pereaksi alkaloid yaitu, pereaksi Dragendorff, pereaksi Meyer, dan pereaksi Wagner. Hasil uji dinyatakan positif bila dengan pereaksi Meyer terbentuk endapan putih kekuningan, endapan coklat dengan pereaksi Wagner dan endapan merah hingga jingga dengan pereaksi Dragendorff.
b. Steroid
Sampel sebanyak 0,05 g dilarutkan dengan 2 mL kloroform dalam tabung reaksi yang kering, kemudian ditambahkan 10 tetes anhidra asetat dan 3 tetes H2S04 pekat. Terbentuknya larutan berwarna merah untuk pertama kali kemudian
berubah menjadi biru dan hijau menunjukkan adanya steroid.
c. Flavonoid
8
yang sama) dan 4 mL alkohol kemudian campuran dikocok. Terbentuknya warna merah, kuning atau jingga pada lapisan amil alkohol menunjukkan adanya flavonoid.
d. Saponin
Sebanyak 0,05 g sampel dilarutkan dengan 2 mL air dan dimasukkan dalam
beaker glass lalu dipanaskan hingga mendidih. Busa yang stabil selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2N menunjukkan adanya saponin.
e. Fenol hidrokuinon
Sebanyak 0,05 g sampel ditambah dengan 2 mL etanol 70%. Larutan yang dihasilkan kemudian diambil sebanyak 1 mL dan ditambah tetes larutan FeCl3 5%. Terbentuknya warna hijau atau hijau biru menunjukkan adanya
senyawa fenol.
f. Tanin
Sampel sebanyak 0,05 g ditambah dengan beberapa tetes FeCl3 kemudian
campuran dihomogenkan. Terbentuknya warna merah kehitaman menunjukkan adanya senyawa tanin.
Analisis Aktivitas Antioksidan Metode DPPH (Aranda et al. 2009)
Uji aktivitas antioksidan dilakukan berdasarkan kemampuan sampel yang digunakan dalam mereduksi radikal bebas stabil DPPH. Ekstrak sebanyak 10 mg ditambah DMSO 1 mL sebagai larutan stock dan dimasukkan ke dalam tabung reaksi. Larutan kemudian diencerkan dengan etanol dan dibuat dalam beberapa konsentrasi (75, 100, 125, 150, dan 175 ppm). Larutan DPPH dibuat dengan penambahan 100 mL etanol ke dalam tabung reaksi berisi 10 mg kristal DPPH. Masing-masing sebanyak 100 µL larutan sampel dan larutan DPPH dimasukkan ke dalam microplate. Campuran kemudian dihomogenkan dan diinkubasi pada ruangan gelap selama 30 menit. Vitamin C (asam askorbat) dilarutkan dengan etanol dan dibuat dengan konsentrasi 3, 5, 8, dan 10 ppm sebagai kontrol positif dan pembanding. Serapan yang dihasilkan diukur dengan microplate reader. Persentase penghambatan efektivitas radikal bebas diperoleh dari nilai absorbansi sampel. Persamaan regresi diperoleh dari hubungan antara konsentrasi sampel dan presentase penghambatan aktivitas radikal bebas. Nilai konsentrasi penghambatan aktivitas radikal bebas sebanyak 50% (IC50) dihitung dengan menggunakan
persamaan regresi. Nilai IC50 diperoleh dengan memasukkan y = 50 serta nilai a
dan b yang telah diketahui. Nilai x sebagai IC50 dapat dihitung dengan persamaan:
Keterangan: Tabung berisi campuran lalu ditambah 5 mL akuades dan divortex kembali hingga homogen. Sebanyak 0,5 mL reagen Folin Ciocelteau 50% ditambahkan ke dalam
tabung berisi campuran. Campuran didiamkan selama 5 menit, lalu ditambah dengan 1 mL Na2CO3 5%, kemudian divortex. Tabung reaksi berisi campuran
tersebut disimpan dalam ruang gelap selama 1 jam, lalu diukur nilai absorbansinya (λ=725 nm) dengan spektrofotometer UV-Vis. Larutan blanko dibuat seperti larutan uji, namun tanpa ekstrak sampel. Selanjutnya dibuat kurva strandar asam galat dan ditentukan kadar total fenol.
HASIL DAN PEMBAHASAN
Komposisi Kimia Daun Lindur (B. gymnorrhiza)
Daun lindur secara empiris telah banyak digunakan oleh masyarakat Tual di Kepulauan Sulawesi, namun komposisi kimia daun lindur tersebut belum diketahui. Komposisi kimia daun lindur ditentukan melalui analisis proksimat. Analisis proksimat merupakan suatu analisis yang dilakukan untuk memprediksi komposisi kimia suatu bahan, termasuk di dalamnya kandungan air, lemak, protein, abu, dan serat kasar. Sampel yang digunakan untuk analisis proksimat yaitu daun lindur segar dan kering. Komposisi kimia daun lindur segar dan kering disajikan pada Tabel 1. Contoh perhitungan analisis proksimat daun lindur disajikan pada Lampiran 2.
Tabel 1 Komposisi kimia daun lindur Komponen Keterangan: *) : Hardiningtyas (2012)
**) : Bunyapraphatsara et al. (2002)
Tabel 1 menunjukkan kadar air daun lindur menurun sebesar 45,13% setelah proses pengeringan selama 2 hari. Hasil ini sesuai dengan Hardiningtyas (2012) yang melakukan penelitian pada daun api-api yang mengalami penurunan kadar air sebesar 60,87% setelah proses pengeringan selama 4 hari. Penurunan kadar air disebabkan proses pengeringan yang menguapkan sebagian air pada bahan. Hal ini sejalan dengan pernyataan Kusnandar (2010) bahwa perubahan kadar air dapat disebabkan oleh mudahnya air menguap ketika mengalami proses pemanasan.
10
Kadar air pada daun lindur segar lebih tinggi dibandingkan daun B. parviflora dan R. mucronata segar, namun masih lebih rendah dibandingkan daun
A. marina segar. Menurut (Hardiningtyas 2012), perbedaan kadar air tersebut diduga dipengaruhi oleh faktor internal dan faktor eksternal. Faktor internal yang diduga menjadi penyebab perbedaan ini adalah morfologi daun dan sifat genetik. Faktor eksternal yang diduga berpengaruh adalah nutrisi dan kondisi lingkungan yang berbeda.
Analisis kadar abu dilakukan untuk mengetahui kandungan mineral yang terdapat pada suatu bahan. Hasil perhitungan kadar abu daun lindur kering menunjukkan selisih sebesar 3,7% dengan kadar abu pada daun lindur segar. Penelitian Hardiningtyas (2012) juga menunjukkan peningkatan kadar abu pada sampel daun A. marina kering sebesar 6,78% dibandingkan dengan kadar abu pada daun A.marina segar.
Kadar abu daun lindur segar lebih tinggi dibandingkan dengan daun mangove lainnya. Hasil penelitian Wibowo et al. (2009), daun mangrove api-api putih segar mengandung mineral, diantaranya kalsium, fosfor, magnesium, besi, sodium dan kalium. Tinggi rendahnya kadar abu dapat disebabkan oleh perbedaan habitat atau lingkungan hidup yang berbeda. Selain itu, masing-masing organisme juga memiliki kemampuan yang berbeda-beda dalam meregulasi dan mengabsorbsi mineral sehingga hal ini nantinya juga akan berpengaruh terhadap nilai kadar abu pada masing-masing bahan (Winarno 2008).
Daun lindur kering mengalami perubahan nilai kadar lemak sebesar 2,03% dibandingkan dengan daun lindur segar. Hasil penelitian Hardiningtyas (2012) juga menunjukkan peningkatan kadar lemak pada daun A. marina kering sebesar 3,17% dibandingkan daun A. marina segar. Kadar lemak daun lindur segar lebih rendah dibandingkan dengan daun B. parviflora dan R. mucronata segar, namun masih lebih tinggi dibandingkan daun A. marina segar. Kadar lemak yang rendah dapat disebabkan oleh kandungan air yang cukup tinggi sehingga kadar lemak secara proporsional menurun. Menurut Yunizal et al. (1998), kadar air umumnya berbanding terbalik dengan kadar lemak. Hubungan tersebut mengakibatkan semakin rendahnya kadar lemak jika kadar air yang terkandung dalam bahan memiliki jumlah yang tinggi.
Protein merupakan makromolekul yang dibentuk dari asam amino yang berikatan peptida (Winarno 2008). Kadar protein daun lindur kering lebih tinggi sebesar 6,33% dibandingkan dengan daun lindur segar, mengingat proses pengeringan yang menyebabkan protein terdenaturasi. Menurut Gaman dan Sherrington (1992), perlakuan pemanasan pada suatu bahan pangan, menyebabkan protein terdenaturasi secara sempurna. Daun lindur segar mengandung protein dalam jumlah yang terbilang kecil, lebih tinggi dibandingkan kadar protein daun mangrove segar lainnya.
mempunyai mutu yang rendah. Kadar protein pada tumbuhan secara umum memiliki mutu yang lebih rendah daripada kadar protein hewani. Protein hewani lebih banyak menyediakan asam amino-asam amino esensial dan karenanya disebut protein bermutu tinggi (Winarno 2008).
Serat kasar merupakan residu dari bahan pangan yang telah diperlakukan dengan kondisi asam dan alkali mendidih. Serat pada tumbuhan umumnya terdiri dari selulosa, hemiselulosa dan lignin. Serat pada tumbuhan yang sebagian besar berupa selulosa akan terhidrolisis menjadi senyawa-senyawa yang lebih sederhana. Serat yang berupa selulosa, hemiselulosa, dan lignin ini merupakan polisakarida yang banyak terdapat pada dinding sel tumbuhan. Selulosa yang terhidrolisis akan menjadi senyawa yang lebih sederhana, diantaranya selodekstrin yang terdiri dari satuan glukosa atau lebih sedikit, kemudian selobiosa dan akhirnya glukosa (Robinson 1995).
Daun lindur kering memiliki kadar abu, lemak, protein, dan serat kasar yang lebih tinggi dibandingkan pada daun lindur segar. Hal ini akibat adanya proses pengeringan pada sampel daun lindur kering tersebut. Menurut Muchtadi dan Fitriyono (2010), proses pengeringan akan mengurangi kadar airnya dan mengakibatkan bahan mengandung senyawa protein, karbohidrat, dan mineral memiliki proporsi yang lebih tinggi.
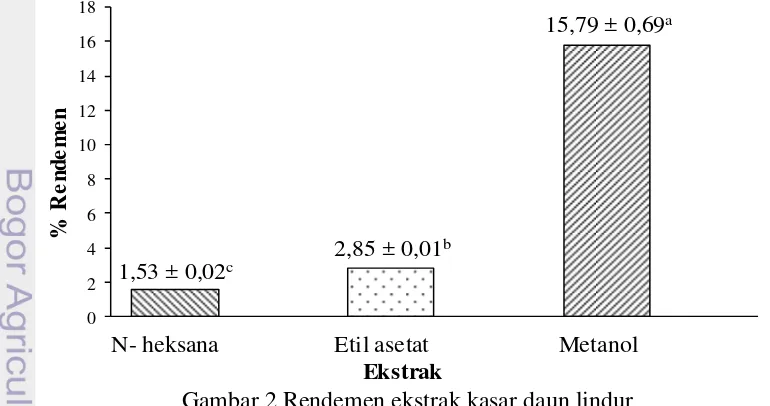
Rendemen Ekstrak Kasar Daun Lindur
Ekstraksi dengan jenis pelarut yang berbeda menghasilkan rendemen ekstrak yang berbeda. Menurut Sultana et al. (2009), jenis pelarut yang digunakan merupakan faktor utama yang menentukan hasil ekstraksi atau rendemen ekstrak. Rendemen ekstrak merupakan perbandingan antara bobot ekstrak yang dihasilkan dengan bobot awal yang digunakan dan dinyatakan dalam persen (%). Rendemen ekstrak daun lindur dengan masing-masing pelarut disajikan pada Gambar 1. Perhitungan rendemen dapat dilihat pada Lampiran 3.
Gambar 2 Rendemen ekstrak kasar daun lindur
Gambar 2 menunjukkan bahwa rendemen terendah yaitu ekstrak n-heksana sebesar 1,53%, sedangkan rendemen tertinggi yaitu ekstrak metanol sebesar 15,79%. Hal tersebut mengindikasikan bahwa kandungan senyawa bioaktif yang
12
paling banyak pada ekstrak kasar daun lindur bersifat polar. Hasil uji ANOVA (Lampiran 4) menunjukkan bahwa jenis pelarut berpengaruh terhadap rendemen ekstrak daun lindur yang dihasilkan (p<0,05), sehingga dilakukan uji lanjut. Uji lanjut yang digunakan adalah uji Duncan. Hasil uji lanjut Duncan (Lampiran 5) diketahui bahwa rendemen ekstrak n-heksana, etil asetat, dan metanol masing-masing berbeda signifikan.
Perbedaan rendemen pada masing-masing ekstrak diakibatkan kemampuan setiap pelarut yang spesifik hanya dapat melarutkan senyawa yang sesuai dengan kepolarannya. Hal ini sejalan dengan hasil penelitian Salamah et al. (2008) yang menunjukkan bahwa rendemen ekstrak hasil maserasi dengan pelarut yang berbeda menghasilkan persentase rendemen yang berbeda pula. Sultana et al.
(2009) menambahkan, rendemen ekstrak sangat tergantung pada jenis pelarut yang digunakan, karena ada komponen berbeda dengan beberapa karakteristik kimia dan polaritas yang mungkin tidak larut dalam pelarut tertentu.
Komponen Bioaktif Ekstrak Kasar Daun Lindur
Komponen bioaktif dalam ekstrak daun lindur ditentukan melalui analisis fitokimia. Analisis fitokimia yang dilakukan meliputi alkaloid, flavonoid, fenol hidrokuinon, tanin, steroid, dan saponin. Komponen bioaktif pada masing-masing ekstrak daun lindur disajikan pada Tabel 2.
Tabel 2 Komponen bioaktif ekstrak kasar daun lindur Komponen bioaktif
merupakan senyawa non polar yang berperan sebagai prekursor steroid (Harborne 1987). Steroid yang terdapat pada ketiga ekstrak daun lindur diduga lebih berfungsi sebagai peningkat stamina, meskipun Belitz et al. (2008) menyatakan bahwa triterpenoid dan steroid merupakan senyawa antioksidan lipofilik. Dugaan tersebut diperkuat dari aktivitas antioksidan ekstrak n-heksana yang lemah (>200 ppm). Hasil penelitian Juniarti et al. (2009) juga menunjukkan adanya steroid pada ekstrak daun saga (Arbus precatorius L.), namun menunjukkan aktivitas antioksidan yang lemah, sedangkan steroid pada hasil penelitian Silvia et al. (2002), menunjukkan aktivitas anti-inflamasi pada steroid yang diekstrak dari daun Agave attenuate.
Ketiga ekstrak daun lindur juga menunjukkan adanya senyawa fenol hidrokuinon. Senyawa fenol cenderung mudah larut dalam air dan beberapa senyawa non polar karena umumnya berikatan dengan gula sebagai glikosida dan biasanya terdapat dalam vakuola sel. Fenol meliputi berbagai senyawa yang berasal dari tumbuhan dan mempunyai ciri yang sama, yaitu cincin aromatik yang mengandung satu atau dua gugus hidroksil, beberapa mungkin digantikan dengan gugus metil atau glikosil. Flavonoid merupakan kelompok yang terbesar di antara komponen fenolat alami yang strukturnya telah diketahui, tetapi fenol monosiklik sederhana, fenilpropanoid dan fenolat quinon terdapat dalam jumlah sedikit. Beberapa golongan bahan polimer penting dalam tumbuhan seperti lignin, melanin, dan tanin merupakan senyawa polifenol (Harborne 1987). Senyawa fenol pada ketiga ekstrak juga ditentukan dengan analisis kadar total fenolik. Hasil analisis menunjukkan bahwa ekstrak etil asetat menunjukkan nilai total fenolik tertinggi dibandingkan ekstrak lainnya.
Flavonoid umumnya terdapat pada tumbuhan terikat pada gula sebagai glikosida dan aglikon flavonoid (Harborne 1987). Senyawa flavonoid hanya terdapat pada ekstrak metanol dan ekstrak etil asetat. Hal ini karena dipengaruhi oleh kepolaran pelarut dalam mengekstrak flavonoid. Menurut Middleton et al.
(2000), flavonoid merupakan senyawa aktif yang termasuk dalam jenis
intermediet antioksidan, yang berperan sebagai antioksidan hidrofilik dan lipofilik. Flavonoid sebagai derivat benzo-γ-piren mempunyai banyak kegunaan disamping fungsinya yang utama sebagai bahan tambahan untuk meningkatkan resistensi dan menurunkan permeabilitas kapiler darah. Efek lain flavonoid sangat banyak macamnya terhadap berbagai organisme dan efek ini dapat menjelaskan alasan tumbuhan yang mengandung flavonoid dapat digunakan dalam pengobatan. Flavonoid dapat berfungsi sebagai antivirus, antialergi, antimikroorganisme, dan antioksidan untuk mengendalikan radikal bebas yang dapat menyebabkan tumor. Lotito dan Fraga (2000) menambahkan, flavonoid merupakan antioksidan yang berperan dalam melindungi antioksidan lipofilik sehingga dapat menguatkan antioksidan seluler.
14
sumberdaya alam tak terbaharukan. Tanin, polifenol dan flavonoid merupakan senyawa yang berfungsi sebagai antioksidan karena ketiga senyawa tersebut merupakan senyawa-senyawa fenol, yaitu senyawa dengan gugus –OH yang terikat pada cincin aromatik. Senyawa-senyawa tersebut tidak reaktif dibandingkan dengan kebanyakan radikal bebas yang lain (Jati 2008).
Hasil analisis fitokimia menunjukkan adanya senyawa saponin pada ekstrak etil asetat dan metanol. Menurut Robinson (1995), terdapat dua jenis saponin, yaitu glikosida triterpenoid alkohol dan glikosida steroid. Kedua jenis ini larut dalam air dan etanol. Saponin merupakan senyawa aktif permukaan dan bersifat seperti sabun. Saponin dapat dideteksi berdasarkan kemampuannya membentuk busa dan menghemolisis sel darah. Hasil penelitian Homhual et al. (2006) menunjukkan bahwa komponen bioaktif yang terdapat pada B. gymnorrhiza
terdiri dari senyawa fenol, flavonoid, steroid, kandungan sulfur, dan komponen terpenoid.
Aktivitas Antioksidan Ekstrak Daun Lindur
Analisis aktivitas antioksidan ekstrak daun lindur yang dilakukan pada penelitian ini menggunakan metode DPPH. Aktivitas antioksidan dengan metode DPPH dinyatakan dalam presentase inhibisinya terhadap radikal bebas DPPH (Ukieyanna 2012). Persen inhibisi merupakan kemampuan suatu bahan untuk menghambat aktivitas radikal bebas yang berhubungan dengan konsentrasi bahan. Nilai IC50 didefinisikan sebagai besarnya konsentrasi yang dapat menghambat
aktivitas radikal bebas DPPH sebanyak 50%. Semakin rendah nilai IC50
menunjukkan aktivitas antioksidan yang semakin tinggi (Molyneux 2004). Hubungan antara konsentrasi ekstrak vitamin C terhadap persen inhibisinya disajikan pada Gambar 3.
Gambar 3 Hubungan konsentrasi vitamin C dengan persen inhibisinya Gambar 3 menunjukkan hubungan antara konsentrasi vitamin C dengan persen inhibisinya. Persen inhibisi vitamin C tertinggi diperoleh pada konsentrasi 10 ppm yaitu sebesar 78,08%, sedangkan persen inhibisi terendah sebesar 25,40% dihasilkan pada konsentrasi 1 ppm. Nilai IC50 larutan kontrol (vitamin C) yang
Gambar 4 Hubungan konsentrasi ekstrak dengan persen inhibisinya
Persen inhibisi merupakan kemampuan suatu bahan untuk menghambat aktivitas radikal bebas, yang berhubungan dengan konsentrasi suatu bahan (Jacoeb et al. 2013). Gambar 4 menunjukkan peningkatan persentase penghambatan terhadap radikal bebas seiring dengan meningkatnya konsentrasi ekstrak. Hasil ini sesuai dengan pernyataan Hanani et al. (2005) bahwa persentase penghambatan terhadap aktivitas radikal bebas akan meningkat seiring dengan meningkatnya konsentrasi ekstrak karena semakin banyaknya senyawa antioksidan yang mendonorkan elektron terhadap radikal bebas.
Hasil penelitian ini menunjukkan bahwa persen inhibisi tertinggi diperoleh dari ekstrak metanol sebesar 58,47%, sedangkan persen inhibisi terendah diperoleh dari ekstrak n-heksana yaitu sebesar 14,73%. Hal ini berbeda dengan hasil penelitian Haq et al. (2011) yang menunjukkan bahwa nilai persen inhibisi tertinggi diperoleh pada ekstrak etanol, diikuti ekstrak metanol, dan ekstrak kloroform pada konsentrasi ekstrak yang sama (2000 ppm). Menurut Blois (2005), suatu senyawa digolongkan sebagai antioksidan sangat kuat apabila nilai IC50
kurang dari 50 ppm, kuat apabila nilai IC50 berkisar 50-100 ppm, sedang apabila
nilai IC50 berkisar 100-150 ppm, dan lemah apabila nilai IC50 berkisar (150-200
ppm). Perhitungan persen inhibisi dan nilai IC50 dapat dilihat pada Lampiran 6.
16
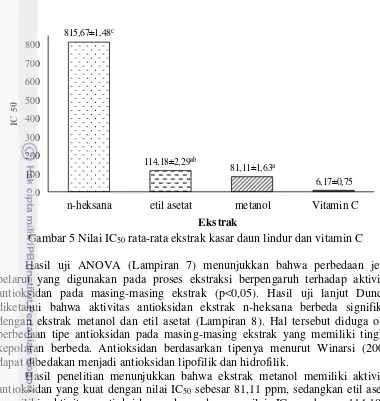
Gambar 5 Nilai IC50 rata-rata ekstrak kasar daun lindur dan vitamin C
Hasil uji ANOVA (Lampiran 7) menunjukkan bahwa perbedaan jenis pelarut yang digunakan pada proses ekstraksi berpengaruh terhadap aktivitas antioksidan pada masing-masing ekstrak (p<0,05). Hasil uji lanjut Duncan diketahui bahwa aktivitas antioksidan ekstrak n-heksana berbeda signifikan dengan ekstrak metanol dan etil asetat (Lampiran 8). Hal tersebut diduga oleh perbedaan tipe antioksidan pada masing-masing ekstrak yang memiliki tingkat kepolaran berbeda. Antioksidan berdasarkan tipenya menurut Winarsi (2007) dapat dibedakan menjadi antioksidan lipofilik dan hidrofilik.
Hasil penelitian menunjukkan bahwa ekstrak metanol memiliki aktivitas antioksidan yang kuat dengan nilai IC50 sebesar 81,11 ppm, sedangkan etil asetat
memiliki aktivitas antioksidan sedang dengan nilai IC50 sebesar 114,18%.
Tingginya nilai IC50 pada ekstrak n-heksana dan etil asetat menunjukkan
lemahnya aktivitas antioksidan ekstrak tersebut dibandingkan dengan ekstrak metanol. Hal ini disebabkan oleh pelarut n-heksana dan etil asetat yang memiliki kepolaran lebih rendah dibandingkan metanol. Hal serupa dibuktikan oleh Ukieyanna (2012) yang menunjukkan bahwa aktivitas antioksidan ekstrak etanol yang lebih rendah dapat disebabkan oleh adanya senyawa-senyawa nonpolar yang terekstrak bukan merupakan senyawa antioksidan yang kuat, misalnya minyak atsiri, lemak, dan lilin.
Faktor lain yang mungkin menyebabkan tingginya aktivitas antioksidan pada ekstrak metanol yaitu karena banyak senyawa bioaktif terekstrak, misalnya tanin yang termasuk senyawa polifenol. Ketiga ekstrak tersebut masih tergolong ekstrak kasar sehingga diduga masih terdapat senyawa pengganggu, diantaranya protein dan senyawa lainnya yang menghalangi proses penangkapan radikal bebas. Kemurnian suatu sampel saat proses ekstraksi mempengaruhi aktivitas antioksidan sampel tersebut.
Nilai aktivitas antioksidan yang diperoleh masih sangat rendah jika dibandingkan hasil penelitian Haq et al. (2011) dengan nilai IC50 ekstrak etanol
sebesar 0,038 ppm serta ekstrak metanol dan kloroform masing-masing sebesar 0,027 ppm dan 0,28 ppm. Rendahnya nilai IC50 yang diperoleh dalam penelitian
penelitian Hardiningtyas (2012) yang menunjukkan penurunan aktivitas antioksidan seiring dengan semakin lamanya waktu ekstraksi. Chew et al. (2011) juga menambahkan bahwa waktu ekstraksi berkepanjangan akan menyebabkan paparan oksigen lebih banyak dan dengan demikian meningkatkan peluang untuk terjadinya oksidasi pada senyawa fenolik.
Kadar Total Fenol Ekstrak Kasar Daun Lindur
Fenolik merupakan metabolit sekunder yang tersebar dalam tumbuhan. Senyawa fenolik dalam tumbuhan dapat berupa fenol sederhana, antraquinon, asam fenolat, kumarin, flavonoid, lignin dan tanin. Penentuan kandungan fenolik total dapat dilakukan dengan menggunakan prinsip Folin-Ciocalteau yang didasarkan pada reaksi oksidasi-reduksi. Kandungan total fenol dinyatakan dalam GAE (gallic acid equivalent). Reagen Folin yang terdiri dari asam fosfomolibdat dan asam fosfotungstat akan tereduksi oleh senyawa polifenol menjadi molibdenum-tungsen (Harborne 1987). Reaksi ini membentuk kompleks warna hijau biru. Semakin tinggi kadar fenolik pada sampel, semakin pekat warna yang terbentuk sehingga semakin tinggi nilai absorbansi yang diukur pada panjang gelombang 725 nm. Perhitungan total fenol dan kurva standar dapat dilihat pada Lampiran 9. Kadar total fenol masing-masing ekstrak disajikan pada Tabel 3. Tabel 3 Kadar total fenol ekstrak daun lindur
Ekstrak Total fenolik (mg GAE/g ekstrak)
N-heksana 12,41 - -
Etil asetat 97,57 - -
Metanol 30,07 134,16 *) 178,73%**)
Keterangan: *) : Banerjee et al. (2008) **) : Haq et al. (2011)
18
Hasil penelitian Haq et al. (2011) menunjukkan nilai total fenol ekstrak etanol daun lindur sebesar 189,4 mg/g, sedangkan ekstrak metanol dan ekstrak kloroform masing-masing sebesar 178,73 mg/g, dan 13,13 mg/g. Kadar total fenolik pada ekstrak kloroform tersebut tidak terlalu berbeda dengan nilai total fenolik pada ekstrak n-heksana, mengingat kloroform dan n-heksana merupakan pelarut yang bersifat non polar. Rendahnya nilai total fenolik pada kedua ekstrak tersebut disebabkan sifat non polarnya. Menurut Harborne (1987), perbedaan tingkat kepolaran pelarut menentukan struktur kimia senyawa fenolik yang terekstrak. Pengujian fenolik total sangat tergantung pada struktur kimianya. Senyawa fenolik yang mempunyai gugus fungsi hidroksil yang banyak atau dalam kondisi bebas (aglikon) akan menghasilkan kandungan fenolik total yang tinggi. Pelarut polar mampu menarik senyawa fenolik dalam jumlah yang cukup banyak. Senyawa fenolik yang bersifat polar memiliki aktivitas antioksidan yang tinggi. Tingginya total fenolik pada ekstrak etil asetat dibandingkan dengan ekstrak metanol karena etil asetat bersifat semi polar yang dapat mengekstrak senyawa fenolik yang bersifat polar dan non polar. Menurut Andayani et al. (2008), pelarut etil asetat dapat mengekstrak senyawa fenolik, baik yang bersifat polar ataupun nonpolar. Hasil penelitian Haq et al. (2011) juga menunjukkan bahwa ekstrak etanol memiliki total fenolik tertinggi dibandingkan ekstrak metanol dan kloroform. Etanol dan etil asetat merupakan pelarut semi polar karena memiliki gugus hidroksil polar dan rantai karbon non polar, sehingga dapat larut dalam pelarut polar dan non polar (Harjadi 1993).
Kadar total fenolik pada ekstrak metanol dan etil asetat berbeda dengan hasil penelitian Haq et al. (2011) dan Banerjee et al. (2008). Menurut Ukieyanna (2012), perbedaan kadar total fenolik pada tumbuhan disebabkan nutrisi, habitat, dan varietas yang berbeda. Hal lain yang menyebabkan perbedaan nilai total fenolik tersebut yaitu pada saat reagen Folin-Ciocalteu direaksikan dengan senyawa fenolik akan terjadi perubahan warna dari kuning menjadi biru. Intensitas warna biru ditentukan dengan banyaknya kandungan fenol dalam larutan sampel. Semakin besar konsentrasi senyawa fenolik dalam sampel semakin pekat warna biru yang terlihat. Warna hijau biru yang teramati berbanding lurus dengan konsentrasi ion fenolat yang terbentuk, semakin besar konsentrasi senyawa fenolik maka semakin banyak ion fenolat yang terbentuk sehingga warna biru yang dihasilkan semakin pekat. Menurut Sudjadi dan Rohman (2004), fenolat hanya terdapat pada larutan basa, tetapi pereaksi Folin-Ciocalteu dan produknya tidak stabil pada kondisi basa. Penambahan Na2CO3 pada penentuan kadar total
KESIMPULAN DAN SARAN
Kesimpulan
Komponen bioaktif yang terdapat pada ketiga ekstrak secara umum yaitu fenol hidrokuinon, flavonoid, tanin, steroid, dan saponin. Aktivitas antioksidan tertinggi yaitu pada ekstrak metanol dengan nilai IC50 sebesar 81,11%, diikuti
ekstrak etil asetat dengan nilai IC50 sebesar 114,18%, dan ekstrak n-heksana
sebesar dengan nilai IC50 sebesar 815,67%.
Saran
Perlu dilakukan pemisahan senyawa bioaktif dengan metode lain yang lebih efektiv serta pengujian komponen bioaktif secara kuantitatif, misal dengan metode GC-MS. Pengujian total fenol juga dapat dilakukan dengan metode lain, misalnya metode Valin.
DAFTAR PUSTAKA
Allen JA, Duke NC. 2006. Bruguiera gymnorrhiza (large-leaf mangrove).
www.traditionaltree.com [9 Juli 2013].
Andarwulan N, Wijaya H, Cahyono DT. 1996. Aktivitas antioksidan dari daun sirih (Piper betle L). Teknologi dan Industri Pangan l 29-30.
Andayani R, Y Lisawati, Maimunah. 2008. Penentuan aktivitas antioksidan, kadar fenol total, dan likopen pada buah tomat (Solanum lycupersicum L). Jurnal Sains dan Teknologi Farmasi 13(1): 1-9.
Aranda SR, Perez-Lopez LA, Arroyo JL, Alanis-Garza BA, de Torres NW. 2009. Antimicrobial and antioxidant activities of plants from Northeast of Mexico.
Journal of Evidence-Based Complementary and Alternative Medicine
41(5):233-236.
Banerjee D, Chakrabati S, Hazra Ak, Banerjee S, Ray J, Mukherjee B. 2008. Antioxidant activity and total phenolics of some mangroves in Sundarbans Afr.
J. Biotech 7(9): 805-810.
Belitz HD, Grosch W, Schieberle P. 2009. Food Chemistry, 4th revised and extended edition. Berlin: Spinger-Verlag, Heidelberg.
Blois MS. 2005. Antioxidant determination by the use of stable free radical.
Nature 181:1191-1200.
20
Bunyapraphatsara N, Jutiviboonsuk A, Sornlek P, Therathanathorn W, Aksornkaew S, Fong HHS, Pezzuto JM, KosmederJ. 2002. Pharmacological studies of plants in the mangrove forest. Thai J. Phytopharm 10(2): 1-12. Chew KK, Ng SY, Thoo YY, Khoo MZ, Wan Aida WM, Ho CW. 2011. Effect
of ethanol concentration, extraction time and extraction temperature on the recovery of phenolic compounds andantioxidant capacity of Centella asiatica
extracts Inter. Food Res. J 18: 566-573.
Darusman LK, Sajuthi D, Sutriah K, Pamungkas D. 1995. Ekstraksi komponen bioaktif sebagai bahan obat dari karang-karangan, bunga karang dan ganggang di perairan Pulau Pari Kepulauan Seribu [laporan penelitian]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Duenas M, Manzano SO, Paramas AG, Buelga SC. 2009. Antioxidant evaluation of O-methylated metabolites of catechins, epicatechin, and quersetin. Journal of Pharmaceutical and Biomedical Analysis.
Duke NC, James AA. 2006. Bruguiera gymnorrhiza (large-leafed mangrove). Species Profiles for Pacific Island Agroforestry Apr; Ver 2.I.
www.traditionaltree.org [10 Oktober 2013].
Fai YM, Tao CC. 2009. Literature review on pharmacutical activities of oleanolic acid. Nat. Prod. Medica, 2: 291-298.
Feng Y. Li XM, Duan XJ, Wang BG. 2006. A new acylated iridoid glucoside fromAvicennia marina. Chinese Chemical Letters, 17(9): 1201-1204.
Gaman PM, Sherington KB. 1992. Pengantar Ilmu Pangan, Nutrisi, dan Mikrobiologi. Ed ke-2. Murdijati G, Sri N, Agnes, M, Sardjono, penerjemah; Kasmidjo RB, editor. Yogyakarta (ID). UGM Pr. Terjemahan dari: The Science of Food, An Introduction do Food Science, Nutrition and Microbiology. Second Edition.
Halliwel B, Gutteridge JMC. 2007. Free Radicals In Biology And Medicine. Ed ke-4. Oxford, UK: Oxford University Press.
Hanani E, Mun’im A, Sekarini R. 2005. Identifikasi senyawa antioksidan dalam spons Callyspongia sp. dari Kepulauan Seribu. Majalah Ilmu Kefarmasian, 2 (3): 127-133.
Haq M, Wirakarnain S, ABMS Hossain, Rosrna Mat Taha, KM Monneruzzaman. 2011. Total phenolic contents, antioxidant and antimicrobial activities of
Bruguiera gymnorrhiza 6(17): 4112-4118.
Harborne JB. 1987. Metode Fitokimia. Edisi ke-2. Padmawinata K, Soediro I, penerjemah. Bandung: Institut Teknologi Bandung. Terjemahan dari:
Phytochemical Methods.
Hardiningtyas SD. 2012. Aktivitas antioksidan dan efek hepatoprotektif daun api-api putih (Avicennia marina). [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Homhual S, Bunyapraphatsara N, Kondratyuk T, Herunsalee A, Chaukul W, Puzzuto JM, Fong HHS, Zhang HJ. 2006. Bioactive dammarane triterpenes from the mangrove plant Bruguiera gymnorrhiza. Journal of Natural Product
69 (3):421-424.
Jacoeb AM, Suptijah P, Zahidah. 2013. Komponen bioaktif dan aktivitas antioksidan buah lindur (Bruguiera gymnorrhiza). Jurnal Pengolahan Hasil Perikanan Indonesia 16(1): 86-94.
Jati SH. 2008. Efek antioksidan ekstrak etanol 70% daun salam (Syzygium polyanthum) pada hati tikus putih jantan galur wistar yang diinduksi karbon tetraklorida (CCl4) [skripsi]. Surakarta: Fakultas Farmasi, Universitas Muhammadiyah Surakarta.
Juniarti, Osmeli D, Yuhernita. 2009. Kandungan senyawa kimia, uji toksisitas (Brine Shrimp Lethality Test) dan antioksidan (1,1-diphenyl-2-picrilhydrazyl) dari ekstrak daun saga (Abrusprecatorius L.). Makara Sains 13(1): 50-54. MUCHTKhrueayu D, Pilantanapak A. 2012. Antifungal activity of bioactive
compound from endophytic fungi isolated from mangrove leaves. 1st Mae Fah University International Conference 2012. Thailand.
Kusnandar F. 2010. Kimia Pangan. Jakarta (ID): PT Dian Rakyat.
Lotito SB, Fraga CG. 2000. Catechins delay lipid oxidation and alpha-tocopherol and beta-carotene depletion following ascorbate depletion in human plasma.
Proc. Soc. Exp. Biol. Med. 225: 32–38.
Middleton EC, Kandaswami, TC Theoharides. 2000. The effects of plant flavonoids on mammalian cells: implications for inflammation, heart disease, and cancer. Pharmacological Reviews 52:673-751.
Molyneux P. 2004. The use of the stable free radical diphenyl picrylhydrazil
(DPPH) for estimating antioxidant activity. Journal Science and Technology. 26 (2): 211-219.
Muchtadi TR, Fitriyono A. 2010. Teknologi Proses Pengolahan Pangan. Bandung (ID): PT Alfabeta.
Robinson T. 1995. Kandungan Organik Tumbuhan Tinggi. Ed ke-4. Kosasih, Padmawinata, penerjemah. Bandung (ID) : ITB Press.
Salamah E, Ayuningrat E, Purwaningsih S. 2008. Penapisan awal komponen bioaktif dari kijing taiwan (Anadonta woodiana Lea.) sebagai senyawa antioksidan. Buletin Teknologi Hasil Perikanan 11(2):119-132.
Silvia BP, Sousa AC, Silvia GM, Mendes TP, Parente JP. 2002. A new bioactive steroidal saponin from Agave attenuate. Zeitschrift fur Naturforschung 57C: 423-428.
Soeksmanto A, Hapsari Y, Simanjuntak P. 2007. Kandungan antioksidan pada beberapa bagian tanaman mahkota dewa (Phaleria macrocarpa Scheff) Boerl. (Thymelaceae). Biodiversitas 8: 92-95.
22
Sultana B, Anwar F, Ashraf M. 2009. Effect of extraction solvent/technique on the antioxidant activity of selected medicinal plant extracts. Molecules 14:
2167-2180.
Ukieyanna E. 2012. Aktivitas antioksidan, kadar fenolik, dan flavonoid tumbuhan suruhan (Peperomia pellucida L. Kunth) [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Wibowo C, Kusmana C, Suryani A, Hartati Y, Oktadiyani P. 2009. Pemanfaatan pohon mangrove api-api (Avicennia spp.) sebagai bahan pangan dan obat.
Prosiding Seminar Hasil-Hasil Penelitian IPB 2009 Buku 1: Bidang pangan dan energi. Bogor: LPPM-IPB.
Winarno FG. 2008. Kimia Pangan dan Gizi. Bogor (ID): M-Brio Press.
Winarsi H. 2007. Antioksidan Alami dan Radikal Bebas. Yogyakarta (ID): Kanisius.
Yunizal, Murtini JT, Dolaria N, Purdiwoto B, Abdulrokhim, Carkipan. 1998.
24
Lampiran 1 Daun lindur (Bruguiera gymnorrhiza)
Sumber: Dokumentasi pribadi (2013) Lampiran 2 Contoh perhitungan analisis proksimat daun lindur a. Kadar air
Ulangan 1 : (34,81 – 34,32) g x 100% = 9,78% (34,81 – 29,80) g
Ulangan 2 : (34,59 – 34,10) g x 100% = 9,78% (34,59 – 29,58) g
% Kadar air rata-rata : (9,78 + 9,78)% = 9,78% 2
b. Kadar abu
Ulangan 1 : (26,66 – 26,25) g x 100% = 8,18% (31,26 – 26,25) g
Ulangan 2 : (30,21 – 29,80) g x 100% = 8,18% (34,81 – 29,80) g
% Kadar abu rata-rata : (8,18 + 8,18)% = 8,18% 2
c. Kadar protein Ulangan 1
% N = (1,1-0)mL x 0,1002 x 14,007) x 100% = 1,53% 1,01 g
% Kadar protein = 1,53% x 6,25 = 9,55% Ulangan 2
% N = (1,2-0)mL x 0,1002 x 14,007) x 100% = 1,67% 1,01 g
% Kadar protein = 1,67% x 6,25 = 10,42% % Kadar protein rata-rata : (9,55 + 10,42)% = 9,77 %
2 d. Kadar lemak
Ulangan 1 : (74,68 – 74,47) g x 100% = 4,19% 5,01 g
Ulangan 2 : (74,36 – 74,18) g x 100% = 3,60% 5,00 g
e. Kadar serat kasar
Lampiran 3 Contoh perhitungan rendemen ekstrak Pelarut Ulangan A C : bobot botol+ekstrak (gram) a. N-heksana
% Rendemen ekstrak (U1) = 37,8821-37,1216 x 100%
50
= 1,52%
b. Etil asetat
% Rendemen ekstrak (U1) = 38,7531-37,3238 x 100%
50
= 2,85%
c. Metanol
% Rendemen ekstrak (U1) = 44,,2718-36,1325 x 100%
26
Lampiran 5 Hasil uji Duncan jenis pelarut terhadap jumlah rendemen ekstrak daun lindur
Lampiran 6 Contoh perhitungan % inhibisi dan IC50
a. Persen inhibisi dan IC50 vitamin C
Sampel Konsentrasi
Nilai IC50 untuk vitamin C adalah 6,168 ppm
b. Persen inhibisi dan IC50 ekstrak daun lindur
Ekstrak
Lampiran 7 Hasil uji ANOVA jenis pelarut terhadap aktivitas antioksidan ekstrak daun lindur
Lampiran 8 Hasil uji Duncan jenis pelarut terhadap aktivitas antioksidan ekstrak daun lindur
Pelarut N Subset for alpha = 0,05
1 2
Metanol 2 94.249950a
Etil asetat 2 127.679450ab
N-heksana 2 906.028700c
Sig. .0687 1.000
Lampiran 9 Contoh perhitungan total fenol dan kurva standar a. Kurva standar
Sampel Berat sampel
(g) Konsentrasi Absorbansi Persamaan garis
Asam galat 0,001 Between Groups 843953.668 2 421976.834 74.290 .003 Within Groups 17040.313 3 5680.104
28
b. Total fenol ekstrak
Ekstrak Berat sampel
(g) Absorbansi
Volume (mL) FP
Total fenol (mg GAE/g)
N-heksana 0,0025 0,176 2 - 12,407
Etil asetat 0,0025 0,692 2 2 97,567
Metanol 0,0024 0,410 2 - 30,074
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta tanggal 9 Mei 1992. Penulis merupakan anak kedua dari tiga bersaudara dari pasangan suami istri Sutrisno dan Lie Kui Lian. Penulis lulus dari SDN 06 Jakarta pada tahun 2004, kemudian melanjutkan pendidikan di SMP Negeri 34 Jakarta dan lulus tahun 2007. Selanjutnya penulis di terima di SMA Negeri 40 Jakarta dan ulus pada tahun 2010. Penulis diterima sebagai mahasiswa Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama kegiatan perkuliahan, penulis aktif dalam kegiatan organisasi sebagai anggota divisi keputrian LDK Al-Hurriyyah IPB (periode 2010-2011), sebagai anggota divisi Sosial Masyarakat Peduli Pangan (periode 2011-2012) Himpunan Mahasiswa Teknologi Hasil Perikanan, sebagai anggota divisi Kaderisasi PPS Betako Merpati Putih IPB (periode 201-2011), sebagai bendahara PPS Betako Merpati Putih IPB (periode 2011–2012), serta berbagai kepanitiaan lainnya. Penulis juga aktif sebagai asisten praktikum mata kuliah Pengetahuan Bahan Baku Hasil Perairan (2013-2014). Penulis telah melaksanakan praktik lapangan pada tahun 2013 di PT Madidihang Freshindo, Muara Baru, Jakarta Utara dengan judul “Penerapan Good Manufacturing Practices (GMP) pada Proses Produksi Tuna Loin Segar di PT Madidihang Freshindo, Muara Baru, Jakarta Utara” dibawah bimbingan Dr. Kustiariyah Tarman, S.Pi, M.Si