ABSTRAK
RESPON PERTUMBUHAN BIBIT KELAPA SAWIT (Elaeis guineensis Jacq.) TERHADAP PEMBERIAN LIMA ISOLAT FUNGI MIKORIZA
ARBUSKULAR DAN DUA TARAF DOSIS PUPUK NPK
Oleh
Novri Dwi Damayanti
Kelapa sawit (Elaeis guineensis Jacq.) merupakan salah satu primadona tanaman perkebunan yang memiliki arti penting bagi pembangunan perkebunan nasional dan sumber perolehan devisa negara. Budidaya tanaman kelapa sawit banyak dilakukan pada tanah ultisol yang mempunyai kendala kekahatan fosfor sehingga diperlukan perbaikan mutu di pembibitan dengan pemanfaatan fungi mikoriza arbuskular (FMA). Penelitian ini bertujuan untuk (1) menentukan jenis FMA terbaik dalam meningkatkan pertumbuhan bibit kelapa sawit, (2) menentukan dosis pupuk NPK yang paling sesuai untuk bibit kelapa sawit, (3) mengetahui apakah respons bibit kelapa sawit terhadap jenis FMA dipengaruhi oleh dosis pupuk NPK, (4) menentukan dosis pupuk NPK terbaik untuk masing-masing jenis FMA.
sp. MV 26), i3 (Entrophospora sp. MV 22), (i4) (Entrophospora sp. MV 25), i5 (Entrophospora sp. MV 28). Faktor kedua adalah dosis pupuk NPK yaitu p1 (100 % dari dosis anjuran) dan p2 (50 % dosis anjuran). Kesamaan ragam antar perlakuan diuji dengan uji Barlett dan kemenambahan data diuji dengan uji Tukey. Pemisahan nilai tengah diuji dengan uji Beda Nyata Terkecil (BNT) pada taraf nyata 5%.
RESPON PERTUMBUHAN BIBIT KELAPA SAWIT (Elaeis guineensis Jacq.) TERHADAP PEMBERIAN LIMA ISOLAT FUNGI MIKORIZA
ARBUSKULAR DAN DUA TARAF DOSIS PUPUK NPK (Skripsi)
Oleh
NOVRI DWI DAMAYANTI
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
Allah menganugrahkan al hikmah kepada siapa yang Dia kehendaki. Dan barang siapa yang dianugrahi al hikmah itu, ia benar-benar telah
dianugrahi karunia yang banyak. Dan hanya orang-orang yang berakallah yang dapat mengambil pelajaran.
(QS. Al-Baqarah : 269)
Tidak ada tujuan yang lebih besar dalam hidup daripada hidup berguna. (Benjamin Franklin)
Memotivasi diri adalah modal sebuah tindakan.
SANWACANA
Syukur Alhamdulillah penulis haturkan kepada Allah SWT yang telah memberikan rahmat, karunia, dan hidayah-Nya sehingga penelitian dan
penyusunan skripsi ini dapat berjalan dengan lancar. Dalam penulisan skripsi ini penulis banyak mendapatkan bantuan dari berbagai pihak. Dengan
diselesaikannya skripsi ini, maka penulis ingin mengucapkan terima kasih kepada:
1. Ibu Dr. Ir. Maria Viva Rini, M.Sc. dan Bapak Dr. Ir. Rusdi Evizal, M.S., selaku pembimbing I dan pembimbing II atas bimbingan, saran, nasihat, kritik arahan, motivasi, dan perhatian yang diberikan kepada penulis selama
melakukan penelitian dan penulisan skripsi ini.
2. Bapak Dr. Ir. Yafizham, M.S., selaku penguji atas segala saran, masukan, dan kritikan yang membangun dalam penulisan skripsi ini.
3. Ibu Prof. Dr. Ir. Dermiyati, M.Agr.Sc., selaku dosen pembimbing akademik yang selalu memberikan motivasi, bimbingan, masukan, dan saran kepada penulis selama menjadi mahasiswa di Universitas Lampung.
4. Bapak Dr. Ir. Kuswanta F. Hidayat, M.P., selaku Ketua Jurusan Agroteknologi Fakultas Pertanian Universitas Lampung.
iii 6. PT Malaysian Agri Hi-Tech (MAH) selaku pihak yang memberikan dana
penelitian kepada penulis.
7. Myco Family Mbak A.D. Puspitasari, S.P., Kak M.G. Warganegara, S.P. M.P., Ibu Fatmawati dan Ahmad atas bantuan dan saran selama penulis menjalankan penelitian.
8. Kedua orang tua penulis Ayahanda Sugiarto (Alm), Ibunda Sumarni dan kakak Resta Yulia Sari, S.H. dan kakak Mustopa yang telah memberikan doa dan dukungan moril maupun materi kepada penulis.
9. Sahabat - sahabatku Ni Wayan Devhi Lestari, Retta R. Rias, Resti Kartini, S.P., Ryzkita P. Pramanda, S.P., D. Fazri, A. Wulandari, dan Leny. F. Mandasari yang telah memberikan dukungan dan kebersamaan selama ini. 10. Untuk teman-teman yang telah membantu penulis dalam penelitian Debby K.
Wibowo, Diago. F. Saputra, C. Prayudha, Restu Y. A. Putra, M. H. Romli, R. Kusuma, Y.A.L.D.J. Pangaribuan, S. A. pithaloka, S.P. Ernawati , Hixkia J. Marpaung, Iyut P. Napitupulu, S.P., dan teman-teman Agroteknologi 2010. 11. Teman-teman D3 Perkebunan Ardas, Anjar, Ari, Dedik, dan Eko atas bantuan
selama penelitian.
Semoga Allah SWT membalas kebaikan yang telah diberikan kepada penulis dan penulis berharap semoga skripsi ini dapat bermanfaat. Amin.
Bandar Lampung, Oktober 2014
DAFTAR ISI
Halaman
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... ix
I. PENDAHULUAN ... 1
1.1 Latar Belakang dan Masalah ... 1
1.2 Tujuan Penelitian ... 6
1.3 Landasan Teori………... 6
1.4 Kerangka Pemikiran... 11
1.5 Hipotesis ... 16
II. TINJAUAN PUSTAKA ... 17
2.1 Informasi Umum Mengenai Kelapa Sawit ... 17
2.1.1 Morfologi Kelapa Sawit ... 18
2.1.2 Tipe Kelapa Sawit ... 21
2.1.3 Syarat Tumbuh ... 21
2.2 Fungi Mikoriza Arbuskular... 23
2.2.1 Morfologi Fungi Mikoriza Arbuskular ... 24
2.2.2 Jenis Fungi Mikoriza Arbuskular ... 26
2.3 Peranan FMA Pada Pertumbuhan Tanaman ... 30
2.4 Peranan Unsur NPK dan Gejala Kekurangan Unsur Hara... 31
III. BAHAN DAN METODE ... 33
3.1 Tempat dan Waktu Penelitian ... 33
3.2 Bahan dan Alat ... 33
3.3 Metode Penelitian ... 33
v
3.4.1 Penyemaian benih ... 36
3.4.2 Penyiapan media tanam di pre-nursery dan main nursery . 37 3.4.3 Penanaman di pre-nursery dan inokulasispora FMA ... 38
3.4.4 Penanaman di main nursery ... 39
3.4.5 Pemeliharaan tanaman ... 39
3.5 Variabel Pengamatan ... 41
IV. HASIL DAN PEMBAHASAN ... 45
4.1 Hasil Penelitian ... 45
4.1.1 Tinggi tanaman ... 46
4.1.2 Jumlah daun ... 48
4.1.3 Tingkat kehijauan daun ... 50
4.1.4 Bobot segar tajuk ... 51
4.1.5 Bobot kering tajuk ... 52
4.1.6 Bobot segar akar ... 53
4.1.7 Bobot kering akar ... 54
4.1.8 Jumlah akar primer ... 55
4.1.9 Volume akar ... 56
4.1.10 Persen infeksi akar oleh FMA ... 57
4.1.11 Jumlah spora ... 58
4.2 Pembahasan... 59
V. KESIMPULAN DAN SARAN ... 67
5.1 Kesimpulan ... 67
5.2 Saran ... 67
DAFTAR GAMBAR
Gambar Halaman
1. Bagan alir kerangka penelitian. ….. ... 15 2. Proses perkembangan spora pada Glomus (Invam, 2013). ... 27 3. Proses perkembangan spora pada Acaulospora (Invam, 2013). ... 28 4. Proses perkembangan spora pada Entrophospora (Invam, 2013). ... 28 5. Proses perkembangan spora pada Gigaspora (Invam, 2013). ... 29 6. Proses perkembangan spora pada Scutellospora (Invam, 2013). ... 30 7. Tata Letak Percobaan pada main nursery. ... 36 8. Benih kelapa sawit yang telah berkecambah/germinated seed (kiri)
dan bibit kelapa sawit berumur 4 minggu yang siap dipindahkan
ke pre-nursery (kanan) ... 37 9. Cara inokulasi spora FMA pada bibit kelapa sawit di pre nursery. .. 38 10. Alat ponjo untuk membuat lubang tanam pada main nursery. ... 38 11. Cara pemupukan pada main nursery. ... 40 12. Pengaruh perlakuan FMA terhadap peningkatan tinggi bibit kelapa
sawit pada umur 6 sampai 9 bulan setelah semai... 47 13. Pengaruh dosis pupuk NPK terhadap peningkatan tinggi bibit kelapa
sawit pada umur 6 sampai 9 bulan setelah semai... 48 14. Pengaruh perlakuan FMA terhadap peningkatan jumlah daun bibit
kelapa sawit pada umur 6 sampai 9 bulan setelah semai. ... 49 15. Pengaruh perlakuan dosis pupuk NPK terhadap peningkatan jumlah
x 16. Akar tanaman kelapa sawit yang diinokulasi
Glomus sp.Isolat MV 26. ... 62 17. Akar tanaman kelapa sawit yang tidak diinokulasi FMA. ... 62 18. Perakaran bibit kelapa sawit umur 9 bulan di nampan
I0 : tanpa inokulasi, I1 : Inokulasi Glomus sp. Isolat MV 23, I2 : Inokulasi Glomus sp. Isolat MV 26, I3 : Inokulasi Entrophospora sp. Isolat MV 22, I4 : Inokulasi Entrophospora sp. Isolat MV 25, I5 : Inokulasi Entrophospora sp. Isolat MV 28 (kiri - kanan). P1 : dosis
pupuk 100 % (atas), P2 : dosis pupuk 50 % (bawah). ... 63 19. Tanaman bibit kelapa sawit umur 9 bulan I0 : tanpa inokulasi,
I1 : Inokulasi Glomus sp. Isolat MV 23, I2 : Inokulasi Glomus sp. Isolat MV 26, I3 : Inokulasi Entrophospora sp. Isolat MV 22, I4 : Inokulasi Entrophospora sp. Isolat MV 25, I5 : Inokulasi Entrophospora sp. Isolat MV 28 (kiri - kanan). P1 : dosis pupuk
DAFTAR TABEL
Tabel Halaman
1. Deskripsi lima jenis fungi mikoriza arbuskular yang digunakan pada
penelitian. ….. ... 35 2. Jenis dan dosis pupuk yang digunakan dalam penelitian. ... 41 3. Rekapitulasi analisis ragam data penelitian. . ... 45 4. Kombinasi perlakuan jenis FMA dan dosis pupuk NPK pada tinggi
tanaman bibit kelapa sawit umur 9 bulan. ... 47
5. Pengaruh perlakuan FMA dan dosis pupuk NPK pada jumlah daun
bibit kelapa sawit umur 9 bulan. . ... 49 6. Pengaruh perlakuan FMA dan dosis pupuk NPK pada tingkat
kehijauan daun bibit kelapa sawit umur 9 bulan. . ... 51 7. Pengaruh perlakuan FMA dan dosis pupuk NPK pada bobot segar
tajuk bibit kelapa sawit umur 9 bulan. ... 52 8. Pengaruh perlakuan FMA dan dosis pupuk NPK pada bobot kering
tajuk bibit kelapa sawit umur 9 bulan. ... 53 9. Pengaruh perlakuan FMA dan dosis pupuk NPK pada bobot segar
akar bibit kelapa sawit umur 9 bulan. ... 53 10. Pengaruh kombinasi perlakuan FMA dan dosis pupuk NPK pada
bobot kering akar bibit kelapa sawit umur 9 bulan. ... 55 11. Pengaruh kombinasi perlakuan FMA dan dosis pupuk NPK pada
jumlah akar primer bibit kelapa sawit umur 9 bulan. ... 56 12. Pengaruh perlakuan FMA dan dosis pupuk NPK pada volume akar
bibit kelapa sawit umur 9 bulan. . ... 57 13. Pengaruh perlakuan FMA dan dosis pupuk NPK pada persen infeksi
vii 14. Pengaruh perlakuan FMA dan dosis pupuk NPK terhadap jumlah
spora pada media tanah bibit kelapa sawit umur 9 bulan yang
ditransformasi dengan x+0,5 dan didetransformasi x2– 0,5. ... 59
15. Rekapitulasi uji Bartlett untuk homogenitas ragam antarperlakuan. . 73
16. Rekapitulasi uji nonaditivitas. ... 73
17. Data tinggi bibit kelapa sawit umur 9 bst. ... 74
18. Analisis ragam untuk tinggi tanaman bibit kelapa sawit. ... 74
19. Data jumlah daun bibit kelapa sawit umur 9 bst. ... 75
20. Analisis ragam untuk jumlah daun bibit kelapa sawit. ... 75
21. Data tingkat kehijauan daun bibit kelapa sawit umur 9 bst. ... 76
22. Analisis ragam untuk tingkat kehijauan daun bibit kelapa sawit. ... 76
23. Data bobot segar tajuk bibit kelapa sawit umur 9 bst. ... 77
24. Analisis ragam untuk bobot segar tajuk bibit kelapa sawit. ... 77
25. Data bobot kering tajuk bibit kelapa sawit umur 9 bst. ... 78
26. Analisis ragam untuk bobot kering tajuk bibit kelapa sawit. ... 78
27. Data bobot segar akar bibit kelapa sawit umur 9 bst. ... 79
28. Analisis ragam untuk bobot segar akar bibit kelapa sawit. ... 79
29. Data bobot kering akar bibit kelapa sawit umur 9 bst. ... 80
30. Analisis ragam untuk bobot kering akar bibit kelapa sawit. ... 80
31. Data jumlah akar primer bibit kelapa sawit umur 9 bst. ... 81
32. Analisis ragam untuk jumlah akar primer bibit kelapa sawit. ... 81
33. Data volume akar bibit kelapa sawit umur 9 bst. ... 82
34. Analisis ragam untuk volume akar bibit kelapa sawit. ... 82
35. Data persen infeksi akar bibit kelapa sawit umur 9 bst. ... 83
viii 37. Data jumlah spora pada media bibit kelapa sawit umur 9 bst. ... 84 38. Data jumlah spora pada media bibit kelapa sawit umur 9 bst
yang ditransformasi x + 0,5. ... 85 39. Analisis ragam untuk jumlah spora pada media bibit kelapa sawit
i Kupersembahkan karya ini untuk orang-orang yang kusayangi,
Bapak Sugiarto (Alm) dan Ibu Sumarni, Kakak ku Resta Yulia Sari, S.H yang senantiasa memberi doa, semangat, dan cinta yang tiada pernah berakhir,
RIWAYAT HIDUP
Penulis lahir di Bandar Lampung, pada tanggal 22 November 1992 sebagai merupakan anak kedua dari dua bersaudara pasangan Bapak Sugiarto (Alm) dan Ibu Sumarni.
Penulis mengawali pendidikan formal pada tahun 1997 di Taman kanak - kanak TK Kartika II - 6. Tahun 1998 melanjutkan pendidikan di Sekolah Dasar Kartika II - 5. Kemudian penulis melanjutkan pendidikan ke Sekolah Menengah Pertama Negeri 29 Bandar Lampung pada tahun 2004. Pada tahun 2007, penulis
melanjutkan pendidikan di Sekolah Menengah Atas Negeri 12 Bandar Lampung. Pada tahun 2010, penulis terdaftar sebagai mahasiswa Jurusan Agroteknologi Fakultas Pertanian Universitas Lampung melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN).
Selama menjadi mahasiswa, penulis melaksanakan kegiatan Kuliah Kerja Nyata (KKN) Tematik di desa Umpu Kencana, Blambangan Umpu, Kabupaten Way Kanan pada bulan Januari 2013. Pada bulan Juli 2013 penulis melaksanakan Praktik Umum di PT Perkebunan Nusantara VII Unit Usaha Bergen, Tanjung Bintang, Lampung Selatan dengan judul “ Manajemen Pemeliharaan Tanaman
keorganisasian mahasiswa di Lembaga Studi Mahasiswa Pertanian (LS MATA) Fakultas Pertanian Universitas Lampung. Penulis juga pernah menjadi asisten dosen untuk mata kuliah Pembibitan Karet pada tahun 2013, mata kuliah Pengantar Produksi Perkebunan dan Produksi Tanaman Penghasil Getah, Gula dan Bahan Penyegar pada tahun 2014.
I. PENDAHULUAN
1.1 Latar Belakang dan Masalah
Kelapa sawit (Elaeis guineensis Jacq.) merupakan salah satu primadona tanaman perkebunan yang memiliki prospek pengembangan cukup cerah. Kelapa sawit menghasilkan minyak sawit dan inti sawit yang dimanfaatkan sebagai minyak pangan, minyak industri, maupun bahan bakar nabati (biodiesel). Minyak kelapa sawit menghasilkan produk yang kaya manfaat di berbagai industri, bahkan limbahnya masih dapat dimanfaatkan untuk industri kosmetik, oleokimia, hingga pakan ternak (Fauzi et al., 2012).
Bagi Indonesia, tanaman kelapa sawit memiliki arti penting bagi pembangunan perkebunan nasional. Selain mampu menciptakan kesempatan kerja juga sebagai sumber perolehan devisa negara. Indonesia merupakan salah satu produsen utama minyak sawit, bahkan saat ini telah menempati posisi kedua di dunia setelah Malaysia. Indonesia memiliki luas areal kelapa sawit terbesar di dunia, yaitu sebesar 34,18% dari luas kelapa sawit dunia (Fauzi et al., 2012).
2
tanaman penghasil minyak nabati, kelapa sawit merupakan tanaman dengan potensi produksi minyak tertinggi, dan (3) semakin berkembangnya jenis-jenis industri hulu pabrik kelapa sawit maupun industri hilir oleokimia dan
oleomakanan (oleochemical dan oleofoods), hingga industri konversi minyak sawit sebagai bahan bakar biodiesel. Cerahnya prospek komoditi minyak kelapa sawit dalam perdagangan minyak nabati dunia telah mendorong pemerintah Indonesia untuk memacu pengembangan areal perkebunan kelapa sawit (Kementerian Pertanian, 2010).
Pada tahun 2012, luas perkebunan kelapa sawit di Indonesia mencapai ± 9.074.621 ha dan total produksi ± 23.521.071 ton TBS (tandan buah segar). Sedangkan di Provinsi Lampung sampai tahun 2012, luas perkebunan kelapa sawit mencapai ± 153.160 ha dan total produksi ± 401.952 ton TBS dengan sebagian besar jenis tanah di Lampung adalah Podsolik Merah Kuning (PMK) seluas 1.522.336 ha (Direktorat Jenderal Perkebunan, 2012).
3
dalam tanah ultisol mempunyai kemampuan menyemat fosfat cukup tinggi, sehingga sebagian besar fosfat dalam keadaan tersemat oleh Al dan Fe, tidak tersedia bagi tanaman maupun biota tanah.
Untuk mengatasi permasalahan budidaya tanaman kelapa sawit pada tanah ultisol diperlukan pengembangan teknologi yang dilakukan dengan perbaikan mutu tanaman di pembibitan. Kegiatan pembibitan berperan sangat penting dalam menghasilkan tanaman kelapa sawit yang baik dan bermutu. Salah satunya adalah dengan pemanfaatan mikroorganisme tanah berupa fungi mikoriza yang dapat bekerja sama dengan akar tanaman dalam menyerap unsur hara dan air.
Mikoriza merupakan suatu bentuk asoasiasi mutualisme antara cendawan (myces) dan perakaran (rhiza) tumbuhan tingkat tinggi. Berdasarkan struktur tubuhnya dan cara infeksi terhadap tanaman inang, mikoriza dapat dikelompokkan ke dalam 3 golongan besar yaitu Endomikoriza, Ektomikoriza, dan Ektendomikoriza
(Kabirun dan Widada, 1994). Fungi yang tergabung ke dalam endomikoriza banyak mendapat perhatian karena penyebarannya lebih luas dan dapat berasosiasi dengan hampir 90% spesies tanaman tingkat tinggi. Salah satu jenis fungi
endomikoriza yang banyak diteliti adalah fungi mikoriza arbuskular (FMA) (Cruz, Ishii dan Kadoya, 2000).
4
terhadap kekeringan, logam berat Al dan Fe, dan meningkatkan serapan hara terutama unsur hara P (Setiadi et al., 2003). Untuk mempelajari potensi suatu organisme, hal pertama yang harus diketahui adalah melihat keanekaragaman organisme tersebut. Dengan adanya data tentang keanekaragaman FMA dapat dilakukan seleksi untuk mendapatkan isolat FMA yang potensial dan efektif.
Keanekaragaman dan penyebaran mikoriza sangat bervariasi, hal ini dapat disebabkan oleh kondisi lingkungan yang bervariasi juga. Eksplorasi jenis-jenis FMA pada daerah pertanaman kelapa sawit merupakan studi awal yang penting dan diperlukan untuk dapat mengidentifikasi jenis-jenis FMA dominan dan spesifik yang ada. Setiap jenis FMA mungkin berbeda-beda dalam
kemampuannya membentuk hifa di dalam tanah, baik distribusi maupun kuantitasnya yang berhubungan dengan kemampuan dalam meningkatkan pertumbuhan tanaman (Delvian, 2003 yang dikutip oleh Hartoyo et al., 2011). Keberadaan dan keberagaman FMA pada rizosfer kelapa sawit belum cukup memberikan gambaran peran FMA, perlu dilakukan uji lanjut untuk mengetahui jenis FMA yang kompatibel dan efektif untuk meningkatkan pertumbuhan kelapa sawit.
5
oleh Kartika, 2012). Perbedaan jenis tanah, tekstur, serta jarak dari garis pantai menyebabkan perbedaan keanekaragaman spesies dan populasi fungi mikoriza, misalnya pada tanah dengan fraksi lempung berdebu merupakan tanah yang baik bagi perkembangan Glomus sp. Pada tanah mangrove yang bercirikan tanah berlumpur dan cenderung liat hanya Glomus sp. yang dapat hidup, sedangkan tanah yang berpasir genus Acaulospora sp. dan Gigaspora sp. ditemukan dalam jumlah yang tinggi (Siradz dan Kabirun, 2007).
Selain itu juga, aktivitas dan perkembangan fungi mikoriza sangat dipengaruhi oleh tingkat pemupukan fosfat. Penambahan pupuk fosfat dapat menurunkan aktivitas fungi mikoriza dan berpengaruh positif terhadap pertumbuhan tanaman, karena pupuk mempunyai pengaruh yang lebih cepat terhadap pertumbuhan daripada infeksi mikoriza (White, 1989 yang dikutip Zulaikha dan Gunawan 2006).
Berdasarkan latar belakang dan masalah yang telah diajukan maka dilaksanakan suatu penelitian untuk menjawab masalah yang dirumuskan dalam pertanyaan sebagai berikut :
1. Jenis FMA mana yang paling baik dalam meningkatkan pertumbuhan bibit kelapa sawit?
2. Dosis NPK manakah yang paling sesuai digunakan untuk pertumbuhan bibit kelapa sawit?
6
4. Berapakah dosis NPK yang terbaik untuk masing-masing jenis FMA yang digunakan?
1.2 Tujuan Penelitian
Berdasarkan identifikasi dan perumusan masalah, tujuan penelitian dirumuskan sebagai berikut :
1. Menentukan jenis FMA terbaik dalam meningkatkan pertumbuhan bibit kelapa sawit.
2. Menentukan dosis NPK yang paling sesuai untuk bibit kelapa sawit.
3. Mengetahui apakah respons bibit kelapa sawit terhadap jenis FMA dipengaruhi oleh dosis pupuk NPK.
4. Menentukan dosis NPK terbaik untuk masing-masing jenis FMA.
1.3 Landasan Teori
Dalam rangka menyusun penjelasan teoretis terhadap pertanyaan yang telah dikemukakan, digunakan landasan teori sebagai berikut.
7
makro seperti N, P, K, Ca, dan Mg; unsur hara mikro Zn, Mo, Cu, dan B, serta bahan organik.
Menurut Tisdale, Nelson, dan Beaton (1995) yang dikutip oleh Wachjar (2002), tingginya biaya pemupukan bagi kelapa sawit (berkisar 20-60% dari biaya pemeliharaan kebun) mendorong upaya untuk mencari cara supaya
mengefisienkan pemupukan agar biaya produksi dapat dikurangi. Salah satunya adalah penemuan di bidang bioteknologi dalam pemanfaatan fungi mikoriza. Hubungan simbiosis mutualisme antara fungi (mykes) dan perkaran (rhiza) tumbuhan tinggi ini diketahui mampu memberikan sejumlah keuntungan bagi tanaman inang dan yang terpenting adalah peranannya dalam membantu tanaman menyerap unsur hara terutama hara fosfor.
8
Menurut Smith dan Read (2008), terdapat tiga mekanisme FMA dalam meningkatkan serapan P, yaitu (1) modifikasi kimia oleh FMA terhadap akar tanaman sehingga FMA dapat mengeluarkan enzim fosfatase dan asam-asam organik; (2) dengan adanya hifa eksternal FMA, jarak difusi ion-ion fosfat tersebut dapat diperpendek sehingga proses difusi menjadi lebih cepat; dan (3) kemampuan hifa FMA untuk tumbuh melampaui zona deplesi dan
mendistribusikan P ke akar merupakan efek positif terhadap serapan P dan pertumbuhan tanaman. Proses ini terjadi karena aktifitas hifa eksternal yang tinggi sehingga terjadi peningkatan daya tarik-menarik ion-ion fosfat yang menyebabkan pergerakan P lebih cepat ke dalam hifa FMA.
Fungi mikoriza arbuskular (FMA) termasuk dalam golongan endomikoriza
dengan klasifikasi termasuk ke dalam filum Glomeromycota. FMA mempunyai 4 ordo, yaitu ordo Glomerales, Diversisporales, Archaeosporales, dan
Paraglomerales. Ordo Glomales mempunyai satu famili yaitu Glomaceae dengan genus Glomus. Ordo Diversisporales mempunyai 4 famili yaitu famili
Acaulosporaceae dengan genus Acaulospora dan Entrophospora, famili Gigasporacea dengan genus Gigaspora dan Scutellospora, famili
Diversisporaceae dengan genus Diversispora (Glomus), dan famili Pacisporaceae dengan genus Pacispora. Ordo Archaeosporales mempunyai 2 famili yaitu famili Archaeosporaceae dengan genus Archaeospora dan famili Geosiphonaceae
9
Hasil penelitian Musfal (2010), memperlihatkan bahwa pemberian FMA pada
tanaman jagung dapat meningkatkan serapan P oleh tanaman, bobot kering
tanaman, hasil pipilan kering jagung, dan dapat mengefisienkan penggunaan
pupuk hingga 50%. Penggunaan FMA dapat meningkatkan produksi kedelai di
lahan kering (Hapsoh, 2008). Hasil penelitian menunjukkan bahwa dalam
simbiosisnya dengan tanaman kelapa sawit, fungi ini dapat meningkatkan serapan P baik melalui perbaikan sistem perakaran tanaman sawit maupun melalui
aktifitasnya dalam memineralisasi P organik tanah. Percobaan di kebun kelapa sawit Cimulang dan Sukamaju PTPN VIII juga menunjukkan bahwa inokulasi FMA dapat mengurangi pupuk 75% untuk menghasilkan pertumbuhan yang sama dengan metode standar pembibitan (Widiastusi et.al., 2006 yang dikutip oleh Widiastusi dan Rostiwati 2011).
Inokulasi FMA pada kelapa sawit dapat meningkatkan efisiensi pemupukan, pertumbuhan, dan serapan hara. Keefektifan inokulasi untuk setiap jenis FMA pada bibit kelapa sawit belum diketahui secara pasti. Keefektifan inokulasi FMA salah satunya dipengaruhi oleh jumlah inokulum. Hasil yang diperoleh
10
Berdasarkan hasil penelitian Prasetyo (2012), diketahui bahwa waktu inokulasi spora FMA saat bibit berumur 1 bulan merupakan waktu terbaik dalam
meningkatkan pertumbuhan bibit kelapa sawit yang ditunjukkan oleh tingginya bobot segar tajuk, bobot kering tajuk, dan tinggi tanaman. Hal itu berhubungan erat dengan mulai terjadinya infeksi FMA pada akar bibit kelapa sawit sehingga penyerapan hara dan air lebih optimal. Infeksi awal dapat terjadi lebih optimal pada bibit berumur 1 bulan karena sudah terbentuknya akar sekunder.
Keanekaragaman dan penyebaran mikoriza sangat bervariasi, hal ini dapat disebabkan oleh kondisi lingkungan yang bervariasi juga. Semua mikoriza tidak mempunyai sifat morfologi dan fisiologi yang sama, oleh karena itu sangat penting untuk mengetahui identitasnya (Puspitasari et.al , 2012). Species dan strain mempunyai perbedaan didalam meningkatkan penyerapan nutrient dan pertumbuhan tanaman. Hal ini menyebabkan dilakukannya penelitian untuk mengetahui spesies atau strain mana yang unggul dibandingkan dengan strain yang lain untuk tanaman tertentu. Setiap spesies mempunyai “innate
effectiveness”. Spesies yang paling efektif meningkatkan pertumbuhan adalah
yang paling cepat dan efektif didalam infeksinya (Suhardi, 1988).
11
Glomus sp. berkecambah lebih cepat daripada spora Entrophospora sp. Menurut Tawaray et al. (1996) yang dikutip oleh Widiastuti et al. (2005) spora beberapa spesies Acaulospora sp. dan Entrophospora sp. memerlukan waktu tiga bulan untuk berkecambah. Hasil penelitian yang dilakukan oleh Irawan (2011) menunjukkan bahwa Glomus sp. telah mampu menginfeksi bibit kelapa sawit 2 minggu setelah inokulasi.
Perkembangan FMA sangat dipengaruhi oleh ketersediaan hara tanah.
Perkembangan FMA terhambat jika kandungan nitrogen dan fosfor tanah tinggi. Pada kondisi tanah yang subur, perkecambahan spora agak terhambat karena adanya kemungkinan kegiatan mikroba di dalam tanah akan mengakibatkan penguraian dinding spora atau hyperparasitis pada spora FMA, akibatnya akan mengurangi kemampuan berkecambah dari spora. Selain itu, pH juga merupakan pengendali penting perkembangan FMA karena mempengaruhi ketersediaan dan keracunan unsur hara (Suhardi, 1988).
1.4 Kerangka Pemikiran
Berdasarkan landasan teori yang telah dikemukakan, berikut ini disusun kerangka pemikiran untuk memberikan penjelasan teoretis terhadap perumusan masalah. Fungi mikoriza Arbuskular (FMA) merupakan salah satu fungi yang dapat bersimbiosis mutualisme dengan akar tanaman. Jika inokulum FMA
12
Mekanisme simbiosis berawal ketika spora berkecambah dan mengeluarkan hifa yang kemudian masuk ke dalam akar kemudian akar tanaman akan mengeluarkan eksudat berupa gula, asam organik, dan asam amino yang berfungsi sebagai sumber makanan bagi FMA untuk pertumbuhan hifa yang tumbuh dari spora. Hifa akan terus tumbuh membentuk apresorium, kemudian menembus sel epidermis akar dan selanjutnya berkembang dalam jaringan korteks. Hifa yang masuk ke dalam sel akan terus bercabang secara dikotomi disebut arbuskular, sementara hifa yang berkembang pada ruang antar sel ada yang menggelembung membentuk vesikel yang berisi cadangan makanan untuk perkembangan FMA.
Selain membentuk hifa internal, FMA membentuk hifa eksternal yang berperan dalam meningkatkan kapasitas akar untuk meningkatkan serapan air dan unsur hara. Kemampuan asosiasi tanaman dengan FMA ini memungkinkan tanaman memperoleh hara dan air yang cukup pada kondisi lingkungan yang miskin unsur hara dan kering, perlindungan terhadap patogen tanah maupun unsur hara
beracun, dan secara tidak langsung melalui perbaikan struktur tanah.
13
oleh tanaman. Dengan adanya hifa eksternal ini penyerapan hara terutama fosfor menjadi lebih besar dibandingkan dengan tanaman yang tidak terinfeksi dengan mikoriza, sehingga pertumbuhan tanaman yang bermikoriza lebih baik
dibandingkan yang tidak bermikoriza.
Terjadinya infeksi FMA pada akar tanaman dipengaruhi oleh beberapa hal, yaitu kecocokan jenis FMA dengan tanaman inang, kondisi jaringan akar tanaman, dan faktor lingkungan. Kecocokan jenis FMA dengan tanaman inang berhubungan erat dengan eksudat akar yang disekresikan oleh tanaman. Kondisi jaringan akar tanaman berhubungan dengan kelunakan epidermis.
Beberapa penelitian menguji keefektifan beberapa spesies fungi mikoriza pada beberapa jenis tanaman menunjukkan bahwa terdapat kesesuaian antara spesies fungi mikoriza dengan tanaman inang tertentu. Adanya adaptasi yang tinggi FMA jenis Glomus sp. dan kecenderungannya untuk bersimbiosis dengan akar kelapa sawit, menyebabkan spora FMA ini dapat berkecambah dan menginfeksi jaringan akar yang lebih baik daripada FMA jenis Entropospora sp. Selain jenis FMA, daerah asal FMA juga mempengaruhi keberhasilan inokulasi. Penggunaan jenis FMA yang berasal dari daerah Lampung dapat lebih baik dibandingkan jenis FMA yang berasal dari daerah Sumatera Utara dan Jawa Timur karena daya adaptasi terhadap lingkungan lebih sesuai sehingga spora FMA asal Lampung dapat lebih cepat berkecambah dan menginfeksi jaringan akar.
Penelitian mengenai dosis pemupukan NPK sudah banyak dilakukan. Pada umumnya dosis pemupukan NPK 100% sesuai dengan dosis anjuran
14
akar diharapkan dapat menguntungkan pertumbuhan bibit kelapa sawit. Fungi mikoriza arbuskular akan mendapatkan fotosintat dari eksudat akar, sedangkan bibit kelapa sawit dapat memperbaiki sistem perakaran karena pada akar terdapat jaringan hifa eksternal FMA yang akan memperluas bidang serapan air dan unsur hara. Ukuran hifa yang lebih halus dari bulu-bulu akar memungkinkan hifa bisa menyusup ke pori-pori tanah yang paling kecil (mikro) sehingga hifa dapat menyerap air pada kondisi tanah yang rendah dan keberadaan unsur hara P yang jauh dari jangkauan akar akan lebih mudah dimobilisasi di daerah perakaran. Sedangkan pada kondisi unsur hara P yang cukup akar tanaman mengakumulasi P dalam jumlah yang tinggi, FMA mendapatkan senyawa C dari tanaman yang mempengaruhi metabolisme tanaman sehingga inokulasi FMA dapat
meningkatkan efisiensi pemupukan sampai 50 % dari dosis anjuran.
15
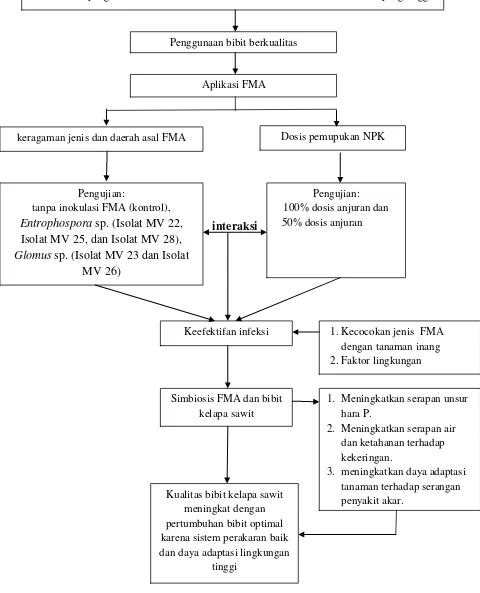
[image:35.595.69.549.114.707.2]interaksi
Gambar 1. Bagan alir kerangka penelitian
Produksi kelapa sawit di Indonesia rendah karena banyak ditanam pada tanah marginal atau tanah ultisol yang memiliki ketersediaan fosfor rendah dan kelarutan Al dan Fe yang tinggi.
Penggunaan bibit berkualitas
Aplikasi FMA
keragaman jenis dan daerah asal FMA Dosis pemupukan NPK
Pengujian:
tanpa inokulasi FMA (kontrol), Entrophospora sp. (Isolat MV 22,
Isolat MV 25, dan Isolat MV 28), Glomus sp. (Isolat MV 23 dan Isolat
MV 26)
Pengujian: 100% dosis anjuran dan 50% dosis anjuran
Keefektifan infeksi
Simbiosis FMA dan bibit kelapa sawit
1.Kecocokan jenis FMA dengan tanaman inang 2.Faktor lingkungan
1. Meningkatkan serapan unsur hara P.
2. Meningkatkan serapan air dan ketahanan terhadap kekeringan.
3. meningkatkan daya adaptasi tanaman terhadap serangan penyakit akar.
Kualitas bibit kelapa sawit meningkat dengan pertumbuhan bibit optimal karena sistem perakaran baik dan daya adaptasi lingkungan
16
1.5 Hipotesis
Dari kerangka pemikiran yang telah dikemukakan dapat disimpulkan hipotesis sebagai berikut:
1. FMA jenis Glomus sp. menghasilkan pertumbuhan bibit kelapa sawit terbaik. 2. Dosis NPK yang sesuai untuk bibit kelapa sawit adalah dosis pupuk yang
diberikan sesuai dengan dosis anjuran.
3. Respons bibit kelapa sawit terhadap pemberian FMA ditentukan oleh dosis pemupukan.
II. TINJAUAN PUSTAKA
2.1 Informasi Umum Mengenai Kelapa Sawit
Klasifikasi tanaman kelapa sawit menurut Pahan (2012): Divisi : Embryophyta Siphonagama
Kelas : Angiospermae Ordo : Monocotyledonae
Famili : Arecaceae (dahulu disebut Palmae) Subfamili : Cocoideae
Genus : Elaeis
Spesies : 1. E. guineensis Jacq.
2. E. oleifera (H.B.K) Cortes 3. E. odora
18
tanaman kelapa sawit. Schadt mendirikan perusahhan perkebunan kelapa sawit di Tanah Ulu (Deli), sedangkan Hallet mendirikan perkebunan di daerah Pulau Raja (Asahan) dan Sungai Liput (Aceh). Sejak itulah, mulai dibuka perkebunan-perkebunan baru. Pada tahun 1938, di Sumatera diperkirakan sudah ada 90.000 ha perkebunan sawit (Pahan, 2012).
2.1.1 Morfologi Kelapa Sawit
a. Akar
Sistem perakaran kelapa sawit merupakan sistem akar serabut. Akar kelapa sawit terdiri dari akar primer, sekunder, tersier dan kuarter. Akar primer adalah akar yang tumbuh langsung dari pangkal batang dengan diameter 5-10 mm. Akar sekunder adalah akar yang tumbuh dari akar primer dengan arah tumbuhnya mendatar maupun ke bawah, berdiameter 1-4 mm. Akar tersier adalah akar yang tumbuh dari akar sekunder dengan arah tumbuhnya mendatar, panjang mencapai 15 cm, berdiameter 0,5-1,5 mm. Akar kuarter adalah akar yang tumbuh dari akar tersier dengan diameter 0,2-0,5 mm dan panjangnya rata-rata 3 cm. Akar tersier dan kuarter inilah yang paling aktif mengambil hara dan air dari dalam tanah (Setyamidjaja, 2006).
b. Batang
19
setelah berumur 4 tahun. Tinggi batang bertambah 25-75 cm/tahun. Jika kondisi lingkungan sesuai, pertambahan tinggi batang dapat mencapai 100 cm/tahun. Pertumbuhan batang tergantung pada jenis tanaman, kesuburan lahan, dan iklim setempat (Fauzi et al., 2012).
c. Daun
Daun-daun membentuk suatu pelepah yang panjangnya dapat mencapai kurang lebih 7,5–9 m. Daun muda yang masih kuncup berwarna kuning pucat. Pada tanah-tanah yang subur daun akan cepat membuka yang berarti makin efektif menjalankan fungsinya sebagai tempat berlangsungnya fotosintesis dan alat respirasi (Fauzi et al., 2012).
Pada tanaman dewasa ditemukan 40-50 pelepah. Jumlah kedudukan pelepah daun pada batang kelapa sawit disebut juga filotaksis yang dapat ditentukan
berdasarkan perhitungan susunan duduk daun, yaitu dengan menggunakan rumus duduk daun 1/8 yaitu setiap satu kali berputar melingkari batang terdapat duduk pelepah sebanyak delapan helai. Pertumbuhan pelepah daun mengarah ke kanan atau ke kiri menyerupai spiral (Fauzi et al., 2012).
d. Bunga
20
cabang, dan setiap cabang terdapat paling banyak 30 bunga betina. Dalam satu tandan terdapat 3000-6000 bunga betina. Bunga betina yang memiliki tiga putik dan 6 perhiasan bunga. Bunga jantan maupun bunga betina biasanya terbuka dalam 2 hari, kecuali pada musim hujan bunga akan mekar bisa sampai 4 hari. Tepung sari dapat menyerbuki selama 2-3 hari, tetapi makin lama daya hidupnya (viabilitas) makin menurun (Setyamidjaja, 2006).
Letak bunga jantan yang satu dengan yang lainnya dalam tandan bunga jantan sangat rapat dan membentuk cabang-cabang bunga yang panjangnya antara 10-20 cm. Pada tanaman dewasa, satu tandan mempunyai ± 200 cabang bunga. Setiap cabang mengandung 700-1200 bunga jantan. Bunga jantan ini terdiri dari 6 helai benang sari dan 6 perhiasan bunga. Tepung sari berwarna kuning pucat dan berbau spesifik. Satu tandan bunga jantan dapat menghasilkan 25-300 gr tepung sari (Setyamidjaja, 2006).
e. Buah
21
inti lebih baik daripada minyak yang terkandung dalam pericarp (Setyamidjaja, 2006).
2.1.2 Tipe Kelapa Sawit
Menurut Fauzi et al. (2012), kelapa sawit berdasarkan ketebalan tempurung dan daging buahnya dibagi menjadi 3 jenis, yaitu: (1) jenis Dura yang memiliki tempurung tebal (2-8 mm), daging buah relatif tipis (35-50% dari buah) dan kernel besar dengan kandungan minyak rendah. Dalam persilangan, jenis dura ini digunakan sebagai pohon induk betina; (2) jenis Pisifera memiliki tempurung sangat tipis (bahkan hampir tidak ada). Berbeda dengan jenis dura, daging buah pisifera lebih tebal. Jenis pisifera tidak dapat diperbanyak tanpa menyilangkan dengan jenis lain karena bunga betinanya steril. Dalam persilangan, jenis pisifera ini digunakan sebagai pohon induk jantan; (3) jenis Tenera merupakan hasil persilangan antara Dura dan Pisifera. Tenera mempunyai tempurung tipis (0,5-4 mm), daging buah sangat tebal (60-96% dari buah), dan tandan buah lebih banyak, tetapi ukurannya relatif lebih kecil. Hasil persilangan ini telah terbukti memiliki kualitas dan kuantitas yang lebih baik dibandingkan dengan jenis lainnya.
2.1.3 Syarat Tumbuh
22
mempengaruhi adalah curah hujan, sinar matahari, suhu, kelembaban udara, dan angin.
Curah hujan optimum rata-rata yang diperlukan tanaman kelapa sawit adalah 2000 – 2500 mm/tahun dengan distribusi merata sepanjang tahun tanpa bulan kering (defisit air) yang berkepanjangan. Namun, yang terpenting adalah tidak terjadi defisit air di atas 250 mm. Tanaman kelapa sawit memerlukan intensistas cahaya yang tinggi untuk berfotosintesis, kecuali saat kondisi tanaman masih muda di pre-nursery. Lama penyinaran yang optimum yang diperlukan tanaman kelapa sawit antara 5-12 jam. Suhu optimum yang dibutuhkan agar tanaman kelapa sawit dapat tumbuh dengan baik adalah 24-28⁰C. Beberapa faktor yang mempengaruhi tinggi rendah suhu adalah lama penyinaran dan ketinggian tempat (Fauzi et al., 2012).
Kelembaban udara dan angin adalah faktor penting yang menunjang pertumbuhan kelapa sawit. Kelembaban optimum bagi pertumbuhan kelapa sawit adalah 80%. Sedangkan angin yang kering menyebabkan penguapan lebih besar, mengurangi kelembaban, dan dalam waktu lama mengakibatkan tanaman layu (Fauzi et al., 2012).
Tanaman kelapa sawit dapat tumbuh secara baik pada berbagai jenis tanah, seperti Podsolik (Ultisol), Latosol, Hidromorfik Kelabu, Regosol, Andosol, dan tanah Alluvial. Beberapa hal yang menentukan sifat tanah adalah tekstur,
23
tebal sekitar 80 cm, tanpa lapisan tanah yang keras (padas). Tekstur tanah ringan dengan kandungan pasir 20-60%, debu 100-40%, dan liat 20-50% (Fauzi et al., 2012).
Sifat kimia tanah dapat dilihat dari keasaman dan komposisi kandungan hara mineralnya. Kelapa sawit dapat tumbuh pada pH tanah 4,0 - 6,5; sedangkan pH optimumnya adalah 5-5,5. Tanaman kelapa sawit tumbuh baik pada tanah yang memiliki kandungan unsur hara yang tinggi, dengan C/N mendekati 10 (Fauzi et al., 2012).
2.2 Fungi Mikoriza Arbuskular
Mikoriza adalah suatu bentuk asosiasi simbiotik antara akar tumbuhan tingkat tinggi dan miselium fungi tertentu. Nama mikoriza pertama kali dikemukakan oleh ilmuwan Jerman Frank pada tanggal 17 April 1885.
24
terhadap kekeringan dan serangan patogen. Ericoid mikoriza dijumpai berasosiasi pada tanaman ordo Ericales. Mikoriza pada tanaman anggrek berperan
menyediakan karbon dan vitamin untuk perkembangan embrio karena biji yang kecil dengan sedikit cadangan makanan. Jenis ektendomikoriza berasosiasi dengan sebagian besar Gimnospermae.
2.2.1 Morfologi Fungi Mikoriza Arbuskular
Fungi mikoriza arbuskular membentuk organ-organ khusus dan mempunyai fungsi yang spesifik. Perkembangan kolonisasi FMA dimulai dengan
pembentukan suatu apresorium. Apresorium merupakan struktur penting dalam siklus hidup FMA. Hal ini diinterpretasikan sebagai kejadian kunci bagi
pengenalan interaksi yang berhasil dengan bakal calon tanaman inang. Fase kontak akan diikuti dengan fase simbiotik. Sejak fase itu, fungi menyempurnakan proses morfogenesis kompleks dengan memproduksi hifa interseluler dan
intraseluler, vesikel, dan arbuskular. Struktur utama FMA adalah arbuskular, vesikel, hifa eksternal dan spora (Dewi, 2007).
25
menyebabkan terjadinya peningkatan sitoplasma, respirasi, dan aktivitas enzim pada kedua organisme tersebut sehingga tanaman/inang akan dapat memanfaatkan fosfor dari fungi dan sebaliknya fungi endomikoriza mengabsorbsi glukosa dan karbon dari inangnya.
Vesikel merupakan hifa fungi endomikoriza yang mengalami penggembungan (melebar). Penggembungan hifa bisa terjadi secara internal di dalam sel atau keluar dari sel akar inang yang terbentuk pada hifa terminus dan interkalar. Bentuk vesikel adalah bulat atau oval/lonjong, berisi senyawa lemak sehingga vesikel merupakan organ penyimpanan cadangan makanan bagi fungi
endomikoriza (Brundrett et al., 2008). Pada kondisi tertentu, vesikel yang telah dewasa dapat berperan sebagai spora atau alat pertahanan fungi tersebut jika berada pada lingkungan yang tidak menguntungkan (Pattimahu, 2004).
26
Spora terdapat pada ujung hifa eksternal dan dapat hidup selama berbulan-bulan, bahkan bertahun-tahun. Spora-spora endomikoriza mampu bertahan di dalam tanah tanpa inang sampai 6 bulan bahkan beberapa spesies seperti Scutelospora sp, Gigaspora sp. dapat bertahan sampai satu–dua tahun (Brundrett et al., 2008). Spora-spora yang dihasilkan secara aseksual maupun seksual pada prinsipnya merupakan salah satu bentuk atau alat pertahanan diri di alam yang dapat berfungsi untuk proses adaptasi terutama apabila mikoriza tersebut belum menemukan tanaman inang yang kompatibel (Smith and Read, 2008).
Hifa eksternal merupakan struktur lain dari FMA yang berkembang di luar akar. Hifa ini berfungsi menyerap hara dan air di dalam tanah. Adanya hifa eksternal yang berasosiasi dengan tanaman akan berperan penting dalam perluasan bidang adsorpsi akar sehingga memungkinkan akar menyerap hara dan air dalam jangkauan yang lebih jauh. Distribusi hifa eksternal ini sangat dipengaruhi oleh faktor biotik dan lingkungan abiotik seperti sifat kimia, fisika tanah, kandungan bahan organik, mikroflora dan mikrofauna (Mosse, 1991).
2.2.2 Jenis Fungi Mikoriza Arbuskular
Fungi Mikoriza Arbuskular dikelompokkan berdasarkan cara terbentuknya spora pada setiap genus. Karakteristik yang khas untuk masing-masing genus ialah sebagai berikut:
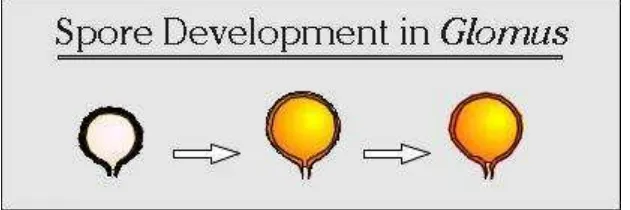
1. Glomus
27
[image:47.595.157.472.184.289.2]satu, seluruh lapisan yang ada pada dinding spora berasal dari dinding hifa pembawa. Permukaan dinding spora halus tidak memiliki ornamen. Ada dudukan hifa (subtending hyphae) lurus berbentuk silinder (Invam, 2013).
Gambar 2. Proses perkembangan spora pada Glomus (Invam, 2013).
2. Paraglomus
Proses pembentukan spora paraglomus hampir sama dengan proses pembentukan spora glomus. Spora tersebut berasal dari ekspansi blastic dari ujung hifa.
paraglomus tidak bereaksi dalam reagen Melzer (Invam, 2013).
3. Acaulospora
Proses perkembangan spora Acaulospora seolah-olah dari ujung hifa tapi sebenarnya tidak. Pertama-tama ada hifa yang ujungnya membesar yang
28
Gambar 3. Proses perkembangan spora pada Acaulospora (Invam, 2013).
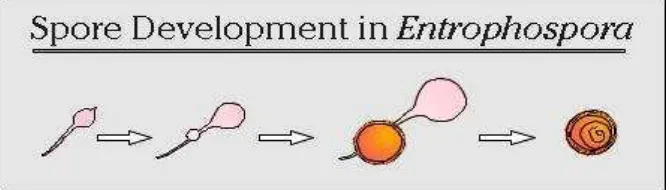
4. Entrophospora
Proses perkembangan spora Entrophospora hampir sama dengan proses perkembangan spora Acaulospora, yaitu di antara hifa terminus dengan subtending hifa. Perbedaan keduanya adalah pada proses perkembangan azygospora berada di dalam blastik atau ditengah hifa terminus, sehingga akan terbentuk dua lubang yang simetris pada spora yang telah matang (Gambar 4). Warna sporanya kuning coklat, tetapi jika spora belum matang warnanya tampak jauh lebih buram (Invam, 2013).
Gambar 4. Proses perkembangan spora pada Entrophospora (Invam, 2013).
5. Archaespora
[image:48.595.147.482.486.581.2]29
leher saccule atau subtending hifa akan berkembang pedicel atau percabangan hifa dari leher saculle (Invam, 2013).
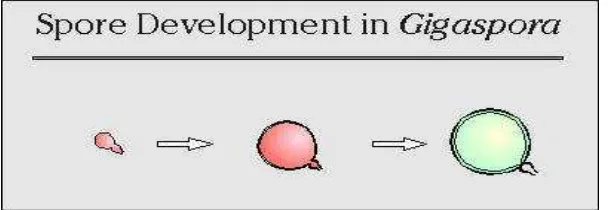
6. Gigaspora
[image:49.595.162.466.361.466.2]Spora berkembang secara blastik dari ujung hifa yang membengkak dan menjadi "sel sporogenous". Setelah sel sporogenous mencapai ukuran penuh (biasanya sekitar 25-50 μm di sebagian besar spesies), spora mulai berkembang di ujung sel sporogenous (Gambar 5). Lapisan luar dan lapisan laminasi berkembang secara bersamaan, dan sering tidak dapat dibedakan dalam spora muda tanpa bantuan pewarnaan Melzer (Invam, 2013).
Gambar 5. Proses perkembangan spora pada Gigaspora (Invam, 2013).
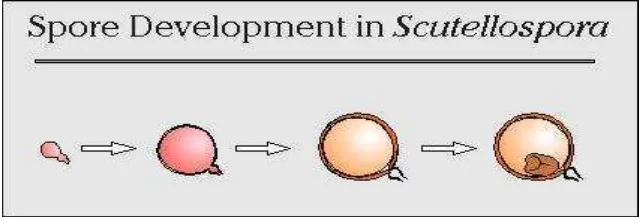
7. Scutellospora
Proses perkembangan spora Scutellospora sama dengan Gigaspora, untuk membedakan dengan genus Gigaspora, pada Scutellospora terdapat lapisan kecambah (Gambar 6). Bila berkecambah, hifa ke luar dari lapisan kecambah (germination shield) tadi. Spora bereaksi dengan larutan Melzer secara
30
Gambar 6. Proses perkembangan spora pada Scutellospora (Invam, 2013).
2.3 Peranan FMA Pada Pertumbuhan Tanaman
Fungi Mikoriza Arbuskular (FMA) mampu meningkatkan pertumbuhan tanaman karena status hara tanaman tersebut dapat ditingkatkan dan diperbaiki (Hapsoh, 2008). Bagi tanaman inang, adanya asosiasi ini dapat memberikan manfaat yang sangat besar bagi pertumbuhannya, baik secara langsung maupun tidak langsung. Secara tidak langsung, mikoriza berperan dalam perbaikan struktur tanah,
31
2.4 Peranan Unsur NPK dan Gejala Kekurangan Unsur Hara
Nitrogen (N) merupakan bagian dari semua sel hidup. Di dalam tanaman, N berfungsi sebagai komponen utama protein, hormon, klorofil, vitamin, dan enzim-enzim esensial untuk kehidupan tanaman. Nitrogen menyusun 40% - 50% bobot kering protoplasma, bahan hidup sel tanaman. Oleh karena itu, N diperlukan dalam jumlah besar untuk seluruh proses pertumbuhan di dalam tanaman.
Metabolisme N merupakan faktor utama pertumbuhan vegetatif, batang, dan daun (Munawar, 2010). Gejala defisiensi unsur hara N pada tanaman kelapa sawit ditandai dengan warna daun menjadi kuning pucat, helaian daun menjadi pendek dan keras, pertumbuhan tanaman terhambat (kerdil), pada kondisi buruk jaringan daun menjadi kering dan mati (Fauzi et al., 2012).
32
menjadi kuning, warna daun hijau tua dan permukaannya terlihat mengilap kemerah-merahan, serta daun berbentuk pendek-pendek (Fauzi et al., 2012). Menurut Munawar (2010), bersama-sama dengan unsur N dan P, Kalium(K) adalah unsur hara esensial primer bagi tanaman yang diserap oleh tanaman dalam jumlah yang lebih besar dibandingkan dengan unsur-unsur hara lainnya, kecuali N. Kalium terlibat banyak dalam proses biokimia dan fisiologi yang sangat vital bagi pertumbuhan dan hasil tanaman, serta ketahanan terhadap cekaman. Unsur K esensial dalam fotosintesis karena terlibat dalam sintesis ATP, produksi dalam aktivitas-aktivitas enzim fotosintesis, penyerapan CO2 melalui mulut daun dan terlibat dalam pengangkutan hasil-hasil fotosintesis. Selain itu juga, kalium berfungsi dalam pembentukan lapisan kutikula yang sangat penting untuk pertahanan tanaman terhadap serangan hama dan penyakit. Gejala defisiensi unsur hara K pada tanaman kelapa sawit ditandai dengan daun tua akan mengerut atau keriting, terdapat bercak kuning transparan pada daun dan berubah merah kecokelatan serta mengering seperti hangus terbakar dan tanaman rentan terhadap penyakit (Fauzi et al., 2012).
33
III. BAHAN DAN METODE
3.1 Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Produksi Perkebunan, rumah kaca Fakultas Pertanian Universitas Lampung, dan lahan Politeknik Negeri Lampung dari bulan Mei 2013 sampai Februari 2014.
3.2Bahan dan Alat
Peralatan yang digunakan antara lain mikroskop stereo dan majemuk, kaca preparat, cawan petri, pinset spora, timbangan elektrik, oven listrik, saringan mikro (ukuran 500 μm, 63 μm, dan 45 μm), gelas ukur, meteran, cangkul, gunting,
ember, gembor, nampan plastik. Bahan-bahan yang digunakan antara lain benih kelapa sawit (D x P) Simalungun, pupuk “ Rock Phospate ”, pupuk Urea, pupuk
NPK, mikoriza Glomus sp. (Isolat MV 23 dan Isolat MV 26) Entrophospora sp. (Isolat MV 22, Isolat MV 25, dan Isolat MV 28), pasir, tanah, polibag, air, larutan KOH 10%, HCL 1%, glycerol, trypan blue, dan akuades.
3.3 Metode Penelitian
34
tanpa inokulasi mikoriza (i0), Glomus sp. Isolat MV 23 (i1), Glomus sp. Isolat MV 26 (i2), Entrophospora sp. Isolat MV 22 (i3), Entrophospora sp. Isolat MV 25 (i4), Entrophospora sp. Isolat MV 28 (i5). Deskripsi masing-masing isolat yang
digunakan dapat dilihat pada Tabel 1. Faktor kedua yaitu pemberian pupuk NPK (P) yang terdiri dari 2 taraf yaitu 100% dosis anjuran NPK/polibag (p1) dan 50% dosis anjuran NPK/polibag (p2). Dosis pupuk anjuran yang digunakan seperti yang tercantum dalam Tabel 2 (hlm. 41)
35
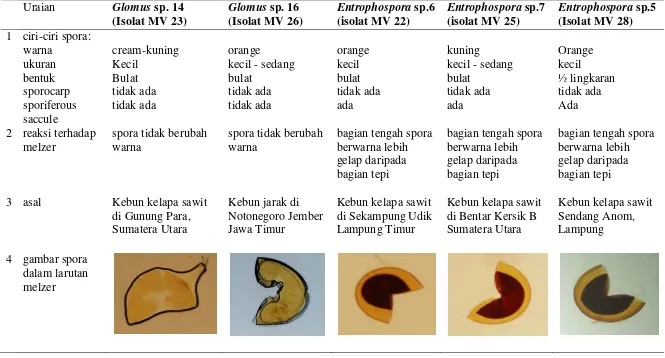
Tabel 1. Deskripsi lima jenis fungi mikoriza arbuskular yang digunakan pada penelitian Uraian Glomus sp. 14
(Isolat MV 23)
Glomus sp. 16 (Isolat MV 26)
Entrophospora sp.6 (isolat MV 22)
Entrophospora sp.7 (isolat MV 25)
Entrophospora sp.5 (Isolat MV 28) 1 ciri-ciri spora:
warna cream-kuning orange orange kuning Orange
ukuran Kecil kecil - sedang kecil kecil - sedang kecil
bentuk Bulat bulat bulat bulat ½ lingkaran
sporocarp tidak ada tidak ada tidak ada tidak ada tidak ada
sporiferous saccule
tidak ada tidak ada ada ada Ada
2 reaksi terhadap melzer
spora tidak berubah warna
spora tidak berubah warna
bagian tengah spora berwarna lebih gelap daripada bagian tepi
bagian tengah spora berwarna lebih gelap daripada bagian tepi
bagian tengah spora berwarna lebih gelap daripada bagian tepi 3 asal Kebun kelapa sawit
di Gunung Para, Sumatera Utara
Kebun jarak di Notonegoro Jember Jawa Timur
Kebun kelapa sawit di Sekampung Udik Lampung Timur
Kebun kelapa sawit di Bentar Kersik B Sumatera Utara
Kebun kelapa sawit Sendang Anom, Lampung 4 gambar spora
dalam larutan melzer
36
Ulangan 1
Ulangan 2
Ulangan 3
Ulangan 4
[image:56.595.113.513.88.428.2]Ulangan 5
Gambar 7.Tata Letak percobaan pada main nursery. Keterangan:
i0 = Tanpa inokulasi mikoriza i1= Glomus sp. Isolat MV 23 i2= Glomus sp. Isolat MV 26
i3= Entrophospora sp. Isolat MV 22 i4= Entrophospora sp. Isolat MV 25 i5= Entrophospora sp. Isolat MV 28
p1 = 100% dosis pupuk anjuran p2 =50% dosis pupuk anjuran
3.4 Pelaksanaan Penelitan
3.4.1 Penyemaian benih
Media tanam yang digunakan adalah pasir steril. Pasir disterilisasi dengan
autoclaf pada suhu 121⁰C selama 1 jam selama 2 kali dengan selang waktu 1 hari. Kemudian pasir yang sudah steril dicampur hingga merata dan dilembabkan
i5p2 i3p2 i5p1 i1p2 i0p2 i4p1 i0p1 i2p1 i3p1 i1p1 i2p2 i4p2
i4p2 i3p1 i1p1 i2p2 i0p1 i1p2 i2p1 i5p2 i4p1 i0p2 i5p1 i3p2
i0p2 i3p2 i2p1 i1p1 i1p2 i5p2 i2p2 i4p1 i3p1 i5p1 i0p1 i4p2
i2p1 i0p1 i5p1 i1p2 i4p2 i3p1 i5p2 i1p1 i4p1 i0p2 i2p2 i3p2
37
[image:57.612.114.504.182.339.2]dengan menggunakan air aquades. Selanjutnya benih kelapa sawit yang telah berkecambah (germinated seed) disemai pada media pasir yang telah disterilkan sampai umur 4 minggu sebelum dipindahkan ke pre-nursery (Gambar 8).
Gambar 8. Benih kelapa sawit yang telah berkecambah/germinated seed (kiri) dan bibit kelapa sawit berumur 4 minggu yang siap dipindahkan ke pre-nursery (kanan).
3.4.2 Penyiapan media tanam di pre-nursery dan main nursery
Media tanam yang digunakan di pre-nursery adalah tanah dan bahan organik dengan perbandingan 7:1. Kedua media tersebut dicampur kemudian ditambahkan pupuk “
38
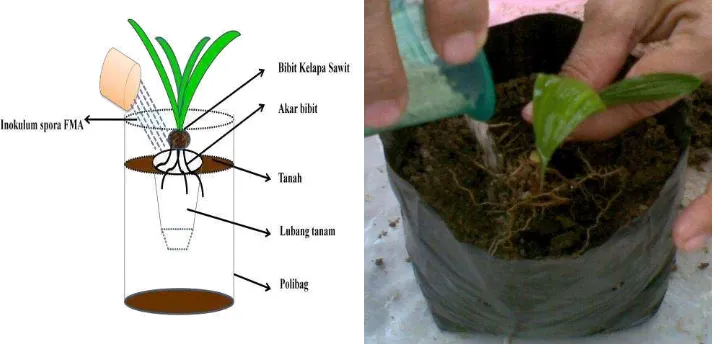
3.4.3 Penanaman di Pre-nursery dan inokulasi spora FMA
[image:58.612.116.478.502.676.2]Benih kelapa sawit yang telah dikecambahkan selama 4 minggu dalam media pasir yang telah disterilkan dipindahkan/transplanting ke polibag berukuran 18 x 25 cm dengan media tanam tanah dan bahan organik (satu bibit per polibag) dan diletakkan di rumah kaca Fakultas Pertanian Universitas Lampung. Proses inokulasi FMA sesuai perlakuan diawali dengan mengeluarkan bibit dari media semaian, kemudian dibuat lubang tanam pada media di polibag yang ukurannya disesuaikan dengan morfologi akar bibit. Inokulum FMA yang disiapkan dalam masing-masing gelas yang berbeda ditaburkan merata pada akar yang terletak di atas lubang tanam (Gambar 9). Inokulan dengan carrier zeolit dan pasir mengandung kepadatan spora yaitu ± 500 spora/bibit. Selanjutnya, perakaran bibit disusun sebelum lubang tanam ditutup dengan media agar perakaran bibit tetap utuh. Setelah bibit berumur 4 minggu, dilakukan pemupukan dengan cara disemprotkan pada daun setiap minggu menggunakan pupuk urea dengan dosis 2 g/liter untuk 100 bibit.
39
3.4.4 Penanaman di main nursery
[image:59.612.228.417.331.479.2]Transplanting bibit dari pre-nursery ke main nursery dilakukan setelah bibit berumur 3 bulan. Penanaman bibit diawali dengan membuat lubang tanam pada media yang ada di polibag main nursery dengan menggunakan alat ponjo (Gambar 10). Ukuran lubang tanam disesuaikan dengan ukuran polibag di pre-nursery. Selanjutnya, polibag disayat kemudian bibit dilepaskan dan ditanam pada lubang tanam. Selanjutnya polibag disusun berdasarkan tata letak percobaan di lahan Politeknik Negeri Lampung.
Gambar 10. Alat ponjo untuk membuat lubang tanam.
3.4.5 Pemeliharaan tanaman
Pemeliharaan yang dilakukan selama penelitian sebagai berikut: 1. Penyiraman
40
2. Penyiangan gulma
Penyiangan gulma dilakukan secara manual dengan mencabut gulma yang tumbuh di permukaan media tanam pada polibag.
3. Pengendalian hama
Hama yang sering menyerang biibt kelapa sawit pada penelitian adalah belalang dan kutu putih. Hama belalang dikendalikan secara manual dan menangkap dan
memusnahkannya. Sedangkan hama kutu putih dikendalikan dengan mengusap daun bibit kelapa sawit dengan alkohol 20%.
4. Pemupukan
[image:60.612.211.431.510.680.2]Jenis dan dosis pupuk yang digunakan pada penelitian ini disesuaikan dengan pertumbuhan bibit dan perlakuan yang digunakan. Pemupukan dilakukan dengan membuat lubang di sekitar perakaran tanaman lalu pupuk diberikan secara ditabur kemudian permukaan tanah ditutup kembali (Gambar 11). Jenis dan dosis pupuk yang digunakan terdapat pada Tabel 2.
41
Tabel 2. Jenis dan dosis pupuk yang digunakan main nursery. Umur tanaman
(minggu)
N:P:K (15:15:15) (g/polibag)
100% dosis anjuran 50% dosis anjuran
14-15 2,5 1,25
16-17 5 2,5
18-20 7,5 3,75
22-24 10 5
26 10 5
28 10 5
30 10 5
32 10 5
34 15 7,5
36 15 7,5
Sumber : Pusat Penelitian Kelapa Sawit, (2013).
3.5 Variabel pengamatan
Pengamatan dilakukan setelah bibit berumur 36 minggu setelah semai. Untuk
menguji kesahihan kerangka pemikiran dan hipotesis dilakukan pengamatan terhadap variabel-variabel sebagai berikut:
1. Tinggi tanaman
Tinggi tanaman diukur dari permukaan tanah sampai ujung daun terpanjang.
Pengukuran dilakukan menggunakan meteran dalam satuan cm. Pengukuran tinggi tanaman dimulai setelah bibit berumur 7,8 dan 9 bulan setelah semai.
2. Jumlah daun
42
3. Tingkat kehijauan daun
Kehijauan daun diukur dengan menggunakan klorofilmeter. Daun yang diambil sampelnya adalah daun ke-3 dan dipilih 2 helai anak daun yang berada ditengah-tengah pelepah. Pengukuran dilakukan pada 6 titik pada setiap sampel daun, sehingga nilai tingkat kehijauan daun merupakan rerata dari 6 titik pengukuran tersebut.
4. Bobot segar tajuk
Seluruh tajuk pada bibit kelapa sawit dipotong, lalu ditimbang dengan timbangan digital dalam satuan gram. Tajuk bibit merupakan organ tanaman yang tumbuh ke atas, dimulai dari pangkal batang hingga ujung daun.
5. Bobot kering tajuk
Seluruh tajuk pada bibit kelapa sawit dipotong, dibersihkan lalu dikeringkan menggunakan oven. Tajuk dikeringkan hingga bobotnya konstan pada suhu 80⁰C. Setelah kering, tajuk ditimbang dengan timbangan digital dalam satuan gram.
6. Bobot segar akar
Seluruh akar pada bibit kelapa sawit dipotong lalu ditimbang dengan timbangan digital dalam satuan gram. Akar bibit kelapa sawit dipotong dari titik tumbuh akar pada pangkal batang.
7. Bobot kering akar
43
bobotnya konstan. Setelah bobot akar konstan, akar ditimbang dengan timbangan digital dalam satuan gram.
8. Jumlah akar primer
Akar primer merupakan akar yang tumbuh pada pangkal batang kelapa sawit. Semua akar primer yang tumbuh dihitung.
9. Volume akar
Seluruh akar pada bibit kelapa sawit yang telah dipotong, lalu dimasukkan ke dalam gelas ukur yang telah diisi air yang telah diketahui volumenya. Volume akar
merupakan penambahan volume air pada gelas ukur dalam satuan ml.
10. Persen infeksi akar oleh FMA
44
tersebut dipotong sepanjang ± 2 cm, kemudian di letakkan di atas kaca preparat untuk diamati di bawah mikroskop majemuk dengan perbesaran 100 kali. Adanya infeksi ditandai dengan adanya struktur pembentuk mikoriza (hifa, vesikel, dan arbuskular) pada jaringan akar dan dihitung menggunakan rumus sebagai berikut:
Infeksi akar (%) = Σ Pengamatan yang positif terinfeksi x 100% Σ Total pengamatan
11.Penghitungan jumlah spora
Diambil sampel tanah di sekitar perakaran bibit kelapa sawit (polybag main nursery) sebanyak 100 g. Kemudian sebanyak 100 g sampel tanah dimasukkan ke dalam gelas ukur kemudian ditambahkan air lebih kurang 1000 ml, kemudian diaduk selama lebih kurang 1 menit supaya spora-spora terperangkap di antara partikel tanah terbebaskan. Larutan dituangkan pada saringan mikro dengan berbagai ukuran dilakukan
V. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Hasil penelitian menunjukkan terjadi interaksi antara jenis FMA dan dosis pupuk NPK yang digunakan sehingga dapat diambil kesimpulan sebagai berikut:
1. Respon bibit kelapa sawit terhadap inokulasi jenis FMA ditentukan oleh dosis pupuk NPK yang digunakan hanya pada tinggi tanaman, bobot kering akar, dan jumlah akar primer.
2. Dosis optimum untuk masing-masing jenis FMA yang digunakan berdasarkan data bobot kering akar adalah kombinasi dosis pupuk NPK 100% dengan masing-masing jenis FMA, kecuali pada FMA jenis Entrophospora sp. Isolat MV 22.
5.2 Saran
68
PUSTAKA ACUAN
Allen, M.F. 2001. Modeling Arbuscular Mycorrhizal Infection: is % Infection an Appropriate Variable? Mycorrhiza J. 10: 255–258.
Brundrett, M., N. Bougher, B. Del, T. Ove, and N. Malajczuk. 2008. Working with Mycorrhizas in Forestry and Agriculture. ACIAR Monograph 32. Australian Centre for International Agricultural Research. Canberra. Cruz, A.F., T. Ishii., and K.Kadoya. 2000. Effect of Arbuscular Mycorrhizal
Fungi on Tree Owth, Leaf Water Potential, and Levels of 1
Aminocyclopropane-1-Carboxylic Acid and Ethylene in the Roots of Papaya under Water-Stress Conditions. Mycorrhiza J. 10(3): 121-123.
Dewi. I. 2007. Peran, Prospek dan Kendala dalam Pemanfaatan Endomikoriza. Makalah Universitas Padjajaran. Bandung.
Direktorat Jenderal Perkebunan. 2012. Tabel Produksi, Luas Areal dan Produktivitas Perkebunan di Indonesia. Direktorat Jenderal Perkebunan, Jakarta.
Fauzi, Y., Y. E Widyastuti., I. Satyawibawa, dan R. H. Paeru.2012. Kelapa Sawit . Penebar Swadaya. Jakarta. 236 hlm.
Hadi, A.M. 2011. Pengaruh Pemberian Glomus sp. Isolat Gigaspora sp. Isolat Entrophospora sp. Isolat dan Dua Dosis NPK pada Pertumbuhan Bibit Kelapa Sawit (Elaeis guineensis Jacq.). di Pembibitan. Skripsi Fakultas Pertanian Universitas Lampung. Bandar Lampung. 65 hlm.
Hapsoh, 2008. Pemanfaatan Fungi Mikoriza Arbuskula pada Budidaya Kedelai di Lahan Kering. Makalah. Pengukuhan Guru Besar. 14 Juni 2008. Kampus USU Medan. 35 hlm.
69
Hartoyo, B., M. Ghulamahdi, L. K. Darusman, S. A. Aziz, dan I. Mansur. 2011. Keanekaragaman Fungi Mikoriza Arbuskula (FMA) pada Rizosfer
Tanaman Pegagan (Centella asiatica (L.) Urban). Jurnal Littri 17(1): 32-40.
INVAM. 2013. http://invam.wvu.edu/the-fungi/classification. Diakses tanggal 18 Oktober 2013
Irawan, D. 2011. Pengaruh 5 Jenis Fungi Mikoriza Arbuskular pada Waktu Terjadinya Simbiosis dan Pertumbuhan . Skripsi Fakultas Pertanian Universitas Lampung. Bandar Lampung.
Kabirun, S. dan J. Widada. 1994. Response of Soybean Own on Acid Soil to Inoculation of Vesicular-Arbuscular Mycorrhizal Fungi. Biotrop Spec. Publ. 56: 131-137.
Kartika, E. 2012. Isolasi, Karakterisasi dan Pengujian Keefektifan Fungi Mikoriza Arbuskular Terhadap Bibit Kelapa Sawit pada Tanah Gambut Bekas Hutan. Jurnal Agronomi. 10(2): 63-70.
Kementrian Pertanian. 2010. Outlook Komoditas Pertanian Perkebunan. Pusat Data dan Informasi Pertanian Kementerian Pertanian. Jakarta. 189 hlm. Madjid, A. 2009. Pengelolaan Kesuburan Tanah Mineral Masam untuk Pertanian.
Makalah Pengelolaan Kesuburan Tanah, Program Studi Ilmu Tanaman, Program Magister (S2), Program Pascasarjana, Universitas Sriwijaya. Palembang.
Mosse, B. 1991. Vesicular-arbuscular mycorrhiza. Research for Tropical Aiculture. Res. Bull. No. 194. Hawaii Inst. of Trop. Aic. and Human Resource. Univ of Hawaii, Honolulu.
Munawar, A. 2010. Kesuburan Tanah dan Nutrisi Tanaman. IPB Press. Bogor. 240 hlm.
Musfal. 2010. Potensi Cendawan Mikoriza Arbuskula untuk Meningkatkan Hasil Tanaman Jagung. Jurnal Litbang Pertanian. 29(4): 154-157
Nurhayati. 2012. Pengaruh Berbagai Jenis Tanaman Inang dan Beberapa Jenis Sumber Inokulum Terhadap Infektivitas dan Efektivitas Mikoriza.
Jurnal Agrista. 16 (2): 80-86.
Pahan, I. 2012 . Kelapa Sawit : Manajemen dari Hulu hingga Hilir. Penebar Swadaya. Jakarta. 411 hlm.
70
Prasetyo, M. 2012. Pengaruh Waktu Inokulasi dan Dosis Inokulasi Spora Fungi Mikoriza Arbuskular pada Pertumbuhan Bibit Kelapa Sawit (Elaeis
guineensis Jacq.). Skripsi Fakultas Pertanian Universitas Lampung. Bandar Lampung.
Puspitasari, D., K. I. Purwani, A. Muhibuddin. 2012. Eksplorasi Vesicular Arbuscular Mycorrhiza (VAM) Indigenous pada Lahan Jagung di Desa Torjun, Sampang Madura. Jurnal Sains dan Seni.1: 19–22.
Rini, M.V. 2012. Arbuscular Mycorrhiza Fungi: An Amazing Soil Microbe. Beneficial Microbes Symposium 2012-KL. Malaysia.
Saputra, H. 2011. Pengaruh Dua Jenis Fungi Mikoriza Arbuskular dan Berbagai Kondisi Cekaman Air pada Pertumbuhan Bibit Kelapa Sawit (Elaeis
guineensis Jacq.). Skripsi Fakultas Pertanian Universitas Lampung. Bandar Lampung.
Setiadi, Y. 2003.“Arbuscular Mycorhiza InokulumProduction”. Program dan Abstrak Seminar dan Pameran Teknologi Produksi dan Pemanfaatan Inokulan Endo-Ektomikoriza untuk Pertanian, Perkebunan, dan Kehutanan. 16 September 2003, Bandung.
_____ .2012. Mengenal Fungsi Mikoriza sebagai Penyokong Kehidupan
Tanaman Pada Lahan Lahan Marginal. Post Mining Restoration Technical Notes. Bogor.
Setyamidjaja. 2006. Kelapa Sawit. Kanisius. Yogyakarta. 56 hlm.
Siradz, S.A. dan S. Kabirun. 2007. Pengembangan Lahan Marginal Pesisir Pantai dengan Bioteknologi Masukan Rendah. Jurnal Ilmu Tanah dan Lingkungan. 7(2): 83-92.
Smith, S.E. and D.J. Read. 2008. Mycorrhizal Symbiosis. Academic Press. New York. 614 pp
Suhardi. 1988. Pedoman Kuliah Mikoriza Vesikular Arbuskular (MVA). Proyek Peningkatan Perguruan Tinggi Universitas Gadjah Mada. PAU-
Bioteknologi Universitas Gadjah Mada. 178 hlm.
Sunarti, R., S. Ika, Syekhfani dan L.A. Abdul. 2004. Peranan Jamur Mikoriza Pada Pertumbuhan Bibit Kelapa Sawit dan Pengaruhnya dalam Menekan Kolonisasi Patogen Ganoderma Boninense. Jurnal Agrivita 2: 212-221. Wacjhar, A., Y. Setiadi, dan N. Yunike. 2002. Pengaruh Inokulasi Dua Spesies
71
Widiastuti, H., N. Sukarno, L.K. Darusman, D.H. Goenadi, S. Smith, dan E. Guhardi. 2002. Optimalisasi Simbiosis Cendawan Mikoriza Arbuskula Acaulospora tuberculata dan Gigaspora margarita pada Bibit Kelapa Sawit di Tanah Masam. Menara Perkebunan. 70 (2): 50-57.
Widiastuti, H., N. Sukarno, L.K. Darusman, D.H. Goenadi, S. Smith, dan E. Guhardi. 2003. Arsitektur Akar Bibit Kelapa Sawit yang diinokulasi Beberapa Cendawan Mikoriza Arbuskula. Menara Perkebunan. 71(1): 28- 43.
Widiastuti, H., N. Sukarno, L.K. Darusman, D.H. Goenadi, S. Smith, dan E. Guhardi. 2005. Penggunaan spora cendawan mikoriza arbuskula sebagai inokulum untuk meningkatkan pertumbuhan dan serapan hara bibit kelapa sawit. Menara Perkebunan. 73(1): 26-34.
Widiastuti, H dan T. Rostiwati, 2011. Keefektifan Pupuk Hayati Mikoriza yang diperkaya terhadap Pertumbuhan Bibit Nyamplung. Prosiding Seminar Nasional Mikoriza : Pupuk dan Pestisida Hayati Pendukung Pertanian Berkelanjutan yang Ramah Lingkungan. Hlm 149-156.
Zulaikha, S dan Gunawan. 2006. Serapan Fosfat dan Respons Fisiologis