ABSTRACT
EFFECT OF INOCULATION TIME AND SPORE NUMBER OF ARBUSCULAR MYCORRHIZAL FUNGI ON GROWTH OF OIL PALM
SEEDLINGS (Elaeis guineensis Jacq.)
By
Mukhtar Dewan Prasetyo
Inoculation of arbuscular mycorrhizal fungi (AMF) at seedling stage of oil palm will improve the quality of the seedlings. The presence of AMF inside oil palm seedlings root will enhance the seedlings growth at nursery stage and later in the field. However, the information on the right time to inoculation the germinated seed of oil palm and how much the spore number of AMF to be used are limited. The presence study therefore aimed 1) to determine the exact time of AMF
inoculation, 2) to determine the exact dose of AMF spore, 3) to determine whether the exact dose of AMF spore to be used is depend on the inoculation time, and 4) to determine the exact dose of AMF spore for every inoculation time.
Barlett test to evaluate the homogeneity of variances among the treatments and Tukey test to check the additivity of the data. The least significant difference (LSD) test in α level 0,05 was used for mean separation.
The results obtained showed that AMF inoculation at one month old seedlings had the better growth of the seedlings through the increment of seedlings height, shoot fresh weight, and shoot dry weight, while 400 spore number gave the better seedling growth through the increment of seedling height, number of leaves, shoot dry weight, root dry weight, and percentage of root infection. Number of spore to be used was determined by the time of inoculation only detected at plant height and leaf greenness level. Therefore, the best combination of spore number and time of inoculation could not be determined in this study.
PENGARUH WAKTU INOKULASI DAN DOSIS INOKULUM SPORA FUNGI MIKORIZA ARBUSKULAR PADA PERTUMBUHAN BIBIT
KELAPA SAWIT (Elaeis guineensis Jacq.)
Oleh
Mukhtar Dewan Prasetyo
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA PERTANIAN
Pada
Program Studi Agroteknologi
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
ix DAFTAR GAMBAR
Gambar Halaman
1. Skema kerangka pemikiran. ... 12
2. Penampang akar yang terinfeksi FMA (Brundrett et al.,1996). ... 19
3. Proses perkembangan spora pada Glomus (Invam, 2012). ... 21
4. Proses perkembangan spora pada Acaulospora dan Entrophospora (Invam, 2012). ... 22
5. Proses perkembangan spora pada Archaespora (Invam, 2012). ... 23
6. Proses perkembangan spora pada Gigaspora (Invam, 2011). ... 23
7. Proses perkembangan spora pada Scutellospora (Invam, 2012). ... 24
8. Tata letak Percobaan dirumah plastik. ... 30
9. Cara inokulasi FMA pada bibit kelapa sawit di pre nursery dan main nursery. ... 32
10. Pengaruh waktu inokulasi FMA terhadap peningkatan tinggi bibit kelapa sawit pada pengamatan 4 sampai 8 bulan setelah semai. ... 41
11.Pengaruh dosis inokulum spora FMA terhadap peningkatan tinggi bibit kelapa sawit pada waktu pengamatan 4 sampai 8 bulan setelah semai. ... 42
12.Pengaruh waktu inokulasi FMA terhadap peningkatan jumlah daun bibit kelapa sawit pada pengamatan 4 sampai 8 bulan setelah semai. ... 43
13.Pengaruh dosis inokulum spora FMA terhadap jumlah daun bibit kelapa sawit pada waktu pengamatan 4 sampai 8 bulan setelah semai. ... 44
x pusat penelitian kelapa sawit (PPKS medan, 2012a) (a) dan bibit
SANWACANA
Syukur Alhamdulillah penulis haturkan kepada pemilik alam semesta, Allah SWT yang telah memberikan rahmat dan hidayah-Nya sehingga penelitian dan
penyusunan skripsi ini dapat berjalan dengan lancar. Penelitian dilaksanakan pada bulan Oktober 2011 sampai dengan bulan Juni 2012. Skripsi ini merupakan salah satu syarat untuk menjadi Sarjana Pertanian dan penulis mengangkat topik mengenai pengaruh waktu inokulasi dan dosis inokulum spora fungi mikoriza arbuskular pada pertumbuhan bibit kelapa sawit (Elaeis guineensis Jacq.).
Penulis menyadari dalam penyusunan skripsi ini masih belum sempurna sehingga saran dan masukan yang bersifat membangun dibutuhkan oleh penulis. Pada kesempatan ini penulis mengucapkan terima kasih atas keterlibatan dan bantuan yang diberikan dalam penelitian dan penyusunan skripsi kepada :
1. Ibu Dr. Ir. Maria Viva Rini, M.Sc., selaku pembimbing utama penelitian dan penyusunan skripsi yang dengan sabar memberikan bimbingan, masukan, dan saran kepada penulis.
ii Lampung.
4. Ibu Dr. Ir. Maimun Barmawi, M.S., selaku pembimbing akademik yang selalu memberikan motifasi, bimbingan, masukan, dan saran kepada penulis selama menjadi mahasiswa di Universitas Lampung.
5. Bapak Dr. Ir. Wan Abas Zakaria, M.S., selaku Dekan Fakulltas Pertanian Universitas Lampung.
6. PT Malaysian Agri Hi-Tech (MAH) selaku pihak yang memberikan dana penelitian dan beasiswa kepada penulis selama menjadi mahasiswa di Program Studi Agroteknologi Fakultas Pertanian Universitas Lampung. 7. Mbak Anggun, Mbak Tri, dan Kak Gery yang sabar membantu penulis dalam
melakukan penelitian.
8. Keluarga penulis: Bapak, Ibu, Okta Dasa Prasetyo (adik), Heny Prasetyowati (kakak), Wiranto (kakak ipar), Nauval (keponakan) dan Nabil (keponakan) yang selalu menjadi motivasi penulis.
9. Untuk Elida Yantama yang selalu mendukung dan membantu penulis dalam senang ataupun duka selama penelitian dan penyusunan skripsi.
iii Bandar lampung, 16 Agustus 2012 Penulis,
I. PENDAHULUAN
1.1 Latar Belakang
Kelapa sawit termasuk tanaman tahunan yang mulai menghasilkan pada umur 3 tahun dengan usia produktif mencapai 25 – 30 tahun. Tinggi tanaman monokotil ini dapat mencapai 24 meter. Bunga dan buahnya berupa tandan serta bercabang banyak. Buahnya berukuran kecil berjenis drupe dan bila matang berwarna merah kehitaman. Daging buahnya (mesocarp) mengandung minyak atau sering disebut dengan CPO (crude palm oil) dan endosperm (inti buah) atau yang sering disebut dengan palm kernel juga dapat dimanfaatkan. Kedua bahan setengah jadi tersebut digunakan sebagai bahan baku industri untuk menghasilkan produk, seperti biofuel, minyak goreng, margarine, sabun, kosmetik, dan produk bernilai ekonomis lainnya (Komisi Pengawas Persaingan Usaha Republik Indonesia, 2007).
Kelapa sawit merupakan salah satu komoditas yang bernilai ekonomis.
Permintaan akan CPO untuk pasar lokal maupun internasional terus meningkat. Berdasarkan data dari FAPRI (Food and Agricultural Policy Reseach Institute, 2010), kebutuhan komsumsi CPO internasional mencapai 45,48 ton dan hanya 98,48% produksi CPO yang dapat dipenuhi. Produksi CPO Indonesia pada tahun 2010 mencapai 21,46 juta ton atau 46,94% dari produksi dunia. Menurut Sucipto (2012), pada tahun 2011 produksi kelapa sawit Indonesia mencapai 23,5 juta ton dan memenuhi kebutuhan pasar sebesar 50 %. Para analis pasar komoditas memprediksi kebutuhan CPO dunia pada 2012 berkisar 51,15 juta ton naik 5,1% dari tahun 2011 sebesar 48,68 juta ton. Hal itu menunjukkan bahwa kelapa sawit merupakan komoditas yang prospektif untuk dikembangkan.
Saat ini, Indonesia memiliki lahan perkebunan sawit terluas di dunia. Namun,
produktivitas lahan kebun sawit Indonesia masih rendah. Luas kebun sawit
Indonesia mencapai 7,1 juta ha dengan produksi CPO sekitar 22 juta ton per
tahun, sedangkan Malaysia hanya 5,1 juta ha dengan produksi CPO sekitar 19,3
juta ton per tahun (Iwan, 2011). Artinya setiap 1 ha lahan di Indonesia hanya
mampu menghasilkan 3,1 ton /ha/tahun CPO, sedangkan Malaysia mampu
menghasilkan 3,78 ton /ha/tahun CPO. Rendahnya produktivitas tersebut terjadi
karena teknik budidaya kelapa sawit yang belum optimal. Salah satunya adalah
pemilihan bibit kelapa sawit yang kurang berkualitas, sehingga diperlukan suatu
teknologi yang tepat untuk menghasilkan bibit yang berkualitas.
menentukan kualitas bibit. Oleh karena itu, berbagai usaha perlu dilakukan untuk mendapatkan kondisi yang optimum dari faktor-faktor tersebut, antara lain adalah dengan pemanfaatan fungi mikoriza arbuskular (FMA) yang merupakan
mikroorganisme tanah yang menguntungkan bagi tanaman (Aeni, 2005).
Sebagian besar lahan di Indonesia memiliki kemasaman yang tinggi (tanah marginal). Tanah masam didefinisikan sebagai tanah yang mengandung
konsentrasi relatif H + yang tinggi (Widiastuti dan Guhardja, 2002). Pada tanah yang masam, unsur hara P sering terikat pada logam sehingga daya larutnya rendah. Pemupukan P pada tanah yang masam memiliki efisiensi yang rendah. Efisiensi yang rendah tersebut berdampak pada tingginya biaya pemupukan bagi kelapa sawit yaitu berkisar 20 - 60% dari biaya pemeliharaan kebun. Oleh karena itu diperlukan upaya untuk mengefisienkan pemupukan agar biaya produksi dapat dikurangi. Salah satunya adalah dengan aplikasi FMA yang memiliki peran dalam membantu penyerapan hara P (Wachjar, 2002).
Simbiosis antara fungi mikoriza arbuskular dengan akar tanaman bersifat
menguntungkan, sehingga inokulasi FMA pada fase pembibitan diharapkan dapat meningkatkan pertumbuhan dan mempercepat masa produksi tanaman kelapa sawit. Hal tersebut dapat terjadi karena FMA berfungsi sebagai alat yang
memobilisasi ketersedian fosfor dalam tanah, meningkatkan kapasitas penyerapan unsur hara dan ketahanan tanaman terhadap kekeringan, serta berfungsi sebagai pembebas patogen akar, karena FMA menghasilkan zat antibiotik (Filion et al., 1999).
Menurut Husna et al. (2007), untuk mendukung keberhasilan aplikasi FMA harus diketahui waktu inokulasi yang tepat karena akan menentukan keberhasilan tanaman terinfeksi oleh FMA. Fungi mikoriza arbuskular hanya dapat
menginfeksi jaringan muda pada akar tanaman, sehingga inokulasi pada tingkat semai dapat mengoptimalkan infeksi. Jika inokulasi dilakukan pada tanaman yang sudah dewasa maka memerlukan dosis FMA yang lebih banyak sehingga tidak efisien. Namun sebaliknya, jika inokulasi dilakukan pada fase kecambah, kemungkinan infeksi tidak terjadi karena spora FMA yang berkecambah tidak mendapat suplai nutrisi yang cukup untuk perkembangannya.
Menurut Widiastuti et al. (2005), keefektifan inokulasi FMA dipengaruhi dosis inokulum. Dosis spora yang berlebihan akan menyebabkan kompetisi spora saat berkecambah dalam memperoleh eksudat akar, sehingga perkembangan FMA tidak optimum. Jika dosis spora yang diinokulasi kurang, maka akan
Berdasarkan latar belakang dan masalah, perlu dilaksanakan suatu penelitian untuk menjawab permasalahan yang dirumuskan dalam pertanyaan sebagai berikut:
1. Kapankah waktu inokulasi FMA yang tepat untuk menghasilkan pertumbuhan bibit kelapa sawit terbaik?
2. Berapakah dosis inokulum spora FMA yang tepat untuk menghasilkan pertumbuhan bibit kelapa sawit terbaik?
3. Apakah respons bibit kelapa sawit terhadap waktu inokulasi ditentukan oleh dosis inokulum FMA yang digunakan?
4. Berapakah dosis spora FMA terbaik untuk masing-masing waktu inokulasi?
1.2 Tujuan Penelitian
Berdasarkan identifikasi dan perumusan masalah, tujuan penelitian dirumuskan sebagai berikut:
1. Menentukan waktu inokulasi FMA yang tepat untuk menghasilkan pertumbuhan bibit kelapa sawit terbaik.
2. Menentukan dosis inokulum spora FMA yang tepat untuk menghasilkan pertumbuhan bibit kelapa sawit terbaik.
3. Untuk mengetahui apakah respons bibit kelapa sawit terhadap waktu inokulasi ditentukan oleh dosis inokulum FMA yang digunakan.
1.2 Kerangka Teoritis
Dalam rangka menyusun penjelasan teoritis terhadap pertanyaan yang telah dikemukakan, penulis menggunakan landasan teori sebagai berikut. Tanaman yang bermikoriza tumbuh lebih baik dari pada tanaman yang tidak bermikoriza. Penyebabnya adalah mikoriza secara efektif dapat meningkatkan penyerapan unsur hara baik unsur hara makro maupun mikro. Mosse (1981) melaporkan bahwa FMA mempunyai kemampuan spesifik dalam meningkatkan penyerapan P pada tanah-tanah marginal, baik bentuk P yang sukar larut, P yang terdapat secara alami, maupun yang berasal dari pupuk. Selain meningkatkan serapan unsur hara, simbiosis tanaman dengan FMA dapat menyebabkan tanaman lebih tahan
terhadap kekeringan dan serangan patogen tanah. Menurut Anas (1997), hifa FMA mampu menyerap air yang ada pada pori-pori tanah saat akar tanaman tidak mampu lagi menyerap air. Hal itu disebabkan oleh penyebaran hifa yang luas di dalam tanah, sehingga jumlah air yang diserap meningkat. Selain itu, hifa FMA mensekresikan antibiotik dapat menghambat serangan serta perkembangan potogen tanah.
Untuk mendukung keberhasilan aplikasi FMA pada tanaman, perlu diketahui cara dan waktu yang tepat. Hal itu merupakan salah satu syarat keberhasilan dalam penggunaan dan pemanfaatan teknologi FMA pada tanaman pertanian,
perkebunan, kehutanan, dan tanaman obat serta pakan ternak guna mendapatkan manfaat yang optimal. Teknik dan waktu yang tepat akan menentukan
keberhasilan tanaman terinfeksi oleh FMA. Waktu inokulasi FMA hanya dilakukan pada saat tanaman masih tingkat semai atau pada biji yang baru berkecambah. Inokulasi FMA pada tanaman yang telah dewasa selain boros penggunaan inokulum juga kurang memberikan manfaat yang optimal (Husnah et al., 2007).
Menurut Clark (1997), peningkatan persentase akar terinfeksi FMA berhubungan dengan dosis FMA yang diberikan. Peningkatan jumlah inokulum FMA dapat meningkatkan jumlah akar terinfeksi. Pemanfaatan FMA dengan dosis yang lebih besar menyebabkan akar tanaman terinfeksi lebih awal dan lebih banyak sehingga pertumbuhan tanaman bisa maksimum.
Kurnianto (2010) yang dikutip oleh Irawan (2011) menyatakan bahwa inokulasi FMA paling baik diberikan saat tanaman berkecambah, namun harus diperhatikan waktu keluarnya akar dengan pemberian FMA. Spora FMA akan berkecambah jika terkena air dan kemudian menghasilkan hifa untuk mencari akar tanaman inang. Jika dalam 2 minggu tidak ada akar tanaman inang yang menghasilkan eksudat akar sebagai bahan makanan untuk pertumbuhan hifa, maka diperkirakan spora akan mati.
Inokulasi FMA pada tanaman sering menggunakan inokulum campuran spora, hifa, dan akar terinfeksi (propagul). Walaupun memiliki beberapa kelebihan, inokulum campuran memiliki kelemahan dalam standarisasi dan sterilisasi. Spora adalah jenis inokulum yang memiliki beberapa kelebihan dibandingkan dengan hifa ataupun akar terinfeksi karena lebih tahan terhadap pengaruh fisika dan kimia akibat ketebalan dindingnya. Selain itu, spora juga dapat disterilisasi untuk
keperluan inokulasi aseptik dan dapat distandarisasi. Namun, spora juga memiliki beberapa kelemahan, yaitu memerlukan waktu untuk berkecambah dan memiliki sifat dorman pada beberapa spesies (Widiastuti et al., 2005).
1.3 Kerangka Pemikiran
lebih cepat dicapai. Selain itu, kelapa sawit merupakan tanaman mycorryzal dependent yaitu jenis tanaman yang tingkat tergantungannya kepada mikoriza tinggi pada saat ditanam pada lahan marginal (tidak subur) atau ultisols yang merupakan jenis tanah terbanyak di Indonesia.
Kandungan hara P dalam tanah melimpah, namun dalam bentuk yang tidak tersedia bagi tanaman. Unsur hara P diserap tanaman dalam bentuk H2PO4- , HPO4-2-, dan PO4-. Pada tanah masam, P membentuk ikatan Fe-P, dan Al-P, sedangkan pada tanah basa membentuk ikatan Ca-P. Hal tersebut menyebabkan akar tanaman tidak dapat menyerap P tersebut. Hifa FMA yang menginfeksi akar tanaman akan mensekresikan enzim fosfatase untuk memecah senyawa P tersebut, sehingga menjadi bentuk yang tersedia bagi tanaman.
Terjadinya infeksi FMA pada akar tanaman dipengaruhi oleh beberapa hal, yaitu kecocokan FMA dengan tanaman inang, kondisi jaringan akar tanaman, dan pengaruh faktor lingkungan. Kecocokan FMA dengan tanaman inang
berhubungan erat dengan eksudat akar yang disekresikan oleh tanaman. Oleh karena itu, sebelum infeksi terjadi FMA akan mengidentifikasi eksudat akar yang disekresikan oleh akar tanaman. Kondisi jaringan akar tanaman berhubungan dengan kelunakan epidermis akar karena FMA hanya dapat menginfeksi akar tanaman yang masih muda. Untuk faktor lingkungan, seperti air, suhu, kelembapan, dan pH berhubungan erat dengan perkecambahan spora.
primer akan membentuk percabangan menghasilkan akar sekunder. Kemudian secara berturut-turut akar sekunder akan membentuk percabangan dan terbentuk akar tersier. Selain itu, pada pangkal bibit kelapa sawit juga akan tumbuh akar primer yang lainnya sehingga dalam penyemaian bibit sistem perakaran dan arsistektur akar mulai berkembang intensif.
Infeksi awal antara FMA dengan tanaman inang dipengaruhi oleh dosis inokulum FMA. Setiap jenis FMA menmbutuhkan dosis yang berbeda untuk mencapai infeksi maksimal pada setiap jenis tanaman. Inokulasi FMA dengan jumlah spora yang lebih banyak akan meningkatkan peluang spora berkecambah semakin tinggi untuk menginfeksi akar. Namun, Jika dosis yang diinokulasikan berlebihan akan mengurangi keefektifan infeksi, karena spora yang berkecambah saling
berkompetisi untuk mendapatkan eksudat akar tanaman yang jumlahnya terbatas diawal masa penyemaian. Oleh sebab itu, dosis inokulum spora yang tinggi belum tentu menghasilkan infeksi yang efektif.
Selain dosis, waktu inokulasi FMA juga berpengaruh terhadap infeksi awal. Fungi mikoriza arbuskular hanya dapat menginfeksi jaringan akar yang muda. Oleh sebab itu, inokulasi biasanya dilakukan pada masa penyemain atau
Waktu dan dosis inokulasi merupakan faktor penting dalam menentukan keefektifan infeksi FMA pada bibit kelapa sawit. Kedua faktor tersebut diharapkan saling melengkapi satu sama lain, sehingga kondisi yang tidak menguntungkan dalam inokulasi FMA dapat ditangani. Keterlambatan inokulasi pada bibit dapat diatasi dengan penambahan dosis FMA yang lebih tinggi. Hal itu disebabkan oleh arsitektur dan morfologi akar telah mengalami perkembangan, sehingga spora yang diinokulasikan harus berada pada bagian jaringan akar yang masih muda agar terjadi infeksi. Waktu inokulasi pada awal pembibitan
diharapkan dapat mengurangi dosis FMA, sehingga dapat menghemat pemakaian inokulum.
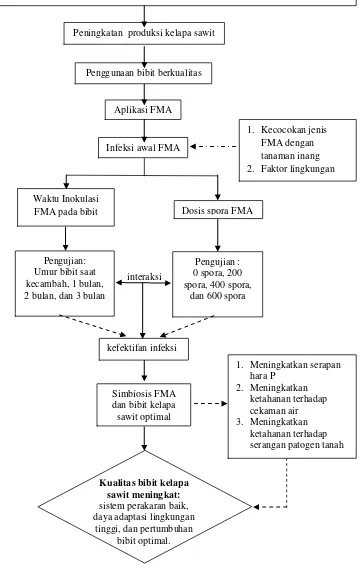
Gambar 1. Diagram alir kerangka pemikiran.
1. Kecocokan jenis FMA dengan tanaman inang 2. Faktor lingkungan
Dosis spora FMA Waktu Inokulasi
FMA pada bibit
Pengujian : 0 spora, 200 spora, 400 spora,
dan 600 spora Pengujian:
Umur bibit saat kecambah, 1 bulan, 2 bulan, dan 3 bulan
Peningkatan produksi kelapa sawit
Penggunaan bibit berkualitas
Aplikasi FMA
Infeksi awal FMA
Produksi kelapa sawit di Indonesia rendah karena banyak ditanam pada lahan marginal atau tanah masam sehingga unsur hara P sulit larut dan efisiensi pemupukan P rendah
Kualitas bibit kelapa sawit meningkat:
sistem perakaran baik, daya adaptasi lingkungan
tinggi, dan pertumbuhan bibit optimal.
1. Meningkatkan serapan hara P 2. Meningkatkan ketahanan terhadap cekaman air 3. Meningkatkan ketahanan terhadap serangan patogen tanah kefektifan infeksi
Simbiosis FMA dan bibit kelapa sawit optimal
1.4 Hipotesis
Dari kerangka pemikiran yang telah dikemukakan dapat disimpulkan hipotesis sebagai berikut:
1. Waktu inokulasi FMA pada awal terbentuknya akar sekunder dan tersier akan menghasilkan pertumbuhan bibit kelapa sawit terbaik.
2. Semakin tinggi dosis inokulum spora FMA yang diinokulasikan hingga mencapai level tertentu akan menghasilkan pertumbuhan bibit kelapa sawit terbaik .
3. Respons pertumbuhan bibit kelapa sawit terhadap waktu inokulasi FMA ditentukan oleh dosis inokulum FMA yang digunakan.
II. TINJAUAN PUSTAKA
2.1 Informasi Umum Mengenai Kelapa Sawit
Klasifikasi tanaman kelapa sawit menurut Pahan (2006): Divisi : Embryophyta Siphonagama
Kelas : Angiospermae Ordo : Monocotyledonae
Family : Arecaceae (dahulu disebut Palmae) Genus : Elaeis
Spesies : Elaeis guineensis Jacq.
2.1.1 Morfologi Kelapa Sawit
Menurut PTPN VII (2006), botani kelapa sawit adalah sebagai berikut:
1. Akar
Akar kelapa sawit berfungsi sebagai penunjang struktur batang, menyerap air dan unsur hara dari dalam tanah, serta sebagai salah satu alat respirasi. Sistem
perakaran kelapa sawit merupakan sistem akar serabut yang terdiri atas akar primer, sekunder, tersier, dan kuartener. Akar primer keluar dari pangkal batang serta menyebar secara horisontal dan vertikal hingga mencapai 15 - 20 m ke dalam tanah. Akar primer bercabang membentuk akar sekunder dengan diameter 2 - 4 mm yang mengarah ke atas mendekati permukaan tanah. Akar sekunder
bercabang membentuk akar tersier yang berdiameter 1 - 2 mm dan membentuk akar kuartener yang berada di dekat pemukaan tanah dengan panjang 2 cm dan berdiameter 0.5 mm.
2. Batang
Batang kelapa sawit berbentuk silinder. Hingga umur 12 tahun batang masih tertutup dengan gagang pelepah, sehingga terkesan batangnya besar. Diameter batang mencapai 30-60 cm. Tinggi batang dapat mencapai 15–18 m, bahkan sampai 30 m. Penambahan tinggi batang 30–60 cm per tahun.
3. Daun
sekitar 20–24 pelepah per tahun. Sejak terbentuk primordial sampai spear (pelepah belum membuka) membutuhkan waktu ± 30 bulan. Daun akan gugur secara alamiah pada kisaran 5–6 tahun. Pelepah tumbuh tersusun menurut spiral, dimana susunan pelepah satu dengan yang lain teratur (phylotaxis).
4. Bunga
Tanaman kelapa sawit yang berumur tiga tahun mulai mengeluarkan bunga jantan atau bunga betina. Bunga jantan berbentuk lonjong memanjang, sedangkan bunga betina bulat. Tanaman kelapa sawit mengadakan penyerbukan silang (cross pollination), yaitu bunga betina dari pohon yang satu dibuahi oleh bunga jantan dari pohon yang lainnya dengan perantaraan angin dan atau serangga penyerbuk.
5. Buah
Buah matang membutuhkan waktu 5–6 bulan setelah terjadi penyerbukan. Jumlah biji setiap tandan bervariasi sesuai dengan umur tanaman. Tandan yang besar dapat mengandung 1.600 buah. Rata-rata ukuran buah mencapai 3–5 cm dengan berat buah ± 20 gram.
2.1.2 Tipe Kelapa Sawit
Menurut Setyamidjaja (2006) yang dikutip oleh Irawan (2011), kelapa sawit dibagi menjadi 3 jenis berdasarkan ketebalan cangkang, yaitu:
1. Dura
2. Pisifera
Jenis ini memiliki cangkang yang tipis (bahkan hampir tidak ada). Berbeda dengan dura daging buah pisifera tebal. Rendemen buahnya tinggi (lebih dari 23%) namun tandan buah hampir selalu gugur sebelum masak sehingga jumlah produksi rendah. Gugurnya buah tersebut disebabkan banyaknya bunga betina yang steril.
3. Tenera
Tenera merupakan hasil persilangan antara dura dan pisifera. Tenera memiliki cangkang yang tipis (0,5 – 4 mm), daging buah tebal, dan rendemen minyak 22 – 24 %.
Saat ini banyak dikembangkan jenis kelapa sawit D x P (dura x pisifera), dimana jenis dura sebagai betina dan pisifera sebagai jantan. Persilangan kedua jenis kelapa sawit tersebut dianggap sebagai bibit unggul karena melengkapi
kekurangan masing-masing induk dengan sifat cangkang buah tipis namun bunga betinanya tetap fertil. Persilangan antara dura betina dengan pisifera jantan disebut dengan tenera. Beberapa tenera unggul memiliki persentase daging
perbuah mencapai 90% dan kandungan minyak dapat mencapai 28% (Subiantoro, 2009).
2.1.3 Syarat Tumbuh
2000 - 2500 mm setahun. Lahan yang sesuai yaitu tidak tergenang air saat hujan dan tidak kekeringan saat musim kemarau. Pola curah hujan tahunan akan memperngaruhi perilaku pembungaan dan produksi buah sawit (Pahan, 2006).
2.2 Fungi Mikoriza Arbuskular
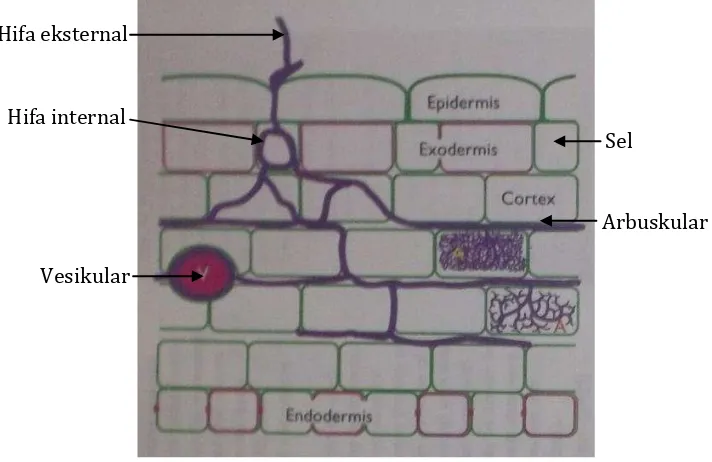
Mikoriza merupakan bentuk asosiasi fungi tanah dengan akar tanaman. Mikoriza terbagi menjadi 2 golongan berdasarkan infeksi pada jaringan akar tanaman, yaitu ektomikoriza dan endomikoriza. Ektomikoriza merupakan golongan fungi yang yang infeksinya pada jaringan akar terjadi di antara sel-sel korteks (interseluler), sedangkan endomikoriza infeksinya terjadi di antara sel-sel korteks dan di dalam sel jaringan akar tanaman (intraseluler). Infeksi di dalam sel jaringan tananaman tersebut membentuk organ arbuskular, sehingga endomikoriza sering disebut juga dengan istilah fungi mikoriza arbuskular (Gambar 2) (Brundrett et al., 1996).
Fungi mikoriza arbuskular dengan akar tanaman membentuk jalinan interaksi yang kompleks. Asosiasi FMA dengan tanaman merupakan suatu bentuk
Gambar 2. Penampang akar yang terinfeksi FMA (Brundrett et al.,1996).
2.2.1 Morfologi Fungi Mikoriza Arbuskular
Fungi mikoriza arbuskular membentuk organ-organ khusus dan mempunyai fungsi yang spesifik. Organ khusus tersebut adalah arbuskular, vesikular, dan spora. Berikut ini dijelaskan mengenai struktur dan fungsi dari organ FMA:
Vesikular merupakan struktur fungi yang berasal dari pembengkakan hifa internal berbentuk bulat telur, dan berisi banyak senyawa lemak (Gambar 2). Vesikel merupakan organ penyimpanan cadangan makanan dan pada kondisi tertentu dapat berperan sebagai spora atau alat untuk mempertahankan kehidupan fungi. Tidak semua genus FMA memiliki vesikel, genus Gigaspora dan Scutellospora tidak memiliki struktur ini (Pattimahu, 2004).
Arbuskular merupakan hifa bercabang halus yang dibentuk oleh percabangan dikotomi yang berulang-ulang sehingga menyerupai pohon di dalam sel inang.
Vesikular
Arbuskular Hifa eksternal
Arbuskular berfungsi sebagai organ pertukaran metabolit antara fungi dengan tanaman (Suhardi, 1989).
Selain arbuskular dan vesikel, FMA juga memiliki organ khusus, yaitu spora. Spora terbentuk pada ujung hifa eksternal. Spora ini dapat dibentuk secara tunggal, berkelompok atau di dalam sporokarp tergantung pada jenis FMA. Perkecambahan spora sangat sensitif tergantung dari kandungan logam berat di dalam tanah dan juga kandungan Al. Kandungan Mn juga mempengaruhi pertumbuhan hifa. Spora dapat hidup di dalam tanah beberapa bulan sampai tahun. Spora dapat disimpan dalam waktu yang lama sebelum digunakan lagi (Mosse, 1981).
2.2.2 Pengelompokan Fungi Mikoriza Arbuskular
Fungi Mikoriza Arbuskular dikelompokkan berdasarkan cara terbentuknya spora pada setiap genus. Berikut ini dijelaskan terbentuknya spora yang menjadi penciri genus pada FMA:
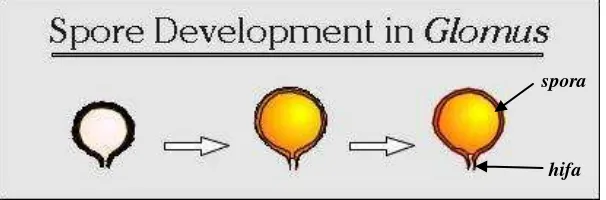
1. Glomus
Gambar 3. Proses perkembangan spora pada Glomus (Invam, 2012).
2. Paraglomus
Proses pembentukan spora paraglomus hampir sama dengan proses pembentukan spora pada glomus. Spora tersebut berasal dari ekspansi blastic dari ujung hifa. Untuk membedakan spora glomus dan paraglomus harus dilakukan uji
perwarnaan melzer’s reagent. Spora glomus menyerap melzer’s sedangkan
paraglomus tidak (Invam, 2012).
3. Acaulospora
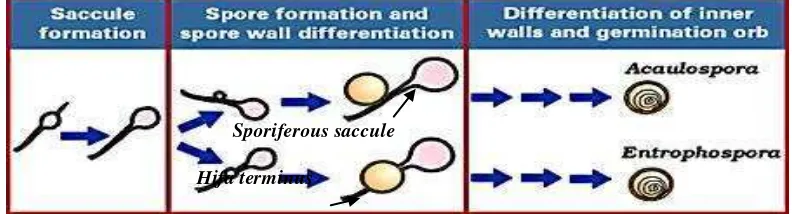
Spora terbentuk di tanah, berbentuk globose, subglobose, ellipsoid maupun fusiformis. Pada awalnya, proses pembentukan spora seperti dimulai dari ujung hifa, karena pada ujung hifa tersebut terjadi pembengkakkan hifa yang strukturnya mirip spora atau disebut saccule. Kemudian dengan berkembangnya saccule tersebut akan disertai muncul bulatan kecil yang terbentuk diantara hifa terminus dan subtending hifa. Bulatan kecil tersebut akan berkembang disamping hifa terminus dan menjadi spora (Gambar 3). Pada spora yang telah masak terdapat satu lubang yang dinamakan ciatric (Invam, 2012).
spora
Gambar 4. Proses perkembangan spora pada Acaulospora dan Entrophospora (Invam, 2012).
4. Enterophospora
Proses pembentukan spora Enterophospora hampir sama dengan proses
pembentukan spora pada Acaulospora. Yang membedakan keduanya adalah pada proses perkembangan azygospora berada di dalam blastik atau ditengah hifa terminus, sehingga akan terbentuk dua lubang yang simetris pada spora yang telah matang (Gambar 4) (Invam, 2012).
5. Archaespora
Perkembangan spora pada genus archaespora merupakan perpaduan antara perkembangan spora genus glomus dan enterophospora atau acoulospora. Pada awalnya, diujung hifa akan terbentuk Sporiferous saccule . Selanjutnya, pada leher saccule atau subtending hifa akan berkembang pedicel atau percabangan hifa dari leher saccule (Gambar 5). Pada ujung pedicel tersebut akan berkembang spora seperti halnya perkembangan spora pada glomus (Invam, 2012).
Sporiferous saccule
Gambar 5. Proses perkembangan spora pada Archaespora (Invam, 2012).
6. Gigaspora
Struktur spora yang terbentuk berupa globose dan subglobose, berbentuk ovoid, pyriformis atau irregular. Spora pada genus gigaspora berasal dari ujung hifa (subtending hifa) yang membulat disebut suspensor. Kemudian, di atas bulbous suspensor tersebut terbentuk spora (Gambar 6). Spora tersebut terbentuk dari suspensor, sehingga dinamakan azygospora (Invam, 2012).
Gambar 6. Proses perkembangan spora pada Gigaspora (Invam, 2012).
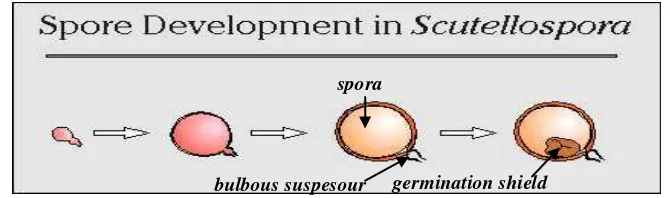
7. Scutellospora
Struktur spora yang terbentuk biasanya globose atau subglobose tetapi sering berbentuk ovoid, obovoid, pyriformis atau irregular. Proses terbentuknya spora pada Scutellospora sama dengan pembentukan spora pada genus Gigaspora (Gambar 7). Pembeda genus Gigaspora dengan Scutellospora, yaitu pada
Sporiferous saccule spora
pedicel Hifa subtending
spora
spora
[image:31.595.159.467.449.552.2]Scutellospora terdapat germination shield, dan pada saat berkecambah hifa akan keluar dari germination shield tersebut (Invam, 2012).
Gambar 7. Proses perkembangan spora pada Scutellospora (Invam, 2012).
2.3 Peranan FMA Pada Pertumbuhan Tanaman
Anas (1997) menjelaskan manfaat FMA pada pertumbuhan tanaman. Tanaman yang bermikoriza tumbuh lebih baik dari tanaman tanpa mikoriza. Penyebab utama adalah mikoriza secara efektif dapat meningkatkan penyerapan unsur hara baik unsur hara makro maupun mikro. Selain itu, akar yang bermikoriza dapat menyerap unsur hara dalam bentuk terikat dan yang tidak tersedia bagi tanaman.
Tanaman yang bermikoriza lebih tahan terhadap kekeringan dari pada yang tidak bermikoriza. Rusaknya jaringan korteks akibat kekeringan dan matinya akar tidak akan permanen pengaruhnya pada akar yang bermikoriza. Setelah periode
kekurangan air (water stress), akar yang bermikoriza akan cepat kembali normal. Hal ini disebabkan karena hifa fungi mampu menyerap air yang ada pada pori-pori tanah saat akar tanaman tidak mampu lagi menyerap air. Penyebaran hifa yang sangat luas di dalam tanah menyebabkan jumlah air yang diambil meningkat (Anas, 1997).
spora
Terinfeksinya akar oleh mikoriza menyebabkan akar terhindar dari serangan penyakit. Infeksi patogen akar akan terhambat. Selain itu, mikoriza menggunakan semua kelebihan karbohidrat dan eksudat akar lainnya, sehingga tercipta
lingkungan yang tidak cocok bagi patogen. Fungi mikoriza ada yang dapat melepaskan antibiotik yang dapat mematikan patogen (Anas, 1997).
2.4 Dosis dan Waktu Inokulasi FMA
Menurut Widiastuti et al. (2005), jumlah spora maupun spesies FMA mampu mempengaruhi peubah pertumbuhan bibit kelapa sawit. Jumlah spora sebanyak 200 buah kemungkinan kurang sesuai untuk inokulum bibit kelapa sawit yang mempunyai perakaran dengan pertumbuhan yang relatif lambat dibandingkan dengan tanaman lainnya. Jumlah spora sebanyak 500 buah menyebabkan
kesempatan spora untuk menginfeksi akar tanaman menjadi lebih besar. Sanders dan Sheikh (1983) mengemukakan bahwa kerapatan propagul merupakan salah satu faktor yang mempengaruhi infeksi primer di samping perkecambahan spora, kecepatan pertumbuhan hifa di media, dan kecepatan pertumbuhan akar tanaman.
III. METODE PENELITIAN
3.1 Tempat dan waktu Penelitian
Penelitian ini dilaksanakan di rumah plastik dan Laboratorium Produksi Perkebunan Fakultas Pertanian Universitas Lampung dari bulan Oktober 2011 sampai dengan Juni 2012.
3.2 Bahan dan Alat
Bahan yang digunakan adalah benih kelapa sawit (germinated seed) jenis dxP, inokulum spora FMA berupa campuran Glomus sp.1, Glomus sp.2, Glomus sp.3, Gigaspora sp., dan Enterophospora sp. (deskripsi masing-masing spesies
disajikan pada Tabel 1), fungisida basamid, pupuk Urea dan NPK, pasir dan tanah (top soil) yang telah disterilkan secara fumigasi dengan bassamid, air, akuades, lactophenol tryphan blue 0,5 %, KOH 1 %, HCl 1%, dan alkohol.
3.3 Metode Penelitian
Untuk menjawab pertanyaan dalam perumusan masalah dan untuk menguji hipotesis, rancangan perlakuan disusun secara faktorial (4 x 4). Faktor pertama adalah waktu inokulasi FMA pada bibit kelapa sawit (W), yaitu saat fase
kecambah (w0) , bibit berumur 1 bulan (w1), bibit berumur 2 bulan (w2), dan bibit berumur 3 bulan (w3). Faktor kedua adalah dosis inokulum spora FMA (D) yang terdiri atas 4 taraf, yaitu kontrol (d0), 200 spora (d1), 400 spora (d2), dan 600 spora (d3).
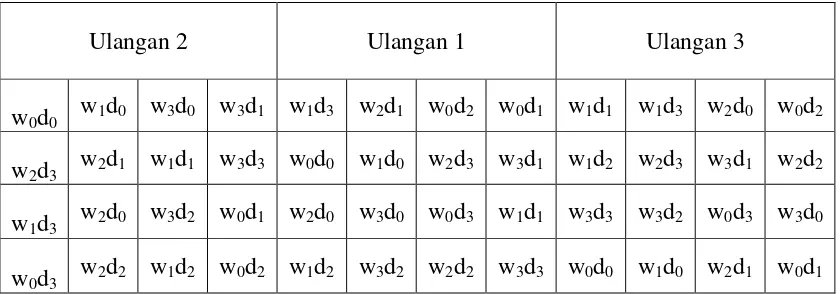
Perlakuan diterapkan pada petak percobaan dalam rancangan kelompok teracak sempurna (RKTS) (Gambar 8). Pengelompokan berdasarkan keseragaman tinggi bibit. Setiap kombinasi perlakuan diulang sebanyak tiga kali dan setiap satuan percobaan terdiri atas satu polybag yang masing-masing berisi satu bibit kelapa sawit. Kesamaan ragam antar perlakuan diuji dengan Uji Bartlett.
Ulangan 2 Ulangan 1 Ulangan 3
[image:38.595.108.528.84.231.2]w0d0 w1d0 w3d0 w3d1 w1d3 w2d1 w0d2 w0d1 w1d1 w1d3 w2d0 w0d2 w2d3 w2d1 w1d1 w3d3 w0d0 w1d0 w2d3 w3d1 w1d2 w2d3 w3d1 w2d2 w1d3 w2d0 w3d2 w0d1 w2d0 w3d0 w0d3 w1d1 w3d3 w3d2 w0d3 w3d0 w0d3 w2d2 w1d2 w0d2 w1d2 w3d2 w2d2 w3d3 w0d0 w1d0 w2d1 w0d1
Gambar 8. Tata letak percobaan di rumah plastik. Keterangan:
waktu inokulasi (w): dosis spora FMA (d):
w0 = kecambah (germinated seed) d1 = 200 spora w1 = Bibit berumur 1 bulan d1 = 200 spora w2= Bibit berumur 2 bulan d2 = 400 spora w4 = Bibit berumur 3 bulan d3 = 600 spora
3.4 Pelaksanaan Penelitian
3.4.1 Sterilisasi Media
Media tanam yang digunakan adalah pasir dan tanah. Media pasir digunakan pada saat pre nursery, sedangkan tanah digunakan pada saat main nursery. Kedua media tersebut disterilkan dengan fumigasi menggunakan basamid. Dosis basamid yang digunakan adalah 50 g untuk setiap 200 kg pasir atau tanah. Pencampuran basamid dengan pasir atau tanah dilakukan dengan mollen selama 15 menit.
air sampai kapasitas lapang untuk menghilangkan efek fumigasi. Media tanam siap digunakan setelah dibiarkan selama 2 minggu.
3.4.2 Penanaman di Pre Nursery
Benih kelapa sawit yang telah berkecambah ditanam pada media dalam polybag (satu benih per polibag) dan diletakkan di rumah kaca. Setelah bibit berumur 4 minggu, dilakukan pemupukan setiap minggu menggunakan pupuk Urea dengan dosis 2 g/liter untuk 100 bibit.
3.4.3 Inokulasi Fungi Mikoriza Arbuskular
Inokulum FMA yang digunakan dalam penelitian ini adalah campuran spora Glomus sp.1, Glomus sp.2, Glomus sp.3, Gigaspora sp., dan Enterophospora sp. Inokulum tersebut berupa pasir dan zeolit yang mengandung 400 spora FMA untuk setiap 50 gram inokulum.
Inokulasi FMA pada bibit kelapa sawit dilakukan pada empat waktu yang
berbeda, yaitu saat fase kecambah (w0) , bibit berumur 1 bulan (w1), bibit berumur 2 bulan (w2), dan bibit berumur 3 bulan (w3). Pada setiap waktu inokulasi, dosis inokulum yang diberikan adalah kontrol (d0), 200 spora (d1), 400 spora (d2), dan 600 spora (d3). Inokulasi pada saat kecambah dilakukan bersamaan dengan penanaman benih di pre nursery. Inokulasi tahap ke 2 dan 3 dilakukan pada saat benih bibit masih di pre nursery. Pada inokulasi keempat dilakukan bersamaan dengan transplanting bibit kelapa sawit dari pre nursery ke main nursery.
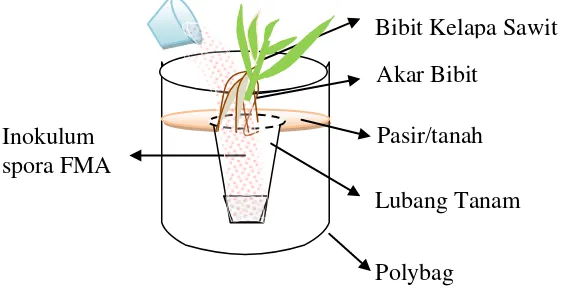
mengganggu pertumbuhan bibit. Kemudian dibuat lubang tanam pada media di polybag yang ukurannya disesuaikan dengan morfologi akar bibit. Inokulum FMA ditaburkan merata pada akar yang terletak di atas lubang tanam (Gambar 9). Selanjutnya, perakaran bibit disusun terlebih dahulu sebelum lubang tanam ditutup dengan media. Hal itu dilakukan agar perakar bibit tetap utuh.
Gambar 9. Cara inokulasi spora FMA pada bibit kelapa sawit di pre nursery dan main nursery.
3.4.3Penanaman di Main Nursery
Transplanting bibit dari pre nursery ke main nursery dilakukan setelah bibit berumur 3 bulan. Penanaman bibit diawali dengan membuat lubang tanam pada media yang ada di polibag main nursery. Ukuran lubang tanam disesuaikan dengan morfologi akar bibit. Selanjutnya, bibit pada polybag pre nursery dibongkar dan diusahakan perakaran bibit tetap utuh. Kemudian, bibit ditanam pada lubang tanam dengan perakaran bibit disusun terlebih dahulu agar akar bibit tidak rusak dan patah. Pada tahap ini juga mulai diterapkan tata letak percobaan (Gambar 8) dan inokulasi FMA untuk bibit berumur 3 bulan.
Bibit Kelapa Sawit Akar Bibit
Pasir/tanah Lubang Tanam
Polybag Inokulum
3.5 Pemeliharaan
Pemeliharaan yang dilakukan selama penelitian sebagai berikut:
1. Penyiraman
Penyiraman dilakukan ketika media tanam mengadung air kurang dari kapasitas lapang. Air disiramkan pada media tanam hingga air keluar dari lubang polybag. Hal tersebut sebagai parameter media tanam telah mengandung air lebih dari kapasitas lapang.
2. Penyiangan gulma
Penyiangan gulma dilakuan secara mekanis dengan mencabut gulma yang tumbuh di permukaan media tanam pada polybag.
3. Perbaikan aerasi media tanam
Perbaikan aerasi media tanam dilakukan dengan mengemburkan permukaan media tanam sedalam 1,5 – 2 cm.
4. Pengendalian hama
Hama yang sering menyerang bibit kelapa sawit pada penelitian adalah belalang (Dissosteira carolina). Hama dikendalikan secara manual dengan menangkap dan memusnahkannya.
5. Pengendalian penyakit
antraknosa pada penelitian ini disebabkan oleh fungi Botryodiplodia spp dan mulai menyerang setelah dilakukan transplanting. Pada awalnya pengendalian dilakukan dengan mengatur jarak tanam dan penyiraman optimal agar iklim mikro disekitar tanaman tidak lembab. Keadaan yang lembab yang akan memacu
perkembangan penyakit ini. Ternyata pengendalian ini tidak mampu menghambat penyebaran antraknosa sehingga daun bibit kelapa sawit diolesi dengan alkohol 70%. Pengendalian dengan menggunakan alkohol ternyata tidak mampu menekan perkembangan Botryodiplodia sp sehingga dilakukan pengendalian dengan fungisida Dithane M-45 80 WP berbahan aktif Mankozeb 80 %. Aplikasi dilakukan hanya pada satuan percobaan yang terserang. Konsentrasi formulasi yang digunakan yaitu 1,5 g/liter. Formulasi tersebut dioleskan pada daun menggunakan tisu.
6. Pemupukan
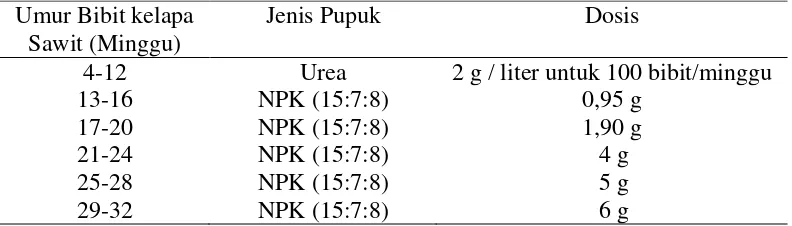
[image:42.595.115.511.643.756.2]Jenis dan dosis pupuk yang digunakan pada penelitian ini disesuaikan dengan pertumbuhan bibit. Pemupukan dimulai ketika tanaman berumur 4 minggu menggunakan pupuk Urea dan diganti dengan NPK (15:7:8) ketika berumur 13 minggu atau setelah dilakukan transplanting. Jenis dan dosis pupuk yang digunakan terpapar pada Tabel 2.
Tabel 2. Jenis dan dosis pupuk yang digunakan dalam penelitian. Umur Bibit kelapa
Sawit (Minggu)
Jenis Pupuk Dosis
4-12 Urea 2 g / liter untuk 100 bibit/minggu
13-16 NPK (15:7:8) 0,95 g
17-20 NPK (15:7:8) 1,90 g
21-24 NPK (15:7:8) 4 g
25-28 NPK (15:7:8) 5 g
3.6 Pengamatan
Setelah bibit berumur 32 minggu setelah semai, untuk menguji kesahihan kerangka pemikiran dan hipotesis dilakukan pengamatan terhadap variabel-variabel sebagai berikut:
1. Tinggi tanaman
Tinggi tanaman diukur dari permukaan tanah sampai ujung daun terpanjang. Pengukuran dilakukan menggunakan penggaris dalam satuan cm. Pengukuran tinggi tanaman dimulai setelah bibit kelapa sawit berumur 4 bulan sampai 8 bulan setelah semai (panen).
2. Jumlah daun
Jumlah daun yang telah membuka sempurna pada setiap bibit dihitung. Penghitungan jumlah daun dimulai dari bibit berumur 4 bulan hingga 8 bulan setelah semai (panen).
3. Tingkat kehijauan daun
4. Bobot segar tajuk
Seluruh tajuk pada bibit kelapa sawit dipotong, lalu ditimbang dengan timbangan digital dalam satuan gram. Tajuk bibit merupakan organ tanaman yang tumbuh keatas, dimulai dari pangkal batang hingga ujung daun.
5. Bobot kering tajuk
Seluruh tajuk pada bibit kelapa sawit yang telah dipotong, lalu dikeringkan menggunakan oven. Tajuk dikeringkan hingga bobotnya konstan pada suhu 800C. Setelah kering, tajuk ditimbang dengan timbangan digital dalam satuan gram.
6. Bobot segar akar
Seluruh akar pada bibit kelapa sawit dipotong lalu ditimbang dengan timbangan digital dalam satuan gram. Akar bibit kelapa sawit dipotong dari titik tumbuh akar pada pangkal batang.
7. Jumlah akar Primer
Akar primer merupakan akar yang tumbuh pada pangkal batang kelapa sawit. Semua akar primer yang tumbuh tersebut dihitung.
8. Volume akar
9. Bobot kering akar
Seluruh akar bibit kelapa sawit dipotong pada bagian titik tumbuh akar (pangkal batang). Kemudian, dikeringkan menggunakan oven dengan suhu 800C. Setelah bobotnya konstan, akar ditimbang dengan timbangan digital dalam satuan gram.
10. Persentase infeksi akar
Penghitungan persentase infeksi akar oleh FMA diawali dengan mengambil akar sekunder dan tersier secara acak ( ± 20 helai), dicuci dengan air sampai bersih dan dimasukkan ke dalam botol film. Botol film yang berisi akar tersebut diisi dengan larutan KOH 10% dan dikukus dalam water bath dengan suhu ± 80 0C selama ± 30 menit. Hal itu dilakukan untuk membersihkan sel dari sitoplasma. Selanjutnya, Larutan KOH dibuang dan akar dicuci kembali dengan dengan air hingga bersih, lalu direndam dalam larutan HCl 1%. Kemudian, akar dikukus kembali dalam water bath pada suhu ± 80 0C. Setelah ± 15 menit, larutan HCl dibuang dan ditambahkan larutan trypan blue 0,05% (0,5 g trypan blue + 450 ml glycerol + 500 ml aquades + 50 ml HCl 1%). Akar tersebut dikukus kembali dalam water bath pada suhu ± 80 0C selama 10 menit. Akar yang telah diwarnai tersebut dipotong sepanjang ±2 cm, kemudian di letakkan di atas preparat untuk diamati di bawah mikroskop majemuk dengan perbesaran 100 kali. Adanya infeksi ditandai dengan adanya struktur pembentuk mikoriza (hifa, vesikel, dan arbuskular) pada jaringan akar dan dihitung menggunakan rumus sebagai berikut:
Σ pengamatan yang positif terinfeksi
IV. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian dan pembahasan, dapat diambil kesimpulan sebagai berikut:
1. Inokulasi FMA pada saat bibit berumur 1 bulan menghasilkan pertumbuhan bibit kelapa sawit terbaik melalui peningkatan bobot kering tajuk, bobot kering akar, dan tinggi tanaman.
2. Dosis inokulum 400 spora FMA menghasilkan pertumbuhan bibit kelapa sawit terbaik melalui peningkatan bobot kering tajuk, bobot kering akar, bobot segar tajuk, jumlah daun, tinggi tanaman, dan persentase infeksi akar.
3. Respons bibit kelapa sawit terhadap waktu inokulasi ditentukan oleh dosis inokulum spora FMA yang digunakan pada variabel pengamatan tingkat kehijauan daun dan tinggi tanaman.
4. Dosis inokulum yang tepat untuk masing-masing waktu inokulasi tidak dapat diketahui karena pada variabel kunci respons bibit kelapa sawit terhadap waktu inokulasi tidak ditentukan oleh dosis FMA yang digunakan.
5.2 Saran
Berdasarkan penelitian yang telah dilakukan, terdapat beberapa saran sebagai berikut:
1. Perlu dilakukan pengujian ulang dosis basamid pada media tanah dan lamanya proses inkubasi dalam proses fumigasi untuk mensteril media tanam.
DAFTAR PUSTAKA
Aeni, E. N. 2005. Pengaruh inokulasi cendawan mikoriza (CMA) dan fumigasi media terhadap pertumbuhan bibik kakao (Theobroma cacao L.). Skripsi Fakultas Pertanian Universitas Lampung. Lampung.
Agrin. 2008. Studi sumber inokulum dan cara penyebaran patogen
Botryodiplodia theobromae penyebab penyakit kulit diplodia pada jeruk siam banjar. Jurnal Penelitian Dan Informasi Pertanian. 12(1): 89 – 99. Anas, I. 1997. Bioteknologi Tanah. Laboratorium Biologi Tanah Jurusan Ilmu
Tanah Fakultas Pertanian IPB. Bogor.
Brundrett, M., N. Bougher, B. Dell, T. Grove, and N. Malajczuk. 1996. Working with Mycorrhizas in Forestyr and Agriculture. Australia Centre For Internasional Agricultural Research (ACIAR). Camberra.
Clark, R. B. 1997. Arbuscular mycorrhizal adaptation, spore germination, root colonization, and host plant growth and mineral acquisition at low pH. Plant and Soil. 92: 15 – 22.
Delvian. 2004. Aplikasi cendawan mikoriza arbuskula dalam reklamasi lahan kritis pasca tambang. Karya Ilmiah Jurusan Kehutanan Fakultas Pertanian Universitas Sumatera Utara. Medan. 5 hlm.
Delvian. 2005. Respon pertumbuhan dan perkembangan cendawan mikoriza arbuskula dan tanaman terhadap salinitas tanah. Karya Ilmiah Jurusan Kehutanan Fakultas Pertanian Universitas Sumatera Utara. Medan. 4 hlm. FAPRI (Food and Agricultural Policy Reseach Institute). 2010. Prospek pasar
kelapa sawit.http://catatansangpenilai.wordpress.com/2011/08/17/prospek-pasar-kelapa-sawit. Diakses 15 Oktober 2011.
Hasan, Syaifudin Nur. 2012. Pengaruh jenis fungi mikoriza arbuskular pada pertumbuhan bibit kelapa sawit (Elaeis guineensis Jacq.) yang ditanam pada media yang terinfeksi dan tidak terinfeksi Ganoderma. Sp. Skripsi Fakultas Pertanian Universitas Lampung. Lampung.
Hasbie. 2011. Prospek pasar kelapa sawit. http://www.catatansangpenilai. wordpress.com/2011/08/17/prospek-pasar-kelapa-sawit/. Diakses tanggal 19 November 2011.
Husna, F. D. Tuheteru, dan Mahfudz. 2007. Aplikasi mikoriza untuk memacu pertumbuhan jati di Muna. Balai besar Penelitian dan Pemulian Tanaman Hutan. 5: 1.
Invam. 2012. Phylogeni perkembangan dan taksonomi ordo glomales. http://invam.caf.wvu.edu/fungi/taxonomy/classification.htm. Diakses tanggal 20 November 2011.
Irawan, Defky. 2011. Pengaruh 5 jenis fungi mikoriza arbuskular pada waktu terjadinya simbiosis dan pertumbuhan bibit kelapa sawit (Elaeis guineensis Jacq.). Skripsi Fakultas Pertanian Universitas Lampung. Lampung.
Iwan. 2011. Industri sawit RI masih kalah dari Malaysia. http://www.neraca. co.id/2011/10/04/industri-sawit-ri-masih-kalah-dari-malaysia. Diakses 29 juli 2012.
Jourdan, C. dan H. Rey. 1997. Architecture and development of the oil-palm (Elaeis guineensis Jacq) root system. Plant and Soil. 1(89): 33 – 48. Komisi Pengawas Persaingan Usaha Republik Indonesia (KPPU RI). 2007. Evaluasi kebijakan perkebunan kelapa sawit. Tidak dipublikasikan. Manan S. 1993. Pengaruh mikoriza pada pertumbuhan semai Pinus merkusi di
persemaian. kuliah silvikultur umum. Fakultas Kehutanan IPB. Bogor. 247 hlm.
Mosse, B. 1981. Vesicular-arbuscular mycorrhizal research for tropical agriculture. research bull. 194. College of Tropical Agriculture and Human Resources. University of Hawaii. Honolulu. USA. 82 p Nugroho, Arto Cahyo. 2008. Optimalisasi pemanfaatan cendawan mikoriza
arbuskula pada pembibitan tanaman kelapa sawit. Balai Besar Perbenihan dan Proteksi Tanaman Perkebunan Surabaya. Jawa Timur. Tidak
dipublikasikan
Pattimahu, D.V. 2004. Restorasi lahan kritis pasca tambang sesuai kaidah ekologi. Makalah Mata Kuliah Falsafah Sains. Sekolah Pasca Sarjana. IPB. Bogor. Jawa Barat.
PPKS. 2012a. Kelainan bibit kelapa sawit. Brosur pusat penelitian kelapa sawit Indonesia, Medan. Sumatera Utara. Tidak dipublikasikan.
PPKS. 2012b. Menangani bercak daun dan antraknosa di pembibitan kelapa sawit. Brosur pusat penelitian kelapa sawit Indonesia, Medan. Sumatera Utara. Tidak dipublikasikan.
PTPN VII. 2006. Kelapa sawit. http: // www.ptpn7.com/displaycontent. aspx?topic=Kelapa%20Sawit. Diakses 15 Oktober 2011.
PKSCWE (Politeknik Kelapa Sawit Citra Widya Edukasi). 2010. Penyakit pada pembibitan kelapa sawit. http://politeknikcitrawidyaedukasi.
wordpress.com/2010/01/29/penyakit-pada-pembibitan-kelapa-sawit. Diakses 29 juli 2012.
Sanders, F. E dan Sheikh. 1983. The development of vesicular-arbuscular
mycorrhizal infection in plant root systems. Plant and Soil. 71: 223 – 246. Simanungkalit, R.D.M. 2006. Pupuk Organik dan Pupuk Hayati. Balai Besar
Litbang Sumberdaya Lahan Pertanian Badan Penelitian dan Pengembangan Pertanian. Jawa Barat
Sitompul, S.M. dan B. Guritno. 1995. Analisis Pertumbuhan Tanaman. Gadjah Mada University Press. Yogyakarta.
Subiantoro, A. 2009. Petunjuk praktis kelapa sawit-2. http://andreysubiantoro. viviti.com/entries/sda/petunjuk-praktis-kelapa-sawit-2. Diakses 3 Agustus 2012.
Sucipto. 2012. Kemilau sawit 2012. http://www.investor.co.id/home/kemilau-sawit-2012/27788. Diakses 9 Agustus 2012.
Subiksa, I. G. M. 2002. Pemanfaatan mikoriz untuk penanggulangan lahan kritis. Makalah Falsafah Sains Program Pasca Sarjana Institut Pertanian Bogor. Suhardi. 1989. Cendawan mikoriza vesikular arbuskular. Pedoman Kuliah.
PAU-Bioteknologi Universitas Gajah Mada. Yogyakarta. 178 hlm. Wachjar, A.,Y. Setiadi, dan N. Yunike. 2002. Pengaruh inokulasi dua species
Widiastuti, H., E. Guhardja, N. Soekarno, L. K. Darusman, D. H. Goenadi, dan S. Smith. 2002. Optimasi simbiosis cendawan mikoriza arbuskula
Acaulospora tuberculata dan Gigaspora margarita pada bibit kelapa sawit di tanah masam. Menara Perkebunan. 70(2): 50 – 57. Widiastuti, H., N. Soekarno, L. K. Darusman, D. H. Goenadi, S. Smith, dan E.
Guhardja. 2005.Penggunaan spora cendawan mikoriza arbuskula sebagai inokulum untuk meningkatkan pertumbuhan dan serapan hara bibit kelapa sawit. Menara Perkebunan. 73: 26 – 34.