ABSTRAK
PENGARUH INOKULASI FUNGI MIKORIZA ARBUSKULAR DAN DOSIS PUPUK FOSFAT PADA PERTUMBUHAN BIBIT KELAPA SAWIT (Elaeis guineensis Jacq.) DAN JARAK PAGAR (Jatropha curcas L.)
DI PEMBIBITAN
Oleh RIO PALASTA
Fungi mikoriza arbuskular (FMA) adalah salah satu jenis fungi pembentuk
mikoriza yang telah banyak digunakan sebagai pupuk hayati. FMA dapat
digunakan untuk mengurangi penggunaan pupuk anorganik. Penelitian ini
bertujuan untuk menentukan jenis FMA yang paling cocok bersimbiosis dengan
bibit kelapa sawit dan jarak pagar, menentukan dosis pupuk P terbaik untuk untuk
pertumbuhan bibit kelapa sawit dan jarak pagar, serta menentukan apakah respons
pertumbuhan bibit kelapa sawit dan jarak pagar yang diinokulasi FMA
dipengaruhi oleh dosis pupuk P yang diberikan.
Penelitian ini dilaksanakan di rumah kaca dan Laboratorium Produksi
Perkebunan, Fakultas Pertanian, Universitas Lampung dari bulan Juni 2012—
Agustus 2013. Penelitian ini disusun dalam Rancangan Kelompok Teracak
Sempurna dengan 4 ulangan. Perlakuan disusun secara faktorial dan terdiri atas
Hasil penelitian menunjukkan bahwa (1) Glomus sp. isolat mv 15
merupakan jenis FMA yang paling cocok bersimbiosis dengan bibit kelapa sawit.
Sedangkan pada bibit jarak pagar adalah Entrophospora sp. isolat mv 3, (2) semua
dosis pupuk P yang diuji tidak ada yang menghasilkan pertumbuhan terbaik untuk
kedua tanaman tersebut, (3) respons pertumbuhan bibit kelapa sawit terhadap
inokulasi FMA tidak dipengaruhi oleh dosis pupuk P yang diberikan. Sedangkan
respons pertumbuhan bibit jarak pagar terhadap inokulasi FMA dipengaruhi oleh
dosis pupuk P yang ditunjukkan oleh variabel persentase infeksi akar dan
PENGARUH INOKULASI FUNGI MIKORIZA ARBUSKULAR DAN DOSIS PUPUK FOSFAT PADA PERTUMBUHAN BIBIT KELAPA
SAWIT (Elaeis guineensis Jacq.) DAN JARAK PAGAR (Jatropha curcas L.) DI PEMBIBITAN
Oleh RIO PALASTA
Tesis
Sebagai salah satu syarat mencapai gelar MAGISTER PERTANIAN
Pada
PROGRAM PASCASARJANA MAGISTER AGRONOMI FAKULTAS PERTANIAN
UNIVERSITAS LAMPUNG
PROGRAM PASCASARJANA MAGISTER AGRONOMI FAKULTAS PERTANIAN
UNIVERSITAS LAMPUNG BANDAR LAMPUNG
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 16 April 1980 sebagai putra keempat dari empat bersaudara pasangan (Alm) Bapak Drs. Sampit Sebayang dan Ibu Asiah Sitepu.
Penulis mengawali pendidikan formal pada tahun 1985 di TK Melania III Jakarta. Pada tahun 1986 penulis melanjutkan pendidikan dasar di SD Melania II Jakarta, tahun 1992 di SMP
Negeri 216 Jakarta, tahun 1995 di SMU Negeri 68 Jakarta, dan pada tahun 1999 penulis melanjutkan pendidikannya ke jenjang perguruan tinggi di Fakultas Pertanian Universitas Lampung.
Pada tahun 2005, penulis diterima sebagai Pegawai Negeri Sipil (PNS) pada Pemerintah Kota Metro dan ditempatkan pada instansi Badan Perencanaan Pembangunan Daerah (Bappeda). Pada tahun 2009, penulis terdaftar sebagai mahasiswa pada Program Studi
Kupersembahkan karya kecilku ini kepada istriku tersayang yang selalu memberikan semangat kepadaku, serta almamater
SANWACANA
Puji dan syukur penulis panjatkan ke hadirat Tuhan atas segala berkat dan karunia-Nya sehingga penulis dapat menyelesaikan tesis ini.
Dalam kesempatan ini penulis ingin mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Ibu Dr. Ir. Maria Viva Rini, M.Sc. selaku Pembimbing I atas
setiap bantuan, nasehat, saran, bimbingan, dukungan, serta perhatian pada penulis.
2. Bapak Dr. Ir. Agus Karyanto, M.Sc. selaku pembimbing II atas arahan, saran, dan bimbingan yang diberikan kepada penulis.
3. Ibu Prof. Dr. Ir. Ainin Niswati, M.Agr.Sc. selaku penguji atas segala saran, masukan, dan arahan yang telah diberikan. 4. Bapak Dr. Ir. Dwi Hapsoro, M.Sc. selaku Ketua Program Studi
Magister Agronomi atas bimbingan, nasehat, dan dukungannya kepada penulis.
5. Ibu Dr. Ir. Tumiar Katarina B. Manik, M.Sc. selaku pembimbing akademik yang telah membimbing penulis
6. Adinda Maulina yang selalu membantu, menghibur, serta
memberikan semangat kepada penulis.
7. Ibunda penulis yang selalu memberikan dukungan moril ketika penulis putus asa.
8. Bapak dan Ibu Mertua penulis yang membantu dan
menemani dalam menghadapi Seminar Hasil Penelitian dan Ujian Komperehensif.
9. Mas Rajino, Mas Gery, dan Mbak Anggun yang telah
membantu penulis baik di lahan maupun di laboratorium. 10. Mbak Ambar dan Mbak Sri yang telah membantu penulis
ketika mengurusi administrasi perkuliahan.
11. Mbak Rini, Ronald, Ade, Maulina, Palupi, dan Dwi atas
kebersamaan dan keceriaannya selama menjalani perkuliahan.
12. Serta rekan-rekan yang namanya tidak dapat disebut
satu-persatu.
Akhirnya penulis mendoakan semoga Tuhan membalas segala kebaikan mereka dan tesis ini dapat bermanfaat bagi semua pihak
yang berkepentingan.
Bandar Lampung, Agustus 2014 Penulis,
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... xiii
I. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 4
1.3 Tujuan Penelitian ... 5
1.4 Manfaat Penelitian ... 6
1.5 Landasan Teori ... 6
1.6 Kerangka Pemikiran ... 12
1.7 Hipotesis ... 15
II. TINJAUAN PUSTAKA ... 16
2.1 Kelapa Sawit ... 16
2.2 Jarak Pagar ... 19
2.3 Fungi Mikoriza Arbuskular (FMA) ... 20
2.4 Fosfat ... 24
2.5 Interaksi FMA dan P ... 28
III. BAHAN DAN METODE PENELITIAN ... 32
3.1 Waktu dan Tempat Penelitian ... 32
3.2 Alat dan Bahan Penelitian ... 32
3.3 Pelaksanaan Penelitian 1 ... 37
3.3.1 Metode Penelitian ... 37
3.3.2 Persiapan Media Tanam dan Bahan Tanam 38
3.3.3 Penyemaian di Prenursery ... 39
3.3.4 Aplikasi Mikoriza dan Pembibitan Main Nursery ... 39
3.3.5 Pengamatan ... 41
3.4 Pelaksanaan Penelitian 2 ... 43
3.4.1 Metode Penelitian ... 43
3.4.2 Persiapan Media Tanam dan Bahan Tanam 45
3.4.4 Aplikasi Mikoriza dan Pembibitan
Main Nursery ... 45
3.4.5 Pengamatan ... 47
IV. HASIL DAN PEMBAHASAN ... 51
4.1 Penelitian 1 ... 51
4.1.1 Hasil Pengamatan pada Bibit Kelapa Sawit 51
4.1.1.1 Tinggi Bibit ... 52
4.1.1.2 Jumlah Daun ... 53
4.1.1.3 Bobot Basah Tajuk ... 54
4.1.1.4 Bobot Basah Akar ... 55
4.1.1.5 Bobot Kering Tajuk ... 56
4.1.1.6 Bobot Kering Akar ... 57
4.1.1.7 Jumlah Akar Primer ... 58
4.1.1.8 Persentase Infeksi Akar ... 59
4.1.2 Pembahasan Penelitian 1 ... 60
4.2 Penelitian 2 ... 66
4.2.1 Hasil Pengamatan pada Bibit Jarak Pagar 66
4.2.1.1 Tinggi Bibit ... 67
4.2.1.2 Jumlah Daun ... 68
4.2.1.3 Bobot Basah Tajuk ... 69
4.2.1.4 Bobot Basah Akar ... 70
4.2.1.5 Bobot Kering Tajuk ... 71
4.2.1.6 Bobot Kering Akar ... 72
4.2.1.7 Jumlah Lateral Akar Primer ... 73
4.2.1.8 Persentase Infeksi Akar ... 74
4.2.1.9 Diameter Batang ... 76
4.2.1.10 Jumlah Cabang ... 77
4.2.1.11 Kadar Air Relatif pada Daun ... 78
4.2.1.12 Serapan Hara P ... 79
4.2.2 Pembahasan Penelitian 2 ... 80
4.3 Pembahasan Umum ... 83
V. KESIMPULAN ... 89
5.1 Simpulan ... 89
5.2 Saran ... 90
DAFTAR PUSTAKA ... 91
DAFTAR TABEL
Tabel Halaman
1. Taksonomi mikoriza ... 8
2. Dosis pemupukan bibit kelapa sawit ... 18
3. Dosis pemupukan bibit jarak pagar ... 20
4. Deskripsi FMA Entrophospora sp. isolat mv 3 ... 33
5. Deskripsi FMA Glomus sp. isolat mv 9 ... 34
6. Deskripsi FMA Glomus sp. isolat mv 10 ... 35
7. Deskripsi FMA Glomus sp. isolat mv 15 ... 36
8. Jadwal pemupukan dan dosis pupuk tanaman kelapa sawit di pembibitan ... 40
9. Jadwal pemupukan dan dosis pupuk tanaman jarak pagar di pembibitan ... 47
10. Rekapitulasi analisis ragam data penelitian bibit kelapa sawit ... 52
11. Tinggi bibit kelapa sawit yang diberi beberapa jenis FMA dosis pupuk pada umur 26 MST ... 53
12. Jumlah daun kelapa sawit yang diberi beberapa jenis FMA dosis pupuk pada umur 26 MST ... 54
13. Bobot basah tajuk kelapa sawit yang diberi beberapa jenis FMA dosis pupuk pada umur 26 MST ... 55
14. Bobot basah akar kelapa sawit yang diberi beberapa jenis FMA dosis pupuk pada umur 26 MST ... 56
16. Bobot kering akar kelapa sawit yang diberi beberapa jenis FMA dosis pupuk pada umur 26 MST ... 58 17. Jumlah akar primer kelapa sawit yang diberi
beberapa jenis FMA dosis pupuk pada umur 26 MST ... 59 18. Persentase infeksi akar kelapa sawit yang diberi
beberapa jenis FMA dosis pupuk pada umur 26 MST ... 60 19. Hasil pengukuran intensitas cahaya pada rumah
kaca yang digunakan untuk pembibitan kelapa sawit ... 63
20. Rekapitulasi analisis ragam data penelitian bibit jarak pagar ... 67
21. Tinggi bibit jarak pagar yang diberi beberapa jenis FMA dan dosis pupuk P pada umur 18 MST ... 68
22. Jumlah daun jarak pagar yang diberi beberapa jenis FMA dan dosis pupuk P pada umur 18 MST ... 69 23. Bobot basah tajuk jarak pagar yang diberi beberapa
jenis FMA dan dosis pupuk P pada umur 18 MST . 70
24. Bobot basah akar jarak pagar yang diberi beberapa jenis FMA dan dosis pupuk P pada umur 18 MST . 71 25. Bobot kering tajuk jarak pagar yang diberi beberapa
jenis FMA dan dosis pupuk P pada umur 18 MST . 72 26. Bobot kering akar jarak pagar yang diberi beberapa
jenis FMA dan dosis pupuk P pada umur 18 MST . 73 27. Jumlah akar lateral primer jarak pagar yang diberi
beberapa jenis FMA dan dosis pupuk P pada umur 18 MST ... 74 28. Persentase infeksi akar jarak pagar yang diberi
beberapa jenis FMA dan dosis pupuk P pada umur 18 MST ... 75 29. Diameter batang jarak pagar yang diberi beberapa
30. Jumlah cabang jarak pagar yang diberi beberapa jenis FMA dan dosis pupuk P pada umur 18 MST . 78 31. Kadar air relatif pada daun jarak pagar yang diberi
beberapa jenis FMA dan dosis pupuk P pada umur 18 MST ... 79 32. Hasil pengukuran intensitas cahaya pada
rumah kaca yang digunakan untuk pembibitan jarak pagar ... 86
33. Hasil pengamatan tinggi bibit kelapa sawit ... 102 34. Hasil pengamatan jumlah daun bibit kelapa sawit 102
35. Hasil pengamatan bobot basah tajuk bibit kelapa sawit ... 103 36. Hasil pengamatan bobot basah akar bibit
kelapa sawit ... 103
37. Hasil pengamatan bobot kering tajuk bibit kelapa sawit ... 104 38. Hasil pengamatan bobot kering akar bibit
kelapa sawit ... 104 39. Hasil pengamatan jumlah akar primer bibit
kelapa sawit ... 105 40. Hasil pengamatan persentase infeksi akar bibit
kelapa sawit ... 105 41. Uji bartlett data pengamatan bibit kelapa sawit ... 106 42. Uji tukey data pengamatan bibit kelapa sawit ... 106
43. Analisis ragam tinggi, jumlah daun, bobot basah tajuk, dan bobot basah akar bibit kelapa sawit ... 107 44. Analisis ragam bobot kering tajuk, bobot kering akar,
jumlah akar primer, dan persentase infeksi akar bibit kelapa sawit ... 108
46. Hasil pengamatan jumlah daun jarak pagar ... 109
47. Hasil pengamatan bobot basah tajuk jarak pagar .. 110
48. Hasil pengamatan bobot basah akar jarak pagar ... 110
49. Hasil pengamatan bobot kering tajuk jarak pagar .. 111
50. Hasil pengamatan bobot kering akar jarak pagar ... 111
51. Hasil pengamatan jumlah akar lateral primer jarak pagar ... 112
52. Hasil pengamatan persentase infeksi akar jarak pagar ... 112
53. Hasil pengamatan diameter batang jarak pagar ... 113
54. Hasil pengamatan jumlah cabang jarak pagar ... 113
55. Hasil pengamatan kadar air relatif pada daun jarak pagar ... 114
56. Uji bartlett data pengamatan bibit jarak pagar ... 114
57. Uji tukey data pengamatan bibit jarak pagar ... 115
58. Analisis ragam tinggi bibit jarak pagar ... 115
59. Analisis ragam jumlah daun, bobot basah tajuk, bobot basah akar, dan bobot kering tajuk bibit jarak pagar ... 116
60. Analisis ragam bobot kering akar, jumlah akar primer, persentase infeksi akar, dan diameter batang bibit jarak pagar ... 117
61. Analisis ragam jumlah cabang dan kadar air relatif bibit jarak pagar ... 118
DAFTAR GAMBAR
Gambar Halaman
1. Ilustrasi struktur FMA pada jaringan akar
tanaman ... 21 2. Tata letak percobaan penelitian I ... 38 3. Tata letak percobaan penelitian II ... 44
4. Grafik serapan hara P oleh tanaman jarak pagar yang diberi beberapa jenis FMA pada umur 18 MST ... 80 5. Beberapa sampel akar kelapa sawit dan
jarak pagar yang terinfeksi oleh FMA dengan
I. PENDAHULUAN
1.1 Latar Belakang
Penggunaan pupuk anorganik telah menjadi tradisi pada sistem
pertanian yang ada pada saat ini. Hal ini mulai dilakukan sejak
revolusi hijau mulai digemakan ke seluruh dunia pada awal
dekade 1960-an. Pada mulanya, penggunaan pupuk anorganik
memberikan dampak positif bagi petani dengan meningkatnya
hasil produksi tanaman. Namun penggunaan pupuk ini dalam
jangka panjang dapat mengakibatkan tanah mengeras, kurang
mampu menyimpan air, dan menurunkan pH tanah yang pada
akhirnya akan menurunkan hasil produksi tanaman (Parman,
2007). Untuk meningkatkan kembali produksi tanaman, petani
mulai menambah dosis pupuk sehingga biaya produksi semakin
meningkat dan keuntungan petani semakin merosot.
Simanungkalit (2006) melaporkan bahwa kelangkaan pupuk
anorganik yang sering terjadi pada setiap musim tanam
menyebabkan banyak petani harus mencari ke daerah lain dan
Oleh karena itu perlu diterapkan sebuah cara untuk mengurangi
penggunaan pupuk anorganik.
Beberapa cara yang telah dikembangkan untuk mengurangi
penggunaan pupuk anorganik adalah dengan menggunakan
pupuk organik dan pupuk hayati. Menurut Simanungkalit (2006),
pupuk organik adalah nama kolektif untuk semua jenis bahan
organik yang berasal dari hewan dan tanaman yang dapat
terdekomposisi menjadi hara tersedia bagi tanaman. Sedangkan
pupuk hayati adalah nama kolektif untuk semua kelompok
fungsional mikroba tanah yang dapat menyediakan hara tersedia
bagi tanaman di dalam tanah. Mikroba tanah yang tergolong
dalam kategori ini adalah rhizobium, fungi mikoriza arbuskular,
mikroba pelarut fosfat, dan lain-lain.
Fungi mikoriza adalah salah satu jenis fungi pembentuk mikoriza
yang belakangan ini mulai dikembangkan sebagai pupuk hayati.
Sedangkan mikoriza adalah asosiasi simbiosis antara tumbuhan
dan fungi yang hidup dalam tanah (Brundrett, 2002). Keuntungan
dari penggunaan fungi ini antara lain; (1) semua bahan
perbanyakannya yang terdiri dari spora, media tanam, serta
tanaman inangnya tersedia di dalam negeri, (2) dapat diproduksi
dengan mudah, 3) pemberian cukup sekali seumur hidup tanaman,
dan 4) memberikan manfaat pada rotasi tanaman berikutnya
Fungi mikoriza arbuskular (FMA) adalah salah satu jenis fungi
pembentuk mikoriza yang telah banyak digunakan sebagai pupuk
hayati. Saat ini banyak sekali penelitian yang membuktikan
bahwa FMA mampu meningkatkan serapan hara baik hara makro
maupun mikro, sehingga FMA dapat digunakan untuk mengurangi
dan mengefisienkan penggunaan pupuk anorganik. Menurut
Husin dan Marlis (2000), FMA dapat memperpanjang dan
memperluas jangkauan akar terhadap penyerapan unsur hara
terutama unsur hara yang tidak mobile di dalam tanah seperti
fosfat (P). Bolan (1991) juga melaporkan bahwa FMA dapat
mengeluarkan enzim fosfatase dan asam-asam organik khususnya
oksalat yang dapat membantu membebaskan P dari senyawa
kompleks di dalam tanah.
Unsur P sangat diperlukan dalam pertumbuhan tanaman.
Kekurangan unsur hara ini dapat mengurangi kemampuan
tanaman untuk mengabsorbsi unsur hara lainnya (Soepardi, 1983).
Menurut Buckman dan Brady (1982) unsur hara P digunakan oleh
tanaman untuk pembelahan sel, pembentukan lemak,
pembungaan, pembuahan, perkembangan akar, memperkuat
batang, dan kekebalan terhadap penyakit. Namun kendala yang
sering dihadapi adalah fosfat di dalam tanah sering tidak tersedia
karena sebagian besar unsur ini berada dalam bentuk terfiksasi.
Kelapa sawit (Elaeis guineensis Jacq.) dan jarak pagar (Jatropha
curcas L.) adalah tanaman perkebunan yang memiliki nilai
ekonomis yang tinggi. Tanaman kelapa sawit menghasilkan
minyak nabati yang dapat digunakan sebagai bahan baku pada
industri minyak makan, dan industri oleokimia (Balitbang
Pertanian, 2007). Begitu juga dengan tanaman jarak pagar yang
menghasilkan minyak nabati yang dapat dijadikan bahan baku
untuk pembuatan biodiesel dan industri sabun (Hambali dan
Mujdalipah, 2006). Namun sebagaimana tanaman pada umumnya,
kedua tanaman tersebut juga memerlukan pemupukan yang
berimbang untuk mencapai produksi yang optimum. Menurut
Riwandi (2002), biaya pemupukan untuk tanaman kelapa sawit
mencapai 50% dari total biaya pemeliharaan. Oleh karena
besarnya biaya pemupukan tersebut, maka inokulasi FMA pada
tanaman kelapa sawit dan jarak pagar perlu dilakukan untuk
mengurangi biaya pemupukan. Namun tidak semua jenis FMA
dapat bersimbiosis secara optimum pada kedua tanaman tersebut.
Oleh karena itu perlu ditemukan jenis FMA yang dapat
bersimbiosis secara optimum pada kedua tanaman tersebut.
1.2 Perumusan Masalah
Berdasarkan latar belakang masalah yang ada, percobaan ini
dilakukan untuk menjawab permasalahan yang dirumuskan
1. Jenis FMA apa yang paling cocok bersimbiosis dengan tanaman
kelapa sawit dan jarak pagar di pembibitan?
2. Berapakah dosis pupuk P yang terbaik untuk pertumbuhan
tanaman kelapa sawit dan jarak pagar di pembibitan?
3. Apakah respons pertumbuhan bibit kelapa sawit dan jarak
pagar terhadap inokulasi FMA dipengaruhi oleh dosis pupuk P
yang diberikan?
4. Berapakah dosis pupuk P terbaik untuk tanaman kelapa sawit
dan jarak pagar yang diinokulasi FMA dan tanaman kelapa
sawit dan jarak pagar yang tidak diinokulasi di pembibitan?
1.3 Tujuan Penelitian
Berdasarkan latar belakang dan perumusan masalah yang telah
dikemukakan, maka dapat dirumuskan tujuan penelitian sebagai
berikut:
1. Menentukan jenis FMA yang paling cocok bersimbiosis dengan
tanaman kelapa sawit dan jarak pagar di pembibitan.
2. Menentukan dosis pupuk P yang terbaik untuk pertumbuhan
tanaman kelapa sawit dan jarak pagar di pembibitan.
3. Menentukan apakah respons pertumbuhan tanaman kelapa
sawit dan jarak pagar yang diinokulasi FMA dipengaruhi oleh
4. Menentukan dosis pupuk P terbaik untuk tanaman kelapa
sawit dan jarak pagar yang diinokulasi FMA dan tanaman
kelapa sawit dan jarak pagar yang tidak diinokulasi FMA di
pembibitan.
1.4 Manfaat Penelitian
Hasil penelitian ini diharapkan bermanfaat bagi peneliti,
pengusaha perkebunan, petani dan masyarakat umum dalam
menghasilkan bibit tanaman kelapa sawit dan jarak pagar yang
berkualitas serta dapat menghemat penggunaan pupuk anorganik.
1.5 Landasan Teori
Dalam rangka menyusun penjelasan teoretis terhadap pertanyaan
yang telah dikemukakan, penulis menggunakan landasan teori
sebagai berikut:
Fosfat (P) merupakan salah satu unsur hara makro yang penting
dalam pertumbuhan dan perkembangan tanaman. Unsur tersebut
digunakan tanaman sebagai penyusun metabolit dalam senyawa
kompleks sebagai aktivator, kofaktor atau penyatu enzim serat,
dan molekul pentransfer energi ADP dan ATP (Marschner, 1995).
Fosfat bersifat tidak mobile di dalam tanah (McWilliams, 2003).
Fosfat bergerak menuju akar tanaman dengan cara difusi yang
atau pengurasan P di sekitar akar (Smith, 2002). Fosfat memiliki
sifat khas yakni sukar larut dalam air namun larut dalam asam
lemah. Hal itu juga menjadi salah satu kendala rendahnya
ketersediaan P di dalam tanah (Syekhfani, 1999). Selain itu, pada
tanah masam (pH<5), unsur ini diikat kuat oleh liat, aluminium,
dan besi. Sedangkan pada tanah alkalis (pH>8), unsur ini diikat
kuat oleh kalsium (Syekhfani, 1999). Dengan demikian, akar
tanaman tidak mampu untuk mengabsorpsi unsur hara tersebut.
Untuk mengatasi hal tersebut, akar tanaman dapat dibantu oleh
fungi mikoriza.
Fungi mikoriza adalah fungi yang hidup dalam tanah yang
berasosiasi dengan tanaman tingkat tinggi sehingga membentuk
simbiosis mutualisme (Numahara, 1993). Berdasarkan struktur
tubuh dan cara menginfeksinya, fungi mikoriza dapat
dikelompokkan menjadi dua yakni endomikoriza dan ektomikoriza
(Rao dan Shuba, 1994). Kelompok fungi endomikoriza memiliki
jaringan hifa yang masuk ke dalam sel korteks dan membentuk
struktur yang khas seperti oval yang disebut vesikular atau
bercabang yang disebut arbuskular (Musfal, 2010). Sedangkan
kelompok ektomikoriza memiliki jaringan hifa yang tidak sampai
masuk ke sel korteks, tetapi berkembang diantara sel tersebut dan
Fungi mikoriza arbuskular (FMA) merupakan salah satu jenis
endomikoriza yang dapat membantu akar tanaman untuk
mengabsorpsi unsur hara terutama unsur hara P dari dalam
tanah. Hal ini disebabkan jaringan hifa eksternal FMA yang
menginfeksi akar tanaman dapat dengan mudah menerobos
pori-pori tanah yang tidak dapat ditembus oleh rambut-rambut akar
tanaman (Beethlenfalvay dan Linderman, 1992).
Fungi mikoriza arbuskular memiliki banyak spesies yang tersebar
di seluruh dunia. Namun secara garis besar para ilmuwan telah
sepakat untuk mengklasifikasikan FMA sesuai dengan Tabel 1.
Tabel 1. Taksonomi mikoriza (Krüger, 2011)
Ordo Famili Genus
Glomales Glomeraceae Glomus Funneliformis Rhizophagus Sclerocytis Claroideoglomeraceae Claroideoglomus Diversisporales Diversisporaceae Redeckera
Diversispora Otospora Acaulosporaceae Acaulospora Entrophosporaceae Entrophospora Gigasporaceae Gigaspora
Scutellospora Racocetra Pacisporaceae Pacispora Archaeosporales Geosiphonaceae Geosiphon
Menurut Orcutt dan Nielsen (2000), FMA dapat meningkatkan
serapan hara dengan cara berikut; (1) memperluas permukaan
akar karena adanya hifa eksternal yang berukuran lebih kecil
dibandingkan akar sehingga dapat menembus pori-pori tanah, (2)
mempercepat pergerakan P ke akar melalui peningkatan afinitas P
ke akar sehingga mengurangi konsentrasi ambang yang
diperlukan P untuk berdifusi, (3) mengubah lingkungan rhizosfer
secara kimia melalui pelepasan asam organik dan peningkatan
aktivitas fosfatase, dan (4) meningkatkan produksi fitohormon
yang dapat mengubah fenotipe akar sehingga meningkatkan
kapasitas penyerapan hara total. Secara fungsional, FMA
membantu penyerapan hara terutama P melalui tiga tahap yaitu;
(1) fosfat diserap oleh hifa dari larutan tanah, (2) translokasi P
melalui hifa, dan (3) transfer P melewati interfase ruang fungi
(Cruz et al., 2004). Bolan (1991) juga melaporkan bahwa FMA
menghasilkan enzim fosfatase yang dapat melepaskan unsur P
yang terikat unsur Al dan Fe pada tanah masam dan Ca pada
tanah berkapur sehingga P akan tersedia bagi tanaman.
Fungi mikoriza arbuskular merupakan fungi yang bersifat obligat
atau tidak mampu melengkapi daur hidupnya tanpa melakukan
simbiosis dengan akar tanaman. FMA menginfeksi akar tanaman
(Marschner, 1995). Selanjutnya perkembangan infeksi FMA di
akar tanaman inang berhubungan dengan pembentukan gula dan
asam organik. Gianinazzi-Pearson dan Gianinazzi (1983)
menyatakan bahwa FMA dapat dengan cepat mengkonversi dan
mentransfer hasil fotosintat tanaman inang ke dalam senyawa
karbon yang spesifik sebagai lipid atau glikogen.
Fungi mikoriza arbuskular dapat bersimbiosis dengan banyak
tanaman. Namun efektivitas dari masing-masing simbiosis
tersebut tidak sama. Brundrett et al. (1996) menyatakan bahwa
efektivitas dari sebuah simbiosis antara FMA dengan tanaman
inang ditentukan oleh jenis FMA, jenis tanaman inang, jenis tanah,
serta interaksi antara ketiganya. Setiap jenis tanaman juga
memberikan respons yang berbeda terhadap FMA. Setiap FMA
memiliki perbedaan dalam kemampuannya meningkatkan serapan
unsur hara dari dalam tanah dan pertumbuhan tanaman (Daniels
dan Menge, 1981). Kemampuan FMA dalam meningkatkan
serapan unsur hara juga dipengaruhi oleh faktor lingkungan
seperti suhu, intensitas cahaya, pH tanah, kadar air tanah,
ketersediaan unsur hara, kandungan bahan organik dalam tanah,
serta residu akar (Gianinazzi-Pearson dan Gianinazzi, 1983).
Menurut Swift (2004) pada tanah yang mengalami defisiensi fosfor
(P), simbiosis FMA dengan akar tanaman akan menguntungkan,
tidak menguntungkan. Simbiosis FMA dengan akar tanaman
akan efektif apabila kandungan P tersedia di dalam tanah tidak
melebihi 70 ppm (Feldman dan Idczak, 1992). Schubert dan
Hayman (1978) melaporkan bahwa FMA tidak akan efektif
bersimbiosis dengan akar tanaman pada tanah yang memiliki
kadar P tersedia 100 ppm atau lebih. Sedangkan Abbot dan
Robson (1977) melaporkan bahwa FMA jenis Glomus fasciculatum
tidak akan efektif bersimbiosis dengan akar tanaman ketika
kandungan P tersedia dalam tanah mencapai 133 ppm.
Irianto (2009) menyatakan bahwa bibit jarak pagar yang
diinokulasi dengan Glomus yang berasal dari rhizosfer tanaman
akasia dan mahoni dapat meningkatkan tinggi, diameter batang,
dan bobot kering bibit. Nurhalisyah (2012) juga melaporkan
bahwa jenis mikoriza yang ditemukan pada pembibitan awal
kelapa sawit adalah Glomus dan Acaulospora. Sedangkan pada
pembibitan utama kelapa sawit yang ditemukan hanya Glomus.
Sundari et al. (2011) menyatakan bahwa dari berbagai jenis FMA,
Glomus adalah jenis FMA yang paling dominan penyebarannya di
berbagai daerah. Hal ini menunjukan bahwa Glomus memiliki
daya adaptasi yang cukup tinggi terhadap lingkungan baik itu
pada kondisi tanah masam maupun netral. Yulianitha et al.
(2011) melaporkan bahwa Glomus mempunyai kemampuan
dibandingkan FMA jenis lainnya. Menurut Ruiz-Lozano et al.
(2000), Glomus mampu hidup dan berkembang pada tanah
dengan kondisi salinitas yang tinggi.
1.6 Kerangka Pemikiran
Berdasarkan landasan teori yang telah dikemukakan, berikut ini
disusun kerangka pemikiran untuk memberikan penjelasan
teoretis terhadap perumusan masalah.
Untuk mencapai hasil produksi tanaman yang optimum, maka
tanaman memerlukan faktor pertumbuhan yang optimum juga.
Salah satu faktor tersebut adalah tercukupinya kebutuhan
tanaman akan unsur hara makro terutama P.
Tanaman membutuhkan P dalam jumlah yang relatif besar.
Unsur hara tersebut digunakan tanaman untuk pembentukan ATP
yang merupakan sumber energi utama pada hampir semua proses
biologis yang terjadi pada tanaman. Untuk memenuhi
kebutuhannya terhadap unsur hara P, maka tanaman juga harus
mampu menyerap unsur hara tersebut dari dalam tanah.
Tanaman menyerap unsur hara dalam tanah melalui akar.
Namun akar tanaman memiliki keterbatasan dalam menyerap
unsur hara. Akar tanaman hanya mampu menyerap unsur hara
yang dapat dijangkaunya dan unsur hara yang bebas atau tidak
Oleh karena itu, kemampuan akar dalam menyerap unsur hara di
dalam tanah akan ditingkatkan dengan adanya FMA yang
bersimbiosis dengan akar tersebut.
Saat spora FMA ditaburkan di sekitar akar tanaman, spora
tersebut membentuk hifa yang perlahan-lahan akan menginfeksi
akar tanaman dan masuk ke dalam sel akar. Kemudian fungi
tersebut akan mengubah morfologi akar dan menghasilkan hifa
eksternal yang fungsinya hampir sama dengan akar tanaman.
Hifa dapat tumbuh melebihi panjangnya rambut akar tanaman
sehingga lebih efektif untuk menyerap air dan unsur hara yang
tidak terjangkau oleh akar tanaman terutama unsur hara fosfor (P)
yang bersifat tidak mobile di dalam tanah. FMA juga
menghasilkan enzim fosfatase yaitu enzim yang mampu
membebaskan P dari senyawa-senyawa kompleks di dalam tanah
sehingga menjadi tersedia bagi tanaman.
Simbiosis antara FMA dengan akar tanaman merupakan simbiosis
mutualisme. Dalam simbiosis tersebut FMA mengambil eksudat
akar dan hasil fotosintesis dari tanaman dan tanaman
mendapatkan unsur hara dan air. Namun efektivitas dari
simbiosis tersebut dipengaruhi oleh 3 faktor yang saling
berinteraksi yakni kadar unsur hara dalam tanah, jenis FMA, dan
tanaman inang. Pada tanah yang banyak mengandung unsur
akar tanaman inang. Namun jika tanah tersebut kekurangan
unsur hara, maka mikoriza akan mudah sekali terbentuk. Hal ini
disebabkan akar tanaman akan memproduksi eksudat akar yang
berlebih jika mengalami defisiensi unsur hara. Eksudat akar
merupakan sumber nutrisi bagi FMA sehingga FMA akan
bersimbiosis dengan akar tanaman untuk mendapatkan eksudat
akar tersebut. Jenis FMA dan tanaman inang juga berpengaruh
terhadap pembentukan mikoriza. Hal itu disebabkan tidak semua
FMA dapat efektif bersimbiosis dengan akar tanaman inang
tertentu.
Dari beberapa jenis FMA yang telah teridentifikasi, Glomus sp.
dikenal sebagai jenis FMA yang memiliki daya adaptasi yang tinggi
terhadap berbagai jenis tanah dan lingkungan. Jenis FMA ini juga
memiliki kemampuan simbiosis yang tinggi terhadap berbagai
jenis tanaman budidaya. Namun jenis FMA ini akan lebih efektif
bersimbiosis dengan akar tanaman apabila diaplikasikan pada
jenis tanah dan lingkungan yang sesuai dengan habitat alaminya.
FMA yang bersimbiosis dengan akar tanaman akan terus
beregenerasi sehingga populasi FMA di dalam tanah akan terus
bertambah. Dengan bertambahnya populasi FMA di dalam tanah,
maka semakin banyak pula unsur hara yang dapat diserap oleh
tanaman. Unsur hara yang diserap tersebut akan digunakan
tanaman untuk pertumbuhannya. Dengan demikian, maka tinggi
1.7 Hipotesis
Berdasarkan kerangka pemikiran yang telah dikemukakan, maka
hipotesis yang diajukan adalah:
1. Glomus sp. isolat mv 10 dan Glomus sp. isolat mv 15
merupakan jenis FMA yang paling cocok bersimbiosis dengan
tanaman kelapa sawit dan jarak pagar pada pembibitan.
2. Dosis pupuk P yang sesuai dengan dosis anjuran merupakan
dosis pupuk yang terbaik untuk pertumbuhan tanaman kelapa
sawit dan jarak pagar di pembibitan.
3. Tanaman kelapa sawit dan jarak pagar yang diinokulasi FMA
memberikan respons yang berbeda terhadap dosis pupuk P
II. TINJAUAN PUSTAKA
2.1 Kelapa Sawit
Kelapa sawit (Elaeis guineensis Jacq.) merupakan tanaman
penghasil minyak yang berasal dari Afrika Barat. Tanaman ini
pertama kali ditanam di Indonesia oleh Bangsa Belanda dengan
bibit yang berasal dari Mauritius dan Amsterdam. Bibit tersebut
ditanam di Kebun Raya Bogor untuk dijadikan tanaman koleksi
pada tahun 1848. Tanaman koleksi inilah yang menjadi nenek
moyang dari tanaman kelapa sawit yang dibudidayakan di Asia
Tenggara khususnya Indonesia dan Malaysia (Hadi, 2004).
Menurut Pahan (2008), kelapa sawit dibedakan menjadi 3 tipe
yaitu:
1. Pisifera, umumnya tidak memiliki cangkang dan bunga
betinanya steril sehingga sangat jarang menghasilkan buah.
Kandungan minyak pada buah tanaman ini mencapai 40%.
2. Dura, memiliki cangkang dengan tebal sekitar 2—8 mm.
Kandungan minyak pada buahnya sekitar 16—18% dan pada
umumnya digunakan sebagai pohon induk untuk
3. Tenera, tanaman ini merupakan hasil persilangan dari Dura
dan Pisifera. Buahnya memiliki cangkang dengan tebal 0,5—4
mm dan kandungan minyaknya sekitar 22—32%.
Tanaman kelapa sawit dapat tumbuh baik pada jenis tanah
podzolik, latosol, hidromorfik kelabu, alluvial atau regosol, tanah
gambut, dataran pantai, dan muara sungai. Tanaman ini dapat
tumbuh optimum pada tanah dengan pH sekitar 5,0—5,5 dan
berdrainase baik. Lama penyinaran yang optimum untuk
tanaman ini adalah 5—7 jam/hari dengan curah hujan tahunan
1.500—4.000 mm dan suhu optimum berkisar 24—28oC (Balai
Pengkajian Teknologi Pertanian, 2008).
Pemupukan merupakan hal yang sangat penting untuk
mengoptimalkan pertumbuhan dan produksi kelapa sawit. Hakim
(2007) menyatakan bahwa 50% biaya produksi kelapa sawit
digunakan untuk pemupukan. Oleh karena itu pemupukan yang
tepat waktu dan tepat dosis harus diterapkan untuk mencapai
hasil produksi yang optimal. Standar dosis pemupukan yang
dianjurkan oleh Pusat Penelitian Kelapa Sawit (PPKS) terdapat
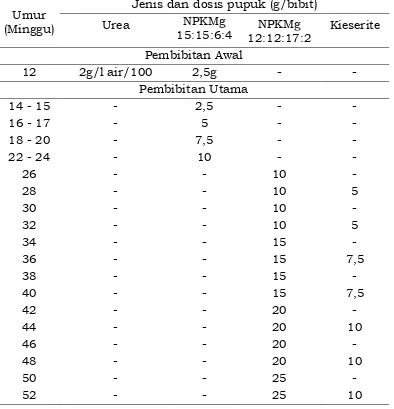
Tabel 2. Dosis pemupukan bibit kelapa sawit (PPKS, 2009).
Umur (Minggu)
Jenis dan dosis pupuk (g/bibit)
Urea NPKMg
15:15:6:4 12:12:17:2 NPKMg Kieserite Pembibitan Awal
12 2g/l air/100 2,5g - -
Pembibitan Utama
14 - 15 - 2,5 - -
16 - 17 - 5 - -
18 - 20 - 7,5 - -
22 - 24 - 10 - -
26 - - 10 -
28 - - 10 5
30 - - 10 -
32 - - 10 5
34 - - 15 -
36 - - 15 7,5
38 - - 15 -
40 - - 15 7,5
42 - - 20 -
44 - - 20 10
46 - - 20 -
48 - - 20 10
50 - - 25 -
52 - - 25 10
Secara alami akar tanaman kelapa sawit membentuk simbiosis
mutualisme dengan fungi mikoriza arbuskular (FMA) untuk
menyerap unsur hara di dalam tanah. Berdasarkan penelitian
Nurhalisyah (2012) pada perkebunan kelapa sawit di Kabupaten
Kutai Barat Provinsi Kalimantan Timur, jenis FMA yang ditemukan
pada kebun pembibitan awal kelapa sawit adalah Glomus dan
ditemukan hanya Glomus saja. Sedangkan pada tanaman belum
menghasilkan (TBM) yang ditemukan hanya Acaulospora saja.
2.2 Jarak Pagar
Jarak Pagar (Jatropha curcas L.) merupakan tanaman penghasil
minyak yang diperkirakan berasal dari daerah tropis di Meksiko,
Amerika Tengah. Tanaman ini diintroduksi ke Indonesia oleh
tentara Jepang pada saat perang dunia kedua untuk digunakan
sebagai bahan bakar pesawat (Balai Pengkajian Teknologi
Pertanian, 2006).
Tanaman jarak pagar telah menyebar luas di daerah tropis dan
subtropis. Tanaman ini tumbuh pada daerah dengan ketinggian
0—1.700 meter di atas permukaan laut atau pada suhu antara
18—35oC. Heller (1996) melaporkan bahwa tanaman ini dapat
tumbuh dengan baik pada daerah dengan curah hujan 200—2.000
mm pertahun, dan pertumbuhan terbaiknya didapatkan pada
daerah dengan curah hujan 900—1.200 mm pertahun (Becker dan
Makkar, 1999). Suhu optimal untuk pertumbuhan tanaman ini
adalah 18oC—30oC. Suhu yang terlalu rendah (<18oC) dapat
menghambat pertumbuhan tanaman. Sedangkan suhu yang
terlalu tinggi (>35oC) dapat menyebabkan daun dan bunganya
berguguran sehingga dapat menurunkan produksi buah.
Tanaman ini juga dapat tumbuh optimal pada tanah dengan pH
Pemupukan adalah salah satu kegiatan dalam pembibitan jarak
pagar yang bertujuan untuk meningkatkan ketersediaan unsur
hara bagi bibit jarak pagar. Dengan tercukupinya kebutuhan bibit
jarak pagar akan unsur hara diharapkan pertumbuhannya dapat
optimal sehingga menghasilkan bibit yang berkualitas baik. Salim
(2010) menganjurkan dosis pemupukan bibit jarak pagar seperti
[image:34.595.114.516.337.477.2]yang terdapat pada Tabel 2.
Tabel 3. Dosis pemupukan bibit jarak pagar.
Umur Bibit (Minggu)
Dosis Pupuk (gram)
Urea SP-36 KCl
1 20 20 10
2 0 0 0
3 0 0 0
4 20 0 0
Tanaman jarak pagar adalah tanaman yang secara alami dapat
bersimbiosis dengan FMA. Muzakkir (2010) melaporkan bahwa
jenis FMA yang ditemukan secara alami pada rhizosfer jarak pagar
adalah Glomus, Acaulospora, dan Gigaspora.
2.3 Fungi Mikoriza Arbuskular (FMA)
FMA merupakan salah satu jenis endomikoriza yang dapat
meningkatkan kemampuan tanaman dalam penyerapan air dan
beberapa karakteristik yaitu perakaran inang yang terinfeksi tidak
membesar, tetapi mempunyai rambut-rambut akar sehingga
penampilannya tidak berbeda dengan akar-akar yang tidak
terinfeksi. Karakteristik lain yang merupakan ciri khas FMA
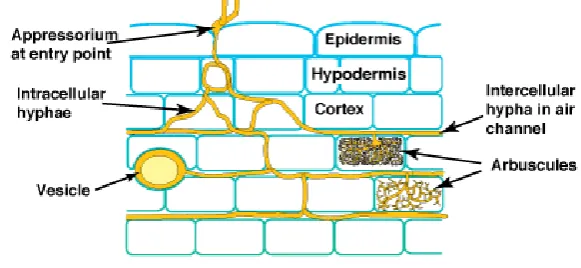
adalah adanya struktur berbentuk percabangan hifa yang disebut
arbuskular dan ada juga yang membentuk struktur berbentuk
oval yang disebut vesikular (Gambar 1). Jenis FMA yang
membentuk arbuskular dan vesikular adalah jenis Glomus,
Paraglomus, Acaulospora, dan Entrophospora, sedangkan jenis
yang lain seperti Gigaspora dan Scutellospora hanya membentuk
[image:35.595.129.420.405.539.2]struktur arbuskular (Brundrett et al., 1996).
Gambar 1. Ilustrasi struktur FMA pada jaringan akar tanaman (Brundrett, 2008).
Secara umum proses kolonisasi FMA pada akar tanaman melalui 4
tahap yaitu (1) induksi perkecambahan spora dan pertumbuhan
hifa, (2) kontak antara hifa dan permukaan akar yang
menyebabkan pengenalan dan pembentukan apresorium, (3)
penetrasi hifa ke dalam akar, dan (4) perkembangan struktur hifa
Pada tanaman yang bersimbiosis dengan FMA, penyerapan hara
terutama P menjadi lebih besar karena penyerapan akar diperluas
oleh miselium eksternal FMA. Kabirun (2002) melaporkan bahwa
kecepatan masuknya P ke dalam hifa FMA enam kali lebih cepat
daripada kecepatan masuknya P melalui rambut akar. Aldeman
dan Morton (1986) melaporkan bahwa infeksi FMA pada akar
tanaman dapat meningkatkan pertumbuhan tanaman dan
kemampuannya untuk menyerap unsur P, Ca, N, Cu, Mn, K, dan
Mg. Hal ini disebabkan adanya hifa eksternal yang tumbuh dan
berkembang melalui bulu akar sehingga jangkauan akar untuk
menyerap unsur hara menjadi lebih luas.
Simbiosis FMA dengan akar tanaman juga memberi beberapa
keuntungan diantaranya mikoriza dapat membantu penyerapan
hara dan air melalui perluasan daerah penyerapan akar serta
meningkatkan efisiensi penggunaan pupuk fosfat (Sastrahidayat,
2000). Terjadinya simbiosis antara akar tanaman dan FMA sangat
tergantung pada jenis FMA, tanaman inang, status tanah, serta
interaksi ketiganya (Brundrett et al., 1996). Sedangkan intensitas
infeksi FMA dipengaruhi oleh berbagai macam faktor seperti
pemupukan, nutrisi tanaman, pestisida, intensitas cahaya,
musim, kelembaban, pH tanah, kepadatan inokulum, serta tingkat
kerentaan tanaman (Fakuara, 1988). Intensitas infeksi FMA juga
Beberapa faktor lingkungan yang mempengaruhi pertumbuhan
dan perkembangan hifa FMA adalah sebagai berikut:
1. Oksigen, Setiadi (1996) melaporkan bahwa penurunan
konsentrasi oksigen dapat menghambat perkecambahan spora
FMA dan kolonisasi akar.
2. Suhu, Gunawan (1993) melaporkan bahwa suhu tanah yang
tinggi umumnya dapat meningkatkan kolonisasi dan sporulasi
FMA yang tinggi.
3. Cahaya, besarnya intensitas cahaya sangat menentukan
jumlah FMA yang terbentuk. Hal ini disebabkan cahaya
matahari berperan dalam pembentukan karbohidrat melalui
asimilasi karbon yang selanjutnya akan digunakan oleh FMA
sebagai sumber energi bagi pertumbuhannya (Fakuara, 1988).
4. Tingkat keasaman (pH) tanah, perkembangan spora FMA
sangat dipengaruhi oleh pH tanah. Setiadi (1996) menyatakan
bahwa pH optimum untuk pertumbuhan dan perkembangan
spora Glomus sp antara 5,5—9,5. Sedangkan pH optimum
untuk pertumbuhan dan perkembangan Gigaspora sp sekitar
4—6.
FMA memiliki selang ekologi yang luas dan dapat ditemukan pada
berbagai ekosistem seperti semak dan sabana, arid, semi arid,
daerah tropika, daerah antartika, ekosistem gambut alami, hutan
dapat diisolasi dari tanah asam hingga alkalin dengan pH tanah
berkisar 2,7—9,2. Sieverding (1991) melaporkan bahwa FMA yang
cocok hidup pada pH<5,0 adalah Entrophospora columbiana, pada
pH>5,0 adalah Glomus mosseae dan Gigaspora margarita, serta
pada kisaran pH 4,0—8,0 terdiri dari Acaulospora myriocarpa,
Acaulospora longula, Acaulospora morrowae, Acaulospora
scrobiculata, Glomus aggregatum, Glomus vesiforme, dan
Scutellospora pellucida. Beberapa penelitian juga menunjukkan
bahwa pada setiap jenis tanah dan jenis tanaman ditemukan jenis
FMA yang berbeda. Hanafiah (2001) melaporkan bahwa di sawah
tadah hujan di Bogor ditemukan 2 isolat Gigaspora dan 5 isolat
Glomus. Pada tanah PMK bekas hutan ditemukan 4 isolat Glomus
dan 5 isolat Acaulospora. Sedangkan pada tanah PMK bekas
perkebunan karet ditemukan 7 isolat Glomus dan 2 isolat
Acaulospora (Kartika, 2006).
2.4 Fosfat
Fosfat merupakan salah satu unsur hara makro yang dibutuhkan
oleh tanaman dalam jumlah banyak selain nitrogen dan kalium.
Peranan fosfat yang paling penting adalah untuk memacu
pertumbuhan generatif tanaman, memacu pertumbuhan akar, dan
pembentukan sistem perakaran (Schmidt, 2000). Menurut
Marschner (1995) dan Havlin et al. (1999), fungsi P pada tanaman
1. Sebagai penyusun struktur makromolekul dalam asam nukleat
(DNA atau RNA), nukleotida, fosfoprotein, fosfolipid, dan fosfat
gula. Asam nukleat adalah senyawa yang berperan dalam
pewarisan sifat dan perkembangan tanaman sehingga tanpa
unsur P proses tersebut tidak akan berlangsung sempurna.
2. Sebagai salah satu unsur penyusun biomembran, yakni
membentuk jembatan antara digliserida dan molekul yang lain
(asam amino, amina atau alkohol), membentuk fosfatidilkolin
yang berfungsi untuk menjaga integritas membran.
3. Sebagai sumber penyimpan dan transfer energi dalam bentuk
ATP, ADP, dan AMP. Energi yang diperoleh dari fotosintesis
dan metabolisme karbohidrat disimpan dalam bentuk fosfat
dan selanjutnya digunakan dalam proses pertumbuhan dan
reproduksi. Energi dalam ATP/ADP terletak pada ikatan
pirofosfat yang pemecahannya akan melepaskan energi yang
dikenal dengan proses fosforilasi. ATP merupakan sumber
energi pada hampir semua proses biologi yang memerlukan
energi.
4. Mengontrol beberapa reaksi enzim kunci. Hampir semua
reaksi metabolisme selalu melewati turunan fosfat. Fosfat juga
berfungsi sebagai regulator reaksi biokimia yang dapat
mengaktivasi atau menginaktivasi protein yang dianggap
5. Digunakan untuk pembentukan biji dan buah. Fosfat juga
berperan dalam pertumbuhan akar dan pemasakan buah.
Menurut Lingga dan Marsono (2001), apabila tanaman
kekurangan unsur hara P akan mengakibatkan daunnya terlihat
tua dan tampak mengkilap kemerahan, buahnya kecil,
penampilannya buruk, dan lekas matang.
Pada umumnya unsur fosfat di alam terdapat dalam tiga bentuk
yaitu P anorganik terlarut, P anorganik tidak larut, dan P organik.
Bentuk P organik yang sering ditemukan di dalam tanah adalah
dalam bentuk fosfolipid, asam nukleat, dan fosfat inositol. Jika P
organik mengalami proses mineralisasi, maka akan terbentuk
H2PO4- yang akan segera diikat oleh komponen tanah. Sedangkan
P anorganik dapat dibedakan menjadi dua yakni; (1) P aktif, yang
terdiri dari P-Ca, P-Al, P-Fe, dan (2) P tidak aktif yang terdiri dari
occlude-P dan mineral fosfor primer (Soepardi, 1983). Fosfat
bersifat tidak mobile dan mudah terjerap dalam liat dan
logam-logam di dalam tanah seperti Al, Fe, dan Ca.
Fosfat diserap tanaman dalam bentuk H2PO4-, HPO42-, dan PO43-.
Absorpsi ion-ion tersebut dipengaruhi oleh pH tanah di sekitar
akar (Engelstad, 1997). Pada pH rendah (pH<5) tanaman lebih
banyak menyerap H2PO4-, dan pada pH tinggi (pH>8) tanaman
Menurut Jones (1982) tanaman hanya mampu menyerap 15—20%
dari pupuk fosfat yang diberikan ke dalam tanah, sedangkan
sisanya akan terjerap diantara koloid tanah dan tinggal sebagai
residu di dalam tanah. Penyerapan P oleh tanaman sebagian
besar dilakukan dengan cara difusi. Difusi merupakan
mekanisme pergerakan P menuju akar karena adanya perbedaan
konsentrasi. Difusi P sangat dipengaruhi oleh beberapa faktor di
dalam tanah yakni kadar air tanah, kapasitas penyangga P tanah,
suhu, dan bentuk lintasan difusi (Havlin et al., 1999).
Gunawan (1993) mengemukakan ada beberapa mekanisme
penyerapan fosfat oleh tanaman dari sumber P tidak larut yaitu:
1. Fosfat organik dapat diabsorpsi oleh tanaman bermikoriza
melalui aksi enzim fosfatase. Enzim fosfatase yang dihasilkan
oleh hifa yang sedang aktif tumbuh dan peningkatan aktivitas
fosfatase pada permukaan akar menyebabkan Pi dibebaskan
oleh fosfat pada daerah dekat permukaan sel sehingga dapat
diserap melalui akar.
2. Sumber fosfat organik dapat dilarutkan oleh adanya
asam-asam organik. Banyak fungi yang menghasilkan asam-asam oksalat
sehingga dapat mengkelat ion Ca atau membuang ion tersebut
dari larutan tanah dalam bentuk kalsium oksalat. Asam
oksalat juga dapat memacu pelepasan ion fosfat yang
3. Beberapa bakteri pelarut fosfat dan fungi tanah dapat
melepaskan P ke dalam pool P labil di dalam tanah yang
selanjutnya dapat diserap oleh tanaman bermikoriza.
Pada saat ini telah banyak beredar pupuk anorganik yang
mengandung fosfat baik itu dalam bentuk pupuk tunggal ataupun
pupuk majemuk. Menurut FAO (2005) pupuk yang mengandung
fosfat yang paling dominan digunakan di Indonesia adalah Triple
Superphosphate (TSP) dan Super Phosphate (SP-36). Pupuk TSP
adalah pupuk tunggal berbentuk butiran padat dengan komponen
utama berupa monokalsium fosfat. Pupuk ini memiliki rumus
kimia Ca (H2PO4)2 dan mengandung 45% P2O5 (IPNI, 2012).
Pupuk TSP memiliki beberapa kelebihan dibandingkan pupuk
fosfat lainnya. Beberapa kelebihannya antara lain mengandung P
yang sangat tinggi (± 45%), memiliki P terlarut lebih dari 90%
sehingga dapat langsung diserap oleh akar tanaman. Namun
belakangan ini peran pupuk TSP mulai digantikan oleh pupuk
SP-36 yang mengandung SP-36% P2O5. Hal ini disebabkan penggunaan
pupuk SP-36 dinilai lebih ekonomis dibandingkan dengan pupuk
TSP.
2.5 Interaksi FMA dan P
Inokulasi FMA pada akar tanaman dapat mempengaruhi
Hal itu disebabkan FMA mampu memproduksi jalinan hifa secara
intensif sehingga luas daerah penyerapan hara terutama P menjadi
lebih besar. FMA juga menghasilkan asam-asam organik dan
enzim fosfatase sehingga mampu melepaskan P yang terjerap
dalam liat, Al, Fe, dan Ca (Gunawan, 1993). Setiadi (2000) juga
menyatakan bahwa inokulasi FMA pada tanaman Acacia mangium
mampu menghemat pengunaan P sebesar 180 kg/ha/tahun.
FMA membantu akar tanaman menyerap P dari dalam tanah
melalui tiga mekanisme yakni:
1. Mekanisme fisik. Infeksi FMA pada akar tanaman dapat
membantu penyerapan P dengan cara memperluas permukaan
serapan akar. Miselium FMA yang tumbuh memanjang dapat
mengambil P yang berada di luar jangkauan akar. Pada
umumnya daerah di sekitar perakaran mengalami kekosongan
unsur hara terutama P atau yang lebih dikenal dengan
depletion zone. Hayman (1983) menyatakan bahwa depletion
zone ini terjadi karena akar tanaman menyerap P lebih cepat
daripada gerakan P yang berdifusi lambat ke permukaan akar
akibat kurangnya mobilitas ion-ion fosfat dalam tanah.
Menurut Suciatmih (1996) panjang hifa FMA dalam tanah
dapat mencapai 2,6—54 meter/gram tanah. Hal tersebut
mengeksplorasi tanah jauh lebih besar dibandingkan akar
yang tidak terinfeksi.
2. Mekanisme kimia. Menurut Hayman (1983) sekitar 95—99% P
yang ada di dalam tanah terdapat dalam bentuk tidak larut
sehingga menjadi tidak tersedia bagi tanaman. Mosse (1981)
menyatakan bahwa FMA mengeluarkan eksudat berupa
anion-anion seperti poligalakturonat, sitrat, dan oksalat. Eksudat ini
menyebabkan perubahan pH rhizosfer menjadi sekitar 6,3
sehingga P yang terikat oleh liat, Fe, dan Al dapat dilepaskan
dan menjadi tersedia bagi tanaman.
3. Mekanisme fisiologis. Hayman (1983) menyatakan bahwa akar
yang terinfeksi oleh FMA memiliki metabolisme energi yang
lebih besar sehingga lebih aktif dalam menyerap P pada
konsentrasi 10-7—10-6 di dalam larutan akar sehingga menjadi
10-3—10-2 di dalam akar tanaman. FMA juga menghasilkan
berbagai jenis hormon seperti auksin, sitokinin, dan giberelin.
Hormon auksin berfungsi untuk mencegah atau
memperlambat proses penuaan dan suberasi akar (feeder root)
sehingga fungsi akar sebagai penyerap unsur hara dapat
diperpanjang.
Simbiosis antara FMA dan akar tanaman tidak selamanya dapat
berlangsung secara efektif. Schubert dan Hayman (1978)
apabila tanah mengalami defisiensi unsur P dan efektivitas
simbiosis tersebut akan menurun seiring dengan meningkatnya
kadar P dalam tanah. Pernyataan tersebut juga didukung oleh
Amijee et al. (1989) yang melaporkan bahwa infeksi FMA pada
akar tanaman secara signifikan berkurang pada tanah yang
mengandung P. De Miranda et al. (1989) juga melaporkan bahwa
penambahan pupuk P pada tanah dapat menyebabkan penundaan
infeksi akar oleh FMA sehingga persentase infeksi akar menjadi
rendah. Menurut Swift (2004) pembentukan simbiosis mikoriza
mencapai maksimum jika kadar P dalam tanah tidak lebih dari 50
III. BAHAN DAN METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan di rumah kaca dan Laboratorium
Produksi Perkebunan, Fakultas Pertanian, Universitas Lampung
dari Bulan Juni 2012 sampai dengan Bulan Agustus 2013.
3.2 Alat dan Bahan Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah polibag
ukuran 10 x 15 cm, polibag ukuran 15 x 30 cm, bak plastik,
cangkul, gembor, sekop, karung plastik, kertas label, autoclave,
saringan mikro (ukuran 250 μm, 150 μm, dan 63 μm), gelas
preparat, cawan petri, mikroskop majemuk, mikroskop stereo,
timbangan elektronik, pinset mikro, nampan plastik, botol film,
preparat, cover slide, pisau pemotong, penggaris, jangka sorong,
oven listrik, dan alat tulis. Sedangkan bahan yang digunakan
dalam penelitian ini adalah benih tanaman kelapa sawit, benih
tanaman jarak pagar, top soil, pasir, bahan organik, kompos,
basamid, pupuk urea, pupuk TSP, pupuk KCl, larutan KOH 10%,
yang terdiri dari Entrophospora sp.isolat mv 3, Glomus sp. isolat
mv 9, Glomus sp. isolat mv 10, dan Glomus sp. isolat mv 15.
Deskripsi dari keempat jenis FMA tersebut terdapat pada Tabel 4,
5, 6, dan 7.
Tabel 4. Deskripsi FMA Entrophospora sp. isolat mv 3.
No Rincian Keterangan
1 Spesies Entrophospora sp.
2 Bentuk Bulat
3 Ukuran Kecil
4 Warna Kuning emas
5 Sporocarp (S) dan Sporiferous saccule (SS)
S: Tidak ada; SS: Ada
6 Spora di dalam/di luar akar atau keduanya
Ada
7 Cara subtending hifa melekat ke dinding spora
Tanpa sekat
8 Bulbose suspensor (BS) dan Auxiliary cells (AC)
BS: Tidak ada; AC: Tidak ada
9 Germination Shield Tidak ada
10 Reaksi terhadap Melzer Positif
11 Media Perbanyakan Pasir
12 Tanaman inang Jagung
13 Asal Kebun kelapa sawit di Simpang Sribawono, Lampung
14 Gambar spora dalam larutan Polivinyl Lacto Glicerol (PVLG) dan Melzer’s
[image:47.595.116.518.240.736.2]Tabel 5. Deskripsi FMA Glomus sp. isolat mv 9.
No Rincian Keterangan
1 Spesies Glomus sp.
2 Bentuk Bulat
3 Ukuran Kecil-sedang
4 Warna Putih--kekuningan
5 Sporocarp (S) dan Sporiferous saccule (SS)
S: Tidak ada; SS: Tidak ada
6 Spora di dalam/di luar akar atau keduanya
Di luar akar
7 Cara subtending hifa melekat ke dinding spora
Tanpa sekat
8 Bulbose suspensor (BS) dan Auxiliary cells (AC)
BS: Tidak ada; AC: Tidak ada
9 Germination Shield Tidak ada
10 Reaksi terhadap Melzer Negatif
11 Media Perbanyakan Zeolit
12 Tanaman inang Jagung
13 Asal Kebun kelapa sawit di Sungai Galuh, Riau
14 Gambar spora dalam larutan Polivinyl Lacto Glicerol (PVLG) dan Melzer’s
[image:48.595.117.515.124.592.2]Tabel 6. Deskripsi FMA Glomus sp. isolat mv 10.
No Rincian Keterangan
1 Spesies Glomus sp.
2 Bentuk Bulat
3 Ukuran Kecil
4 Warna Putih--kekuningan
5 Sporocarp (S) dan Sporiferous saccule (SS)
S: Tidak ada; SS: Tidak ada
6 Spora di dalam/di luar akar atau keduanya
Di luar dan di dalam akar
7 Cara subtending hifa melekat ke dinding spora
Tanpa sekat
8 Bulbose suspensor (BS) dan Auxiliary cells (AC)
BS: Tidak ada; AC: Tidak ada
9 Germination Shield Tidak ada
10 Reaksi terhadap Melzer Negatif
11 Media Perbanyakan Pasir+zeolit
12 Tanaman inang PJ
13 Asal Kebun kelapa sawit di Gunung Para, Sumatera Utara
14 Gambar spora dalam larutan Polivinyl Lacto Glicerol (PVLG) dan Melzer’s
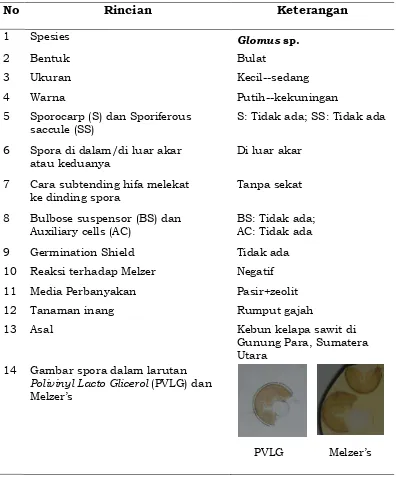
[image:49.595.114.516.129.626.2]Tabel 7. Deskripsi FMA Glomus sp. isolat mv 15.
No Rincian Keterangan
1 Spesies Glomus sp.
2 Bentuk Bulat
3 Ukuran Kecil--sedang
4 Warna Putih--kekuningan
5 Sporocarp (S) dan Sporiferous saccule (SS)
S: Tidak ada; SS: Tidak ada
6 Spora di dalam/di luar akar atau keduanya
Di luar akar
7 Cara subtending hifa melekat ke dinding spora
Tanpa sekat
8 Bulbose suspensor (BS) dan Auxiliary cells (AC)
BS: Tidak ada; AC: Tidak ada
9 Germination Shield Tidak ada
10 Reaksi terhadap Melzer Negatif
11 Media Perbanyakan Pasir+zeolit
12 Tanaman inang Rumput gajah
13 Asal Kebun kelapa sawit di Gunung Para, Sumatera Utara
14 Gambar spora dalam larutan Polivinyl Lacto Glicerol (PVLG) dan Melzer’s
[image:50.595.116.512.125.618.2]3.3 Pelaksanaan Penelitian 1
Pengaruh inokulasi FMA dan dosis pupuk P pada pertumbuhan bibit kelapa sawit di pembibitan.
3.3.1 Metode Penelitian
Untuk menjawab rumusan masalah dan untuk menguji hipotesis
maka percobaan ini disusun dengan menggunakan rancangan
perlakuan faktorial (5×3) dengan 4 ulangan. Faktor pertama
adalah jenis FMA yang terdiri dari m0 (tanpa FMA), m1
(Entrophospora sp. isolat mv 3), m2 (Glomus sp. isolat mv 9), m3
(Glomus sp. isolat mv 10), m4 (Glomus sp. isolat mv 15). Faktor
kedua adalah dosis pupuk yaitu p1 (23,32 gram TSP/tanaman
atau sesuai dosis anjuran), P2 (15,55 gram TSP/tanaman atau 2/3
dosis anjuran), dan P3 (11,66 gram TSP/tanaman atau 1/2 dosis
anjuran). Masing-masing perlakuan diulang sebanyak 4 kali
sehingga diperoleh 60 satuan percobaan. Setiap perlakuan
diterapkan ke dalam satuan percobaan menurut rancangan
kelompok teracak sempurna (RKTS). Setiap satu satuan
percobaan diwakili oleh satu tanaman.
Selanjutnya data yang diperoleh diuji dengan uji Bartlett untuk
menguji homogenitas ragam dan uji Tukey untuk sifat
kemenambahan data. Apabila asumsi terpenuhi yaitu ragam
ragam dan dilanjutkan dengan uji BNT pada taraf 5%. Tata letak
percobaan di lapangan dapat dilihat pada Gambar 2.
Kelompok II Kelompok I
m1p1 m0p1 m1p2 m2p2 m2p3 m4p3
m3p2 m0p2 m0p3 m3p2 m4p2 m1p2
m2p3 m4p2 m2p1 m1p3 m0p2 m4p1
m1p3 m3p3 m2p2 m0p1 m3p3 m1p1
m3p1 m4p1 m4p3 m3p1 m0p3 m2p1
Kelompok IV Kelompok III
m0p2 m3p3 m1p1 m3p1 m3p3 m0p2
m4p1 m3p2 m0p3 m4p3 m0p3 m4p2
m4p2 m2p2 m1p3 m3p2 m1p1 m1p2
m1p2 m3p1 m4p3 m4p1 m2p3 m2p2
m2p1 m0p1 m2p3 m1p3 m0p1 m2p1
Keterangan:
m0 = tanpa FMA (kontrol)
m1 = Entrophospora sp. isolat mv 3 m2 = Glomus sp. isolat mv 9
m3 = Glomus sp. isolat mv 10 m4 = Glomus sp. isolat mv 15
[image:52.595.109.478.152.487.2]p1 = 23,32 gram TSP p2 = 15,66 gram TSP p3 = 11,66 gram TSP
Gambar 2. Tata letak percobaan penelitian I.
3.3.2Persiapan Media Tanam dan Bahan Tanam
Media tanam yang digunakan untuk penyemaian (prenursery)
benih kelapa sawit adalah campuran topsoil dan pasir dengan
perbandingan 2:1 dan telah disterilkan dengan autoclave.
Sedangkan media tanam untuk pembibitan (main nursery) adalah
campuran topsoil, bahan organik, dan pasir dengan perbandingan
Bahan tanam yang digunakan adalah benih kelapa sawit Tenera
(D×P) yang berasal dari Pusat Penelitian Kelapa Sawit (PPKS)
Medan. Benih tersebut adalah benih yang telah berkecambah
(germinated seed)
3.3.3 Penyemaian di Prenursery
Benih kelapa sawit yang telah berkecambah disemai dalam polibag
berukuran 10×15 cm yang telah berisi campuran topsoil dan pasir
dengan perbandingan 2:1 dan telah disterilkan. Penyemaian
dilakukan dengan cara membenamkan benih kelapa sawit ke
dalam media tanam sampai seluruh permukaan benih tertutup
tanah. Kemudian benih disiram setiap hari. Pemupukan
dilakukan setelah benih berumur 4 minggu dan diberi pupuk
setiap dua minggu sekali. Pupuk yang digunakan adalah pupuk
urea yang dilarutkan dalam air dengan dosis 2 gram/liter/100
tanaman. Hal itu dilakukan terus-menerus sampai dengan 12
minggu setelah tanam.
3.3.4Aplikasi Mikoriza dan Pembibitan Main Nursery
Aplikasi FMA dilakukan setelah benih kelapa sawit telah disemai
selama 12 minggu dan telah tumbuh menjadi tanaman muda
(bibit). Aplikasi dilakukan dengan cara mencabut bibit dari
prenursery (polibag berukuran 10×15 cm) dengan hati-hati
berukuran 15×30 cm yang telah berisi campuran topsoil, bahan
organik, dan pasir dengan perbandingan 2:1:1, telah disterilkan,
dan diberi lubang tanam. Pada saat bibit telah dipindahkan ke
lubang tanam pada main nursery, daerah sekitar perakaran bibit
ditaburi inokulan FMA sesuai perlakuan sebanyak ± 500 spora,
lalu lubang tanam ditimbun tanah agar bibit dapat berdiri tegak.
Lalu masing-masing polibag diberi label sesuai dengan perlakuan
yang diberikan. Kemudian polibag-polibag tersebut disusun di
dalam rumah kaca sesuai dengan tata letak percobaan.
Pemeliharaan tanaman dilakukan dengan cara penyiraman setiap
hari dan pemupukan seperti yang tertera pada Tabel 8. Standar
dosis pemupukan bibit kelapa sawit yang digunakan disesuaikan
dengan standar dosis pemupukan yang dianjurkan oleh Pusat
[image:54.595.113.515.537.679.2]Penelitian Kelapa Sawit (PPKS).
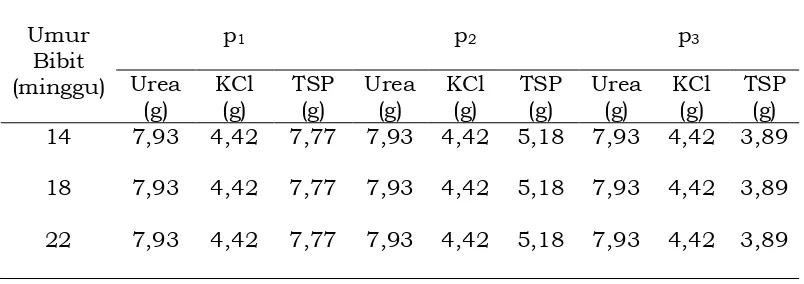
Tabel 8. Jadwal pemupukan dan dosis pupuk tanaman kelapa sawit di pembibitan.
Umur Bibit (minggu)
p1 p2 p3
Urea (g) KCl (g) TSP (g) Urea (g) KCl (g) TSP (g) Urea (g) KCl (g) TSP (g) 14 7,93 4,42 7,77 7,93 4,42 5,18 7,93 4,42 3,89
18 7,93 4,42 7,77 7,93 4,42 5,18 7,93 4,42 3,89
3.3.5 Pengamatan
Penelitian diakhiri setelah bibit ditanam selama 26 minggu di
pembibitan. Untuk menguji kesahihan kerangka pemikiran dan
hipotesis dilakukan pengamatan terhadap peubah-peubah sebagai
berikut :
1. Tinggi bibit
Pengamatan dilakukan dengan mengukur tinggi bibit mulai dari
pangkal batang sampai ujung daun tertinggi.
2. Jumlah daun
Pengamatan dilakukan dengan menghitung pelepah daun yang
telah membuka sempurna pada tanaman.
3. Bobot basah tajuk
Pengamatan dilakukan dengan menimbang seluruh tajuk yang
telah dipisahkan dengan akar.
4. Bobot basah akar
Pengamatan dilakukan dengan menimbang bobot seluruh akar
yang keluar dari pangkal batang.
5. Bobot kering tajuk
Pengamatan dilakukan dengan menimbang tajuk yang sudah
dikeringkan dalam oven pada suhu 80oC sampai bobotnya
6. Bobot kering akar
Pengamatan dilakukan dengan mengeringkan seluruh akar yang
keluar dari pangkal batang dengan oven pada suhu 80oC sampai
beratnya konstan, lalu ditimbang.
7. Jumlah akar primer
Pengamatan dilakukan dengan menghitung jumlah akar yang
keluar dari pangkal batang.
8. Persentase infeksi akar oleh FMA
Pengamatan ini dilakukan pada 18 buah akar sekunder yang
diambil secara acak. Sampel akar dicuci sampai bersih dan
dimasukkan ke dalam botol film. Botol yang sudah berisi sampel
akar diisi dengan larutan KOH 10% sampai seluruh akar terendam
dan dikukus selama 30 menit pada suhu 80oC. Larutan KOH
selanjutnya dibuang, dan akar dicuci dengan air mengalir sampai
bersih. Sampel akar kemudian direndam dalam larutan HCL 1%
dan dikukus selama 30 menit pada suhu 80oC. Setelah selesai,
larutan HCl dibuang dan akar siap untuk diwarnai dengan
merendamnya dalam larutan Trypan blue 0,05% ( 0,5 gram
Trypan blue dalam 450 ml glycerol + 50 ml HCl 1% + 500 ml
aquades) minimal selama 1 hari. Akar yang telah diwarnai
dipotong-potong sepanjang ± 1,5 cm dan disusun sebanyak 3 baris
pada gelas preparat, dan setiap baris terdiri dari 6 helai akar.
Kemudian akar tersebut diletakkan di atas preparat, ditetesi
dengan cover slide dan diberi label. Selanjutnya preparat akar
diamati di bawah mikroskop majemuk dengan perbesaran 100
kali. Setiap helai akar sekunder yang diamati dibagi menjadi 5—
6 titik pengamatan. Perhitungan persentase infeksi akar
dilakukan dengan menggunakan rumus berikut ini.
3.4 Pelaksanaan Penelitian II
Pengaruh inokulasi fungi mikoriza arbuskular dan dosis pupuk P pada pertumbuhan bibit jarak pagar di pembibitan.
3.4.1 Metode Penelitian
Pada penelitian ini, percobaan disusun dengan menggunakan
rancangan perlakuan faktorial (5×3) dengan 4 ulangan. Faktor
pertama adalah jenis mikoriza yang terdiri dari m0 (tanpa FMA), m1
(Entrophospora sp. isolat mv 3), m2 (Glomus sp. isolat mv 9), m3
(Glomus sp. isolat mv 10), m4 (Glomus sp. isolat mv 15). Faktor
kedua adalah dosis pupuk yaitu p1 (15,65 gram TSP/tanaman
atau sesuai dosis anjuran), p2 (10,43 gram TSP/tanaman atau 2/3
dosis anjuran), p3 (7,83 gram TSP/tanaman atau 1/2 dosis
anjuran). Masing-masing perlakuan diulang sebanyak 4 kali
sehingga diperoleh 60 satuan percobaan. Setiap perlakuan
kelompok teracak sempurna (RKTS). Setiap satu satuan
percobaan diwakili oleh satu tanaman.
Selanjutnya data yang diperoleh diuji dengan uji Bartlett untuk
menguji homogenitas ragam dan uji Tukey untuk sifat
kemenambahan. Apabila asumsi terpenuhi yaitu ragam homogen
dan data bersifat menambah, maka data dianalisis ragam dan
dilanjutkan dengan uji BNT pada taraf 5%. Tata letak percobaan
di lapangan dapat dilihat pada Gambar 3.
Kelompok II Kelompok I
m1p1 m0p1 m1p2 m2p2 m2p3 m4p3
m3p2 m0p2 m0p3 m3p2 m4p2 m1p2
m2p3 m4p2 m2p1 m1p3 m0p2 m4p1
m1p3 m3p3 m2p2 m0p1 m3p3 m1p1
m3p1 m4p1 m4p3 m3p1 m0p3 m2p1
Kelompok IV Kelompok III
m0p2 m3p3 m1p1 m3p1 m3p3 m0p2
m4p1 m3p2 m0p3 m4p3 m0p3 m4p2
m4p2 m2p2 m1p3 m3p2 m1p1 m1p2
m1p2 m3p1 m4p3 m4p1 m2p3 m2p2
m2p1 m0p1 m2p3 m1p3 m0p1 m2p1
Keterangan:
p1 = 15,65 gram TSP p2 = 10,43 gram TSP p3 = 7,83 gram TSP
m0 = tanpa FMA (kontrol)
m1 = Entrophospora sp. isolat mv 3 m2 = Glomus sp. isolat mv 9
[image:58.595.115.491.321.647.2]m3 = Glomus sp. isolat mv 10 m4 = Glomus sp. isolat mv 15
3.4.2 Persiapan Media Tanam dan bahan Tanam
Media tanam yang digunakan untuk penyemaian (prenursery)
benih jarak pagar adalah pasir yang telah disterilkan dengan
autoclave. Sedangkan media tanam untuk pembibitan (main
nursery) adalah campuran topsoil, kompos, dan pasir dengan
perbandingan 2:1:1 dan telah disterilkan juga dengan autoclave.
Bahan tanam yang digunakan adalah benih jarak pagar yang
berasal dari perkebunan rakyat.
3.4.3 Penyemaian
Benih jarak pagar disemai dalam bak plastik yang telah berisi
pasir yang telah disterilkan. Penyemaian dilakukan dengan cara
membenamkan benih jarak pagar ke dalam media tanam sampai
seluruh permukaan benih tertutup tanah. Kemudian benih
disiram setiap hari. Hal itu dilakukan terus-menerus sampai
dengan 7 hari setelah tanam. Pada tahap ini, pemupukan tidak
perlu dilakukan karena benih masih memanfaatkan cadangan
makanan yang terdapat pada endospermanya.
3.4.4 Aplikasi Mikoriza dan Pembibitan Main Nursery
Aplikasi mikoriza dilakukan pada saat benih jarak pagar telah
disemai selama 7 hari dan telah tumbuh menjadi tanaman muda
prenursery (polibag berukuran 10×15 cm) dengan hati-hati
kemudian memindahkannya ke main nursery, yakni polibag
berukuran 15×30 cm yang telah berisi campuran topsoil, kompos,
dan pasir dengan perbandingan 2:1:1, telah disterilkan, dan diberi
lubang tanam. Pada saat bibit telah dipindahkan ke lubang tanam
pada main nursery, daerah sekitar perakaran bibit ditaburi
inokulan FMA sesuai perlakuan sebanyak ± 500 spora, lalu lubang
tanam ditimbun tanah agar bibit dapat berdiri tegak. Lalu
masing-masing polibag diberi label sesuai dengan perlakuan yang
diberikan. Kemudian polibag-polibag tersebut disusun di dalam
rumah kaca sesuai dengan tata letak percobaan.
Pemeliharaan tanaman dilakukan dengan cara penyiraman setiap
hari dan pemupukan seperti yang tertera pada Tabel 9. Standar
dosis pemupukan bibit jarak pagar yang digunakan disesuaikan
dengan standar dosis pemupukan yang dilaporkan oleh Salim
Tabel 9. Jadwal pemupukan dan