ANALISIS KANDUNGAN KROMIUM, MANGAN DAN ZINK
PADA BUAH KELOR (Moringa oleifera Lam.) SECARA
SPEKTROFOTOMETRI SERAPAN ATOM
SKRIPSI
OLEH:
FHIZRI AYUNINGTYAS
NIM 121524031
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
ANALISIS KANDUNGAN KROMIUM, MANGAN DAN ZINK
PADA BUAH KELOR (Moringa oleifera Lam.) SECARA
SPEKTROFOTOMETRI SERAPAN ATOM
SKRIPSI
Diajukan Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Farmasi Pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
FHIZRI AYUNINGTYAS
NIM 121524031
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
iv
KATA PENGANTAR
Bismillaahirrahmaanirrahiim,
Puji dan syukur penulis ucapkan kehadirat Allah SWT, Tuhan semesta
alam, yang telah melimpahkan rahmat dan keberkahan-Nya, sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini, serta shalawat dan
salam bagi Rasulullah Muhammad SAW sebagai suri tauladan dalam hidup dan kehidupan.
Skripsi ini disusun untuk melengkapi salah satu syarat mencapai gelar
Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara, dengan judul “Analisis Kandungan Kromium, Mangan dan Zink Pada Buah Kelor (Moringa
oleifera Lam.) Secara Spektrofotometri Serapan Atom”
Penulis mengucapkan terima kasih kepada Ibu Dra dan I
memberikan banyak waktu, bimbingan dan nasihat selama penelitian hingga selesainya penyusunan skripsi ini. Penulis juga mengucapkan terima kasih kepada Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas Farmasi
Universitas Sumatera Utara dan Ibu Prof. Dr. Julia Reveny, M.Si., Apt., selaku Wakil Dekan I Fakultas Farmasi Universitas Sumatera Utara yang telah
memberikan fasilitas sehingga penulis dapat menyelesaikan pendidikan. Selain itu, penulis juga mengucapkan terima kasih kepada Bapak
telah memberikan evaluasi dan masukan kepada penulis dalam penyusunan skripsi
v
seluruh Staf Pengajar Fakultas Farmasi USU yang telah banyak membimbing dan mendidik penulis selama masa perkuliahan hingga selesai.
Pada kesempatan ini penulis juga mengucapkan terima kasih kepada
Ayahanda Zulkifli AR. dan Ibunda Faridah tercinta yang telah memberikan pengorbanan tidak ternilai, baik moril maupun materil serta terima kasih kepada
Fauzi, Abang Denny, Kak Eca, Kak Tarry, Kak Maya, Arnis, Dinda, Lia, Futri, Dadang, Didi dan Fanny atas doa dan dukungannya dalam penyelesaian skripsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan, sehingga penulis mengharapkan kritik dan saran yang bersifat membangun. Akhir
kata, semoga tulisan ini dapat bermanfaat bagi pembaca dan menjadi sumbangan yang berarti bagi ilmu pengetahuan khususnya dalam bidang ilmu farmasi.
Medan, Juli 2015 Penulis,
vi
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Uraian Tumbuhan ... 5
2.1.1 Daerah tumbuh (habitat) ... 5
2.1.2 Morfologi tumbuhan ... 5
2.1.3 Sistematika tumbuhan ... 6
vii
2.1.5 Nama asing ... 7
2.1.6 Kandungan kimia ... 7
2.1.7 Khasiat tumbuhan ... 8
2.2 Mineral ... 8
2.2.1 Kromium ... 9
2.2.2 Mangan ... 10
2.2.3 Zink ... 11
2.3 Destruksi ... 12
2.4 Spektrofotometri Serapan Atom ... 12
2.4.1 Prinsip dasar spektrofotometri serapan atom ... 12
2.4.2 Instrumentasi spektrofotmetri serapan atom ... 13
2.4.3 Gangguan-gangguan pada spektrofotometri serapan atom ... 16
2.5 Validasi Metode Analisis ... 17
BAB III METODE PENELITIAN... 21
3.1 Tempat dan Waktu Penelitian ... 21
3.2 Alat-alat ... 21
3.3 Bahan-bahan ... 21
3.3.1 Sampel ... 21
3.3.2 Pereaksi ... 22
3.4 PembuatanPereaksi ... 22
3.4.1 Larutan asam nitrat (1:1) ... 22
3.4.2 Larutan kalium sulfida 1% (b/v) ... 22
viii
3.4.4 Larutan natrium hidroksida 1 N (b/v) ... 22
3.4.5 Larutan difenilkarbazida 0,005% (b/v) ... 22
3.4.6 Larutan asam sulfat 1 N (v/v) ... 23
3.5 Prosedur Penelitian ... 23
3.5.1 Pengambilan sampel ... 23
3.5.2 Identifikasi sampel ... 23
3.5.3 Pemeriksaan secara makroskopik ... 23
3.5.4 Penyiapan sampel ... 23
3.5.5 Proses destruksi ... 24
3.5.6 Pembuatan larutan sampel ... 24
3.5.7 Analisis kualitatif ... 25
3.5.7.1 Kromium ... 25
3.5.7.2 Mangan ... 25
3.5.7.3 Zink ... 25
3.5.8 Pembuatan kurva kalibrasi ... 26
3.5.8.1 Kromium ... 26
3.5.8.2 Mangan ... 26
3.5.8.3 Zink ... 27
3.5.9 Analisis secara spektrofotometri serapan atom ... 27
3.5.9.1 Penetapan kadar kromium dalam sampel ... 27
3.5.9.2 Penetapan kadar mangan dalam sampel ... 27
3.5.9.3 Penetapan kadar zink dalam sampel ... 28
3.5.10 Analisis data secara statistik ... 28
ix
3.5.11 Analisis validasi metode ... 29
3.5.11.1 Uji perolehan kembali (recovery) ... 29
3.5.11.2 Simpangan baku relatif ... 30
3.5.11.3 Batas deteksi dan batas kuantitasi ... 31
BAB IV HASIL DAN PEMBAHASAN ... 32
4.1 Hasil Identifikasi Tumbuhan ... 32
4.2 Hasil Pemeriksaan Secara Makroskopik ... 32
4.3 Analisis Kualitatif ... 32
4.4 Kurva Kalibrasi Kromium, Mangan dan Zink ... 33
4.5 Analisis Kadar Kromium, Mangan dan Zink Dalam Sampel ... 35
4.6 Analisis Data Secara Statistik ... 37
4.7 Analisis Validasi Metode ... 37
4.7.1 Uji perolehan kembali (recovery) ... 37
4.7.2 Simpangan baku relatif ... 38
4.7.3 Batas deteksi dan batas kuantitasi ... 38
BAB V KESIMPULAN DAN SARAN ... 40
5.1 Kesimpulan ... 40
5.2 Saran ... 40
DAFTAR PUSTAKA ... 41
x
DAFTAR TABEL
Halaman Tabel 2.1 Rentang persen perolehan kembali yang diizinkan pada analit
sampel ... 18 Tabel 4.1 Hasil analisis kualitatif ... 33
Tabel 4.2 Hasil analisis kadar kromium, mangan dan zink dalam ...
sampel ... 36 Tabel4.3 Persen uji perolehan kembali (recovery) pada kromium,
mangan dan zink ... 37 Tabel 4.4 Simpangan baku relatif kromium, mangan dan zink dalam
sampel ... 38 Tabel 4.5 Batas deteksi dan batas kuantitasi kromium, mangan dan zink 39
xi
DAFTAR GAMBAR
Halaman Gambar 4.1 Kurva kalibrasi larutan kromium ... 34
xii
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Hasil identifikasi tumbuhan ... 43 Lampiran 2. Gambar pohon dan buah kelor (Moringa oleifera Lam.) 44
Lampiran 3. Bagan alir proses destruksi kering (buah kelor) ... 47 Lampiran 4. Gambar abu hasil destruksi ... 48
Lampiran 5. Bagan alir pembuatan larutan sampel ... 49 Lampiran 6. Gambar hasil analisis kualitatif kromium, mangan dan
zink ... 50 Lampiran 7. Data kalibrasi kromium dengan spektrofotometer
serapan atom, perhitungan persamaan garis regresi dan
koefisien korelasi (r) ... 51 Lampiran 8. Data kalibrasi mangan dengan spektrofotometer
serapan atom, perhitungan persamaan garis regresi dan
koefisien korelasi (r) ... 53
Lampiran 9. Data kalibrasi zink dengan spektrofotometer serapan atom, perhitungan persamaan garis regresi dan
koefisien korelasi (r) ... 55 Lampiran 10. Hasil analisis kadar kromium, mangan dan zink pada
buah kelor sebelum di uji t ... 57 Lampiran 11. Hasil analisis kadar kromium, mangan dan zink pada
buah kelor sesudah di uji t ... 58
Lampiran 12. Contoh perhitungan kadar kromium, mangan dan zink
pada buah kelor ... 59
Lampiran 13. Perhitungan statistik kadar kromium, mangan dan zink
pada sampel buah ... 61
Lampiran 14. Hasil analisis kadar kromium, mangan dan zink sebelum dan sesudah penambahan larutan baku pada
xiii
Lampiran 15. Perhitungan jumlah baku yang ditambahkan untuk persen perolehan kembali kromium, mangan dan zink
pada buah kelor ... 70 Lampiran 16. Perhitungan uji perolehan kembali kadar kromium,
mangan dan zink dalam buah kelor ... 72 Lampiran 17. Perhitungan simpangan baku relatif (RSD) kadar
kromium, mangan dan zink ... 90
Lampiran 18. Perhitungan batas deteksi (LOD) dan batas kuantitasi
(LOQ) ... 93
Lampiran 19. Tabel distribusi t ... 96 Lampiran 20. Gambar alat spektrofotometri serapan atom (SSA) dan
1
BAB I
PENDAHULUAN
1.1Latar Belakang
Di Indonesia, khususnya di pedesaan, pohon kelor banyak ditanam di sepanjang tepi ladang atau sawah, berfungsi sebagai tanaman penghijau,sebagai tanda batas tanah atau ladang kepemilikan seseorang. Tanaman kelor juga sudah
dikenal secara luas di lingkungan pedesaan sebagai tanaman berkhasiat obat, dengan memanfaatkan seluruh bagian tanaman ini, mulai dari daun, kulit batang,
biji, buah atau polong hingga akarnya (Katharina, dkk., 2008).
Tanaman kelor selain berkhasiat obat juga sebagai sumber gizi. Kandungan nutrisi dan senyawa yang terdapat pada tanaman kelor dapat
dimanfaatkan untuk mencegah dan menyembuhkan berbagai penyakit seperti stimulan jantung, antitumor, antipiretik, antiepilepsi, antiinflamasi, diuretik dan antispasmodik (Kurniawan, 2013). Tanaman kelor juga diketahui memiliki
senyawa antioksidan dan asam amino (Kurniasih, 2013). Menurut penelitian Kristinawatidan Nurlaela(2013), buah kelor bermanfaat untuk mengatasi asam
urat dan rematik. Buah kelor juga dimanfaatkan secara tradisional untuk obat cacing, kanker wajah, anti hipertensi dan antidiabetes (Paliwal, dkk., 2011).
Mineralmemegang peranan penting dalam pemeliharaan fungsi tubuh, baik
pada tingkat sel, jaringan, organ maupun fungsi tubuh secara keseluruhan, juga berperan dalam berbagai tahap metabolisme, terutama sebagai kofaktor dalam
2
mensintesa mineral sehingga unsur-unsur ini harus disediakan melalui makanan (Almatsier, 2004).
Tanaman kelor mengandung sejumlah mineral penting yang dibutuhkan
oleh tubuh. Mineral yang terdapat dalam kelor adalah kalsium, kromium, mangan, magnesium, molybdenum, flour, besi, fosfor, kalium, natrium, selenium, sulfur
dan zink (Kurniasih, 2013).
Mineral yang bermanfaat dari buah kelor diantaranya adalah kromium, mangan dan zink. Kromium merupakan mineral mikro yang penting untuk
mengatur resistensi insulin. Kecukupan kromium sangat berarti untuk menurunkan kadar gula darah dan menjaga keseimbangan kolesterol(Almatsier,
2004).
Mangan berperan sebagai kofaktor berbagai enzim yang membantu bermacam proses metabolisme karbohidrat dan lemak, juga berperan dalam
pembentukan jaringan ikat dan tulangserta pencegahan pengoksidasian lemak oleh radikal bebas(Almatsier, 2004).
Zink merupakan mineral penting yang terlibat dalam pembelahan sel,
metabolisme asam nukleat dan pembuatan protein. Zink juga membantu kerja hormon kesuburan serta hormon yang diproduksi oleh kelenjar di otak, tiroid,
adrenal dan timus(Almatsier, 2004).
Kelor dapat tumbuh pada daerah yang mempunyai ketinggian 300 - 500 meter di atas permukaan laut dengan tipe tanah berpasir atau lempung berpasir.
3
jenis tanaman, kesuburan tanah atau jenis tanah dan pengelolaan tanaman (Kurniasih, 2013; Rosmarkam dan Yuwono, 2002).
Kromium, mangan dan zink dapat diperiksa menggunakan beberapa
metodediantaranya gravimetri, potensiometri, elektrolisis, spektroskopi visible dan spektroskopi serapan atom.Metode yang dipilih untuk pemeriksaan kadar
kromium, mangan dan zink adalah metode spektroskopi serapan atom karenamempunyai kepekaan yang tinggi (batas deteksi kurang dari 1 ppm), pelaksanaannya relatif sederhana (Gandjar dan Rohman, 2008).
1.2 Perumusan Masalah
Berdasarkan uraian diatas, maka permasalahan dalam penelitian ini dapat dirumuskan sebagai berikut:
a. Apakah pada buah kelor (Moringa oleifera Lam.)terdapat kandungan mineral kromium, mangan dan zink?
b. Berapakah kadar kromium, mangan dan zink yang terkandung padabuah
kelor?
1.3 Hipotesis
Berdasarkan perumusan masalah diatas, makahipotesis dalam penelitian ini
adalah:
a. Buah kelor (Moringa oleifera Lam.)terdapatmineral kromium, mangan dan
zink
4
1.4 Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk:
a. Mengidentifikasikandungan kromium, mangan dan zink pada buah kelor
(Moringa oleifera Lam.).
b. Mengetahui kadar kromium, mangan dan zink yang terkandung pada
buah kelor.
1.5Manfaat Penelitian
Untuk memberikan informasi kepada masyarakat mengenai kandungan mineral kromium, mangan dan zink padabuah kelor sehingga meningkatkan
5
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Uraian tumbuhan meliputi daerah tumbuh (habitat), morfologi tumbuhan,
sistematika tumbuhan, namaasing dan daerah, kandungan kimia dan kegunaan tumbuhan.
2.1.1 Daerah tumbuh (habitat)
Tanaman kelor merupakan tanaman asli kaki bukit Himalaya, Asia Selatan, dari timur laut Pakistan, sebelah utara Bengala Barat di India dan timur
laut Bangladesh. Tanaman kelor telah menyebar dan beradaptasi dengan baik di luar daerah asalnya, termasuk seluruh Asia Selatan dan di banyak negara Asia Tenggara, Semenanjung Arab, Afrika, Amerika Tengah, Karibia dan Amerika
Selatan (Kurniasih, 2013).
Tanaman kelor tumbuh di dataran rendah maupun dataran tinggi sampai ketinggian ± 1000 m dpl. Tanaman kelor dapat tumbuh dengan baik di daerah
yang mempunyai ketinggian tanah 300-500 m dpl (Tilong, 2012). Tanaman kelor tumbuh liar di ladang, di daerah yang cukup air, tetapi juga bisa tumbuh di tanah
gersang (Kurniawan, 2013).
2.1.2 Morfologi tumbuhan
Tanaman kelor merupakan tanaman perdu tegak dengan batang berkayu
yang memilikiketinggian pohon mencapai 12 meter; berakar tunggang berwarna putih yang membesar seperti lobak; mempunyai batang bulat dengan arah tumbuh
6
simpodial; daun majemuk, bertangkai panjang, tersusun berseling; helai daun saat muda berwarna hijau muda, setelah dewasa hijau tua, bentuk helai daun bulat telur, panjang 1 - 3 cm, lebar 4 mm sampai 1 cm, ujung daun tumpul, pangkal
daun membulat, dan tepi daun rata, susunan pertulangan menyirip, pemukaan atas dan bawah halus; bunga berwarna putih agak krem, menebar aroma
khas(Kurniasih, 2013).
Tanaman kelor berbuah setelah berumur 12-18 bulan, berbentuk segitiga memanjang dengan panjang sekitar 20-60 cm, ketika masih muda berwarna hijau,
namun setelah tua warnanya berubah menjadi cokelat,berwarna cokelat setelah tua; biji berbentuk bulat, ketika muda berwarna hijau terang dan ketika polong
matang dan kering berwarna cokelat kehitaman dengan sayap biji ringan, sedangkan kulit biji mudah dipisahkan sehingga meninggalkan biji yang berwarna putih biji berbentuk bulat(Tilong, 2012).
2.1.3 Sistematika tumbuhan
Menurut Depkes RI (2001), sistematika tanaman keloradalah sebagai berikut.
Kingdom : Plantae
Divisio : Spermatophyta Subdivisio : Angiospermae Kelas : Dicotyledoneae
Ordo : Brassicales Famili : Moringaceae
Genus : Moringa
7
2.1.4 Nama daerah
Penanaman kelor di Indonesia tersebar di seluruh daerah, mulai dari Sabanghingga Meurauke. Tanaman kelor dikenal pada berbagai daerah,
sepertimurong (Aceh), marangghi (Madura), moltong (Flores), kelo (Gorontalo), keloro (Bugis), Kawano (Padang), ongge (Bima) dan kelor (Jawa, Melayu, Sunda,
Bali dan Lampung) (Tilong, 2012).
2.1.5 Nama asing
Selama berabad-abad, tanaman kelor telah dibawa ke berbagai daerah,
mulai dari wilayah sub tropis hingga tropis. Kini kelor dikenal di 82 negara dengan 210 nama yang berbeda, diantaranyaadalah pattima (Benin), aleko
(Ethiopia), yevu-ti (Ghana), cham’mwanba (Malawi), ewe ile (Nigeria), cedro (Brazil), angela (Colombia), dangap (Somalia), ruwang (Sudan), mupulanga (Zimbabwe), sajina (Bangladesh), suhanjna (Pakistan) dan marum (Thailand)
(Kurniasih, 2013).
2.1.6 Kandungan kimia
Hasil penelitian menunjukkan bahwa nutrisi dan senyawa kimia dari setiap
100 g buah kelor, antara lain: 7,2 g karbohidrat; 2,8 g protein; 0,7 g lemak. Selain itu juga terdapat alkaloid, asam amino essensial, vitamin dan mineral (Mallilin,
dkk., 2004).
Menurut Aslam, dkk. (2005), setiap 100 gram tanaman kelor mengandung mineral kalium (1,97 g daun segar; 1,96 mg buah polong), natrium (259,10 mg
daun segar; 199 mg buah polong), kalsium (189,50 mg daun segar; 129,20 mg buah polong), magnesium (9,82 mg daun segar; 9,39 mg buah polong), besi
8
21,25mg buah polong), tembaga (1,12 mg daun segar; 3,2 mg buah polong); mangan (11,28 mg daun segar; 7,20 mg buah polong) dan zink (2,09 mg daun segar; 1,53 mg buah polong).
2.1.7 Khasiat tumbuhan
Setiap bagian tanaman kelor dapat dimanfaatkan untuk mencegah dan
menyembuhkan penyakit. Secara tradisional, akar kelor digunakan untuk menyembuhkan nyeri, rematik, sariawan dan asma; kulit akar untuk mengatasi pembengkakan dan sariawan sedangkan kulit batang digunakan untuk pelancar
haid, flu dan sariawan. Ramuan daun kelor dapat membantu penyembuhan pembengkakan limpa, penurun gula darah, meningkatkan nafsu makan, panas dalam,
anemia dan mempelancar air susu ibu (Kurniasih, 2013).
Buah kelor berkhasiat sebagai antimikroba, menurunkan kolesterol,
antihipersensitif, antiinflamasi, menjaga kesehatan organ reproduksi dan tonik (Tilong, 2012). Berdasarkan penelitian yang dilakukan, buah kelor dapat
digunakan untuk mengatasi rematik dan asam urat(Kristinawati dan Nurlaela, 2013).
2.2 Mineral
Mineral adalah nutrisi yang dibutuhkan oleh tubuh dalam jumlah tertentu
untuk menjaga kesehatan. Mineral merupakan zat anorganik (unsur atau senyawa kimia) yang ditemukan di alam (Tilong, 2012). Mineral berperan dalam berbagai
9
Menurut jumlah yang dibutuhkan oleh tubuh, mineral dapat diklasifikasikan menjadi mineral mayor dan mineral minor. Mineral utama (mayor) adalah mineral yang kita perlukan lebih dari 100 mg sehari, seperti
kalsium, tembaga, fosfor, kalium, natrium dan klorida. Mineral minor (trace elements) adalah mineral yang dibutuhkan kurang dari 100 mg sehari, seperti
kromium, magnesium, yodium, besi, flor, mangan, selenium dan zink. Mineral minor tak kalah penting dibandingkan mineral utama. Kekurangan mineral minor akan menyebabkan masalah kesehatan ( Tilong, 2012).
2.2.1 Kromium
Kromium merupakan mikronutrien bagi makhluk hidup, tetapi bersifat
toksik dalam dosis tinggi. Cr (III) dibutuhkan untuk metabolisme hormon insulin dan pengaturan kadar glukosa darah. Defisiensi Cr (III) bisa menyebabkan hiperglisemia, glukosoria, meningkatnya cadangan lemak tubuh dan menurunkan
jumlah sperma (Almatsier, 2004).
Kebutuhan kromium pada manusia dipengaruhi oleh umur dan kondisi wanita (hamil dan menyusui). Angka kecukupan gizi untuk kromium adalah pada
usia 0-6 bulan (0,2 mcg); usia 7-12 bulan (5,5 mcg); 1-3 tahun (11 mcg); 4-8 tahun (15 mcg), 9-13 tahun (21-25 mcg); 14-50 tahun (24-35 mcg); wanita hamil
(29-30 mcg) dan ibu menyusui (44-45 mcg).Dalam bentuk makanan, kromium hanya diserap sebesar 1 - 3%. Efek toksik kromium dapat merusak dan mengiritasi hidung, paru-paru, lambung dan usus. Dampak jangka panjang yang
10
menyebabkan gangguan perut, bisul, kejang, ginjal, kerusakan hati dan bahkan kematian (Widowati, dkk., 2008).
2.2.2Mangan
Mangan merupakan mikronutrien essensial bagi semua makhluk hidup. Di tubuh terdapat 10-20 mg mangan, yang terutama berada di dalam tulang dan
kelenjar. Mangan berperan sebagai kofaktor berbagai enzim yang membantu bermacam proses metabolisme, diantaranya dalam metabolisme karbohidrat dan lemak. Mangan juga berperan dalam pembentukan jaringan ikat dan tulang serta
pencegahan pengoksidasian lemak oleh radikal bebas. Angka kecukupan gizi untuk mangan bagi wanita 1,6 - 1,8 mg dan pria 1,9 - 2,3 mg per hari tergantung
usia (Almatsier, 2004).
Absorpsi mangan oleh alat pencernaan makanan kurang dari 5%. Walaupun keterlibatannya luas dalam metabolisme, namun defisiensi mangan
tidak luas pengaruhnya, hal ini mungkin karena banyak ion magnesium yang dapat mensubstitusikan mangan dalam banyak fungsi yang berkaitan dengan enzim. Penggunaan suplementasi besi dan kalsium perlu diperhatikan karena
kedua zat tersebut menghambat absorpsi mangan (Linder,1985; Almatsier, 2004). Defisiensi mangan pada manusia yang mengkonsumsi mangan 0,35
mg/hari menunjukkan gejala kehilangan berat badan, gangguan pertumbuhan kuku/rambut, dermatitis dan hipokolesterolemia. Penelitian pada hewan jantan dan betina kekurangan mangan dapat menyebabkan sterildan keturunan dari induk
yang menderita kekurangan mangan menunjukkan kelainan kerangka dan gangguan kerangka otot. Keracunan karena kelebihan mangan dapat terjadi bila
11
gejala-gejala kelainan otak disertai penampilan dan tingkah laku abnomal yang menyerupai Parkinson (Widowati, dkk., 2008).
2.2.3 Zink
Zink adalah mineral penting yang ikut membentuk lebih dari 300 enzim dan protein. Zink terlibat dalam pembelahan sel, metabolisme asam nukleatdan
pembuatan protein. Zink juga membantu kerja hormon termasuk hormon kesuburan, juga hormon yang diproduksi oleh kelenjar di otak, tiroid, adrenal dan timus. Widya Karya Pangan dan Gizi tahun 1998 menetapkan angka kecukupan
zink untuk Indonesia adalah bayi (3-5 mg), usia 1-9 tahun (8-10 mg), usia 10->60 (15 mg) baik pria maupun wanita, ibu hamil (+ 5 mg), ibu menyusui (+ 10 mg)
(Almatsier, 2004).
Zink terdapat pada berbagai jenis bahan makanan. Kandungan zink paling tinggi terdapat dalam kerang, daging sapi dan daging merah lainnya, ayam, ikan,
kacang, buncis, biji-bijian, sereal sedangkan sayuran mengandung zink rendah. Sekitar 10-40% zink yang terdapat dalam makanan akan diabsorpsi tubuh. Dari makanan nabati, zink yang terabsorpsi hanya 10-20%, sedangkan dari hewani
dapat mencapai 30% (Widowati, dkk., 2008).
Kekurangan zink ringan dapat menyebabkan kurangnya nafsu makan
disertai turunnya berat badan dan mudah terinfeksi. Kekurangan zink sedang dapat menyebabkan terhambatnya pertumbuhan, kekurangan hormon kesuburan dan melambatnya penyembuhan luka. Pada kasus yang lebih berat, timbul gejala
12
2.3 Destruksi
Untuk menentukan kandungan mineral bahan makanan, bahan harus dihancurkan atau didestruksi dulu. Cara yang biasa dilakukan yaitu pengabuan
kering (dry ashing) dan pengabuan basah (wet digestion). Pemilihan cara tersebut tergantung pada sifat zat organik dalam bahan, sifat zat anorganik yang ada dalam
bahan, mineral yang akan dianalisa serta sensitivitas cara yang digunakan (Apriyantono, dkk., 1989).
Pengabuan kering dapat diterapkan pada hampir semua analisa mineral.
Cara ini membutuhkan sedikit ketelitian dan mampu menganalisis bahan lebih banyak daripada pengabuan basah. Pengabuan basah memberikan beberapa
keuntungan. Suhu yang digunakan tidak dapat melebihi titik didih larutan dan pada umumnya karbon lebih cepat hancur dari pada menggunakan cara pengabuan kering. Cara pengabuan basah pada prinsipnya adalah penggunaan asam nitrat
untuk mendestruksi zat organik pada suhu rendah dengan maksud menghindari kehilangan mineral akibat penguapan, pada tahap selanjutnya proses sering kali berlangsung sangat cepat akibat penambahan asam perklorat atau hidrogen
peroksida (Apriyantono, dkk., 1989).
2.4 Spektrofotometri Serapan Atom
2.4.1 Prinsip dasar spektrofotometri serapan atom
Spektroskopi serapan atom digunakan untuk analisis kuantitatif unsur-unsur logam dalam jumlah sekelumit (trace) dan sangat kelumit (ultratrace). Cara analisis ini memberikan kadar total unsur logam dalam suatu sampel dan tidak
13
untuk analisis logam karena mempunyai kepekaan yang tinggi (batas deteksi kurang dari 1 ppm), pelaksanaannya relatif sederhana dan interferensinya sedikit (Gandjar dan Rohman, 2008).
Spektroskopi serapan atom didasarkan pada absorbsi cahaya oleh atom. Atom-atom akan menyerap cahaya pada panjang gelombang tertentu tergantung
pada sifat unsurnya. Sebagai contoh kalium menyerap cahaya pada panjang gelombang 766,5 nm; kalsium menyerap cahaya pada panjang gelombang 422,7 nm dan besi menyerap cahaya pada panjang gelombang 248,3 nm. Cahaya pada
panjang gelombang ini mempunyai cukup energi untuk mengubah tingkat elektronik suatu atom. Dengan menyerap suatu energi, maka atom akan
memperoleh energi sehingga suatu atom pada keadaan dasar dapat dinaikkan tingkat energinya ke tingkat eksitasi (Khopkar, 1984; Gandjar dan Rohman, 2008).
Interaksi materi dengan berbagai energi seperti energi panas, energi radiasi, energi kimia dan energi listrik selalu memberikan sifat-sifat yang spesifik untuk setiap unsur. Besarnya perubahan yang terjadi biasanya sebanding dengan
jumlah unsur atau persenyawaan yang terdapat di dalamnya. Proses interaksi ini mendasari analisis spektrofotometri atom yang dapat berupa emisi dan absorpsi
(Gandjar dan Rohman, 2008).
2.4.2 Instrumentasi spektrofotometri serapan atom
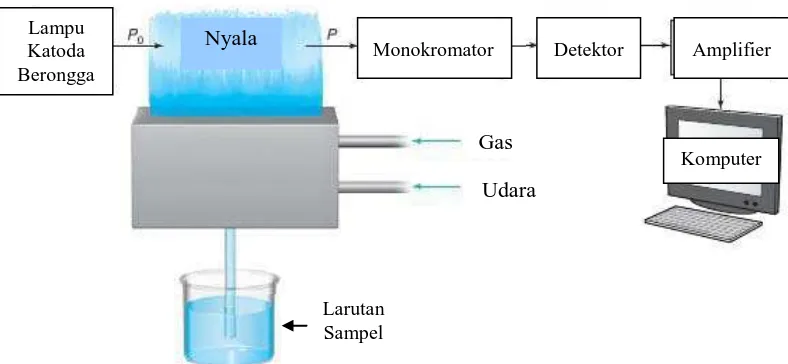
Menurut Harris (2010) sistem peralatan spektrofotometer serapan atom
14
Gambar 2.1 Sistem Peralatan Spektrofotometri Serapan Atom
a. Sumber sinar
Sumber sinar yang umum dipakai adalah lampu katoda berongga (hollow cathode lamp). Lampu ini terdiri atas tabung kaca tertutup yang mengandung
suatu katoda dan anoda. Katoda berbentuk silinder berongga yang terbuat dari unsur atau dilapisi unsur yang sama dengan unsur yang akan dianalisis. Tabung logam ini diisi dengan gas mulia dengan tekanan rendah yang jika diberikan
tegangan pada arus tertentu, katoda akan memancarkan elektron-elektron yang bergerak menuju anoda dengan kecepatan dan energi yang tinggi. Elektron dengan
energi tinggi ini akan bertabrakan dengan gas mulia sehingga gas mulia kehilangan elektron dan menjadi ion bermuatan positif. Ion gas mulia bermuatan positif akan bergerak menuju katoda dengan kecepatan dan energi yang tinggi
sehingga menabrak unsur-unsur yang terdapat pada katoda. Akibat tabrakan ini, unsur-unsur akan terlempar ke luar permukaan katoda dan mengalami eksitasi ke
tingkat energi elektron yang lebih tinggi (Gandjar dan Rohman, 2008). Lampu
Katoda Berongga
Nyala
Monokromator Detektor Amplifier
Komputer
Udara Gas
15 b. Tempat sampel
Dalam analisis dengan spektrofotometri serapan atom, sampel yang akan dianalisis harus diuraikan menjadi atom-atom netral. Ada berbagai macam alat
yang dapat digunakan untuk mengubah suatu sampel menjadi uap atom-atom yaitu dengan nyala (flame) dan tanpa nyala (flameless) (Gandjar dan Rohman,
2008).
Teknik atomisasi dengan nyala bergantung pada suhu yang dapat dicapai oleh gas-gas yang digunakan. Untuk gas batubara-udara suhunya kira-kira sebesar
1800ºC, gas alam-udara 1700ºC, gas udara 2200ºC dan gas asetilen-dinitrogen oksida sebesar 3000ºC. Sumber nyala yang paling banyak digunakan
adalah campuran asetilen sebagai bahan pembakar dan udara sebagai pengoksidasi (Gandjar dan Rohman, 2008).
Teknik atomisasi tanpa nyala dapat dilakukan dengan meletakkan
sejumlah sampel di dalam tungku dari grafit kemudian dipanaskan dengan sistem elektris dengan cara melewatkan arus listrik pada tabung grafit. Akibat pemanasan ini, zat yang akan dianalisis akan berubah menjadi atom-atom netral dan
dilewatkan suatu sinar yang berasal dari lampu katoda berongga sehingga terjadi proses penyerapan energi (Gandjar dan Rohman, 2008).
c. Monokromator
Pada spektrofotometri serapan atom, monokromator berfungsi untuk memisahkan dan memilih panjang gelombang yang digunakan untuk analisis. Di
16 d. Detektor
Detektor digunakan untuk mengukur intensitas cahaya yang melalui tempat pengatoman. Biasanya detektor yang digunakan adalah tabung penggandaan foton (photomultiplier tube) (Gandjar dan Rohman, 2008).
e. Readout
Readout merupakan suatu alat penunjuk atau dapat juga diartikan sebagai
sistem pencatatan hasil. Pencatatan hasil dilakukan dengan suatu alat yang telah terkalibrasi untuk pembacaan suatu transmisi atau absorbsi. Hasil pembacaan dapat berupa angka atau kurva dari suatu alat perekam yang menggambarkan absorbansi atau intensitas emisi (Gandjar dan Rohman, 2008).
2.4.3 Gangguan-gangguan pada spektrofotometri serapan atom
Gangguan-gangguan (interference)pada spektrofotometri serapan atom adalah peristiwa-peristiwa yang menyebabkan pembacaan absorbansi unsur yang dianalisis menjadi lebih kecil atau lebih besar dari nilai yang sesuai dengan konsentrasinya dalam sampel (Gandjar dan Rohman, 2008).
Menurut Gandjar dan Rohman (2008), gangguan-gangguan yang terjadi pada spektrofotometri serapan atom adalah:
1. Gangguan yang berasal dari matriks sampel yang mana dapat mempengaruhi banyaknya sampel yang mencapai nyala
2. Gangguan kimia yang dapat mempengaruhi jumlah atau banyaknya atom yang terjadi di dalam nyala
17 4. Gangguan oleh penyerapan non-atomik.
2.5 Validasi Metode Analisis
Validasi metode analisis adalah suatu tindakan penilaian terhadap parameter tertentu, berdasarkan percobaan laboratorium, untuk membuktikan
bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya. Tindakan ini dilakukan untuk menjamin bahwa metode analisis akurat, spesifik,
reprodusibel dan tahan akan kisaran analit yang akan dianalisis (Gandjar dan Rohman,2008; Harmita, 2004).
Beberapa parameter analisis yang harus dipertimbangkan dalam validasi
metode analisis adalah sebagai berikut: 1. Kecermatan (accuracy)
Kecermatan adalah ukuran yang menunjukkan derajat kedekatan hasil analis dengan kadar analit yang sebenarnya. Kecermatan dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan. Untuk mencapai
kecermatan yang tinggi, dapat dilakukan dengan berbagai cara seperti menggunakan peralatan yang telah dikalibrasi, menggunakan pereaksi dan pelarut
yang baik, pengontrolan suhu dan pelaksanaannya yang cermat, taat asas sesuai prosedur (Harmita, 2004).
Kecermatan ditentukan dengan dua cara yaitu metode simulasi
(spiked-placebo recovery) dan metode penambahan baku (standard addition method).
Metode simulasi (spiked-placebo recovery) merupakan metode yang dilakukan
18
hasilnya dibandingkan dengan kadar analit yang ditambahkan (kadar yang sebenarnya). Dalam metode penambahan baku, sampel dianalisis lalu sejumlah tertentu analit yang diperiksa ditambahkan ke dalam sampel, dicampur dan
dianalisis lagi. Selisih kedua hasil dibandingkan dengan kadar yang sebenarnya (hasil yang diharapkan) (Harmita, 2004).
Dalam kedua metode tersebut, persen perolehan kembali dinyatakan sebagai rasio antara hasil yang diperoleh dengan hasil yang sebenarnya. Metode adisi dapat dilakukan dengan menambahkan sejumlah analit dengan konsentrasi
tertentu pada sampel yang diperiksa, lalu dianalisis dengan metode tersebut. Persen perolehan kembali ditentukan dengan menentukan berapa persen analit
[image:31.595.111.514.454.544.2]yang ditambahkan tadi dapat ditemukan. Rentang persen perolehan kembali yang diizinkan pada setiap konsentrasi analit pada matriks adalah sebagai berikut ini:
Tabel 2.1 Rentang persen perolehan kembali yang diizinkan pada analit sampel
Jumlah analit pada sampel Persen perolehan kembali yang diizinkan (%)
1 ppm 80-110
100 ppb 80-110
10 ppb 60-115
1 ppb 40-120
Sumber: Harmita (2004).
2. Keseksamaan (precision)
Keseksamaan adalah ukuran yang menunjukkan derajat kesesuaian antara hasil uji individual, diukur melalui penyebaran hasil individual dari rata-rata jika
19
dan biasanya dinyatakan sebagai simpangan baku relatif dari sejumlah sampel yang berbeda signifikan secara statistik (Harmita, 2004).
3. Selektivitas (spesifisitas)
Selektivitas atau spesifisitas suatu metode adalah kemampuan suatu metode mengukur zat tertentu saja secara cermat dan seksama dengan adanya
komponen lain yang mungkin ada dalam matriks sampel. Selektivitas biasanya dinyatakan sebagai derajat penyimpangan metode yang dilakukan terhadap sampel yang mengandung bahan yang ditambahkan berupa cemaran, hasil urai,
senyawa sejenisdan senyawa lain yang dibandingkan terhadap hasil analisis sampel yang tidak mengandung bahan lain yang ditambahkan (Harmita, 2004).
4. Linearitas dan rentang
Liniearitas merupakan kemampuan suatu metode untuk memperoleh hasil-hasil uji yang secara langsung proporsional dengan konsentrasi analit pada kisaran
yang diberikan. Linearitas suatu metode merupakan ukuran seberpa baik kurva kalibrasi yang menghubungkan antara absorbansi (y) dengan konsentrasi (x). Liniearitas dapat diukur dengan melakukan pengukuran tunggal pada konsentrasi
yang berbeda-beda. Rentang metode adalah pernyataan batas terendah dan tertinggi analit yang sudah ditunjukkan dapat ditetapkan dengan kecermatan,
keseksamaan dan linearitas yang dapat diterima (Harmita, 2004; Gandjar dan Rohman, 2008).
5. Batas deteksi dan batas kuantitasi
Batas deteksi adalah jumlah analit terkecil dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan dibandingkan dengan
20
sebagai kuantitas analit terkecil dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama (Harmita, 2004).
6. Ketangguhan metode (ruggedness)
Ketangguhan metode adalah derajat ketertiruan hasil uji yang diperoleh dari analisis sampel yang sama dalam berbagai kondisi uji normal, seperti
laboratorium, analisis, instrumen, bahan pereaksi, suhu dan hari yang berbeda. Ketangguhan metode dinyatakan sebagai tidak adanya pengaruh perbedaan operasi atau lingkungan kerja terhadap hasil uji (Harmita, 2004).
7. Kekuatan (robustness)
Kekuatan merupakan kemampuan metode untuk tetap tidak terpengaruh
oleh adanya variasi parameter metode yang kecil. Kekuatan suatu metode adalah dengan membuat variasi parameter-parameter penting dalam suatu metode secara sistematis lalu mengukur pengaruhnya pada pemisahan (Gandjar dan Rohman,
21
BAB III
METODE PENELITIAN
Metode penelitian yang dilakukan ini adalah penelitian yang besifat deskriptif, yang bertujuan menggambarkan suatu keadaan secara sistematis yaitu
untuk mengetahui kadar mangan, kromiumdan zink pada buah kelor.
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara pada bulan Oktober 2014-Desember 2014.
3.2Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah Spektrofotometer Serapan Atom (Hitachi Z-2000) lengkap dengan lampu katoda kromium, mangan
dan zink, tanur (Naberthem), kertas saring Whatmann no.42, neraca analitik (BOECO Germany), botol semprot, krus porselen, hot plate (FISONS), blender (Aragawa) dan alat-alat gelas (Pyrex dan Oberoi).
3.3 Bahan- bahan
3.3.1 Sampel
Sampel yang digunakan adalah buah kelorsegar yang masih muda(Moringa
oleiferaLam.) berasal dari pohon kelor yang tumbuh di Jalan Kenanga Raya,
22
3.3.2 Pereaksi
Semua pereaksi yang digunakan dalam penelitian ini berkualitas pro analisis keluaran E.Merck yaitu asam nitrat 65% (b/v), natrium hidoksida1N (b/v),
kalium sulfida 1% (b/v), dithizon 0,0005% (b/v), difenilkarbazida 0,005% (b/v),asam sulfat 96% (v/v), larutan baku kromium 1000 µg/mL, larutan baku
mangan1000 µg/mL, larutan baku zink 1000 µg/mL, kecuali disebutkan lain yaitu akua demineralisata (Laboratorium Penelitian FakultasFamasi USU).
3.4 Pembuatan Pereaksi
3.4.1 Larutan asam nitrat (1:1)
Sebanyak 500 ml larutan HNO3 65% b/v diencerkan dengan 500 mL
akuabides (Isaac, 1990).
3.4.2Larutan kalium sulfida 1% (b/v)
Kalium Sulfida sebanyak 1 gram dilarutkan dengan air suling hingga 100
mL (Ditjen POM, 1979).
3.4.3 Larutan ditizon 0,0005% (b/v)
Larutkan 25,6 mg Difeniltiokarbazen98% b/v dalam 100 mLetanol (Ditjen POM, 1995).
3.4.4 Larutan natrium hidroksida 1N (b/v)
Sebanyak 4 gram pelet NaOH dilarutkan dalam 100 mL air suling bebas CO2 (Ditjen POM, 1979).
3.4.5Larutan difenilkarbazida 0,005% (b/v)
23
3.4.6 Larutan asam sulfat 1 N (v/v)
Sebanyak 3 mL larutan H2SO4 96% v/v diencerkan dengan akuades hingga
100 mL (Ditjen POM, 1979).
3.5 Prosedur Penelitian
3.5.1 Pengambilan sampel
Metode pengambilan sampel dilakukan dengan cara sampling purposifyang
dikenal juga sebagai sampling pertimbangan. Metode sampling ini ditentukan atas dasar pertimbangan bahwa sampel yang diambil dapat mewakili populasi (Sudjana, 2002).
3.5.2 Identifikasi sampel
Identifikasi tumbuhan dilakukan oleh Herbarium Bogoriense, Bidang
Botani, Pusat Penelitian dan Pengembangan Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor.
3.5.3 Pemeriksaan secara makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk, tekstur dan ukuran serta pemeriksaan organoleptik dengan mengamati warna, rasa dan bau dari buah kelor muda (Moringa oleifera Lam.)
3.5.4Penyiapansampel
Sampel yang digunakan adalah buah kelor segar muda yang dibersihkan dari
24
3.5.5Proses dekstruksi
Buah kelor segar muda yang telah dihaluskan, ditimbang sebanyak 10gram dalam krus porselin, ditambah 5 tetes HNO3 65% (b/v), diarangkan di atashot
plate, lalu diabukan di tanur mula-mula pada temperatur 100oC dan secara perlahan-lahan dinaikkan interval 25oC setiap 5 menit sampai temperatur menjadi
500oC dan pengabuan dilakukan selama 60 jam (dihitung saat suhu sudah 500°C), lalu suhu tanur diturunkan ± 27°C, krus porselin dikeluarkandan dibiarkan hingga dingin. Abu ditambahkan 5 mL HNO3 (1:1), kemudian diuapkan pada hot
platesampai kering. Krus porselen dimasukkan kembali ke dalam tanur dengan
temperatur awal 100ºC dan perlahan-lahan temperatur dinaikkan hingga 500ºC
dengan interval 25ºC setiap 5 menit. Pengabuan dilakukan selama 1 jam dan dibiarkan hingga dingin pada tanur(temperatur tanur± 27°C)(Isaac, 1990).
Perlakuan yang sama diulang sebanyak 6 kali untuk masing-masing
sampel.Bagan alir proses dekstruksi dapat dilihat pada Lampiran 3, halaman 47.
3.5.6Pembuatan larutan sampel
Sampel hasil dekstruksiyang di dalam krus porselin dilarutkan dengan 5
mL HNO3(1:1), dituangkan ke dalam labu ukur 50 mL, lalu krus porselen dibilas
dengan akua demineralisata sebanyak tiga kali masing-masing 10 mL,
laludicukupkan volumenya dengan akua demineralisata hingga garis tanda. Larutan sampel disaring dengan kertas saringWhatmann no. 42, kemudian 5 mL filtrat pertama dibuang untuk menjenuhkan kertas saring, selanjutnya filtrat
25
masing-masing sampel. Bagan alir pembuatan larutan sampel dapat dilihat pada Lampiran 5,halaman 49.
3.5.7 Analisis kualitatif
3.5.7.1 Kromium
Reaksi warna dengan larutan difenilkarbazida
Larutan sampel 1 mL, tambahkan setetes aqua brom jenuh, diteruskan dengan 2-3 tetes kalium hidroksida 2 N. Tambahkan sebutir kristal fenol, lalu setetes larutan difenilkarbazid dan tambahkan asam sulfat setetes demi setetes
sampai warna merah hilang dan diperoleh warna lembayung ungu (Vogel, 1979).
3.5.7.2 Mangan
Reaksi warna dengan larutan kalium sulfida
Larutan sampel 1 mL dimasukkan ke dalam tabung reaksi, ditambahkan 3 tetes larutan kalium sulfida. Endapan merah muda akan terbentuk jika terdapat
mangan (Vogel, 1979).
3.5.7.3 Zink
Reaksi warna dengan larutan dithizon
Larutan sampel 5 mL dimasukkan ke dalam tabung reaksi, ditambahkan dengan natrium hidroksida 1 N, ditambahkan 5 mL dithizon 0,005% kocok kuat,
26
3.5.8Pembuatan kurva kalibrasi
3.5.8.1 Kromium
Larutan baku kromium (1000 µg/mL) dipipet sebanyak 0,5 mL;
dimasukkan ke dalam labu ukur 100 mLdan dicukupkan volumenya dengan akua demineralisata sampai garis tanda (konsentrasi 5 µg/mL) disebut LIB I kromium.
Larutan untuk kurva kalibrasi kromium dibuat dengan memipet (0,5; 1,0; 1,5; 2,0 dan 2,5)mL larutan baku 5 µg/mL (LIB I kromium), masing-masing dimasukkan ke dalam labu ukur 25 mL dan dicukupkan volumenya dengan akua
demineralisata sampai garis tanda (larutan ini mengandung 0,1; 0,2; 0,3; 0,4dan 0,5)µg/mL, lalu diukur pada panjang gelombang 357,9 nm (lampu katoda
kromium)dengan nyala udara-asetilen.
3.5.8.2Mangan
Larutan baku mangan(1000 µg/ml) dipipet sebanyak 0,5 mL; dimasukkan
ke dalam labu ukur 50 mL dandicukupkan volumenya dengan akua demineralisata sampai garis tanda (konsentrasi 10 µg/mL) disebut LIBI mangan.
Larutan untuk kurva kalibrasi mangan dibuat dengan memipet (0,5;
1,0;1,5; 2,0 dan 2,5) mL larutan baku 10 µ g/mL (LIB I mangan), masing-masing dimasukkan ke dalam labu ukur 25mL dan dicukupkan volumenya dengan akua
27
3.5.8.3 Zink
Larutan baku zink (1000 µg/mL) dipipet sebanyak 0,5mL; dimasukkan ke dalam labu ukur 100 mLdan dicukupkan volumenya dengan akua demineralisata
sampai garis tanda (konsentrasi 10 µg/mL) disebut LIB I zink.
Larutan untuk kurva kalibrasi zink dibuat dengan memipet (0,5; 1,0; 1,5;
2,0 dan 2,5) mL larutan baku 10 µg/mL (LIB Izink), masing-masing dimasukkan ke dalam labu ukur 25 mL dan dicukupkan volumenya dengan akua demineralisatasampai garis tanda (larutan ini mengandung 0,2; 0,4; 0,6; 0,8 dan
1,0)µg/mL, lalu semua larutan diukur pada panjang gelombang 213,9 nm (lampu katoda zink)dengan nyala udara -asetilen.
3.5.9 Analisis secara spektrofotometri serapan atom
3.5.9.1 Penetapan kadar kromiumdalam sampel
Larutan sampel buah kelor hasil dekstruksidiukur absorbansinya dengan menggunakan spektrofotometer serapan atom yang telah dikondisikan dan diatur
metodenya. Penetapan kadar untuk kromiumdilakukan pada panjang gelombang 357,9 nm (lampu katoda kromium)dengan nyala udara-asetilen. Nilai absorbansi yang diperoleh harus berada dalam rentang kurva kalibrasi larutan baku kromium.
Konsentrasi kromium dalam sampel ditentukan berdasarkan persamaan garis regresi dari kurva kalibrasi.
3.5.9.2 Penetapan kadar mangan dalam sampel
Larutan sampel buah kelor hasil dekstruksidiukur absorbansinya dengan menggunakan spektrofotometer serapan atom yang telah dikondisikan dan diatur
28
279,5 nm (lampu katoda mangan)dengan nyala udara - asetilen. Nilai absorbansi yang diperoleh harus berada dalam rentang kurva kalibrasi larutan baku mangan. Konsentrasi mangan dalam sampel ditentukan berdasarkan persamaan garis
regresi dari kurva kalibrasi.
3.5.9.3 Penetapan kadar zinkdalam sampel
Larutan sampel buah kelor hasil dekstruksi diukur absorbansinya dengan menggunakan spektrofotometer serapan atom yang telah dikondisikan dan diatur metodenya. Penetapan kadar untuk zinkdilakukan pada panjang gelombang 213,9
nm (lampu katoda zink)dengan nyala udara-asetilen. Nilai absorbansi yang diperoleh harus berada dalam rentang kurva kalibrasi larutan baku zink.
Konsentrasi zink dalam sampel ditentukan berdasarkan persamaan garis regresi dari kurva kalibrasi.
Kadar kromium, mangan dan zink dalam sampel dapat dihitung dengan
cara sebagai berikut:
Kadar (µg/g) = Konsentrasi (µg/ml) x Volume(mL) x Faktor Pengenceran
Berat Sampel (g)
3.5.10 Analisis data secara statistik
3.5.10.1 Penolakan hasil pengamatan
Menurut Sudjana (2002) kadar kromium, mangan dan zink yang diperoleh
dari hasil pengukuran masing-masing larutan sampel dianalisis dengan metode standar deviasi menggunakan rumus sebagai berikut:
SD =
�
∑(Xi−X)229 Keterangan: Xi = Kadar sampel (mg/100g)
X = Kadar rata-rata sampel (mg/100g) n = Jumlah pengulangan
Untuk mencari t hitung digunakan rumus:
t hitung =� Xi-X � SD/ √n
dan untuk menentukan kadar mineral di dalam sampel dengan interval kepercayaan 99%, α = 0.01, dk = n-1, dapat digunakan rumus:
Kadar Mineral: μ = X ± (t(α/2, dk) x SD /√n )
Keterangan: X = Kadar rata-rata sampel(mg/100g) SD = Standar deviasi(mg/100g)
dk = Derajat kebebasan (dk = n-1) α = Interval kepercayaan
n = Jumlah pengulangan
3.5.11 Analisis validasi metode
3.5.11.1Uji perolehan kembali (recovery)
Uji perolehan kembali atau recovery dilakukan dengan metode
penambahan larutan standar (standard addition method). Kadar mineral dalam sampel ditentukan terlebih dahulu, selanjutnya dilakukan penentuan kadar mineral
30
Sampelbuah kelor yang telah dihaluskan, ditimbang sebanyak 10 g di dalam krus porselin sebanyak 6 krus, lalu masing-masing krus ditambahkan 0,7mL larutan baku kromium (konsentrasi 10 µg/mL); 0,09 mL larutan baku
mangan(konsentrasi 100 µg/mL)dan 0,06 mL larutan baku zink (konsentrasi 100 µg/mL), perhitungan jumlah baku yang ditambahkan dapat dilihat pada Lampiran
15, halaman 70,kemudian dilanjutkan dengan prosedur dekstruksi kering seperti yang telah dilakukan pada sampel sebelumnya. Prosedur pengukuran uji perolehan kembali dilakukan sama dengan prosedur pengukuran penetapan kadar
sampel.
Menurut Harmita (2004) persen perolehan kembali dapat dihitung dengan
rumus di bawah ini:
Persen Perolehan Kembali=CF - CA CA*
x 100%
Keterangan:
CA = Kadar logam dalam sampel sebelum penambahan baku (mg/100g)
CF = Kadar logam dalam sampel setelah penambahan baku (mg/100g)
C*A = Kadar larutan baku yang ditambahkan (mg/100g)
3.5.11.2 Simpangan baku relatif
Keseksamaan atau presisi diukur sebagai simpangan baku relatif atau
koefisien variasi. Keseksamaan atau presisi merupakan ukuran yang menunjukkan
derajat kesesuaian antara hasil uji individual ketika suatu metode dilakukan secara berulang untuk sampel yang homogen. Nilai simpangan baku relatif yang
31 RSD = ×100%
X SD
Keterangan: X = Kadar rata-rata sampel (%)
SD = Standar deviasi (%)
RSD = Relative Standard Deviation(%)
3.5.11.3Batas deteksi danbatas kuantitasi
Menurut Harmita (2004) batas deteksi merupakan jumlah terkecil analit
dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan. Batas kuantitasi merupakan kuantitas terkecil analit dalam sampel yang masih
dapat memenuhi kriteria cermat dan seksama.
Batas deteksi dan batas kuantitasi ini dapat dihitung dengan rumus sebagai berikut:
Simpangan baku (µg/mL)=
�
∑(Y-Yi) 2n-2
Batas deteksi (µg/mL)=3xSB
slope
Batas kuantitasi (µg/mL)=10 xSB
32
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan oleh Herbarium Bogoriense, Bidang
Botani, Pusat Penelitian dan Pengembangan Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI), Bogor.Tumbuhan yang digunakan adalah buahtumbuhan kelor(Moringa oleifera Lam.), suku Moringaceae. Hasil identifikasi tumbuhan
dapat dilihat pada Lampiran 1, halaman 43.
4.2 Hasil Pemeriksaan secara Makroskopik
Hasil pemeriksaan makroskopik terhadap buah kelor muda segar (Moringa
oleifera Lam.) seperti yang tertera pada Lampiran 2, halaman 44 dan 45adalah
buah polongberbentuk segitiga dengan panjang 21-27 cm dan lebar 1,5-2,5 cm; berwarna hijau, memiliki rasa pahit, berserat pada permukaan buah, didalam buah
terdapat 14 biji berbentuk bulat berwarna hijau muda.
4.3 Analisis Kualitatif
Analisis kualitatif dilakukan sebagai analisis pendahuluan
untukmengetahui ada atau tidaknya mineral kromium, mangan dan zink dalam sampel yang akan dianalisis secara kuantitatif dengan menggunakan spektrofotometer serapan atom. Data hasil analisis secara kualitatif dapat dilihat
33
Tabel 4.1 Hasil analisis kualitatif
No Logam yang
dianalisis Pereaksi Hasil Reaksi Keterangan 1. Kromium Larutan
difenilkarbazida Larutan ungu - 2. Mangan Larutan kalium
sulfida
Endapan merah
Muda +
3. Zink Larutan dithizon Lapisan kloroform
berwarna merah +
Keterangan : + : Mengandung logam - : Tidak mengandung logam
Dari Tabel 4.1 diatas menunjukkan bahwa larutan sampel yang diperiksa
terdapat ion mangan dan ion zink. Sampel dikatakan positif terdapat ion mangan karena menghasilkan endapan merah muda dengan penambahan kalium sulfidadan terdapat ion zink karena menghasilkan warna merah pada lapisan
kloroform dengan penambahan larutan dithizon (Vogel, 1979). Hasil analisis secara kualitatif untuk ion kromium menggunakan larutan difenilkarbazida tidak
menghasilkan warna ungu, hal ini disebabkan karena kadar kromium yang terdapat pada sampel sangat kecil sehingga tidak dapat dideteksi secara kualitatif.
Hasil serapan menggunakan spektrofotometer serapan atom menunjukkan
adanya absorbansi pada panjang gelombang kromium yaitu 357,9 nm;mangan 279,5 nm dan zink213,9 nm sesuai yang tercantum pada literatur (Khopkar, 1984).
4.4Kurva Kalibrasi Kromium, Mangan dan Zink
Kurva kalibrasi kromium, mangan dan zink diperoleh dengan cara mengukur absorbansi dari larutan baku kromium, mangan dan zink pada panjang
34
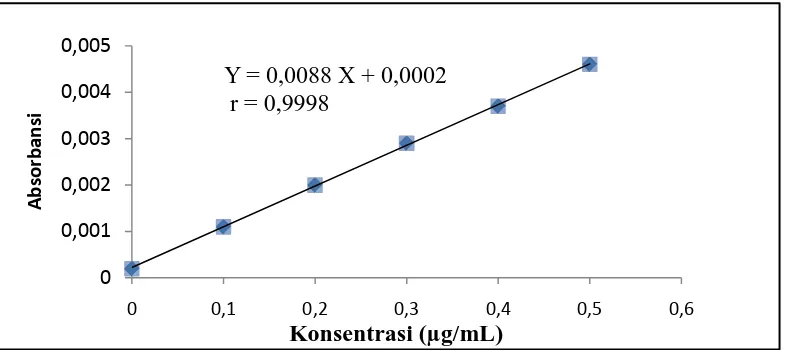
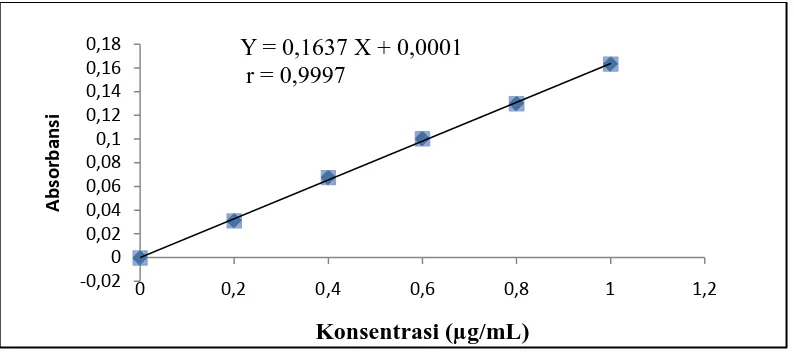
Pengukuran kurva kalibrasi untuk ketiga mineral tersebut diperoleh persamaan garis regresi yaitu Y = 0,0088 X + 0,0002 untuk kromium, Y = 0,0470 X+ 0,0003 untuk mangan dan Y = 0,1637 X + 0,0001 untuk zink.Kurva kalibrasi larutan
[image:47.595.119.512.236.411.2]baku kromium, mangan dan zink dapat dilihat pada Gambar 4.1, Gambar 4.2dan Gambar 4.3 berikut ini:
Gambar 4.1 Kurva kalibrasi larutan baku kromium
Gambar 4.2 Kurva kalibrasi larutan baku mangan
Y = 0,0470 X + 0,0003 r = 0,9999
0 0,01 0,02 0,03 0,04 0,05
0 0,2 0,4 0,6 0,8 1 1,2
A b s o r b a n s i Konsentrasi (µg/mL)
Y = 0,0088 X + 0,0002 r = 0,9998
0 0,001 0,002 0,003 0,004 0,005
0 0,1 0,2 0,3 0,4 0,5 0,6
[image:47.595.118.512.472.648.2]35
Gambar 4.3 Kurva kalibrasi larutan baku zink
Berdasarkan kurva diatas diperoleh hubungan yang linear antara konsentrasi dengan absorbansi, dengan koefisien korelasi (r) kromium sebesar 0,9998;
mangan sebesar 0,9999 dan zink sebesar 0,9997. Nilai r ≥ 0,97 menunjukkan adanya korelasi linier yang menyatakan adanya hubungan antara X (konsentrasi)
dan Y (absorbansi)(Ermer dan McB. Miller, 2005).
Data hasil pengukuran absorbansi larutan baku dan perhitungan persamaan garis regresi kromium, mangan dan zink dapat dilihat pada Lampiran 7, 8dan 9,
halaman51, 53dan 55.
4.5Analisis Kadar Kromium, Mangan dan Zink Dalam Sampel
Penentuan kadar kromium, mangan dan zink dilakukan secara
spektrofotometri serapan atom. Konsentrasi kromium, mangan dan zink dalam sampel ditentukan berdasarkan persamaan garis regresi kurva kalibrasi larutan
baku masing-masing. Konsentrasi kromium, mangan dan zink dalam sampel sudah berada pada rentang kurva kalibrasi maka masing-masing sampel tidak diencerkan lagi (faktor pengenceran = 1). Data kadar pada buah kelor sebelum
Y = 0,1637 X + 0,0001 r = 0,9997
-0,02 0 0,02 0,04 0,06 0,08 0,1 0,12 0,14 0,16 0,18
0 0,2 0,4 0,6 0,8 1 1,2
[image:48.595.115.512.84.260.2]36
dan sesudah uji t,dapat dilihat pada Lampiran 10 dan 11,halaman57 dan 58, serta contoh perhitungan dapat dilihat pada Lampiran12, halaman 59 sampai halaman 60.Hasil analisis kuantitatif kromium, mangan dan zink pada buah bila
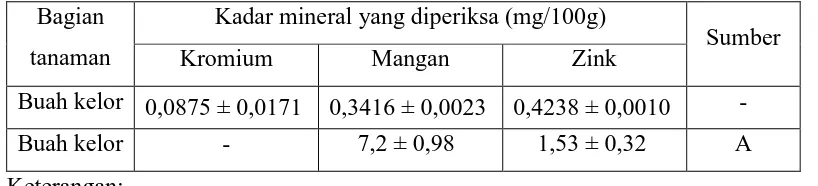
[image:49.595.110.519.243.336.2]dibandingkan dengan bagian tanaman lain dari kelor dapat dilihat pada Tabel 4.2 berikut:
Tabel 4.2 Hasil analisis kadar kromium, mangan dan zink dalam sampel
Bagian tanaman
Kadar mineral yang diperiksa (mg/100g)
Sumber
Kromium Mangan Zink
Buah kelor 0,0875 ± 0,0171 0,3416 ± 0,0023 0,4238 ± 0,0010 - Buah kelor - 7,2 ± 0,98 1,53 ± 0,32 A Keterangan:
A= Aslam, dkk., 2005
Berdasarkan tabel 4.2 diatas dapat dilihatbahwa hasil analisis kadar kromium, mangan dan zink pada buah kelor (Moringa oleifera Lam.)lebih kecil bila dibandingkan dengan hasil analisis yang dilakukan oleh Aslam, dkk. (2005).
Hal ini dikarenakan adanya perbedaan tempat tumbuh, kesuburan tanah, jenis tanah dan pengelolaan tanaman, sehingga mempengaruhi kandungan unsur hara
yang terdapat di dalamnya. Unsur hara mangan dan zink pada tanaman berperanlangsung dalam fotosintesis yaitu dalam pembentukan klorofil dan sebagai pengaktivator enzim(Damanik, dkk., 2010).
Kromium merupakan mineral yang sukar berpindah dari tanah dan hanya sebagian kecil yang dapat menuju tanaman. Kadar kromium yang tinggi pada
37
4.6 Analisis Data Secara Statistik
Kadar kromium, mangan dan zink yang diperoleh dari pengukuran masing-masing larutan sampel, dianalisis secara statistik dan untuk mengetahui
apakah data diterima atau ditolak dilakukan uji t. Pada tingkat kepercayaan 99% dengan nilai α = 0,01, dk = n-1 = 6-1 = 5 diperoleh nilai t tabel(α/2, dk) = 4,0321.
Data diterima jika t hitung < t tabel. Berdasarkan hasil perhitungan statistik dari kadar kromium, mangan dan zink pada buah kelor diperoleh bahwa t hitung < t tabel, maka semua datanya dapat diterima.Perhitungan dapat dilihat pada
Lampiran 13, halaman 61 sampai halaman 66.
4.7 Analisis Validasi Metode
4.7.1 Uji perolehan kembali (recovery)
Hasil uji perolehan kembali (recovery) kadar kromium, mangan dan zink setelahpenambahan masing-masing larutan baku kromium, mangan dan zink dalam sampel dapat dilihat pada Lampiran 14,halaman 67 sampai halaman 69.
Perhitungan persen recoverykromium, mangan dan zink dalam sampel dapat dilihat pada Lampiran 16,halaman 72sampai halaman 89. Persen recoverykromium, mangan dan zink dalam sampel dapat dilihat pada Tabel 4.3
[image:50.595.109.513.637.718.2]berikut:
Tabel 4.3Persen uji perolehan kembali (recovery) kadar kromium, mangan dan
zink
No. Logam yang dianalisis
Rata-rata recovery
(%) Syarat rentangrecovery (%)
1. Kromium 101,4128
80- 120
2. Mangan 100,1937
38
Berdasarkan Tabel4.3diatas, dapat dilihat bahwa rata-rata hasil uji perolehan kembali (recovery) tersebut menunjukkan kecermatan kerja yang memuaskan pada saat pemeriksaan kadar kromium, mangan dan zink dalam
sampel. Hasil uji perolehan kembali (recovery) ini memenuhi syarat akurasi yang telah ditetapkan, jika rata-rata hasil perolehan kembali (recovery) berada pada
rentang 80-120% (Ermer dan McB. Miller, 2005).
4.7.2Simpanganbaku relatif
Perhitungansimpangan baku relatifkromium, mangan dan zink dalam
sampel dapat dilihat pada Lampiran 17,halaman90 sampai halaman 92.Simpangan baku relatif kromium, mangan dan zink dalam sampel dapat dilihat pada Tabel 4.4
[image:51.595.115.513.417.498.2]berikut:
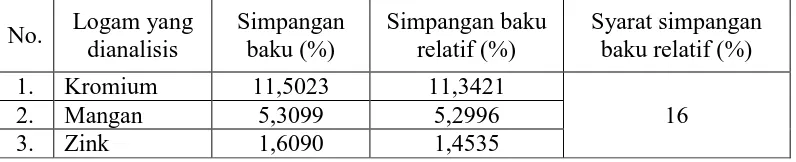
Tabel 4.4Simpangan baku relatifkromium, mangan dan zink dalamsampel
No. Logam yang dianalisis
Simpangan baku (%)
Simpangan baku relatif (%)
Syarat simpangan baku relatif (%)
1. Kromium 11,5023 11,3421
16
2. Mangan 5,3099 5,2996
3. Zink 1,6090 1,4535
Nilai simpangan baku relatif (RSD) untuk analit dengan kadar part per
million (ppm) adalah tidak lebih dari 16% dan untuk analit dengan kadar part per
billion (ppb) RSD-nya adalah tidak lebih dari 32% (Harmita, 2004). Hasil yang
diperoleh menunjukkan bahwa metode yang dilakukan memiliki ketelitian yang
baik karena memenuhi syarat.
4.7.3Batas deteksi dan batas kuantitasi
39
dilihat pada Lampiran 18,halaman 93 sampai halaman 95.Batas deteksi dan kuantitasi kromium, mangan dan zink dalam sampel dapat dilihat pada Tabel 4.5 berikut:
Tabel4.5Batas deteksi dan batas kuantitasi kromium, mangan dan zink
No. Logam yang dianalisis
Batas deteksi
(µg/mL) Batas kuantitasi (µg/mL)
1. Kromium 0,0411 0,1368
2. Mangan 0,0202 0,0673
3. Zink 0,0331 0,1105
40
BAB V
KESIMPULAN DAN SARAN
5.1Kesimpulan
Berdasarkan hasil pemeriksaan kandungan kromium, mangan dan zink pada
buah kelor, maka disimpulkan:
a) Buah kelor(Moringa oleifera Lam.) mengandung mineral kromium, mangan dan zink
b) Kadar kromium, mangan dan zink pada buah kelor secara berturut - turut adalah (0,0875 ± 0,0171) mg/100 g; (0,3416 ± 0,0023) mg/100 g; (0,4238
± 0,0010) mg/100g.
5.2Saran
Berdasarkan hasil pemeriksaan kandungan mineral kromium, mangan dan zink pada buah kelor, maka disarankanpeneliti selanjutnya untukmeneliti
41
DATAR PUSTAKA
Almatsier, S. (2004). Prinsip Dasar Ilmu Gizi. Jakarta: PT. Gramedia PustakaUtama. Halaman 228, 250, 269-272.
Apriyantono A., Fardiaz D., Puspitasari NL., Yasni S., dan Budijanto S.(1989). Petunjuk Laboratorium Analisis Pangan. Penelaah : Muchtadi. D.Bogor: Departemen Pendidikan dan Kebudayaan Direktorat Jendral Pendidikan Tinggi Pusat Antar Univesitas Pangan dan Gizi Institut pertanian Bogor. Halaman 16.
Aslam, M., Anwar, F., Nadeem, R., Rashid, U., dan Kazi, T.G (2005). Mineral Composition of Moringa oleifera Leaves and Pods from Different Region of Punjab, Pakistan. Asian Journal of Plant Sciences. 4(8): 417 - 421. Damanik, M.B., Hasibuan, B.E., Fauzi, Sarifuddin., dan Hanum, H. (2010).
KesuburanTanah dan Pemupukan. Medan: USU Press. Halaman 97-99.
Depkes RI. (2001). Inventaris Tanaman Obat Indonesia. Jilid II. Jakarta: Balai Penelitian dan Pengembangan Kesehatan. Halaman 231.
Ditjen POM. (1979). Farmakope Indonesia. Edisi Ketiga. Jakarta: Departemen Kesehatan RI. Halaman 692.
Ditjen POM. (1995). Farmakope Indonesia. Edisi Keempat. Jakarta: Departemen Kesehatan RI. Halaman1146, 1151, 1126, 1213.
Ermer, J., dan McB. Miller, J.H. (2005). Method Validation in Pharmaceutical Analysis. Weinheim: Wiley-Vch Verlag GmbH & Co. KGaA. Halaman 171.
Gandjar, I.G., dan Rohman, A. (2008). Kimia Farmasi Analisis. Cetakan III.Yogyakarta: Pustaka Pelajar. Halaman 298, 310.
Harris, D.C. (2010). Quantitative Chemical Analysis.Eighth Edition. New York: W.H. Freeman and Company. Halaman 481.
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya. Review Artikel. Majalah Ilmu Kefarmasian. 1(3):117-119,12 - 122, 127 - 130.
42
Katharina, N., Sitorus, M., dan Jonni, M.S (2008). Cegah Malnutrisi dengan Kelor. Yogyakarta: Kansius. Halaman 11.
Khopkar, S.M. (1984). Basic Concepts of Analytical Chemistry. Penerjemah:Saptorahardjo, A., dan Nurhadi. A. (2008).Konsep Dasar Kimia Analitik.Jakarta: UIPress. Halaman81, 296.
Kristinawati, E., dan Nurlaela (2013). Pengaruh Pemberian Filtrat Buah Kelor (Moringa oliefera Lam.) Terhadap Kadar Asam Urat Pada Hewan Coba Tikus Putih (Rattus norvegicus) Strain Wistar. Media Bina Ilmiah. 7(6): 1978-3787.
Kurniasih. (2013). Khasiat dan Manfaat Daun Kelor. Yogyakarta: Pustaka Baru Press. Halaman 35- 36, 39, 59-62.
Kurniawan, S. (2013). Obat Sirih Merah dan Daun kelor. Yogyakarta: Bukubiru. Halaman 11, 17-21.
Linder, M.C (1985). Nutritional Biochemistry and Metabolisme. Penerjemah: Aminuddin Parakkasi. (1992). Biokimia Nutrisi dan Metabolisme. Cetakan I. Jakarta: UIPress. Halaman 285-297.
Mallilin, A., Trinidad, P., Sagum, R.S., Baquiran, P., dan Alcantara, J.S. (2014). Mineral Availability and Dietary Fiber Characteristics of Moringa oleifera. Food and Public Health. 4(5): 242-246.
Paliwal, R., Sharma, V., dan Pracheta. (2011). A Review on Horse Radish Tree (Moringa oleifera): A Multipurpose Tree with High Economic and Commercial Importance.Asian Journal of Biotechnology. ISSN 1996-0700/ DOI: 10.3923/ajbkr.2011.
Rosmarkam, A., dan Yuwono,N.A. (2002). Ilmu Kesuburan Tanah.Yogyakarta: Kanisius. Halaman31, 77, 79.
Sudjana. (2002). Metode Statistika. Edisi Keenam. Bandung: Tarsito. Halaman 93, 168, 239.
Tilong, A.D. (2012). Ternyata Kelor Penakluk Diabetes. Yogyakarta: DIVA Press. Halaman 10 - 14.
43
44
LAMPIRAN
45
[image:58.595.151.475.140.652.2]Lampiran 2. Gambarpohon dan buah kelor (Moringa oleifera Lam.)
46
Lampiran 2 (Lanjutan) Buah dan daun kelor
[image:59.595.128.469.140.403.2][ d a p in B fo text
Gambar 2. Buah kelor
[image:59.595.130.468.425.726.2]47
[image:60.595.190.440.138.423.2]Lampiran 2 (Lanjutan). Gambar buah kelor yang utuh dan dikupas
[image:60.595.190.440.439.723.2]Gambar 4. Buah kelor utuh
48
Lampiran 3. Bagan alir proses dekstruksi kering (buah kelor)
dibersihkan dari pengotor
dicuci dengan akua demineralisata ditiriskan
diangin-anginkan di udara terbuka dihaluskan dengan blender
ditimbang 10 gram di dalam krus porselen ditambahkan 5 tetes Asam Nitrat 65% (b/v) diarangkan di atas hot plate
diabukan dalam tanur dengan temperatur awal 100°C dan perlahan-lahan temperatur dinaikkan hingga suhu 500°C dengan interval 25°C setiap 5 menit
dilakukan selama 60 jam dan dibiarkan hingga dingin
ditambahkan 5 mLHNO3 (1:1)
diuapkan pada hot plate sampai kering
dimasukkan kembali ke dalam tanur dengan temperatur awal 100°C dan perlahan-lahan temperatur dinaikkan hingga suhu 500°C dengan interval 25°C setiap 5 menit dilakukan selama 1 jam dan dibiarkan hingga dingin
di dalam tanur Buah Kelor Muda
Sampel yang telah dihaluskan
Sampel yang telah mengarang
Sampel yang telah mengabu
49
[image:62.595.138.492.136.402.2]Lampiran 4. Gambar abu hasil destruksi
50
Lampiran 5. Bagan alir pembuatan larutan sampel
dilarutkan dalam 5 mLHNO3 (1:1)
dimasukkan ke dalam labuukur 50 mL
dibilas krus porselen sebanyak tiga kali dengan 10 mL akua demineralisata
dicukupkan volumenya dengan akua demineralisatahingga garis tanda
disaring dengan kertas saring Whatmann No.42 dibuang 5 mL untuk menjenuhkan kertas saring
dimasukkan ke dalam botol
dilakukan analisis kualitatif
dilakukan analisis kuantitatif dengan spektrofotometer serapan atom pada λ 357,9 nm (lampu katoda kromium) untuk kromium, λ 279,5 nm (lampu katoda mangan)
untuk mangan, dan λ 213,9 nm (lampu katoda zink) untuk zink
Sampel hasil dekstruksi
Filtrat
Larutan sampel
51
[image:64.595.170.405.146.421.2]Lampiran 6. Gambar hasil analisis kualitatif kromium, mangan dan zink
Gambar 7. Hasil analisis kualitatif kromium, mangan dan zink
52
Lampiran7. Data kalibrasi kromium dengan spektrofotometer serapan atom,
perhitungan persamaan garis regresi dan koefisien korelasi (r)
No Konsentrasi (µ g/mL) (X)
Absorbansi (Y)
1. 0,0000 0,0002
2. 0,1000 0,0011
3. 0,2000 0,0020
4. 0,3000 0,0029
5. 0,4000 0,0037
6. 0,5000 0,0046
No X Y XY X² Y²
1 0,0000 0,0002 0,0000 0,0000 0,00000004 2 0,1000 0,0011 0,0001 0,0100 0,00000121 3 0,2000 0,0020 0,0004 0,0400 0,00000400 4 0,3000 0,0029 0,0009 0,0900 0,00000841 5 0,4000 0,0037 0,0015 0,1600 0,00001361 6 0,5000 0,0046 0,0023 0,2500 0,00002116
∑ X = 1,5000
∑ Y = 0,0145
∑ XY = 0,0052
∑ X² = 0,5500
∑ Y² = 0,00004851
X = 0,2500 Y = 0,0024
a = ∑XY-((∑Xx∑Y)/ n)
∑X²-( (∑X)² / n )
a= 0,0052-((1,5000 x 0,0145)/ 6) 0,5500- ((1,5000)2/ 6)
a= 0,0088
Y = a X + b b = Y - a X
= 0,00242 - (0,0088 x 0,2500) = - 0,0002
53
Lampiran 7.(Lanjutan)
r = ∑
XY- [(∑X)(n∑Y)]
��∑X² - (∑X)² / n �(∑Y² - (∑Y)² / n )
r =
0,0052 - �(1,5)(0,0145)
6 �
��0,55 - (1,5)2
6 ��0,00004851 -
(0,0145)2
6 �
r = 0,001535
0,0015353
54
Lampiran 8. Data kalibrasi mangan dengan spektrofotometer serapan atom,
perhitungan persamaan garis regresi dan koefisien korelasi (r)
No Konsentrasi (µ g/mL) (X)
Absorbansi (Y)
1. 0,0000 0,0005
2. 0,2000 0,0094
3. 0,4000 0,0194
4. 0,6000 0,0282
5. 0,8000 0,0379
6. 1,0000 0,0475
No X Y XY X² Y²
1 0,0000 0,0005 0,0000 0,0000 0,00000025 2 0,2000 0,0094 0,0019 0,0400 0,00008836 3 0,4000 0,0194 0,0077 0,1600 0,00037636 4 0,6000 0,0282 0,0169 0,3600 0,00079524 5 0,8000 0,0379 0,0303 0,6400 0,00143641 6 1,0000 0,0475 0,0475 1,0000 0,00225625
∑X = 3,0000
∑Y = 0,1429
∑XY= 0,1044
∑ X²= 2,2000
∑ Y² = 0,00495287
X= 0,5 Ῡ= 0,0238
a=∑X Y-((∑X x∑Y)/ n)
∑X²-((∑X)² / n )
a=0,1044-((3 x 0,1429)/ 6) 2,2000 -((3)2/ 6)
a= 0,0470
Y = a X + b b = Ῡ- a X
= 0,02382- (0,04704 x 0,5) = 0,0003
55
Lampiran 8. (Lanjutan)
r = ∑
XY-[(∑X)(∑Y)
n ]
��∑X² - (∑X)² / n �(∑Y² - (∑Y)² / n )
r
0,1044 - �(3,0)(0,1429)
6 �
��2,2 - (3)26 ��0,00495287 - (0,1429)2
6 �
=
r =0,03293
0,032933
56
Lampiran 9. Data kalibrasi zink dengan spektrofotometer serapan atom,
perhitungan persamaan garis regresi dan koefisien korelasi (r)
No Konsentrasi (µ g/mL) (X)
Absorbansi (Y)
1. 0,0000 -0,0002
2. 0,2000 0,0311
3. 0,4000 0,0676
4. 0,6000 0,1004
5. 0,8000 0,1299
6. 1,0000 0,1633
No X Y XY X² Y²
1 0,0000 -0,0002 0,0000 0,0000 0,00000004 2 0,2000 0,0311 0,0062 0,0400 0,00096721 3 0,4000 0,0676 0,0270 0,1600 0,00456976 4 0,6000 0,1004 0,0602 0,3600 0,01008016 5 0,8000 0,1299 0,1039 0,6400 0,01687401 6 1,0000 0,1633 0,1633 1,0000 0,02666689
∑ X = 3,0000
∑ Y = 0,4921
∑ XY = 0,3607
∑ X² = 2,2000
∑ Y² = 0,0591581
X = 0,5000 Y