PEMANFAATAN ARANG AMPAS TEBU SEBAGAI ADSORBEN
ION LOGAM Cd, Cr, Cu DAN Pb
DALAM AIR LIMBAH
ADE APRILIANI
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
KATA PENGANTAR
Assalamu’alaikum Warahmatullahi Wabarakatuh
Segala puji bagi Allah SWT yang Maha Esa lagi Maha Perkasa yang
mengatur hidup dan kehidupan manusia dan para makhluk-Nya yang lain. Atas
berkat rahmat dan karunia serta ridho-Nya penulis dapat menyelesaikan skripsi
“Pemanfaatan Arang Ampas Tebu sebagai Adsorben Ion Logam Berat Cd, Cr,
Cu dan Pb dalam Air Limbah” Shalawat serta salam semoga tetap tercurah
kepada junjungan kita Rasulullah Muhammad SAW, kepada para keluarga dan
para sahabatnya serta termasuk kita pula selaku ummatnya. Amin.
Skripsi ini merupakan salah satu syarat menempuh ujian Sarjana Sains
pada Program Studi Kimia, Fakultas Sains dan Teknologi, Universitas Islam
Negeri Syarif Hidayatullah Jakarta.
Dalam penyusunan skripsi ini, penulis mendapat bimbingan dan
bantuan dari berbagai pihak, oleh karena itu pada kesempatan ini penulis
mengucapkan terima kasih kepada :
1. Dr. Syopiansyah Jaya Putra, M.Sis, selaku Dekan Fakultas Sains dan
Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta.
2. Sri Yadial Chalid, M.Si, selaku Ketua Program Studi Kimia Fakultas Sains
dan Teknologi, Universitas Islam Negeri Syarif Hidayatullah Jakarta.
3. Nurhasni, M.Si, selaku Dosen Pembimbing I, yang telah membantu penulis
serta memberikan semangat dan motivasi serta masukan dalam menyelesaikan
4. Hendrawati, M.Si, selaku Kepala Laboratorium Kimia PLT UIN Syarif
Hidayatullah Jakarta sekaligus sebagai Dosen Pembimbing II yang telah
memberikan izin untuk melakukan penelitian di laboratorium kimia dan
memberikan nasihat serta bimbingannya kepada penulis dalam menyelesaikan
skripsi.
5. Dr. Mirzan T Razzak, M.Eng, APU selaku Kepala Pusat Laboratorium
Terpadu UIN Syarif Hidayatullah Jakarta sekaligus sebagai Dosen Penguji I
yang telah memberikan izin kepada penulis untuk melakukan penelitian serta
telah memberikan saran dan masukan yang sangat bermanfaat untuk perbaikan
skripsi ini.
6. Yusraini Dian Inayati Siregar, M.Si. selaku Dosen Penguji II yang telah
memberikan saran yang sangat bermanfaat untuk perbaikan skripsi ini.
7. Bapak (H. Dai Murdalih) dan Ibuku tersayang (Hj. Nuryani) serta kakak-
kakak tercinta (a iwan, a ita, a irfan, a irul, a indi, a memes, a dedy dan a
dukut) dan tiga keponakanku (daffa, danar dan akhdan) yag telah memberikan
cinta dan kasih sayangnya baik secara moril maupun materil dalam
pelaksanaan dan penyusunan skripsi.
8. Seluruh Dosen dan Karyawan Program Studi Kimia, terimakasih atas
pengajaran dan ilmunya yang bermanfaat bagi penulis.
9. Staf Laboran PLT UIN khususnya laboratorium kimia, pangan dan lingkungan
10. Nunu, yang sama-sama merasakan suka dan duka selama penelitian dan
berbagi ilmu kepada penulis.
11. Sahabat-sahabat terhebatku Ria, Fiqi, Wardah, Reska, Tika, Uchi dan Ndut
Aan terimaksih atas semua ketulusan, semangat dan perhatian yang kalian
berikan selama ini. Tetap semangat dalam kebersamaan.
12. Aji, yang selalu memberikan doa, semangat dan dukungan kepada penulis
dalam penyelesaian skripsi.
13. Teman-teman Kimia 2005 yang tidak bisa disebutkan satu persatu,
terimakasih atas dukungan kalian semua.
Akhir kata semoga skripsi ini bermanfaat bagi penulis khususnya dan
bagi pembaca umumnya. Dengan segenap kerendahan hati penulis menyadari
bahwa skripsi ini masih jauh dari kesempurnaan. Saran dan kritik yang konstruktif
dari pembaca sangat penulis harapkan.
Wassalamu’alaikum Warahmatullahi Wabarakatuh
Jakarta, Maret 2010
DAFTAR ISI
Halaman
KATA PENGANTAR ... vi
DAFTAR ISI ... ix
DAFTAR GAMBAR ... xii
DAFTAR TABEL ... xiv
DAFTAR LAMPIRAN ... xv
ABSTRAK ... xvi
ABSTRACT ... ... xvii
BAB I PENDAHULUAN ... 1
1.1. Latar Belakang... 1
1.2. Perumusan Masalah ... 4
1.3. Hipotesa ... 4
1.4. Tujuan Penelitian ... 4
1.5. Manfaat Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1. Adsorpsi ... 6
2.1.1. Faktor-Faktor Yang Mempengaruhi Daya Adsorpsi ... 9
2.1.2. Metode Sorpsi... 10
2.2. Biosorpsi... 11
2.3. Isoterm Adsorpsi ... 13
2.3.1. Isoterm Langmuir ... 14
2.4. Logam Berat ... 16
2.4.1. Timbal (Pb) ... 17
2.4.2. Kadmium (Cd) ... 19
2.4.3. Kromium (Cr) ... 20
2.4.4. Tembaga (Cu) ... 22
2.5. Tanaman Tebu ... 23
2.5.1. Ampas Tebu ... 25
2.6. Spektroskopi Serapan Atom (SSA) ... 26
2.6.1. Prinsip Spektroskopi Serapan Atom ... 27
BAB III METODE PENELITIAN ... 33
3.1. Waktu dan Tempat Penelitian ... 33
3.2. Alat dan Bahan ... 33
3.2.1. Alat ... 33
3.2.2. Bahan ... 33
3.3. Rancangan Penelitian ... 34
3.4. Prosedur Kerja ... ... 35
3.4.1. Pembuatan Arang Ampas Tebu ... 35
3.4.2. Preparasi Limbah Simulasi ... 35
3.4.3. Penentuan Kondisi Optimum ... 36
1).Penentuan Pengaruh Massa Arang Ampas Tebu terhadap Penyerapan Ion Logam Cd, Cr, Cu dan Pb ... 36
2). Penentuan Pengaruh pH Larutan Ion logam ... 36
3). Penentuan Pengaruh Konsentrasi Larutan Ion Logam ... 37
4). Penentuan Pengaruh Lama Pemanasan ... 37
3.3.5. Aplikasi Penggunaan Arang Ampas Tebu pada Limbah Simulasi .... 38
3.4.6. Aplikasi Penggunaan Arang Ampas Tebu pada Limbah Laboratorium 39 BAB IV HASIL DAN PEMBAHASAN ... 40
4.1. Pengaruh Massa Arang Ampas Tebu ... 40
4.2. Pengaruh pH Larutan Ion Logam ... 42
4.3. Pengaruh Konsentrasi Larutan Ion Logam ... 43
4.4. Pengaruh Lama Pemanasan ... 45
4.5. Aplikasi pada Limbah Simulasi ... 48
4.6. Aplikasi pada Limbah Laboratorium Kimia Pusat Laboratorium Terpadu UIN Syarif Hidayatullah Jakarta. ... 50
4.7. Isoterm Adsorpsi ... 52
BAB V KESIMPULAN DAN SARAN ... 57
5.1. Kesimpulan ... 57
5.2. Saran ... 58
DAFTAR PUSTAKA ... 59
DAFTAR GAMBAR
Halaman
Gambar 1. Kurva Isoterm Langmuir ...15
Gambar 2. Kurva Isoterm Freundlich ...16
Gambar 3. (a) Batang Tebu dan (b) Tanaman Tebu ...24
Gambar 4. Skema Prinsip SSA ...28
Gambar 5. (a) Komponen-komponen utama SSA, (b) Sistem Instrumentasi SSA Single Beam dan (c) Double Beam ...29
Gambar 6. Lampu Katoda ...30
Gambar 7. Gambar Nebulizer,Burner dan Spray Chamber ………..31
Gambar 8. Bagan Alir Penelitian ………..34
Gambar 9. Pengaruh Massa Arang Ampas Tebu terhadap Penyerapan Ion Logam Cd (II), Cr (VI), Cu(II) dan Pb(II) (volume 10ml, konsentrasi 20 mg/L dan lama pemanasan 2,5jam)...40
Gambar 10.Pengaruh pH Ion Logam Cd(II), Cr(VI), Cu(II) dan Pb(II) terhadap Efisiensi Penyerapan Arang Ampas Tebu(volume 10ml, konsentrasi 20 mg/L, Massa 0,5 g arang ampas tebu) ...42
Gambar 11. Pengaruh Konsentrasi Ion Logam Cd(II), Cr(VI), Cu(II) dan Pb(II) terhadap Efisiensi Penyerapan Ampas Tebu (volume 10 ml, konsentrasi 20 mg/L, massa 0,5 g ampas tebu)...44
Gambar 12.Pengaruh Lama Pemanasan Arang Ampas Tebu terhadap Penyerapan Ion logam Cd(II), Cr(VI), Cu(II) dan Pb(II)(volume 10ml, konsentrasi 20mg/L, suhu 2500C, massa 0,5 g ampas tebu) ...46
Gambar 13.Pembentukan Senyawa Kompleks antara Ion Logam Pb dengan Selulosa ...52
Gambar 14. (a) Isoterm Langmuir dan (b) Isoterm Freundlich adsorpsi ion logam Cd oleh ampas tebu ...53
Gambar 16. (a) Isoterm Langmuir dan (b) Isoterm Freundlich adsorpsi
ion logam Cr oleh ampas tebu ...55
Gambar 17. (a) Isoterm Langmuir dan (b) Isoterm Freundlich adsorpsi
DAFTAR TABEL
Halaman
Tabel 1. Komponen Penyusun Serat Ampas Tebu ...26
Tabel 2. Kapasitas Penyerapan Ion Logam pada Variasi Massa Arang
Ampas Tebu ...41
Tabel 3. Kapasitas Penyerapan Ion Logam pada Variasi pH Larutan
Ion Logam ...43
Tabel 4. Kapasitas Penyerapan Ion Logam pada Variasi Konsentrasi
Larutan Ion Logam ...45
Tabel 5. Kapasitas Penyerapan Ion Logam pada Variasi Lama Pemanasan ...47
Tabel 6. Aplikasi Penyerapan Ion Logam dalam Limbah Simulasi ………..48
Tabel 7. Aplikasi Penyerapan Ion Logam dalam Limbah Laboratorium
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Data Penentuan Kondisi Optimum Penyerapan ...63
Lampiran 2. Contoh Perhitungan Efisiensi dan Kapasitas Penyerapan ...69
Lampiran 3. Isoterm Langmuir Adsorpsi Ion Logam oleh Ampas Tebu ...70
Lampiran 4. Isoterm Freundlich Adsorpsi Ion Logam oleh Ampas Tebu ...72
Lampiran 5. Asam dan Basa Beberapa Senyawa dan dan Ion Menurut Prinsip HSAB dari Pearson ...74
Lampiran 6. Pembuatan Larutan ...75
Lampiran 7. Pembuatan Larutan Buffer ...76
ABSTRAK
ADE APRILIANI. Pemanfaatan Arang Ampas Tebu sebagai Adsorben Ion
Logam Cd, Cr, Cu dan Pb dalam Air Limbah. Di bawah bimbingan Nurhasni, M.Si dan Hendrawati, M.Si.
Telah dilakukan penelitian terhadap kemampuan arang ampas tebu sebagai adsorben untuk menyerap ion logam Cd, Cr, Cu dan Pb dalam air limbah. Percobaan dilakukan dalam skala laboratorium menggunakan metode batch. Penentuan kondisi optimum meliputi massa adsorben, pH, konsentrasi ion logam dan lama pemanasan. Hasil analisis menggunakan Spektroskopi Serapan Atom (SSA) dalam air limbah simulasi menunjukkan efisiensi penyerapan tertinggi pada ion logam Pb sebesar 95,92 % dan kapasitas penyerapan 0,3940 mg/g. Sedangkan efisiensi penyerapan terendah pada ion logam Cd dengan nilai 59,98 % dan kapasitas penyerapan 0,4096 mg/g. Pada air limbah Laboratorium Kimia UIN Syarif Hidayatullah Jakarta, efisiensi penyerapan tertinggi pada ion logam Cu dengan efisiensi penyerapan sebesar 92,85 % dan kapasitas penyerapan 0,026 mg/g. Sedangkan efisiensi penyerapan terendah pada ion logam Cd, yaitu 62,33 % dengan kapasitas penyerapan 0,0374 mg/g.
ABSTRACT
ADE APRILIANI. The Used of Sugarcane Bagasse Charcoal as an Adsorbent of
Metal Ions Cd, Cr, Cu and Pb in Wastewater. Advisor Nurhasni, M.Si and Hendrawati, M.Si.
The ability of sugarcane bagasse charcoal as an adsorbent to adsorp metal ions of Cd, Cr, Cu and Pb from wastewater has been investigated. The experiment was done in laboratory scale by using batch method. The determination of optimum condition was include of adsorbent dosage, pH concentration of metal ions and duration of heating. The result was analyzed by using Atomic Absorption Spectroscopy (AAS) in simulation wastewater indicate the highest adsorption efficiency increase 95,92% for Pb metal ion and adsorption capacity 0,3941 mg/g. Meanwhile the lowest adsorption efficiency for Cd metal ion is 59,98% and adsorption capacity 0,4096 mg/g. In wastewater from Chemical Laboratory of UIN Syarif Hidayatullah Jakarta, the result indicate the highest adsorption efficiency increase 92,85% for Cu metal ion and adsorption capacity 0,026 mg/g. Meanwhile the lowest adsorption efficiency for Cd metal ion, that is 62,33% with adsoption capacity 0,0374 mg/g.
BAB I
PENDAHULUAN
1.1. Latar Belakang
Perkembangan industri yang ada saat ini telah mengalami kemajuan yang
sangat pesat. Akibat proses industrialisasi tersebut dihasilkan buangan limbah
industri berupa limbah cair, padat maupun gas yang dapat mengakibatkan
terjadinya pencemaran lingkungan. Limbah cair pada industri ini memberikan
kontribusi terhadap pelepasan logam berat beracun di dalam aliran air. Hal ini
akan berdampak negatif pada makhluk hidup di lingkungan sekitarnya.
Beberapa metode untuk menghilangkan logam berat dari air limbah telah
dilakukan dengan proses secara fisika dan kimia yang meliputi presipitasi,
koagulasi dan pertukaran ion. Tetapi metode-metode tersebut diatas masih mahal
terutama bagi negara-negara yang sedang berkembang. Proses adsorpsi
merupakan teknik pemurnian dan pemisahan yang efektif dipakai dalam industri
karena dianggap lebih ekonomis dalam pengolahan air dan limbah (Al-Asheh et
al., 2000) dan merupakan teknik yang sering digunakan untuk mengurangi ion logam berat dalam air limbah (Selvi et al., 2001).
Pertimbangan biaya untuk pengolahan merupakan salah satu alternatif
yang perlu dipertimbangkan untuk memilih teknologi yang akan digunakan untuk
pengolahan senyawa logam berat tersebut. Senyawa alam yang banyak terdapat
dalam limbah pertanian atau buangan industri merupakan potensi adsorben murah.
Biaya pengolahan adalah parameter yang penting dalam memilih adsorben dan
diperlukan dan ketersediaan adsorben tersebut. Secara umum adsorben dapat
dikatakan murah apabila tidak memerlukan atau memerlukan sedikit proses,
bahannya banyak terdapat dan merupakan hasil samping atau limbah dari industri
(Arifin, 2003).
Pemanfaatan bahan alami atau biomaterial dari limbah pertanian sebagai
bahan pengganti karbon aktif ataupun resin penukar ion untuk menyerap senyawa-
senyawa beracun telah mulai diteliti. Penggunaan biomaterial dari limbah
pertanian atau industri dapat digunakan sebagai alternatif adsorben dengan biaya
rendah diantaranya adalah tongkol jagung, gabah padi, ampas kedelai, biji kapas,
jerami dan kulit kacang tanah (Marshall dan Mitchell, 1996). Dari penelitian yang
telah dilakukan memperlihatkan bahwa biomaterial mengandung gugus fungsi
antara lain karboksil, amino, sulfat, polisakarida, lignin dan sulfihidril mempunyai
kemampuan penyerapan yang baik (Volesky, 2004).
Ampas tebu adalah hasil limbah dari industri gula atau pembuatan
minuman dari air tebu yang belum termanfaatkan secara optimal sehingga
membawa masalah tersendiri bagi industri gula maupun lingkungan karena
dianggap sebagai limbah. Secara kimiawi, komponen utama penyusun ampas tebu
adalah serat yang didalamnya terkandung gugus selulosa, poliosa seperti
hemiselulosa, lignoselulosa dan lignin (Santosa dkk., 2003). Dari komponen
penyusun ampas tebu tersebut, peneliti ingin mengetahui kemampuan ampas tebu
dalam menyerap ion logam dalam air limbah karena ampas tebu memiliki serat
dan pori-pori yang cukup besar dalam menampung gula yang sebelumnya
terkandung dalam ampas tebu tersebut. Sehingga ion logam dapat terserap
penyerap ion logam merupakan proses daur ulang yang sangat baik bagi
penghematan sumber daya alam dan merupakan salah satu cara bagi pengolahan
limbah, seperti yang dikemukakan oleh para pakar lingkungan bahwa sebaik-
baiknya pengolahan limbah adalah dengan cara daur ulang. Selain itu, karena
ampas tebu mudah didapatkan serta dapat diregenerasi kembali dan dari sisi
ekonomis harga ampas tebu yang murah dibanding penyerap sintetis lain, maka
hal ini menjadi keuntungan tersendiri dalam penggunaan ampas tebu sebagai
penyerap ion logam Cd, Cr, Cu dan Pb (Refilda dkk., 2001).
Pemanfaatan ampas tebu menjadi arang mempunyai prospek yang bagus
dan ekonomis untuk dikembangkan. Hasil pengarangan ampas tebu pada suhu
320oC akan mengakibatkan penguraian lignosellulose mejadi asam asetat,
metanol, gas CO, CH4, H2 dan CO2. Asam asetat umumnya berasal dari selulosa,
terutama hemiselolosa sedangkan metanol berasal dari lignin yang dapat larut.
Arang ampas tebu yang dibuat melalui tahap pirolisis (proses karbonisasi) pada
suhu tertentu dapat dijadikan alternatif adsorben untuk menyerap ion logam berat
beracun (Mukhlieshin, 1997).
Dalam penelitian ini akan diselidiki kemampuan arang ampas tebu dalam
menyerap ion logam, khususnya terhadap ion logam berat Cd, Cr, Cu dan Pb.
Keempat logam tersebut banyak digunakan dalam industri dan memiliki potensi
dampak pencemaran pada lingkungan. Dengan menggunakan metode statis
(batch) serta analisis penyerapan logam menggunakan Spektrofotometer Serapan
Atom (SSA), diharapkan penelitian ini dapat dijadikan sumbangan ilmu
terjadinya pencemaran lingkungan yang diakibatkan oleh adanya ion logam dan
senyawa beracun.
1.2. Perumusan Masalah
1. Apakah arang ampas tebu dapat menyerap ion logam Cd, Cr, Cu dan Pb
pada air limbah?
2. Berapa efisiensi dan kapasitas penyerapan arang ampas tebu sebagai
adsorben terhadap ion logam Cd, Cr, Cu dan Pb?
1.3. Hipotesa
1. Arang ampas tebu dapat menyerap ion logam Cd, Cr, Cu dan Pb pada air
limbah.
2. Efisiensi dan kapasitas penyerapan arang ampas tebu terhadap ion logam
Cd, Cr, Cu dan Pb dapat mencapai 100%.
1.4. Tujuan Penelitian
1. Menguji dan menganalisis kemampuan arang ampas tebu dalam menyerap
ion logam Cd, Cr, Cu dan Pb serta menentukan kondisi optimum terhadap
beberapa parameter yang digunakan antara lain massa adsorben,
konsentrasi ion logam, pH ion logam dan lama pemanasan.
2. Memanfaatkan penggunaan ampas tebu sebagai hasil limbah dari industri
gula maupun pembuatan minuman sari tebu dalam bentuk arang agar tidak
1.5. Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini adalah dapat memberikan
informasi bahwa arang ampas tebu dapat digunakan sebagai alternatif biomaterial
penyerap ion logam sehingga dapat diaplikasikan penggunaannya dalam upaya
BAB II
TINJAUAN PUSTAKA
2.1. Adsorpsi
Adsorpsi merupakan suatu proses penyerapan oleh padatan tertentu
terhadap zat tertentu yang terjadi pada permukaan zat padat karena adanya gaya
tarik atom atau molekul pada permukaan zat padat tanpa meresap ke dalam
(Atkins,1999).
Proses adsorpsi dapat terjadi karena adanya gaya tarik atom atau molekul
pada permukaan padatan yang tidak seimbang. Adanya gaya ini, padatan
cenderung menarik molekul-molekul yang lain yang bersentuhan dengan
permukaan padatan, baik fasa gas atau fasa larutan ke dalam permukaannya.
Akibatnya, konsentrasi molekul pada permukaan menjadi lebih besar dari pada
dalam fasa gas atau zat terlarut dalam larutan. Menurut Giles dalam Osipow
(1962), yang bertanggung jawab terhadap adsorpsi adalah gaya tarik van der
waals, pembentukan ikatan hidrogen, pertukaran ion dan pembentukan ikatan
kovalen.
Adsorpsi dapat terjadi pada antarfasa padat-cair, padat-gas atau gas-cair.
Molekul yang terikat pada bagian antarmuka disebut adsorbat, sedangkan
permukaan yang menyerap molekul-molekul adsorbat disebut adsorben. Pada
adsorpsi, interaksi antara adsorben dengan adsorbat hanya terjadi pada permukaan
adsorben. Adsorpsi adalah gejala pada permukaan, sehingga makin besar luas
permukaan, maka makin banyak zat yang teradsorpsi. Walaupun demikian,
Berdasarkan besarnya interaksi antara adsorben dan adsorbat, adsorpsi
dibedakan menjadi dua macam yaitu adsorpsi fisika dan adsorpsi kimia.
a. Adsorpsi Fisika
Dalam adsorpsi fisika, molekul-molekul teradsorpsi pada permukaan
adsorben dengan ikatan yang lemah. Adsorpsi fisika terjadi bila gaya
intermolekular lebih besar dari gaya tarik antar molekul atau gaya tarik menarik
yang relatif lemah antara adsorbat dengan permukaan adsorben, gaya ini disebut
gaya Van der Waals sehingga adsorbat dapat bergerak dari satu bagian permukaan
ke bagian permukaan lain dari adsorben. Adsorpsi ini berlangsung cepat, dapat
membentuk lapisan jamak (multilayer) dan dapat bereaksi balik (reversibel), sehingga molekul-molekul yang teradsorpsi mudah dilepaskan kembali dengan
cara menurunkan tekanan gas atau konsentrasi zat terlarut.
Panas adsorpsi yang menyertai adsorpsi fisika yaitu berkisar 10 kJ/mol
(kira-kira mempunyai orde yang sama dengan kalor yang dilepaskan pada proses
kondensasi adsorbat) dan lebih panas dari adsorpsi kimia. Adsorpsi fisika
umumnya terjadi pada temperatur yang rendah dan jumlah zat yang teradsorpsi
akan semakin kecil dengan naiknya suhu. Banyaknya zat yang teradsorpsi dapat
beberapa lapisan monomolekuler, demikian juga kondisi kesetimbangan tercapai
segera setelah adsorben bersentuhan dengan adsorbat. Hal ini dikarenakan dalam
fisika tidak melibatkan energi aktivasi.
b. Adsorpsi Kimia
Pada adsorpsi kimia, molekul-molekul yang teradsorpsi pada permukaan
adsorben bereaksi secara kimia, karena adanya reaksi antara molekul-molekul
terjadi pemutusan dan pembentukan ikatan (Reza, 2002). Oleh karena itu, panas
adsorpsinya mempunyai kisaran yang sama seperti reaksi kimia, yaitu berkisar
100 kJ/mol (mempunyai orde besaran yang sama dengan energi ikatan kimia).
Ikatan antara adsorben dengan adsorbat dapat cukup kuat sehingga spesies aslinya
tidak dapat ditemukan kembali. Adsorpsi ini bersifat irreversibel, hanya dapat
membentuk lapisan tunggal (monolayer) dan diperlukan energi yang banyak untuk melepaskan kembali adsorbat (dalam proses adsorpsi). Pada umumnya,
dalam adsorpsi kimia jumlah (kapasitas) adsorpsi bertambah besar dengan
naiknya temperatur. Zat yang teradsorpsi membentuk satu lapisan monomolekuler
dan relatif lambat tercapai kesetimbangan karena dalam adsorpsi kimia
melibatkan energi aktivasi (Oscik, 1982).
Menurut Syahmani dan Sholahudin (2007), energi adsorpsi fisika adalah
42 kJ/mol sedangkan adsorpsi kimia berada dalam kisaran 42-420 kJ/mol. Secara
kualitatif perilaku adsorpsi dapat juga dipandang dari sifat polar ataupun nonpolar
antara zat padat (adsorben) dengan komponen larutan (adsorbat). Adsorben polar
akan cenderung mengadsorpsi kuat adsorbat polar dan lemah terhadap adsorbat
nonpolar, demikian juga sebaliknya. Adsorben polar akan mengadsorpsi kuat zat
terlarut polar dari pelarut nonpolar karena kelarutannya yang rendah dan
mengadsorpsi yang lemah dari pelarut polar karena kelarutannya yang tinggi,
demikian juga sebaliknya.
Menurut Hughes dan Poole (1984) proses adsorpsi melalui pertukaran ion
dan kompleksasi hanya berlangsung pada lapisan permukaan sel yang mempunyai
situs-situs yang bermuatan berlawanan dengan muatan ion logam sehingga
kimiawi dianggap mempunyai situs-situs aktif atau gugus fungsional yang mampu
berinteraksi dengan logam permukaan sel seperti posfat, karboksil, amina dan
amida. Jika proses adsorpsi melalui pertukaran ion, adsorpsi dipengaruhi oleh
banyak proton dalam larutan yang berkompetisi dengan ion logam pada
permukaan adsorben, sehingga pada pH yang rendah jumlah proton melimpah,
peluang terjadinya pengikatan logam oleh adsorben relatif kecil, sebaliknya pada
pH tinggi, jumlah proton relatif kecil menyebabkan peluang terjadinya pengikatan
logam menjadi besar.
2.1.1. Faktor-Faktor Yang Mempengaruhi Daya Adsorpsi
Menurut Gaol (2001), banyaknya adsorbat yang terserap pada permukaan
adsorben dipengaruhi oleh beberapa faktor, yaitu :
1. Jenis Adsorbat, dapat ditinjau dari
a. Ukuran molekul adsorbat, rongga tempat terjadinya adsorpsi dapat dicapai
melalui ukuran yang sesuai, sehingga molekul-molekul yang bisa diadsorpsi
adalah molekul-molekul yang berdiameter sama atau lebih kecil dari
diameter pori adsorben.
b. Polaritas molekul adsorbat, apabila diameter sama, molekul-molekul polar
lebih kuat diadsorpsi daripada molekul-molekul yang kurang polar, sehingga
molekul-molekul yang lebih polar bisa menggantikan molekul-molekul yang
kurang polar yang telah diserap.
2. Sifat Adsorben, dapat ditinjau dari
a. Kemurnian adsorben, adsorben yang lebih murni memiliki daya serap yang
b. Luas Permukaan, semakin luas permukaan adsorben maka jumlah adsorbat
yang terserap akan semakin banyak pula.
c. Temperatur, adsorpsi merupakan proses eksotermis sehingga jumlah
adsorbat akan bertambah dengan berkurangnya temperatur adsorbat.
Adsorpsi fisika yang substansial biasa terjadi pada temperatur di bawah titik
didih adsorbat, terutama di bawah 50 oC. Sebaliknya pada adsorpsi kimia,
jumlah yang diadsorpsi berkurang dengan naiknya temperatur adsorbat.
d. Tekanan, untuk adsorpsi fisika, kenaikan tekanan adsorbat mengakibatkan
kenaikan jumlah zat yang diadsorpsi.
2.1.2. Metode Sorpsi
Metode sorpsi dapat dilakukan dengan dua cara yaitu statis (batch) dan
dinamis (kolom).
1. Cara statis yaitu ke dalam wadah yang berisi sorben dimasukkan larutan
yang mengandung komponen yang diinginkan, selanjutnya diaduk dalam
waktu tertentu, kemudian dipisahkan dengan cara penyaringan atau
dekantasi. Komponen yang telah terikat pada sorben dilepaskan kembali
dengan melarutkan sorben dalam pelarut tertentu dan volumenya lebih
kecil dari volume larutan mula-mula.
2. Cara dinamis (kolom) yaitu ke dalam kolom yang telah diisi dengan
sorben dilewatkan larutan yang mengandung komponen tertentu
selanjutnya komponen yang telah terserap dilepaskan kembali dengan
Karena selektivitasnya yang tinggi, proses adsorpsi sangat sesuai untuk
memisahkan bahan dengan konsentrasi yang kecil dari campuran yang
mengandung bahan lain yang berkonsentrasi tinggi. Bentuk lain dari adsorpsi
adalah pertukaran ion (ion exchange).
Kecepatan adsorpsi tidak hanya bergantung pada perbedaan konsentrasi
dan luas permukaan adsorben, melainkan juga pada suhu, pH larutan, tekanan
(untuk gas), ukuran partikel, dan porositas adsorben tetapi juga bergantung pada
ukuran molekul bahan yang akan diadsorpsi dan viskositas campuran yang akan
dipisahkan (Hanjono, 1995).
2.2. Biosorpsi
Proses penyerapan yang menggunakan material biologi (biomaterial)
sebagai sorben disebut biosorpsi. Menurut Cossich et al., (2003), biosorpsi didefinisikan sebagai proses pengunaan bahan alami untuk mengikat logam berat.
Proses ini terjadi ketika ion logam berat mengikat dinding sel dengan dua cara
yang berbeda, pertama pertukaran ion di mana ion monovalent dan divalent
seperti Na, Mg, dan Ca pada dinding sel digantikan oleh ion-ion logam berat; dan
kedua adalah pembentukan kompleks antara ion-ion logam berat dengan
fungsional grup seperti karbonil, amino, thiol, hidroksi, posfat, dan hidroksi-
karboksil yang berada pada dinding sel. Proses biosorpsi ini bersifat bolak balik
dan cepat. Proses bolak balik ikatan ion logam berat di permukaan sel ini dapat
terjadi pada sel mati dan sel hidup dari suatu biomass. Proses biosorpsi dapat lebih
efektif dengan kehadiran tertentu pH dan kehadiran ion-ion lainnya di media di
ion logam berat tersebar pada permukaan sel, ion akan mengikat pada bagian
permukaan sel berdasarkan kemampuan daya afinitasnya (Gadd dalam Sunarya,
1998).
Biomaterial yang digunakan sebagai penyerap disebut biosorben.
Biomaterial memiliki kemampuan penyerapan yang unik. Penyerapan dapat
melalui pengikatan aktif dan pasif. Pengikatan aktif melibatkan reaksi
metabolisme terjadi pada biomaterial yang hidup sedangkan pengikatan pasif
hanya terjadi pada biomaterial yang telah mati. Tidak seperti sorben sintetis
(resin, silica dan selulosa) yang hanya mengandung satu macam gugus fungsi,
biomaterial memiliki berbagai fungsi yang ditemukan dalam sel dan dinding
selnya. Gugus fungsi yang aktif dalam proses penyerapan diantaranya karboksil,
hidroksil, amino, posfat dan lain-lain.
Mekanisme penyerapan ion logam yang terjadi pada biomaterial telah
diusulkan oleh Tzesus dalam Guibal et al., (1992) yang berhubungan dengan
perpindahan ion logam melalui lapisan atau permukaan dinding.
Tahap perpindahan yang terjadi adalah :
1. Perpindahan ion logam dari bagian larutan ke film pembatas yang ada di
sekitar dinding sel
2. Perpindahan ion logam dari film pembatas ke permukaan sel
3. Perpindahan ion logam sel ke sisi aktif biomaterial
4. Fase penyerapan yang terdiri dari pengikatan, pengompleksan dan
pengendapan di dalam membran biomaterial.
Biomaterial menarik untuk dipelajari dalam proses penyerapan karena
kemampuan penyerapan yang lebih dan ukuran partikelnya dapat dioptimumkan
(Fourest dan Roux, 1992).
Proses adsorpsi menggunakan produk limbah pertanian atau biosorpsi
menjadi alternatif baru untuk pengolahan air limbah. Menurut Kargi dan Cikla
(2006), proses biosorpsi lebih baik digunakan untuk metode kimia dan fisika
dikarenakan oleh faktor-faktor di bawah ini :
a. Tanaman dapat digunakan sebagai adsorben dari limbah berlebih yang
dihasilkan dari pengolahan air limbah
b. Biosorben murah, mudah didapatkan dan kemungkinan dapat digunakan
kembali
c. Penyerapan ion logam selektif dapat menggunakan biosorben
d. Proses biosorpsi dapat dilakukan secara luas pada beberapa kondisi
lingkungan seperti pH, kekuatan ion dan temperatur.
2.3. Isoterm Adsorpsi
Isoterm adsorpsi merupakan fungsi konsentrasi zat terlarut yang terserap
pada padatan terhadap konsentrasi larutan. Persamaan yang dapat digunakan
untuk menjelaskan data percobaan isoterm dikaji oleh Freundlich, Langmuir, serta
Brunauer, Emmet dan Teller (BET). Tipe isoterm adsorpsi dapat digunakan untuk
mempelajari mekanise adsorpsi adsorpsi fase cair-padat pada umumnya menganut
tipe isoterm Freundlich dan Langmuir (Atkins, 1999). Adsorben yang baik
memiliki kapasitas adsorpsi dan presentase penyerapan yang tinggi.
Sedangkan presentase adsorpsi (efisiensi adsorpsi) dapat dihitung dengan
menggunakan rumus :
Keterangan :
Q = Kapasitas adsorpsi per bobot molekul (mg/g) C1 = Konsentrasi awal larutan (mg/L)
C2 = Konsentrasi akhir larutan (mg/L)
m = Massa adsorben (g)
V = Volume larutan (mL)
% E = Efisiensi adsorpsi
2.3.1. Isoterm Langmuir
Tipe isoterm Langmuir merupakan proses adsorpsi yang berlangsung
secara kimisorpsi satu lapisan. Kimisorpsi adalah adsorpsi yang terjadi melalui
ikatan kimia yang sangat kuat antara sisi aktif permukaan dengan molekul
adsorbat dan dipengaruhi oleh densitas elektron. Adsorpsi satu lapisan terjadi
karena ikatan kimia biasanya bersifat spesifik, sehingga permukaan adsorben
mampu mengikat adsorbat dengan ikatan kimia. Isoterm Langmuir diturunkan
berdasarkan teori dengan persamaan :
Isoterm Langmuir dipelajari untuk menggambarkan pembatasan sisi adsorpsi
dengan asumsi bahwa sejumlah tertentu sisi sentuh adsorben ada pada
permukaannya dan semua memiliki energi yang sama, serta adsorpsi bersifat balik
terhadap c dengan persamaan :
Gambar 1. Kurva isoterm Langmuir
2.3.2. Isoterm Freundlich
Isoterm Freundlich merupakan isoterm yang paling umum digunakan dan
dapat mencirikan proses adsorpsi dengan lebih baik (Jason, 2004). Isoterm
Freundlich menggambarkan hubungan antara sejumlah komponen yang
teradsorpsi per unit adsorben dan konsentrasi komponen tersebut pada
kesetimbangan. Freundlich memformulasikan persamaan isotermnya sebagai
berikut :
Apabila dilogaritmakan, persamaan akan menjadi :
Keterangan :
x/m = jumlah adsorbat teradsorpsi perunit massa adsorben (mg/g)
Isoterm Freundlich menganggap bahwa pada semua sisi permukan
adsorben akan terjadi proses adsorpsi di bawah kondisi yang diberikan. Isoterm
Freundlich tidak mampu memperkirakan adanya sisi-sisi pada permukaan yang
mampu mencegah adsorpsi pada saat kesetimbangan tercapai dan hanya ada
nomor atom 22-92 dan terletak pada periode III dan IV dalam sistem periodik
unsur kimia (Cotton dan Wilkinson,1986).
Logam berat adalah unsur-unsur yang umumnya digunakan dalam
industri, bersifat toksik bagi makhluk hidup dalam proses aerobik maupun
anaerobik. Berdasarkan sudut pandang toksikologi, logam berat ini dapat dibagi
dalam dua jenis yaitu logam berat esensial dan non esensial. Jenis pertama adalah
logam berat esensial, di mana keberadaannya dalam jumlah tertentu sangat
dibutuhkan oleh organisme hidup, namun dalam jumlah yang berlebihan dapat
menimbulkan efek racun. Contoh logam berat ini adalah Zn, Cu, Fe, Co, Mn dan
lain sebagainya. Sedangkan jenis kedua adalah logam berat tidak esensial atau
beracun, di mana keberadaannya dalam tubuh masih belum diketahui manfaatnya
atau bahkan dapat bersifat racun, seperti Hg, Cd, Pb, Cr dan lain-lain (Widowati
dkk., 2008).
Logam berat dapat menimbulkan efek gangguan terhadap kesehatan
manusia, tergantung pada bagian mana dari logam berat tersebut yang terikat
dalam tubuh serta besarnya dosis paparan. Efek toksik dari logam berat mampu
menghalangi kerja enzim sehingga mengganggu metabolisme tubuh,
menyebabkan alergi, bersifat mutagen, karsinogen bagi manusia ataupun hewan
(Widowati dkk., 2008).
2.4.1. Timbal (Pb)
Timbal atau plumbum dalam keseharian lebih dikenal dengan timah hitam
merupakan logam yang lunak dan tahan terhadap korosi atau karat sehingga
persenyawaannya dapat berada dalam badan perairan secara alamiah dan sebagai
dampak terhadap aktivitas manusia. Secara alamiah, Pb dapat masuk ke badan
perairan melalui pengkristalan Pb di udara dengan bantuan air hujan. Pb yang
masuk ke dalam badan perairan sebagai dampak aktivitas manusia diantaranya
adalah air buangan limbah dari industri yang berkaitan dengan Pb, misalnya dari
pertambangan bijih timah hitam dan buangan sisa industri baterai.
Senyawa Pb yang ada dalam badan perairan dapat ditemukan dalam
bentuk ion-ion divalent atau ion-ion tetravalen (Pb2+, Pb4+). Ion Pb tetravalen
mempunyai daya racun yang lebih tinggi bila dibandingkan dengan ion Pb
divalen. Timbal bersifat toksik bagi semua organisme hidup, bahkan juga sangat
berbahaya untuk manusia. Dalam badan perairan, konsentrasi Pb yang mencapai
188 mg/L dapat membunuh ikan-ikan. Keracunan timbal bersifat akut dan kronis.
Hal itu disebabkan senyawa-senyawa Pb dapat memberikan racun terhadap
banyak fungsi organ dan sistem saraf yang terdapat dalam tubuh (Palar, 1994).
Keracunan akut dapat terjadi jika Pb masuk ke dalam tubuh seseorang
melalui makanan atau menghirup gas Pb dalam waktu relatif pendek dengan dosis
atau kadar relatif tinggi. Pb bisa merusak jaringan saraf, fungsi ginjal, sistem
reproduksi, sistem endokrin dan jantung, serta gangguan pada otak sehingga anak
mengalami gangguan kecerdasan dan mental. Sedangkan paparan Pb secara kronis
bisa mengakibatkan kelelahan lesu, gangguan iritabilitas, kehilangan libido,
infertilitas pada laki-laki, gangguan menstruasi, depresi, sakit kepala, sulit
2.4.2. Kadmium (Cd)
Kadmium bersifat tahan panas sehingga sangat baik untuk campuran
pembuatan keramik. Kadmium merupakan logam yang sering digunakan dalam
lempengan elektroda, pengecatan, stabilizer dalam pabrik plastik dan baterai dan
sebagai campuran logam (alloy). Kadmium relatif aktif dalam lingkungan aquatik
dan garam-garamnya dapat larut dalam air.
Kadmium bersifat toksik bagi semua organisme hidup, bahkan juga sangat
berbahaya untuk manusia. Dalam badan perairan, kelarutan kadmium dalam
konsentrasi tertentu dapat membunuh biota perairan. Pada konsentrasi 200 µg/L
menyebabkan keracunan pada ikan (Greenberg dalam Nurhasni, 2002). Logam
kadmium juga mengalami proses biotransformasi dan bioakumulasi dalam
organisme hidup (tumbuhan, hewan dan manusia). Keracunan kadmium bersifat
akut dan kronis. Sistem tubuh yang dapat dirusaknya adalah ginjal, paru-paru,
kekurangan darah, kerapuhan tulang, mempengaruhi sistem reproduksi dan organ-
organnya serta logam kadmium diduga merupakan salah satu penyebab dari
timbulnya kanker pada manusia (Palar, 1994).
Keracunan akut muncul setelah 4-10 jam sejak penderita terpapar oleh Cd.
Keracunan Cd bisa menimbulkan penyakit paru-paru akut. Paparan Cd secara akut
dapat menyebabkan kehilangan nafsu makan, daya tahan tubuh lemah, kerusakan
hepar dan ginjal, kanker, sakit kepala, kedinginan hingga menggigil, nyeri otot
dan diare bahkan bisa menyebabkan kematian (Widowati dkk., 2008).
Kercunan kronis Cd bisa merusak sisitem fisiologis tubuh, antara lain
kerusakan sistem reproduksi, sistem saraf, bahkan dapat mengakibatkan
kerusakan tulang (Widowati dkk., 2008).
2.4.3. Kromium (Cr)
Berdasarkan pada sifat-sifat kimianya, logam Cr dalam persenyawaannya
mempunyai bilangan oksidasi +2, +3 dan +6. Sesuai dengan tingkat valensi yang
dimilikinya, logam atau ion-ion kromium yang telah membentuk senyawa,
mempunyai sifat-sifat yang berbeda-beda sesuai dengan tingkat ionitasnya.
Senyawa yang terbentuk dari ion logam Cr(II) akan bersifat basa, senyawa yang
terbentuk dari ion logam Cr(III) bersifat amfoter dan senyawa yang terbentuk dari
ion Cr (VI) akan bersifat asam (Palar, 2004).
Kromium banyak digunakan oleh bidang perindustrian. Kegunaan umum
yang dikenal dari senyawa-senyawa kromat dan dikromat ini adalah dalam
bidang-bidang seperti tekstil, penyamakan, pencelupan, fotografi, zat warna dan
masih banyak lagi kegunaan lainnya.
Dalam badan perairan Cr dapat masuk melalui dua cara, yaitu secara
alamiah dan non alamiah. Masuknya Cr secara alamiah dapat terjadi disebabkan
oleh beberapa faktor fisika, seperti erosi (pengikisan) yang terjadi pada batuan
mineral. Disamping itu debu-debu dan partikel-partikel Cr yang di udara akan
dibawa oleh air hujan. Masukkan Cr yang terjadi secara non alamiah lebih
merupakan dampak atau efek dari aktivitas yang dilakukan manusia. Sumber-
sumber Cr yang berkaitan dengan aktivitas manusia dapat berupa limbah atau
buangan industri sampai buangan rumah tangga. Dalam badan perairan, terjadi
reaksi redoks. Proses kimia tersebut juga terjadi pada logam kromium yang ada di
perairan. Proses kimia seperti pengompleksan dan sistem reaksi redoks, dapat
mengakibatkan terjadinya pengendapan atau sedimentasi logam Cr di dasar
perairan. Proses-proses kimiawi yang berlangsung dalam badan perairan juga
dapat mengakibatkan terjadinya peristiwa reduksi senyawa-senyawa Cr(VI) yang
sangat beracun menjadi Cr(III) yang kurang beracun. Peristiwa reduksi yang
terjadi atas senyawa Cr(VI) dan Cr(III), dapat berlangsung bila badan perairan
berada dan atau mempunyai lingkungan yang bersifat asam. Untuk perairan yang
berlingkungan basa, ion-ion Cr(III) akan diendapkan di dasar perairan (Palar,
2004).
Daya racun yag dimiliki oleh logam Cr di tentukan oleh valensi ion-nya.
Ion Cr(VI) merupakan bentuk logam Cr yang paling dipelajari sifat racunnya, bila
dibandingkan dengan ion-ion Cr(II) dan Cr(III). Sifat racun yang dibawa oleh
logam ini juga dapat mengakibatkan terjadinya keracunan akut dan keracunan
kronis.
Keracunan akut dapat mengakibatkan kanker pada alat pencernaan, iritasi
mata dan kulit, kanker paru-paru, pembengkakan dan kemerahan pada kulit.
Keracunan kronis akibat terpapar Cr antara lain dapat menyebabkan gangguan alat
pernafasan, bronkitis, penurunan fungsi paru-paru, asma, gangguan pada hati,
2.4.4. Tembaga (Cu)
Unsur tembaga di alam, dapat ditemukan dalam bentuk logam bebas, akan
tetapi lebih banyak ditemukan dalan bentuk persenyawaan atau sebagai senyawa
padat dalam bentuk mineral.
Secara kimia, senyawa-senyawa dibentuk oleh logam Cu (tembaga)
mempunyai bilangan valensi +1 dan +2. Berdasarkan pada bilangan valensi yang
dibawanya logam Cu dinamakan juga cuppro untuk yang bervalensi +1 dan
cuppry untuk yang bervalensi +2. Kedua jenis ion Cu tersebut dapat membentuk
kompleks ion yang sangat stabil seperti Cu(NH3)6Cl2. Logam Cu dan beberapa
bentuk persenyawaannya seperti CuO, CuCO3, Cu(OH)2 dan Cu(CN)2 tidak dapat
larut dalam air dingin atau panas, tetapi mereka dapat dilarutkan dalam asam
seperti H2SO4 dalam larutan basa NH4OH.
Logam Cu merupakan jenis logam penghantar listrik terbaik setelah perak,
karena itu banyak digunakan dalam bidang elektronika atau perlistrikan. Cu juga
dapat membentuk alloy dengan berbagai macam logam lainnya seperti dengan
seng, timah atau timbal (Cu-Zn-Sn-Pb) dalam bentuk kuningan yang banyak
digunakan dalam peralatan rumah tangga. Senyawa Cu banyak digunakan dalam
industri cat sebagai antifoling, industri insektisida dan fungisida, sebagai katalis,
baterai, elektroda, penarik sulfur dan sebagai pigmen serta pencegah pertumbuhan
lumut.
Secara alamiah, Cu masuk ke dalam badan perairan sebagai akibat dari
peristiwa erosi atau pengikisan batuan mineral dan melalui persenyawaan Cu di
atmosfer yang dibawa oleh air hujan, serta berasal dari buangan industri,
peningkatan kelarutan Cu dalam badan perairan. Dalam kondisi normal,
keberadaan Cu dalam perairan ditemukan dalam bentuk senyawa CuCO3,
Cu(OH)2 dan lain-lain. Bila dalam badan perairan terjadi peningkatan kelarutan
Cu melebihi ambang batas yang seharusnya, maka akan terjadi peristiwa
biomagnifikasi terhadap biota-biota perairan.
Tembaga bersifat toksik bagi organisme. Bentuk tembaga yang paling
beracun adalah debu-debu Cu yang dapat mengakibatkan kematian pada dosis
3,5mg/kg. Pada manusia efek keracunan utama yang ditimbulkan akibat terpapar
oleh debu atau uap logam Cu adalah terjadinya gangguan pada jalur pernafasan
sebelah atas dan terjadinya kerusakan atropik pada selaput lendir yang
berhubungan dengan hidung (Palar, 2004).
2.5. Tanaman Tebu
Tanaman tebu atau Saccharum officinarum termasuk dalam famili
Graminease atau kelompok rumput-rumputan. Tanaman ini hanya dapat tumbuh di daerah beriklim udara sedang sampai panas. Tebu cocok pada daerah yang
mempunyai ketinggian tanah 1 sampai 1300 meter di atas permukaan air laut.
Umur tanaman sejak ditanam sampai bisa dipanen mencapai kurang lebih 1 tahun.
Di Indonesia tebu banyak dibudidayakan di pulau Jawa dan Sumatra.
Secara morfologi, tanaman tebu dapat dibagi menjadi empat bagian, yaitu
batang, daun, akar dan bunga. Batang tebu memiliki sosok tinggi kurus, tidak
bercabang dan tumbuh tegak dan terdiri dari banyak ruas yang setiap ruasnya
dibatasi oleh buku-buku sebagai tempat duduknya daun. Tinggi batang tanaman
berwarna hijau, kuning, ungu, merah tua atau kombinasi dari warna-warna
tersebut. Batang tanaman tebu memiliki ruas-ruas yang panjangnya masing-
masing 10-30 cm. Bentuk daun tebu berwujud helaian dengan pelepah. Panjang
daun dapat mencapai 1-2 meter dan lebar 4-8 centimeter dengan permukaan kasar
dan berbulu. Bunga tebu berupa bunga majemuk yang berbentuk terurai di puncak
sebuah poros gelagah. Sedangkan akarnya berbentuk serabut (Anonim, 2002).
Kadar berat setiap komponen kimia penyusun batang tebu tidak tepat,
tergantung pada jenis tebu, kandungan hara dan cara pemeliharaan tebu. Kadar
komponen penyusun batang tebu antara lain sukrosa (dalam nira), monosakarida,
zat anorganik, zat organik, air nira dan serat (Subrata, 1993).
Apabila tebu dipotong, maka akan terlihat serat-serat dan didapatkan
cairan yang manis. Kandungan serat dan kulit yang biasanya disebut sabut
umumnya sekitar 12,5% dari bobot tebu keseluruhan. Sedangkan kandungan
terbesar dari tebu adalah cairan nira yang prosentasenya sebesar 87,5 % yang
terdiri atas air dan bahan kering. Bahan kering tersebut ada yang terlarut dan ada
yang tidak terlarut.
(a) (b)
Tebu dari perkebunan diolah menjadi gula di pabrik gula. Dalam proses
produksi gula, dari setiap tebu yang diproses dihasilkan ampas tebu sebesar 90 %,
gula yang dimanfaatkan hanya 5 % dan sisanya berupa tetes tebu (molases) dan air (Witono, 2003).
2.5.1. Ampas Tebu
Ampas tebu atau lazimnya disebut bagas, merupakan limbah yang
dihasilkan dari proses pemerahan atau ekstraksi batang tebu. Dalam satu kali
proses ekstraksi dihasilkan ampas tebu sekitar 35 – 40 % dari berat tebu yang
digiling secara keseluruhan. Dari sekian banyak ampas tebu yang dihasilkan, baru
sekitar 50 % yang sudah dimanfaatkan misalnya sebagai bahan bakar dalam
proses produksi dan transportasi tebu dari lahan pertanian ke tempat pemerahan.
Namun selebihnya masih menjadi limbah yang perlu penanganan lebih serius
untuk diolah kembali. Di samping itu, ampas tebu dijual untuk dimanfaatkan
sebagai tambahan bahan baku pembuatan kertas (Birowo, 1992).
Ampas tebu umumnya digunakan sebagai bahan bakar utuk
menghasilkan energi yang diperlukan pada pembuatan gula. Selain itu, ampas
tebu dapat juga digunakan sebagai pakan ternak, bahan baku serat, papan plastik,
dan kertas (Witono, 2003). Kaur et al., (2008) mengemukakan bahwa ampas tebu tanpa diarangkan dapat dimanfaatkan sebagai adsorben ion logam berat seperti
seng, kadmium, tembaga dan timbal dengan efisiensi berturut-turut sebesar 90, 70,
55 dan 80 %.
Ampas tebu memiliki sifat fisik yaitu bewarna kekuning-kuningan,
penyimpanan dalam jumlah berat tertentu dibandingkan dengan penyimpanan
dalam bentuk arang dengan jumlah yang sama. Ampas tebu yang dihasilkan dari
tanaman tebu tersusun atas penyusun-penyusunnya antara lain air (kadar air
44,5%), serat yang berupa zat padat (kadar serat 52,0 %) dan brix yaitu zat padat
yang dapat larut, termasuk gula yang larut (3,5 %).
Secara kimiawi, komponen utama penyusun ampas tebu adalah serat yang
didalamnya terkandung selulosa, poliosa seperti hemiselulosa dan lignin. Susunan
ketiga komponen tersebut dalam ampas tebu hampir sama dengan susunan yang
ada dalam tanaman monokotil berkayu lunak.
Tabel 1. Komponen Penyusun Serat Ampas Tebu
Komponen Kandungan(%)
Selulosa Pentosan Lignin Komponen Lainnya
45 32 18 5 Sumber : material handbook thirteenth edition, 1991
2.6. Spektroskopi Serapan Atom (SSA)
Pada tahun 1860 Kirchoff dan Bunsen menyatakan bahwa spektrum atom,
baik spektrum emisi maupun spektrum absorpsi dapat digunakan sebagai dasar
teknik analisis unsur selektif. Peristiwa serapan atom pertama kali diamati oleh
Fraunhofer, ketika menelaah garis-garis hitam pada spektrum matahari.
Sedangkan yang memanfaatkan prinsip serapan atom pada bidang analisis adalah
seorang Australia bernama Alan Walsh pada tahun 1955 (Khopkar, 2003).
Spektroskopi serapan atom (SSA) merupakan metode yang memanfaatkan
fenomena penyerapan energi sinar oleh atom netral dalam bentuk gas sebagai
rendah. Atom-atom bebas bisa dihasilkan dengan cara menyemprotkan sampel
yang berupa larutan atau suspensi ke dalam nyala. Besarnya kepekatan analit
ditentukan dari besarnya penyerapan berkas sinar garis resonansi yang melewati
nyala.
Cara analisis ini selain atomisasi dengan nyala dapat pula dilakukan
dengan tanpa nyala (flameless atomizer), yaitu dengan menggunakan energi listrik dengan batang karbon (CRA = Carbon Rod Atomizer) atau bahkan dengan uapnya
saja seperti pada analisis merkuri.
Dalam Spektrofotometer Serapan Atom (SSA) dengan nyala, biasanya
terdapat empat jenis nyala yang digunakan sebagai bahan bakar pada SSA, yaitu:
1. Acetylene – udara, campuran ini paling banyak digunakan dalam SSA
(= 35 unsur). Suhu yang dihasilkan oleh campuran ini adalah sekitar 2300-
2400 oC dengan burning velocity
± 160 cm/det.
2. Nitrous oksida – acetylene, campuran ini dapat menghasilkan nyala
dengan panas ± 3200 oC, tetapi burning velocyty nya cukup besar yaitu
± 220 cm. det.
3. Udara – hidrogen
4. Argon – udara – hidrogen (Suryana, 2001).
2.6.1. Prinsip Spektroskopi Serapan Atom (SSA)
Metode SSA berprinsip pada absorpsi cahaya oleh atom. Atom-atom
menyerap cahaya tersebut pada panjang gelombang tertentu, tergantung sifat
unsurnya. SSA adalah cara analitis yang berdasarkan pada proses penyerapan
tingkat energi yang lebih tinggi. Jika pada sejumlah populasi atom yang berada
pada tingkat energi dasar (Eo) dberikan seberkas radiasi gelombang
elektromagnetik dengan tingkat energi tertentu (sesuai dengan besarnya energi
untuk menaikkan tingkat energi atom dari Eo E1) maka sebagian dari energi
radiasi akan diserap oleh atom dan tingkat energi atom naik dari Eo E1.
Energi radiasi gelombang elektromagnetik yang tidak mengalami
penyerapan akan keluar dari populasi atom dan intensitasnya berkurang sesuai
dengan jumlah atom yang mengalami perpindahan tingkat energi. Dengan
demikian, pengurangan intensitas radiasi pada panjang gelombang yang sesuai
dapat diukur dan besarnya sebanding dengan populasi atom yang menyerap
radiasi tersebut. Dengan mengukur jumlah energi yang diserap, maka dapat
menentukan konsentrasi atom elemen yang diuji dalam contoh (Suryana, 2001).
Pengisapan Penguapan Disosiasi
M+ X- M+ X- MX MX M (gas) + X(gas)
Larutan Kabut Padatan Gas
M*(gas) Eksitasi
Ex Termal
Emisi hv
nyala
Gambar 4. Skema Prinsip dari SSA
Penyerapan energi oleh sekumpulan populasi atom netral yang
menyebabkan berkurangnya intensitas radiasi. Berkurangnya intensitas radiasi ini
sebanding dengan jumlah atom yang menyerap energi radiasi tersebut. Energi
yang diserap berbanding lurus dengan energi yang diperlukan untuk eksitasi atom.
A = -log Ic/Io = Kv.d.c
Dimana :
A = Absorbansi
Io = Intensitas cahaya awal (erg/detik)
It = Intensitas cahaya setelah sebagian diabsorpsi oleh contoh (erg/detik)
Kv = Absortivitas molar-konstan (mol/L.cm)
d = Tebal media (cm)
c = Konsentrasi atom analit dalam contoh (mol/L)
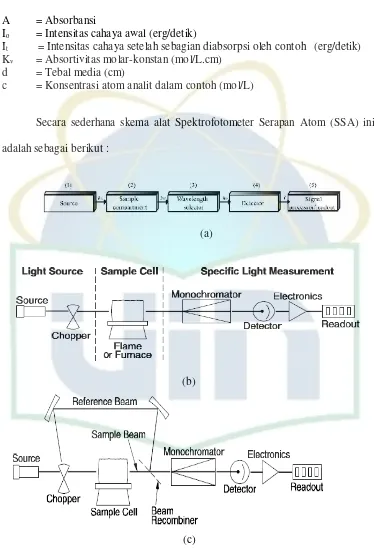
Secara sederhana skema alat Spektrofotometer Serapan Atom (SSA) ini
adalah sebagai berikut :
(a)
(b)
(c)
1. Sumber Cahaya
Sumber cahaya yang banyak digunakan adalah lampu katoda berongga,
tabung yang bermuatan gas sumber radiasi yang baik adalah sumber radiasi yang
memenuhi syarat-syarat sebagai berikut :
1. Memancarkan intensitas sinar dengan pita radiasi yang sempit.
2. Tidak mengabsorbsi sendiri.
3. Tidak ada background yang kontinyu.
Gambar 6. Lampu katoda
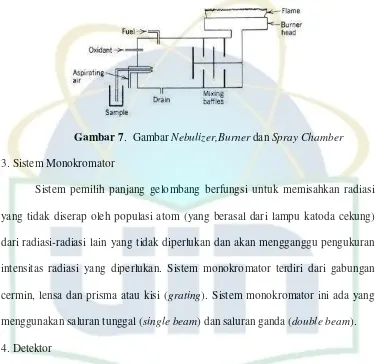
2. Sistem Atomisasi
Sistem pengatoman dengan nyala terdiri dari pembakar (burner), pengabut (nebulizer) dan pengatur aliran gas serta kapiler. Sedangkan sistem pengatoman
tanpa nyala yaitu pemanasan secara listrik oleh batang karbon dengan tahapan
pengeringan (drying), pengabuan (ashing) dan pengatoman (atomizing).
Sistem pengatoman dengan nyala berfungsi untuk mengubah populasi
unsur dalam larutan menjadi populasi atom dimana akan dilakukan pengukuran
absorbsi. Proses yang terjadi dalam atomisasi secara umum adalah :
1. Nebulasi yaitu pengubahan cairan ke dalam bentuk kabut aerosol
2. Pemisahan titik-titik kabut dengan sebaran ukuran yang benar
3. Pencampuran kabut dengan gas memasukannya ke dalam burner
Gas (biasanya oksigen untuk pembakar) dialirkan ke dalam spray chamber
melalui venturi akibatnya cairan sampel terisap ke atas dan dialirkan ke dalam
halus terus masuk ke dalam pembakar, diameter dari partikel-partikel biasanya
lebih kecil dari 2 µm. Pada bagian spray chamber kabut sampel dicampur dengan
bahan bakar kemudian dimasukkan ke dalam pembakar. Campuran bahan bakar
dan oksigen harus diperhatikan dan disesuaikan dengan unsur yang dipakai.
Gambar 7. Gambar Nebulizer,Burner dan Spray Chamber 3. Sistem Monokromator
Sistem pemilih panjang gelombang berfungsi untuk memisahkan radiasi
yang tidak diserap oleh populasi atom (yang berasal dari lampu katoda cekung)
dari radiasi-radiasi lain yang tidak diperlukan dan akan mengganggu pengukuran
intensitas radiasi yang diperlukan. Sistem monokromator terdiri dari gabungan
cermin, lensa dan prisma atau kisi (grating). Sistem monokromator ini ada yang menggunakan saluran tunggal (single beam) dan saluran ganda (double beam).
4. Detektor
Detektor pada SSA berfungsi untuk mengubah intensitas radiasi menjadi
arus atau sinyal listrik. Keluaran dari detektor diumpankan ke suatu sistem
pencatat yang sesuai. Alat pencatat ini digunakan untuk mengubah dan mencatat
sinyal-sinyal listrik yang berasal dari suatu detektor ke suatu bentuk yang mudah
dibaca oleh operator, misalnya dalam bentuk angka-angka digital sesuai dengan
tube. Photomultiplier tube menghasilkan sinyal listrik sebanding dengan intensitas cahaya pada panjang gelombang yang telah dipisahkan oleh monokromator.
5. Sistem Pengolahan
Berfungsi untuk mengolah kuat arus yang dihasilkan oleh detektor
menjadi besaran daya serap atom transmisi yang selanjutnya diubah menjadi
besaran konsentrasi.
6. Pencatat (rekorder)
Berfungsi untuk mencatat hasil yang dikeluarkan oleh sistem pengolahan.
Keuntungan metode SSA adalah sebagai berikut :
a. Dari satu larutan yang sama, beberapa unsur yang berlainan dapat diukur.
b. Pengukuran dapat langsung dilakukan terhadap larutan contoh, jadi
berbeda dengan kolorimetri (yang membutuhkan pembentukan senyawa
berwarna), gravimetrik (endapan perlu dikeringkan terlebih dahulu), dan
sebagainya, preparasi contoh sebelum pengukuran cukup sederhana.
c. Output data (absorban) dapat langsung dibaca.
BAB III
METODE PENELITIAN
3.1. Waktu dan Tempat Penelitian
Penelitian ini dilakukan selama tiga bulan yang dilaksanakan dari bulan
Juli-September 2009. Tempat pelaksanaan penelitian ini adalah di Laboratorium
Penelitian Kimia, Pusat Laboratorium Terpadu (PLT) Universitas Islam Negeri
Syarif Hidayatullah Jakarta, dengan alamat di jalan Ir. H. Juanda No. 95, Ciputat,
15412.
3.2. Alat dan Bahan
3.2.1. Alat
Alat yang digunakan dalam penelitian ini adalah spektrofotometri serapan
atom Analyst 700 Perkin Elmer(SSA), shaking incubation (Heidolph Inkubator
1000), ayakan dengan ukuran partikel 212 m Retsch, timbangan analitik, pH
meter, furnace, kertas saring whatman, blender, gelas beker, erlenmeyer, labu ukur, pipet ukur, pipet volum dan corong gelas.
3.2.2. Bahan
Bahan yang digunakan dalam penelitian ini adalah ampas tebu (diambil
dari penjual minuman sari tebu di daerah Bintaro Regensi Tangerang) yang sudah
diberikan perlakuan sebelumnya, larutan simulasi limbah Pb(NO3)2, CdSO4.8H2O,
K2Cr2O7, CuSO4.5H2O, HNO3 0,1 N, HNO3 1 %, NaOH 10 %, aquadest, air
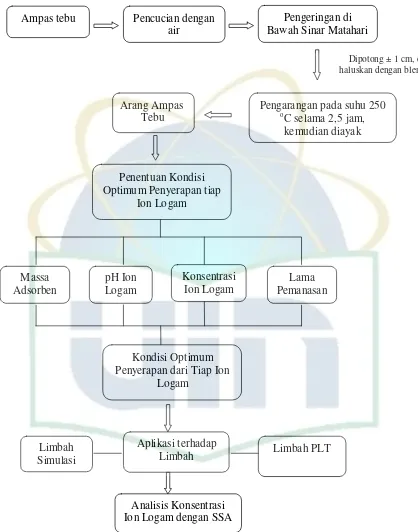
3.3. Rancangan Penelitian
Ampas tebu Pencucian dengan
air
Pengeringan di Bawah Sinar Matahari
Dipotong ± 1 cm, di haluskan dengan blender
Arang Ampas
Tebu Pengarangan pada suhu 250 oC selama 2,5 jam,
kemudian diayak
Penentuan Kondisi Optimum Penyerapan tiap
Ion Logam
Massa
Adsorben pH Ion Logam
Konsentrasi
Ion Logam Pemanasan Lama
Kondisi Optimum Penyerapan dari Tiap Ion
Logam
Limbah Simulasi
Aplikasi terhadap
Limbah Limbah PLT
Analisis Konsentrasi Ion Logam dengan SSA
3.4. Prosedur Kerja
Penelitian ini dilaksanakan dalam tiga tahap. Pertama adalah pembuatan
adsorben dari arang ampas tebu. Kedua adalah penentuan kondisi optimum
penyerapan ion logam Cd, Cr, Cu, dan Pb oleh arang ampas tebu dengan variasi
massa arang ampas tebu, pH ion logam, konsentrasi larutan ion logam dan lama
pemanasan. Ketiga, setelah diketahui kondisi optimum dari masing-masing logam
yang akan di analisis, kemudian penggunaan arang ampas tebu tersebut
diaplikasikan ke dalam limbah, yaitu limbah simulasi dan limbah laboratorium.
Konsentrasi dari masing-masing ion logam dianalisis menggunakan Spektroskopi
Serapan Atom (SSA). Bagan alir penelitian ini ditunjukkan secara sistematis pada
Gambar 8.
3.4.1. Pembuatan Arang Ampas Tebu
Ampas tebu dicuci bersih dengan air yang mengalir, setelah itu
dikeringanginkan selama 1 minggu kemudian dipotong-potong dengan ukuran ± 1
cm, dihaluskan dengan blender, kemudian diarangkan pada suhu 250 oC hingga
menjadi serbuk arang selama 2,5 jam. Setelah itu, diayak dengan pengayak
menjadi ukuran partikel 212 m.
3.4.2. Preparasi Limbah Simulasi
Dibuat larutan campuran dari Pb(NO3)2, CdSO4.8H2O, K2Cr2O7, dan
CuSO4.5H2O masing-masing dengan konsentrasi 100 mg/L yang disiapkan secara
3.4.3. Penentuan Kondisi Optimum
1. Penentuan Pengaruh Massa Arang Ampas Tebu terhadap Penyerapan Ion Logam Cd, Cr (VI), Cu dan Pb
Adsorben dengan ukuran partikel 212 m ditimbang masing-masing
dengan massa 0,5 ; 1 dan 1,5 gram, dimasukkan masing-masingnya ke dalam
erlenmeyer. Kemudian dimasukkan 10 mL larutan ion logam dengan konsentrasi
20 mg/L ke dalam erlenmeyer. Erlenmeyer diletakkan pada shaker incubation
dengan kecepatan pengadukan 180 rpm pada temperatur ruang (26 oC) selama 30
menit. Setelah itu campuran dipisahkan dengan cara disaring dengan
menggunakan kertas saring. Filtrat hasil saringan di tempatkan pada vial dan
ditepatkan volumenya 10 mL dengan akuades dan ditambah 1 tetes asam nitrat p.a
sebagai bahan pengawet agar tidak terjadi perubahan-perubahan pada komposisi
larutan dan selanjutnya konsentrasi ion logam diukur dengan SSA.
2. Penentuan Pengaruh pH Larutan Ion Logam
Adsorben dengan ukuran partikel 212 m ditimbang masing-masing
dengan massa 0,5 gram, dimasukkan masing-masingnya ke dalam erlenmeyer
dengan larutan pH-nya samadengan pH larutan ion yang akan dimasukkan. pH
dipertahankan dengan menggunakan larutan buffer pH 3, 4, 5, 6 dan 7 dengan
perbandingan 10 : 1 (10 mL larutan ion logam : 1 mL larutan buffer). Dimasukkan
10 mL larutan ion logam dengan konsentrasi optimum dengan variasi pH 3, 4, 5, 6
dan 7 ke dalam erlenmeyer. Erlenmeyer diletakkan pada shaker dengan kecepatan
pengadukan 150-200 rpm pada temperatur ruang. Setelah itu campuran dipisahkan
dengan cara disaring dengan menggunakan kertas saring. Filtrat hasil saringan di
dengan pH masing-masing larutan, ditambah 1 tetes asam nitrat p.a sebagai bahan
pengawet agar tidak terjadi perubahan-perubahan pada komposisi larutan dan
selanjutnya konsentrasi ion logam diukur dengan SSA.
3. Penentuan Pengaruh Konsentrasi Larutan Ion logam
Adsorben dengan ukuran partikel 212 m ditimbang masing-masing
dengan massa 0,5 gram, dimasukkan masing-masingnya ke dalam erlenmeyer.
Dimasukkan 10 mL larutan ion logam dengan variasi konsentrasi 20, 40, 60, 80
dan 100 mg/L ke dalam erlenmeyer. Erlenmeyer diletakkan pada shaker dengan kecepatan pengadukan 180 rpm pada temperatur ruang (26 oC) selama 30 menit.
Setelah itu campuran dipisahkan dengan cara disaring dengan menggunakan
kertas saring. Filtrat hasil saringan di tempatkan pada vial dan ditepatkan
volumenya 10 mL dengan akuades pH optimum, ditambah 1 tetes asam nitrat p.a
sebagai bahan pengawet agar tidak terjadi perubahan-perubahan pada komposisi
larutan dan selanjutnya konsentrasi ion logam diukur dengan SSA.
4. Penentuan Pengaruh Lama Pemanasan
Adsorben dengan ukuran partikel 212 m masing-masing ditimbang
dengan massa 0,5 gram, lalu dipanaskan pada suhu 250 oC dengan variasi lama
pemanasan 1,5; 2; 2,5 dan 3 jam. Dimasukkan 10 mL larutan ion logam dengan
konsentrasi optimum, pH optimum ke dalam erlenmeyer yang telah berisi
adsorben. Erlenmeyer diletakkan pada shaker dengan kecepatan pengadukan 180
rpm pada temperatur ruang (26 oC) selama 30 menit. Setelah itu campuran
saringan di tempatkan pada vial dan ditepatkan volumenya 10 mL dengan akuades
pH optimum, ditambah 1 tetes asam nitrat p.a sebagai bahan pengawet agar tidak
terjadi perubahan-perubahan pada komposisi larutan dan selanjutnya konsentrasi
ion logam diukur dengan SSA.
3.4.4. Penentuan Isoterm Adsorpsi
Sebanyak 0,5 g adsorben arang ampas tebu dimasukkan dalam 10 mL
larutan ion tunggal Cd, Cr, Cu dan Pb pada beberapa konsentrasi, yaitu 20, 40, 60,
80 dan 100 mg/L ke dalam erlenmeyer. Kemudian di di shaker selama 30 menit
dengan kecepatan 180 rpm pada temperatur ruang. Campuran disaring dengan
menggunakan kertas saring. Filtrat hasil saringan di tempatkan pada vial dan
ditepatkan volumenya 10 mL dengan akuades pH optimum, ditambah 1 tetes asam
nitrat p.a sebagai bahan pengawet agar tidak terjadi perubahan-perubahan pada
komposisi larutan dan selanjutnya konsentrasi ion logam diukur dengan SSA.
3.4.5. Aplikasi Penggunan Arang Ampas Tebu pada Limbah Simulasi
Dengan menggunakan kondisi optimum yang diperoleh (massa adsorben
dan lama pemanasan), arang ampas tebu dimasukkan ke dalam erlenmeyer
kemudian ditambahkan 10 mL larutan limbah simulasi (konsentrasi 100 mg/L dan
pH optimum). Erlenmeyer diletakkan pada shaker dengan kecepatan pengadukan
180 rpm pada temperatur ruang (26 oC) selama 30 menit. Campuran dipisahkan
disaring dengan menggunakan kertas saring. Filtrat di tempatkan pada vial dan
nitrat p.a sebagai bahan pengawet agar tidak terjadi perubahan-perubahan pada
komposisi larutan dan konsentrasi ion logam diukur dengan SSA.
3.4.6. Aplikasi Penggunaan Arang Ampas Tebu pada Limbah Laboratorium
Air limbah Laboratorium Kimia Pusat Laboratorium Terpadu UIN Syarif
Hidayatullah Jakarta diambil, kemudian disaring untuk memisahkan larutan dari
padatan yang tidak larut. Setelah itu diukur konsentrasi awal dari ion logam Cd,
Cr, Cu dan Pb sebelum dilakukan adsorpsi menggunakan arang ampas tebu.
Kemudian limbah yang telah diukur konsentrasi ion logam awal, diatur pH-nya
sesuai dengan pH optimum.
Dengan menggunakan kondisi optimum yang diperoleh, arang ampas tebu
dimasukkan dalam erlenmeyer, ditambahkan 10 mL air limbah. Diletakkan pada
shaker dengan kecepatan pengadukan 180 rpm pada temperatur ruang (26 oC) selama 30 menit. Campuran disaring dengan menggunakan kertas saring. Filtrat di
tempatkan pada vial dan ditepatkan volumenya 10 mL dengan akuades pH
optimum, ditambah 1 tetes asam nitrat p.a sebagai bahan pengawet agar tidak
terjadi perubahan-perubahan pada komposisi larutan dan konsentrasi ion logam
BAB IV
HASIL DAN PEMBAHASAN
4.1. Pengaruh Massa Arang Ampas Tebu
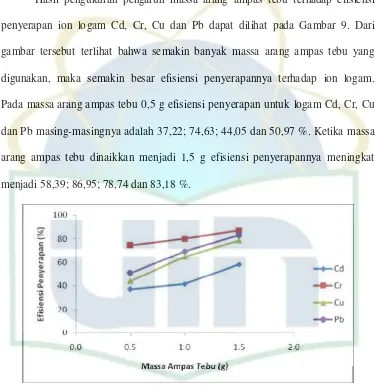
Hasil pengukuran pengaruh massa arang ampas tebu terhadap efisiensi
penyerapan ion logam Cd, Cr, Cu dan Pb dapat dilihat pada Gambar 9. Dari
gambar tersebut terlihat bahwa semakin banyak massa arang ampas tebu yang
digunakan, maka semakin besar efisiensi penyerapannya terhadap ion logam.
Pada massa arang ampas tebu 0,5 g efisiensi penyerapan untuk logam Cd, Cr, Cu
dan Pb masing-masingnya adalah 37,22; 74,63; 44,05 dan 50,97 %. Ketika massa
arang ampas tebu dinaikkan menjadi 1,5 g efisiensi penyerapannya meningkat
menjadi 58,39; 86,95; 78,74 dan 83,18 %.
Gambar 9. Pengaruh Massa Arang Ampas Tebu terhadap Penyerapan Ion
Logam Cd (II), Cr (VI), Cu(II) dan Pb(II) (volume 10mL, konsentrasi 20 mg/L dan lama pemanasan 2,5 jam)
Bertambahnya massa arang ampas tebu sebanding dengan bertambahnya
bertambahnya sisi aktif adsorpsi dan efisiensi penyerapannya pun meningkat
sedangkan kapasitas penyerapannya menurun dengan bertambahnya massa
adsorben (Lampiran 1). Hal ini diperkuat oleh Barros et al., (2003) yang menyatakan bahwa pada saat ada peningkatan massa adsorben, maka ada
peningkatan presentase efisiensi penyerapan dan penurunan kapasitas penyerapan.
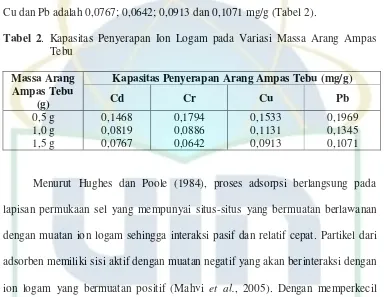
Kapasitas penyerapan pada massa arang ampas tebu 1,5 g pada ion logam Cd, Cr,
Cu dan Pb adalah 0,0767; 0,0642; 0,0913 dan 0,1071 mg/g (Tabel 2).
Tabel 2. Kapasitas Penyerapan Ion Logam pada Variasi Massa Arang Ampas
Tebu
Kapasitas Penyerapan Arang Ampas Tebu (mg/g) Massa Arang
Menurut Hughes dan Poole (1984), proses adsorpsi berlangsung pada
lapisan permukaan sel yang mempunyai situs-situs yang bermuatan berlawanan
dengan muatan ion logam sehingga interaksi pasif dan relatif cepat. Partikel dari
adsorben memiliki sisi aktif dengan muatan negatif yang akan berinteraksi dengan
ion logam yang bermuatan positif (Mahvi et al., 2005). Dengan memperkecil
ukuran partikel dari adsorben, maka semakin luas sisi permukaan sehingga
efisiensi penyerapan meningkat.
4.2. Pengaruh pH Larutan Ion Logam
Nilai pH merupakan salah satu parameter terpenting dalam proses adsorpsi