OLEH ISOLATAspergillusspp.1 DARI BAGAS Oleh
Zahra Wanda Asfarini
Bagas atau biasa dikenal dengan ampas tebu merupakan hasil samping dari batang tebu yang diekstraksi cairannya. Bagas mengandung senyawa-senyawa kompleks seperti selulosa, hemiselulosa, lignin, dan protein, sehingga berpotensi sebagai media pertumbuhan mikroba. Senyawa kompleks tersebut dapat diuraikan menjadi senyawa sederhana oleh mikroba. Salah satu mikroba yang mampu menguraikan senyawa kompleks yaitu fungi karena fungi dapat menghasilkan enzim ekstraseluler. Bahan peyusun enzim adalah protein. Salah satu sumber nutrisi yang diperlukan untuk sintesis enzim adalah nitrogen. Penambahan urea dalam media fermentasi bagas diharapkan dapat meningkatkan jumlah enzim ekstraseluler, sehingga meningkatkan degradasi bagas. Tujuan dari penelitian ini adalah untuk mengetahui pengaruh penambahan urea terhadap degradasi bagas oleh isolatAspergillusspp.1 yang diisolasi dari bagas.
Penelitian ini dilaksanakan di Laboratorium Mikrobiologi dan Biomolekuler Jurusan Biologi FMIPA Universitas Lampung, dimulai dari bulan Juni 2011 sampai Januari 2012. Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL). Parameter utama yaitu persentase pengurangan berat kering, sedangkan parameter pendukung yaitu aktivitasfilter paperase(FP-ase), dan degradasi berbagai substrat berdasarkan gula pereduksi yang dihasilkan. Perlakuan yang diberikan pada media fermentasi yaitu kadar urea sebesar 0% (w/v), 0,03% (w/v), 0,06% (w/v), 0,09% (w/v), dan 0,12% (w/v). Masing-masing dengan 3 kali ulangan. Data dianalisis ragam pada taraf 5%. Data yang
menunjukkan perbedaan nyata, diuji lanjut dengan uji polinomial orthogonal. Hasil penelitian menunjukkan bahwa penambahan urea memberikan pengaruh yang nyata terhadap persentase pengurangan berat kering bagas. Persentase pengurangan berat kering bagas tertinggi didapatkan pada kadar urea 0,12% (w/v) sebesar 5,74% dan persentase pengurangan berat kering bagas terendah yaitu sebesar 0,82% pada kadar urea 0% (w/v).
A. Latar Belakang
Seiring dengan berkembangnya kemajuan di bidang industri pertanian telah berdampak pada peningkatan limbah pertanian seperti bagas, jerami padi, jerami jagung, tongkol jagung, kulit pisang, dan lain sebagainya. Bagas atau ampas tebu merupakan salah satu limbah padat dalam industri gula yang terdiri dari kumpulan serat batang tebu yang telah diekstraksi cairannya (Sulistianingsih, 2006). Berdasarkan data yang diperoleh dari Pusat Penelitian Perkebunan Gula Indonesia (P3GI), di Indonesia bagas yang dihasilkan dari proses penggilingan tebu yaitu sebanyak 32% dari berat tebu giling. Pabrik gula sudah memanfaatkan 60% dari bagas tersebut sebagai bahan bakar pembangkit tenaga listrik, bahan baku industri kanvas rem, pembuatan kertas, serta media pertumbuhan jamur. Jadi, dapat
diperkirakan sebanyak 40% dari bagas tersebut belum dimanfaatkan (Husin, 2007).
lignoselulosa yang cukup tinggi bagas berpotensi digunakan sebagai media pertumbuhan mikroba atau pakan ternak melalui proses fermentasi (Jati, 2008 ; Meryandini dkk., 2009). Mikroba yang dapat tumbuh pada substrat lignoselulosa yaitu fungi dan bakteri. Fungi merupakan organisme
heterotrofik yang memerlukan senyawa organik untuk nutrisinya. Fungi dapat memanfaatkan subtrat yang ada di lingkungan dengan cara
mengeksresikan enzim-enzim ekstraseluler. Enzim ekstraseluler dapat menguraikan senyawa kompleks dari substrat menjadi senyawa yang lebih sederhana (Gandjar, 2006). Dengan kamampuannya dalam menghasilkan enzim tersebut, fungi dapat dimanfaatkan untuk menguraikan senyawa kompleks seperti selulosa, lignin, dan hemiselulosa yang terkandung pada bagas menjadi senyawa sederhana, sehingga dapat diserap oleh dinding sel (Cooke dan Rayner, 1984). Dari penelitian Arivo diketahui bahwa
Aspergillusyang diisolasi dari bagas memiliki aktivitas enzim selulase sebesar 0,002596 nkat, sedangkan aktivitas enzim xilanase tertinggi yaitu 3,082 U/ml (Melisa, 2010).
Kandungan protein dalam bagas sangat rendah yaitu 1,6% (w/w) Ensminger et al., 1990), maka diperlukan tambahan nitrogen dari senyawa lain.
Senyawa nitrogen yang ditambahkan dapat berupa urea. Berdasarkan penelitian yang telah dilakukan oleh Narashimha dkk (2006) urea
memecah bagas sebagai substrat, sehingga degradasi bagas berlangsung lebih cepat.
Dari uraian di atas maka perlu dilakukan penelitian tentang pengaruh penambahan urea terhadap degradasi bagas dengan isolatAspergillusspp.1 sebagai mikroba pendegradasinya.
B. Tujuan Penelitian
Mengetahui pengaruh penambahan urea terhadap degradasi bagas oleh isolat Aspergillusspp.1 dari bagas.
C. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai pengaruh penambahan urea terhadap degradasi bagas oleh isolatAspergillus spp.1, serta mengetahui potensi bagas sebagai media pertumbuhan fungi dan pakan ruminansia.
D. Kerangka Pemikiran
lain. Nitrogen merupakan salah sumber nutrisi yang dibutuhkan mikroba untuk membentuk enzim. Salah satu senyawa yang mengandung unsur nitrogen adalah urea(CO(NH2)2). Penambahan urea dalam media fermentasi bagas diharapkan dapat meningkatkan jumlah enzim ekstraseluler yang dihasilkan olehAspergillusspp.1sehingga degradasi bagas dapat berlangsung lebih cepat.
Selulosa tidak hanya terdapat pada bagas tetapi juga kertas saring. Kertas saring merupakan selulosa sintetik yang dibuat dari campuran selulosa bentuk amorf dan kristalin. Kertas saring dapat digunakan sebagai substrat untuk mengukur total aktivitas enzim selulase yang dikenal dengan nama filter paperase (FP-ase). Dengan melakukan pengukuran aktivitas FP-ase dapat diketahui aktivitas campuran enzim selulase yang menghidrolisis bahan yang mengandung selulosa dan menghasilkan produk akhir berupa gula pereduksi (glukosa).
E. Hipotesis
A. Degradasi
Degradasi adalah suatu reaksi perubahan kimia atau peruraian suatu
senyawa atau molekul menjadi senyawa atau molekul yang lebih sederhana (Yatim, 2007). Misalnya, penguraian polisakarida selulosa menjadi
monosakarida (glukosa). Degradasi polimer dasarnya berkaitan dengan terjadinya perubahan sifat karena ikatan rantai utama makromolekul. Pada polimer linear, reaksi tersebut mengurangi massa molekul atau panjang rantainya.
Faktor-faktor yang mempengaruhi degradasi antara lain : a. Substrat
b. Sumber nitrogen
Nitrogen diperlukan karena dapat mempengaruhi aktivitas fungi untuk menghasilkan enzim ekstraseluler. Bahan yang banyak digunakan sebagai sumber nitrogen adalah ammonium nitrat, ammonium sulfat, dan urea. Nilai aktivitas FP-ase yang dihasilkan olehA. nigerpada penambahan urea sebesar 0,03% (w/v) memberikan hasil yang optimal dibandingkan sumber nitrogen lainnya (pepton, NaNO3, dan ekstrak ragi) yakni sebesar 1,68 U/ml (Narashimha, 2006). Jika ezim ekstraseluler yang dihasilkan oleh fungi banyak, maka degradasi akan berlangsung lebih cepat. Sebaliknya, jika enzim ekstraseluler yang dihasilkan oleh fungi sedikit, maka degradasi akan berlangsung lebih lama.
c. pH
pH aktivitas enzim sangat penting untuk proses degradasi, karena enzim-enzim tertentu hanya akan mengurai suatu substrat sesuai dengan aktivitasnya pada pH tertentu. Umumnya fungi menyukai pH di bawah 7 (Gandjar, 2006). Hasil penelitian Indah (2012) pH optimum enzim selulase yang dihasilkan oleh isolat Aspergillus spp.1 yaitu 4. Jika pH sesuai dengan aktivitas enzim, maka kerja enzim ekstraseluler untuk mendegradasi substrat akan optimal.
d. Suhu
Namun suhu yang terlalu tinggi dapat menyebabkan rusaknya enzim yang disebut denaturasi, sedangkan suhu yang terlalu rendah dapat menghambat kerja enzim. Bila kerja terhambat atau struktur enzim rusak maka degradasi tidak dapat berlangsung dengan baik.
e. Kelembaban
Kelembaban merupakan faktor penting yang dapat mempengaruhi pertumbuhan fungi, biosintesis, dan sekresi enzim. Kelembaban yang rendah menyebabkan berkurangnya kelarutan nutrisi di dalam
substrat, derajat pertumbuhan rendah, dan tegangan air tinggi. Sedangkan level kelembaban yang lebih tinggi dapat menyebabkan berkurangnya enzim yang dihasilkan karena dapat mereduksi porositas (jarak interpartikel) pada matriks padatan, sehingga
menghalangi transfer oksigen (Alam dkk., 2005). Jika jumlah enzim berkurang, maka proses degradasi akan berlangsung lebih lama. Kelembaban yang optimal untuk pertumbuhanAspergillus niger adalah 85% (Maciel dkk., 2008).
B. Tinjauan Umum Fungi
diperkuat oleh khitin atau polisakarida lainnya dan tidak memiliki klorofil (Gandjar dkk., 1999 ; Moore-Landdecker, 1996).
Fungi bereproduksi dengan dua cara yaitu seksual (generatif) dan aseksual (vegetatif). Reproduksi aseksual dilakukan melalui pembelahan, tunas, dan pembentukan spora (Pelczar dan Chan, 2006). Reproduksi seksual pada fungi dapat disebabkan oleh fusi genetik dan dilanjutkan dengan
pembentukan spora melalui pembelahan meiosis (Rao,1994). Spora aseksual diproduksi pada ujung hifa sedangkan spora seksual diproduksi pada saat konjugasi hifa (Paul dan Clark, 1996).
Supaya reproduksi dan pertumbuhan fungi berlangsung dengan baik, fungi memerlukan substrat yang mengandung nutrisi sesuai untuk unsur
metabolisme tubuhnya (Prasetyani, 2007). Nutrisi yang digunakan untuk pertumbuhan fungi yaitu senyawa organik seperti glukosa, asam-asam organik, selulosa, lignin, pektin, disakarida dan polisakarida (Alexander, 1997). Fungi heterotrof menyerap molekul-molekul organik sederhana terlarut disekitarnya melalui dinding dan membrane sel. Fungi dapat menghasilkan enzim ekstraseluler yang berfungsi untuk melakukan
depolimerisasi (pemecahan polimer kompleks) untuk memeperoleh nutrisi terlarutnya (Campbellet al., 2000).
menguntungkan bagi bakteri (Volk dan Wheeler, 1993). Selain itu,
pertumbuhan fungi juga dipengaruh oleh musim, faktor biologi, temperatur, pH, topografi, dan subtrat organik disekitarnya. Umumnya pH optimum untuk pertumbuhan fungi adalah kurang dari 7. Temperatur berpengaruh dalam penentuan laju pertumbuhan suatu organisme. Peningkatan tempratur data meningkatkan aktivitas enzim dalam metabolisme tubuh suatu
organisme (Barnet dan Hunter, 1998).
C. Aspergillus
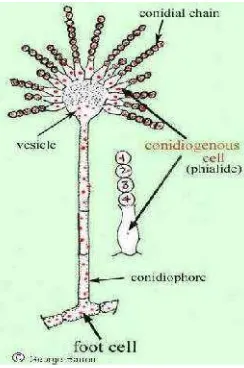
[image:10.595.265.387.542.726.2]Aspergilusmemiliki hifa septap, miselia bercabang (terdapat dibawah permukaan merupakan hifa vegetatif, sedangkan yang muncul di atas permukaan umumnya hifa fertil), koloni kompak konidiofora septap atau non septat, muncul darifoot cell, (sel miselium yang membengkak dan berdinding tebal); sterigmata atau fialid biasanya sederhana berwarna atau tidak berwarna, konidia membentuk rantai yang berwarna hijau coklat atau hitam dan beberapa spesies tumbuh pada suhu 37oC.
IsolatAspergillusspp.1 memiliki morfologi makroskopis sebagai berikut koloni berwarna putih terdiri dari kumpulan hifa setelah diinkubasi selama satu hari pada media PDA, berbentuk bundar dengan tepian menyebar, tepian seperti wol, dengan elevasi cembung. Pada inkubasi hari ketujuh, koloni berwarna cokelat dengan bentuk konsentris, tepian bercabang dengan elevasi datar. Ciri-ciri mikroskopisAspergillusspp.1 adalah hifa bersepta, berwarna cokelat muda, dan berbentuk spiral. Spora aseksual berbentuk konidia yang menjuntai. Panjang juntaian 10 atau lebih konidia. Konidia terbentuk di atas vesikula. Konidia berbentuk bulat, dan berwarna cokelat. Ukuran 5 µm. konidia di produksi berantai dan bercabang, anamorf. Konidiofor pembentukannya tunggal dan sederhana (Arivo, 2010).
Berdasarkan hasil identifikasi yang dilakukan oleh Arivo (2010) dengan menggunakan buku kunci identifikasi Barner dan Hunter (1998), klasifikasi isolatAspergillusspp.1 adalah sebagai berikut:
Kingdom : Fungi Divisi : Eumycota
Klasifikasi tersebut bersifat sementara karena siklus reproduksi seksual isolatAspergillusspp.1 belum diketahui. Jika reproduksi seksualnya sudah diketahui, maka dapat digolongkan ke dalam subdivisi Ascomycotina seperti spesiesA.niger. Pada ascomycotina reproduksi aseksual
menghasilkan konidia dan reproduksi seksualnya menghasilkan spora yang terbentuk dalam kantung yang disebut askospora (Campbellet al, 2000). Konidia dihasilkan pada ujung hifa, sedangkan askospora dihasilkan dari persatuan dua ini kompatibel dalam sel induk askus yang diikuti dengan meiosis dan mitosis sehingga terbentuk 2,4,8, atau lebih askospora yang masing–masing mengandung satu inti yang haploid (Tim Taksonomi Tumbuhan I, 2006).
D. Enzim Selulase
Menurut Poedjadi, (1994) enzim merupakan protein yang dihasilkan sel hidup berperan sebagai katalisator dalam proses biokimia (intrasel/ ekstrasel). Umumnya enzim memiliki karakteristik antara lain enzim memiliki spesifitas sangat tinggi terhadap substrat, dapat mempercepat reaksi kimia lebih cepat dibanding katalisator lainnya tanpa mengubah dirinya sendiri dan tidak menghasilkan produk samping. Enzim berperan di dalam sel untuk mengatur fungsi biologis organisme melalui proses
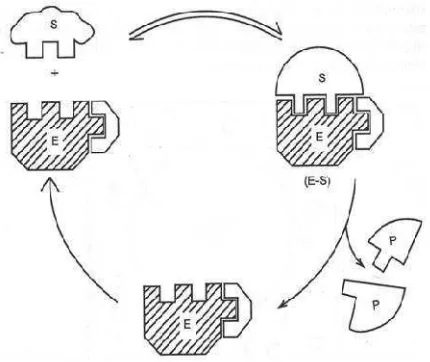
Prinsip kerja enzim berlangsung dalam dua tahap. Pada tahap pertama, enzim (E) bergabung dengan substrat (S) membentuk kompleks enzim substrat (E-S). tahap kedua, kompleks enzim-substrat terurai menjadi
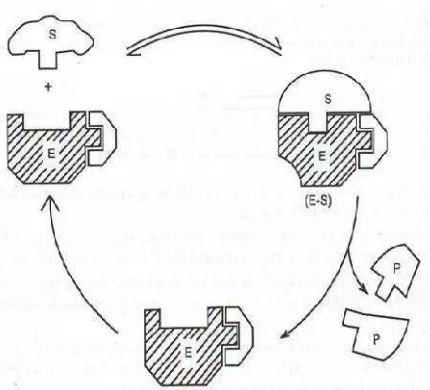
produk dan enzim bebas. Terdapat dua model yang diusulkan pada kegiatan enzim dalam mempengaruhi substrat sehingga diperoleh produk, yaitu model kunci dan anak kunci, dan modelinduced fit(Santoso, 2010).
[image:13.595.220.435.393.574.2]Pada model kunci dan anak kunci, substrat atau bagian substrat harus mempunyai bentuk yang sangat tepat dengan sisi katalitik enzim. Substrat ditarik oleh sisi katalitik enzim yang cocok untuk substrat tersebut sehingga terbentuk kompleks enzim substrat.
Gambar 2. Model kerja enzim menurut teori kunci dan anak kunci (Santoso, 2010).
substrat setelah terjadi pengikatan. Jadi, tautan yang cocok pada keduanya dapat diinduksi ketika terbentuk kompleks enzim-substrat.
Gambar 3. Model kerja enzim menurut teori terinduksi (Santoso, 2010).
Selulase merupakan enzim yang berperan dalam menghidrolisis selulosa dengan memutus ikatan β-1,4-D-glikosida untuk menghasilkan
oligosakarida dan glukosa. Proses hidrolisa selulosa oleh mikrooorganisme terjadi diluar sel dan enzim selulase yang dihasilkan merupakan enzim enzim ekstraseluler. Berdasarkan aktivitasnya dalam mendegradasi substrat selulosa dikenal tiga jenis enzim yaitu enzim endo-1,4-β-glukanase, ekso-1,4-β-glukanase, dan β-glukosidase. Enzim endo-1,4-β-glukanase memutus ikatan internal β-1,4-D-glikosida secara acak pada bagian amorf dari
selobiosa dan gula pereduksi, dan β-glukosidase menghidrolisis selobiosa menjadi glukosa (Zhang dkk., 2006).
Aktivitasfilter paperase(FP-ase) umumnya digunakan untuk mengukur aktivitas selulase total pada substrat selulosa yang masih bersifat kristal dengan melibatkan aktivitas C1yang berperan sebagai pengaktif selulosa kristal menjadi selulosa reaktif (Reese et al., 1950 dalam dalam Hartati, 2001). CMC (Carboxy Metil Cellulosa) merupakan substrat yang umumnya digunakan untuk pengujian aktivitas endoglukanase sehingga sering disebut dengan CMC-ase (Zhang dkk., 2006). Substrat CMC memiliki kelarutan yang lebih tinggi dibandingkan selulosa lainnya, sehingga lebih mudah dihidrolisis oleh enzim selulase (Yanuar dkk., 2003).
E. Urea
Gambar 4. Struktur Kimia Urea (Wikipedia, 2012)
Urea adalah suatu senyawa organik yang terdiri dari unsur karbon, hidrogen, oksigen dan nitrogen dengan rumus CON2H4atau (NH2)2CO. Urea
memiliki bentuk fisik berupa butiran atau granular berwarna putih. Urea dapat digunakan sebagai pupuk disebut pupuk nitrogen, memiliki
2007). Selain itu, urea juga dapat digunakan sebagai tambahan makanan protein oleh hewan pemamah biak, dalam pembuatan resin, plastik,, produksi melamin, dan juga bahan antara dalam pembuatan ammonium sulfat, asaam sulfat, dan fitalosianina (Austin, 1996).
[image:16.595.259.408.263.384.2]F. Bagas
Gambar 5. Bagas
Bagas atau biasa dikenal dengan ampas tebu merupakan hasil samping dari batang tebu yang diekstraksi cairannya (Slamet, 2004). Bagas mengandung lignoselulosa sebesar lebih kurang 52,7% selulosa, 20% hemiselulosa, dan 24,2% lignin (Samsuri dkk., 2007). Selain itu, bagas juga mengandung senyawa nitrogen dan thiamin yang berguna untuk pertumbuhan miselium fungi (Saskiawan dan Sudarmono, 1993). Panjang serat bagas berkisar antara 1,7 sampai 2 mm dengan diameter sekitar 20 mikro. Bagas
A. Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan dari bulan Juni 2011 sampai Januari 2012 di Laboratorium Mikrobiologi dan Laboratorium Biomolekuler Jurusan Biologi FMIPA Unila.
B. Alat dan Bahan 1. Alat
Alat-alat yang digunakan dalam penelitian ini yaitu : botol selai, erlenmeyer, gelas beker, batang pengduk, tabung reaksi, rak tabung reaksi, mikropipet, pipet tips, mikrotub, lampu spiritus, jarum ose, neraca analitik, inkubator kapang, autoklaf,laminar air flow,orbital shaker,water bath shaker, sentrifuge, spektrofotometer, vortex mixer,
oven, kertas saring, corong, dan kompor listrik. 2. Bahan
C. Metode Penelitian
Penelitian ini menggunakan metode eksperimental dalam skala laboratorium dengan Rancangan Acak Lengkap dengan tiga kali ulangan. Perlakuan yang diberikan pada media fermentasi yaitu kadar urea sebesar 0% (w/v), 0,03% (w/v), 0,06% (w/v), 0,09% (w/v), dan 0,12% (w/v).
Parameter utama yang diukur yaitu persentase pengurangan berat kering bagas dan parameter pendukung yaitu aktivitasfilter paperase(FP-ase) dan degradasi berbagai substrat terhadap gula pereduksi yang dihasilkan. Persentase pengurangan berat kering bagas ditentukan menggunakan metode pengeringan dalam oven. Untuk aktivitas FP-ase dan degradasi berbagai substrat terhadap gula pereduksi yang dihasilkan ditentukan berdasarkan kadar glukosa yang terbentuk dari reaksi enzimatis substrat dengan ekstrak kasar enzim.
D. Analisis Data
Data yang diperoleh dianalisis ragam dan jika di antara perlakuan berbeda nyata pada taraf 5%, maka analisis dilanjutkan dengan
polinomial orthogonal.
E. Pelaksanaan penelitian
1. Pembuatan Media Fermentasi
(Ahamed dan Vermette, 2008). Setelah itu, urea ditambahkan ke dalam media masing-masing dengan kadar 0,03% (w/v), 0,06% (w/v), 0,09% (w/v), dan 0,12% (w/v). Sebagai kontrol digunakan media dengan kadar urea yang sama tapi tidak diberi isolat. Selanjutnya, media disterilkan dengan autoklaf selama 15 menit dengan suhu 121oC dan tekanan 2 atm.
2. Inokulasi
Masing-masing isolatAspergillusspp.1 diremajakan pada media PDA miring dalam tabung reaksi selama 3 hari. Kemudian larutan garam fisiologis 0,9% (w/v) dituangkan ke dalam tabung reaksi dan dilakukan pemisahan spora dari media agar menggunakan vortex mixer hingga spora terlepas. Sebanyak 1,8 ml suspensi spora diinokulasikan pada media fermentasi dan diinkubasi selama 4 hari pada suhu ruang dengan orbital shaker(Purwadaria, 2003).
3. Persentase Pengurangan Berat Kering
Kertas saring ditimbang (A gram). Bagas yang telah difermentasi ditempatkan pada kertas saring. Kemudian dikeringkan dalam oven 55oC sampai beratnya konstan. Kertas saring dan bagas yang telah dikeringkan ditimbang (B gram). Berat kering merupakan selisih berat B-A. Persentase pengurangan berat kering ditentukan dengan rumus :
Keterangan : = Rata-rata berat kering bagas kontrol Wbf = Berat kering bagas yang difermentasi
4. Pengukuran Aktivitas FP-ase
Sebanyak 50 mg substrat kertas saring dipotong-potong dengan ukuran 1x1 cm2. Lalu, dimasukkan ke dalam tabung reaksi, ditambahkan 1,8 ml buffer sitrat pH 4 dan 0,2 ml ekstrak kasar enzim. Kemudian larutan tersebut dihomogenkan dan diinkubasi selama 30 menit padawater bath dengan suhu 40oC lalu ditambahkan 2 ml pereaksi DNS. Setelah itu, dihomogenkan, dipanaskan dalam air mendidih selama 15 menit, dan direndam dalam air es selama 20 menit.
Masing-masing larutan diukur absorbansinya pada panjang gelombang 540 nm dengan menggunakan spektrofotometer (Miller, 1959). Kadar glukosa ditentukan dengan menggunakan kurva standar glukosa. Satu unit aktivitas FP-ase didefinisikan sebagai jumlah µmol glukosa yang dihasilkan per menit untuk setiap ml enzim pada kondisi pengujian.
5. Pengukuran Degradasi Berbagai Substrat Berdasrkan Kadar Gula Pereduksi yang Dihasilkan
jerami padi, bagas, rumput gajah, dan larutan CMC 0,5% (w/v) dimasukkan ke dalam tabung reaksi, ditambahkan 1,8 ml buffer sitrat pH 4 dan 0,2 ml ekstrak kasar enzim. Kemudian larutan tersebut dihomogenkan dan diinkubasi selama 60 menit padawater bathdengan suhu 40oC lalu ditambahkan 2 ml pereaksi DNS. Setelah itu,
dihomogenkan, dipanaskan dalam air mendidih selama 15 menit, dan direndam dalam air es selama 20 menit.
Masing-masing larutan diukur absorbansinya pada panjang gelombang 540 nm dengan menggunakan spektrofotometer (Miller, 1959). Kadar gula pereduksi ditentukan dengan menggunakan kurva standar glukosa.
6. Pembuatan Kurva Standar Glukosa untuk Uji Aktivitas FPase Larutan gula reduksi glukosa merupakan larutan gula standar yang digunakan pada interval 0-160 µg/ml yaitu 0 µg, 20 µg, 40 µg, 60 µg, 80 µg, 100 µg, 120 µg, 140 µg, dan 160 µg masing-masing larutan diambil sebanyak 1 ml, ditambahkan 1 ml larutan buffer sitrat dan 50 mg kertas saring sebagai substrat dan 2 ml pereaksi DNS. Dihomogenkan dan dipanaskan dalam air mendidih selama 15 menit. Selanjutnya didinginkan dengan merendamnya kedalam air es selama 20 menit. Pengukuran absorbansi dilakukan dengan menggunakan
7. Pembuatan Kurva Standar Glukosa untuk Uji Degradasi Berbagai Subtrat Berdasarkan Gula pereduksi yang dihasilkan.
Larutan gula standar yang digunakan pada interval 0-1000 µg/ml yaitu 0 µg, 100 µg, 200 µg, 300 µg, 400 µg, 500 µg, 600 µg, 700 µg, 800 µg, 800 µg, 900 µg, dan 1000 µg. Masing-masing larutan diambil sebanyak 1 ml, ditambahkan 1 ml larutan buffer sitrat pH 4 dan 2 ml pereaksi DNS. Dihomogenkan dan dipanaskan dalam air mendidih selama 15 menit. Selanjutnya didinginkan dengan merendamnya kedalam air es selama 20 menit. Pengukuran absorbansi dilakukan dengan
A. Kesimpulan
Dari hasil penelitian yang telah dilakukan dapat disimpulkan bahwa :
1. Peningkatan kadar urea diikuti dengan peningkatan degaradasi bagas oleh isolatAspergillusspp.1. Persentase pengurangan berat kering bagas terendah yaitu sebesar 0,82% pada kadar urea 0% (w/v) dan persentase pengurangan berat kering bagas tertinggi didapatkan pada kadar urea 0,12% (w/v) sebesar 5,74%.
2. Penambahan urea memberikan pengaruh yang tidak signifikan
terhadap aktivitas FP-ase. Nilai aktivitas FP-ase tertinggi pada kadar urea 0,03% (w/v) sebesar 0,12 U/ml, sedangkan aktivitas FP-ase terendah didapatkan pada kadar urea 0% yaitu sebesar 0,12 U/ml. 3. Bagas paling banyak menghasilkan enzim hidrolase. Substrat yang
B. Saran
(Skripsi)
Oleh
ZAHRA WANDA ASFARINI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
Oleh
ZAHRA WANDA ASFARINI
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA SAINS
Pada Jurusan Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
Nama Mahasiswa : Zahra Wanda Asfarini Nomor Pokok Mahasiswa : 0717021072
Jurusan : Biologi
Fakultas : Matematika dan Ilmu Pengetahuan Alam
MENYETUJUI
1. Komisi Pembimbing
Dra. Christina.N Ekowati, M.Si Kusuma Handayani, M. Si
NIP. 195808181985032001 NIP 197808192008012018
2. Ketua Jurusan Biologi
1. Tim Penguji
Ketua : Dra. Christina N. Ekowati, M. Si ...
Sekretaris : Kusuma Handayani, M. Si ...
Penguji
Bukan Pembimbing : Dr. Sumardi ...
2. Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Prof. Suharso, Ph.D. NIP. 196905301995121001
Abdullah, N., N. Ejaz, M. Abdullah. Alim-un-Nisa, dan S. Firdous.
Lignocellulosic Degradation in Solid-State Fermentation of Sugar Cane Bagasse byTermitocessp.Micologia Aplicada International, 18 (2), 2006, pp 15-19.
Ahamed, A. dan P. Vermette. 2008. Culture-based Strategies to Enhance Cellulase Enzyme Production from Trichodrma ressei RUT-C30 in Bioreactor Culture Conditions. Biochemical Engineering Journal, 40, 399-407.
Alam, Md. Z., N. Muhammad, dan M. E. Mahmat. 2005. Production of Cellulase from Oil Palm Biomass as Substrate by Solid State Bioconversion.
American Journal of Applied Science2 (2): 569-572.
Alexander, M. 1997.Soil Microbiology. John Wlley dan Sons, Inc. New York. Pp. 52-57.
Ambriyanto, K. S. 2010.Isolasi dan Karakterisasi Bakteri aerob Pendegradasi Selulosa dari Seresah Daun Rumput Gajah (Pennisetum purpureum Schaum). (Skripsi). Institut Teknologi Sepuluh Nopember. Surabaya.
Arivo, D. 2010.Isolasi dan Uji Kemampuan Selulolitik Isolat Fungi yang dapat Mendegradasi Bagas untuk Pakan Ruminansia.(Skripsi). Universitas Lampung. Bandar Lampung.
Austin, G. T., 1996.Industri Proses Kimia. Jilid 1. Edisi Kelima. Penerbit Erlangga. Jakarta.
Barnett, H.L. and B.B. Hunter. 1998.Illustrated marga of imperfect fungi.4thed. USA: Prentice-Hall, Inc.
Barron, George. 2008. Heterocaryosis and the Parasexual Cycle in Aspergillus. http://www.uoguelph.ca/~gbarron/2008/parasex.htm. Diakses pada tanggal 14 Mei 2012 pukul 10.00 WIB.
Campbell, N.A., J.B. Reece, L.G. Mitchel. 2000.Biologi Jilid 2. Erlangga. Jakarta.
Ensminger, M.E., J.E. Oldfield and W.W. Heinemann. 1990. Feed and Nutrition. The Ensminger Publ. Co. California.
Gandjar, I. 2006.Mikologi Dasar dan Terapan. Yayasan Obor Indonesia. Jakarta.
Gandjar, I., R.A. Samson, K. Twell Vermaullen, A. Oetari, dan I. Santoso. 1999. Pengenalan Kapang Tropik Umum. Yayasan Obor Indonesia. Jakarta.
Hartati, Sri. 2001.Pemanfaatan Limbah Agar-Agar Kertas untuk Produksi Enzim Selulase dari Kapang Trichoderma viride. (Skripsi). Institut Pertanian Bogor. Bogor. 71 hlm.
Husin. 2007.Pemanfaatan Bagas Sebagai Bahan Industri. http://bioindustri. blogspot.com/2009/11/bagassebagai-bahan-industri.html. Diakses tanggal 11 Februari 2011 pukul 10.36 WIB.
Indah, R.J. 2012.Pengaruh Penambahan Urea Pada Media Bagas terhadap Produksi dan Karakterisasi Enzim Selulase Isolat Aspergillus spp.1. (Skripsi). Universitas Lampung. Bandar Lampung.
Jati, K.K. 2008.Pengaruh Tingkat Penggunaan Ampas Tebu (Bagasse)
Fermentasi Dalam Ransum terhadap Kecernaan Bahan Kering dan Bahan Organik pada Domba Lokal Jantan (Jurnal). Universitas Sebelas Maret. Surakarta.
Aspergillus terreus ATCC 74135 in Solid State Fermentation. African Journal of Biotechnology Vol. 10 (21), pp. 4428-4435, 23 May 2011.
Lonsane, B.K., N.P. Ghildyal, S. Budiatman, dan S.V. Rama Krishna. 1985. Engineering Aspects of Solid State Fermentation.Enzyme Microb. Tech. Vol. 7:258-265.
Lynd, L.R., Weimer P. J., Zyl W. H., Pretorius I. S. 2002. Microbial cellulose utilization : fundamental and biotechnology.Microbiol Molecul Bio Reviews66: 506-577
Maciel, G.M., L.P. de Souza Vandenberghe, C. Windson, I. Haminiuk, R. C. Fendrich, B. E. D. Bianca, T.Quintella da Silva Brandalize, A.Pandey and C. R. Soccol. 2008. Xylanase Production by Aspergillus niger LPB 236 in Solid-State Fermentation Using Statistical Experimental Design.(Jurnal). Food Technology, Biotechnology46(2) 183-189.
Melisa, R. 2010.Uji Kemampuan Xilanolitik Isolat Fungi yang dapat
Mendegradasi Bagas Untuk Pakan Ruminansia (Skripsi). Universitas Lampung. Bandar Lampung.
Meryandini. A, W.Widosari, B.Maranatha, T.C.Sunarti, N.Rachmania, H.Satria. 2007. Isolasi Bakteri Selulolitik dan Karakterisasi Enzimnya.Makara SainsVol.13 No.1 April 2009: 33-38.
Moore-Landecker, E. 1996.Fundamentals of the Fungi. Prentice Hall. Upper Saddle River. New Jersey. 574 pp.
Murphi, H. 1994.Pemanfaatan Kulit Biah Pisang untuk Produksi Enzim Selulase oleh Trichoderma viride, Aspergillus niger, Aspergillus oryzae (Skripsi). Institut Pertanian Bogor. Bogor.
Muthuvelayudham, R and Viruthagir, 2006 Fermentative production and kinetics of cellulose protein on Tricoderma reesei ysing sugarcane bagasse and rice straw.African Journal of BiotechnologyVol. 5 (20), pp. 1873-1881, 16 october 2006.
Aspergillus niger.African Journal of BiotechnologyVol. 5 (5), pp. 472-476.
Ojumu, T.V., S.B. Ogbe, B. Eriola, L.S. Kolawole, dan A. Bamikole. 2003. Cellulase Production by Aspergillus flavua Linn Isolate NSPR 101 fermented in sawdust, bagasse, and corncob. African Journal of Biotechnology Vol. 2 (6), pp. 150-152, June 2003.
Palimbani. 2007.Urea. http://pusri.wordpress.com/2007/09/22/mengenal-pupuk-urea/. Diakses pada tanggal 3 Juni 2012 pukul 15:07 WIB.
Pelczar, M.J. dan Chan, E.C.S. 2006.Dasar-Dasar Mikrobiologi Jilid I. Penerbit Universitas Indonesia. Jakarta.
Perez J., Munoz-Dorado J, Rubia T., Martines J. 2002. Biodegradation and biological treatment of cellulose, hemicelluloses, and lignin: an over view. Journal Int. Microbiol5: 53-63.
Prasetyani, H. 2007.Uji aktivitas Enzim Selulase dari Isolat Mikrofungi Saprotrof Perkebunan Kopi Sumberjaya Lampung Barat (Skripsi). Universitas Lampung. 64 hlm.
Purwadaria, T., P.A. Marbun, A.P. Sinurat, dan P.P. Ketaren. 2003. Perbandingan Aktivitas Enzim Selulase dari Bakteri dan Kapang Hasil Isolasi dari Rayap (Jurnal).Balai Penelitian Ternak. Bogor.
Rao, S.N.S. 1994.Mikroorganisme Tanah dan Pertumbuhan Tanaman. Penerbit Universitas Indonesia. Jakarta. 353 hlm.
Samsuri, M., Gozani.M, Mardias.R, Baiquni.H, Hermansyah.H, Wijanarko.A. 2006.Pemanfaatan Selulosa Bagas Untuk Produksi Etanol Melalui Sakarifikasi Dan Fermentasi Serentak Dengan Enzim Xilanase. Universitas Indonesia.
Saskiawan, I., dan Sudarmono. 1993. “Alternatif Penggunaan Sekam Padi pada Budidaya Jamur Tiram”. Seminar Hasil Litbang tanggal 14 Juni 1993. Pusat Litbang. LIPI. Pp. 338-342.
Singh, A., N. Singh dan N. R. Bishnoi. Production of Cellulases by Aspergillus Heteromorphus from Wheat Straw under Submerged Fermentation. International Journal of Civil and Environmental Engineering1:1 2009.
Sulistianingsih. 2006.Teknik Pengomposan Limbah Padat Industri Gula dan Aplikasinya pada Lahan Pertanaman Tebudi PT GMP. Lampung Tengah. Laporan PU. Unila. Bandar Lampung.
Tim Taksonomi Tumbuhan I. 2006.Bahan Ajar Taksonomi Tumbuhan I. Universitan Lampung. Bandar Lampung.
Volk, W.A. dan M. F. Wheeler. 1993.Mikrobiologi Dasarjilid I hal. 184-185. Erlangga. Jakarta. 396 hlm.
Wyman,CE. 2002. Potential Synergies and Challenges in Refining Cellulosic Biomassto Fuels.Biotechnol Progress.
Yanuar,A., Rosmalasari, E., dan Anwar,A. 2003. Preparasi dan Karakterisasi Selulosa Mikrokristal dari nata de coco untuk Bahan Pembantu Pembuatan Tablet.(Jurnal). Universitas Indonesia. Jakarta.
Yatim, W. 2007 .Kamus Biologi. Yayasan Obor Indonesia. Jakarta.
Penulis dilahirkan di Jakarta pada tanggal 1 Maret 1989. Sebagai anak kelima dari lima bersaudara, dari bapak Rizanir Djalil dan ibu Jusniar Malik. Pendidikan yang ditempuh penulis yaitu di TK Islam Al-Furqon, SDIT Al-Hikmah, Madrasah Tsanawiyah dan Madrasah Aliyah Pondok Pesantren Husnul Khotimah. Pada tahun 2007, Penulis terdaftar sebagai Mahasiswa Jurusan Biologi FMIPA Unila melalui jalur SPMB.
Penulis pernah menjadi anggota biro rumah tangga Himbio FMIPA Unila (2009/2010). Penulis juga menjadi asisten praktikum mata kuliah Mikrobiologi Umum.
Allah SWT,
Alhamdulillahirobbil’alamin, puji syukur penulis panjatkan kepada Allah SWT,
karena berkat kesempatan, kemudahan, kekuatan, kesabaran, rahmat, dan hidayah-Nya, sehingga penulis dapat menyelesaikan skripsi ini dengan baik. Shalawat serta salam tak lupa tercurahkan kepada Nabi Muhammad SAW yang telah menuntun kita dari kegelapan menuju jalan cahaya-Nya, kepada sahabat, keluarga, dan ummatnya yang setia hingga akhir zaman.
Skripsi ini disusun sebagai tugas akhir untuk mencapai gelar sarjana sains di Universitas Lampung dengan judul“Pengaruh Penambahan Urea terhadap Degradasi Bagas oleh IsolatAspergillusspp.1 dari Bagas”. Penelitian ini merupakan bagian dari proyek penelitian“Pemutusan Ikatan Lignoselulosa Bagas
Tebu Isolat Mikrofungi Terseleksi Secara Enzimatis Untuk Pembuatan Ransum
Ruminansia Berkualitas Tinggi”oleh Ibu Mucharomah Prayuwidayati, S.Pt, M.T.A
yang sepenuhnya didanai oleh Dirjen DIKTI Kementrian Pendidikan Nasional melalui
Hibah Penelitian Kompetensi Tahun 2009-2010.
1. Kedua orang tuaku tercinta, yang telah membesarkan, mendidik, dan memberi nasihat, kasih sayang, semangat, do’a yang tiada henti kepada penulis dalam mencapai cita-cita. Semoga Allah SWT selalu
melimpahkan rahmat dan ridhonya untuk Ummi dan Abi.
2. Ibu Dra. Christina Nugroho Ekowati, M.Si., selaku pembimbing I atas ide, motivasi, saran, kritik, arahan, nasihat, bimbingan, dan perhatian yang telah diberikan dengan penuh kesabaran kepada penulis.
3. Ibu Kusuma Handayani, M.Si, selaku pembimbing II yang telah memberikan bimbingan, arahan, saran, kritik, dan dukungan dalam menyelesaikan skripsi ini.
4. Bapak Dr. Sumardi M.Si., selaku Pembahas yang selalu memotivasi, memberikan bimbingan, saran, kritik, serta, koreksinya sehingga skripsi ini menjadi lebih baik.
5. Ibu Dra. Nuning Nurcahyani, M.Sc., selaku pembimbing akademik penulis atas segala dukungan, nasihat dan bimbingan kepada penulis dalam
menempuh pendidikan di Jurusan Biologi.
6. Bapak Prof. Suharso, Ph.D selaku Dekan FMIPA Unila.
7. Ibu Dra. Nuning Nurcahyani, M.Sc., selaku ketua jurusan Biologi FMIPA Unila atas dukungan sehingga penulis dapat menyelesaikan skripsi. 8. Uni Elsi, Bang Inang, Uni Yetty, Bang Icangtersayang atas do’a, kasih
penulis selama ini.
10. Diah, Dwi, Mba Debi, Mba Win, Mba Tika, Mba Yeyen, Mba Leni, Mba Tia, Mba Siska, Kak Yan, Kak Agus, Kak Zein, Kak, Riki, Kak Asep, dan rekan-rekan di lab.Mikrobiologi, terima kasih untuk motivasi,
kebersamaan, canda tawa, dan semangat selama ini.
11. Teman-teman Biologiangkatan ‘07FMIPA Unila Asnita, Tria, Lia, Wiwik, Desi, Anjar, Koko, Pius, Eka, Diah, Ratna, Dwi, Mika, Tiwi, Eca, Iik, Dita, Lian, Gita, Dora, Nunu, Anton, Omen, Ria, Oca, Tika, Heni, Suci, Mpud, Ara, Eni, Nina, Ghina, Ayu, Muti, Mara, Harfiah,Putra, Bhakti, dan teman-teman yang tidak dapat disebutkan satu per satu, terima kasih atas kebersamaan, canda tawa, semangat, dan motivasi selama ini. 12. Kakak tingkat dari angkatan 2000–2006 dan adik tingkat2008–2011,
terima kasih atas kekeluargaan, kritik, canda tawa, dan semangat yang diberikan kepada penulis.
13. Kepada semua pihak yang tidak dapat penulis sebutkan satu per satu, yang dengan tulus telah membantu penulis selama masa perkuliahan dan
penyusunan skripsi ini.
Bandar Lampung, Juli 2012 Penulis