SINTESIS TERSIER-BUTIL EUGENOL DARI EUGENOL DENGAN TERSIER-BUTIL KLORIDA MENGGUNAKAN KATALIS ALUMINIUM
KLORIDA DENGAN VARIASI LAMA PEMANASAN Skripsi
Diajukan Untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Farmasi
Oleh :
Vita Felicia NIM : 06 8114 145
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
SINTESIS TERSIER-BUTIL EUGENOL DARI EUGENOL DENGAN TERSIER-BUTIL KLORIDA MENGGUNAKAN KATALIS ALUMINIUM
KLORIDA DENGAN VARIASI LAMA PEMANASAN Skripsi
Diajukan Untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Farmasi
Oleh :
Vita Felicia NIM : 06 8114 145
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iii
2010SINTESIS TERSIER-BUTIL EUGENOL DARI EUGENOL DENGAN TERSIER-BUTIL KLORIDA MENGGUNAKAN KATALIS ALUMINIUM
KLORIDA DENGAN VARIASI LAMA PEMANASAN
Oleh :
Vita Felicia NIM : 06 8114 145
Skripsi ini telah disetujui oleh :
Pembimbing
iv
Halaman Pengesahan
PENGESAHAN SKRIPSI Berjudul
SINTESIS TERSIER-BUTIL EUGENOL DARI EUGENOL DENGAN TERSIER-BUTIL KLORIDA MENGGUNAKAN KATALIS ALUMINIUM
KLORIDA DENGAN VARIASI LAMA PEMANASAN Oleh :
Vita Felicia NIM : 06 8114 145
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi
Universitas Sanata Dharma Pada Tanggal 25 Januari 2010
Mengetahui
2. Dra. Maria Margaretha Yetty Tjandrawati, M.Si. ...
v
Caje dhanam anggavarassa hetu,
Angam caje jivitam rakkhamano,
Angam dhanam jititancapi sabbam,
Caje naro dhammamanussaranto
Biarlah seseorang mengorbankan hartanya demi menyelamatkan anggota tubuhnya,
Biarlah ia mengorbankan anggota tubuhnya demi menyelamatkan hidupnya, Tetapi biarlah ia mengorbankan hartanya, anggota tubuhnya, dan segalanya,
meskipun hidupnya, Demi kebenaran Dhamma
(Khuddaka Nikaya, Jataka 28/147)
vi
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata
Dharma:
Nama : Vita Felicia
NIM : 068114145
Demi pengembangan ilmu pengetahuan, saya memberikan kepada
Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul:
SINTESIS TERSIER-BUTIL EUGENOL DARI EUGENOL DENGAN TERSIER-BUTIL KLORIDA MENGGUNAKAN KATALIS ALUMINIUM KLORIDA DENGAN VARIASI LAMA PEMANASAN
berserta perangkat yang diperlukan. Dengan demikian saya memberikan kepada
Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam
bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan
secara terbatas, dan mempublikasikan di internet atau media lain untuk kepentingan
akademis tanpa perlu meminta izin dari saya maupun memberikan royalti kepada saya
selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini yang saya buat dengan sebenarnya.
Dibuat di Yogyakarta
Pada tanggal 25 Januari 2010
Yang menyatakan,
vii PRAKATA
Puji syukur kepada Tuhan yang Maha Esa atas berkat dan karuniaNya,
sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi yang
berjudul “Sintesis tersier-butil eugenol dari eugenol dengan tersier-butil klorida
menggunakan katalis aluminium klorida dengan variasi lama pemanasan” sebagai
salah satu syarat untuk mencapai gelar Sarjana Farmasi (S. Farm.) di Universitas
Sanata Dharma Yogyakarta.
Dalam penulisan skripsi ini, penulis banyak mendapatkan bantuan dari
berbagai pihak, baik bimbingan, dorongan, maupun saran. Pada kesempatan ini,
penulis ingin menyampaikan penghargaan dan ucapan terima kasih kepada:
1. Rita Suhadi, M.Si., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata
Dharma.
2. Jeffry Julianus, M.Si. selaku dosen pembimbing utama atas bimbingan dan
pengarahannya dari awal penelitian hingga penyusunan skripsi ini.
3. Dra. Maria Margaretha Yetty Tjandrawati, M.Si. selaku dosen penguji atas
pengarahan, saran dan kritiknya selama penelitian maupun penyusunan
skripsi.
4. Lucia Wiwid Wijayanti, M.Si. selaku dosen penguji atas pengarahan, saran
dan kritiknya.
5. Mas Parlan, mas Bimo, dan mas Kunto, terima kasih atas bantuan selama
viii
6. Marissa, Handayani, Jati dan Linda, tim seperjuangan yang tangguh.
7. Andi Boedianto, S.Kom. atas dukungannya dalam penyusunan skripsi.
8. Teman-teman Farmasi 2006, terutama minat FST 2006 yang tidak dapat
disebut satu per satu. Terima kasih atas kebersamaannya selama di farmasi.
Sukses selalu bagi kita semua.
9. Teman-teman Kamadhis Satya Dharma dan Vidyasena Vihara Vidyaloka yang
selalu menyemangati penulis disaat penulis menemui hambatan atau masalah.
Semoga selalu berbahagia.
10.Teman-Teman KKN Tempel XXXVIII dan seluruh warga Dusun Tempel.
Sukses selalu bagi kita semua.
11.Segenap pihak yang telah membantu dan memberikan dukungan yang tidak
dapat disebutkan satu persatu.
Akhir kata penulis menyadari penyusunan skripsi ini masih jauh dari
sempurna mengingat keterbatasan kemampuan dan pengetahuan yang dimiliki.
Oleh karena itu, saran dan kritik yang bersifat membangun sangat diperlukan oleh
penulis demi kesempurnaan skripsi ini. Semoga skripsi ini dapat memberikan
sumbangsih yang bermanfaat bagi perkembangan ilmu pengetahuan.
ix
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini
tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan
dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 21 Desember 2009
Penulis,
x
SINTESIS TERSIER BUTIL EUGENOL DARI EUGENOL DENGAN TERSIER BUTIL KLORIDA MENGGUNAKAN KATALIS ALUMINIUM
KLORIDA DENGAN VARIASI LAMA PEMANASAN
INTISARI
Penambahan gugus yang meruah didekat gugus hidroksi dapat meningkatkan aktivitas antioksidan. Sintesis tersier-butil eugenol dari eugenol dengan tersier-butil klorida menggunakan katalis aluminium klorida (AlCl3) bertujuan meningkatkan aktivitas antioksidan dari eugenol. Variasi lama pemanasan dilakukan agar didapatkan lama pemanasan yang optimal selama proses sintesis sehingga jumlah hasil sintesis yang dihasilkan paling banyak.
Penelitian ini merupakan penelitian eksperimental murni. Sintesis dilakukan berdasarkan reaksi alkilasi Friedel-Crafts, yaitu mereaksikan eugenol dengan tersier-butil klorida mengunakan katalis AlCl3 pada pemanasan 60oC dan dilakukan variasi lama pemanasan 3, 5, dan 7 jam. Hasil sintesis diuji organoleptis dan kromatografi lapis tipis (KLT). Uji KLT dilakukan dengan lempeng silika gel 60 GF254, dengan fase gerak toluena : etil asetat (93:7) dan dideteksi dengan sinar UV 254 nm. Senyawa hasil sintesis dianalisis dengan kromatografi gas – spektroskopi massa (GC-MS).
Hasil KLT menunjukkan adanya bercak senyawa baru pada hasil sintesis dengan pemanasan selama 3 jam dan mempunyai nilai Rf 0,82, sedangkan pada
hasil sintesis dengan pemanasan 5 jam dan 7 jam, tidak didapatkan bercak senyawa baru. Hasil GC-MS menunjukkan terbentuk tersier-butil eugenol pada hasil sintesis pemanasan selama 3 jam. Pada pemanasan selama 5 jam dan 7 jam tidak dihasilkan tersier-butil eugenol.
xi ABSTRACT
Addition of large group near the hidroxy group can increased antioxidant activity. Synthesis of tertiary-butyl eugenol from eugenol with tertiary-butyl chloride using aluminium chloride catalyst (AlCl3) aims to increased the antioxidant activity from eugenol. Heating variation done to get the optimum heating time during the t-butil eugenol synthesis process and so that amount of material target increased too.
This experiment is an experimental method. The synthesis is based on the reaction of Friedel-Crafts alkylation, which eugenol react with t-butil chloride using AlCl3 as catalyst. Temperatur of this reaction is 60oC for increased the rate of reaction. The heating was varied to 3, 5, and 7 hours. The results obtained and then tested organoleptis and thin-layer chromatography (KLT). KLT test performed with plates silica gel 60 GF254, with the motion phase toluene: etilasetat (93:7) and detected by UV254 nm light. To strengthen the KLT test result, test compounds synthesis gas chromatography-mass spectroscopy (GC-MS)
KLT results indicate a new compound spots on the synthesis of 3 hours heating with Rf value is 0.82, whereas the synthesis of 5 hours and 7 hours is not
new compounds available spots. GC-MS results show tertiary-butyl eugenol formed in the synthesis with 3 hours heating. Five hours heating and 7 hours heating did not formed.
xii DAFTAR ISI
HALAMAN JUDUL...ii
HALAMAN PERSETUJUAN PEMBIMBING...iii
HALAMAN PENGESAHAN...iv
HALAMAN PERSEMBAHAN...v
HALAMAN PERSETUJUAN...vi
PRAKATA...vii
PERNYATAAN KEASLIAN KARYA...ix
INTISARI...x
ABSTRACT...xi
DAFTAR ISI...xii
DAFTAR TABEL...xv
DAFTAR GAMBAR...xvi
DAFTAR LAMPIRAN...xvii
BAB I. PENGANTAR...1
A. Latar Belakang...1
1. Permasalahan...3
2. Keaslian Penelitian...3
3. Manfaat Penelitian...3
B. Tujuan Penelitian...4
BAB II. PENELAAHAN PUSTAKA...5
xiii
A. Jenis dan Rancangan Penelitian...19
B. Variabel dan Definisi Operasional...19
C. Bahan Penelitian...20
D. Alat Penelitian...20
E. Tata Cara Penelitian...20
1. Sintesis t-butil klorida dari t-butil alkohol dengan asam klorida...20
2. Sintesis t-butil eugenol dengan katalis aluminium klorida...21
a. Sintesis t-butil eugenol dengan pemanasan 3 jam...21
b. Sintesis t-butil eugenol dengan pemanasan 5 jam...21
xiv
3. Analisis hasil...22
a. Uji organoleptis...22
b. Kromatografi lapis tipis (KLT)...22
c. Elusidasi struktur dengan Spektrometri Massa...22
d. Perhitungan jumlah senyawa hasil sintesis...23
BAB IV. HASIL DAN PEMBAHASAN...24
A. Sintesis t-butil klorida dari t-butil alkohol dengan asam klorida...24
B. Sintesis tersier-butil eugenol dengan katalis aluminium klorida...26
C. Analisis hasil...28
1. Uji organoleptis...28
2. Kromatografi lapis tipis...29
3. Kromatografi Gas – Spektroskopi Massa...32
D. Variasi Pemanasan...36
BAB V. KESIMPULAN DAN SARAN...40
A. Kesimpulan...40
B. Saran...40
DAFTAR PUSTAKA...41
LAMPIRAN...44
xv
DAFTAR TABEL
Tabel I. Hasil pemeriksaan organoleptis senyawa hasil sintesis dan starting
material...28
Tabel II. Nilai Rf Kromatografi Lapis Tipis Senyawa Hasil Sintesis Dengan Fase
xvi
DAFTAR GAMBAR
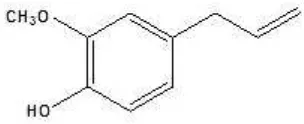
Gambar 1. Struktur Eugenol...6
Gambar 2. Diagram keadaan energi...7
Gambar 3. Mekanisme AlCl3 dalam membentuk karbokation...9
Gambar 4. Struktur dietil eter...11
Gambar 5. Prinsip Reaksi Friedel-Craft...12
Gambar 6. Penembakan elektron pada spektrometri massa...15
Gambar 7. Posisi orto-para dari gugus hidroksi eugenol...18
Gambar 8. Reaksi tahap pertama pembentukan t-butil klorida...24
Gambar 9. Reaksi tahap kedua pembentukan t-butil klorida...25
Gambar 10.Reaksi penetralan asam klorida...25
Gambar 11. Kromatogram kromatografi gas tersier-butil klorida...26
Gambar 12. Mekanisme reaksi AlCl3 dan t-butil klorida...27
Gambar 13. Mekanisme reaksi pembentukan t-butil eugenol...27
Gambar 14. Hasil elusi senyawa hasil sintesis...30
Gambar 15. Kromatogram kromatografi gas senyawa hasil sintesis...33
Gambar 16. Spektrum massa senyawa hasil sintesis pada waktu retensi 12,292 menit...34
Gambar 17. Interaksi t-butil eugenol dengan AlCl3...35
xvii
DAFTAR LAMPIRAN
Lampiran 1. Perhitungan bahan...44
Lampiran 2. Data penimbangan AlCl3...45
Lampiran 3. Gambar hasil elusi senyawa hasil sintesis...46
Lampiran 4. Perhitungan nilai Rf ...47
Lampiran 5. Kromatogram Hasil Kromatografi Gas...48
Lampiran 6. Spektra Massa Hasil Spektroskopi Massa...49
Lampiran 7. Kromatogram Kromatografi Gas t-Butil Klorida...50
Lampiran 8. Spektrum Massa t-Butil Klorida...51
1 BAB I PENGANTAR
A. Latar Belakang
Saat ini, terdapat berbagai jenis penyakit yang timbul karena terjadi proses
oksidasi radikal bebas di dalam tubuh. Radikal bebas sangat reaktif karena
memiliki elektron yang tidak berpasangan dan mempunyai kemampuan untuk
menimbulkan kerusakan, termasuk peroksidasi lipid, lesi Deoxyribo Nucleic Acid
(DNA), dan fragmentasi protein dalam sel. Akumulasi dari kerusakan
makromolekuler intraseluler merupakan penyebab proses penuaan dini, kanker,
stroke, dan lainnya (Fulder, 2004).
Oleh karena itu diperlukan suatu senyawa yang dapat menghentikan proses
oksidasi radikal bebas di dalam tubuh. Salah satu senyawa yang mempunyai
kemampuan untuk menangkap radikal bebas adalah senyawa antioksidan, yakni
dengan cara mendonorkan radikal hidrogennya untuk melengkapi elektron yang
dimiliki suatu radikal bebas. Hal ini dapat menghambat terjadinya reaksi berantai
dari pembentukan radikal bebas yang menimbulkan kerusakan pada sel normal.
Eugenol merupakan salah satu senyawa antioksidan yang diketahui telah
menunjukkan aktivitas antioksidan pada uji empiris terhadap reaksi oksidasi asam
lemak. Beberapa uji empiris yang dilakukan adalah uji Thiobarbituric Acid
(TBA), pemucatan β-karoten, Tiosianat dan bilangan peroksida (Tahir et al.,
2
antioksidan karena dapat mendonorkan atom hidrogen untuk menetralkan radikal
bebas yang berbahaya dalam tubuh.
Pada penelitian ini, eugenol dimodifikasi menjadi t-butil eugenol untuk
meningkatkan aktivitas antioksidannya. Penambahan gugus t-butil pada posisi
orto gugus hidroksi fenolik bertujuan untuk meningkatkan aktivitas antioksidan
eugenol. Berdasarkan hasil penelitian, diketahui bahwa penambahan gugus
meruah didekat gugus hidroksi dapat meningkatkan aktivitas antioksidan (Ogata
et al., 2000). Oleh karena itu, sintesis t-butil eugenol dilakukan dengan
menambahkan gugus yang meruah pada posisi orto gugus hidroksi eugenol.
Proses sintesis t-butil eugenol dilakukan berdasarkan reaksi alkilasi Friedel
Craft, yakni dengan cara mereaksikan eugenol dan t-butil klorida dengan
menggunakan katalis asam Lewis, yang pada penelitian ini menggunakan
aluminium klorida. Reaksi alkilasi Friedel-Crafts dipengaruhi oleh penggunaan
katalis, suhu, dan lama pengadukan. Oleh karena itu perlu dilakukan penelitian
pada variasi lama pemanasan.
Pemanasan dilakukan dengan tujuan agar reaksi berjalan lebih cepat dan
didapatkan jumlah senyawa hasil sintesis yang lebih besar. Oleh karena itu perlu
dilakukan variasi pemanasan sehingga dihasilkan t-butil eugenol yang optimal.
Hal ini disebabkan adanya energi yang diberikan dari pemanasan akan
meningkatkan pergerakan molekul eugenol dan t-butil klorida, sehingga kontak
atau tumbukan antara eugenol dan t-butil klorida akan semakin besar dan
3
1. Permasalahan
Dari latar belakang yang telah diuraikan di atas, masalah yang muncul
dapat dirumuskan sebagai berikut:
a) Apakah t-butil eugenol dapat dihasilkan dari reaksi antara t-butil klorida
dengan eugenol menggunakan katalis aluminium klorida?
b) Apakah variasi lama pemanasan dapat mempengaruhi jumlah hasil sintesis t
-butil eugenol yang dihasilkan?
2. Keaslian Penelitian
Sejauh pengamatan penulis, penelitian tentang sintesis t-butil eugenol dari
eugenol dan t-butil klorida menggunakan katalis aluminium klorida dengan variasi
lama pemanasan belum pernah dilakukan.
3. Manfaat Penelitian
Secara teoritis, penelitian ini bermanfaat untuk menambah faedah bagi
perkembangan ilmu kefarmasian tentang sintesis t-butil eugenol dari eugenol dan
t-butil klorida menggunakan katalis aluminium klorida.
Secara praktis, penelitian ini diharapkan dapat memberikan data
mengenai sintesis t-butil eugenol dan pengaruh lama pemanasan terhadap jumlah
4
B. Tujuan Penelitian ini bertujuan untuk:
1. Mensintesis t-butil eugenol dari t-butil klorida dengan eugenol menggunakan
katalis aluminium klorida
2. Mengetahui pengaruh variasi lama pemanasan terhadap jumlah hasil sintesis t
5 BAB II
PENELAAHAN PUSTAKA
A. Antioksidan
Antioksidan adalah senyawa yang mampu menghambat proses
autooksidasi pada semua bahan yang mengandung lipida. Proses autooksidasi ini
salah satunya dapat disebabkan oleh radikal bebas. Radikal bebas di dalam tubuh
menjadi berbahaya mengingat sebagian besar komponen tubuh kita tersusun dari
lipid (Nawar, 1985). Antioksidan menghambat pembentukkan radikal bebas
dengan bertindak sebagai donor radikal H terhadap radikal bebas sehingga
radikal bebas berubah menjadi bentuk yang lebih stabil. Beberapa kriteria
senyawa antioksidan di antaranya adalah memiliki kelarutan yang tinggi dalam
lipida, efektif dalam jumlah relatif sedikit, toksisitas rendah, dan radikal yang
terbentuk harus lebih stabil daripada radikal bebasnya (Puspita-Nienaber dkk.,
1997).
Sumber-sumber antioksidan dapat dikelompokkan menjadi dua, yaitu:
1. Antioksidan sintetik
Antioksidan yang diperoleh dari hasil sintesis reaksi kimia, contohnya
tokoferol dan Butylated hydroxytoluene (BHT), Butylated hydroxyanisole (BHA),
propil galat.
2. Antioksidan alami
Antioksidan hasil ekstraksi bahan alami, contohnya golongan flavonoid,
6
B. Eugenol
Eugenol merupakan cairan tidak berwarna atau berwarna kuning-pucat,
dapat larut dalam alkohol, eter dan kloroform, memiliki berat molekul 161,20 dan
titik didih 255oC (Anonim, 1989). Senyawa ini termasuk turunan guaiakol yang
mendapat tambahan rantai alil dan dikenal dengan nama IUPAC 2-metoksi-4-(2’
-propenil) fenol. Eugenol sedikit larut dalam air namun mudah larut pada pelarut
organik (Anonim, 1986). Hal ini memenuhi salah satu kriteria antioksidan, dimana
eugenol dapat larut ke dalam lipid, sehingga dapat bekerja efektif dalam
menangkal radikal bebas.
Gambar 1. Struktur Eugenol
Eugenol merupakan salah satu senyawa alami yang telah diketahui
mempunyai aktivitas sebagai antioksidan. Eugenol secara struktural merupakan
jenis senyawa yang memiliki kemampuan untuk menangkap radikal bebas,
sehingga dapat memutus rantai reaksi radikal, sehingga pada akhirnya terbentuk
senyawa yang lebih stabil daripada radikal bebasnya. Eugenol memiliki struktur
cincin aromatis dan memiliki gugus hidroksi fenolik. Gugus hidroksi (-OH)
fenolik pada eugenol merupakan gugus yang berperan sebagai penangkap radikal
bebas dalam mekanisme antioksidan. Hal ini didasarkan pada senyawa fenolik
lain seperti kurkumin yang juga mempunyai aktivitas antioksidan dikarenakan
7
Kkal/mol daripada nilai BDEs C-H metilen 116,07 Kkal/mol, sehingga atom H
dari gugus –OH fenolik lebih mudah diabstraksi daripada abstraksi atom H dari
C-H metilen (Sun et al., 2002).
Usaha untuk meningkatkan aktivitas antioksidan eugenol dilakukan
dengan cara memodifikasi struktur eugenol. Penambahan gugus yang meruah
pada posisi orto gugus hidroksi fenolik dapat meningkatkan aktivitas antioksidan
(Ogata et al., 2000). Modifikasi dilakukan dengan menambahkan suatu gugus
yang meruah yaitu t-butil pada posisi orto gugus hidroksi fenolik eugenol.
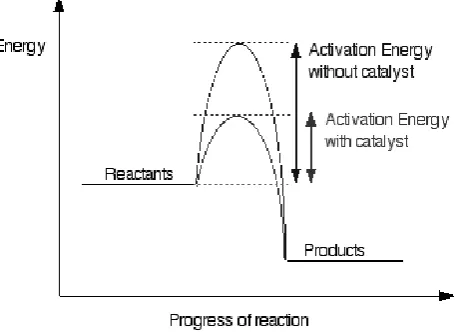
C. Katalis Aluminium Klorida
Katalis adalah suatu zat yang mempercepat suatu laju reaksi, namun ia
sendiri, secara kimiawi, tidak berubah pada akhir reaksi. Menambahkan katalis
memberikan perubahan yang berarti pada energi aktivasi. Katalis menyediakan
satu rute alternatif bagi reaksi. Rute alternatif ini memiliki energi aktivasi yang
rendah. Diagram dibawah ini merupakan gambaran keadaan energi:
8
Energi aktivasi didefinisikan sebagai energi yang harus dilampaui agar
reaksi kimia dapat terjadi atau bisa juga diartikan sebagai energi minimum yang
dibutuhkan agar reaksi kimia tertentu dapat terjadi. Biasanya dilambangkan
sebagai Ea, dengan satuan kilo joule per mol. Terkadang suatu reaksi kimia
membutuhkan energi aktivasi yang sangat besar, maka dari itu dibutuhkan suatu
katalis agar reaksi dapat berlangsung dengan pasokan energi yang lebih rendah
(Anonim, 2004).
Aluminium klorida (AlCl3) berupa serbuk putih pada kondisi masih murni,
memiliki bau yang kuat seperti asam klorida (HCl), higroskopis dan larut dalam
pelarut organik, seperti etanol dan eter. Memiliki berat molekul 133,34 (Anonim,
1989).
Aluminium klorida (AlCl3) adalah garam logam anhidrat yang merupakan
asam Lewis. Asam Lewis adalah zat yang dapat menerima sepasang elektron
(akseptor elektron). Pada reaksi alkilasi Friedel-Crafts, asam lewis yang umum
digunakan sebagai katalis adalah AlCl3 (Fessenden dan Fessenden, 1986).
Keuntungan AlCl3 digunakan dalam reaksi Friedel-Crafts adalah sifatnya sebagai
akseptor elektron akan mudah menerima elektron dari ion klorida pada senyawa
alkil klorida, menghasilkan karbokation alkil. Pembentukan karbokation inilah
yang akan mempercepat reaksi alkilasi Friedel-Crafts, karena muatan positif dari
karbokation akan diserang oleh muatan negatif pada cincin benzen yang akan
9
Gambar 3. Mekanisme AlCl3 dalam membentuk karbokation
Selain itu, yang menjadi alasan AlCl3 sering digunakan sebagai katalis
dalam reaksi Friedel-Crafts karena AlCl3 memiliki kelarutan yang baik hampir
pada setiap pelarut pada umumnya seperti air, etanol dan eter, serta bahannya
relatif mudah didapatkan.
D. Tersier-Butil Klorida
Tersier-butil klorida memiliki nama kimia 2-kloro-2-metilpropana
berbentuk cairan dengan berat molekul 92,57, berat jenis 0,847, dan titik didih
51,0oC. Tersier-butil klorida larut dalam air, alkohol, dan eter (Anonim, 1989).
Tersier-butil klorida merupakan senyawa alkil halida. Dalam reaksi kimia,
struktur bagian alkil dari suatu alkil halida yang berperanan. Oleh karena itu perlu
dibedakan empat tipe alkil halida, yakni: metil, primer, sekunder, dan tersier. Tipe
alkil halida ini akan mempengaruhi kestabilan karbokation yang terbentuk, karena
karbokation tidak stabil dan dengan cepat bereaksi lebih lanjut. Dalam suatu
karbokation, karbon yang bermuatan positif adalah suatu pusat elektropositif.
Rapatan elektron dari ikatan-ikatan sigma digeser ke arah karbon positif. Geseran
rapatan ini menciptakan muatan positif parsial (sebagian) pada atom-atom yang
berdekatan. Muatan parsial positif ini mempolarisasi ikatan-ikatan sigma
berikutnya. Dengan cara ini muatan positif karbokation agak disebar, dan
10
atom dan elektron daripada sebuah atom hidrogen. Semakin banyak gugus alkil
terikat pada atom karbon bermuatan positif, berarti makin banyak atom yang
dapat membantu membagi muatan positif itu dan membantu menstabilkan
karbokation (Fessenden dan Fessenden, 1986). Keuntungan menggunakan t-butil
klorida adalah akan didapatkan karbokation yang lebih stabil dibandingkan tipe
metil, primer, dan sekunder.
E. Pelarut
Dalam reaksi organik, pengaruh dari pelarut yang digunakan merupakan
hal yang penting. Pelarut dalam reaksi organik dapat dibagi menjadi tiga, yakni:
a. Protik
Merupakan pelarut yang berfungsi sebagai pendonor proton, gugus -̶OH
ataupun -NH-, dan termasuk turunan alkohol, amina, asam karboksilat, dan
air. Senyawa ini memiliki momen dipol dan kapasitas ikatan hidrogen yang
besar.
b. Dipolar aprotik
Pelarut ini memiliki momen dipol dan sifat pendonor yang besar. Contohnya
adalah dimetil sulfoksida, alkil sianida, amida sekunder dan keton.
c. Non-polar aprotik
Pelarut ini memiliki momen dipol yang kecil, tidak memiliki proton asam
ataupun sifat donor maupun akseptor. Pelarut ini juga memiliki gaya
intermolekuler yang lemah. Contohnya adalah senyawa hidrokarbon,
11
Dalam sintesis ini digunakan pelarut non polar aprotik, yaitu dietil eter.
Dietil eter memiliki momen dipol yang kecil karena bentuknya yang simetris.
Gambar 4. Struktur dietil eter
Dietil eter memiliki bobot molekul 74,12 g/mol, titik didih 34,4oC, dan berat jenis
0,714. Berwujud cairan tidak berwarna (bening), memiliki bau yang khas, mudah
menguap dan mudah terbakar (Anonim, 2008).
Pemilihan dietil eter sebagai pelarut dalam sintesis t-butil eugenol ini
disebabkan semua starting material dalam sintesis ini, yaitu t-butil klorida, AlCl3
dan eugenol, memiliki kelarutan yang baik dalam dietil eter. Selain itu, dietil eter
sebagai pelarut non polar aprotik tidak memiliki proton asam, tidak bersifat donor
maupun akseptor, sehingga dalam reaksi sintesis ini tidak akan mempengaruhi
reaksi yang terjadi (inert).
F. Reaksi Alkilasi Friedel-Crafts
Reaksi alkilasi atau penambahan suatu gugus alkil ke dalam cincin benzen
dapat dilakukan berdasarkan reaksi alkilasi Friedel-Crafts dengan menggunakan
katalis asam Lewis seperti AlCl3. Alkilasi Friedel-Crafts merupakan substitusi
dengan suatu gugus alkil pada cincin benzen yang akan mengaktifkan cincin
sehingga substitusi kedua juga dapat terjadi. Maka biasanya digunakan senyawa
12
Gambar 5. Prinsip Reaksi Friedel-Crafts
Karakteristik utama pada seluruh gugus pengaktivasi seperti gugus alkil
adalah kemampuannya memberikan elektron-elektron pada cincin benzen, yang
membuat cincin benzen menjadi semakin kaya elektron dan dengan cepat mampu
menstabilkan karbokation, sehingga menurunkan energi aktivasi dari reaksi
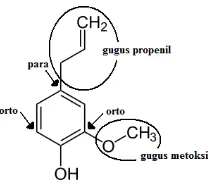
(McMurry, 2008). Adanya gugus hidroksi pada eugenol yang bersifat sebagai
aktifator dan pengarah orto-para maka gugus t-butil akan masuk pada posisi orto
dari gugus hidroksi. Posisi para dari gugus hidroksi tidak dapat dimasuki gugus
t-butil karena sudah diduduki gugus propenil.
G. Uji Organoleptis
Uji organoleptis merupakan uji pendahuluan bertujuan untuk mengetahui
sifat fisik dari senyawa hasil sintesis, meliputi bentuk, warna, bau dan rasa. Untuk
beberapa hal dilengkapi dengan sifat kimia atau fisika, dimaksudkan untuk
dijadikan petunjuk dalam pengelolaan, peracikan, dan penggunaan. Uji ini
dilakukan dengan membandingkan senyawa hasil sintesis dengan starting
material yang digunakan. Uji ini merupakan uji paling sederhana, dapat dilakukan
tanpa bantuan alat.
Dari hasil pemeriksaan organoleptis dapat untuk mengetahui telah
terbentuknya senyawa baru. Jika senyawa hasil sintesis berbeda dengan senyawa
13
pemeriksaan organoletis tidak cukup kuat dijadikan syarat baku, namun secara
tidak langsung dapat membantu dalam penilaian pendahuluan terhadap zat yang
bersangkutan (Anonim, 1995).
H. Kromatografi Lapis Tipis
Kromatografi Lapis Tipis (KLT) digunakan untuk menguji kemurnian
secara kualitatif dari campuran suatu senyawa, untuk pembuktian ada tidaknya
komponen yang dicari atau kemurnian komponen tersebut. Caranya dengan
membandingkan senyawa hasil sintesis dengan senyawa standar. Senyawa yang
murni akan memberikan bercak tunggal pada berbagai fase gerak dengan berbagai
tingkat kepolaran dan mempunyai harga Rf yang sama dengan senyawa
standarnya (Gasparic, 1978).
Teknik ini dilakukan dengan lempeng kaca yang dilapisi dengan fase
diam. Senyawa analit ditotolkan pada dasar lempeng fase diam dan dielusi dengan
fase gerak yang bergerak naik karena gaya kapilaritas (Bresnick, 2004).
Fase diam dibuat dari penjerap yang khusus digunakan untuk KLT.
Penjerap yang umum dipakai ialah silika gel, aluminium oksida, kieselguhr,
selulosa, dan lain-lain. Untuk analisis tebal penjerap 0,1 - 0,3 mm. Fase gerak
adalah medium angkut yang terdiri atas satu atau beberapa pelarut. Fase ini
bergerak dalam fase diam karena adanya gaya kapiler. Sistem pelarut
multi-komponen harus berupa campuran sesederhana mungkin terdiri atas maksimum
tiga komponen dan masing-masing harus murni. Campuran pelarut hanya boleh
14
berubah oleh penyerapan atau penguapan, komponen-komponen campuran pelarut
mungkin bereaksi satu sama lain (Stahl,1985).
Identifikasi dari komponen yang dianalisis memiliki prinsip bahwa setiap
komponen memiliki kondisi dan karakteristik pada kromatogram yang disebut
sebagai harga Rf . Karakteristik tersebut dapat berupa variasi dari harga Rf ,
ketajaman fluoresensi warna, dan lain-lain. Variasi harga Rf dibandingkan antara
senyawa yang dicari dengan standarnya (Gasparic, 1978).
I. Kromatografi Gas
Kromatografi gas merupakan instrument analitis yang memberikan
informasi baik kualitatif maupun kuantitatif mengenai komponen suatu sampel.
Sampel akan mengalami proses pemisahan dalam kolom, kemudian dideteksi dan
direkam sebagai pita elusi (Day and Underwood, 1996).
Data kromatografi gas biasanya terdiri atas waktu retensi berbagai
komponen campuran. Waktu retensi diukur mulai dari titik penyuntikan sampai
titik maksimum puncak dan sangat khas untuk senyawa tertentu pada kondisi
tertentu (kolom, suhu, gas pembawa, laju aliran). Adanya komponen tertentu
dapat diidentifikasi dengan cara spiking apabila tersedia senyawa murninya.
Senyawa murni ditambahkan kedalam cuplikan yang diduga mengandung
senyawa yang diinginkan dan dikromatografi. Jika puncak yang sesuai diperkuat
secara simetris pada dua sistem fase diam yang berlainan dan kepolarannya
15
J. Spektrometri Massa
Spektrometri massa merupakan suatu teknik yang digunakan dalam
penentuan berat molekul suatu senyawa. Untuk mendapatkan informasi yang
mungkin mengenai struktur suatu senyawa dapat dilakukan dengan mengukur
bobot molekul dari fragmen-fragmen ketika molekul mengalami pemecahan
(McMurry, 2008).
Dalam spektrometri massa, molekul-molekul organik ditembak dengan
elektron berenergi tinggi. Penembakan elektron pada suatu molekul menyebabkan
pelepasan elektronnya dan terbentuk ion melekul. Energi yang dibutuhkan untuk
penembakan dapat divariasikan, namun umumnya digunakan 70 eV. Pemecahan
molekul dengan elektron berkekuatan 7-15 eV tidak menghasilkan
pecahan-pecahan molekul yang dapat diidentifikasi, sedangkan dengan elektron diatas 70
eV akan dihasilkan fragmen yang sulit diidentifikasi, karena massa relatif
pecahannya sangat kecil. Ion molekuler merupakan suatu radikal kation, suatu
spesies yang kehilangan satu elektronnya sehingga bermuatan positif parsial
(Bruice, 1998).
Gambar 6. Penembakan elektron pada spektrometri massa
Ion-ion molekuler pecah menjadi fragmen kecil yang bersifat tidak stabil,
baik yang berbentuk radikal bebas maupun ion-ion lain. Fragmen yang bermuatan
16
baik yang tidak bermuatan atau radikal tidak dapat dideteksi dalam spektrometri
massa (Sastrohamidjojo, 2001).
Metode kromatografi gas – spektrometri massa (GC-MS) memberikan
keuntungan saat keduanya digunakan secara bersamaan. Proses pemisahan
dilakukan oleh kromatografi gas, sedangkan proses fragmentasi dilakukan oleh
spektrometri massa. Selain itu, metode ini juga dapat digunakan untuk hampir
semua jenis analit, memiliki batas deteksi yang rendah, dan memberikan
informasi penting tentang spektra massa dari suatu senyawa organik (Dean, 1995).
K. Image J
Image J (dari NIH free image analysis) merupakan suatu perangkat lunak
yang sudah mulai digunakan untuk banyak bidang, salah satunya adalah bidang
analisis kesehatan. Pada analisis, biasanya Image J diaplikasikan pada gambar
yang akan dianalisis. Image J digunakan untuk mendapatkan spektra kuantitatif
pada gambar yang akan kita analisis, sehingga dapat memberikan data berupa
perhitungan Area Under Curve (AUC) dari wilayah yang ingin diukur
(Wankhede, 2004).
Perhitungan data ini dilakukan berdasarkan intensitas warna pada wilayah
yang disoroti, dimana semakin tajam warna yang diukur, maka AUC akan
semakin besar. Sedangkan apabila wilayah yang disoroti memiliki warna pudar,
maka harga AUC akan kecil. Oleh karena itu pada Image J, gambar yang akan
dianalisis perlu diatur sedemikian rupa sehingga dapat dianalisis, bisa dengan
17
L. Landasan Teori
Eugenol telah diketahui mempunyai aktivitas sebagai antioksidan dengan
gugus hidroksi fenolik pada eugenol yang berperan sebagai penangkap radikal
bebas dalam mekanisme antioksidan. Modifikasi dengan penambahan gugus
t-butil pada eugenol akan meningkatkan aktivitas antioksidannya. Penambahan
gugus ini dilakukan dengan reaksi alkilasi Friedel-Crafts dengan katalis asam
lewis.
Reaksi alkilasi Friedel-Crafts adalah reaksi penambahan gugus alkil ke
dalam cincin benzen dengan menggunakan katalis asam Lewis. Prinsip
penambahan gugus alkil pada reaksi Friedel-Crafts adalah gugus alkil yang akan
ditambahkan memiliki karbokation pada salah satu atom C, yang kemudian akan
diserang oleh cincin benzen yang bermuatan negatif. Reaksi ini bergantung pada
penggunaan katalis, suhu pemanasan dan lama pemanasan. Reaksi alkilasi yang
dilakukan adalah reaksi penambahan gugus t-butil ke dalam cincin benzen dari
senyawa eugenol, dengan menggunakan katalis AlCl3. Karbokation pada atom C
tersier dari gugus t-butil akan diserang oleh muatan negatif dari ikatan rangkap
cincin benzen pada senyawa eugenol, sehingga gugus t-butil akan masuk pada
posisi orto dari gugus hidroksi eugenol.
Adanya gugus hidroksi pada eugenol yang bersifat sebagai aktifator dan
pengarah orto-para maka gugus t-butil akan masuk pada posisi orto dari gugus
hidroksi. Posisi para dari gugus hidroksi tidak dapat dimasuki gugus t-butil karena
sudah diduduki gugus propenil, sedangkan salah satu posisi orto dari eugenol
18
Gambar 7. Posisi orto-para dari gugus hidroksi eugenol
Salah satu batas dari reaksi Friedel-Crafts adalah pemanasan, dimana
pemanasan akan berpengaruh pada jumlah hasil sintesis yang didapatkan.
Semakin lama pemanasan akan meningkatkan jumlah hasil sintesis yang
didapatkan, karena pengaruh pemberian lama pemanasan pada suatu reaksi kimia
akan meningkatkan intensitas tumbukan antara starting material. Berdasarkan
teori tumbukan dari kinetika kimia, laju reaksi akan berbanding lurus dengan
banyaknya tumbukan molekul per detik atau berbanding lurus dengan frekuensi
tumbukan molekul. Hal ini berarti intensitas tumbukan antara starting material
akan meningkatkan kecepatan reaksi dan pembentukan senyawa target, sehingga
semakin panjang lama pemanasan akan menghasilkan senyawa target yang
banyak.
M. Hipotesis
a) Tersier-butil eugenol dapat dihasilkan dari reaksi alkilasi t-butil klorida
dengan eugenol menggunakan katalis aluminium klorida.
b) Lama pemanasan yang menghasilkan jumlah senyawa hasil sintesis yang
19 BAB III
METODE PENELITIAN
B. Jenis dan Rancangan Penelitian
Penelitian ini termasuk dalam penelitian eksperimental karena ada
perlakuan terhadap subjek uji, yaitu eugenol.
C. Variabel dan Definisi Operasional 2. Variabel Penelitian
a. Variabel bebas pada penelitian ini adalah lama pemanasan 3 jam, 5 jam
dan 7 jam.
b. Variabel tergantung pada penelitian ini adalah hasil sintesis t-butil eugenol
karena merupakan obyek yang kehadirannya akibat reaksi antara eugenol
dengan t- butil klorida.
c. Variabel pengganggu terkendali pada penelitian ini adalah suhu percobaan
dan kondisi peralatan.
3. Definisi operasional
a. Bahan awal adalah bahan yang digunakan untuk menghasilkan senyawa
dalam sintesis. Bahan awal yang digunakan dalam penelitian ini adalah
20
b. Katalis adalah suatu senyawa atau bahan yang digunakan dalam sintesis
untuk meningkatkan laju reaksi kimia dan mengoptimalkan hasil sintesis.
Dalam penelitian ini digunakan katalis aluminium klorida.
c. Molekul target adalah senyawa akhir yang diinginkan terbentuk dalam
sintesis. Molekul target dalam penelitian ini adalah t-butil eugenol.
D. Bahan Penelitian
Eugenol (p.a., Sigma), t-butil alkohol (p.a., Merck), alumunium klorida
anhidrat (p.a., Merck), aquadest, etil asetat (p.a., Merck), toluene (p.a., Merck),
dan Silika gel 60 GF254 (Merck), asam klorida (p.a., Merck), natrium klorida, dan
natrium bikarbonat.
E. Alat Penelitian
Alat yang digunakan meliputi alat-alat gelas, perangkat alat refluks,
perangkat kromatografi lapis tipis, stirer, pemanas elektrik (Heidolph MR2002),
timbangan elektrik (Mextler PM 100), mikropipet (Socorex Swiss), termometer,
thermopan (electrothermal 9100), kromatografi gas-spektrometer massa
(Shimadzu QP 2010S), dan lampu UV254 nm.
F. Tata Cara Penelitian
1. Sintesis t-butil klorida dari t-butil alkohol dengan asam klorida
Tersier-butil alkohol 15 ml dicampurkan dengan asam klorida (HCl) 40 ml
21
menit. Kemudian dimasukkan ke corong pisah dan diambil fase atasnya. Cuci
dengan 6 ml larutan natrium klorida jenuh, 6 ml larutan natrium bikarbonat,
dan 6 ml larutan natrium klorida jenuh, secara berturut-turut dan diambil
lapisan atasnya.
2. Sintesis t-butil eugenol dengan katalis aluminium klorida d. Sintesis t-butil eugenol dengan pemanasan 3 jam
Aluminium klorida (AlCl3) 4,3336 g dilarutkan dalam dietil eter 100 ml
dalam labu alas bulat. Kemudian ditambahkan t-butil klorida sebanyak 3,6
ml ke dalam labu alas bulat. Campuran dibiarkan semalam. Eugenol 1 ml
ditambahkan pada campuran diatas dan dipanaskan pada suhu 600C selama
3 jam.
e. Sintesis t-butil eugenol dengan pemanasan 5 jam
Aluminium klorida (AlCl3) 4,3336 g dilarutkan dalam dietil eter 100 ml
dalam labu alas bulat. Kemudian ditambahkan t-butil klorida sebanyak 3,6
ml ke dalam labu alas bulat. Campuran dibiarkan semalam. Eugenol 1 ml
ditambahkan pada campuran diatas dan dipanaskan pada suhu 600C selama
5 jam.
f. Sintesis t-butil eugenol dengan pemanasan 7 jam
Aluminium klorida (AlCl3) 4,3336 g dilarutkan dalam dietil eter 100 ml
dalam labu alas bulat. Kemudian ditambahkan t-butil klorida sebanyak 3,6
ml ke dalam labu alas bulat. Campuran dibiarkan semalam. Eugenol 1 ml
ditambahkan pada campuran diatas dan dipanaskan pada suhu 600C selama
22
2. Analisis hasil a. Uji organoleptis
Senyawa hasil sintesis diamati warna, bau dan bentuk dan dibandingkan
dengan eugenol. Adanya perbedaan sifat fisis senyawa hasil sintesis
dengan eugenol menunjukkan telah terbentuknya senyawa baru yang
berbeda dengan starting material eugenol.
b. Kromatografi lapis tipis (KLT)
Eugenol 1 ml diencerkan dengan dietil eter 100 ml digunakan sebagai
baku pembanding. Baku pembanding dan ketiga senyawa hasil sintesis
sebanyak 15 l ditotolkan pada lempeng silika gel 60 GF254 dengan
mikropipet, kemudian dielusi dengan fase gerak toluena : etilasetat (93:7)
dengan jarak elusi 15 cm dan dideteksi dengan sinar UV254 nm. Amati
bercak yang terdapat pada lempeng KLT. Bandingkan harga Rf senyawa
hasil sintesis dengan harga Rf eugenol. Jika harga Rf senyawa hasil
sintesis berbeda dengan harga Rf eugenol, maka didapatkan senyawa baru
yang berbeda dengan eugenol.
c. Elusidasi struktur dengan Spektrometri Massa
Senyawa hasil sintesis diidentifikasi strukturnya dengan
menggunakan kromatografi gas-spektroskopi massa. Masing-masing
spektrum yang dihasilkan dapat digunakan untuk menyimpulkan struktur
senyawa hasil sintesis.
Senyawa hasil sintesis dimasukkan ke dalam kamar pengion pada
23
terfragmentasi. Fragmen-fragmen tersebut melewati lempeng pemercepat
ion dan didorong menuju tabung analisator, dimana partikel-partikel akan
dibelokkan ke dalam medan magnet dan menimbulkan arus pada kolektor
yang sebanding dengan kelimpahan relatif setiap fragmennya. Kelimpahan
relatif setiap fragmen akan dicatat dan menghasilkan data spektrum massa.
Dari data spektrum yang dihasilkan tersebut, dilakukan interpretasi
sehingga dapat diperoleh informasi mengenai struktur senyawa hasil
sintesis.
d. Perhitungan jumlah senyawa hasil sintesis
Perhitungan jumlah senyawa hasil sintesis dilakukan dengan menggunakan
pengukuran ImageJ. Hasil foto elusi KLT senyawa hasil sintesis dipilih
salah satu yang menunjukkan bercak paling baik. Kemudian kontras dan
cahaya pada menu program ImageJ diatur hingga pada display
menunjukkan bercak tunggal yang batasnya jelas berbeda dengan latarnya.
Setelah itu gunakan rectangular selections untuk memetak wilayah bercak
yang akan dihitung dan pada kotak itu diberi nomor 1. Kemudian kotak
digeser ke bercak yang sejajar, kemudian diberi nomor 2, begitu pula pada
bercak nomor 3. Pada saat menandai kotak nomor 3, akan otomatis muncul
plots dari bercak yang disoroti tadi. Setelah itu, menu wand (tracing) tool
digunakan untuk mengetahui AUC dari bercak yang disoroti. Arahkan
wand (tracing) tool ke wilayah dibawah plot bercak, maka seketika akan
24 BAB IV
HASIL DAN PEMBAHASAN
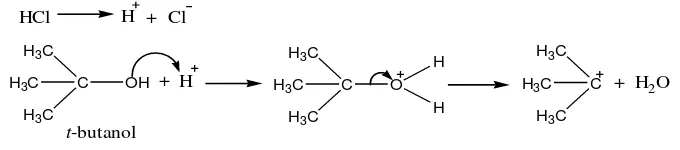
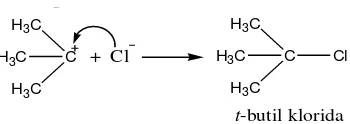
A. Sintesis tersier-butil klorida
Tersier-butil klorida merupakan starting material pada reaksi sintesis t
-butil eugenol. Pada penelitian ini t-butil klorida disintesis dari t-butil alkohol dan
asam klorida (HCl). Sintesis t-butil klorida berdasarkan reaksi substitusi,
nukleofilik, unimolekular (SN1). Mekanisme reaksinya memiliki dua tahap. Pada
tahap pertama HCl terionisasi menjadi ion H+ dan Cl-. Ion H+ memprotonasi
gugus hidroksi pada t-butil alkohol membentuk gugus pergi yang lebih baik, yaitu
gugus -OH2. Setelah itu akan terjadi pemutusan ikatan pada t-butil alkohol yang
terprotonasi menjadi karbokation t-butil dan H2O.
Gambar 8. Reaksi tahap pertama pembentukan t-butil klorida
Pada tahap kedua, terjadi reaksi antara karbokation t-butil dengan ion Cl
-membentuk t-butil klorida. Tahap kedua ini berlangsung cepat karena energi
aktivasi yang dibutuhkan untuk reaksi antara karbokation t-butil dan ion Cl- kecil.
25
Gambar 9. Reaksi tahap kedua pembentukan t-butil klorida
Reaksi antara t-butil alkohol dan HCl menghasilkan produk dengan dua
fase. Fase yang diambil adalah fase atas yang merupakan t-butil klorida,
sedangkan fase bawah merupakan campuran air dan HCl yang tersisa. Fase atas
dicuci dengan larutan natrium klorida (NaCl) jenuh dan larutan natrium
bikarbonat (NaHCO3) jenuh. Fungsi pencucian dengan larutan NaCl jenuh adalah
untuk menarik air yang masih berada dalam produk t-butil klorida yang
dihasilkan. Sedangkan fungsi pencucian dengan larutan NaHCO3 jenuh adalah
untuk menetralkan HCl yang tersisa pada produk t-butil klorida, dengan reaksi :
Gambar 10. Reaksi penetralan asam klorida
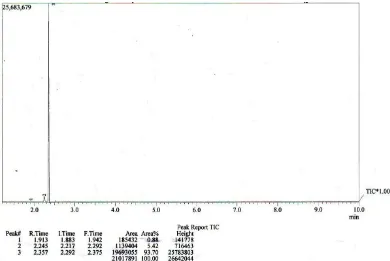
Tersier-butil klorida yang dihasilkan diuji kemurniannya dengan
kromatografi gas. Dari kromatogram yang didapatkan menunjukkan t-butil yang
dihasilkan murni, sehingga dapat digunakan sebagai starting material pada
sintesis t-butil eugenol.
26
Gambar 11. Kromatogram kromatografi gas tersier-butil klorida
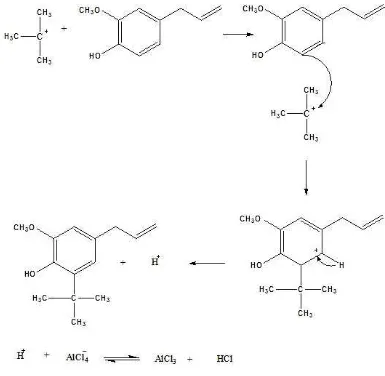
B. Sintesis tersier-butil eugenol dengan katalis aluminium klorida Sintesis senyawa t-butil eugenol berdasarkan pada reaksi alkilasi
Friedel-Crafts yang dilakukan dengan cara mereaksikan eugenol dengan t-butil klorida
menggunakan katalis AlCl3 anhidrat. Hal ini dikarenakan AlCl3 anhidrat lebih
mudah larut dalam pelarut dietil eter. Selain itu, apabila AlCl3 yang digunakan
AlCl3 hidrat, maka t-butil klorida dapat bereaksi dengan air sehingga menjadi
t-butanol dan asam klorida.
Sebelum direaksikan dengan eugenol, t-butil klorida dicampur dengan
AlCl3 anhidrat dan didiamkan selama semalam. Hal ini dilakukan untuk
memastikan seluruh t-butil klorida terbentuk menjadi karbokation tersier. Setelah
27
ditambahkan eugenol untuk menghasilkan t-butil eugenol. Reaksi t-butil klorida
dengan AlCl3 adalah:
Gambar 12. Mekanisme reaksi AlCl3 dan t-butil klorida
28
Gugus hidroksi pada eugenol bersifat sebagai aktifator dan pengarah
orto-para. Hal ini menyebabkan pada reaksi diatas, gugus t-butil akan masuk pada
posisi orto dari gugus hidroksi. Posisi para dari gugus hidroksi tidak dapat
dimasuki gugus t-butil karena sudah diduduki gugus metoksi dan gugus propenil.
Sifat utama gugus pengaktivasi, seperti gugus hidroksi pada eugenol,
adalah kemampuannya memberikan elektron-elektron pada cincin benzen
eugenol, sehingga membuat cincin benzen menjadi semakin kaya elektron. Cincin
benzen yang kaya elektron ini ketika bertemu dengan gugus t-butil, yang
merupakan karbokation, akan dapat bereaksi.
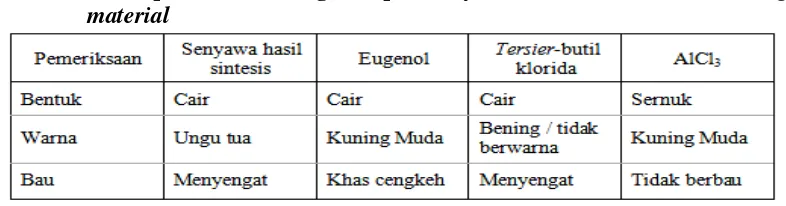
C. Analisis hasil 1. Uji organoleptis
Analisis senyawa hasil sintesis yang pertama dilakukan adalah pengujian
secara organoleptis untuk mengetahui sifat fisik dari senyawa hasil sintesis,
meliputi bentuk, warna, dan bau. Adanya perbedaan sifat fisis senyawa hasil
sintesis dengan starting material-nya menunjukkan telah terbentuknya senyawa
baru yang berbeda. Tabel I berikut menunjukkan hasil pemeriksaan organoleptis
senyawa hasil sintesis dengan starting material-nya sebagai pembanding.
29
Dari hasil pemeriksaan organoleptis diatas, maka dapat disimpulkan
senyawa hasil sintesis sudah berbeda dengan bahan awal, yaitu eugenol dan t-butil
klorida. Hal ini dapat dilihat dari bentuk, bau, dan warna dari senyawa hasil
sintesis yang berbeda dengan eugenol dan t-butil klorida.
2. Kromatografi lapis tipis
Kromatografi lapis tipis (KLT) dapat digunakan untuk mengetahui apakah
terbentuk senyawa hasil sintesis ataupun untuk mengetahui kemurnian senyawa
hasil sintesis. Dalam sistem KLT ini, digunakan fase diam silika gel GF 254 dan
fase gerak toluen : etil asetat (93:7) dan sebagai pembanding digunakan baku
eugenol, dengan jarak pengelusian 15 cm. Hasil bercak pengelusian kemudian
diamati dibawah sinar UV 254.
Silika gel GF 254 yang digunakan mengandung CaSO4 (gips) yang
mengandung indikator yang dapat berflouroresensi pada panjang gelombang 254
nm. Dengan indikator fluororesensi ini, akan menyebabkan bercak senyawa
mudah terdeteksi dengan adanya peredaman pada bercak dengan latar belakang
berfluororesensi hijau terang. Peredaman ini terjadi karena senyawa hasil sintesis
dan eugenol memiliki ikatan rangkap terkonjugasi atau gugus kromofor sehingga
pada waktu disinari dengan sinar UV 254 nm, sinar UV ini akan diabsorbsi oleh
gugus kromofor dari kedua senyawa tersebut. Sebagai akibatnya, sinar yang
mengena senyawa hasil sintesis dan eugenol tidak dapat mencapai indikator
fluororesensi dan tidak ada cahaya yang dipancarkan pada bercak tersebut dan
30
Pemilihan fase gerak toluen : etil asetat (93:7) didasarkan pada hasil
orientasi pengelusian eugenol. Orientasi fase gerak menggunakan 3 jenis
komposisi fase gerak, yaitu toluen : etil asetat (93:7), toluen, dan hexan : etil
asetat (90:10). Dari ketiga fase gerak yang diuji, fase gerak toluen : etil asetat
yang memberikan pemisahan yang paling baik, sehingga dalam penelitian ini
digunakan fase gerak toluen : etil asetat (93:7).
Dari hasil percobaan didapatkan hasil elusi sebagai berikut:
Gambar 14. Hasil elusi senyawa hasil sintesis
Fase gerak toluen : etil asetat (93:7) bersifat lebih non polar dibandingkan
fase diam silika gel GF 254, sehingga senyawa yang bersifat non polar akan lebih
31
bersifat lebih non polar daripada eugenol, karena memiliki tambahan gugus
t-butil, sehingga diprediksikan akan terbentuk bercak diatas bercak eugenol baku.
Tabel II. Nilai Rf Kromatografi Lapis Tipis Senyawa Hasil Sintesis Dengan Fase Gerak Toluena : Etil Asetat (93:7)
Senyawa Nilai Rf
Eugenol standar Bercak A = 0,61 Hasil sintesis dengan katalis
AlCl3 dengan pemanasan selama 3 jam
Bercak B = 0,61
Bercak E = 0,82
Hasil sintesis dengan katalis AlCl3 dengan pemanasan selama 5 jam
Bercak C = 0,61
Hasil sintesis dengan katalis AlCl3 dengan pemanasan selama 7 jam
Bercak D = 0,61
Dapat dilihat pada hasil elusi, pada hasil sintesis dengan pemanasan
selama 3 jam, terdapat 2 bercak. Bercak yang pertama adalah bercak yang sejajar
dengan baku eugenol, dengan nilai Rf 0,61. Hal ini menunjukkan bahwa pada
senyawa hasil sintesis dengan pemanasan selama 3 jam masih terdapat eugenol.
Bercak kedua adalah bercak baru dengan Rf 0,82. Hal ini menunjukkan pada
lama pemanasan 3 jam terbentuk senyawa baru yang bersifat lebih non polar
dibandingkan eugenol, karena Rf dari bercak ini lebih besar daripada Rf
eugenol standar, sehingga lebih terbawa oleh fase gerak yang bersifat non polar
dan terelusi lebih tinggi dibandingkan eugenol. Tersier-butil eugenol merupakan
senyawa yang lebih non polar dibandingkan eugenol, karena pada t-butil eugenol
32
Berdasarkan hal itu, maka diasumsikan bahwa bercak dengan nilai Rf 0,82
adalah bercak dari senyawa hasil sintesis.
Pada hasil sintesis dengan pemanasan 5 jam dan 7 jam hanya
menunjukkan masing-masing satu bercak, yakni bercak dengan nilai Rf 0,61,
yang menunjukkan bahwa hasil sintesis yang didapatkan masih eugenol dan tidak
terbentuk t-butil eugenol. Sementara itu, bercak yang tidak terelusi merupakan
senyawa lain yang dapat berupa sisa starting material ataupun senyawa hasil
reaksi samping dari sintesis t-butil eugenol yang tidak terelusi dengan fase gerak
toluen : etil asetat (93:7). Namun, untuk mengetahui apa senyawa tersebut tidak
dapat digunakan analisis dengan KLT. Sehingga diperlukan analisis lebih lanjut
dengan kromatografi gas-spektroskopi massa.
4. Kromatografi Gas – Spektroskopi Massa
Untuk memperkuat hasil analisis dengan KLT, maka digunakan
kromatografi gas bersama dengan spektroskopi massa (GC-MS) untuk mengetahui
komponen dalam senyawa hasil sintesis. Senyawa hasil sintesis yang dianalisis
dengan GC-MS adalah senyawa hasil sintesis dengan lama pemanasan selama 3
jam, karena pada hasil elusi dengan kromatografi lapis tipis hasil sintesis dengan
lama pemanasan selama 3 jam menunjukkan bercak baru.
Pada GC-MS, proses pemisahan dilakukan oleh kromatografi gas,
sedangkan proses fragmentasi dilakukan oleh spektrometri massa. Metode ini
dapat digunakan untuk memberikan informasi penting tentang spektrum massa
33
komponen senyawa hasil sintesis yang masih bercampur dengan senyawa lain,
maka senyawa lain ini dapat dipisahkan. Pemisahan ini bertujuan untuk
mendapatkan hasil yang baik pada pengelusidasian senyawa hasil sintesis dengan
spektroskopi massa. Dengan demikian, diharapkan spektrum yang dihasilkan pada
spektroskopi massa adalah benar-benar murni berasal dari senyawa hasil sintesis.
Pengujian senyawa hasil sintesis dengan GC dilakukan dilaboratorium
MIPA Universitas Gadjah Mada Yogyakarta. Dari uji tersebut diperoleh data
kromatogram GC yang diperlihatkan pada gambar 11. Dari gambar kromatogram
dapat dilihat bahwa senyawa hasil sintesis yang diuji menghasilkan 33 puncak.
Hal ini menunjukkan bahwa senyawa hasil sintesis belum murni.
Gambar 15. Kromatogram kromatografi gas senyawa hasil sintesis Setelah terjadi pemisahan komponen senyawa hasil sintesis dengan
34
dengan spektroskopi massa. Spektrum massa yang dihasilkan dari spektrometer
massa dapat digunakan untuk menentukan bobot molekul senyawa hasil sintesis
dan untuk penyelidikan kerangka molekul senyawa hasil sintesis melalui
interpretasi fragmen-fragmennya.
Pada spektroskopi massa senyawa hasil sintesis, molekul senyawa hasil
sintesis ditembak dengan elektron berenergi tinggi sehingga salah satu elektron
valensinya akan lepas dan pecah menjadi fragmen-fragmen dengan m/z lebih
kecil, baik berupa radikal bebas, fragmen netral, maupun ion-ion.
Gambar 16. Spektrum massa senyawa hasil sintesis pada waktu retensi 12,292 menit
Keterangan:
A = Peak dengan m/z = 41 menunjukkan fragmen [C3H5]+ B = Peak dengan m/z = 57 menunjukkan fragmen [C4H9]+
C = Peak dengan m/z = 355 menunjukkan fragmen [C14H19O2AlCl3]+
Dari hasil elusidasi ini, diketahui bahwa pada senyawa hasil sintesis telah
terbentuk t-butil eugenol. Bobot molekul t-butil eugenol adalah 220, namun pada
gambar spektrum diatas tidak ada yang menunjukkan peak dengan rasio m/z =
220. Peak C pada gambar spektrum diatas terdapat peak dengan rasio m/z = 355
yang merupakan peak dari t-butil eugenol tapi masih dalam bentuk mengikat
katalis, yaitu AlCl3, sehingga rasio m/z yang terukur adalah bobot molekul t-butil
35
Interaksi antara t-butil eugenol dengan AlCl3 dapat terjadi dikarenakan
AlCl3 merupakan akseptor elektron sedangkan gugus OH pada t-butil eugenol
merupakan pendonor elektron, sehingga dapat terjadi interaksi antara keduanya.
AlCl3 yang memiliki orbital kosong akan menerima elektron dari pasangan
elektron bebas yang ada pada atom O dari gugus hidroksi t-butil eugenol, dengan
interaksi pada gambar 14 dibawah ini.
Gambar 17. Interaksi t-butil eugenol dengan AlCl3
36
Pada gambar 12 diatas, peak A dengan m/z = 41, merupakan fragmen yang
mengalami pemutusan setelah ditembak dengan elektron berenergi tinggi
membentuk ion propenil dan peak B dengan m/z = 57 merupakan fragmen
[C4H9]+ yaitu radikal t-butil yang mengalami pemutusan dari posisi orto dari
gugus hidroksi eugenol setelah ditembak dengan elektron berenergi tinggi.
Kelemahan dari analisis dengan kromatografi gas-spektroskopi massa pada
metode penelitian ini adalah tidak dapat memastikan senyawa yang terbentuk
adalah t-butil eugenol, karena pada kromatogram kromatografi gas, terdapat 33
peak yang berarti terdapat 33 jenis senyawa dalam senyawa hasil sintesis.
Sehingga tidak dapat dipastikan peak mana yang merupakan t-butil eugenol. Oleh
karena itu, diperlukan suatu metode analisis kualitatif lain terhadap senyawa hasil
sintesis. Analisis kualitatif yang dapat dilakukan adalah KLT preparatif dengan
mengambil bercak senyawa hasil sintesis pada hasil elusi KLT, kemudian
dilakukan analisis dengan spektroskopi inframerah (IR) untuk mengetahui gugus
fungsional yang terdapat dalam senyawa hasil sintesis, atau dapat juga dengan
spektroskopi resonansi magnetik inti (NMR) yang dapat memberikan informasi
struktural mengenai atom-atom hidrogen dalam suatu molekul organik.
D. Variasi Pemanasan
Salah satu batasan dari reaksi Friedel-Crafts adalah pemanasan, dimana
pemanasan akan berpengaruh pada jumlah hasil sintesis yang didapatkan. Pada
umumnya pada suatu reaksi sintesis, semakin lama pemanasan akan
37
lama pemanasan pada suatu reaksi kimia berpengaruh pada kecepatan reaksi dan
kecepatan terbentuknya senyawa target. Adanya energi dari pemanasan akan
meningkatkan pergerakan molekul t-butil klorida dan eugenol, sehingga kontak
atau tumbukan antar keduanya akan semakin besar dan mempercepat reaksi
pembentukan t-butil eugenol.
Variasi lama pemanasan ini bertujuan untuk melihat pada lama pemanasan
mana yang dapat menghasilkan t-butil eugenol dalam jumlah terbanyak. Lama
pemanasan divariasi 3 jam, 5 jam, dan 7 jam. Pemilihan waktu ini berdasarkan
hasil orientasi, dimana pada umumnya reaksi sintesis berlangsung 3 jam,
kemudian divariasikan dengan interval 2 jam, untuk melihat perbedaan antara
ketiga hasil sintesis apabila lama pemanasan divariasikan.
Dari bercak hasil uji KLT yang didapatkan, dapat dilakukan perhitungan
jumlah senyawa hasil sintesis dengan menggunakan Image J. Perhitungan
dilakukan pada senyawa hasil sintesis dengan pemanasan 3 jam dengan
didapatkan nilai area under curve (AUC) 39589, sedangkan pada lama pemanasan
5 jam dan 7 jam, tidak didapatkan bercak t-butil eugenol, sehingga tidak dapat
dihitung jumlahnya dengan Image J.
Hal ini menunjukkan variasi lama pemanasan mempengaruhi reaksi
pembentukan dan jumlah hasil sintesis t-butil eugenol yang dihasilkan. Semakin
lama pemberian pemanasan pada reaksi sintesis tidak diiringi dengan
pembentukan t-butil eugenol yang semakin banyak. Senyawa baru hasil sintesis
yang semula terbentuk pada lama pemanasan selama 3 jam, dengan diberi
38
tidak terbentuk. Hal ini menunjukkan senyawa hasil sintesis pada lama pemanasan
5 jam dan 7 jam mengalami dekomposisi senyawa.
Dekomposisi adalah proses peruraian suatu senyawa kimia sebagai akibat
dari pengaruh lingkungan pada jangka waktu tertentu. Terjadinya dekomposisi
senyawa kimia dapat disebabkan dari pH lingkungan, suhu, kelembaban, akibat
hidrolisis, ataupun solvolisis dari senyawa organik. Hal ini umum terjadi dan
gugus-gugus fungsional tertentu memudahkan terjadinya reaksi tersebut
(Parrot,1970).
Berdasarkan faktor-faktor penyebab dekomposisi diatas, hidrolisis dan
solvolisis bukan merupakan penyebab dekomposisi senyawa hasil sintesis pada
penelitian ini. Hal ini dikarenakan pada sintesis t-butil eugenol, tidak
menggunakan starting material berupa air sehingga tidak terdapat kemungkinan
terjadi hidrolisis. Sedangkan kemungkinan terjadi solvolisis juga tidak mungkin
terjadi karena pada sintesis ini digunakan pelarut dietil eter yang merupakan
pelarut non polar aprotik yang tidak memiliki proton asam, tidak bersifat donor
maupun akseptor, sehingga dalam reaksi sintesis ini tidak akan mempengaruhi
reaksi yang terjadi (inert). Kondisi pH lingkungan dan kelembaban lingkungan
pada penelitian ini tidak diperhatikan oleh peneliti, namun tidak berpengaruh pada
reaksi sintesis.
Faktor yang mungkin menjadi penyebab dekomposisi senyawa baru hasil
sintesis adalah suhu percobaan. Suhu percobaan yang digunakan adalah 60oC.
Dari 3 hasil sintesis, yaitu hasil sintesis dengan lama pemanasan selama 3 jam, 5
39
pemanasannya. Pada hasil sintesis dengan lama pemanasan selama 3 jam
terbentuk senyawa baru, sedangkan pada hasil sintesis dengan lama pemanasan
selama 5 jam dan 7 jam mengalami dekomposisi senyawa. Dari data ini terlihat
bahwa semakin lama pemaparan suhu pemanasan, senyawa baru hasil sintesis
akan terdekomposisi. Hal ini disebabkan semakin panjang lama pemanasan,
energi di dalam reaksi akan meningkat sehingga menyebabkan ketidakstabilan
senyawa baru hasil sintesis dan mengalami dekomposisi.
Berdasarkan hasil penelitian ini, lama pemanasan 3 jam merupakan lama
pemanasan yang paling baik dibandingkan dengan lama pemanasan 5 jam dan 7
40 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan uji organoleptis, kromatografi lapis tipis, kemudian yang
ditegaskan dengan spektroskopi massa, maka dapat disimpulkan bahwa:
1. Tersier-butil eugenol dapat dihasilkan dari reaksi alkilasi t-butil klorida
dengan eugenol menggunakan katalis aluminium klorida.
2. Lama pemanasan yang menghasilkan jumlah senyawa hasil sintesis yang
paling banyak bukan lama pemanasan selama 7 jam, karena pada lama
pemanasan 3 jam diperoleh t-butil eugenol, sedangkan pada lama pemanasan 5
dan 7 jam tidak diperoleh t-butil eugenol.
B. Saran
Dalam penelitian lebih lanjut mengenai sintesis t-butil eugenol dari t-butil
klorida dengan eugenol, perlu dilakukan:
1. Pemurnian senyawa hasil sintesis.
2. Analisis kualitatif dan kuantitatif terhadap t-butil eugenol dengan metode
lainnya.
41 Royal Society of Chemistry, Cambridge, UK
Anonim, 2004, Efek Dari Katalis, www.chem-is-try.org, diakses pada tanggal 18 November 2009
Anonim, 2008, Safety Data Sheet Diethyl Ether, www.lindchem.com, diakses pada tanggal 18 November 2009
Ardyansyah, 2007, Antioksidan dan Peranannya Bagi Kesehatan, http://www.iptek.com, diakses pada tanggal 10 April 2008
Bresnick, M.D, 2004, Intisari Kimia Organik, 96-99, 101-107, Penerbit Hipokrates, Jakarta
Bruice, P.Y., 1998, Organic Chemistry, 2nd edition, 953, 955, 960, Prentice Hall, New Jersey
Day, Jr., R.A. and Underwood, A.L., Analisis Kimia Kuantitatif, diterjemahkan oleh Pudjaatmaka, A. H., Edisi IV, 519, Penerbit Erlangga, Jakarta
Dean, J.A., 1995, Analytical Chemistry Handbook, 13, 26, McGraw-Hill, Inc., New York
Fessenden dan Fessenden, 1986, Kimia Organik, diterjemahkan oleh Pudjaatmaka, A.H., Jilid 1, Edisi III, 31, 186-188, Erlangga, Jakarta
Fessenden dan Fessenden, 1986, Kimia Organik, diterjemahkan oleh Pudjaatmaka, A.H., Jilid 2, Edisi III, 171, Erlangga, Jakarta