SINTESIS BUTIL EUGENOL DARI EUGENOL DAN TERSIER-BUTIL KLORIDA DENGAN KATALIS BESI (III) KLORIDA :
TINJAUAN TERHADAP VARIASI SUHU REAKSI
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh : Linda Setiawati NIM : 068114052
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2009
SINTESIS BUTIL EUGENOL DARI EUGENOL DAN TERSIER-BUTIL KLORIDA DENGAN KATALIS BESI (III) KLORIDA :
TINJAUAN TERHADAP VARIASI SUHU REAKSI
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh : Linda Setiawati NIM : 068114052
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
Skripsi
Sintesis Tersier-Butil Eugenol dari Eugenol dan Tersier-Butil Klorida dengan Katalis Besi (III) Klorida : Tinjauan Terhadap Variasi Suhu Reaksi
Yang diajukan oleh :
Linda Setiawati
NIM : 068114052
telah disetujui oleh
Pembimbing :
Dra. M.M. Yetty Tjandrawati, M.Si. tanggal 16 November 2009
Karena begitu besar kasih Allah akan dunia ini, sehingga Ia
telah mengaruniakan Anak-Nya yang tunggal, supaya setiap
orang yang percaya kepada-Nya tidak binasa, melainkan beroleh
hidup yang kekal
(Yohanes 3:16)
Tuhan akan mengangkat engkau menjadi kepala dan bukan menjadi
ekor, engkau akan tetap naik dan bukan turun, apabila engkau
mendengarkan perintah Tuhan, Allahmu, yang kusampaikan pada
hari ini kaulakukan dengan setia
(Ulangan 28:13)
Mintalah, maka akan diberikan kepadamu; carilah, maka kamu
akan mendapatkan; ketoklah, maka pintu akan dibukakan bagimu
(Matius 7:7)
Kupersembahkan karya kecilku ini untuk Tuhan Bapaku,
Keluarga dan Jerry tercinta, serta Almamaterku
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma :
Nama : Linda Setiawati Nomor Mahasiswa : 068114052
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul :
Sintesis Tersier-Butil Eugenol dari Eugenol dan Tersier-Butil Klorida dengan Katalis Besi (III) Klorida : Tinjauan Terhadap Variasi Suhu Reaksi
beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, me-ngalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan mempublikasikannya di Internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya maupun memberikan royalti kepada saya selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini yang saya buat dengan sebenarnya.
Dibuat di Yogyakarta
Pada tanggal : 7 Januari 2009
Yang menyatakan
PRAKATA
Pujian, hormat, serta syukur senantiasa penulis panjatkan kepada Tuhan
Yesus Kristus, Allah, dan Bapa kami karena hanya oleh berkat, anugerah,
kemurahan, kasih setia, dan penyertaan-Nya penulis dapat menyelesaikan laporan
akhir yang berjudul “Sintesis Tersier-Butil Eugenol dari Eugenol dan
Tersier-Butil Klorida dengan Katalis Besi (III) Klorida : Tinjauan Terhadap Variasi Suhu
Reaksi” ini guna memenuhi salah satu syarat untuk memperoleh gelar Sarjana
Strata Satu Program Studi Ilmu Farmasi (S.Farm.).
Penulis menyadari bahwa penulisan skripsi ini bukanlah sesuatu hal yang
mudah, hanya dengan bantuan dan dukungan dari berbagai pihak penulis mampu
menyelesaikan skripsi ini. Oleh karena itu, penulis mengucapkan terima kasih
kepada :
1. Rita Suhadi M.Si., Apt., selaku Dekan Fakultas Farmasi Universitas Sanata
Dharma Yogyakarta.
2. Dra. M.M. Yetty Tjandrawati, M.Si., selaku dosen pembimbing yang telah
memberikan dukungan, bimbingan, masukan, kritik, dan saran kepada penulis.
3. Jeffry Julianus, M.Si., selaku dosen penguji yang telah memberikan dukungan,
bimbingan, masukan, kritik, dan saran kepada penulis.
4. Lucia Wiwid Wijayanti, M.Si., selaku dosen penguji yang telah memberikan
masukan, kritik, dan saran kepada penulis.
5. Yohanes Dwiatmaka, M.Si., selaku Kepala Laboratorium Farmasi atas izin
yang diberikan sehingga penulis dapat melakukan penelitian di laboratorium.
6. Pak Parlan, Pak Kunto, Pak Bimo, dan segenap laboran Fakultas Farmasi yang
telah membantu berlangsungnya penelitian.
7. Orangtua tercinta yang telah merawat, membesarkan, dan mendidik penulis,
serta telah memberi dukungan baik materiil maupun spirituil dan juga atas
kasihnya yang tiada terkira.
8. Tante Sri Lestari atas dukungan dan bantuannya, baik materiil maupun
spirituil serta persaudaraan yang luar biasa.
9. Kekasihku Yeremia Priyadi, atas dukungan, kesabaran, pertolongan, dan cinta
kasihnya yang tiada terkira, yang senantiasa memberikan semangat dan
kebahagiaan bagi penulis.
10.Keluarga Yeremia Priyadi, atas dukungan dan kepeduliannya.
11.Teman-teman satu kelompok penelitian, Handa, Marissa, Vita, dan Jati atas
kerjasama, kekompakan, dan persahabatannya sejak awal, pertengahan, hingga
akhir penelitian.
12.Teman-teman komsel pemuridan : Anjas Wati, Monic, Yanti, Yuli, Anita,
Fung, Intan, dan Viva atas persahabatan dan dukungan di dalam doa.
13.Teman-teman komsel penginjilan : Reni, Iren, Eka, Nisia, Wiwit, Kaka, dan
Monika, Lina Chang atas persahabatan dan dukungan di dalam doa.
14.Teman-teman kelas A angkatan 2006, khususnya Henny atas persahabatan dan
diskusi yang terjalin selama perkuliahan.
15.Teman-teman kelompok praktikum A FST 2006, khususnya Uut, Nika, dan
16.Semua pihak yang telah membantu penulis dalam menyelesaikan penelitian ini
yang tidak bisa penulis sebutkan satu-persatu.
Akhirnya, dengan segala kerendahan hati penulis menyadari bahwa skripsi
ini jauh dari sempurna karena keterbatasan pikiran, waktu, dan tenaga. Oleh
karena itu, penulis sangat mengharapkan kritik dan saran yang membangun agar
skripsi ini menjadi lebih sempurna. Akhir kata, semoga skripsi ini bermanfaat
bagi pembaca semua.
Yogyakarta, 16 November 2009
Penulis
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini
tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan
dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 16 November 2009
Penulis
Linda Setiawati
INTISARI
Eugenol merupakan senyawa antioksidan alami dengan aktivitas lemah. Dilakukan modifikasi struktur eugenol untuk meningkatkan aktivitas antioksidan dengan menambahkan gugus tersier-butil pada posisi orto dari gugus fenolik melalui reaksi alkilasi Friedel-Craft yang diharapkan menghasilkan senyawa t -butil eugenol. Pada sintesis t-butil eugenol digunakan 3 variasi suhu reaksi dan diharapkan dapat diketahui suhu reaksi yang menghasilkan senyawa t-butil eugenol terbanyak.
Sintesis t-butil eugenol dilakukan dengan melarutkan besi (III) klorida anhidrat 5,2722 g dalam dietil eter. Larutan FeCl3 ini ditambah dengan t-butil
klorida 3,6 mL dan didiamkan selama 12 jam. Pada campuran tersebut ditambahkan eugenol 1 mL dan di reflux selama 3 jam. Dilakukan variasi pemanasan pada suhu 40oC, 600C dan 800C.
Senyawa hasil sintesis berupa larutan berwarna coklat kehitaman. Pengujian dengan kromatografi lapis tipis menunjukkan terdapat senyawa baru dengan nilai Rf senyawa hasil sintesis lebih besar dari nilai Rf eugenol.
Peningkatan jumlah senyawa hasil sintesis terbesar diperoleh pada suhu 80oC yaitu 1.096,280 % berdasar analisis area dibawah kurva (ADK) dengan program
ImageJ. Hasil analisis dengan kromatografi gas menunjukkan terdapat 42 macam senyawa hasil sintesis. Berdasarkan hasil elusidasi struktur dengan spektrometri massa dapat disimpulkan bahwa salah satu senyawa hasil sintesis adalah di-t-butil eugenol.
Kata kunci : eugenol, di-t-butil eugenol, alkilasi Friedel-Craft, variasi suhu
ABSTRACT
Eugenol is a natural antioxidant compound that has weak antioxidant activity. It was needed to modify eugenol structure to increase antioxidant activity with added tertiary butyl on orto position to phenolic group with Friedel-Craft alkylation that was expected to produce t-butyl eugenol. In t-butyl eugenol synthesis was used 3 variation reaction temperature and was expected to produce the most t-butyl eugenol.
Tertiary butyl eugenol synthesis was done by dissolving ferric chloride anhydrous 5.2722 g on ethoxyethane. This ferric chloride solution was added with t-butyl chloride 3.6 mL, and waited for 12 hours. The mixture was added with eugenol 1 mL and refluxed for 3 hours. It was heated on 40oC, 600C, and 800C.
Synthetic product was brown blackish solution. Analysis with thin layer chromatography showed that there was a new compound which had Rf value
greater than eugenol. The greatest increasing total synthetic product that was obtained on 80oC was 1,096.280 % based on Area Under Curve (AUC) with ImageJ. Gas chromatography showed that there were 42 compounds in products. Based on structure elucidation with mass spectrometry showed that ones of synthetic product was di-t-butyl eugenol.
DAFTAR ISI
Halaman
HALAMAN JUDUL ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
HALAMAN PERSEMBAHAN ... v
HALAMAN PERNYATAAN PUBLIKASI ... vi
PRAKATA ... vii
PERNYATAAN KEASLIAN KARYA ... x
INTISARI ... xi
A. Eugenol sebagai Antioksidan ... 4
B. Sintesis t-Butil Klorida ... 6
C. Sintesis t-Butil Eugenol dengan Variasi Suhu Reaksi ... 7
D. Pengaruh Pelarut ... 11
E. Analisis Senyawa Hasil Sintesis ... 12
1. Kromatografi lapis tipis (KLT) ... 12
2. Kromatografi gas ... 14
3. Elusidasi Struktur dengan Spektrometri Massa ... 15
4. Perhitungan Jumlah Senyawa Hasil Sintesis dengan Program ImageJ ... 16
F. Landasan Teori ... 17
G. Hipotesis ... 18
BAB III. METODE PENELITIAN ... 19
A. Jenis dan Rancangan Penelitian ... 19
B. Definisi Operasional ... 19
C. Variabel Penelitian ... 19
D. Bahan Penelitian ... 20
E. Alat Penelitian ... 20
F. Tata Cara Penelitian ... 20
1. Sintesis t-butil klorida sebagai starting material ... 20
2. Sintesis t-butil eugenol dengan katalis besi (III) klorida (FeCl3) pada variasi suhu reaksi ... 21
a. Sintesis t-butil eugenol pada suhu 40oC ... 21
c. Sintesis t-butil eugenol pada suhu 80oC ... 21
3. Analisis Senyawa Hasil Sintesis ... 22
a. Uji organoleptis ... 22
b. Kromatografi lapis tipis (KLT) ... 22
c. Kromatografi gas (KG) ... 23
d. Perhitungan jumlah senyawa hasil sintesis ... 23
e. Elusidasi struktur dengan spektroskopi massa ... 24
BAB IV. HASIL DAN PEMBAHASAN ... 25
A. Sintesis t-Butil Eugenol dengan Variasi Suhu Reaksi ... 25
B. Analisis Senyawa Hasil Sintesis ... 29
1. Uji organoleptis ... 29
2. Uji kromatografi lapis tipis (KLT) ... 30
3. Kromatografi gas ... 33
4. Perhitungan jumlah senyawa hasil sintesis ... 34
5. Elusidasi senyawa hasil sintesis ... 35
BAB V. KESIMPULAN DAN SARAN ... 41
A. Kesimpulan ... 41
B. Saran ... 41
DAFTAR PUSTAKA ... 42
LAMPIRAN ... 45
BIOGRAFI ... 69
DAFTAR TABEL
Halaman
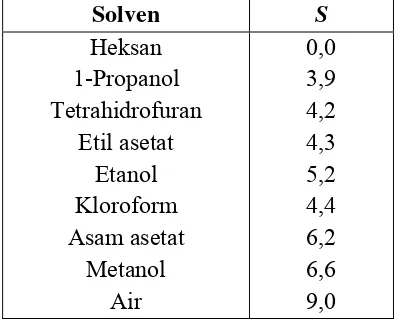
Tabel I. Parameter Empiris Kekuatan Pelarut (S)... 13 Tabel II. Hasil Pemeriksaan Organoleptis Senyawa Hasil Reaksi dengan
Eugenol ... 29
Tabel III. Hasil Uji Kromatografi Lapis Tipis Senyawa Hasil Sintesis ... 32
DAFTAR GAMBAR
Halaman
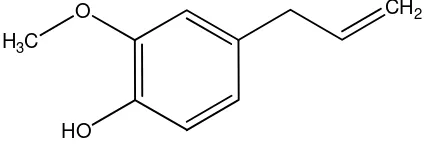
Gambar 1. Struktur Eugenol ... 5
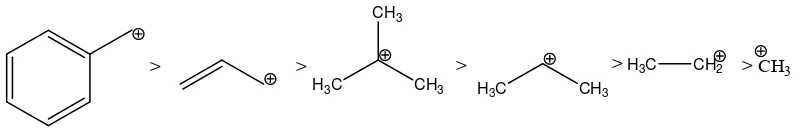
Gambar 2. Kestabilan Karbokation ... 7
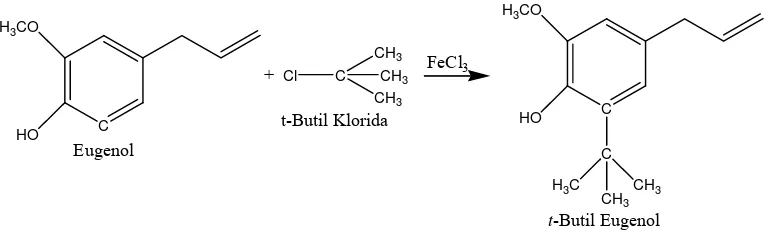
Gambar 3. Reaksi Pembentukan t-Butil Eugenol ... 8
Gambar 4. Pengaruh Katalis dalam Penurunan Energi Aktivasi ... 8
Gambar 5. Pengaruh Suhu Terhadap Distribusi Energi Tumbukan ... 10
Gambar 6. Reaksi Transfer Proton ... 11
Gambar 7. Mekanisme Reaksi Sintesis t-Butil Eugenol ... 18
Gambar 8. Mekanisme Sintesis t-Butil Klorida ... 25
Gambar 9. Penomoran Cincin Benzena untuk Substitusi Gugus t-Butil ... 28
Gambar 10. Profil Bercak Uji Kromatografi Lapis Tipis ... 31
Gambar 11. Kromatogram Kromatografi Gas Standar Eugenol ... 33
Gambar 12. Kromatogram Kromatografi Gas Senyawa Hasil Sintesis ... 33
Gambar 13. Spektrum Massa Standar Eugenol ... 35
Gambar 14. Spektrum Massa Senyawa Hasil Sintesis ... 35
Gambar 15. Fragmentasi di-t-Butil Eugenol ... 37
Gambar 16. Mekanisme Sintesis di-t-Butil Eugenol ... 39
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Perhitungan Jumlah Reaktan yang Dipergunakan ... 45
Lampiran 2. Rangkaian Alat Sintesis Tersier-Butil Eugenol ... 47 Lampiran 3. Hasil Uji Organoleptis Senyawa Hasil Sintesis ... 48
Lampiran 4. Perhitungan Nilai Rf Analisis dengan Kromatografi Lapis
Tipis ... 49
Lampiran 5. Perhitungan Jumlah Senyawa Hasil Sintesis... 50
Lampiran 6. Spesifikasi Kromatografi Gas-Spektrometer Massa
Standar Eugenol ... 51
Lampiran 7. Kromatogram Kromatografi Gas Standar Eugenol ... 52
Lampiran 8. Spesifikasi Kromatografi Gas-Spektrometer t-Butil Klorida ... 53 Lampiran 9. Kromatogram Kromatografi Gas t-Butil Klorida ... 54 Lampiran 10. Spektrum Massa t-Butil Klorida ... 55 Lampiran 11. Spesifikasi Kromatografi Gas-Spektrometer Senyawa Hasil
Sintesis ... 56
Lampiran 12. Kromatogram Kromatografi Gas Senyawa Hasil Sintesis ... 57
BAB I PENGANTAR
A. Latar Belakang
Paparan kronik sinar matahari khususnya sinar ultraviolet (UV) yang
berlebihan pada kulit dapat menyebabkan berbagai reaksi biokimia. Efek
merugikan dari radiasi sinar UV dapat dikurangi dengan penggunaan senyawa
antioksidan yang dapat mengontrol produksi radikal bebas dan stress oksidatif
yang dihasilkan akibat radiasi UV (Morquio et al., 2005).
Eugenol merupakan metabolit sekunder yang berasal dari tanaman
cengkeh (Syzygium aromaticum, (Linn.) Merr) yang memiliki gugus hidroksi (-OH) fenolik yang berperan sebagai penangkap radikal bebas dalam mekanisme
aktivitas antioksidan. Keberadaan eugenol yang melimpah di Indonesia menurut
Sastrohamidjojo (2008), menunjukkan bahwa eugenol potensial untuk
dikembangkan sebagai senyawa antioksidan dari bahan alam. Namun berdasarkan
pengujian yang dilakukan oleh Ogata (2000) menunjukkan bahwa aktivitas
eugenol sebagai antioksidan bersifat lemah dengan nilai IC50 > 800 μM,
berdasarkan metode 2,2-difenil-1-pikril hidrazil (DPPH).
Modifikasi struktur terhadap eugenol telah dilakukan oleh Ogata (2000)
dengan menambahkan gugus meruah didekat gugus hidroksi yang terbukti dapat
meningkatkan aktivitasnya sebagai senyawa antioksidan. Keberadaan gugus
meruah berupa tersier-butil pada senyawa Butylated Hydroxytoluene (BHT) dapat menyebabkan BHT poten sebagai antioksidan dengan nilai IC50 = 0,31 μM (Uto,
2002). Pada penelitian ini dilakukan penambahan gugus meruah berupa
tersier-butil pada posisi orto dari gugus hidroksi fenolik eugenol yang diharapkan dapat menghasilkan senyawa t-butil eugenol dengan aktivitas antioksidan lebih baik daripada eugenol.
Reaksi sintesis ini didasarkan pada reaksi alkilasi Friedel-Craft dengan
menggunakan eugenol dan alkil halida seperti t-butil klorida sebagai starting material serta FeCl3 sebagai katalis yang diharapkan dapat menghasilkan senyawa
t-butil klorida. Besi (III) klorida merupakan katalis asam Lewis yang bersifat cukup kuat (Segi, et al., 1980), sehingga reaksi dapat berlangsung dalam suasana lembut (mild) dan diharapkan diperoleh jumlah t-butil eugenol yang lebih besar.
Semakin tinggi suhu yang dipergunakan dapat meningkatkan frekuensi
tumbukan antar molekul (Keenan dkk., 1980) serta memperbanyak fraksi molekul
yang memiliki energi melampaui energi aktivasi (Silberberg, 2006) sehingga
dapat meningkatkan kinetika reaksi (Corwin, 2001). Dipergunakan variasi suhu
reaksi pada 40o, 60o, dan 80oC dengan tujuan untuk mengetahui suhu reaksi yang
menghasilkan t-butil eugenol terbanyak.
1. Permasalahan
a. Apakah t-butil eugenol dapat disintesis dari eugenol dan t-butil klorida dengan katalis FeCl3?
2. Keaslian Penelitian
Penelitian tentang sintesis tersier-butil eugenol dari eugenol dan tersier-butil klorida dengan katalis besi (III) klorida dengan variasi suhu reaksi sejauh
pengamatan peneliti belum pernah dilakukan.
3. Manfaat Penelitian a. Manfaat teoritis
Penelitian ini bertujuan untuk memperkaya pengetahuan dalam bidang
sintesis senyawa t-butil eugenol yang berasal dari eugenol dan t-butil klorida dengan katalis FeCl3 menurut reaksi alkilasi Friedel-Craft.
b. Manfaat metodologis
Penelitian ini bertujuan untuk memperkaya metode sintesis senyawa
antioksidan baru yaitu t-butil eugenol. c. Manfaat praktis
Penelitian ini memberikan sumbangan suatu senyawa antioksidan baru
dapat dipergunakan secara luas oleh masyarakat setelah diformulasikan
dalam suatu bentuk sediaan obat serta dilakukan uji praklinik dan uji
klinik.
B. Tujuan Penelitian
1. Mengetahui apakah t-butil eugenol dapat disintesis dari eugenol dan t-butil klorida dengan katalis FeCl3.
BAB II
PENELAAHAN PUSTAKA
A. Eugenol sebagai Antioksidan
Berbagai macam kerusakan sel dapat menyebabkan munculnya berbagai
penyakit degeneratif seperti kanker, penyakit jantung koroner, artherosklerosis,
dan penuaan dini (Gitawati, 1995). Munculnya berbagai penyakit tersebut
disebabkan karena adanya pengrusakan makromolekul seperti Deoxyribose Nucleic Acid, karbohidrat, membran lipid, dan protein oleh radikal bebas.
Beberapa tahun terakhir ini terjadi peningkatan minat untuk mendapatkan
senyawa antioksidan alami (Sunarni dkk., 2007) yang mampu menghambat reaksi
berantai radikal bebas dalam tubuh dengan memberikan elektronnya kepada
molekul radikal bebas (Kumalaningsih, 2007). Beberapa senyawa antioksidan
sintesis seperti Butylated hydroxyanisole (BHA) dan Butylated hydroxytoluene
(BHT) diduga bersifat karsinogenik (Rajeshwar et al., 2005) dan bersifat toksik pada dosis tinggi (Halliwell and Gutteridge, 1999), sehingga sekarang lebih
banyak dikembangkan antioksidan dari bahan-bahan alami (Hartoyo, 2003).
Eugenol merupakan senyawa alami yang telah diketahui mempunyai
aktivitas sebagai antioksidan (Ogata et al., 2000). Gugus hidroksi (-OH) fenolik pada eugenol (Gambar 1) merupakan gugus yang berperan sebagai penangkap
radikal bebas dalam mekanisme antioksidan. Senyawa fenolik lain seperti
kurkumin yang memiliki gugus hidroksi (-OH) fenolik dan gugus metilen dalam
jawab terhadap aktivitas antioksidan dibandingkan gugus metilen. Hal ini
disebabkan nilai Bond Dissociaton Enthalpies (BDEs) gugus hidroksi (-OH) fenoliknya lebih rendah (5,04 Kkal/mol) daripada nilai BDEs -C-H metilen
(116,07 Kkal/mol). Abstraksi atom H dari gugus (–OH) fenolik lebih mudah
terjadi daripada abstraksi atom H dari C-H metilen (Sun et al., 2002).
O H3C
CH2
HO
Gambar 1. Struktur Eugenol
Eugenol diperoleh dari minyak cengkeh, berbentuk cairan tidak berwarna
atau kuning pucat dengan BM 164,20. Eugenol memiliki bau cengkeh kuat,
menusuk, rasa pedas, dan tidak memutar bidang polarisasi. Bila terpapar udara
warna eugenol menjadi lebih tua dan mengental. Eugenol sukar larut dalam air,
larut dengan etanol, kloroform, eter, dan minyak lemak. Kelarutan eugenol adalah
1 bagian volume larut dalam 2 bagian volume etanol 70%. Bobot jenis eugenol
antara 1,064 dan 1,070 serta indeks bias antara 1,540 dan 1,542 pada suhu 20ºC
(Anonim, 2001).
Menurut Sastrohamidjojo (2008), tanaman cengkeh sebagai penghasil
senyawa eugenol yang tumbuh pada area lebih dari 438.000 ha di berbagai
wilayah Indonesia, menempati posisi kedua sebagai komoditas ekspor minyak
esensial. Dengan keberadaan tanaman cengkeh yang melimpah, maka eugenol
memiliki potensi yang tinggi untuk dikembangkan secara komersial sebagai
senyawa antioksidan yang berasal dari bahan alam. Namun berdasarkan penelitian
yang dilakukan oleh Ogata (2000) dengan metode 2,2-difenil-1-pikril hidrazil
(DPPH), menunjukkan bahwa eugenol memiliki aktivitas antioksidan yang lemah
(IC50 > 800 μM).
Ogata (2000) menemukan bahwa dengan penambahan gugus meruah
didekat gugus hidroksi pada eugenol akan meningkatkan aktivitasnya sebagai
senyawa antioksidan. Gugus meruah berupa tersier-butil yang terdapat pada senyawa Butylated Hydroxytoluene (BHT) menyebabkan kepotenannya sebagai antioksidan dengan nilai IC50 = 0,31 μM (Uto, 2002). Untuk meningkatkan
aktivitas antioksidan eugenol dilakukan dengan melakukan modifikasi struktur
dengan menambahkan gugus meruah berupa t-butil pada posisi orto dari gugus hidroksi fenolik eugenol menghasilkan senyawa t-butil eugenol.
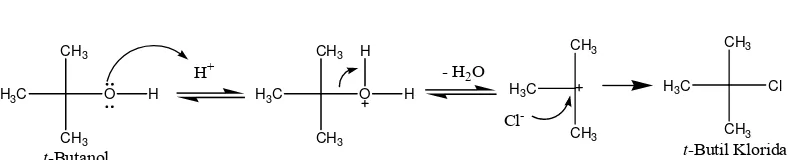
B. Sintesis t-Butil Klorida
Sintesis t-butil klorida didasarkan atas reaksi substitusi nukleofilik 1 (SN 1)
pada alkohol. Reaksi substitusi melibatkan reaksi antara elektrofil (spesies
kekurangan elektron) dengan nukleofil (spesies kaya elektron). Reaksi SN 1terdiri
dari dua tahap dan merupakan reaksi unimolekular. Reaksi ini melalui dua tahap
yaitu tahap pertama meliputi pemisahan gugus-pergi (spesies penerima elektron)
dari substrat, yang menghasilkan suatu karbokation yang merupakan senyawa
antara (intermediate). Tahap kedua merupakan tahap diserangnya karbokation oleh nukleofil dari karbokation terhibridisasi sp2 dari sisi mana pun (Bresnick,
Kestabilan karbokation akan mempengaruhi kecepatan reaksi yaitu dengan
semakin stabilnya karbokation akan meningkatkan kecepatan reaksi. Peningkatan
substitusi akan menghasilkan lebih banyak gugus yang dapat memberikan
elektron (induksi elektron) untuk menstabilkan karbokation. Gugus benzil dan alil
bersifat sangat stabil karena delokalisasi muatan positif melalui resonansi.
Karbokation dapat berpindah melalui pergeseran untuk membentuk karbokation
yang bersifat lebih stabil (Bresnick, 2004).
> >
Gambar 2. Kestabilan Karbokation
Alkohol tidak dapat menjalani reaksi substitusi dalam larutan netral atau
basa karena tidak memiliki gugus pergi yang baik seperti dalam alkil halida.
Alkohol memiliki gugus hidroksil (-OH) yang bersifat basa kuat sehingga
merupakan gugus pergi yang buruk. Oleh karena itu diperlukan suasana asam
dalam reaksinya agar alkohol dapat mengalami protonasi menghasilkan ion
oksonium (-OH2+), suatu gugus pergi yang baik karena gugus ini akan dilepaskan
sebagai air suatu basa sangat lemah (Fessenden dan Fessenden, 1986a).
C. Sintesis Tersier-Butil Eugenol dengan Variasi Suhu Reaksi
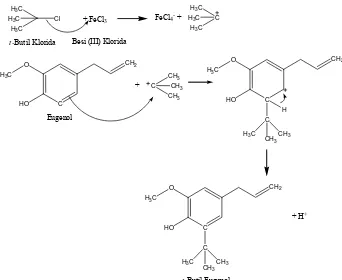
Sintesis t-butil eugenol berdasarkan pada reaksi alkilasi Friedel-Craft melibatkan penambahan suatu alkil halida (t-butil klorida) pada cincin aromatis (eugenol) dengan menggunakan katalis asam Lewis kuat (FeCl3) (Gambar 2).
C Gambar 3. Reaksi Pembentukan t-Butil Eugenol
Katalis merupakan suatu zat yang meningkatkan kecepatan suatu reaksi
kimia tanpa dirinya mengalami perubahan kimia yang permanen (Keenan dkk.,
1980). Katalis dapat bereaksi membentuk zat antara, tetapi akan diperoleh
kembali dalam tahap reaksi berikutnya (Chang, 2003). Katalis bekerja dengan
cara menurunkan barier energi dengan menyediakan energi pengaktifan yang
lebih rendah (Gambar 3) sehingga molekul yang energinya tidak tinggi dapat
bereaksi (Keenan dkk., 1980).
Gambar 4. Pengaruh Katalis dalam Penurunan Energi Aktivasi
Besi (III) klorida merupakan katalis asam Lewis yang bersifat cukup kuat
(III) klorida merupakan penerima pasangan elektron dari t-butil klorida yang kemudian membentuk ion FeCl4- (Fessenden dan Fessenden, 1986a).
Pada reaksi kimia dipergunakan model berupa teori tumbukan yang
menyatakan untuk terjadinya suatu reaksi kimia, molekul-molekul yang terlibat di
dalamnya harus bertumbukan terlebih dahulu. Pada tumbukan yang sukses dapat
menyebabkan perubahan molekul reaktan menjadi molekul produk dengan
disertai perusakan ikatan molekul reaktan dan pembentukan ikatan baru pada
molekul produk. Teori tumbukan menyebutkan terdapat tiga faktor yang
mempengaruhui laju reaksi kimia yaitu :
1. Frekuensi tumbukan yang semakin besar dapat meningkatkan laju reaksi.
2. Diperlukan energi tumbukan yang cukup untuk membentuk ikatan baru.
Apabila molekul bertumbukan dengan energi yang belum cukup untuk
membentuk ikatan baru maka tidak terjadi reaksi.
3. Geometri tumbukan, diperlukan orientasi yang tepat antar molekul untuk
dapat bereaksi (Corwin, 2001).
Diperlukan suhu optimum untuk terjadinya reaksi kimia. Setiap
peningkatan suhu 10oC dapat meningkatkan laju reaksi menjadi 2 atau 3 kali
semula (Petrucci, 1987). Kenaikan suhu dapat meningkatkan laju suatu reaksi
yang disebabkan oleh :
1. Adanya pergerakan molekul yang lebih cepat sehingga persentase tabrakan
antar molekul yang menghasilkan reaksi kimia akan menjadi lebih besar
(Keenan dkk., 1980).
2. Adanya peningkatan energi tumbukan (Corwin, 2001) yang dapat
memperbesar fraksi tumbukan dengan energi yang cukup untuk melampaui
energi aktivasi (Gambar 4) (Silberberg, 2006).
Gambar 5. Pengaruh Suhu Terhadap Distribusi Energi Tumbukan Walaupun reaksi alkilasi Friedel-Craft ini dipergunakan secara luas dalam
sintesis alkilbenzena, namun reaksi ini memiliki 4 batasan, yaitu :
1. Hanya dapat dipergunakan alkil halida. Sedangkan aril halida dan vinilhalida
tidak dapat bereaksi karena keduanya membutuhkan energi yang tinggi untuk
bereaksi pada kondisi Friedel-Craft.
2. Reaksi Friedel-Craft tidak berhasil pada cincin aromatik yang tersubstitusi
baik oleh gugus amino maupun gugus penarik elektron kuat yaitu –NR3+,
-NO2, -CN, -SO3H, -CHO, -COCH3, -COOH, -COOCH3, -NH2, - NHR, - NR2.
3. Reaksi alkilasi Friedel-Craft sering kali sulit untuk menghentikan reaksinya
setelah terjadi substitusi tunggal. Setelah gugus alkil pertama terdapat pada
cincin, reaksi substitusi kedua dapat terjadi sehingga menimbulkan
polialkilasi.
katalis, suhu reaksi, dan pelarut reaksi. Penataan ulang lebih sedikit terjadi
pada suhu reaksi yang lebih rendah, namun sering kali diperoleh campuran
produk (Murry, 2004).
D. Pengaruh Pelarut
Reaksi organik lebih sering terjadi pada fase cair yang homogen daripada
tidak digunakannya pelarut. Keberadaan pelarut ini sebenarnya tidak
diperhitungkan dalam persamaan stoikiometri dan bukan bahan penting untuk
reaksi tersebut. Namun perlu diperhatikan interaksi kompleks yang terbentuk
antara molekul terlarut dan pelarut yang dapat menyebabkan perubahan besar
pada aktivitas, energi bebas, dan tentu saja reaktivitasnya. Oleh karena itu perlu
diperhatikan dalam melakukan pemilihan pelarut dalam suatu reaksi kimia.
Contoh pengaruh pelarut seperti pada gambar 5 di bawah ini (Isaacs, 1995).
H
Gambar 6. Reaksi Transfer Proton
Pelarut cair dapat dibedakan menjadi tiga kategori utama yaitu :
1. Protik, merupakan pelarut yang memiliki fungsi sebagai donor proton seperti
memiliki gugus –OH atau –NH-, serta memiliki momen dipol yang besar dan
mampu untuk membentuk ikatan hidrogen. Contohnya adalah alkohol, amina,
asam karboksilat, dan air.
2. Dipolar aprotik, memiliki momen dipol yang besar dan sifat pendonor, tetapi
tidak memiliki proton asam. Contohnya adalah dimetilsulfoksida, alkil
sianida, amida, dan keton sekunder.
3. Non-polar aprotik, hanya memiliki sedikit momen dipol, tanpa proton asam
maupun sifat pendonor atau akseptor sehingga hanya memiliki kekuatan
intermolekuler yang lemah. Contohnya adalah hidrokarbon, halokarbon, dan
eter (Isaacs, 1995).
E. Analisis Senyawa Hasil Sintesis 1. Kromatografi lapis tipis (KLT)
Kromatografi lapis tipis (KLT) merupakan metode pemisahan
fisika-kimia yang didasarkan pada perbedaan adsorbsi antara fase diam terhadap fase
gerak dan zat terlarut yang terjadi secara kompetitif. Bercak dengan nilai Rf
sama kemungkinan adalah senyawa yang sama. Campuran yang akan
dipisahkan dilarutkan dalam pelarut yang sesuai dan lebih menguntungkan
jika digunakan pelarut pengembang yang kepolarannya sama (Gritter dkk.,
1991). Gasparic (1978) menyebutkan bahwa terbentuknya suatu bercak
tunggal tidak dapat disimpulkan sebagai suatu senyawa murni sebelum
digunakan sistem pelarut dengan kepolaran yang berbeda.
Pada sistem seperti KLT, dimana bagian lintasan dan koefisien partisi
mungkin tidak konstan sepanjang jarak pengembangan, rasio jarak yang
Rf=
Pemilihan pelarut untuk menghasilkan pemisahan yang baik
memerlukan sejumlah percobaan. Sistem pelarut biasanya merupakan
campuran yang tediri dari dua komponen yaitu air dan pelarut organik polar
yang larut dalam air. Pemilihan sistem pelarut ini dapat dilakukan secara
eksperimental maupun dengan menghitung nilai kekuatan pelarut (S’) dengan
rumus :
S’ = FaSa + FbSb + …
dengan F adalah volume fraksi dari pelarut murni (a, b, dan seterusnya) dan S
adalah parameter kekuatan pelarut. Dengan semakin besar nilai S
menunjukkan bahwa semakin kuat solut untuk teradsorpsi pada silika gel KLT
tetapi akan semakin lemah terikat pada sistem KLT fase terbalik (Dean, 1995).
Tabel I. Parameter Empiris Kekuatan Pelarut (S)
Solven S
Silika gel lebih sering digunakan untuk bahan pelapis. Lapisan silika
gel merupakan kumpulan sangat tebal dari partikel kecil dengan ukuran
seragam (6-13 µm) dengan permukaan halus dan rata (Dean, 1995). Silika gel
bersifat sedikit asam sehingga sampel dengan sifat asam sering agak mudah
dipisahkan sehingga dapat meminimumkan reaksi asam-basa antara penjerap
dan senyawa yang dipisahkan (Gritter dkk., 1991). Pengikat yang sering
digunakan untuk serbuk silika gel adalah 5-20 % kalsium sulfat hemihidrat,
bentuk halus dari gipsum (silika gel G) yang dipergunakan untuk
meningkatkan kohesi dari partikel adsorben dan meningkatkan adhesi dari
lapisan adsorben dengan lempeng (Dean, 1995).
2. Kromatografi gas
Kromatografi gas adalah suatu metode pemisahan dengan proses
migrasi diferensial dimana komponen-komponen cuplikan ditahan secara
selektif oleh fasa diam berupa padatan maupun cairan serta fase gerak berupa
gas. Kromatografi gas ini dapat digunakan untuk analisa kualitatif (penentuan
sifat-sifat dari suatu komponen atau campuran dari komponen) serta analisa
kuantitatif (penentuan jumlah dari suatu komponen atau komponen-komponen
dalam suatu campuran) (Sastrohamidjojo, 1991).
Data kromatografi gas biasanya terdiri dari waktu retensi atau waktu
tambat berbagai komponen campuran. Waktu retensi diukur mulai dari titik
penyuntikan sampai titik maksimum puncak dan sangat khas untuk senyawa
tertentu pada kondisi tertentu (kolom, suhu, gas pembawa, dan laju aliran).
Adanya komponen tertentu dapat dipisahkan dengan cara spiking jika tersedia senyawa murninya. Senyawa murni ditambahkan ke dalam cuplikan yang
diduga mengandung senyawa yang diinginkan dan dikromatografi. Jika
berlainan dan kepolarannya berbeda, komponen itu mungkin ada (Gritter dkk.,
1991).
Metode kromatografi gas dan spektrometri massa memberikan
keuntungan saat keduanya digunakan secara bersamaan. Proses pemisahan
dilakukan oleh kromatografi gas, sedangkan proses identifikasi dan kuantitatif
dilakukan oleh spektrometri massa. Keuntungan dari kromatografi
gas-spektrometri massa antara lain metode ini dapat digunakan untuk hampir
semua jenis analit, memiliki batas deteksi yang rendah, dan memberi
informasi penting tentang spektrum massa dari suatu senyawa organik (Dean,
1995).
3. Elusidasi Struktur dengan Spektrometri Massa (Mass Spectrometry) Penentuan struktur molekul organik dapat dilakukan dengan metode
spektroskopi. Dalam hal ini dapat digunakan spektroskopi ultraviolet,
spektrofotometri inframerah, spektroskopi resonansi magnetik inti, dan
spektrometri massa (Samhoedi, 1980).
Pada spektrometri massa sering kali dipergunakan metode Electron Impact (EI) yaitu spektrometer massa membombardir molekul dalam fase uap dengan sinar elektron berenergi tinggi dan mencatat hasil tumbukan elektron
sebagai spektrum ion positif dan dinyatakan dalam massa/muatan (m/z)
(Silverstein and Webster, 1998). Ion bermuatan positif yang berenergi tinggi
ini disebut ion molekuler yang kemudian dapat dipecah menjadi ion berukuran
lebih kecil (Sastrohamijojo, 1991).
Proses ini menginisiasi ion radikal yang disebut ion molekuler atau
induk. Untuk spesies molekuler M, pembentukan ion sering ditulis dalam
persamaan :
M + e ÆM . + 2 e
Tanda titik disini menunjukkan bahwa ion berada dalam bentuk radikal karena
kehilangan sebuah elektron. Puncak ion molekuler memiliki nilai m/z yang
berhubungan dengan bobot molekul dari molekul netral aslinya (Skoog,
1985).
Spektrum massa merupakan grafik perbandingan massa/muatan (m/z)
terhadap kelimpahan relatifnya. Muatan ion dari kebanyakan partikel yang
terdeteksi dalam spektra massa adalah +1. Nilai m/z ion semacam ini sama
dengan massanya. Dari segi praktis spektrum massa adalah rekaman dari
massa partikel kelimpahan relatif partikel tersebut (Fessenden dan Fessenden,
1986b).
4. Perhitungan Jumlah Senyawa Hasil Sintesis dengan Program ImageJ
ImageJ yang menggunakan bahasa pemrograman Java ini diciptakan oleh Wayne Rasband di National Institutes of Health (NIH). ImageJ dapat digunakan untuk berbagai format gambar standar yang akan diolah, termasuk
implementasi gabungan gambar dengan warna 48-bit yang sekarang ini sedang
berkembang. Kemampuan untuk membuka berbagai jenis format gambar telah
menjadi keistimewaan yang dimiliki oleh ImageJ (Collins, 2007).
terjadinya fotosintesis di daun, sehingga dipilih wilayah yang berwarna hijau
dari keseluruhan bagian daun yang berwarna-warni. Dilakukan pengaturan
gambar yang akan dianalisis dengan mengubahnya menjadi warna hitam putih
serta gambar binary sehingga dapat dilakukan analisis partikel untuk menghitung luas area hijau. Dapat pula dilakukan pengaturan
brightness/contrast yang kemudian dapat dilakukan analisis partikel untuk menghitung luas area hijau (Reinking, 2001).
F. Landasan Teori
Reaksi alkilasi Friedel-Craft merupakan reaksi penambahan alkil halida
pada cincin aromatis. Reaksi sintesis t-butil eugenol didasarkan pada reaksi alkilasi Friedel-Craft dengan melibatkan eugenol yang memiliki cincin aromatis,
t-butil klorida sebagai alkil halida, serta FeCl3 sebagai katalis (Gambar 6).
Setiap terjadi kenaikan suhu reaksi sebesar 10oC terjadi peningkatan laju
reaksi menjadi 2 atau 3 kali semula. Semakin tinggi suhu reaksi akan
meningkatkan frekuensi tumbukan antar molekul dan meningkatkan energi
tumbukan yang menyebabkan terdapat lebih banyak fraksi tumbukan yang
memiliki energi melebihi energi aktivasi sehingga terjadi peningkatan kinetika
reaksi dan jumlah senyawa hasil sintesis yang dihasilkan.
+ FeCl3
t-Butil Klorida Besi (III) Klorida
FeCl4- + H+ FeCl3 + HCl
Gambar 7. Mekanisme Reaksi Sintesis t-Butil Eugenol
G. Hipotesis
1. Tersier-butil eugenol dapat disintesis dari eugenol dan t-butil klorida dengan katalis FeCl3.
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian Penelitian ini termasuk penelitian eksperimental deskriptif.
B. Definisi Operasional
1. Starting material adalah senyawa digunakan sebagai bahan awal untuk menghasilkan produk. Dalam penelitian ini digunakan starting material
eugenol dan t-butil klorida.
2. Molekul target adalah senyawa yang menjadi target suatu sintesis dan
diharapkan terbentuk dari starting material. Molekul target dalam penelitian ini adalah t-butil eugenol.
3. Katalis adalah senyawa yang terlibat dalam reaksi yang digunakan untuk
meningkatkan laju reaksi kimia. Dalam penelitian ini digunakan katalis besi
(III) klorida.
4. Jumlah senyawa hasil sintesis adalah perbandingan Area Under Curve (AUC) bercak baru dengan AUC total pada kromatografi lapis tipis dengan
menggunakan perhitungan ImageJ.
C. Variabel Penelitian 1. Variabel bebas adalah suhu reaksi 40o, 60o, dan 80o C.
2. Variabel tergantung adalah jumlah t-butil eugenol.
D. Bahan Penelitian
Eugenol (p.a., Sigma), butanol (p.a., Merck), asam klorida (p.a., Merck), ferri klorida anhidrat (p.a., Merck), eter (p.a., Merck), asam asetat (p.a., Merck), toluene (p.a., Merck), aquadest, lempeng KLT, dan silika gel 60 GF254 (Merck).
E. Alat Penelitian
Labu alas bulat 500 ml (Pyrex-Germany), pengaduk magnetik, mantle heater (Heidolph), Erlenmeyer bertutup (Duran schott mainz), Beaker glass ( Pyrex-Germany), pendingin Alihn, klem, termometer, corong kaca, gelas arloji, gelas pengaduk, timbangan elektrik (Mextler PM 100), stir plate, kromatografi gas-spektrometer massa (Shimadzu QP 2010S), lampu UV254 nm, pipa kapiler.
F. Tata Cara Penelitian 1. Sintesis t-butil klorida sebagai starting material
Butanol 25 mL dimasukkan dalam labu Erlenmeyer dan ditambahkan
HCl 50 mL dengan hati-hati. Dilakukan pengadukan di atas stir plate selama 15 menit. Campuran tersebut dipindahkan ke dalam corong pisah dan
dibiarkan hingga dua lapisan terpisah. Dipisahkan lapisan larut air dengan
corong pisah, dan dilakukan pencucian lapisan organik. Pencucian secara
berturut dilakukan dengan larutan jenuh sodium klorida 6 mL, larutan jenuh
sodium bikarbonat 6 mL, dan larutan jenuh sodium klorida 6 mL. Diambil
2. Sintesis t-butil eugenol dengan katalis besi (III) klorida (FeCl3) pada variasi
suhu reaksi
a. Sintesis t-butil eugenol pada suhu 40oC
Besi (III) klorida anhidrat 5,2722 g dilarutkan dalam eter 100 mL,
dimasukkan dalam labu alas bulat yang memiliki penutup kaca, ditambah
dengan t-butil klorida 3,6 mL, dan didiamkan selama 12 jam. Pada campuran tersebut ditambahkan eugenol 1 mL serta digojog. Panaskan
campuran pada suhu 40oC selama 3 jam. Pada saat dilakukan pemanasan
disertai proses reflux dengan pendingin Alihn yang mempergunakan aliran air dingin. Senyawa hasil sintesis didinginkan pada suhu kamar dan
dilakukan analisis hasil senyawa hasil sintesis.
b. Sintesis t-butil eugenol pada suhu 60oC
Besi (III) klorida anhidrat 5,2722 g dilarutkan dalam eter 100 mL,
dimasukkan dalam labu alas bulat yang memiliki penutup kaca, ditambah
dengan t-butil klorida 3,6 mL, dan didiamkan selama 12 jam. Pada campuran tersebut ditambahkan eugenol 1 mL serta digojog. Panaskan
campuran pada suhu 60oC selama 3 jam. Pada saat dilakukan pemanasan
disertai proses reflux dengan pendingin Alihn yang mempergunakan aliran air dingin. Senyawa hasil sintesis didinginkan pada suhu kamar dan
dilakukan analisis hasil senyawa hasil sintesis.
c. Sintesis t-butil eugenol pada suhu 80oC
Besi (III) klorida anhidrat 5,2722 g dilarutkan dalam eter 100 mL,
dengan t-butil klorida 3,6 mL, dan didiamkan selama 12 jam. Pada campuran tersebut ditambahkan eugenol 1 mL serta digojog. Panaskan
campuran pada suhu 80oC selama 3 jam. Pada saat dilakukan pemanasan
disertai proses reflux dengan pendingin Alihn yang mempergunakan aliran air dingin. Senyawa hasil sintesis didinginkan pada suhu kamar dan
dilakukan analisis hasil senyawa hasil sintesis.
3. Analisis Senyawa Hasil Sintesis
a. Uji organoleptis
Uji organoleptis dilakukan untuk mengetahui sifat fisis dari
senyawa hasil sintesis. Senyawa hasil sintesis diamati warna dan bau serta
dibandingkan dengan eugenol. Adanya perbedaan sifat fisis antara eugenol
(starting material) dengan senyawa hasil sintesis merupakan suatu tanda yang menunjukkan terbentuk senyawa baru yang berbeda dengan eugenol.
b. Kromatografi lapis tipis (KLT)
Senyawa hasil sintesis sebanyak 20 μl ditotolkan pada lempeng
silika gel 60 GF254, dielusi dengan fase gerak toluena : etilasetat (93:7),
jarak elusi 15 cm dan deteksi sinar UV254 nm. Diamati jumlah bercak yang
terdapat pada lempeng KLT. Hitung harga Rf bercak yang dihasilkan dan
dibandingkan dengan harga Rf eugenol. Jika harga Rf senyawa hasil
sintesis berbeda dengan harga Rf eugenol maka menunjukkan telah
c. Kromatografi gas (KG)
Tahap kerja kromatografi gas secara umum adalah cuplikan
senyawa hasil sintesis dilarutkan dalam aseton, kemudian diinjeksikan
kedalam injektor kromatografi gas. Aliran gas dari gas pengangkut helium
akan membawa cuplikan yang telah diuapkan masuk ke dalam kolom yang
dilapisi fase cair dimethylpolysilosane. Selanjutnya cuplikan diukur oleh detektor dan diperoleh suatu kromatogram.
Senyawa hasil sintesis dianalisis menggunakan instrumen
kromatografi gas dengan kondisi alat: jenis kolom HP-5MS; panjang
kolom 30 m; diameter internal 0,25 mm; gas pembawa helium; suhu oven
kolom 100oC; suhu injektor 300oC; tekanan 22,0 kPa; dan aliran kolom 0,5
mL/min yang dilakukan oleh petugas laboratorium kimia organik, Fakultas
MIPA, Universitas Gadjah Mada, Yogyakarta.
d. Perhitungan jumlah senyawa hasil sintesis
Perhitungan jumlah senyawa hasil sintesis dilakukan dengan
menggunakan program ImageJ.. Melalui program ImageJ dibuka foto yang akan dianalisis melalui menu file-open. Dilakukan pengaturan
brightness/contrass foto KLT melalui menu : image - adjust
-brightness/contrass sehingga diperoleh perbedaan yang kontras antara bercak dengan lempengnya. Dilakukan pengkotakan setiap bercak dengan
menggunakan rectangular selections dan dianalisis dengan wand tool
untuk mengetahui luas area bercak tersebut. Diperoleh luas area untuk
jumlah senyawa hasil sintesis. Senyawa hasil sintesis pada masing-masing
suhu 40oC, 60oC, dan 80oC dihitung jumlahnya dan dibandingkan nilainya
sehingga dapat ditentukan suhu yang dapat menghasilkan jumlah senyawa
hasil sintesis t-butil eugenol terbanyak.
60°C atau 80°C A 40°C
40°C 100%
e. Elusidasi struktur dengan spektroskopi massa
Tahapan kerja spektroskopi massa secara umum adalah senyawa
hasil sintesis dimasukkan ke dalam kamar pengion pada spektrometer
masa untuk ditembak dengan seberkas elektron sehingga terfragmentasi.
Fragmen-fragmen tersebut melewati lempeng pemercepat ion dan
didorong menuju tabung analisator, dimana partikel-partikel akan
dibelokkan ke dalam medan magnet dan menimbulkan arus pada kolektor
yang sebanding dengan kelimpahan relatif setiap fragmennya. Kelimpahan
relatif setiap fragmen akan dicatat dan menghasilkan data spektrum massa.
Data spektrum yang dihasilkan kemudian dilakukan interpretasi sehingga
BAB IV
HASIL DAN PEMBAHASAN
A. Sintesis t-Butil Eugenol dengan Variasi Suhu Reaksi
Sintesis t-butil eugenol dilakukan dengan mereaksikan eugenol dan t-butil klorida dengan katalis besi (III) klorida (FeCl3) anhidrat berdasarkan pada reaksi
alkilasi Friedel-Craft. Tersier-butil klorida disintesis dari butanol dan HCl menurut reaksi SN 1 (Gambar 8).
Gambar 8. Mekanisme Sintesis t-Butil Klorida
Hasil sintesis dari butanol dan HCl akan menghasilkan fase organik yang
mengandung tersier-butil klorida serta senyawa lain yang terbentuk selama reaksi maupun sisa pereaksi yang tidak habis bereaksi. Pencucian dengan larutan jenuh
sodium klorida berfungsi untuk menarik air yang masih terkandung dalam fase
organik sampel. Dengan penambahan NaCl jenuh menyebabkan kekuatan ionik
lapisan air akan bertambah sehingga ion-ion dari NaCl akan menarik molekul air
untuk berikatan dengan NaCl. Sedangkan pada pencucian dengan larutan jenuh
sodium bikarbonat karena untuk menghilangkan sisa HCl, dengan reaksi :
NaHCO3 + HCl Æ CO2↑ + NaCl + H2O
Tersier-butil klorida terlebih dahulu akan bereaksi dengan katalis FeCl3
membentuk karbokation t-butil dan kemudian bereaksi dengan eugenol. Eugenol berperan sebagai nukleofil sedangkan karbokation t-butil berperan sebagai elektrofil. Pada akhir reaksi akan dihasilkan kembali FeCl3 karena katalis
berfungsi untuk menurunkan energi aktivasi reaksi kimia sehingga FeCl3 tidak
mengalami transformasi bentuk.
Pada alkilasi terhadap eugenol dipergunakan FeCl3 sebagai katalis karena
sifatnya sebagai katalis asam Lewis yang cukup kuat sehingga dapat
menghasilkan reaksi yang lembut (mild) dan diperoleh jumlah t-butil eugenol yang banyak. Dipergunakan FeCl3 anhidrat untuk mempercepat proses pelarutan
FeCl3 dalam dietil eter. Bentuk anhidrat memiliki kisi kristal kosong dalam
strukturnya sehingga akan lebih cepat menarik pelarut dietil eter yang berasal luar
sistemnya. Hal ini menyebabkan terjadi kontak lebih banyak antara FeCl3 dengan
dietil eter sehingga proses pelarutan akan berlangsung lebih cepat.
Katalis FeCl3 dilarutkan dalam pelarut dietil eter, yang memiliki sifat
sebagai pelarut non-polar aprotik, agar reaksi berlangsung dalam fase yang sama
dengan eugenol dan t-butil klorida yaitu pada fase cair. Besi (III) klorida dalam bentuk padat hanya dapat bekerja sebagai katalis pada bagian permukaannya saja
dengan luas permukaan spesifik yang terbatas. Dietil eter hanya memiliki sedikit
momen dipol, tanpa proton asam maupun sifat pendonor atau akseptor sehingga
hanya memiliki kekuatan intermolekuler yang lemah. Dipergunakan dietil eter
untuk memberikan waktu yang cukup untuk bereaksi sehingga seluruh t-butil klorida dapat bereaksi dengan FeCl3 menghasilkan karbokation t-butil.
Pada campuran yang telah didiamkan selama 12 jam tersebut ditambahkan
eugenol dan dipanaskan pada 3 macam variasi suhu yaitu 40oC, 60oC, dan 80oC.
Dipergunakan jumlah eugenol yang lebih kecil dari t-butil klorida dengan perbandingan mol eugenol dengan t-butil klorida sebesar 1 : 5 dengan harapan agar seluruh eugenol dapat bereaksi menghasilkan t-butil eugenol. Proses pemanasan disertai proses reflux dengan pendingin Alihn yang dialiri air dingin. Penggunaan air dingin bertujuan untuk meningkatkan efektivitas pendinginan
pada proses reflux. Diharapkan tidak ada komponen campuran yang hilang menguap, yaitu terutama untuk mencegah penguapan dietil eter yang memiliki
titik didih sebesar 40,54oC. Dilakukan variasi suhu reaksi untuk melihat pengaruh
suhu terhadap kinetika reaksi yang akan berpengaruh pada jumlah senyawa hasil
sintesis.
Terbentuknya t-butil eugenol karena terjadi substitusi elektrofilik aromatis pada cincin benzena oleh gugus t-butil. Eugenol memiliki 3 macam gugus yang melekat pada cincin benzena yaitu gugus metoksi (-OCH3), gugus hidroksi (-OH),
serta gugus propenil (-CH2-CH=CH2) (Gambar 9). Dengan adanya ketiga gugus
tersebut akan mempengaruhi posisi substitusi gugus t-butil yang akan masuk. Gugus metoksi, hidroksi, dan propenil bersifat sebagai pengarah orto dan para
karena memiliki sifat sebagai gugus aktivasi. Gugus hidroksi akan mengarahkan t -butil pada posisi orto (nomor 6). Gugus metoksi akan mengarahkan t-butil pada posisi orto (nomor 3) dan para (nomor 5). Gugus propenil mengarahkan t-butil
pada posisi orto (nomor 3 dan 5). Terdapat 3 lokasi atom C yang dapat menerima substituen t-butil yaitu nomor 3, 5, dan 6. Namun pada posisi nomor 3 dan 5 memiliki halangan sterik yang lebih besar daripada nomor 6 sehingga gugus t -butil akan tersubstitusi pada posisi atom C nomor 6 (Gambar 97). Atom C pada
posisi nomor 3 terletak diantara gugus meruah metoksi dan propenil, sehingga
gugus t-butil sulit untuk mencapai atom C nomor 3 tersebut dan reaksi alkilasi akan sulit terjadi. Posisi orto terhadap atom C nomor 5 terdapat gugus propenil yang lebih meruah dibandingkan gugus hidroksi yang terletak pada posisi orto
terhadap atom C nomor 6. Hal ini menyebabkan gugus t-butil akan lebih mudah mendekat pada atom C nomor 6 dengan halangan sterik lebih kecil dibandingkan
nomor 5 dan reaksi alkilasi akan lebih mudah terjadi pada atom C nomor 6.
Akibatnya gugus t-butil akan tersubstitusi pada posisi atom C nomor 6.
O
Gambar 9. Penomoran Cincin Benzena untuk Substitusi Gugus t-Butil Pada percobaan ini dilakukan variasi suhu reaksi pada 40oC, 60oC, dan
80oC. Dipergunakan suhu 40oC sebagai suhu terendah karena pemilihan suhu
reaksi pada umumnya dilakukan berdasar titik didih terendah suatu zat yang
terdapat dalam campuran. Hal ini dilakukan untuk meminimalisasi kemungkinan
hilangnya komponen dalam campuran selama berlangsungnya reaksi. Pada
terendah adalah dietil eter (40,54oC). Titik didih eugenol adalah 286,78oC dan t -butil klorida sebesar 52,32oC.
Variasi suhu reaksi dilakukan dengan interval suhu 20oC sehingga
pemanasan dilakukan pada tiga macam suhu reaksi yaitu 40oC, 60oC, dan 80oC.
hal ini didasarkan bahwa setiap kenaikan suhu sebesar 10oC dapat meningkatkan
kecepatan reaksi menjadi dua atau tiga kalinya sehingga dipergunakan interval
kenaikan suhu yang lebih besar dari 10oC yaitu 20oC dengan harapan dapat
memperbesar peningkatan kecepatan reaksi dan terjadi peningkatan jumlah
senyawa hasil sintesis yang lebih besar dalam waktu yang sama.
B. Analisis Senyawa Hasil Sintesis 1. Uji organoleptis
Pemeriksaan organoleptis dilakukan untuk mengetahui warna dan bau
senyawa hasil reaksi yang kemudian dibandingkan dengan eugenol (tabel II).
Tabel II. Hasil Pemeriksaan Organoleptis Senyawa Hasil Reaksi dengan Eugenol
Pemeriksaan Senyawa hasil sintesis Eugenol Warna Coklat Kehitaman Putih bening
Bau Tidak berbau Minyak cengkeh
Berdasar hasil pemeriksaan organoleptis ini dapat disimpulkan bahwa
senyawa hasil sintesis telah berbeda dari eugenol yang digunakan sebagai starting material sehingga dapat disimpulkan telah terbentuk senyawa baru.
2. Uji kromatografi lapis tipis (KLT)
Uji Kromatografi Lapis Tipis (KLT) pada percobaan ini dipergunakan
untuk mengidentifikasi terbentuknya senyawa baru yang berbeda dengan eugenol.
Dengan terbentuknya bercak baru sebagai hasil pemisahan dari senyawa hasil
sintesis dengan Rf yang berbeda dengan Rf bercak milik eugenol menunjukkan
telah terbentuk senyawa baru.
Sistem KLT yang digunakan adalah kromatografi fase normal dengan fase
diam adalah silika gel 60 GF254 yang bersifat polar serta fase gerak toluena : etil
asetat (93 : 7) yang bersifat non polar. Eugenol dapat dipisahkan dari suatu
campuran senyawa dengan menggunakan fase diam silika gel serta fase gerak
berupa campuran toluena : etil asetat (97 : 3). Penggunaan fase gerak toluena : etil
asetat (97 : 3) untuk memisahkan senyawa hasil sintesis yang diduga bersifat lebih
non polar daripada eugenol dimungkinkan dapat menyebabkan t-butil eugenol terelusi hingga mencapai batas jarak pengembangan fase gerak. Oleh karena itu,
dilakukan modifikasi fase gerak yaitu dengan menggunakan campuran toluena :
etil asetat (93 : 7) untuk memisahkan senyawa hasil sintesis agar diperoleh
pemisahan yang baik dengan nilai Rf tidak terlalu kecil maupun besar.
Dipergunakan fase diam silika gel 60 GF254 karena senyawa t-butil
eugenol tidak berwarna secara visible tetapi memiliki gugus kromofor, sehingga ditambahkan indikator fosforesensi yang dapat membuat lempeng berpendar serta
bercak senyawa yang memiliki sifat dapat menyerap sinar UV 254 nm akan
dari bahan anorganik sehingga tepat apabila dipergunakan fase gerak yang bersifat
organik sebab indikator fosforesensi tidak akan ikut terelusi dan tidak akan
terkumpul hanya pada bagian atas lempeng yang menyebabkan bercak tidak dapat
teramati.
Berdasarkan gambar 10 dan tabel III diketahui pada senyawa hasil sintesis
terdapat bercak dengan Rf yang berbeda dengan nilai Rf eugenol sehingga
disimpulkan bahwa telah terbentuk suatu senyawa baru yang memiliki sifat lebih
non polar dibandingkan dengan eugenol. Hal ini disebabkan senyawa yang lebih
bersifat polar akan teradsorpsi dan memiliki interaksi lebih kuat dengan fase diam
silika gel 60 GF254 yang bersifat polar daripada dengan fase geraknya, sehingga
senyawa tersebut mengalami elusi yang lebih lambat serta memiliki nilai Rf lebih
kecil dibandingkan dengan senyawa yang bersifat lebih non polar.
Gambar 10. Profil Bercak Uji Kromatografi Lapis Tipis
Keterangan :
Fase diam : Silika Gel 60 GF254 Bercak A dan E : Standar Eugenol
Fase gerak : Toluena : Etil asetat Bercak B dan F : Hasil sintesis suhu 40oC (93 : 7) Bercak C dan G : Hasil sintesis suhu 60oC Jarak elusi : 15 cm Bercak D dan H : Hasil sintesis suhu 80oC Deteksi : sinar UV 254 nm
Tabel III. Hasil Uji Kromatografi Lapis Tipis Senyawa Hasil Sintesis
Senyawa Bercak Harga Rf
Standar Eugenol A 0,60
E 0,60
Uji KLT ini menunjukkan bahwa senyawa hasil sintesis yang dihasilkan
dari variasi suhu reaksi 40oC, 60oC, dan 80oC tidak murni karena pada hasil
pengelusian terhadap masing-masing senyawa hasil sintesis tersebut
menghasilkan dua bercak. Bercak pertama pada masing-masing senyawa hasil
sintesis dengan variasi suhu 40oC, 60oC, dan 80oC yaitu bercak B, C, dan D
(Gambar 8) merupakan senyawa eugenol karena memiliki nilai Rf mendekati nilai
Rf standar eugenol. Bercak kedua pada masing-masing senyawa hasil sintesis
dengan suhu 40oC, 60oC, dan 80oC yaitu bercak F, G, dan H (Gambar 10)
3. Kromatografi gas
Kromatografi gas dapat dipergunakan untuk mengetahui tingkat
kemurnian senyawa hasil sintesis yang dapat dikombinasikan dengan spektrometri
massa. Keuntungan dari kombinasi kromatografi gas-spektrometri massa
(GC-MS) ini adalah apabila terdapat komponen senyawa hasil sintesis yang masih
bercampur dengan senyawa lain, maka senyawa yang tidak diinginkan dapat
dipisahkan dan hanya dilakukan analisis MS terhadap senyawa yang diinginkan.
Dengan demikian, diharapkan spektrum yang dihasilkan pada spektrometri massa
adalah hasil fragmentasi dari senyawa tunggal.
Gambar 11. Kromatogram Kromatografi Gas Standar Eugenol
Gambar 12. Kromatogram Kromatografi Gas Senyawa Hasil Sintesis
Analisis kualitatif terhadap kromatografi gas dapat dilakukan dengan
mengamati banyaknya jumlah puncak. Satu senyawa dapat ditunjukkan dengan
satu puncak pada kromatogram yang memiliki waktu retensi tertentu. Dilakukan
analisis kromatografi gas terhadap standar eugenol. Kromatogram yang dihasilkan
(gambar 11) menunjukkan hanya terdapat 1 puncak yaitu eugenol dengan waktu
retensi 19,120 menit. Berdasarkan gambar 12 diketahui bahwa senyawa hasil
sintesis tidak murni karena terdapat 42 puncak pada kromatogram yang
menunjukkan bahwa pada senyawa hasil sintesis terdapat 42 macam senyawa.
Untuk mengetahui senyawa yang dihasilkan maka dilakukan spektrometri massa
pada puncak-puncak tersebut dan dilakukan intrepretasi terhadap spektrum MS.
4. Perhitungan jumlah senyawa hasil sintesis
Dilakukan penghitungan luas area bercak terhadap hasil uji Kromatografi
Lapis Tipis (KLT) gambar 10 dengan menggunakan program ImageJ. Hasil pada tabel IV menunjukkan dengan semakin meningkatnya suhu reaksi menyebabkan
peningkatan jumlah senyawa hasil sintesis yang semakin besar.
Tabel IV. Peningkatan Jumlah Senyawa Hasil Sintesis
Senyawa Peningkatan Jumlah Senyawa Hasil Sintesis
Hasil sintesis suhu 40oC 0 %
Hasil sintesis suhu 60oC 159,461 %
Peningkatan suhu reaksi dapat mempengaruhi dua faktor, yaitu :
a. Meningkatkan kecepatan pergerakan molekul eugenol dan t-butil sehingga molekul-molekul akan memiliki frekuensi tumbukan yang lebih besar dan
meningkatkan laju reaksi.
b. Meningkatkan energi yang dimiliki oleh molekul eugenol dan t-butil sehingga terdapat lebih banyak molekul yang memiliki energi melebihi energi aktivasi.
Terlampauinya energi aktivasi ini akan mengawali terjadinya reaksi alkilasi
Friedel-Craft dimana ikatan molekul eugenol dan t-butil akan berubah menjadi ikatan molekul produk. Peningkatan frekuensi dan energi ini dapat
meningkatkan laju reaksi alkilasi Friedel-Craft.
5. Elusidasi senyawa hasil sintesis
Spektra massa digunakan untuk menentukan bobot molekul suatu senyawa
serta untuk mengetahui kerangka molekul senyawa hasil sintesis melalui
interpretasi fragmen-fragmen yang dihasilkan.
Gambar 13. Spektrum Massa Standar Eugenol
Gambar 14. Spektrum Massa Senyawa Hasil Sintesis ke-40
Keterangan :
A = puncak dengan rasio m/z = 276 menunjukkan ion molekuler senyawa hasil sintesis (di-t-butil eugenol)
B = puncak dengan rasio m/z = 261 menunjukkan fragmen ion C17H25O2+
C = puncak dengan rasio m/z = 205 menunjukkan fragmen ion C13H18O2+
D = puncak dengan rasio m/z = 57 menunjukkan fragmen karbokation t-butil E = puncak dengan rasio m/z = 41 menunjukkan fragmen ion C3H5+
Puncak ion molekuler ini bersifat tidak stabil sehingga dapat terpecah
menjadi fragmen-fragmen ion molekuler dengan rasio m/z yang lebih kecil, baik
berupa radikal bebas, fragmen netral, maupun ion-ion. Hanya fragmen yang
bermuatan positif dan radikal positif yang dapat teridentifikasi pada spektrometri
massa ini.
Berdasarkan 42 macam senyawa yang tampak dalam kromatogram GC,
ditentukan senyawa yang dapat diidentifikasi yaitu pada puncak kromatogram
ke-40 yang memiliki waktu retensi 17,706 menit. Hasil spektrum senyawa tersebut
(gambar 14) dapat dianalisis mulai dari sisi sebelah kanan menuju kiri yaitu
dimulai dari puncak A yang memiliki ion molekular (m/z) sebesar 276. Nilai m/z
sebesar 276 ini menunjukkan bobot molekul (BM) senyawa hasil sintesis.
Senyawa yang memiliki BM 276 ini sama dengan bobot molekul senyawa
2-metoksi-3,6-di-t-butil-4-(2’-propenil)fenol atau disebut di-t-butil eugenol yang dapat ditegaskan dengan pola fragmentasi MS pada puncak B, C, dan D.
Puncak B (m/z 261) merupakan fragmen dari ion molekul yang mengalami
pelepasan radikal metil menghasilkan ion C17H25O2+. Puncak C (m/z 205)
merupakan ion C13H18O2+. Puncak D (m/z 57) merupakan fragmen dari ion
-butil. Puncak E (m/z 41) merupakan fragmen dari ion molekul yang mengalami
Gambar 15. Fragmentasi di-t-Butil Eugenol
Berdasarkan hasil spektrometri massa tersebut dapat disimpulkan bahwa
senyawa hasil sintesis yang terbentuk adalah di-t-butil eugenol. Terbentuknya
di-t-butil eugenol karena terjadi di-alkilasi pada eugenol (Gambar 16) yang merupakan batasan ke-3 pada reaksi alkilasi Friedel-Craft yaitu reaksi alkilasi
Friedel-Craft sering kali sulit untuk menghentikan reaksinya setelah terjadi
substitusi tunggal.
Terdapat tiga macam gugus yang terdapat pada eugenol yaitu gugus
metoksi (-OCH3), gugus hidroksi (-OH), serta gugus propenil (-CH2-CH=CH2)
yang akan mempengaruhi posisi substitusi gugus t-butil yang akan masuk. Ketiga gugus tersebut merupakan gugus aktivator sehingga bersifat sebagai pengarah orto
dan para. Posisi atom C nomor 3, 5, dan 6 memiliki peluang untuk menerima substitusi gugus t-butil dan proses di-alkilasi ini terjadi melalui 2 tahapan sebagai berikut :
a. Gugus t-butil pertama akan masuk pada posisi nomor 6 karena halangan sterik yang kecil yaitu hanya terdapat gugus hidroksi yang kurang meruah sehingga
gugus t-butil dapat dengan mudah mengalami reaksi substitusi pada atom C nomor 6.
b. Gugus t-butil kedua akan masuk pada posisi orto terhadap gugus metoksi dan propenil (nomor 3) akibat halangan sterik yang lebih kecil daripada atom C
nomor 5 yang memiliki halangan sterik lebih besar akibat adanya gugus yang
+ FeCl3 t-Butil Klorida Besi (III) Klorida
FeCl4- + H+ FeCl3 + HCl t-Butil Klorida Besi (III) Klorida
FeCl4- + H+ FeCl3 + HCl
Gambar 16. Mekanisme Sintesis di-t-Butil Eugenol
Di-alkilasi dapat terjadi akibat pengaruh substitusi gugus t-butil yang pertama pada posisi atom C nomor 6 (Gambar 9). Gugus t-butil bersifat sebagai gugus aktivator sehingga dapat meningkatkan kereaktifan cincin benzena dan
dapat menyebabkan terjadi reaksi dengan gugus t-butil kedua yang berlangsung lebih cepat daripada reaksi pertamanya. Di-alkilasi ini juga disebabkan karena penggunaan eugenol yang lebih kecil daripada t-butil klorida dengan perbandingan mol eugenol : t-butil klorida sebesar 1 : 5. Jumlah t-butil klorida yang berlebih menyebabkan semakin besar kemungkinan eugenol bertemu dengan
t-butil klorida dalam satu sistem sehingga dapat terjadi substitusi kedua pada eugenol menghasilkan di-t-butil eugenol. Untuk mencegah terjadinya di-alkilasi ini dapat dipergunakan perbandingan eugenol dan t-butil klorida sebesar 1 : 1 agar hanya terjadi monoalkilasi pada eugenol sehingga dapat dihasilkan t-butil eugenol.
Tidak terjadi alkilasi ketiga pada eugenol pada posisi atom C nomor 5
karena terdapat gugus meruah berupa gugus t-butil dan propenil pada posisi orto
terhadap atom C nomor 5 yang menimbulkan halangan sterik sehingga
mempersulit gugus t-butil ketiga untuk mendekat dan mengalami reaksi substitusi.
BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
1. Tidak dihasilkan t-butil eugenol dari sintesis eugenol dan t-butil klorida dengan katalis FeCl3.
2. Pada reaksi antara eugenol dan t-butil klorida dengan katalis FeCl3 pada
variasi suhu reaksi 40o, 60o, dan 80oC menghasilkan 42 macam senyawa, salah
satunya adalah senyawa di-t-butil eugenol.
3. Suhu reaksi 80oC menghasilkan peningkatan jumlah senyawa hasil sintesis
terbesar dibandingkan terhadap senyawa hasil sintesis suhu 40oC berdasarkan
AUC yaitu 1.096,280 %.
B. Saran
Dilakukan elusidasi struktur terhadap bercak baru hasil uji kromatografi lapis tipis
preparatif.
DAFTAR PUSTAKA
Anonim, 2001, Merck Index 13th edition : An Encyclopedia of Chemicals, Drugs, and Biological, 239, 612, Merck & Co., Inc., USA.
Bresnick, S.D., 2004, Intisari Kimia Organik, 29-31, 96-97, 101-107, Penerbit Hipokrates, Jakarta.
Chang, R., 2003, Kimia Dasar Konsep-Konsep Inti, jilid dua, edisi ketiga, 44, Penerbit Erlangga, Jakarta.
Collins, T. J., 2007, ImageJ for Microscopy,
http://www.biotechniques.com/BiotechniquesJournal/supplements/2007/Ju ly/ImageJ-for-microscopy/biotechniques-42894.html, diakses tanggal 26 September 2009.
Corwin, C.H., 2001, Introductory Chemisrty Concepts & Connections, 3rd edition, 452, 453, Prentice-Hall, Inc., New Jersey.
Dean, J.A., 1995, Analytical Chemistry Handbook, 13, 26, 98-100, McGraw-Hill, New York.
Fessenden, R.J., dan Fessenden, J.S., 1986a, Kimia Organik, diterjemahkan oleh Pudjaatmaka, A.H., edisi III, jilid I, 269, 271, 327-341, 471-472, Penerbit Erlangga, Jakarta.
Fessenden, R.J., dan Fessenden, J.S., 1986b, Kimia Organik, diterjemahkan oleh Pudjaatmaka, A.H., edisi III, jilid II, 454, Penerbit Erlangga, Jakarta.
Gasparic, J., and Churacek, J., 1978, Laboratory Handbook of Paper and Thin-layer Chromatography, 63, Ellis Horwood Limited, England.
Gitawati, R., 1995, Radikal Bebas : Sifat dan peranan dalam Menimbulkan Kerusakan Sel, Cermin Dunia Kedokteran, 102, 33-35.
Gritter, J. R., Bobbit, J. M., dan Scharting, A. E., 1991, Pengantar Kromatografi, diterjemahkan oleh Kosasih Padmawinata, edisi II, 109-112, ITB, Bandung.
Halliwell, B., and Gutteridge, J.M.C., 1999, Free Radicals in Biology and Medicine, 3rd ed., 368-369, Oxford University Press, New York.
Isaacs, N., 1995, Physical Organic Chemistry, 2nd ed., 193, 194, Longman Group Limited, United Kingdom Curtis.
Keenan, C.W., Kleinfelter, D.C., dan Wood, J.H., 1980, Ilmu Kimia untuk Universitas, 521, 522, Erlangga, Jakarta.
Kumalaningsih, S., 2007, Antioksidan Alami, Penangkal Radikal Bebas, Trubus Agrisarana, 2-22.
Morquio, A., Rivera-Megret, F., and Dajas, F., 2005, Photoprotection by Topical Application of Achyrocline satureioides (‘Marcela’), Phytotherapy Research, 19(6), 486-490.
Murry, M.J., 2004, Organic Chemistry, 6th edition, 535-537, Thomson Learning, Inc., USA.
Ogata, M., Hoshi, M., Urano, S., and Endo, T., 2000, Antioksidant Activity of Eugenol dan Related Monomeric and Dimeric Compounds,Chem. Pharm. Bull., 48(10), 1467-1469.
Petrucci, R. H., 1987, Kimia Dasar Prinsip dan Terapan Modern, edisi keempat, jilid 2, 168, Penerbit Erlangga, Jakarta.
Rajeshwar, Y., Kumar, G.P.S., Gupta, M., and Mazunder, U.K., 2005, Studies On In Vitro Antioxidant Activities of Methanol Extract of Mucuma pruriens (Fabaceae) Seeds, Eur. Bull. Drug Res., 13 (1), 31-39.
Reinking, L., 2001, Examples of Image Analysis Using ImageJ, imagej.sourceforge.net/docs/pdfs/examples.pdf, diakses tanggal 26 September 2009.
Samhoedi, M., 1980, Elusidasi Struktur – Penentuan Struktur dengan Pertolongan Metoda Spektroskopik UV, IR, H1-NMR, C13-NMR, MS, Fakultas Farmasi Universitas Gadjah Mada, Yogyakarta.
Sastrohamidjojo, H., 1991, Kromatografi, edisi II, 11, 34-36, 41, 46, 99, 100, 163, 164, Liberty, Yogyakarta.
Sastrohamidjojo, H., 2008, The Prospect of Indonesian Essential Oils Industry, http://chem.uii.ac.id/Prof%20Jon/Prospek_Atsiri_di_Indonesia.pdf,
diakses tanggal 26 April 2009.
Segi, M., Nakajima, T., and Suga S., 1980, Comparison of Lewis Acids as catalyst for the Alkylation of Benzene with s-Butyl Chloride, Bull. Chem. Soc. Jpn., 53, 1465-1466, Kanazawa University, Kanazawa.
Silberberg, M.S., 2006, Chemistry The Molecular Nature of Matter and Change, 4th edition, 694, 695, McGraw-Hill, New York.