SINTESIS BUTIL EUGENOL DARI EUGENOL DAN TERSIER-BUTIL KLORIDA DENGAN VARIASI KATALIS ALUMINIUM
KLORIDA DAN BESI (III) KLORIDA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh : Handayani NIM : 068114146
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh : Handayani NIM : 068114146
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
v
HALAMAN PERSEMBAHAN
Every generation of scientific men (i.e. scientists) starts where
the previous left off,
and the most advance discoveries of one age constitute
elementary axioms of the next.
Aldous Huxley
Special dedicated to :
My beloved Father,Mom, sisters and brothers
vi Nama : Handayani
NIM : 068114146
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul :
SINTESIS BUTIL EUGENOL DARI EUGENOL DAN
TERSIER-BUTIL KLORIDA DENGAN VARIASI KATALIS ALUMINIUM
KLORIDA DAN BESI (III) KLORIDA
berserta perangkat yang diperlukan. Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan mempublikasikan di internet atau media lain untuk kepentingan akademis tanpa perlu meminta izin dari saya maupun memberikan royalti kepada saya selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini yang saya buat dengan sebenarnya.
Dibuat di Yogyakarta
Pada tanggal 21 Januari 2010
Yang menyatakan
vii PRAKATA
Puji syukur penulis panjatkan kepada Tuhan Yesus Kristus atas semua rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi yang berjudul “Sintesis Tersier-Butil Eugenol dari Eugenol dan Tersier-Butil Klorida dengan Variasi Katalis Aluminium Klorida dan
Besi (III) Klorida”. Skripsi ini disusun dalam rangka memenuhi salah satu syarat untuk memperoleh gelar Sarjana Farmasi (S. Farm).
Selama penelitian dan penyusunan skripsi ini, penulis tidak terlepas dari bantuan dan dukungan berbagai pihak. Oleh karena itu, penulis mengucapkan terima kasih kepada :
1. Rita Suhadi, M.Si., Apt selaku Dekan Fakultas Farmasi Universitas Sanata Dharma.
2. Jeffry Julianus, M.Si., selaku dosen pembimbing atas kesediaannya dalam memberikan arahan, dukungan dan masukan dalam penelitian dan penulisan skripsi ini.
3. Dra. M. M. Yetty Tjandrawati, M.Si. atas kesediaannya dalam memberikan arahan dukungan dan menjadi dosen penguji atas masukan berupa saran dan kritik yang membangun.
viii
membantu dan memberi kepercayaan selama bekerja di laboratorium. 6. Hendrix, koko dan saudara yang telah mendukung penulis selama ini.
7. Tersier-Butil Eugenol Team 2009 yaitu Marissa Winata, Vita Felicia, Prasetya Jati dan Linda Setiawati atas keceriaan, kebersamaan di laboratorium dan perjuangan baik suka maupun duka yang telah kita lalui bersama.
8. Henny Puspitasari atas bantuan, keceriaan dan kebersamaan kita selama ini. 9. David Christiansen, Fian, Yoyok, dkk atas kebersamaan dan keceriaan yang
singkat di laboratorium lantai 4.
10.Six CP Girls yaitu Maya Christina, Winda Sugijanto, Marisa Anggraini, Vilia Inggriani dan Vionni atas persahabatan dan dukungannya.
11.Keluarga besar Kost Gracia atas keceriaan, kekompakan dan dukungannya kepada penulis.
12.Wiwit, Irene Christina, Jimbong, Reni, Eka, Lia Yumi, dan teman-teman lainnya atas kebersamaan dan kekompakan di kampus.
13.Teman-teman FST angkatan 2006, khususnya kelas A atas kebersamaan yang diberikan selama 3,5 tahun ini.
14.Semua pihak yang turut membantu dalam penyusunan skripsi ini.
ix
memberikan manfaat bagi semua pihak serta mendukung perkembangan ilmu pengetahuan.
Yogyakarta, 12 Januari 2010
Penulis,
x
Penulis menyatakan dengan sesungguhnya bahwa skripsi yang penulis tulis ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 12 Januari 2010
Penulis,
xi INTISARI
Kemampuan eugenol sebagai antioksidan masih rendah, salah satu cara untuk meningkatkan aktivitas antioksidan eugenol yaitu menambahkan gugus meruah seperti tersier-butil (t-butil) pada posisi orto dari gugus hidroksi fenolik eugenol sehingga dihasilkan t-butil eugenol. Sintesis t-butil eugenol dilakukan dengan mereaksikan eugenol dan t-butil klorida dengan variasi katalis aluminium klorida (AlCl3) dan besi (III) klorida (FeCl3) yang akan mempengaruhi jumlah
senyawa hasil sintesis.
Senyawa hasil sintesis dilakukan serangkaian analisis berupa uji organoleptis, kromatografi lapis tipis, kromatografi gas dan elusidasi struktur senyawa menggunakan spektrometri massa. Sedangkan analisis kuantitatif yaitu perhitungan AUC senyawa hasil sintesis menggunakan program Image J.
Berdasarkan perhitungan Area Under Curve (AUC) pada KLT, senyawa hasil sintesis pada penggunaan katalis AlCl3 sebesar 10341,024 dan pada
penggunaan katalis FeCl3 sebesar 6766,924. Elusidasi struktur menunjukkan pada
penggunaan katalis AlCl3 menghasilkan 33 macam senyawa dimana dari 5
senyawa yang dianalisis salah satunya adalah t-butil eugenol, sedangkan pada katalis FeCl3 dihasilkan 42 macam senyawa yang tidak dihasilkan t-butil eugenol,
namun dihasilkan di-t-butil eugenol.
xii
eugenol antioxidant activity was added tertiary-butyl (t-butyl) as bulky group on orto position from phenolic hydroxy group of eugenol, therefore it could present t-butyl eugenol. The synthesis of t-butyl eugenol reacted eugenol and t-butyl chloride with variation catalysts of aluminium chloride (AlCl3) or ferric chloride
(FeCl3) which would affect the amount of synthesis result.
The synthesis product was tested by the several analyzing such as organoleptic, thin layer chromatography, gas chromatography and structure elucidation was used mass spectrometry. While the quantitative analysis was to calculated the synthesis product using Image J program.
Based on the Area Under Curve (AUC) calculation of thin layer chromatography, showed that the synthesis product using AlCl3 as catalyst was
10341,024 and the using FeCl3 as catalyst was 6766,924. Structure elucidation
showed that on using AlCl3 as catalyst presented 33 variant products resulted one
of the products was t-butyl eugenol which was analyzed from 5 variant products, while using FeCl3 as catalyst presented 42 variant products which was not
obtained t-butyl eugenol but di-t-butyl eugenol.
xiii DAFTAR ISI
Halaman
HALAMAN JUDUL ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN SKRIPSI ... iv
HALAMAN PERSEMBAHAN ... v
PERSETUJUAN PUBLIKASI ... vi
PRAKATA ... vii
PERNYATAAN KEASLIAN KARYA ... x
xiv
A. Antioksidan ... 6
B. Eugenol ... 7
C. Sintesis Tersier-Butil Eugenol ... 8
D. Reaksi Substitusi Nukleofilik 1 (SN 1) ... 9
E. Tersier-Butil Klorida ... 10
F. Katalis Alkilasi Friedel-Crafts ... 11
G. Efek Pelarut ... 13
H. Analisis Hasil ... 14
1. Uji organoleptis ... 14
2. Kromatografi lapis tipis (KLT) ... 15
3. Kromatografi gas (GC) ... 16
I. Elusidasi Struktur ... 17
J. Perhitungan Jumlah Senyawa Hasil Sintesis dengan Program Image J ... 18
K. Landasan Teori ... 18
L. Hipotesis ... 20
BAB III. METODE PENELITIAN... 21
A. Jenis dan Rancangan Penelitian ... 21
B. Variabel Penelitian dan Definisi Operasional ... 21
C. Bahan atau Materi Penelitian ... 21
xv
E. Tata Cara Penelitian ... 22
1. Sintesis tersier-butil klorida ... 22
2. Sintesis tersier-butil eugenol dengan katalis aluminium klorida (AlCl3) ... 23
3. Sintesis tersier-butil eugenol dengan katalis besi (III) klorida (FeCl3) ... 23
F. Analisis Hasil ... 24
1. Uji organoleptis ... 24
2. Kromatografi lapis tipis (KLT) ... 24
3. Kromatografi gas (GC) ... 25
4. Elusidasi struktur dengan spektrometri massa (MS) ... 25
5. Perhitungan jumlah senyawa hasil sintesis menggunakan program Image J ... 26
BAB IV. HASIL DAN PEMBAHASAN ... 27
A. Sintesis Tersier-Butil Klorida ... 27
B. Sintesis Tersier-Butil Eugenol ... 29
C. Analisis Senyawa Hasil Sintesis ... 35
1. Uji organoleptis ... 35
2. Kromatografi lapis tipis (KLT) ... 36
3. Kromatografi gas (GC) dan spektrometri massa (MS) senyawa hasil sintesis pada penggunaan katalis AlCl3 ... 40
xvi
A. Kesimpulan ... 53
B. Saran ... 53
DAFTAR PUSTAKA ... 54
LAMPIRAN ... 57
xvii
DAFTAR TABEL
Halaman
Tabel I. Klasifikasi Katalis dalam Reaksi Alkilasi Friedel-Crafts ... 12 Tabel II. Hasil Uji Organoleptis Senyawa Hasil Sintesis Menggunakan
Katalis Aluminium Klorida (AlCl3) ... 35
Tabel III. Hasil Uji Organoleptis Senyawa Hasil Sintesis Menggunakan
Katalis Besi (III) Klorida (FeCl3) ... 36
Tabel IV. Harga Rf Kromatografi Lapis Tipis (KLT) Senyawa Hasil
xviii
Gambar 2. Contoh Mekanisme Reaksi SN 1 pada t-Butil Bromida ... 9
Gambar 3. Struktur Tersier-Butil Klorida... 10 Gambar 4. Hubungan Kenaikan Energi dan Kecepatan Reaksi Terhadap
Penggunaan Katalis. ... 11 Gambar 5. Struktur Dietil Eter ... 14 Gambar 6. Reaksi Sintesis Tersier-Butil Eugenol Melalui Reaksi Alkilasi
Friedel-Crafts ... 19 Gambar 7. Mekanisme Pembentukan Tersier-Butil Klorida ... 27 Gambar 8. Tahap Pembentukan Karbokation Tersier-Butil Menggunakan
Katalis Aluminium Klorida (AlCl3) ... 30
Gambar 9. Tahap Penyerangan Eugenol Terhadap Karbokation Tersier-
Butil ... 30 Gambar 10. Pembentukan Tersier-Butil Eugenol (Rearomatisasi) ... 30 Gambar 11. Tahap Pembentukan Karbokation Tersier-Butil Menggunakan
Katalis Besi (III) Klorida (FeCl3) ... 32
Gambar 12. Tahap Penyerangan Eugenol Terhadap Karbokation Tersier-
Butil ... 32 Gambar 13. Pembentukan Tersier-Butil Eugenol (Rearomatisasi) ... 32 Gambar 14. Gambar Kromatogram Kromatografi Lapis Tipis (KLT)
xix
Gambar 15. Kromatogram Kromatografi Gas (GC) Eugenol ... 40 Gambar 16. Kromatogram Kromatografi Gas (GC) Senyawa Hasil Sintesis
Menggunakan Katalis Aluminium Klorida (AlCl3) ... 41
Gambar 17. Spektrum Massa Senyawa Hasil Sintesis Puncak ke-23 pada Waktu Retensi 12,292 Menit Menggunakan Katalis Aluminium Klorida (AlCl3) ... 42
Gambar 18. Mekanisme Fragmentasi Tersier-Butil Eugenol Menggunakan
Katalis Aluminium Klorida (AlCl3) ... 43
Gambar 19. Kromatogram Kromatografi Gas (GC) Senyawa Hasil Sintesis Menggunakan Katalis Besi (III) Klorida (FeCl3) ... 45
Gambar 20. Spektrum Massa Senyawa Hasil Sintesis Puncak ke-40 pada Waktu Retensi 17,706 Menit Menggunakan Katalis Besi (III) Klorida (FeCl3) ... 46
Gambar 21. Mekanisme Reaksi Terbentuknya di-Tersier-Butil Eugenol pada Katalis Besi (III) Klorida (FeCl3) ... 48
Gambar 22. Pendeaktivasi Cincin Benzena Oleh Aluminium Klorida
(AlCl3) ... 49
xx
Klorida (AlCl3) yang Diperlukan Dalam Reaksi ... 57
Lampiran 2. Senyawa Hasil Sintesis Menggunakan Katalis Aluminium
Klorida (AlCl3) ... 59
Lampiran 3. Senyawa Hasil Sintesis Menggunakan Katalis Besi (III)
Klorida (FeCl3) ... 59
Lampiran 4. Perhitungan Rf Senyawa Hasil Sintesis... 59
Lampiran 5. Rangkaian Alat Dalam Sintesis Tersier-Butil Eugenol ... 60 Lampiran 6. Spesifikasi Kromatografi Gas-Spektrometri Massa (GC-MS)
Eugenol ... 61 Lampiran 7. Hasil Kromatografi Gas (GC) Hasil Sintesis Eugenol ... 61 Lampiran 8. Hasil Spektrometri Massa (MS) Eugenol ... 62 Lampiran 9. Spesifikasi Kromatografi Gas-Spektrometri Massa (GC-MS)
Dalam Analisis Senyawa Hasil Sintesis Tersier-Butil
Klorida ... 63 Lampiran 10. Hasil Kromatografi Gas (GC) Hasil Sintesis Tersier-Butil
Klorida ... 64 Lampiran 11. Hasil Spektrometri Massa (MS) Hasil Sintesis Tersier-Butil
Klorida ... 65 Lampiran 12. Spesifikasi Kromatografi Gas-Spektrometri Massa (GC-MS)
xxi
Katalis Aluminium Klorida (AlCl3) ... 66
Lampiran 13. Hasil Kromatografi Gas (GC) Senyawa Hasil Sintesis
Menggunakan Katalis Aluminium Klorida (AlCl3) ... 67
Lampiran 14. Hasil Spektrometri Massa (MS) Senyawa Hasil Sintesis
Menggunakan Katalis Aluminium Klorida (AlCl3) ... 68
Lampiran 15. Spesifikasi Kromatografi Gas-Spektrometri Massa (GC-MS) Dalam Analisis Senyawa Hasil Sintesis yang Menggunakan
Katalis Besi (III) Klorida (FeCl3) ... 73
Lampiran 16. Hasil Kromatografi Gas (GC) Senyawa Hasil Sintesis
Menggunakan Katalis Besi (III) Klorida (FeCl3) ... 74
Lampiran 17. Hasil Spektrometri Massa (MS) Senyawa Hasil Sintesis
1
A. Latar Belakang
Berbagai penelitian telah dilakukan untuk mendapatkan senyawa-senyawa antioksidan. Hal ini disebabkan karena timbulnya berbagai macam penyakit yang disebabkan oleh proses oksidasi radikal bebas di dalam tubuh, sehingga dapat membahayakan kelangsungan hidup jika tidak segera ditanggulangi. Oleh karena itu, senyawa antioksidan sangat diperlukan oleh tubuh untuk menetralkan radikal bebas yang masuk ke dalam tubuh.
Senyawa antioksidan bekerja dengan cara menstabilkan radikal bebas. Mekanisme penstabilannya dengan mendonorkan radikal hidrogen secara cepat ke radikal bebas, sehingga dapat menghambat terjadinya reaksi berantai dari pembentukan radikal bebas yang menyebabkan tekanan oksidatif pada sel normal di dalam tubuh (Gordon, 1990).
Senyawa yang telah diketahui mempunyai potensi antioksidan adalah senyawa eugenol, Indonesia termasuk penghasil minyak cengkeh dalam jumlah besar dan mudah ditemukan di seluruh wilayah Indonesia (Guenther, 1950). Faktor tersebut yang mendorong penelitian senyawa-senyawa antioksidan alami ini.
2
kemampuan eugenol dalam menangkap radikal bebas masih rendah dengan nilai IC50 > 800 μM yang diukur menggunakan metode 2,2-difenil-1-pikril hidrazil
(DPPH), alasan ini juga yang mendorong perkembangan penelitian dalam upaya untuk meningkatkan potensi antioksidan dari senyawa eugenol. Salah satunya adalah modifikasi struktur eugenol dengan penambahan gugus yang meruah pada posisi orto dari gugus hidroksi fenolik eugenol. Salah satu gugus meruah yang dapat ditambahkan adalah gugus tersier-butil (t-butil) pada posisi orto dari gugus hidroksi fenolik. Penambahan gugus meruah ini akan meningkatkan halangan sterik yang disebabkan gugus-gugus yang mempunyai ukuran molekul besar yang terikat pada cincin benzena eugenol saling berdekatan. Meningkatnya halangan sterik akan mempersulit senyawa radikal yang terbentuk untuk bereaksi kembali, sehingga senyawa radikal tersebut bersifat stabil.
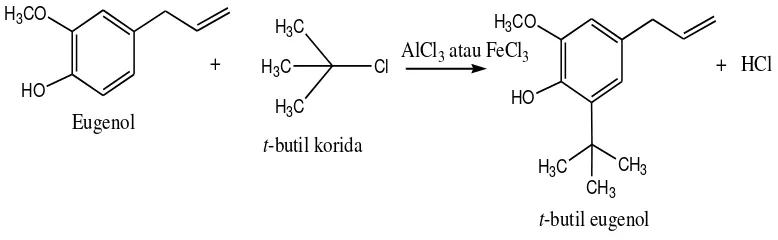
Modifikasi molekul ini dilakukan berdasarkan prinsip reaksi alkilasi Friedel-Crafts, yaitu mereaksikan suatu benzena dengan alkil halida dengan menggunakan katalis asam Lewis seperti aluminium klorida (AlCl3) (Fessenden
and Fessenden, 1986). Sintesis dilakukan dengan mereaksikan eugenol yang mempunyai cincin benzena dan t-butil klorida dengan memvariasikan katalis yaitu aluminium klorida (AlCl3) dan besi (III) klorida (FeCl3).
perbedaan kecepatan pembentukan karbokation t-butil dan mempengaruhi persentase jumlah senyawa hasil sintesis (Carey and Sunberg, 2007). Hal ini bertujuan untuk membandingkan jumlah senyawa hasil sintesis dari kedua katalis yang digunakan. Katalis AlCl3 telah banyak digunakan dalam reaksi alkilasi
Friedel-Crafts untuk membantu polarisasi senyawa alkil halida, sehingga karbokation t-butil yang terbentuk lebih mudah diserang oleh cincin aromatik seperti benzena (McMurry, 2004). Selain AlCl3 digunakan juga alternatif katalis
lain misalnya FeCl3 (Yao, 1998). Kedua katalis ini dapat dibedakan menurut
aktivitasnya sebagai asam Lewis dalam alkilasi benzena dengan t-butil klorida. Katalis AlCl3 termasuk ke dalam katalis yang keaktifannya sangat tinggi,
sedangkan FeCl3 termasuk ke dalam katalis yang keaktifannya sedang (Masahito
et al., 1980).
Perbedaan struktur molekul antara katalis AlCl3 dan FeCl3 akan
mempengaruhi kereaktifan dari kedua asam Lewis ini, dalam kemampuan membentuk karbokation t-butil. Dalam tabel periodik, atom Al terletak pada golongan IIIA sedangkan atom Fe berada di golongan VIIIB. Atom Al memiliki jari-jari atom yang lebih kecil daripada atom Fe, hal ini dibuktikan dengan ukuran jari-jari atom Al3+ adalah 0,068 Å, sedangkan atom Fe3+ adalah 1,170 Å (Fessenden dan Fessenden, 1986). Pada jari-jari atom yang lebih kecil, Al mempunyai kerapatan muatan yang lebih besar sehingga mengakibatkan kekuatan Al dalam berikatan dengan gugus metil lebih kuat, hal ini yang menyebabkan AlCl3 menjadi asam Lewis yaitu akseptor elektron yang lebih kuat dan lebih
4
Perbedaan kereaktifan tersebut akan mempengaruhi kecepatan polarisasi gugus alkil halida yaitu t-butil klorida dalam reaksi alkilasi Friedel-Crafts. Sehingga variasi penggunaan katalis ini bertujuan untuk mengetahui pengaruh perbedaan kereaktifan kedua katalis terhadap jumlah senyawa hasil sintesis. Penggunaan variasi katalis diharapkan dapat mengetahui katalis mana yang menghasilkan persentase jumlah senyawa hasil sintesis yang optimal.
1. Perumusan masalah
Berdasarkan latar belakang di atas, masalah yang muncul dapat dirumuskan sebagai berikut :
1) Apakah t-butil eugenol dapat dihasilkan dari reaksi antara eugenol dengan t-butil klorida menggunakan katalis AlCl3?
2) Apakah t-butil eugenol dapat dihasilkan dari reaksi antara eugenol dengan t-butil klorida menggunakan katalis FeCl3?
3) Apakah reaksi antara eugenol dengan t-butil klorida menggunakan katalis AlCl3 menghasilkan senyawa hasil sintesis lebih banyak dibandingkan
hasil reaksi antara eugenol dengan t-butil klorida menggunakan katalis FeCl3?
2. Keaslian penelitian
Penelitian tentang sintesis t-butil eugenol dengan mereaksikan eugenol dan t-butil klorida menggunakan variasi katalis AlCl3 dan FeCl3 sejauh
3. Manfaat penelitian
a. Manfaat teoritis. Penelitian ini diharapkan dapat menambah pengetahuan yang baru mengenai sintesis suatu senyawa untuk meningkatkan pemanfaatan eugenol yang banyak terdapat di Indonesia.
b. Manfaat metodologis. Penelitian ini diharapkan memberikan pertimbangan dalam pemilihan katalis pada sintesis t-butil eugenol dengan starting material eugenol dan t-butil klorida.
c. Manfaat praktis. Penelitian ini diharapkan dapat memberikan alternatif untuk mensintesis obat yang memiliki aktivitas sebagai antioksidan yang telah diteliti secara teoritis.
B. Tujuan Penelitian
1. Untuk mengetahui t-butil eugenol dapat dihasilkan dari reaksi antara eugenol dengan t-butil klorida menggunakan katalis AlCl3.
2. Untuk mengetahui t-butil eugenol dapat dihasilkan dari reaksi antara eugenol dengan t-butil klorida menggunakan katalis FeCl3.
3. Untuk membandingkan jumlah senyawa hasil sintesis pada reaksi antara eugenol dengan t-butil klorida menggunakan katalis AlCl3 apakah lebih
6 BAB II
PENELAAHAN PUSTAKA
A. Antioksidan
Di Indonesia terjadi peningkatan prevalensi penyakit seperti kanker, kardiovaskuler, penyumbatan pembuluh darah, stroke dan proses penuaan yang disebabkan oleh radikal bebas sehingga mendorong adanya penelitian senyawa-senyawa antioksidan yang berasal dari sumber alami (Zang et al., 2000).
Aktivitas molekul radikal bebas atau Reactive Oxygen Species (ROS) dapat pula menimbulkan kerusakan seluler, genetika, mempercepat proses penuaan dan penyakit degeneratif seperti tekanan darah tinggi serta terganggunya sistem imun tubuh (Ardiansyah, 2007).
Dalam pencegahan terjadinya stress oksidatif, yaitu keadaan yang tidak seimbang antara jumlah oksidan dan peroksidan dalam tubuh sangat dibutuhkan antioksidan. Senyawa antioksidan adalah senyawa yang mampu menghambat, memperlambat dan mencegah proses autooksidasi pada semua bahan yang mengandung lipida (Niki and Noguchi, 2000).
autooksidasi dengan pengubahan radikal lipida ke bentuk lebih stabil (Ardiansyah, 2007).
Penambahan antioksidan (AH) primer dengan konsentrasi rendah pada lipida dapat menghambat atau mencegah reaksi autooksidasi lemak dan minyak. Penambahan tersebut dapat menghalangi reaksi oksidasi pada tahap inisiasi maupun propagasi. Berikut ini reaksinya :
Inisiasi : R* + AH → RH + A* Propagasi: ROO* + AH → ROOH + A*
Radikal-radikal antioksidan (A*) yang terbentuk pada reaksi tersebut relatif stabil dan tidak mempunyai cukup energi untuk dapat bereaksi dengan molekul lipida lain membentuk radikal lipida baru.
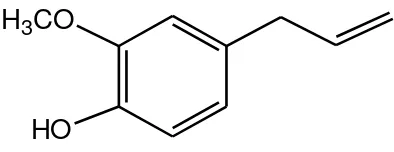
B. Eugenol
Salah satu senyawa alami yang telah diketahui mempunyai aktivitas sebagai antioksidan adalah eugenol (Ogata et al., 2000). Eugenol atau 2-metoksi-4-(2-propenil) fenol berupa cairan yang tidak berwarna atau berwarna kuning pucat, bobot molekulnya adalah 164,20 g/mol dengan titik didih 250-255°C, titik lebur -9,2°C sampai -9,1°C, berbau cengkeh dan mempunyai rasa tajam (Anonim, 2001).
8
H
3CO
HO
Gambar 1. Struktur Eugenol
C. Sintesis Tersier-Butil Eugenol
Berdasarkan strukturnya, eugenol dapat dipandang dari dua sisi yakni satu sisi mengandung gugus allil dan sisi lainnya mengandung gugus mirip katekol. Pada prinsipnya dari eugenol dapat diubah menjadi bahan dasar untuk pembuatan senyawa-senyawa yang lebih berdaya guna, salah satunya adalah senyawa t-butil eugenol (Busroni, 2000).
Aktivitas senyawa antioksidan eugenol masih lemah dengan nilai IC50 >
800 μM menggunakan metode 2,2 difenil-1-pikril hidrazil (DPPH). Rendahnya aktivitas eugenol mendorong untuk dilakukan modifikasi struktur, salah satunya adalah dengan menambahkan gugus meruah pada eugenol (Ogata et al., 2000).
Modifikasi eugenol menjadi t-butil eugenol berdasarkan prinsip reaksi alkilasi Friedel-Crafts yaitu penambahan suatu gugus alkil ke dalam cincin benzena dengan katalis asam Lewis (McMurry, 2004). Dalam reaksi modifikasi ini dilakukan penambahan gugus yang meruah pada eugenol yaitu gugus t-butil.
Reaksi Friedel-Crafts tidak terjadi pada cincin aromatik yang telah disubstitusi dengan gugus amin (–NH2, –NHR, –NR2) atau gugus penarik elektron yang
kuat (–+NR
3, –NO2, –CN, –SO3H, –CHO, –COCH3, –CO2H, –CO2CH3).
Seringkali ditemukan kesulitan dalam proses penghentian reaksi setelah substitusi pertama sehingga banyak dihasilkan produk polialkilasi.
Kadang terjadi rearrangement pada gugus alkil selama reaksi berlangsung, terutama jika digunakan alkil halida primer (McMurry, 2004).
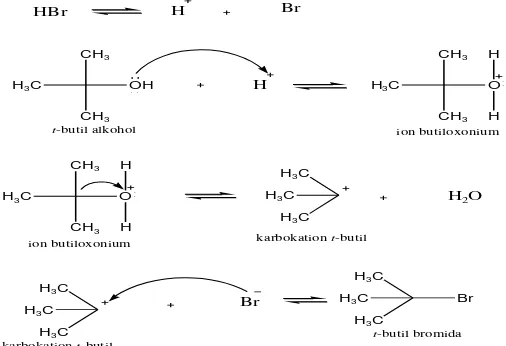
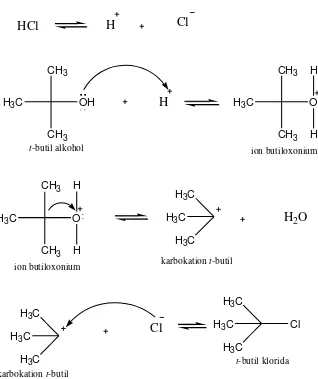
D. Reaksi Substitusi Nukleofilik 1 (SN 1)
Reaksi SN 1 merupakan reaksi subtitusi yang terjadi pada alkil halida
tersier yang memiliki rintangan sterik. Reaksi ini berlangsung secara bertahap dengan pembentukan karbokation, karbokation merupakan zat antara reaktif yang terbentuk dalam reaksi dan bereaksi lebih lanjut menghasilkan produk (Fessenden and Fessenden, 1986).
Contoh reaksi SN 1 adalah pada pembentukan t-butil bromida dari t-butil
alkohol dengan HBr. Reaksinya adalah sebagai berikut :
CH3
10
E. Tersier-Butil Klorida
Nama lain t-butil klorida adalah 2-kloro-2-metil propana dengan rumus molekul C4H9Cl dan memiliki bobot molekul 92,567260 g/mol. Sifat fisika kimia
t-butil klorida yaitu berupa cairan jernih tidak berwarna pada suhu kamar; titik
didih : 50,9ºC; titik leleh : -26,0ºC; massa jenis : 0,8420 g/ml; sulit larut air, campur dengan alkohol dan eter (Anonim, 2001).
Tersier-butil klorida merupakan suatu alkil halida yang terdiri dari suatu
atom klorida yang berikatan dengan gugus alkil tersier yaitu t-butil dalam hibridisasi sp3. Atom klorida ini yang akan menjadi gugus pergi ketika diserang oleh suatu nukleofil dalam reaksi pembentukan karbokation t-butil (Brown, 1999). Dalam ikatan karbon pada gugus t-butil dengan atom klorida, atom klorida mempunyai elektronegatifitas yang lebih besar daripada atom karbon. Pada akhirnya, gugus fungsional ini akan terpolarisasi sehingga gugus alkil berperan sebagai elektrofil dan atom klorida sebagai nukleofil (Anonim, 2008).
Keuntungan penggunaan t-butil klorida dalam sintesis t-butil eugenol adalah menghasilkan karbokation yang lebih stabil dibanding gugus alkil sekunder dan primer. Gugus alkil sekunder dan primer menghasilkan karbokation yang bersifat tidak stabil karena akan mengalami rearragement melalui perpindahan atom hidrogen menjadi gugus tersier (McMurry, 2004).
Gambar 3. Struktur Tersier-Butil Klorida
Cl H3C
H3C
F. Katalis Alkilasi Friedel-Crafts
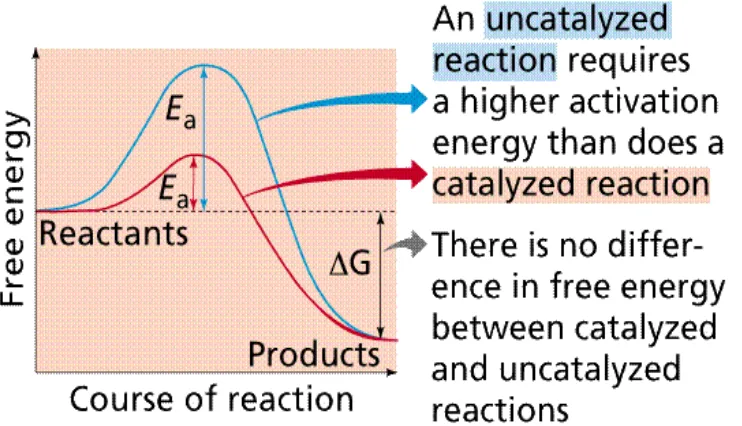
Katalis merupakan suatu substansi kimia yang dapat meningkatkan kecepatan suatu reaksi tanpa diubah dalam reaksi keseluruhan, tetapi bukan berarti katalis tidak terlibat dalam reaksi (Bruice, 1998). Pada saat reaksi berlangsung, katalis akan berada dalam bentuk yang sama sebelum dan sesudah reaksi. Semua reaksi kimia memerlukan energi aktivasi untuk memecah ikatan kimia dan bereaksi. Katalis berfungsi untuk menurunkan energi aktivasi dalam reaksi tersebut, sehingga energi yang diperlukan untuk mencapai terbentuknya produk akan lebih rendah dan reaksi akan berjalan lebih cepat (Silverman, 1992).
Gambar 4. Hubungan Kenaikan Energi dan Kecepatan Reaksi Terhadap Penggunaan Katalis (Purves et al., 2002)
12
pada t-butil klorida yang digunakan sehingga akan berpengaruh pada jumlah t-butil eugenol yang dihasilkan (Carey and Sunberg, 2007).
Katalis yang digunakan dalam sintesis t-butil eugenol adalah asam Lewis aluminium klorida (AlCl3) anhidrat. Aluminium klorida anhidrat mempunyai
bobot molekul 133,34 g/mol dan dibuat dari logam aluminium dengan pemanasan gas HCl. Sifat fisika kimia AlCl3 anhidrat yaitu: berwarna putih, abu atau kuning
kehijauan; menguap dalam udara; memiliki bau menyegat HCl; larut dalam pelarut organik contohnya benzophenone, benzena, nitrobenzena, karbon tetraklorida dan kloroform; kelarutan 1 gram AlCl3 larut dalam 0,9 ml air; 4 ml
alkohol; larut dalam eter, gliserol dan polietilenglikol (Anonim, 2001).
Selain itu juga digunakan besi (III) klorida (FeCl3) anhidrat yang
mempunyai bobot molekul 162,22 g/mol; terdiri dari ion klorida 65,57% serta ion Fe 34,43%; bersifat sangat higroskopis; titik leleh sekitar 37ºC; titik lebur 306ºC; titik didih 315ºC; larut dalam air, alkohol, aseton, dietil eter, etilamin, anilin, tapi tidak larut dalam gliserol dan pH 0,1M dalam pelarut air (Anonim, 2001).
Karakteristik dasar yang dapat dibedakan antara kedua katalis adalah atom Al mempunyai kerapatan muatan yang lebih besar ketika berikatan dengan atom Cl daripada atom Fe, sehingga kekuatan Al dalam ikatan dengan atom Cl lebih kuat. Hal ini yang menyebabkan AlCl3 menjadi asam Lewis lebih kuat dan
lebih reaktif dari FeCl3 serta perbedaan dalam klasifikasi katalis yang dapat dilihat
pada Tabel I. Perbedaan kereaktifan tersebut akan mempengaruhi kecepatan polarisasi gugus alkil halida yaitu t-butil klorida dalam reaksi sintesis t-butil eugenol.
G. Efek Pelarut
Secara umun, pelarut atau solvent terdiri dari 3 jenis, yang pertama adalah protic yaitu pelarut yang mempunyai kemampuan untuk mendonorkan proton pada gugus –OH atau gugus –NH–, yang termasuk di dalamnya adalah alkohol, amin, asam karboksilat dan air yang memiliki momen dipol yang cukup besar serta mempunyai kapasitas untuk mengikat hidrogen (Isaacs, 1995).
Jenis kedua adalah dipolar aprotic, dimana mempunyai momen dipol yang besar dan sifat donor, tapi tidak mempunyai asam untuk mendonorkan proton. Contohnya dimetil-sulfosida, alkil sianida, amida sekunder dan keton (Isaacs, 1995).
14
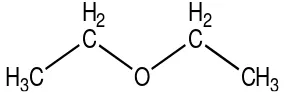
Pelarut yang digunakan dalam sintesis t-butil eugenol adalah dietil eter mempunyai rumus molekul (C2H5)2O dengan bobot molekul 74,129 g/mol,
kemurnian sebesar lebih dari 99,7%; bobot jenis pada suhu 20ºC adalah 0,713-0,715; titik didih sebesar 34-35ºC; produk stabil dengan 5-10 ppm 2,6 di-t-butil-4 metil fenol (BHT) (Anonim, 2001).
Menurut Dave et al. (2003), pelarut dietil eter mempunyai momen dipol yang kecil yaitu sebesar 3,8 . 10-30 Cm, sehingga termasuk ke dalam pelarut aprotik nonpolar yang tidak memiliki kemampuan untuk mensolvatasi nukleofil. Sifat dietil eter yang stabil ini digunakan untuk melarutkan dan menghomogenkan campuran antara starting material dan katalis tanpa mempengaruhi reaksi alkilasi Friedel-Crafts yang terjadi pada proses sintesis.
Gambar 5. Struktur Dietil Eter
H. Analisis Hasil 1. Uji organoleptis
Uji ini bertujuan untuk mengetahui sifat fisik dari senyawa hasil sintesis meliputi bentuk, warna dan bau. Uji ini dilakukan dengan membandingkan senyawa hasil sintesis dengan starting material yang digunakan. Pengujian paling sederhana ini dilakukan dengan membandingkan senyawa hasil sintesis dengan starting material yang digunakan.
Dari hasil pemeriksaan organoleptis dapat diketahui jika senyawa hasil sintesis berbeda dengan senyawa awal (starting material) maka disimpulkan telah dihasilkan senyawa yang baru (Anonim, 1995).
2. Kromatografi lapis tipis (KLT)
Kromatografi lapis tipis (KLT) merupakan metode pemisahan fisikokimia. Lapisan pemisah terdiri atas fase diam yang ditempatkan pada penyangga berupa lempeng gelas, logam atau lapisan yang cocok. Campuran yang akan dipisahkan berupa larutan yang ditotolkan membentuk bercak atau pita. Lempeng kemudian dimasukan ke dalam bejana tertutup rapat yang berisi larutan pengembang (fase gerak) yang cocok. Pemisahan terjadi selama perambatan kapiler (pengembangan). Senyawa yang tidak berwarna harus ditampakkan atau dideteksi (Hostettmann et al., 1995).
Fase diam (lapisan penjerap) dibuat dari salah satu penjerap yang khusus digunakan untuk KLT. Sedangkan fase gerak adalah medium yang terdiri atas satu atau beberapa pelarut. Jarak pengembangan senyawa pada kromatogram biasanya dinyatakan dengan angka Rf atau hRf. Harga Rf
didefinisikan sebagai perbandingan antara jarak senyawa dari titik awal dan jarak tepi pelarut dari awal.
Rf
16
Angka Rf berkisar antara 0,00-1,00 dan hanya dapat ditentukan
dengan dua desimal. Harga hRf adalah angka Rf dikalikan faktor 100 (h),
menghasilkan nilai berkisar antara 0-100 (Stahl, 1969).
Sistem KLT dapat digunakan untuk mengetahui kemurnian suatu senyawa. Suatu senyawa dinyatakan murni secara KLT apabila pada beberapa fase gerak dengan polaritas yang berbeda memberikan bercak tunggal setelah dielusi. Sebaliknya untuk senyawa yang belum murni akan memberikan bercak lebih dari satu jika dielusi (Gasparic and Churacek, 1978).
Dalam proses pengelusian bercak pada KLT, dapat terjadi peristiwa tailing. Tailing terjadi jika volume totolan terlalu banyak, pemilihan fase gerak yang kurang sesuai, ataupun chamber yang tidak jenuh sepenuhnya (Stahl, 1969).
3. Kromatografi gas (GC)
Detektor yang digunakan dalam kromatografi gas dapat dihubungkan dengan detektor spektrometri massa, sepanjang senyawa yang terdiri dari campuran dapat melewati kromatografi gas untuk diubah menjadi ion sehingga terdeteksi pada detektor spektrometri massa (Willard et al., 1988).
I. Elusidasi Struktur Spektrometri massa (MS)
Spektrometri massa (MS) adalah suatu metode analisis instrumentasi yang dipakai untuk identifikasi penentuan struktur dari komponen sampel dengan cara menunjukkan massa relatif dari molekul komponen dan massa relatif dari pecahannya (Sastrohamidjojo, 2001).
Dasar spektrometri massa adalah penembakan elektron dengan molekul berenergi tertentu yang cukup untuk mengalahkan potensial ionisasi pertama senyawa tersebut, sehingga molekul akan terpecah sesuai dengan aturan, terjamin keterulangannya dan teramalkan. Senyawa organik dalam keadaan gas dikenai elektron yang berenergi tinggi, tabrakan antara sebuah molekul dan elektron berenergi tinggi tersebut menyebabkan lepasnya sebuah elektron dari molekul tersebut sehingga terbentuk ion. Ion molekul yang dihasilkan tidak stabil sehingga pecah menjadi fragmen-fragmen kecil berupa radikal bebas maupun ion-ion lain, selanjutnya fragmen yang bermuatan positif akan dideteksi (Sastrohamidjojo, 2001).
18
senyawa berdasarkan pola ion fragmen yang terbentuk dan untuk memperkirakan mekanisme reaksi berdasarkan pola fragmentasi yang terjadi dalam usaha penentuan struktur senyawa hasil sintesis.
J. Perhitungan Jumlah Senyawa Hasil Sintesis dengan Program Image J Image J merupakan program yang didesain dengan teknik arsitektur yang
membantu proses penyajian data berupa gambar, editing, analisis dan pengolahan data berupa gambar dengan komputerisasi. Penggunaannya sudah banyak ditemui pada analisis three-dimensional live-cell imaging, radiological image processing, serta analisis data KLT untuk mengetahui luas daerah bercak (Freykamp, 2009).
Prinsip kerja program image J adalah gambar berupa foto lempeng KLT diubah ataupun diatur kekontrasannya supaya lebih jelas, kemudian dianalisis kuantitatif luas daerah plot yang kita inginkan (Anonim, 2009). Setelah diproses dan didapatkan luas daerah bercak senyawa hasil sintesis kemudian dihitung jumlah senyawa hasil sintesis.
K. Landasan Teori
Peningkatan aktivitas antioksidan dapat dilakukan dengan memodifikasi senyawa eugenol dengan menambahkan gugus t-butil pada eugenol. Penambahan gugus t-butil ke dalam eugenol dapat dilakukan berdasarkan reaksi alkilasi Friedel-Crafts sehingga dihasilkan t-butil eugenol. Reaksi alkilasi Friedel-Crafts adalah reaksi antara alkil halida dan senyawa aromatis dengan katalis asam Lewis.
Gambar 6. Reaksi Sintesis Tersier-Butil Eugenol Melalui Reaksi Alkilasi Friedel-Crafts
Dalam sintesis t-butil eugenol ini, alkil halida yang digunakan adalah t-butil klorida yang akan terpolarisasi menjadi karbokation t-t-butil yang bermuatan positif, sehingga akan mempermudah reaksi dengan cincin benzena pada eugenol yang bermuatan negatif. Gugus t-butil akan masuk ke posisi orto dari gugus hidroksi fenolik. Sehingga dengan penambahan gugus t-butil akan menambah gugus meruah pada posisi orto dari gugus hidroksi fenolik.
Dalam sintesis t-butil eugenol digunakan variasi katalis asam Lewis yaitu AlCl3 dan FeCl3 yang telah banyak digunakan dalam reaksi alkilasi Friedel-Crafts.
Perbedaan katalis yang digunakan dapat mempengaruhi persentase jumlah senyawa hasil sintesis. Hal ini disebabkan oleh kerapatan muatan antara atom Al dengan atom Cl lebih tinggi daripada atom Fe, sehingga mengakibatkan adanya perbedaan reaktifitas dimana AlCl3 lebih reaktif dari FeCl3. Perbedaan reaktifitas
20
dari kedua katalis yang mempengaruhi kemampuan dalam membentuk karbokation t-butil yang akan masuk pada posisi orto dari hidroksi fenolik. Adanya perbedaan kemampuan membentuk t-butil eugenol disebabkan oleh aluminium klorida (AlCl3) yang lebih reaktif dari besi (III) klorida (FeCl3) akan
menghasilkan karbokation t-butil yang lebih banyak, sehingga t-butil eugenol yang dihasilkan juga lebih banyak.
L. Hipotesis
Berdasarkan landasan teori di atas, hipotesis dari penelitian ini adalah: 1) Tersier-butil eugenol dapat dihasilkan dari reaksi antara eugenol dengan
t-butil klorida menggunakan katalis AlCl3.
2) Tersier-butil eugenol dapat dihasilkan dari reaksi antara eugenol dengan t-butil klorida menggunakan katalis FeCl3.
3) Reaksi antara eugenol dengan t-butil klorida menggunakan katalis AlCl3
21 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan suatu penelitian eksperimental deskriptif.
B. Variabel Penelitian dan Definisi Operasional
a. Starting material adalah senyawa awal yang digunakan dalam proses sintesis dengan tujuan untuk mendapatkan senyawa yang kita inginkan. Starting material dalam penelitian ini adalah eugenol dan t-butil klorida.
b. Molekul target adalah senyawa akhir yang dihasilkan melalui proses reaksi starting material dengan katalis. Molekul target dalam penelitian ini adalah
t-butil eugenol.
c. Katalis adalah senyawa yang digunakan untuk mempercepat reaksi pembentukan molekul target. Katalis yang digunakan dalam penelitian ini adalah AlCl3 dan FeCl3.
C. Bahan atau Materi Penelitian
22
D. Alat
Labu alas bulat 500 ml (Iwaki pyrex), Allihn condensor (Brand, West Germany), statif dan klem, Erlenmeyer bertutup (Duran schott mainz),
termometer raksa, corong kaca, gelas ukur (Iwaki pyrex), labu ukur (Iwaki pyrex), pipet ukur (Brand), gelas arloji, gelas pengaduk, corong pisah, kompor listrik (Herdolph MR 2002), timbangan elektrik (Mextler PM 100), thermopan (electrothermal 9100), oven (Memmert oven model 400), kromatografi gas-spektrometer massa (Shimadzu QP2010S), micropipette (Socorex, Swiss), lampu UV254 nm (Desaga, Germany), beaker glass (Duran schott mainz), pipet gondok,
baskom, pompa air 2400L (Kyodo, Indonesia) dan alat gelas lainnya.
E. Tata Cara Penelitian 1. Sintesis tersier-butil klorida
Tersier-butil alkohol sebanyak 5 ml dicampur dengan 13 ml larutan asam
2. Sintesis tersier-butil eugenol dengan katalis aluminium klorida (AlCl3) Aluminium klorida anhidrat sebanyak 4,333 g dilarutkan dalam 100 ml dietil eter, kemudian dimasukkan dalam labu alas bulat yang memiliki penutup kaca. Tersier butil klorida sebanyak 3,6 ml ditambahkan ke dalam labu alas bulat yang berisi campuran katalis aluminium klorida dan pelarut dietil eter, didiamkan semalam.
Eugenol 1 ml ditambahkan ke dalam labu alas bulat yang telah berisi campuran t-butil klorida, aluminium klorida dan pelarut dietil eter yang telah didiamkan semalam, dipanaskan pada suhu 600C selama 3 jam. Senyawa hasil sintesis diisolasi.
3. Sintesis tersier-butil eugenol dengan katalis besi (III) klorida (FeCl3) Besi (III) klorida anhidrat sebanyak 5,347 g dilarutkan dalam 100 ml dietil eter, kemudian dimasukkan dalam labu alas bulat yang memiliki penutup kaca. Tersier butil klorida 3,6 ml ditambahkan ke dalam labu alat bulat yang berisi campuran besi (III) klorida dan pelarut dietil eter, didiamkan semalam.
24
F. Analisis Hasil 1. Uji organoleptis
Uji organoleptis dilakukan untuk mengetahui sifat fisis dari senyawa hasil sintesis. Adanya perbedaan sifat fisis antara eugenol yang digunakan sebagai starting material dengan senyawa hasil sintesis merupakan suatu tanda yang
menunjukkan telah terbentuk suatu senyawa baru yang berbeda dengan eugenol. Senyawa hasil sintesis diamati warna, bau dan bentuk serta dibandingkan dengan eugenol. Adanya perbedaan sifat fisis senyawa hasil sintesis dengan eugenol menunjukkan telah terbentuknya senyawa baru yang berbeda dengan eugenol.
2. Kromatografi lapis tipis (KLT)
Larutan senyawa hasil sintesis sebanyak 5 l ditotolkan pada lempeng silika gel 60 GF254, kemudian dielusi dengan fase gerak toluena : etil asetat (93:7)
dengan jarak elusi 15 cm dan deteksi dengan sinar UV254 nm. Amati jumlah
3. Kromatografi gas (GC)
Senyawa hasil sintesis dianalisis menggunakan instrumen kromatografi gas dengan kondisi alat: jenis kolom HP-5MS; panjang kolom 30 m; diameter internal 0,25 mm; gas pembawa helium; suhu oven kolom 100oC; suhu injektor 300oC; tekanan 22,0 kPa; dan aliran kolom 0,5 mL/min yang dilakukan oleh
petugas laboratorium kimia organik, Fakultas MIPA, Universitas Gadjah Mada, Yogyakarta.
Cuplikan senyawa hasil sintesis dilarutkan dalam aseton, kemudian diinjeksikan kedalam injektor kromatografi gas. Aliran gas dari gas pengangkut helium akan membawa cuplikan yang telah diuapkan masuk ke dalam kolom yang dilapisi fase cair dimethylpolysilosane. Selanjutnya cuplikan diukur oleh detektor dan diperoleh suatu kromatogram.
4. Elusidasi struktur dengan spektrometri massa (MS)
26
5. Perhitungan jumlah senyawa hasil sintesis menggunakan program Image J
Perhitungan ini dilakukan untuk mengetahui jumlah senyawa hasil sintesis. Setiap proses sintesis dihitung jumlahnya dan dibandingkan sehingga dapat diperoleh suatu proses sintesis yang menghasilkan jumlah senyawa hasil sintesis yang optimal menggunakan program Image J.
Program Image J dioperasikan dengan membuka gambar berupa foto lempeng KLT yang akan dianalisis, kemudian dipilih toolbar adjust yang digunakan untuk mengatur kekontrasan, brightness, maupun keseimbangan intensitas warna hingga tercapai bercak yang terlihat kontras dan berbeda signifikan dengan latar lempeng KLT. Langkah selanjutnya adalah memilih toolbar process dan binary, maka akan dihasilkan gambar hitam putih yang akan
27 BAB IV
HASIL DAN PEMBAHASAN
A. Sintesis Tersier-Butil Klorida
Tesier-butil klorida disintesis berdasarkan prinsip reaksi substitusi
nukleofilik 1 (SN 1) yang berlangsung dengan cepat dengan mekanisme reaksi
28
Dalam mekanisme di atas (Gambar 7), pembentukan t-butil klorida terdiri dari 3 tahap. Tahap pertama adalah atom O pada t-butil alkohol yang bertindak sebagai basa menerima proton dari atom hidrogen pada HCl, sehingga membentuk ion butil oxonium. Kemudian tahap kedua adalah pemutusan ikatan antara atom karbon dan atom oksigen pada ion butil oxonium yang menghasilkan karbokation t-butil. Pada tahap terakhir adalah karbokation t-butil sebagai asam Lewis menerima pasangan elektron bebas dari ion klorida dan membentuk t-butil klorida.
Tersier-butil klorida disintesis dari tersier-butil alkohol yang dicampur
dengan HCl dengan di-stirrer selama 15 menit, tujuan stirrer adalah untuk mengoptimalkan pencampuran yang terjadi sehingga t-butil klorida dapat terbentuk dengan optimal. Kemudian dipindahkan ke corong pisah yang dihasilkan 2 lapisan, dimana lapisan yang atas merupakan lapisan non polar (organik) yang memiliki bobot molekul lebih rendah daripada lapisan polar yang berada di lapisan bawah. Lapisan yang dibuang adalah lapisan bawah karena t-butil klorida bersifat lebih nonpolar dan larut dalam pelarut organik, sehingga akan berada pada fase organik di lapisan atas.
Selanjutnya lapisan organik dicuci berturut-turut dengan 6 ml NaCl jenuh, 6 ml NaHCO3 jenuh, dan 6 ml NaCl jenuh. Tujuan pencucian NaCl adalah
untuk menarik molekul air yang terbentuk. Penetralan sisa HCl dilakukan dengan penambahan NaHCO3 yang akan membebaskan gas CO2. Reaksinya adalah :
Kemudian hasil dari sintesis t-butil klorida ini yang digunakan sebagai starting material dalam sintesis t-butil eugenol.
B. Sintesis Tersier-Butil Eugenol
Sintesis t-butil eugenol merupakan reaksi alkilasi Friedel-Crafts yang dilakukan dengan mereaksikan eugenol dan t-butil klorida sebagai starting material menggunakan variasi katalis aluminium klorida (AlCl3) dan besi (III)
klorida (FeCl3). Tersier-butil klorida merupakan suatu alkil halida yang akan
terpolarisasi dengan perantaraan katalis AlCl3 atau FeCl3 menjadi karbokation
t-butil. Karbokation t-butil yang bermuatan positif akan mempermudah reaksi dengan cincin benzena eugenol yang bermuatan negatif. Gugus hidroksi pada cincin benzena eugenol memiliki sifat sebagai aktivator serta pengarah orto-para karena memberikan efek resonansi pendorong elektron kuat dan efek induksi terhadap gugus penarik elektron. Dalam hal ini gugus t-butil akan masuk ke posisi orto dari gugus hidroksi fenolik dan tidak masuk pada posisi para karena posisi
para sudah diduduki gugus propenil, sehingga dengan adanya gugus t-butil akan
menambah gugus meruah didekat gugus hidroksi fenolik eugenol.
30
Mekanisme reaksi sintesis t-butil eugenol yang terjadi jika menggunakan katalis AlCl3 sebagai berikut :
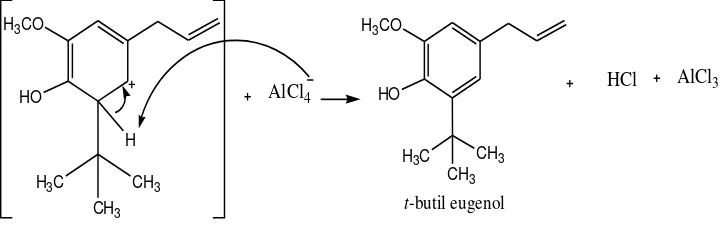
Secara umum mekanisme reaksi alkilasi eugenol terdiri dari tiga tahap. Tahap pertama sintesis t-butil eugenol diawali dengan pembentukan karbokation t-butil (Gambar 8) yang bersifat elektrofil dengan bantuan katalis AlCl3. Katalis
ini akan membantu ionisasi t-butil klorida untuk membentuk karbokation
AlCl3 Cl
Gambar 8. Tahap Pembentukan Karbokation Tersier-Butil Menggunakan Katalis Aluminium Klorida (AlCl3)
t-butil klorida Aluminum klorida
Gambar 9. Tahap Penyerangan Eugenol Terhadap Karbokation Tersier-Butil
H3CO
bermuatan positif karena kehilangan ion Cl- yang akan ditangkap oleh AlCl3
menjadi AlCl4-.
Eugenol berperan sebagai nukleofil yang menyerang atom karbon bermuatan positif pada karbokation t-butil (Gambar 9). Atom hidrogen pada cincin benzena akan lepas dan ditangkap oleh AlCl4-, kemudian akibat kehilangan
proton pada cincin benzena menghasilkan sebuah produk substitusi teralkilasi yang netral yaitu t-butil eugenol (Gambar 10).
Gugus t-butil akan masuk pada posisi orto dari gugus hidroksi fenolik, hal ini dikarenakan gugus hidroksi (–OH) fenolik pada eugenol merupakan gugus pengaktivasi cincin benzena yang kuat dan pengarah orto-para terhadap substitusi gugus alkil ke dalam cincin benzena. Posisi para pada cincin benzena eugenol telah diduduki propenil, maka gugus alkil akan masuk ke dalam posisi orto. Gugus metoksi yang terdapat di eugenol merupakan pengarah orto-para sehingga gugus t-butil akan dipastikan menempati posisi para dari gugus –OH fenolik yang kosong. Gugus t-butil tidak masuk ke posisi orto karena halangan sterik lebih besar pada posisi tersebut, hal ini disebabkan karena t-butil yang diserang oleh cincin benzena eugenol akan berada pada posisi dimana halangan steriknya kecil. Penambahan gugus t-butil akan membuat senyawa hasil reaksi semakin meruah di dekat gugus hidroksi fenolik.
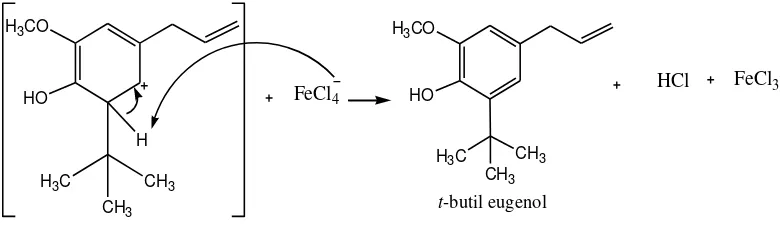
Sintesis t-butil eugenol dengan katalis FeCl3 pada prinsipnya sama
dengan sintesis t-butil dengan katalis AlCl3. Berikut ini adalah mekanisme reaksi
32
Gambar 11. Tahap Pembentukan Karbokation Tesier-Butil Menggunakan Katalis Besi (III) Klorida (FeCl3)
t-butil klorida Besi (III) klorida
H3CO
Gambar 12.Tahap Penyerangan Eugenol Terhadap Karbokation Tersier-Butil
H3CO
Gambar 13. Pembentukan Tersier-Butil Eugenol (Rearomatisasi)
Katalis AlCl3 dan FeCl3 yang digunakan dalam sintesis ini adalah bentuk
anhidrat, tujuannya agar dapat meningkatkan kelarutan dari katalis AlCl3 dan
FeCl3. Jika menggunakan AlCl3 dan FeCl3 dalam bentuk hidrat maka sudah
kisi kristal kosong dalam strukturnya sehingga akan lebih cepat menarik pelarut dietil eter pada luar sistem. Hal ini menyebabkan terjadinya kontak lebih banyak antara AlCl3 atau FeCl3 dengan dietil eter sehingga proses pelarutan akan
berlangsung lebih cepat.
Pengaruh pemilihan pelarut terhadap jalannya reaksi substitusi terdapat pada kemampuan mensolvatasi ion-ion, karbokation, nukleofil dan gugus-gugus pergi. Penggunaan dietil eter pada sintesis t-butil eugenol selain mempertimbangkan sifat kelarutan semua bahan juga sifat momen dipol yang kecil, sehingga termasuk ke dalam pelarut aprotik nonpolar yang tidak memiliki kemampuan untuk mensolvatasi nukleofil. Hal ini menyebabkan pelarut dietil eter tidak akan mempengaruhi sifat nukleofilitas eugenol sebagai anion dalam menyerang karbokation yang bersifat elektrofil dan juga tidak bereaksi dengan karbokation t-butil yang digunakan.
Berdasarkan hasil orientasi yang dilakukan, perbandingan jumlah mol AlCl3 atau FeCl3 : t-butil klorida : eugenol adalah 5:5:1. Jumlah AlCl3 atau FeCl3
dan t-butil klorida dalam jumlah berlebih supaya karbokation yang terbentuk juga berlebih. Hal ini akan memastikan semua eugenol dapat teralkilasi, sehingga didapatkan senyawa hasil sintesis yang maksimal.
Sebelum dilakukan proses sintesis, terlebih dahulu dilakukan pendiaman campuran yang terdiri dari t-butil klorida dan katalis (AlCl3 atau FeCl3).
34
optimal untuk bereaksi sehingga seluruh t-butil klorida dapat bereaksi dengan AlCl3 atau FeCl3 menghasilkan karbokation t-butil.
Sintesis t-butil eugenol menggunakan pemanasan pada suhu 60ºC selama 3 jam. Hal ini didasarkan pada proses alkilasi Friedel-Crafts antara t-butil klorida dan etilen benzena yang dilakukan dengan pemanasan pada suhu 60ºC selama 3 jam, dimana pada suhu 60ºC kecepatan terjadinya reaksi alkilasi telah optimal. Suhu pemanasan yang lebih rendah dari 60ºC akan menurunkan kecepatan reaksi dalam proses sintesis. Selain itu, suhu 60ºC digunakan karena mempertimbangkan titik didih dari masing-masing starting material, katalis dan pelarut yang digunakan serta dipertimbangkan pula suhu dimana reaksi alkilasi Friedel-Crafts dapat terjadi dengan optimal. Dimana eugenol memiliki titik didih di atas 250-255°C, AlCl3 sebesar 262ºC, FeCl3 sebesar 315ºC dan dietil eter sebesar 34-35ºC.
Dalam proses sintesis, digunakan refluks dengan pendingin Allihn condensor sebanyak 2 buah yaitu six bulb condensor dengan panjang efektif 30
cm disertai dengan pemanasan. Digunakan sebanyak 2 buah supaya meminimalisasi uap yang tidak sempat terembunkan oleh Allihn condensor. Semakin panjang dan luas kontak uap dengan pendingin dapat memaksimalkan uap hasil sintesis yang terbentuk dan langsung terkondensasi menjadi cairan. Setelah itu, hasil sintesis dalam labu alas bulat dilanjutkan dengan serangkaian pengujian.
C. Analisis Senyawa Hasil Sintesis 1. Uji organoleptis
Uji organoleptis merupakan identifikasi awal senyawa hasil sintesis dengan pengamatan berdasarkan panca indera. Uji ini dilakukan dengan membandingkan senyawa hasil sintesis dengan eugenol dan AlCl3 atau FeCl3
(Tabel II). Tujuannya adalah untuk mengetahui sifat fisik dari senyawa hasil sintesis yang meliputi bentuk, warna dan bau.
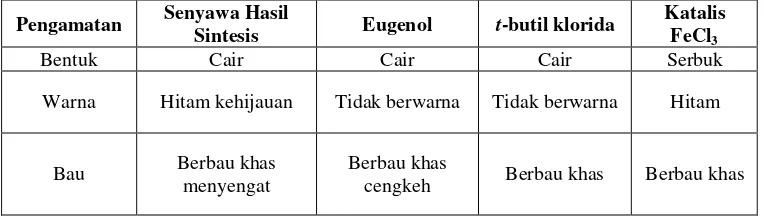
Tabel II. Hasil Uji Organoleptis Senyawa Hasil Sintesis Menggunakan Katalis Aluminium Klorida (AlCl3)
Pengamatan Senyawa Hasil
Sintesis Eugenol t-Butil Klorida Katalis AlCl3
Bentuk Cair Cair Cair Serbuk
Warna Ungu Tidak berwarna Tidak berwarna Kuning
36
Dari data hasil uji organoleptis di atas, menunjukkan bahwa terdapat perbedaan dari bau dan warna, sehingga dapat disimpulkan bahwa telah terbentuk senyawa baru yang berbeda dari eugenol. Sehingga dapat diperkirakan bahwa senyawa baru hasil sintesis menggunakan katalis AlCl3 ini memiliki struktur
molekul yang berbeda dengan eugenol.
Tabel III. Hasil Uji Organoleptis Senyawa Hasil Sintesis Menggunakan Katalis Besi (III) Klorida (FeCl3)
Pengamatan Senyawa Hasil
Sintesis Eugenol t-butil klorida
Katalis FeCl3
Bentuk Cair Cair Cair Serbuk Warna Hitam kehijauan Tidak berwarna Tidak berwarna Hitam
Bau Berbau khas menyengat Berbau khas cengkeh Berbau khas Berbau khas
Hasil uji organoleptis senyawa hasil sintesis menggunakan katalis FeCl3
juga menunjukkan bahwa terbentuk senyawa baru karena terlihat perbedaan warna larutan dan bau dengan eugenol. Maka hasil dari uji ini dapat dijadikan sebagai data awal untuk dilanjutkan ke uji lainnya.
2. Kromatografi lapis tipis (KLT)
Analisis hasil sintesis menggunakan KLT bertujuan sebagai pemeriksaan awal senyawa hasil sintesis yang terbentuk. Parameter yang digunakan adalah nilai Rf dari masing-masing bercak yang muncul pada lempeng KLT. Nilai Rf
Sebelum dilakukan elusi menggunakan fase gerak, terlebih dahulu dilakukan orientasi volume penotolan pada plate KLT. Berdasarkan hasil orientasi, volume yang digunakan agar tidak terjadi tailing adalah sebesar 5µl. Pencegahan terjadinya tailing supaya hasil foto KLT senyawa hasil sintesis dapat berupa bercak tunggal yang tidak mengekor, sehingga dapat dianalisis jumlah senyawa hasil sintesis secara optimal yang dihasilkan menggunakan program Image J.
Sistem kromatografi yang digunakan termasuk fase normal karena fase diam yang digunakan lebih bersifat polar dibandingkan fase geraknya. Fase diam yang digunakan adalah silika gel GF254, Gips (CaSO4) berfungsi melekatkan silika
gel pada lempeng, selain itu mengandung indikator yang dapat berfluoresensi pada panjang gelombang 254 nm. Adanya indikator akan menyebabkan kedua bercak senyawa mudah terdeteksi akibat adanya peredaman pada bercak dengan latar belakang berfluoresensi hijau terang. Peredaman ini terjadi karena senyawa hasil sintesis dan eugenol memiliki ikatan rangkap terkonjugasi pada cincin benzena sehingga pada waktu disinari dengan sinar UV 254 nm, sinar UV akan diabsorbsi oleh ikatan rangkap terkonjugasi pada cincin benzena. Sehingga akan terjadi peredaman bercak sebab sinar UV 254 nm yang mengenai senyawa tidak dapat mencapai indikator fluoresensi dan tidak ada cahaya yang dapat dipancarkan oleh bercak tersebut.
38
digunakan adalah etil asetat : toluena dengan komposisi perbandingan 7 : 93. Komposisi campuran fase gerak yang dipilih adalah fase gerak yang relatif non polar daripada fase diam. Pemilihan fase gerak ini berdasarkan hasil orientasi yang memperlihatkan hasil elusi totolan hasil sintesis dan pembanding yang digunakan lebih optimal dalam proses elusi dengan fase gerak etil asetat : toluena (7:93). Pemeriksaan senyawa hasil sintesis dengan KLT diamati dibawah sinar UV 254 nm dengan menggunakan pembanding eugenol sebagai standar.
Ket :
A = eugenol standar
B dan D = senyawa hasil sintesis dengan katalis AlCl3 C dan E = senyawa hasil sintesis dengan katalis FeCl3 Fase diam = silika gel GF254
Deteksi = sinar UV254 nm Jarak elusi = 15 cm
Gambar 14. Gambar Kromatogram Kromatografi Lapis Tipis (KLT) Senyawa Hasil Sintesis A
D
B
E
Berdasarkan hasil kromatogram KLT (Gambar 14) memperlihatkan bahwa senyawa hasil sintesis memiliki bercak yang hampir sejajar dengan eugenol dan bercak di atas eugenol, tetapi dari hasil dapat diketahui senyawa hasil sintesis belum murni karena dari bercak yang dihasilkan masih terdapat 2 bercak. Hasil KLT ini digunakan sebagai pemeriksaan bahwa telah dihasilkan senyawa baru yang berbeda dengan eugenol. Di bawah ini merupakan hasil perhitungan nilai Rfdari masing-masing bercak :
Tabel IV. Harga Rf Kromatografi Lapis Tipis (KLT) Senyawa Hasil Sintesis Menggunakan Fase Gerak Etil Asetat : Toluena (7:93)
Senyawa Nilai Rf
Eugenol standar Bercak A = 0,50 Hasil sintesis dengan katalis AlCl3 Bercak B = 0,47 Bercak D = 0,69 Hasil sintesis dengan katalis FeCl3 Bercak C = 0,48 Bercak E = 0,70
Dari harga Rf pada Tabel IV, senyawa hasil sintesis menggunakan katalis
AlCl3 dan FeCl3 memiliki harga Rf yang berbeda dengan harga Rf eugenol standar
yang digunakan sebagai pembanding. Digunakan pembanding eugenol standar karena senyawa yang diharapkan terbentuk yaitu t-butil eugenol belum mempunyai standar yang dapat digunakan sebagai pembanding, sehingga hanya digunakan eugenol yang sudah ada senyawa standarnya.
Berdasarkan data (Tabel IV), dapat disimpulkan bahwa senyawa hasil sintesis yang menggunakan katalis AlCl3 maupun FeCl3 merupakan senyawa yang
berbeda dari eugenol. Hal ini dipertegas dengan harga Rf yang lebih besar atau
40
interaksi dengan fase gerak yang digunakan bersifat lebih nonpolar lebih kuat daripada interaksi dengan fase diam yang lebih polar. Dilihat dari struktur senyawa yang diharapkan, senyawa t-butil eugenol lebih bersifat nonpolar dari eugenol karena adanya penambahan gugus t-butil sehingga diperkirakan bahwa bercak baru yang berbeda dengan Rf standar eugenol mengandung t-butil eugenol
yang akan dianalisis lebih lanjut menggunakan GC-MS.
3. Kromatografi gas (GC) dan spektrometri massa (MS) senyawa hasil sintesis pada penggunaan katalis AlCl3
Dalam penelitian ini, analisis senyawa hasil sintesis dilakukan dengan menggunakan kromatografi gas yang dihubungkan dengan spektrometri massa. Digunakan kombinasi GC-MS karena senyawa hasil sintesis yang masih belum murni dan tercampur senyawa lain dapat dipisahkan terlebih dahulu dengan kromatografi gas, kemudian selanjutnya akan dideteksi lebih lanjut dengan spektrometri massa.
Gambar 16. Kromatogram Kromatografi Gas (GC) Senyawa Hasil Sintesis Menggunakan Katalis Aluminium Klorida (AlCl3)
Dari hasil kromatogram tersebut, dapat diketahui bahwa senyawa hasil sintesis menggunakan katalis AlCl3 belum merupakan senyawa yang murni. Jika
dibandingkan kromatogram starting material-nya yaitu eugenol (Gambar 15) dapat dilihat bahwa tidak ada puncak yang sama dengan eugenol pada kromatogram senyawa hasil sintesis di atas (Gambar 16), hal ini menunjukkan bahwa eugenol tidak berada pada senyawa hasil sintesis. Kromatogram pada gambar 16 memperlihatkan bahwa puncak atau peak yang muncul sangat banyak, selain menunjukkan senyawa hasil sintesis yang belum murni atau mengandung senyawa lain. Setelah terjadi pemisahan komponen senyawa hasil sintesis dengan menggunakan kromatografi gas, maka selanjutnya komponen senyawa hasil sintesis dielusidasi dengan spektrometri massa.
42
kerangka molekul senyawa hasil sintesis melalui interpretasi fragmennya. Dalam MS akan dihasilkan ion molekul berupa ion radikal positif akibat dari penembakan molekul senyawa hasil sintesis dengan elektron berenergi tinggi (Electron Impact 70 eV). Berdasarkan elusidasi struktur dengan MS ini, senyawa t-butil eugenol yang diharapkan mempunyai bobot molekul yang sesuai dengan
m/z 220.
Gambar 17. Spektrum Massa Senyawa Hasil Sintesis Puncak ke-23 pada Waktu Retensi 12,292 Menit Menggunakan Katalis Aluminium Klorida (AlCl3)
Data puncak yang menunjukkan bahwa senyawa hasil sintesis terdapat pecahan fragmen dari t-butil eugenol adalah puncak ke-23 pada hasil GC. Tetapi yang dapat dianalisis hanya 5 puncak karena keterbatasan data, dimana salah satunya merupakan puncak t-butil eugenol. Berdasarkan hasil pemecahan fragmen pada gambar 17, puncak A yang tampak merupakan puncak yang menunjukkan bobot molekul fragmen senyawa yang diidentifikasi yaitu m/z 355. Jika dianalisis, m/z = 355 sesuai dengan BM t-butil eugenol yang berikatan kovalen koordinasi dengan katalis AlCl3.
Ikatan ini terjadi pada atom oksigen di gugus hidroksi fenolik yang memiliki elektron bebas untuk mengisi orbital kosong pada atom Al. Secara umum konfigurasi atom Al3+ adalah 1s2 2s2 2p6 dimana 3 elektron pada kulit
A B
terluarnya telah diberikan kepada atom khlor untuk berikatan. Kulit ketiga pada atom Al ini akan diisi oleh pasangan elektron bebas pada atom oksigen fenolik t-butil eugenol.
Tiga buah atom khlor pada AlCl3 mengandung isotop 37Cl yang
menghasilkan puncak-puncak dengan pola fragmentasi M + 2, M + 4, dan M + 6. Oleh karena itu, jumlah bobot molekul t-butil klorida yang berikatan kovalen koordinasi dengan katalis AlCl3 sesuai dengan jumlah kelimpahan relatif isotop
atom Cl = m/z 353, sehingga M + 2 = m/z 355 yang merupakan puncak A.
Kemudian puncak lainnya yang dapat diidentifikasi pecahan fragmennya adalah puncak B yaitu dengan m/z 57 yang merupakan fragmen gugus t-butil
44
Fragmen-fragmen lainnya belum bisa teridentifikasi mekanisme pemecahan fragmen yang terbentuk. Tetapi berdasarkan penyelidikan kerangka molekul (Gambar 18), sudah dapat diidentifikasi bahwa terdapat pecahan fragmen-fragmen dalam spektrum massa merupakan gugus yang terdapat pada butil eugenol. Sehingga dapat disimpulkan bahwa senyawa hasil sintesis adalah t-butil eugenol.
4. Kromatografi gas (GC) dan spektrometri massa (MS) senyawa hasil sintesis pada penggunaan katalis FeCl3
Gambar 19. Kromatogram Kromatografi Gas (GC) Senyawa Hasil Sintesis Menggunakan Katalis Besi (III) Klorida (FeCl3)
Jika dibandingkan kromatogram eugenol (Gambar 15) dengan kromatogram di atas, dimana tidak ada puncak yang sama dengan eugenol pada kromatogram senyawa hasil sintesis (Gambar 19), hal ini menunjukkan bahwa eugenol tidak berada pada senyawa hasil sintesis.
Berdasarkan kromatogram GC yang dihasilkan, menunjukkan jumlah peak yang muncul sangat banyak. Hal ini menunjukkan bahwa senyawa hasil
sintesis menggunakan katalis FeCl3 belum murni karena banyak puncak senyawa
lain yang ikut terdeteksi. Setelah terjadi pemisahan komponen senyawa hasil sintesis, maka selanjutnya dideteksi dengan spektrometer massa.
Pada kedua hasil GC pada penggunaan katalis AlCl3 maupun FeCl3
46
sehingga senyawa hasil sintesis menjadi tidak stabil dan menghasilkan produk degradasinya.
Pada penggunaan katalis FeCl3, hasil puncak yang dapat diidentifikasi
adalah puncak ke 40 berdasarkan hasil GC yang merupakan puncak dari senyawa di-t-butil eugenol. Mekanisme pemecahan fragmen ada 5 puncak, yaitu puncak A,
B, C, D dan E.
Gambar 20. Spektrum Massa Senyawa Hasil Sintesis Puncak ke-40 pada Waktu Retensi 17,706 Menit Menggunakan Katalis Besi (III) Klorida (FeCl3)
Berdasarkan hasil pemecahan fragmen pada Gambar 20, puncak A merupakan bobot molekul di-t-butil eugenol yang merupakan bentuk di-alkilasi, yaitu masuknya gugus alkil t-butil ke dalam cincin benzena pada t-butil eugenol. Terjadinya di-alkilasi ini merupakan salah satu kelemahan dari reaksi Friedel-Crafts karena reaksi alkilasi sulit dikendalikan. Hal ini dapat disebabkan karena pada reaksi digunakan perbandingan mol antara eugenol : t-butil klorida : FeCl3
adalah 1:5:5. Jumlah mol t-butil klorida yang berlebih dibanding jumlah mol eugenol dapat mengakibatkan karbokation t-butil yang terbentuk juga berlimpah, sehingga dapat terus diserang oleh atom karbon cincin benzena eugenol. Gugus hidroksi pada eugenol merupakan pengarah orto-para yang posisinya sudah terisi
A B
D
E
semua, jadi yang berpengaruh lebih dominan adalah metoksi sebagai gugus pengaktivasi cincin benzena dan merupakan pengarah orto-para. Posisi orto lebih sedikit halangan steriknya daripada posisi para, akibatnya gugus t-butil yang kedua akan masuk pada posisi orto dari gugus metoksi (Gambar 21). Terjadinya di-alkilasi juga tidak dapat dihindari akibat kestabilan dari karbokation t-butil
sehingga kecepatan reaksi akan berjalan lebih cepat dibanding gugus alkil lainnya. Kecepatan reaksi yang meningkat akan mengakibatkan tumbukan antara molekul eugenol dan karbokation t-butil lebih banyak, sehingga terbentuk produk di-alkilasi yaitu di-t-butil eugenol.
Mekanisme reaksi terbentuknya di-t-butil eugenol adalah :
48
Gambar 21. Mekanisme Reaksi Terbentuknya di-Tersier-Butil Eugenol pada Katalis Besi (III) Klorida (FeCl3)
Pada hasil dan pembahasan sebelumnya, alkilasi yang kedua tidak terjadi pada sintesis t-butil eugenol menggunakan katalis AlCl3. Hal ini disebabkan
karena pada senyawa t-butil eugenol berikatan kovalen koordinasi dengan katalis AlCl3, sehingga gugus AlCl3 akan mendeaktivasi cincin benzena pada t-butil
eugenol. Gugus AlCl3 mendeaktivasi cincin benzena karena merupakan penarik
δ- >>
Gambar 22. Pendeaktivasi Cincin Benzena Oleh Aluminium Klorida (AlCl3)
Berikut ini (Gambar 23) merupakan mekanisme pemecahan fragmen senyawa hasil sintesis: