i
SINTESIS TERSIER-BUTIL EUGENOL DARI EUGENOL DENGAN TERSIER-BUTIL KLORIDA MENGGUNAKAN KATALIS ALUMINIUM
KLORIDA DENGAN VARIASI SUHU PEMANASAN
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperolah Gelar Sarjana Farmasi (S. Farm)
Program Studi Ilmu Farmasi
Oleh: Prasetya Jati NIM : 06 8114 144
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
ii
SINTESIS TERSIER-BUTIL EUGENOL DARI EUGENOL DENGAN TERSIER-BUTIL KLORIDA MENGGUNAKAN KATALIS ALUMINIUM
KLORIDA DENGAN VARIASI SUHU PEMANASAN
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperolah Gelar Sarjana Farmasi (S. Farm)
Program Studi Ilmu Farmasi
Oleh: Prasetya Jati NIM : 06 8114 144
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
v
HALAMAN PERSEMBAHAN
“Aku iki dalané marang Gusti Allah lan Aku sing nuduhaké,
Gusti Allah kuwi sapa lan kepriyé kaanané;
Aku uga sing mènèhi urip marang manungsa.
Ora ana wong siji waé sing bisa sowan marang Sang Rama, yèn ora
lantaran Aku.”
Akulah jalan dan kebenaran dan hidup. Tidak ada seorangpun yang datang kepada Bapa, kalau tidak melalui Aku
(Yohanes 14:6)
Kupersembahkan karya ini untuk:
vii PRAKATA
Puji dan syukur kepada Tuhan Yesus Kristus atas anugrah dan karya indah-Nya melalui penulis, sehingga penulis dapat menyelesaikan skripsi yang berjudul “Sintesis Tersier-Butil Eugenol Dari Eugenol Dengan Tersier-Butil Klorida Menggunakan Katalis Aluminium Klorida Dengan Variasi Suhu Pemanasan”. Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Strata Satu Program Studi Ilmu Farmasi (S.Farm.) di Universitas Sanata Dharma Yogyakarta.
Penulisan skripsi ini tidak akan pernah lepas dari bantuan, saran, dorongan dan bimbingan dari berbagai pihak. Oleh karena itu, pada kesempatan ini penulis ingin menyampaikan rasa terima kasih kepada :
1. Rita Suhadi, M.Si., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Dra. Maria Margaretha Yetty Tjandrawati, M.Si. selaku dosen pembimbing yang bersedia untuk mengarahkan dan membantu penulis sehingga skripsi ini dapat terselesaikan.
3. Jeffry Julianus, M.Si selaku dosen penguji atas pengarahan, saran, dan kritiknya selama penelitian maupun penyusunan skripsi.
4. Lucia Wiwid Wijayanti, M.Si. selaku dosen penguji atas waktu, bantuan dan saran yang telah diberikan.
viii
6. Seluruh staf laboratorium di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta terutama Pak Parlan, Mas Bimo, dan Mas Kunto, terimakasih atas bantuannya selama penelitian berlangsung.
7. Bapak, Ibu, Nendya, Oline, dan seluruh keluarga besar tercinta. Terimakasih untuk doa, semangat, dan dukungannya selama penyusunan skripsi ini.
8. Keluarga Prasodjo dan Sukrisno terimakasih atas bantuan dan dukungan selama penyusunan skripsi ini.
9. Vita, Handa, Marissa, dan Linda, tim seperjuangan yang hebat. Terimakasih untuk semangat, bantuan, dan dukungannya
10. Thomplink, Angel, Rudi, Lulu, Oktav, dan Mbak Dita terimakasih untuk semangat, kegilaan dan kebersamaannya selama ini.
11. Teman-teman kos Progresif; Anton, Aan, Jimbong, dan Pungki. Sukses selalu untuk kita semua.
12. Teman-teman Farmasi Angkatan 2006, terutama minat FST 2006 yang tidak dapat penulis sebut satu per satu. Terimakasih untuk semangat kalian selama di farmasi. Semoga selalu sukses.
13. Teman-teman KKN Palihan XXXVIII dan seluruh warga Dusun Palihan, terutama; Mbah Joyo, Mas Aga, dan Mas Bayu. Sukses selalu untuk kita semua.
ix
15. Semua pihak yang telah membantu dan memberikan dukungan yang tidak dapat disebutkan satu persatu.
Penulis menyadari bahwa dalam penyusunana skripsi ini masih terdapat banyak kekurangan. Oleh karena itu, sumbangan pemikiran, saran dan kritik yang membangun akan sangat diharapkan. Akhir kata penulis memohon maaf atas segala kekurangan dan mudah mudahan skripsi ini dapat bermanfaat bagi pembaca.
xi
SINTESIS TERSIER-BUTIL EUGENOL DARI EUGENOL DENGAN TERSIER-BUTIL KLORIDA MENGGUNAKAN KATALIS ALUMINIUM
KLORIDA DENGAN VARIASI SUHU PEMANASAN INTISARI
Penambahan gugus meruah didekat gugus hidroksi dapat meningkatkan aktivitas antioksidan. Sintesis tersier-butil eugenol dilakukan untuk meningkatkan aktivitas antioksidan dari eugenol. Sintesis dilakukan dengan mereaksikan eugenol dengan tersier-butil klorida menggunakan katalis Aluminium klorida (AlCl3). Variasi suhu pemanasan dilakukan untuk mendapatkan suhu pemanasan
yang optimal selama proses sintesis t-butil eugenol sehingga didapatkan jumlah senyawa hasil sintesis yang optimal.
Penelitian ini termasuk penelitian eksperimental murni. Proses sintesis dilakukan menurut reaksi alkilasi Friedel Craft, dengan cara mereaksikan suatu eugenol dengan t-butil klorida dengan menggunakan katalis AlCl3. Reaksi sintesis
dilakukan selama 3 jam. Suhu pemanasan divariasikan menjadi 400C, 600C, dan 800C.
Hasil sintesis kemudian diuji organoleptis, Kromatografi Lapis Tipis (KLT), dan Kromatografi Gas (GC) – Spektroskopi Massa (MS). Uji KLT dilakukan dengan lempeng silika gel 60 GF254, fase gerak toluena : etilasetat
(93:7) dan dideteksi dengan sinar UV254 nm. Hasil uji KLT menunjukkan adanya
bercak senyawa baru pada hasil sintesis dengan suhu pemanasan 600C, sedangkan pada suhu 400C dan 800C tidak diperoleh bercak senyawa baru. Hasil GC-MS menunjukkan terbentuk tersier-butil eugenol pada pada hasil sintesis pada suhu pemanasan 600C. Jadi tersier-butil eugenol dapat disintesis dari eugenol dengan t -butil klorida menggunakan katalis AlCl3 dan variasi suhu pemanasan
mempengaruhi jumlah t-butil eugenol yang dihasilkan.
xii
SINTESIS TERSIER-BUTIL EUGENOL DARI EUGENOL DENGAN TERSIER-BUTIL KLORIDA MENGGUNAKAN KATALIS ALUMINIUM
KLORIDA DENGAN VARIASI SUHU PEMANASAN ABSTRACT
Adding of large groups near the hydroxy group can increase the antioxidant activity. Synthesis of tertiary-butyl eugenol done to improve the antioxidant activity of eugenol. Synthesis carried out by reacting eugenol with tertiary-butyl chloride using aluminum chloride catalyst (AlCl3). Heating temperature variations made to obtain the optimum heating temperature during the synthesis of t-butyl eugenol, so get the optimal yield.
This experiment is an experimental method. Synthesis process is based on Friedel Craft alkilasi reaction, by reacting a eugenol with t-butyl chloride with AlCl3 as catalyst. Synthesis reaction carried out during 6 hours. Heating
temperature was varied to 400C, 600C, and 800C.
The results of synthesis and then tested organoleptis, Thin Layer Chromatography (KLT), and Gas Chromatography (GC) - Mass Spectroscopy (MS). KLT test performed with plates silica gel 60 GF254, motion phase toluene: etilasetat (93:7) and detected by UV254 nm light. KLT test result indicates a new compound spots on the synthesis by heating temperature 600C, whereas at temperature 400C and 800C did not obtain a new compound spots. GC-MS results show tertiary-butyl formed eugenol on the synthesis of the heating temperature 600C. So tertiary-butyl eugenol can be synthesized from eugenol with t-butyl chloride with AlCl3 as catalyst, heating temperature variations affect the amount
of tertiary-butyl eugenol produced.
xiii DAFTAR ISI
HALAMAN JUDUL ii
HALAMAN PERSETUJUAN PEMBIMBING iii
HALAMAN PENGESAHAN iv
HALAMAN PERSEMBAHAN v
PERNYATAAN PERSETUJUAN PUBLIKASI vi
PRAKATA vii
PERNYATAAN KEASLIAN KARYA x
xv
b. Uji organoleptis 24 c. Kromatografi lapis Tipis (KLT) 24 d. Elusidasi Struktur dengan spektrometri massa 25
BAB IV. HASIL DAN PEMBAHASAN 26
A. Sintesis tersier-butil klorida 26
B. Sintesis tersier-butil eugenol 28
C. Analisis hasil 31
1. Uji organoleptis 31
2. Kromatografi lapis Tipis (KLT) 32
3. Elusidasi struktur senyawa hasil sintesis 38 4. Perhitungan jumlah senyawa hasil sintesis 44
BAB V. KESIMPULAN DAN SARAN 49
A. Kesimpulan 49
B. Saran 49
DAFTAR PUSTAKA 50
LAMPIRAN 52
xvi
DAFTAR TABEL
Tabel 1. Hasil pemeriksaan organoleptis senyawa hasil sintesis dan
starting material 31
Tabel 2. Data Rf eugenol dan senyawa hasil sintesis 38
xvii
DAFTAR GAMBAR
Gambar 1. Reaksi penghambatan radikal primer terhadap radikal lipida 6 Gambar 2. Antioksidan bertindak sebagai proksidan 7
Gambar 3. Struktur eugenol 7
Gambar 4. Diagram keadaan energi 9
Gambar 5. Struktur dietil eter 11
Gambar 6. Contoh reaksi Friedel-Craft 12
Gambar 7. Reaksi eugenol dengan t-butil klorida 13
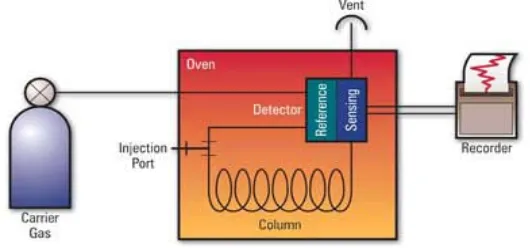
Gambar 8. Instrumen kromatografi gas 15
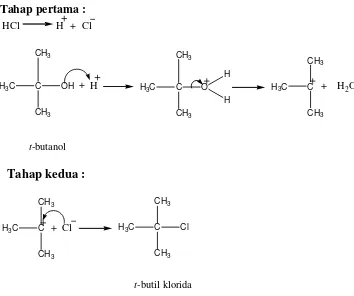
Gambar 9. Mekanisme reaksi pembentukan t-butil klorida 27
Gambar 10. Reaksi penetralan asam klorida 28
Gambar 11. Reaksi AlCl3 dengan t-butil klorida ketika larutan didiamkan
semalam 29
Gambar 12. Reaksi sintesis t-butil eugenol dari eugenol dan t-butil klorida
dengan katalis AlCl3 30
Gambar 13. Ikatan hidrogen eugenol dengan silika gel 35 Gambar 14. Ikatan hidrogen senyawa hasil sintesis dengan silika gel 35
Gambar 15. KLT senyawa hasil sintesis 36
Gambar 16. KLT senyawa hasil sintesis dan katalis AlCl3 37
xviii
Gambar 18. Spektrum massa senyawa pada peak nomor 23 dengan waktu
retensi 12,242 menit 40
Gambar 19. Penembakan molekul senyawa hasil sintesis dengan elektron
berenergi tinggi 41
Gambar 20. Fragmentasi kation t-butil (C4H9+) (m/z = 57) 42
Gambar 21. Fragmentasi kation C3H5+ (m/z = 41) 43
xix DAFTAR LAMPIRAN
Lampiran 1. Perhitungan bahan 53
Lampiran 2. Penimbangan AlCl3 54
Lampiran 3. KLT senyawa hasil sintesis 55
Lampiran 4. KLT senyawa hasil sintesis dan katalis AlCl3 56
Lampiran 5. Kondisi GC-MS 57
Lampiran 6. Hasil elusidasi struktur dengan Kromatografi Gas 58 Lampiran 7. Spektrum massa senyawa hasil sintesis 59
Lampiran 8. Perhitungan nilai Rf 60
Lampiran 9. Hasil AUC dengan program Image J (Eugenol, pemanasan 400
C, dan 600 C) 61
Lampiran 10. Hasil AUC dengan program Image J (Eugenol dan
pemanasan 800 C) 62
Lampiran 11. Hasil AUC dengan program Image J (Pemanasan 600 C dan
bercak baru senyawa hasil sintesis) 63
1 BAB I PENGANTAR
A. Latar Belakang
Saat ini berbagai macam penyakit dapat timbul seperti kanker, kardiovaskuler, penyumbatan pembuluh darah, stroke, dan penuaan dini yang salah satu penyebabnya disebabkan oleh terjadinya proses oksidasi radikal bebas di dalam tubuh. Oleh karena itu sangat diperlukan suatu senyawa yang dapat menangkap atau menetralkan proses oksidasi radikal bebas, salah satunya adalah senyawa antioksidan. Senyawa antioksidan diperlukan oleh tubuh untuk menetralkan radikal bebas dan mencegah kerusakan yang ditimbulkannya terhadap sel normal, protein dan lemak. Senyawa antioksidan menstabilkan radikal bebas dengan cara mendonorkan radikal hidrogennya untuk melengkapi elektron yang dimiliki oleh suatu radikal bebas. Hal ini dapat menghambat terjadinya reaksi berantai dari pembentukan radikal bebas yang dapat memberikan tekanan oksidatif terhadap sel-sel tubuh.
sehingga perlu dilakukan modifikasi senyawa untuk menghasilkan turunan eugenol yang mempunyai aktivitas antioksidan lebih baik.
Pada penelitian ini, dilakukan modifikasi eugenol menjadi tersier-butil eugenol untuk meningkatkan aktivitas antioksidannya. Penambahan gugus t-butil pada posisi orto dari gugus hidroksi fenolik bertujuan untuk meningkatkan aktivitas antioksidan eugenol. Pada sebuah penelitian, telah terbukti bahwa penambahan gugus meruah didekat gugus hidroksi dapat meningkatkan aktivitas antioksidan (Ogata et al., 2000). Penambahan gugus yang meruah seperti t-butil didekat gugus hidroksi fenolik dapat dilihat pada senyawa BHT (Butylated Hidroxytoluene) ternyata mempunyai aktivitas antioksidan lebih baik. Karena itu, sintesis t-butil eugenol dilakukan dengan menambahkan gugus meruah pada posisi
orto dari gugus hidroksi eugenol.
Proses sintesis tersier-butil eugenol dapat dilakukan berdasarkan reaksi alkilasi Friedel Craft, yaitu dengan cara mereaksikan suatu benzen dengan alkil halida dengan menggunakan katalis Aluminium klorida (Fessenden dan Fessenden, 1986). Dalam sintesis ini, digunakan starting material eugenol dan
t-butil klorida yang direaksikan menggunakan katalis AlCl3.
3
semakin besar. Hal ini disebabkan karena adanya pemanasan akan memberikan energi yang meningkatkan pergerakan molekul starting material sehingga kontak atau tumbukan antar starting material makin besar dan mempercepat reaksi pembentukan senyawa target. Dalam reaksi alkilasi Friedel Craft diperlukan suhu optimal agar dihasilkan senyawa hasil sintesis dalam jumlah optimum. Oleh karena itu, dalam penelitian ini dilakukan variasi suhu pemanasan untuk mengetahui pada suhu mana dihasilkan t-butil eugenol dalam jumlah terbanyak.
1. Permasalahan
Dari latar belakang yang telah diuraikan di atas, masalah yang muncul dapat dirumuskan sebagai berikut:
a. Apakah t-butil eugenol dapat disintesis dari eugenol dengan t-butil klorida menggunakan katalis Aluminium klorida (AlCl3
b. Apakah variasi suhu pemanasan dapat mempengaruhi jumlah senyawa t-butil eugenol yang dihasilkan?
)?
2. Keaslian Penelitian
Sejauh pengamatan penulis, penelitian tentang sintesis t-butil eugenol dari eugenol dan t-butil klorida menggunakan katalis aluminium klorida dengan variasi suhu pemanasan belum pernah dilakukan.
Secara teoritis, penelitian ini bermanfaat untuk perkembangan ilmu kefarmasian tentang sintesis t-butil eugenol dari eugenol dan t-butil klorida menggunakan katalis aluminium klorida.
Secara praktis, penelitian ini bermanfaat dalam hal memberikan data mengenai pengaruh suhu pemanasan terhadap jumlah senyawa t-butil eugenol yang dihasilkan.
B. Tujuan Penelitian ini bertujuan untuk:
1. Mengetahui apakah t-butil eugenol dapat disintesis dari eugenol dengan t-butil klorida menggunakan katalis Aluminium klorida (AlCl3)
5 BAB II
PENELAAHAN PUSTAKA
A. Antioksidan
Antioksidan adalah senyawa yang mempunyai struktur molekul yang dapat memberikan elektronnya kepada molekul radikal bebas tanpa terganggu sama sekali dan dapat memutus reaksi berantai dari radikal bebas. Antioksidan juga didefinisikan sebagai senyawa yang dapat menunda, memperlambat, dan mencegah proses oksidasi lipid. Antioksidan mampu menunda dan mencegah terjadinya reaksi antioksidasi radikal bebas dalam oksidasi lipid (Anonim, 2009).
Sumber-sumber antioksidan dapat dikelompokkan menjadi 2, yaitu:
a. Antioksidan sintetik : Antioksidan yang diperoleh dari hasil sintesa reaksi kimia, contohnya tokoferol, Butylated hydroxytoluene (BHT), Butylated hydroxyanisole (BHA), dan propil galat.
b. Antioksidan alami : Antioksidan hasil ekstraksi bahan alami, contohnya golongan flavonoid, turunan asam sinamat, kumarin dan lain-lain (Ardiansyah, 2007).
memperlambat laju autooksidasi dengan berbagai mekanisme di luar mekanisme pemutusan rantai autooksidasi dengan pengubahan radikal lipida ke bentuk lebih stabil (Ardiansyah,2007). Beberapa kriteria senyawa antioksidan diantaranya adalah memiliki kelarutan yang tinggi dalam lipida, efektif dalam jumlah realtif sedikit, toksisitas rendah, dan radikal yang terbentuk harus lebih stabil daripada radikal bebasnya (Puspita-Nienaber dkk., 1997).
Penambahan antioksidan (AH) primer dengan konsentrasi rendah pada lipida dapat menghambat atau mencegah reaksi autooksidasi lemak dan minyak. Penambahan tersebut dapat menghalangi reaksi oksidasi pada tahap inisiasi maupun propagasi (gambar 1). Radikal-radikal antioksidan (A*) yang terbentuk pada reaksi tersebut relatif stabil dan tidak mempunyai cukup energi untuk dapat bereaksi dengan molekul lipida lain membentuk radikal lipida baru. Besar konsentrasi antioksidan yang ditambahkan dapat berpengaruh pada laju oksidasi. Pada konsentrasi tinggi, aktivitas antioksidan grup fenolik sering lenyap bahkan antioksidan tersebut menjadi prooksidan (gambar 2).
Inisiasi : R* + AH → RH + A* Propagasi : ROO* + AH → ROOH + A*
7
AH + O2
H3CO HO
→ A* + HOO* AH + ROOH → RO* + H2O + A*
Gambar 2. Antioksidan bertindak sebagai prooksidan
(Ardiansyah, 2007)
B. Eugenol
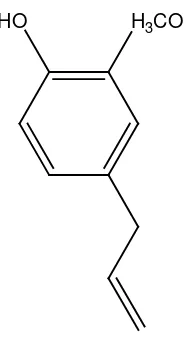
Eugenol merupakan senyawa berbentuk cairan tidak berwarna atau berwarna kuning-pucat, dapat larut dalam alkohol, eter dan kloroform. Senyawa ini termasuk turunan guaiakol yang mendapat tambahan rantai alil, dikenal dengan nama IUPAC 2-metoksi-4-(2’-propenil) fenol. Eugenol sedikit larut dalam air namun mudah larut pada pelarut organik (Anonim, 1986). Hal ini memenuhi salah satu kriteria antioksidan, dimana eugenol dapat larut ke dalam lipid, sehingga dapat bekerja efektif dalam menangkal radikal bebas.
Gambar 3. Struktur Eugenol
memiliki kemampuan untuk menangkap radikal bebas, sehingga dapat memutus rantai reaksi radikal. Proses ini menghasilkan senyawa yang lebih stabil dari radikal bebasnya. Gugus dalam struktur eugenol yang berperan sebagai penangkap radikal bebas adalah gugus hidroksi (-OH). Hal ini didasarkan pada senyawa fenolik lain seperti kurkumin yang juga memiliki aktivitas antioksidan dikarenakan nilai bond dissociation enthalpies (BDEs) gugus O-H fenoliknya lebih rendah 5,04 Kkal/mol daripada nilai BDEs C-H metilen 116,07 Kkal/mol. Sehingga atom H dari gugus –Oh fenoliknya lebih mudah diabstraksi daripada abstraksi atom H dari C-H metilen (Sun et al., 2002).
Modifikasi struktur eugenol dilakukan untuk meningkatkan aktivitas antioksidan dari eugenol. Penambahan gugus meruah didekat gugus hidroksi fenolik dapat meningkatkan aktivitas antioksidan (Ogata et al., 2000). Modifikasi dilakukan dengan menambahkan suatu gugus yang meruah yaitu t-butil pada posisi orto dari gugus hidroksi fenolik eugenol.
C. Aluminium Klorida
Aluminium Klorida (AlCl3) berupa serbuk putih pada kondisi masih
murni, memiliki bau yang kuat seperti HCl, higroskopis dan larut dalam pelarut organik, seperti etanol dan eter. Memiliki berat molekul 133,34 (Anonim,1989).
AlCl3 adalah garam logam anhidrat yang merupakan asam lewis. Asam
lewis adalah zat yang dapat menerima sepasang elektron. AlCl3 merupakan asam
9
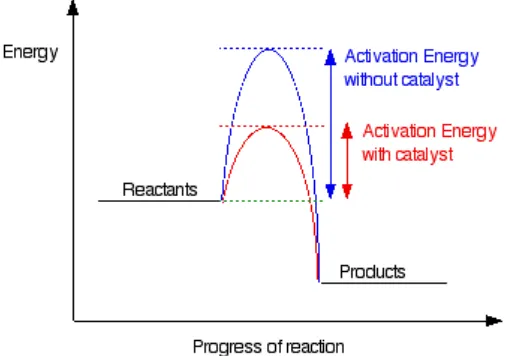
Katalis adalah suatu zat yang mempercepat suatu laju reaksi, namun bahan ini secara kimiawi, tidak berubah pada akhir reaksi. Penggunaan katalis memberikan perubahaan yang berarti pada energi aktivasi. Energi aktivasi adalah energi minimum yang dibutuhkan untuk memulai suatu reaksi kimia. Biasanya dilambangkan Ea, dengan satuan kilo joule/mol. Dengan adanya katalis maka suatu reaksi akan memiliki energi aktivasi yang lebih rendah. Gambaran keadaan energi dengan adanya katalis dapat dilihat pada diagram di bawah ini:
Gambar 4. Diagram keadaan energi
(Anonim, 2004)
D. Tersier-Butil Klorida
Tersier-butil klorida merupakan senyawa alkil halida. Ada 4 tipe alkil halida, yaitu: metil, primer, sekunder, dan tersier. Tipe alkil halida ini akan mempengaruhi tipe kestabilan karbokation yang terbentuk, karena karbokation tidak stabil dan dengan cepat bereaksi lebih lanjut. Dalam suatu karbokation, karbon yang bermuatan positif adalah suatu pusat elektropositif. Rapatan elektron dari ikatan-ikatan sigma digeser ke arah karbon positif. Geseran rapatan ini menciptakan muatan positif parsial (sebagian) pada atom-atom yang berdekatan. Muatan parsial positif ini mempolarisasi ikatan-ikatan sigma berikutnya. Dengan cara ini muatan positif karbokation agak disebar, dan karbokation itu terstabilkan. Gugus alkil mengandung lebih banyak atom dan elektron daripada sebuah atom hidrogen. Semakin banyak gugus alkil terikat pada atom karbon bermuatan positif, berarti makin banyak atom yang dapat membantu membagi muatan positif itu dan membantu menstabilkan karbokation (Fessenden dan Fessenden, 1986).
E. Pelarut
Dalam reaksi organik, pengaruh dari pelarut yang digunakan merupakan hal penting. Pelarut dalam reaksi organik dapat dibagi menjadi tiga, yakni:
a. Protik
11
Pelarut ini memiliki momen dipol dan sifat pendonor yang besar. Contohnya adalah dimetil sulfoksida, alkil sianida, amina sekunder, dan keton.
c. Non-polar Aprotik
Pelarut ini memiliki momen dipol yang kecil, tidak memiliki proton asam ataupun sifat donor maupun akseptor. Pelarut ini juga memiliki gaya intermolekular yang lemah. Contohnya adalah senyawa hidrokarbon, halokarbon, dan eter (Isaacs, 1995).
Dalam sintesis t-butil eugenol digunakan pelarut dietil eter yang termasuk pelarut non-polar aprotik. Dietil eter memiliki momen dipol yang kecil, terlihat dari strukturnya yang simetris.
H3C
Gambar 5. Struktur dietil eter
Dietil eter memiliki bobot molekul 74, 12, titik didih 34,40 C, dan berat jenis 0,714. Berwujud cairan (bening), bau khas, mudah menguap, dan mudah terbakar (Anonim, 2008).
F. Reaksi Friedel Craft
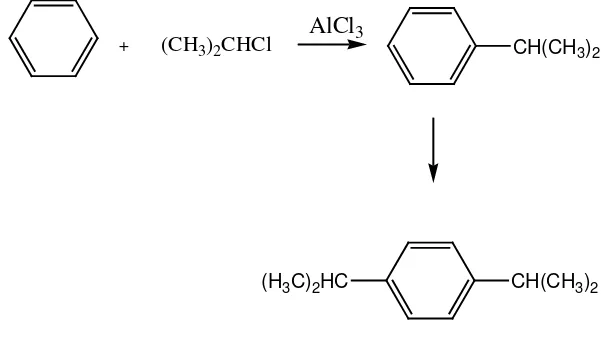
Reaksi alkilasi atau penambahan suatu gugus alkil ke dalam cincin benzen dapat dilakukan berdasarkan reaksi alkilasi Friedel-Craft dengan menggunakan katalis asam Lewis seperti Aluminium Klorida. Alkilasi Friedel-Craft merupakan
sehingga substitusi kedua juga dapat terjadi. Maka biasanya digunakan senyawa aromatik berlebih ( Fessenden dan Fessenden,1986).
+ (CH3)2CHCl
AlCl3
CH(CH3)2
CH(CH3)2 (H3C)2HC
Gambar 6. Contoh Reaksi Friedel-Craft
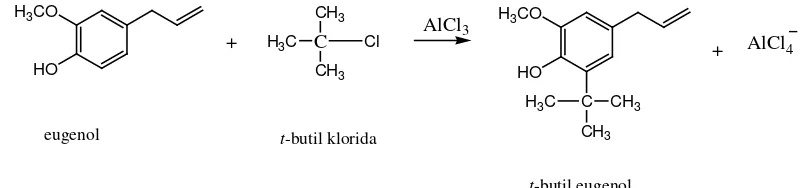
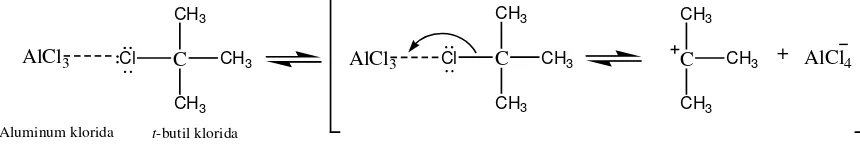
Penambahan gugus t-butil dalam eugenol dapat dilakukan berdasarkan reaksi Friedel-Craft. Dalam reaksi tersebut, eugenol direaksikan dengan t-butil klorida dengan katalis AlCl3
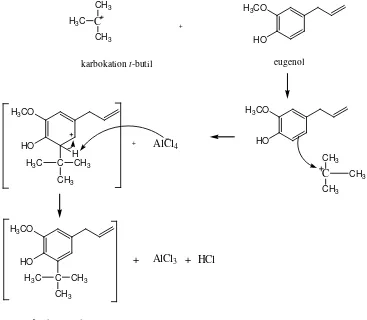
Adanya gugus hidroksi pada eugenol yang bersifat sebagai aktifator dan pengarah orto – para maka gugus t-butil akan masuk pada posisi orto dari gugus hidroksi. Posisi para dari gugus hidroksi tidak dapat dimasuki gugus t-butil karena sudah diduduki gugus lain, yaitu gugus propenil. Karakteristik utama pada seluruh gugus pengaktivasi adalah kemampuannya memberikan elektron-elektron pada cincin benzen, yang membuat cincin benzen semakin kaya elektron dan dengan cepat mampu menstabilkan karbokation, sehingga menurunkan energi aktivasi dari reaksi (McMurry, 2008).
13
Gambar 7. Reaksi eugenol dengan t-butil klorida
Optimasi proses sintesis perlu dilakukan agar diperoleh jumlah senyawa
t-butil eugenol yang optimal. Reaksi alkilasi Friedel-Craft sangat bergantung pada penggunaan katalis, suhu, dan lama pemanasan.
G. Uji Organoleptis
Uji organoleptis bertujuan untuk mengetahui sifat fisik dari senyawa hasil sintesis, meliputi bentuk, warna, bau dan rasa. Uji ini dilakukan dengan membandingkan senyawa hasil sintesis dengan starting material yang digunakan. Uji ini merupakan uji paling sederhana, dapat dilakukan tanpa bantuan alat. Dari hasil pemeriksaan organoleptis dapat diketahui jika senyawa hasil sintesis berbeda dengan senyawa awal (starting material) maka disimpulkan telah dihasilkan senyawa yang baru (Anonim, 1995).
H. Kromatografi Lapis Tipis (KLT)
Kromatografi lapis tipis dapat digunakan untuk mengidentifikasi komponen tertentu. Teknik ini sering dilakukan dengan lempeng kaca atau plastik yang dilapisi dengan fase diam. Senyawa yang akan dianalisis ditotolkan pada dasar lempengan yang dilapisi fase diam dan dielusi dengan fase gerak yang akan bergerak naik oleh karena gaya kapilaritas (Bresnick, 2004).
Jika fase diam bersifat polar maka senyawa yang bersifat polar akan melekat lebih kuat pada lempeng daripada senyawa non polar akibat interaksi tarik-menarik dipol-dipol. Senyawa non polar kurang melekat pada fase diam polar sehingga terelusi lebih cepat. Berdasarkan hal tersebut dapat disimpulkan bahwa jarak rambat senyawa pada lempengan dapat digunakan sebagai cerminan polaritas suatu senyawa (Bresnick, 2004).
Fase diam yang digunakan berupa serbuk halus yang berfungsi sebagai permukaan penyerap atau berfungsi sebagai permukaan penyangga untuk lapisan zat cair. Fase diam yang biasa digunakan adalah silika gel (asam silika), alumina (aluminium oksida), selulosa, kiselgur (tanah diatom). Sedangkan untuk fase gerak dapat digunakan segala macam pelarut, didasarkan pada pustaka yang ada atau dari hasil percobaan dengan variasi tingkat kepolaran (Gritter dkk, 1991).
Identifikasi senyawa-senyawa yang dipisahkan dengan kromatografi lapis tipis lebih baik dikerjakan dengan pereaksi kimia dan reaksi-reaksi warna. Tetapi lazimnya menggunakan harga Retardation factor (Rf). Harga-harga Rf untuk
15
Nilai Rf diperoleh dari perbandingan jarak yang ditempuh oleh bercak
senyawa yang diidentifikasi dengan jarak yang ditempuh pelarut (jarak pengembangan), Rf didefinisikan dalam satuan panjang yang lazim digunakan
(Gritter dkk, 1991).
Untuk mengidentifikasi bercak yang ada pada lempeng KLT dapat dilakukan menempatkan lempeng KLT dibawah sinar UV atau dengan menyemprotkan larutan yang dapat bereaksi dengan senyawa sehingga dapat menimbulkan warna (Bresnick, 2004).
I. Kromatografi Gas
Kromatografi gas merupakan instrumen analitis yang memberikan informasi baik kualitatif maupun kunatitatif mengenai komponen dari suatu sampel. Sampel akan mengalami proses pemisahan dalam kolom, kemudian dideteksi dan direkam sebagai pita elusi (Day and Underwood, 1996).
Secara umum instrument dari kromatografi gas adalah sebagai berikut :
Data kromatografi gas biasanya terdiri atas waktu retensi berbagai komponen campuran. Waktu retensi diukur mulai dari titik penyuntikan sampai titik maksimum puncak dan sangat khas untuk senyawa tertentu pada kondisi tertentu (kolom, suhu, gas pembawa, laju aliran). Adanya komponen tertentu dapat diidentifikasikan dengan cara spiking apabila tersedia senyawa murninya. Senyawa murni ditambahkan ke dalam cuplikan yang diduga mengandung senyawa yang diinginkan dan dikromatografi. Jika puncak yang sesuai diperkuat secara simetris pada dua sistem fase diam yang berlainan dan kepolarannya berbeda, komponen itu mungkin ada (Gritter, 1991).
J. Spektrometri Massa (MS)
Spektroskopi massa merupakan suatu teknik yang digunakan dalam penentuan suatu massa dan juga berat molekul suatu senyawa. Untuk mendapatkan informasi yang mungkin mengenai struktur suatu senyawa dapat dilakukan dengan mengukur massa dari fragmen-fragmen ketika molekul mengalami pemecahan (McMurry, 2004).
17
positif lawan perbandingan massa/muatan (m/z). Muatan ion dari kebanyakan partikel yang terdeteksi dalam spektrum massa adalah +1. Nilai m/z ion semacam ini sama dengan massanya. Dari segi praktis, spektrum massa adalah rekaman dari massa partikel lawan kelimpahan relatif partikel tesebut.
Suatu molekul atau ion pecah menjadi fragmen-fragmen bergantung pada kerangka karbon dan gugus fungsional yang ada. Oleh karena itu, struktur dan massa fragmen memberikan petunjuk mengenai struktur molekul induknya. Selain itu, spektrum massa digunakan juga untuk menentukan bobot molekul suatu senyawa (Fessenden dan Fessenden, 1986).
Untuk pembuatan spektrum massa hanya dibutuhkan sekitar 1µg hingga 0,5 mg zat. Pada spektroskopi massa, proses yang terjadi adalah sebagai berikut: (1) Ionisasi molekul pada bagain mana akan terbentuk hasil ionisasi bermuatan positif, (2) Mempercepat ion positif melalui medan magnet, (3) Pemisahan ion bedasarkan perbandingan massanya terhadap muatan (m/e), (4) Identifikasi dan registrasi ion tersebut.
K. PROGRAM IMAGE J
Image J adalah sebuah program dari The National Institute of Health (NIH) yang memungkinkan Anda untuk menganalisis ukuran partikel dalam foto. Analisis dapat dilakukan terhadap ukuran butir dan distribusi di bagian lintas material dan menggunakan informasi tersebut untuk menentukan beberapa sifat mekanik dari sistem (Anonim, 2009).
Program ini merupakan program grafis yang cukup mudah dan telah dipilih karena kemudahan penggunaan bagi komputer berbasis kegiatan pencitraan yang terintegrasi di dalam buku. Kode sumbernya tersedia secara bebas, sehingga pengguna memiliki kebebasan penuh untuk menjalankan, menyalin, mendistribusikan, mempelajari, mengubah dan meningkatkan kinerja perangkat lunak Pada tingkat yang lebih mendasar ini memungkinkan pengguna untuk mengumpulkan operasi pencitraan bersama di makro, yang disimpan sebagai file teks dan mudah untuk menulis, mengedit dan debug (Anonim, 2009).
L. Landasan Teori
Reaksi alkilasi Friedel Craft adalah reaksi alkilasi atau penambahan suatu gugus alkil ke dalam cincin benzen menggunakan katalis asam Lewis seperti Aluminium Klorida. Reaksi ini sangat bergantung pada kondisi tertentu, seperti penggunaan katalis, suhu, dan lama pemanasan.
19
struktur eugenol dengan penambahan gugus t-butil pada posisi orto dari gugus hidroksi fenolik eugenol dapat meningkatkan aktivitas antioksidan eugenol. Modifikasi struktur eugenol ini dilakukan dengan reaksi alkilasi Friedel Craft dengan katalis asam lewis. Reaksi yang terjadi adalah penambahan gugus t-butil ke dalam cincin benzen dari senyawa eugenol, dengan menggunakan katalis Aluminium klorida.
Gugus hidroksi fenolik pada eugenol merupakan gugus aktifator dan merupakan pengarah orto-para, sehingga gugus t-butil akan masuk pada posisi orto dari gugus hidroksi. Gugus t-butil tidak akan masuk pada posisi para dari gugus hidroksi fenolik eugenol. Karena pada posisi ini sudah diduduki gugus lain yaitu, gugus propenil dan posisi orto yang lain sudah diduduki gugus metoksi.
M. Hipotesis
1. Tersier-butil eugenol dapat disintesis dari eugenol dengan t-butil klorida menggunakan katalis Aluminium klorida (AlCl3).
21 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk dalam penelitian eksperimental karena ada perlakuan terhadap subjek uji, yaitu eugenol.
B. Variabel dan Definisi Operasional 1. Variabel penelitian
a. Variabel bebas pada penelitian ini adalah suhu pemanasan 400 C, 600 C, dan 800
b. Variabel tergantung pada penelitian ini adalah jumlah senyawa t-butil eugenol karena merupakan obyek yang kehadirannya akibat reaksi antara eugenol dengan t-butil klorida.
C.
c. Variabel pengganggu terkendali pada penelitian ini adalah lama pemanasan dan kondisi peralatan.
2. Definisi operasional
a. Starting material adalah senyawa awal yang digunakan dalam proses sintesis dengan tujuan untuk mendapatkan senyawa yang kita inginkan.
Starting material dalam penelitian ini adalah eugenol dan t-butil klorida. b. Molekul target adalah senyawa akhir yang dihasilkan melalui proses reaksi
starting material dengan katalis. Molekul target dalam penelitian ini adalah
c. Katalis adalah senyawa yang digunakan untuk mempercepat reaksi pembentukan molekul target. Katalis yang digunakan dalam penelitian ini adalah alumunium klorida.
C. Bahan Penelitian
Eugenol (p.a., Sigma), t-butil klorida (p.a., Merck), alumunium klorida (p.a., Merck), aquadest, etil asetat (p.a., Merck), toluena (p.a., Merck), dan silika gel 60 GF254
D. Alat Penelitian (Merck).
Alat yang digunakan meliputi alat-alat gelas, perangkat alat refluks, perangkat kromatografi lapis tipis, pemanas elektrik (Heidolph MR2002), timbangan elektrik (Mextler PM 100), mikropipet (Socorex Swiss), termometer,
thermopan (electrothermal 9100), kromatografi gas-spektrometer massa (Shimadzu QP 2010S), dan lampu UV254
E. Tata Cara Penelitian nm.
1. Sintesis t-butil klorida dari t-butanol dan asam klorida (HCl)
23
bikarbonat, dan 6 ml larutan Natrium Klorida jenuh secara berturut-turut dan diambil lapisan atasnya.
2. Sintesis t-butil eugenol dengan katalis aluminium klorida (AlCl3)
a. Aluminium Klorida 4,3336 g dilarutkan dalam dietil eter 100 ml dalam labu alas bulat. Kemudian tambahkan t-butil klorida sebanyak 3,6 ml ke dalam labu alas bulat. Campuran dibiarkan selama 1 malam. Eugenol 1 ml ditambahkan pada campuran di atas dan dipanaskan pada suhu 400 C selama 3 jam.
b. Aluminium Klorida 4,3336 g dilarutkan dalam dietil eter 100 ml dalam labu alas bulat. Kemudian tambahkan t-butil klorida sebanyak 3,6 ml ke dalam labu alas bulat. Campuran dibiarkan selama 1 malam. Eugenol 1 ml ditambahkan pada campuran di atas dan dipanaskan pada suhu 600 C selama 3 jam.
3. Analisis hasil
a. Perhitungan jumlah senyawa hasil sintesis
Setiap proses sintesis dihitung jumlahnya dan dibandingkan sehingga dapat diperoleh suatu proses sintesis yang menghasilkan jumlah senyawa
t-butil eugenol yang optimal. Jumlah senyawa hasil sintesis dihitung dengan program Image J.
b. Uji organoleptis
Senyawa hasil sintesis diamati warna, bau dan bentuk dan dibandingkan dengan eugenol. Adanya perbedaan sifat fisis senyawa hasil sintesis dengan eugenol menunjukkan telah terbentuknya senyawa baru yang berbeda dengan starting material eugenol.
c. Kromatografi lapis tipis (KLT)
Eugenol 1 ml diencerkan dengan dietil eter100 ml digunakan sebagai baku pembanding. Baku pembanding dan ketiga senyawa hasil sintesis sebanyak 15 µl ditotolkan pada lempeng silika gel 60 GF254 dengan
mikropipet, kemudian dielusi dengan fase gerak toluena : etil asetat (93:7) dengan jarak elusi 15 cm dan dideteksi dengan sinar UV254 nm. Amati
bercak yang terdapat pada lempeng KLT. Bandingkan harga Rf senyawa
25
sintesis berbeda dengan harga Rf
d. Elusidasi struktur dengan spektrometri massa
eugenol, maka didapatkan senyawa baru yang berbeda dengan eugenol.
Senyawa hasil sintesis diidentifikasi strukturnya dengan menggunakan spektroskopi massa. Masing-masing spektrum yang dihasilkan dapat digunakan untuk menyimpulkan struktur senyawa hasil sintesis.
26
A. Sintesis Tersier-Butil Klorida
Salah satu starting material dalam sintesis tersier-butil eugenol adalah
tersier-butil klorida. Senyawa ini disintesis dengan mereaksikan t-butanol dan asam klorida (HCl). Mekanisme reaksi ini terdiri dari dua tahap. Pada tahap pertama HCl akan terionisasi menjadi ion H+ dan Cl-, ion H+ yang terbentuk akan memprotonasi gugus hidroksi pada t-butanol sehingga terbentuk gugus pergi yang lebih baik. Selanjutnya terjadi pemutusan ikatan pada t-butanol dan diperoleh karbokation t-butil dan H2O. Pada tahap pertama energi aktivasi yang dibutuhkan
dalam pemutusan ikatan ini tinggi sehingga reaksi berlangsung lambat. Kemudian pada tahap kedua akan terjadi reaksi antara karbokation t-butil dengan ion Cl -yang tersisa membentuk t-butil klorida. Pada tahap kedua ini energi aktivasi yang dibutuhkan untuk reaksi antara karbokation t-butil dan ion Cl- kecil sehingga reaksi berlangsung lebih cepat. Sintesis t-butil klorida dilakukan berdasarkan reaksi SN1 (substitusi, nukleofilik, unimolekular). Reaksi pembentukkan t-butil
27
Gambar 9. Mekanisme reaksi pembentukkan tersier-butil klorida
Produk yang dihasilkan dari pencampuran t-butanol dan HCl adalah produk dengan dua fase. Fase yang diambil adalah fase atas karena fase ini merupakan t-butil klorida yang terbentuk, sedangkan fase bawah merupakan campuran air dan HCl yang tersisa. Setelah kedua fase dipisahkan maka kemudian fase atas dicuci dengan larutan natrium klorida (NaCl) jenuh dan larutan natrium bikarbonat (NaHCO3) jenuh. Larutan NaCl jenuh berfungsi sebagai “drying
agent”, yaitu untuk menarik air yang masih terjebak dalam produk t-butil klorida yang dihasilkan. Sedangkan larutan NaHCO3 jenuh berfungsi untuk menetralkan
Gambar 10. Reaksi penetralan asam klorida
Dai hasil sintesis tersebut diperoleh senyawa t-butil klorida yang kemudian digunakan sebagai salah satu starting material pada sintesis t-butil eugenol.
B. Sintesis Tersier-Butil Eugenol
Sintesis tersier-butil eugenol dilakukan dengan cara mereaksikan eugenol dan tersier-butil klorida menggunakan katalis Aluminium Klorida. Reaksi sintesis dilakukan dengan refluks menggunakan pendingin Alihn, dengan menggunakan
refluks maka uap dari starting material akan terkondensasi pada kondensor bola menjadi molekul-molekul cairan dan kemudian akan turun bereaksi kembali. Oleh karena itu kondisi refluks membantu menjaga kesempurnaan proses reaksi karena dapat mempertahankan kestabilan thermodinamika dari sistem yang ada.
Hasil penimbangan Aluminium Klorida dilarutkan dalam dietil eter 100 ml, dipilih pelarut dietil eter karena AlCl3 melarut baik dalam dietil eter. Selain
itu pelarut dietil eter termasuk pelarut non-polar aprotik, sifat dari perlarut ini adalah inert karena gaya intermolekulernya lemah sehingga tidak akan bereaksi dengan reaktan. Hal ini penting karena pelarut pada penelitian kali ini berfungsi sebagai pelarut katalis. Katalis awalnya berbentuk serbuk padatan, agar mempercepat saat bereaksi dengan t-butil klorida yang bentuknya cair. Maka AlCl3
NaHCO3 + HCl NaCl + H2O + CO2
29
pelarut yang digunakan tidak bersifat inert, pelarut seperti ini bisa mendonorkan protonnya sehingga akan mempengaruhi hasil sintesis.
Aluminium Klorida berfungsi untuk sebagai katalis yang dapat mempercepat laju reaksi dan bahan ini tidak berubah pada akhir reaksi. AlCl3
Selanjutnya larutan dimasukkan dalam labu alas bulat dan ditambahkan t -butil klorida. Kemudian dilakukan penggojogan yang bertujuan memberi energi kinetik untuk mempercepat reaksi. Larutan ini didiamkan selama semalam. Reaksi yang berlangsung ketika larutan didiamkan selama satu malam adalah:
Gambar 11. Reaksi AlCl
dapat mempercepat laju reaksi karena membantu terbentuknya karbokation yang optimal pada atom C tersier dari gugus alkil t-butil klorida. Prinsipnya adalah suatu reaksi dapat terjadi jika partikel-partikel bertumbukan dengan energi yang cukup. Energi minimum untuk mencapai suatu reaksi disebut energi aktivasi. Agar laju reaksi meningkat maka perlu penurunan energi aktivasi, salah satunya dengan pemakaian katalis.
3
Setelah AlCl
dengan t-butil klorida ketika larutan didiamkan semalam
3 direaksikan semalaman dengan t-butil klorida, proses
selanjutnya adalah ditambahkan eugenol dan dilakukan proses refluks. Ketika AlCl3
akan lebih mudah menyerang C tersier dari gugus t-butil. Dalam proses refluks kali ini air sebagai pendingin diganti dengan air es, hal ini bertujuan agar uap dari
starting material akan cepat terkondensasi kembali pada kondensor bola menjadi molekul-molekul cairan. Sehingga akan kembali turun menuju labu alas bulat bereaksi kembali.
Adanya gugus hidroksi pada eugenol yang bersifat sebagai aktifator dan pengarah orto – para maka gugus t-butil akan masuk pada posisi orto dari gugus hidroksi. Posisi para dari gugus hidroksi tidak dapat dimasuki gugus t-butil karena sudah diduduki gugus lain, yaitu propenil. Reaksinya adalah sebagai berikut:
31
Reaksi sintesis tertier-butil eugenol merupakan reaksi alkilasi Friedel-Craft dengan menggunakan katalis asam Lewis yaitu AlCl3
Pemeriksaan
. Dalam reaksi ini terjadi substitusi dengan gugus alkil pada cincin benzen. Karakteristik utama gugus pengaktivasi, seperti gugus hidroksi pada eugenol adalah kemampuannya memberikan elektron-elektron pada cincin benzen, yang membuat cincin benzen semakin kaya elektron. Sehingga ketika eugenol bereaksi dengan karbokation t -butil maka dengan cepat karbokation akan terstabilkan.
C. ANALISIS HASIL
1. UJI ORGANOLEPTIS
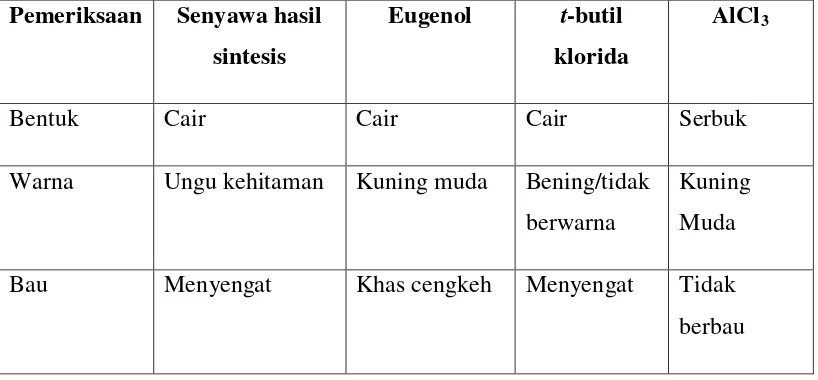
Uji pendahuluan yang dilakukan hanyalah uji organoleptis. Hasil pemeriksaan organoleptis senyawa hasil sintesis dibandingkan dengan eugenol adalah sebagai berikut:
Tabel I. Hasil pemeriksaan organoleptis senyawa hasil sintesis dan starting material
Warna Ungu kehitaman Kuning muda Bening/tidak berwarna
Dari hasil pemeriksaan organoleptis senyawa hasil sintesis memiliki bentuk, warna, dan bau yang berbeda dengan senyawa awal yaitu eugenol dan t -butil klorida. Hal ini telah menunjukkan bahwa senyawa yang dihasilkan telah berbeda dengan senyawa awal. Untuk mengetahui apakah senyawa yang dihasilkan adalah t-butil eugenol maka dilakukan uji selanjutnya.
2. KROMATOGRAFI LAPIS TIPIS
Kromatografi lapis tipis (KLT) merupakan salah satu metode kromatografi yang dapat digunakan untuk mengetahui kemurnian suatu senyawa hasil sintesis. Fase diam yang digunakan dalam kromatografi lapis tipis kali ini adalah silika gel 60 GF254
Silika gel 60 GF
dan fase geraknya toluena : etilasetat (93:7), jarak pengelusian 15 cm. Bercak hasil elusi kemudian dideteksi di bawah sinar UV 254. Pembading yang digunakan adalah baku eugenol, digunakan eugenol karena tersier-butil eugenol merupakan senyawa baru, sehingga belum ada senyawa baku tersier-butil eugenol yang dapat digunakan sebagai pembanding. Jika terdapat bercak baru yang berbeda dengan eugenol, bercak tersebut dapat dianggap sebagai senyawa baru. Kemudian dapat dilakukan uji dengan kromatografi gas (GC) - spektroskopi massa (MS) untuk menentukan apakah telah terbentuk tersier-butil eugenol atau belum.
254 sebagai fase diam mengandung Gips (CaSO4)
33
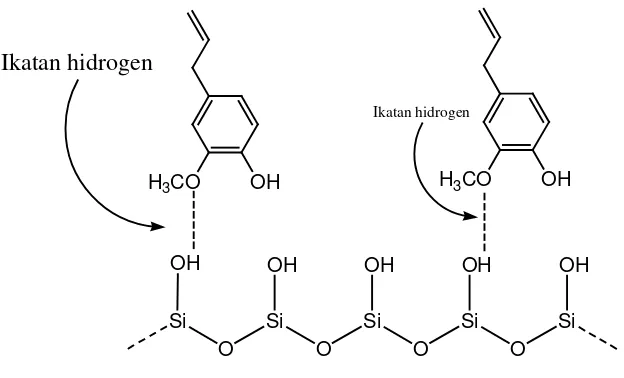
terdeteksi, hal ini karena akan terjadi peredaman pada becak dengan latar belakangnya berfluororesensi hijau terang. Peredaman terjadi karena senyawa hasil sintesis yaitu tersier-butil eugenol dan eugenol memiliki ikatan rangkap terkonjugasi atau gugus kromofor. Ketika dilakukan deteksi bercak, sinar UV akan diabsorbsi oleh kedua senyawa tersebut, hal inilah yang disebut sebagai peredaman bercak karena sinar UV 254 nm tidak dapat mengenai indikator fluororesensi dan tidak ada cahaya yang dipancarkan pada bercak tersebut. Fase gerak yang digunakan adalah toluena : etilasetat (93:7) dipilih fase gerak ini karena dari hasil orientasi, fase gerak inilah yang paling optimal memisahkan bercak senyawa hasil sintesis dengan bercak eugenol. Fase gerak toluena : etilasetat sifatnya lebih non polar dibanding fase diam silika gel GF 254. Sehingga senyawa yang bersifat lebih non polar akan lebih cenderung terbawa fase gerak. Senyawa hasil sintesis yang diharapkan lebih non polar dari eugenol, karena adanya tambahan gugus t-butil, sehingga diprediksikan akan terbentuk bercak di atas bercak eugenol.
Hasil Rf senyawa hasil sintesis yang diperoleh pada suhu 600 C (Gambar
15 bercak B) adalah 0, 74 dan Rf eugenol sebesar 0, 62 keduanya berwarna
Pada gambar 15 nampak bercak F, G, dan H, dimana bercak ini berbeda dengan bercak eugenol. Namun bercak ini bukanlah bercak senyawa hasil sintesis. Bercak ini adalah bercak katalis AlCl3 (Gambar 16) yang merupakan senyawa
logam. Senyawa ini tidak rigid, planar, dan bukan senyawa aromatis sehingga juga dapat menimbulkan peredaman bercak, karena sinar UV 254 nm tidak dapat mengenai indikator fluororesensi dan tidak ada cahaya yang dipancarkan pada bercak tersebut.
Hasil Rf eugenol lebih kecil dari Rf senyawa hasil sintesis hal ini dapat
35
Gambar 13. Ikatan hidrogen eugenol dengan silika gel
Gambar 14. Ikatan hidrogen senyawa hasil sintesis dengan silika gel
Gambar 15. KLT senyawa hasil sintesis
Keterangan:
37
Gambar 16. KLT senyawa hasil sintesis dan katalis AlCl3
Keterangan:
Bercak A : eugenol Bercak B dan C : katalis AlCl3
Tabel II. Data Rf eugenol dan senyawa hasil sintesis
3. ELUSIDASI STRUKTUR SENYAWA HASIL SINTESIS
Elusidasi struktur senyawa hasil sintesis dilakukan dengan spektroskopi massa (GC-MS). Kromatografi gas dapat digunakan untuk mengetahui tingkat kemurnian senyawa hasil sintesis. Kromatografi gas ini digunakan bersama dengan penggunaan spektroskopi massa. Keuntungan dari kombinasi kromatografi gas dan massa adalah apabila komponen senyawa hasil sintesis masih bercampur dengan senyawa lain, maka senyawa lain ini dapat dipisahkan. Pemisahan ini akan menghasilkan spektrum yang dihasilkan pada spektroskopi massa adalah benar-benar murni dari senyawa hasil sintesis.
Senyawa Nilai Rf
Eugenol 0, 62 (bercak A)
Senyawa hasil sintesis dengan suhu pemanasan 400
0, 62 (bercak C) C
Senyawa hasil sintesis dengan suhu pemanasan 600
0, 62 (bercak D)
0, 74 (bercak B) C
Senyawa hasil sintesis dengan suhu pemanasan 800
39
Gambar 17. Kromatogram senyawa hasil sintesis dengan kromatografi gas
Hasil pengujian kemurnian dengan kromatografi gas menunjukkan senyawa hasil sintesis belum murni. Hal ini terlihat dari masih banyaknya puncak senyawa lain di hasil kromatogram. Peak dari t-butil eugenol ditunjukkan oleh peak nomor 23 dengan waktu retensi 12,242 menit. Namun dari hasil peak yang diperoleh telah menunjukkan terjadi pemisahan senyawa hasil sintesis dengan kromatografi gas. Proses selanjutnya adalah elusidasi komponen hasil sintesis dengan spektroskopi massa.
Gambar 18. Spektrum massa senyawa pada peak nomor 23 dengan waktu retensi 12,242 menit
Keterangan:
Peak pada rasio m/z = 355 menunjukkan ion molekular senyawa
hasil sintesis yang masih berikatan dengan katalis
Peak pada rasio m/z = 57 menunjukkan fragmen ion t-butil
Peak pada rasio m/z = 41 menunjukkan fragmen ion C3H5
+
Gambar 18 menunjukkan hasil elusidasi struktur senyawa hasil sintesis dengan spektroskopi massa. Prinsip elusidasi dengan spektrometer massa adalah molekul senyawa hasil sintesis ditembak dengan elektron berenergi tinggi sehingga salah satu elektron valensinya lepas. Hasil dari penembakan dengan elektron berenergi tinggi ini adalah suatu ion molekular, yaitu ion radikal dengan muatan +1. Dari hasil elusidasi, diketahui telah terbentuk senyawa hasil sintesis yaitu tersier-butil eugenol. Bobot molekul dari t-butil eugenol adalah 220, namun pada gambar18 tidak ada yang menunjukkan peak dengan rasio m/z = 220. Dari
peak pada rasio m/z = 355 sebenarnya telah menunjukkan bahwa telah terbentuk
t-butil eugenol hanya saja masih dalam bentuk berikatan dengan katalis AlCl3.
41
Gambar 19. Penembakan molekul senyawa hasil sintesis dengan elektron berenergi tinggi
Peak ion molekular ini tidak stabil sehingga masih dapat terfragmentasi kembali. Ion molekular akan kembali terpecah menjadi fragmen-fragmen yang lebih kecil, baik berupa radikal bebas maupun ion-ion. Tetapi hanya fragmen bermuatan positif yang akan terdeteksi oleh spektrofotometer massa.
Peak pada rasio m/z = 57 menunjukkan fragmen kation t-butil (C4H9+).
H3CO
kation t-butil, m/z = 57
H3CO
Kation senyawa hasil sintesis akan mengalami fragmentasi lebih lanjut dengan menghasilkan kation senyawa C3H5+. Peak kation C3H5+ ini menunjukkan
rasio m/z = 41 yang sesuai peak C. Mekanisme fragmentasi ion molekular C3H5+
43
Gambar 21. Fragmentasi kation C3H5+
Peak ion molekular memiliki massa yang sesuai dengan bobot molekul senyawa hasil sintesis namun bentuknya masih berikatan dengan katalis AlCl
(m/z = 41)
3.
Hal ini dapat disebabkan karena AlCl3 merupakan akseptor elektron sedangkan
gugus OH pada t-butil eugenol merupakan pendonor elektron. AlCl3 akan
menerima elektron dari pasangan elektron bebas pada atom O. Hal ini terjadi karena adanya orbital kosong pada AlCl3, sehingga atom O pada gugus hidroksi
dari eugenol masih bisa berinteraksi dengan AlCl3. Ikatan katalis AlCl3 dengan
H3CO
O
C CH3
H3C
CH3
Cl3Al H
Gambar 22. tersier-butil eugenol masih berikatan dengan katalis
4. PERHITUNGAN JUMLAH SENYAWA HASIL SINTESIS
45
suhu terhadap jumlah senyawa t-butil eugenol, sehingga diperoleh jumlah senyawa t-butil eugenol yang paling optimal.
Reaksi alkilasi Friedel-Craft sangat bergantung pada kondisi tertentu, seperti penggunaan katalis, suhu, dan lama pemanasan. Dalam penelitian ini diamati salah satu faktor yang mempengaruhi reaksi alkilasi Friedel-Craft yaitu suhu pemanasan. Hal ini dikarenakan suhu akan mempengaruhi kecepatan reaksi dan kecepatan terbentuknya senyawa target. Pengaruh suhu pemanasan terhadap laju reaksi adalah apabila suhu pada suatu reaksi dinaikkan, maka menyebabkan partikel semakin aktif bergerak, sehingga tumbukan yang terjadi semakin sering, menyebabkan laju reaksi semakin besar. Hal ini disebabkan karena adanya pemanasan akan memberikan energi yang meningkatkan pergerakan molekul
starting material sehingga kontak atau tumbukan antar starting material makin besar dan mempercepat reaksi pembentukan senyawa target. Sehingga suhu pemanasan akan mempengaruhi jumlah senyawa t-butil eugenol yang dihasilkan.
energi aktivasi, yaitu jumlah energi minimum yang diperlukan untuk mengawali reaksi kimia.
Pemberian suhu akan memberikan energi kinetik untuk tumbukan molekul-molekul. Saat molekul bertumbukan sebagian dari energi kinetik akan diubah menjadi energi vibrasi. Apabila energi kinetik awalnya besar, maka molekul yang bertumbukan akan bergetar kuat sehingga memutuskan beberapa ikatan kimianya dan membentuk produk. Jika energi kinetik awalnya kecil, maka molekul hanya akan terpental dan tetap utuh sehingga tidak terbentuk produk. Hal yang terjadi pada suhu 400 C adalah energi kinetik yang ada lebih kecil dari energi aktivasi sehingga molekul tetap utuh dan tidak terbentuk senyawa t-butil eugenol.
47
Perhitungan jumlah senyawa hasil sintesis dilakukan dengan program
Image J. Prinsip program Image J adalah mengukur intensitas warna dari suatu objek dan mengkalkulasinya dalam suatu Area Under Curve (AUC). Jadi, dari hasil KLT yang diperoleh diproses dengan program tersebut, kemudian dibandingkan AUC senyawa hasil sintesis dengan AUC total.
Tabel 3. Data AUC eugenol dan senyawa hasil sintesis Bercak senyawa Nilai AUC bercak
Eugenol 1504.861
Senyawa hasil sintesis 1417.083
=
= 48,50 %
-butil klorida terlalu cepat menguap kembali dan waktu bereaksinya minimal. Berdasarkan teori tumbukan, kelajuan dari setiap langkah dalam suatu reaksi adalah berbanding langsung dengan:
1. Jumlah tumbukan per detik antara partikel-partikel yang bereaksi 2 Bagian dari tumbukan itu yang efektif
Berdasarkan teori tersebut, menjelaskan tidak dihasilkannya senyawa t-butil eugenol pada suhu 800 C. Hal ini menggambarkan ketika t-butil klorida terlalu cepat menguap karena suhu yang digunakan terlalu jauh dari titik didihnya, maka kesempatan senyawa tersebut untuk bereaksi sangat minimal. Hal ini karena tumbukan antar partikel-partikel starting material yaitu t-butil klorida dan eugenol sangat minimal, sehingga tidak terjadi peningkatan laju reaksi dan akhirnya pada suhu 800
Hasil penelitian yang diperoleh, variasi suhu pemanasan akan mempengaruhi jumlah senyawa t-butil eugenol yang dihasilkan. Semakin tinggi suhu pemanasan akan meningkatkan hasil jumlah senyawa t-butil eugenol yang dihasilkan. Hal ini terlihat dari variasi suhu 40
C tidak diperoleh senyawa t-butil eugenol.
0
49 BAB V
KESIMPULAN DAN SARAN
A. KESIMPULAN
Dari penelitian yang dilakukan diketahui bahwa:
1. t-butil eugenol dapat disintesis dari eugenol dengan t-butil klorida menggunakan katalis Aluminium Klorida.
2. Variasi suhu pemanasan akan mempengaruhi jumlah senyawa t-butil eugenol yang dihasilkan. Suhu pemanasan yang optimal dalam reaksi sintesis t-butil eugenol, yaitu suhu 600 C.
B. SARAN
Setelah t-butil eugenol dapat disintesis dari eugenol dengan t-butil klorida menggunakan katalis Aluminium klorida, serta diketahui suhu pemanasan paling optimal dalam reaksi sintesis t-butil eugenol, perlu dilakukan penelitian lebih lanjut dengan:
1. Pemurnian senyawa hasil sintesis agar didapatkan senyawa tersier-butil eugenol yang murni, dengan KLT preparatif.
DAFTAR PUSTAKA
Anonim, 1986, Sediaan Galenik, 10-11, 16-17, 25-28, Departemen Kesehatan Republik Indonesia, Jakarta
Anonim, 1989, The Merck Index, an Encyclopedia of Chemical, Drugs, and, Biologicals, Eleventh Edition, 335, 1566, 3849, Merck & Co., Inc., Rahway, New Jersey, USA
Anonim, 1995, Farmakope Indonesia, Edisi IV, 12, Departemen Kesehatan Republik Indonesia, Jakarta
Anonim, 2004, Efek dari katalis,
November 2009
Anonim, 2009, Antioksidan,
November 2009
Anonim, 2009, Image J, www.duke.edu, diakses pada tanggal 2 Desember 2009 Anonim, 2009, Image J , www.cambridge.org, diakses pada tanggal 2 Desember
2009
Anonim, 2009, Ekstraksi,
Desember 2009
Ardyansyah, 2007, Antioksidan dan Peranannya Bagi Kesehatan, www.iptek.com, diakses pada tanggal 23 September 2008
Bresnick, M.D, 2004, Intisari Kimia Organik, 96-99, 101-107, Penerbit Hipokrates, Jakarta
Chang, R., 2003, Kimia Dasar Konsep-Konsep Inti Jilid 2, Edisi ketiga, 43-45, Penerbit Erlangga, Jakarta
Corwin, C. H., 2001, Introductory Chemistry Concepts and Connections, 452-453, 3rd Edition, Prentice-Hall, Inc. New Jersey
Day, Jr., R. A. and Underwood, A. L., Analisis Kimia Kuantitatif, diterjemahkan oleh Pudjaatmaka, A. H., Edisi IV, 519, Penerbit Erlangga, Jakarta Fessenden dan Fessenden, 1986, Kimia Organik, diterjemahkan oleh
51
Fessenden dan Fessenden, 1986, Kimia Organik, diterjemahkan oleh Pudjaatmaka, A.H., Jilid 2, Edisi III, 471, Erlangga, Jakarta
Gritter, J. R., Bobbit, J. M., and Scharting, A. E., 1991, Pengantar Kromatografi, diterjemahkan oleh Kosasih Padmawinata, Edisi II, 109-112, ITB, Bandung
Gasparic, J., and Churacek, J., 1978, Laboratory Handbook of Paper and Thin Layer Chromatoghrapy, 63, Ellis Horwood Limited, England Issacs, Neil, 1995, Physical Organic Chemistry, Second Edition, 194, Longman
Group, London
McMurry, J., 2008, Organic Chemistry, 7eth Ed., 393-453, Thomson Learning, Inc., USA
Ogata, M., Hoshi, M., Urano, S., and Endo, T., 2000, Antioksidant Activity of Eugenol dan Related Monomeric and Dimeric Compounds, Chem. Pharm. Bull. 48 (10) 1467-1469 (2000)
Puspita-Nienaber, N. L., Rahayu, W. P., dan Andarwulan, N., 1997, Sifat Antioksidan dan Antimikroba Rempah-rempah dan Bumbu Tradisional, Makalah Seminar Sehari Khasiat Keamanan Pangan Bumbu dan Jamu Tradisional, Yogyakarta
Sastrohamidjojo, H,. 1991, Spektroskopi, Edisi II, 46-161, Penerbit Liberty, Yogyakarta
Sastrohamidjojo, H,. 1994, Spektroskopi Resonansi Magnetik inti, Cetakan Pertama, 8-84, Penerbit Liberty, Yogyakarta
Sastrohamidjojo, H,. 2001, Kimia Dasar, 166-175, Gajah Mada University Press, Yogyakarta
Silberberg, M. S., 2006, Chemistry the Molekular Nature of Matter and Charge, 4th Edition, 692-695, Mc Graww-Hill, New York
53
55
57
59
Lampiran 8. Perhitungan nilai Rf
Senyawa hasil sintesis dengan suhu pemanasan 400
0, 62 (bercak C) C
Senyawa hasil sintesis dengan suhu pemanasan 600
0, 62 (bercak D)
0, 74 (bercak B) C
Senyawa hasil sintesis dengan suhu pemanasan 800
61
63
Lampiran 12. Hasil AUC dengan program Image J
Senyawa AUC
Eugenol 3841.368 (bercak A)
Senyawa hasil sintesis dengan suhu pemanasan 400
3470.681 (bercak C) C
Senyawa hasil sintesis dengan suhu pemanasan 600
1504.861 (bercak D) C
Senyawa hasil sintesis dengan suhu pemanasan 800
1449.062 (bercak E) C
Bercak baru pada hasil sintesis dengan suhu pemanasan 600
1417.083 (bercak B)
65
Lampiran 13. Perhitungan jumlah senyawa hasil sintesis
Bercak senyawa Nilai AUC bercak
Eugenol 1504.861
Senyawa hasil sintesis 1417.083
=
BIOGRAFI PENULIS