Prosiding Kimia-FMIPA ITS
DUA SENYAWA MANGOSTIN DARI EKSTRAK N-HEKSANA PADA KAYU AKAR
MANGGIS (Garcinia mangostana, Linn.) ASAL KAB. NGANJUK, JAWA TIMUR
Prima Agusti Lukis*, Prof. Dr. Taslim Ersam1. Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Teknologi Sepuluh Nopember
Abstrak
Garcinia mangostana, Linn. (manggis) merupakan salah satu spesies dari famili Clusiaceae yang telah dilaporkan sebagai sumber senyawa santon terprenilasi dan teroksigenasi. Dua senyawa santon diprenilasi telah berhasil diisolasi dari ekstrak n-heksana pada kayu akar manggis, yaitu β-mangostin (1) berupa kristal jarum berwarna kuning (0,2714 g) dengan titik leleh 170 – 173 °C dan α-mangostin (2) berupa padatan kuning (0,0458 g) dengan titik leleh 172 – 174 °C. Kedua senyawa tersebut diperoleh dengan menggunakan metode ekstraksi dengan cara maserasi dan fraksinasi menggunakan kromatografi cair vakum, kemudian dimonitoring dengan kromatografi lapis tipis. Pemurnian dilakukan dengan metode rekristalisasi dengan campuran dua pelarut yang sama yaitu n-heksana : aseton. Penentuan struktur kedua senyawa tersebut dilakukan dengan menggunakan data spektroskopi UV, IR, 1H-NMR, 13C-NMR, DEPT 135, HMBC dan dilakukan perbandingan data senyawa yang sama dengan yang telah dilaporkan oleh peneliti sebelumnya.
Kata kunci:
Garcinia mangostana,Linn., santon, ekstraksi, maserasi, fraksinasi,rekristastalisasi
1. Pendahuluan
Indonesia merupakan Negara kepulauan yang dilalui oleh garis katulistiwa sehingga beriklim tropis, akibat suhu yang tinggi dan curah hujan sepanjang tahun menyebabkan Indonesia memiliki keanekaragaman ekosistem dan dikenal sebagai Negara Megabiodiversitas terbesar di dunia setelah Brazilia. Selain itu, keanekaragaman ini disebabkan oleh letak Indonesia yang strategis di antara dua benua yaitu benua Asia dan benua Australia, serta dua samudra yaitu samudra Hindia dan samudra Pasifik, sehingga berbagai jenis tumbuhan dan hewan yang ada di Indonesia merupakan perpaduan antara dua benua tersebut. Diperkirakan terdapat sekitar 54% spesies tumbuhan di dunia tersebar di hutan tropic yang setara dengan 250.000 spesies tumbuhan tingkat tinggi, sedangkan tumbuhan yang tumbuh di hutan tropic Indonesia ada 30.000 spesies (Ersam,2001).
Tumbuhan memiliki peranan penting bagi kehidupan, di samping berfungsi sebagai sumber protein nabati, juga berfungsi sebagai transformator karbon dioksida menjadi oksigen dalam proses fotosintesis, bahkan akhir – akhir ini dikembangkan suatu bahan bakar kendaraan bermotor yang ramah lingkungan berasal dari minyak tumbuhan atau biasa disebut Biofuel.
Kemajuan di bidang ilmu pengetahuan, teknologi dan kesehatan juga banyak mengeksplorasi tumbuhan sebagai obat, karena tumbuhan tersebut mengandung banyak senyawa kimia yang memiliki berbagai macam khasiat. Oleh karena itu, dapat dibayangkan jika satu spesies tumbuhan yang mengandung 100 senyawa kimia itu punah, maka potensi yang dimiliki oleh 100 senyawa akan mati bersama dengan punahnya spesies tersebut. Jadi, tumbuhan yang tumbuh di hutan tropis Indonesia merupakan sumber berbagai jenis bahan kimia alami dan salah satu asset nasional yang belum banyak dieksplorasi dan dimanfaatkan oleh masyarakat.
Berdasarkan penelitian terdahulu, kebanyakan tumbuhan dapat menghasilkan senyawa metabolit primer dan metabolit sekunder. Protein, lemak, asam nukleat dan polisakarida merupakan penyusun dari makhluk hidup, sehingga disebut sebagai metabolit primer. Metabolit sekunder berperan pada kelangsungan hidup suatu spesies, terutama dalam perjuangan menghadapi spesies – spesies lain. Zat kimia yang dihasilkan dapat berfungsi sebagai pertahanan, penarik seks dan feromon (Manitto, 1992). Senyawa – senyawa yang merupakan senyawa metabolit sekunder diantaranya adalah flavonoid, benzofenon, kumarin, santon, dan lain – lain (Sumaryono, 1999).
Tumbuhan dari genus Garcinia yang telah banyak menarik perhatian beberapa tahun terakhir karena banyaknya senyawa metabolit sekunder yang telah berhasil diisolasi dari tumbuhan tersebut. Garcinia merupakan genus yang paling penting dari family
* Corresponding author phone: +6285648734537
e-mail: agresty_290888@yahoo.com
1 Alamat sekarang: Jurusan Kimia, FMIPA, Institut
Prosiding Kimia-FMIPA ITS
Clusiaceae dan banyak tersebar secara luas di kawasan tropis Asia, khususnya Indonesia. Adapun kegunaan Garcinia yang tersebar di Indonesia antara lain, berguna sebagai bahan bangunan (21 spesies), buahnya dimakan (22 spesies), tanaman peneduh di pinggir jalan, pencegah erosi, tanaman hias, daunnya sebagai sayuran, serta untuk mengobati berbagai penyakit, seperti disentri, peradangan saluran kemih, tumor rongga mulut dan kerongkongan. Selain itu, tumbuhan genus Garcinia telah dikenal sebagai sumber senyawa santon dan biflavonoid (Waterman, 1980) dengan berbagai macam bioaktivitas, seperti antimalaria (Hay, 2004), antijamur, antikanker, dan antibakteri (Peres, 1996).
Beberapa senyawa santon yang telah dilaporkan dari berbagai spesies Garcinia diantaranya adalah porsaton A dari G. parvifolia (Kosela et.al, 2006); 1,4-dihidroksi-2-(3’-metilbut-2’-enil) santon dari G. polyanta Oliv (Lanang et.al, 2005); 1,7-dihidroksi-6’,6’-dimetilpiran-(2’,3’:6,5) santon dari G. nigrolineata (Rukachaisirikul, et.al, 2003); 1,6-dihidroksi santon, 1,4,5-trihidroksi santon dari G. vieillardii (Hay, et.al, 2004); kowanin, kowanol, kowasanton dari G. cowa (Saksena, et.al, 2003). Senyawa – senyawa ini melalui penelitian bioaktifitas secara in vitro maupun in vivo telah menunjukan aktifitas sebagai antijamur, antibakteri, antikanker, antifungal, dan antimalaria.
Secara kemotaksonomi aktivitas kimiawi satu spesies dengan spesies lain dalam satu genus atau famili pada prinsipnya adalah sama secara kualitatif dan akan berbeda secara kuantitatif. Perbedaan kuantitas dari masing-masing senyawa dipengaruhi oleh ekosistem tumbuhan tersebut. Bagian-bagian tertentu pada tumbuhan seperti batang, kulit batang dan akar juga berpeluang ditemukan senyawa-senyawa yang sama atau berbeda. Selain itu afinitas kimiawi dalam satu genus memiliki hubungan kekerabatan molekul. Hubungan ini dapat dilihat pada jalur biogenesis pembentukan senyawa-senyawa tersebut (Venkataraman, 1972). Fakta ini ditunjukkan oleh afinitas kimiawi tumbuhan Artocarpus altilis asal Indonesia dengan asal Srilangka dan Taiwan juga memperlihatkan data yang sama (Ersam, 2001).
Garcinia mangostana, Linn. adalah spesies tanaman yang telah banyak digunakan sebagai obat tradisional. Tanaman ini telah diketahui menghasilkan berbagai macam metabolit yang aktif secara biologis seperti benzofenon terisoprenilasi dan santon dengan α-mangostin (10), β-mangostin (22), dan γ-mangostin (23) sebagai komponen utamanya. Ekstrak kulit buah (periscarp) dengan n-heksana menghasilkan senyawa santon gartanin (26), 1-isomangostin, 1-isomangostin hidrat, 3-isomangostin dan 3-isomangostin hidrat (Chaverry, 2008). Selain itu, masih banyak kandungan senyawa dalam spesies
ini yang belum diuji aktivitasnya sebagai antidiabetes dan antiobesitas.
Masyarakat di daerah Nganjuk yang merupakan daerah tumbuhnya Garcinia mangostana L. ini juga memanfaatkan tumbuhan ini sebagia obat disentri. Mereka mengambil kulit kayunya untuk digunakan sebagai obat tersebut. Oleh karena itu dilakukan suatu penelitian yang dimaksudkan untuk mengisolasi berbagai jenis kandungan kimia senyawa mangostin yang dapat dipisahkan pada ekstrak n-heksana dari kayu akar Garcinia mangostana L.
2. Metodologi 2.1 Alat
Peralatan yang digunakan dalam penelitian ini adalah seperangkat alat gelas seperti Erlenmeyer, beaker glass, gelas ukur, pengaduk, penyaring vakum, peralatan kolom kromatografi (KCV). Peralatan lain yang digunakan adalah ekstraktor, Eyela Rotary Evaporator N-1001, lampu ultraviolet (UV) dengan λ 254 dan 366 nm, Melting Point Apparatus Fisher – Johns, Spektrofotometer UV-VIS 1700 Pharmastec Shimadzu, Spektrofotometer IR BUCK Scientific 500 dan Spektrometri 1H dan 13 C-NMR Jeol JMN ECA 500 MHz.
2.2 Bahan
Bahan yang digunakan dalam penelitian ini adalah kayu akar tanpa kulit G.mangostana dalam bentuk serbuk kering, pelarut organic seperti n-heksana, metilen klorida, kloroform, etil asetat, aseton dan metanol. Bahan – bahan yang lain yang digunakan adalah TLC aluminium sheets 20x20 cm Silica gel 60 F254 untuk KLT, Silica gel 60 untuk
impregnasi, Silica gel 60 G untuk kromatografi cair vakum, penampak noda serium sulfat (Ce(SO4)2)
1,5% dalam H2SO4 2N.
2.3 Persiapan Bahan Tumbuhan
Sebagai sampel digunakan kayu akar G. mangostana dari Nganjuk sebanyak 3 kg. Selanjutnya kayu akar yang telah kering, dipotong kecil – kecil, digiling hingga menjadi serbuk halus dan siap digunakan. Pemilihan pelarut untuk ekstraksi dilakukan dengan menyiapkan 5 vial masing – masing diisi 10 ml pelarut n-heksana, metilen klorida, etil asetat, aseton dan metanol sebanyak masing – masing ± 2 gram serbuk halus dimasukkan ke dalam vial 50 ml kemudian didiamkan selama 1 x 24 jam. Setelah itu, masing – masing ekstrak dimonitoring dengan KLT menggunakan eluen kloroform : metanol (9,8 : 0,2) untuk mengetahui pelarut yang terbaik. Setelah itu noda dideteksi dengan lampu UV, disemprot penampak noda 1,5% serium sulfat dalam H2SO4 2 N dan dipanaskan dalam oven.
Prosiding Kimia-FMIPA ITS
2.4 Isolasi dan Identifikasi 2.4.1Isolasi Senyawa 2.4.1.1 Maserasi
Sebanyak 3 kg serbuk halus kayu akar Garcinia mangostana dimaserasi dengan n-heksan selama 1 x 24 jam pada suhu kamar. Maserasi pertama digunakan tujuh liter n – heksana dan maserasi yang kedua ditambah enam liter n- heksana. Setelah itu, keseluruhan ekstrak n-heksana diuapkan pelarutnya dengan Rotary Evaporator sehingga diperoleh ekstrak padat n-heksana sebanyak 3,4565 gram. Keseluruhan ekstrak padat yang diperoleh dimonitoring KLT menggunakan eluen kloroform : metanol (9,8 : 0,2), noda dideteksi dengan lampu UV kemudian disemprot penampak noda 1,5% serium sulfat dalam H2SO4 2 N dan dipanaskan dalam oven.
2.4.1.2Fraksinasi Ekstrak n-heksana
Fraksi n-heksana (3,4565 g ) difraksinasi menggunakan kromatografi cair vakum menggunakan eluen n-heksana : diklorometana yang ditingkatkan kepolarannya. Pengelompokan fraksi dilakukan pada fraksi – fraksi yang memiliki kemiripan Rf dan pola noda pada KLT. Fraksi gabungan dari fraksinasi I menghasilkan 4 fraksi yaitu fraksi A, B, C dan D.
Fraksi gabungan tersebut dimonitoring KLT dengan menggunakan eluen kloroform : metanol (9,9 : 0,1), noda dideteksi dengan lampu UV kemudian disemprot menggunakan penampak noda 1,5 % serium sulfat dalam H2SO4 2 N dan dipanaskan
dalam oven.
2.4.2 Pemurnian Senyawa Hasil Isolasi 2.4.2.1 Rekristalisasi
Padatan kuning yang terdapat pada fraksi A dan D, dipisahkan dari pelarutnya dengan cara menyaring dengan penyaring vakum, kemudian direkristalisasi menggunakan campuran pelarut yang sama yaitu n-heksana : aseton dalam keadaan panas, didinginkan dalam lemari es selama 1 x 24 jam. Kristal yang diperoleh disaring dengan penyaring vakum, dicuci dengan campuran pelarut n – heksana : diklorometana dingin, kemudian dimonitoring KLT menggunakan eluen kloroform : methanol (9,9 : 0,1), diklorometana : etil asetat (9,5 : 0,5), dan diklorometana : n-heksana (8 : 2) untuk kristal A, sedangkan untuk kristal D menggunakan eluen diklorometana : etil asetat (9,5 : 0,5), kloroform : etil asetat (9 : 1), dan kloroform : metanol (9,9 : 0,1).
2.4.2.2 Uji Titik Leleh dan Kelarutan
Uji titik leleh sampel murni dilakukan dengan meletakkan padatan sampel murni pada apparatus kemudian diukur titik lelehnya.
Uji kelarutan sampel murni dilakukan dengan melarutkan padatan sampel dalam berbagai pelarut (n-heksana; diklorometana; kloroform; etil asetat; aseton dan metanol) dan diamati kelarutannya.
2.4.2 Penentuan Struktur
2.4.2.1 Spektrofotometri Ultra Violet
Analisa spektroskopi UV dilakukan dengan peralatan spectrometer UV. Sampel dilarutkan dalam methanol p.a dan dimasukkan dalam kuvet, sedangkan untuk larutan blanko digunakan methanol p.a yang dimasukkan dalam kuvet lain. Kedua kuvet diletakkan dalam tempat sampel ( sampel cell) dalam alat. Absorbansi sampel diukur pada panjang gelombang 200 – 600 nm. Kemudian larutan sampel ditambahkan NaOH sebagai reagen geser dan dilakukan prosedur pengukuran UV yang sama. Larutan sampel ditambahkan AlCl3 dan HCl untuk
melihat pergeseran puncaknya dan diukur panjang gelombangnya. Larutan sampel ditambah NaOAc dan H3BO3 untuk melihat pergeseran puncaknya dan
diukur panjang gelombangnya.
2.4.2.2 Spektrofotometri IR
Analisa spektroskopi infra merah dilakukan dengan menggunakan peralatan Spektrofotometer IR BUCK Scientific 500, sampel murni digerus dengan menggunakan KBr sampai homogen kemudian dipadatkan sehingga menjadi pellet dengan ketebalan
± 1 mm menggunakan alat pres tekanan. Kemudian pellet tersebut dimasukkan ke dalam alat spektrofotometer IR dan dianalisis pada bilangan gelombang 400 – 4000 cm-1.
2.4.2.3 Spektroskopi NMR
Padatan murni yang diperoleh diambil sebanak 7-10 mg dan dilarutkan dalam 0,5 ml pelarut bebas proton (aseton d6) yang dapat melarutkan dengan sempurna. Larutan sampel dimasukkan dalam tabung injection kemudian diletakkan dalam alat NMR Jeol JNM ECA 500 MHz untuk mengukur 1H-NMR, 13C-1H-NMR, DEPT 135, dan NMR 2D yaitu HMBC.
3 Hasil dan Pembahasan 3.1 Uji Pendahuluan
Kayu akar Garcinia mangostana tanpa kulit yang diperoleh dari Kabupaten Nganjuk, Jawa Timur, mula – mula dirajang hingga menjadi potongan – potongan kecil dan dikeringkan untuk menghilangkan kadar air dalam sampel tersebut. Sampel yang kering itu dihaluskan hingga menjadi
Prosiding Kimia-FMIPA ITS
serbuk untuk memperluas permukaan dari sampel, sehingga dihasilkan serbuk kering 3 kg. Kemudian dilakukan uji pendahuluan untuk mengetahui kandungan senyawa – senyawa metabolit sekunder yang terdapat dalam sampel. Kromatogram hasil uji KLT menunjukkan adanya sekumpulan noda yang berwarna kuning, yang mengindikasikan adanya senyawa fenolat. Metode KLT ini digunakan sebagai uji kualitatif, dikarenakan kemampuannya untuk mengetahui distribusi senyawa dengan mudah dan cepat, serta menghemat sampel sebab jumlah sampel yang dibutuhkan hanya sedikit.
3.2 Isolasi Senyawa
Serbuk kering kayu akar G.mangostana ini diekstraksi menggunakan metode maserasi pada suhu kamar. Pemilihan metode ini dikarenakan memiliki bebrapa kelebihan yaitu praktis, tidak melibatkan
pemanasan yang dapat menyebabkan
terdekomposisinya senyawa – senyawa target, dan cara penggunaannya mudah. Pelarut yang digunakan pada maserasi ini adalah n-heksana karena pelarut tersebut mampu mengekstrak kandungan senyawa target dan mudah untuk dipisahkan, yang dapat dilihat pada KLT uji pendahuluan.
Maserasi sampel dengan n-heksana dilakukan dalam waktu 2x24 jam. Ekstrak cair n-heksana yang diperoleh dari tiap maserasi dimonitoring KLT. Ekstrak cair yang diperoleh berwarna kuning bening diuapkan pelarutnya pada tekanan rendah menggunakan rotary evaporator sehingga diperoleh ekstrak padat berwarna kuning sebanyak 3,4565 gram. Proses penguapan pelarut menggunakan rotary evaporator karena prosesnya berjalan cepat, filtrate dapat diperoleh kembali dan tidak memerlukan suhu yang tinggi. Maserasi dihentikan setelah warna noda ekstrak n-heksana memudar. Hal ini menunjukkan bahwa senyawa – senyawa yang dapat diekstrak oleh pelarut n-heksana hamper teresktrak semua.
Fraksi n-heksana padat (3,4565 g) diambil, kemudian difraksinasi menggunakan kromatografi cair vakum untuk memisahkan senyawa – senyawa target ke dalam fraksi yang lebih sederhana. Metode ini dipilih karena memiliki keunggulan yaitu dapat memisahkan bahan sampel dalam jumlah yang cukup besar dalam waktu yang singkat
.
Eluen yang dipakai untuk kromatografi cair vakum adalah eluen n-heksana : diklorometana yang ditingkatkan kepolarannya dan hasil KCV dimonitoring KLT dengan eluen kloroform : metanol (9,8 : 0,2). Noda yang memiliki nilai Rf yang relative sama digabung dan diperoleh empat fraksi gabungan.
Fraksi gabungan A terbentuk padatan kristal jarum berwarna kuning di dasar vial sehingga dilakukan pemisahan dengan penyaringan vakum dan
diperoleh kristal sebanyak 0,2714 g. Fraksi gabungan B terbentuk padatan kristal yang mirip dengan fraksi gabungan A, tetapi masih terdapat pengotor sehingga perlu pemurnian lebih lanjut. Fraksi gabungan C terbentuk padatan kristal kuning, tetapi masih perlu pemisahan lebih lanjut karena masih terdapat dua noda yang masih belum terpisah. Fraksi gabuingan A dan B itu merupakan kelompok noda yang relative non polar. Sedangkan fraksi gabungan D terbentuk padatan kuning yang berbeda bentuknya dengan fraksi gabungan A yaitu berupa serbuk kuning sebanyak 0,1691 g dan fraksi ini merupakan kelompok noda yang relative polar dibandingkan fraksi gabungan A dan B, tetapi fraksi ini masih ada pengotornya, sehingga perlu dimurnikan lagi melalui proses rekristalisasi.
Fraksi A terlihat pada kromatogram, noda tunggal yang relative non polar, sehingga dapat disebut senyawa 1, sedangkan fraksi D menunjukkan noda tunggal yang relative polar dibandingkan dengan fraksi A, sehingga dapat disebut senyawa 2.
3.3 Pemurnian Senyawa
Pemurnian senyawa dapat dilakukan dengan beberapa cara, yaitu dengan rekristalisasi, uji tiga eluen yang berbeda kepolarannya, serta uji titik leleh senyawa tersebut.
3.3.1 Rekristalisasi
Padatan berwarna kuning yang terdapat pada fraksi A dan D direkristalisasi mengunakan pelarut yang sama yaitu n-heksana : aseton. Pemilihan pelarut tersebut didasarkan pada prinsip rekristalisasi yaitu sampel yang tidak larut dalam suatu pelarut pada suhu kamar tetapi dapat larut dalam pelarut pada suhu kamar. Jadi rekristalisasi meliputi tahap awal yaitu melarutkan senyawa yang akan dimurnikan dalam sedikit mungkin pelarut atau campuran pelarut dalam keadaaan panas atau bahkan sampai suhu pendidihan sehingga diperoleh larutan jernih dan tahapan selanjutnya yaitu mendinginkan larutan yang akan dapat menyebabkan terbentuknya kristal, lalu dipisahkan melalui penyaringan.
3.3.2 Uji Tiga Eluen yang Berbeda Kepolarannya
Kristal yang diperoleh dari rekristalisasi fraksi A dan D dimonitoring KLT dalam berbagai eluen yang berbeda kepolarannya dan data yang diperoleh menunjukkan bahwa kristal yang diperoleh telah murni. Eluen yang digunakan untuk fraksi A antara lain : diklorometana : etil asetat (9,5 : 0,5); kloroform : metanol (9,9 : 0,1) dan diklorometana : n-heksana (8 : 2). Sedangkan eluen yang digunakan untuk fraksi D antara lain : diklorometana : etil asetat (9,5 : 0,5); kloroform : etil asetat (9 : 1) dan kloroform : metanol (9,9 : 0,1)
Prosiding Kimia-FMIPA ITS
3.3.3 Uji Titik Leleh dan Kelarutan
Senyawa 1 dan 2 diuji titik lelehnya menggunakan alat pengukur titik leleh dan hasilnya menunjukkan nilai yang berbeda. Nilai titik leleh untuk senyawa 1 adalah 172 – 173 °C, sedangkan nilai titik leleh untuk senyawa 2 adalah 172 – 174 °C. Senyawa 1 dan 2 diuji kelarutannya dengan pelarut n-heksana, diklorometana, kloroform, etil asetat, aseton, dan metanol. Senyawa 1 larut baik dalam kloroform, etil asetat dan aseton, tidak larut dalam metanol, sedikit larut dalam n-heksana dan diklorometana. Sedangkan senyawa 2 larut dalam etil asetat, aseton, dan metanol, sedikit larut dalam n-heksana, diklorometana,dan kloroform.
3.4 Penentuan Struktur Hasil Isolasi Senyawa 1
Spektrum UV (Gambar 2) untuk senyawa 1 memperlihatkan serapan pada pita 1 dengan λmaks
315 nm yang menunjukkan adanya eksitasi elektron dari orbital n→π* yang menyatakan adanya sistem konjugasi dari suatu heteroatom dengan ikatan rangkap terkonjugasi (-C=C-C=O). Sedangkan serapan dengan λmaks 244 nm pada pita 2 yang
menunjukkan adanya eksitasi elektron dari orbital
π→π* yang merupakan gugus kromofor yang khas untuk sistem ikatan rangkap terkonjugasi (-C=C-C=C-) dari cincin aromatik. Sehingga dapat disarankan bahwa senyawa 1 memiliki sistem aromatik dan karbonil terkonjugasi (Nilar, et.al., 2005) yang khas untuk kerangka santon (Lannang, et.al., 2005; Kosela, et.al., 2006; Ito, et.al., 1997).
Selanjutnya penambahan basa (NaOH) sebagai pereaksi geser mengakibatkan pergeseran batokromik pada pita 1 dari serapan dengan λmaks 315
nm menjadi λmaks 356 nm yang menunjukkan adanya
gugus penarik elektron (-C=O) pada posisi para dengan gugus pendorong electron yang diakibatkan oleh keseimbangan keto enol yang khas untuk senyawa fenolat (Ito, et.al., 1997; Sen, et.al., 1982).
R O OH NaOH R O O -R O O - Na+
+
OH2 Gambar 1. Keseimbangan keto – enol dengan NaOHPenambahan pereaksi geser AlCl3
mengakibatkan pergeseran batokromik dari λmaks 315
nm menjadi 480 nm yang menunjukkan adanya gugus hidroksi pada posisi orto dengan karbonil (Nedialkov, 2002), sedangkan dengan penambahan HCl tidak terjadi pergeseran lagi yang menunjukkan bahwa senyawa ini tidak memiliki gugus hidroksi pada posisi orto.
R O O O O Al2+ Al+ R O OH OH OH AlCl3 R O OH OH O Al2+ HCl
Gambar 3. Keseimbangan keto – enol dengan AlCl3
dan HCl.
Gambar 4. Spektrum UV pada MeOH + (AlCl3 dan
HCl)
Spektrum IR (Gambar 5) senyawa 1 hasil isolasi memperlihatkan serapan – serapan yang khas untuk beberapa gugus fungsi, diantaranya adalah pada bilangan gelombang (νmaks) 3402 cm-1
menunjukkan adanya gugus hidroksil bebas,sedangkan serapan pada bilangan gelombang (νmaks) 2997 cm
-1
, 2962 cm-1, 2931 cm-1, 2858 cm-1 menunjukkan adanya gugus C-H alifatik. Serapan dengan bilangan gelombang (νmaks) 1647 cm-1
menunjukkan adanya satu karbonil yang terkhelat oleh gugus hidroksi, sedangkan serapan pada
Keterangan : MeOH MeOH + NaOH nm MeOH + AlCl3 MeOH + AlCl3 + HCl Abs nm
Gambar 2. Spektrum UV pada MeOH, MeOH + NaOH
Prosiding Kimia-FMIPA ITS
bilangan gelombang (νmaks) 1600 cm-1 dan 1573 cm-1
menunjukkan kekhasan –C=C- aril sp2 pada sistem aromatik dan serapan pada bilangan gelombang (νmaks) 1284 cm-1 menunjukkan adanya satu gugus
–C – O eter.
Gambar 5. Spektrum IR dalam pellet KBR Penentuan struktur senyawa 1 dilanjutkan dengan menggunakan data spektrum 1H-NMR seperti yang terlihat pada Tabel 3.1, yang menunjukkan adanya beberapa kelompok sinyal yang terdiri dari minimal 28 proton, dimana terdapat sinyal pada daerah downfield dengan pergeseran kimia 13,61(ppm) (1H, s) yang khas untuk proton dari gugus hidroksil terkhelat dengan gugus karbonil. Pergeseran kimia 3,80(ppm) dan 3,95(ppm) (masing – masing 3H, s) yang merupakan ciri khas dari gugus metoksi, ada dua sinyal singlet pada δH(ppm) 6,47
dan 6,83 (masing – masing 1H, s) yang menunjukkan adanya dua proton aromatik, terdapat juga dua gugus prenil yang jelas nyata dengan adanya dua vinil pada
δH(ppm) 5,28 dan 5,22 (1H, m). Selain itu, ada dua
gugus metilen pada δH(ppm) 4,12 (2H, d, J = 6,5)
dan 3,31 (2H, d, J = 7,15) dan ada empat proton metil olefinik pada δH(ppm) 1,63; 1,65; 1,77; 1,82 (masing
– masing 3H, s).
Berdasarkan data UV, IR dan 1H-NMR dapat diketahui bahwa senyawa 1 merupakan turunan dari santon dimetoksi dan diprenilasi yang strukturnya memiliki kesamaan dengan senyawa β -mangostin (22) (Ryu, et.al., 2010).
Tabel 3.1 Data 1H-NMR, 13C-NMR, DEPT, dan HMBC Senyawa 1 dalam Aseton d6 No. karbon Senyawa 1 δH δC DEPT HMBC 1 - 160,6 C 2 - 111,8 C 3 - 164,6 C 4 6,47 (s) 89,9 CH 3, 4a, C-9a, C-9 4a - 156,3 C 5 6,83 (s) 102,7 CH C-7,C-8a,C-9 6 - 157,6 C 7 - 144,6 C 8 - 138,2 C 8a - 112,2 C 9 - 182,9 C 9a - 104,2 C 10 - - - 10a - 156,2 C 11 3,31(d,J=7 ,15 Hz) 21,9 CH3 C-1, C-2, C-3, C-12, C-13, C-15 12 5,22 (t) 123,4 CH C-14 13 - 131,5 C 14 1,77 (s) 25,9 CH3 C-12,C-13, 15 1,82 (s) 25,9 CH3 16 4,12(d, J=6,5Hz) 26,9 CH2 C-8, C-8a, C-7, C-17, C-18 17 5,28 (t) 124,7 CH C-19 18 - 131,5 C 19 1,63 (s) 17,9 CH3 C-20,C-17,C-18 20 1,65 (s) 18,3 CH2 1-OH 13.61 (s) C-1, C-2, C-9a, C-8a 3-OMe 3,95 (s) 61,4 O-CH3 C-3 7-OMe 3,80 (s) 56,5 O-CH3 C-7
Kemudian data tersebut diperkuat lagi dengan spektrum 13C-NMR dimana, senyawa 1 memiliki minimal 24 atom karbon dimana menghasilkan spectrum pada δC(ppm) 182,9; 164,6;
160,6; 157,5; 156,3; 156,2; 144,6; 138,2; 131,5; 124,7; 123,4; 112,2; 111,8; 104,2; 102,7; 89,9; 61,4; 56,5; 26,9; 25,9; 25,9; 21,9; 18,4 dan17,9.
Berdasarkan data spektrum DEPT 135 yang dapat dilihat pada Tabel 3.1, memperlihatkan adanya 12 atom karbon, yaitu empat gugus metin (C-H) pada pergeseran kimia δC(ppm) 124,7; 123,4;
102,8; dan 89,9. Ada dua gugus metilen (CH2) pada
pergeseran kimia δC(ppm) 26,9 dan 21,9, yang
menunjukkan bahwa senyawa 1 ini terbukti memiliki dua gugus prenil atau merupakan senyawa santon diprenilasi. Ada enam gugus metil (CH3) pada
pergeseran kimia δC(ppm) 61,4; 56,5; 25,9; 25,9;
18,4 dan 17,9, dua diantaranya adalah gugus metoksi (O-CH3) pergeseran kimia δC 61,4; 56,5 sehingga
senyawa 1 ini terbukti merupakan senyawa santon dimetoksi. Sedangkan 12 atom karbon yang tidak muncul di spektrum DEPT 135, menunjukkan bahwa s atom karbon tersebut merupakan atom C kuartener. Kemudian dari data 13C-NMR pada senyawa 1 dibandingkan dengan data dari literatur (Tabel 3.2)
%T OH C-H C=O C=C C-O 1/cm
Prosiding Kimia-FMIPA ITS
yang menunjukkan bahwa senyawa 1 memiliki kesamaan struktur dengan senyawa β-mangostin (22).
Tabel 3.2 Data Perbandingan 1H-NMR dan 13C-NMR Senyawa 1 dengan Senyawa 22
dalam Aseton d6 No. karbon Senyawa 22 Senyawa 1 δH δC δH δC 1 - 160,2 - 160,5 2 - 111,9 - 111,8 3 - 163,9 - 164,6 4 6,39 (s) 89,2 6,47 (s) 89,9 4a - 156,1 - 157,5 5 6,86 (s) 101,8 6,83 (s) 102,7 6 - 154,8 - 156,3 7 - 143,0 - 144,6 8 - 137,5 - 138,2 8a 112,8 - 112,2 9 - 182,3 - 182,9 9a - 104,3 - 104,2 10 - - - - 10a - 155,7 - 156,2 11 3,37(d,J=6,0Hz) 21,8 3,31(d, J=7,15Hz) 25,9 12 5,29 (m) 122,7 5,28 (t) 123,4 13 - 132,5 - 131,5 14 1,69 (s) 26,2 1,65(s) 25,9 15 1,69 (s) 26,2 1,63(s) 18,3 16 4,13 (d, J=6,6 Hz) 27,0 4,12 (d, J= 6,5 Hz) 21,9 17 5,29 (m) 123,6 5,22 (t) 124,7 18 - 132,1 - 131,5 19 1,85 (s) 18,6 1,82(s) 17,9 20 1,83 (s) 18,2 1,77(s) 26,9 1-OH 13,44(s) 13.61(s) 3-OMe 3,93 (s) 62,5 3,95 (s) 61,4 7-OMe 3,83 (s) 56,2 3,80 (s) 56,5
Penentuan struktur yang terakhir menggunakan spektrum NMR 2D – HMBC untuk semakin memperkuat posisi atom karbon, karena dapat menjelaskan korelasi jarak jauh antara proton dengan karbon seperti yang ditunjukkan pada Tabel 3.1. Korelasi gugus metilen ditunjukkan pada
δH(ppm) 3,31 dengan δC(ppm) 111,8 (C-2), 131,5
(C-13), 160,5 (C-1), 164,6 (C-3) dan 123,4 (C-12) sehingga gugus prenil berada pada posisi C-2. Pergeseran kimia dari gugus metilen 4,12 (ppm) dengan δC(ppm) 112,2 (C-8a), 124,7 (C-17), 144,6
(C-7), 138,2 (C-8) dan 131,5 (C-18). Sedangkan gugus metoksi pada pergeseran kimia 3,80 ppm berkorelasi dengan δC (ppm) 144,6 yang berada pada
posisi C-7 dan satu gugus metoksi yang lain menunjukkan pergeseran kimia 3,95ppm berkorelasi dengan δC(ppm) 164,6 yang berada pada posisi C-3.
Gugus hidroksil yang terkhelat dengan karbonil menunjukkan pergeseran kimia 13,61 ppm berkorelasi dengan δC (ppm)104,2 9a), 111,8
(C-2), 160,5 (C-1) dan 112,2 (C-8a). Gugus metil pada pergeseran kimia 1,77 (ppm) dan 1,82 (ppm) berkorelasi yang sama dengan δC (ppm) 123,4
(C-12), 131,5 (C-13) dan 26,9 (C-14). Korelasi jarak
jauh antara proton dengan karbon dapat diamati pada Gambar 6. O H H H H H MeO OH O O H OMe H H 1 2 3 5 6 7 4 8 9 11 10a 4a 16 O O H OH H MeO O H OMe
Gambar 6. Korelasi jauh antara proton dan karbon : (a) posisi prenil pada C-2 dan C-8, (b) posisi metoksi pada C-3 dan C-7, posisi proton aromatic pada C-4 dan C-5, serta posisi OH khelat pada C-1
Berdasarkan analisis data di atas menunjukkan struktur senyawa 1 memiliki kesamaan struktur dengan senyawa 22. Dengan demikian struktur senyawa 1 adalah β-mangostin.
3.5 Penentuan Struktur Hasil Isolasi Senyawa 2
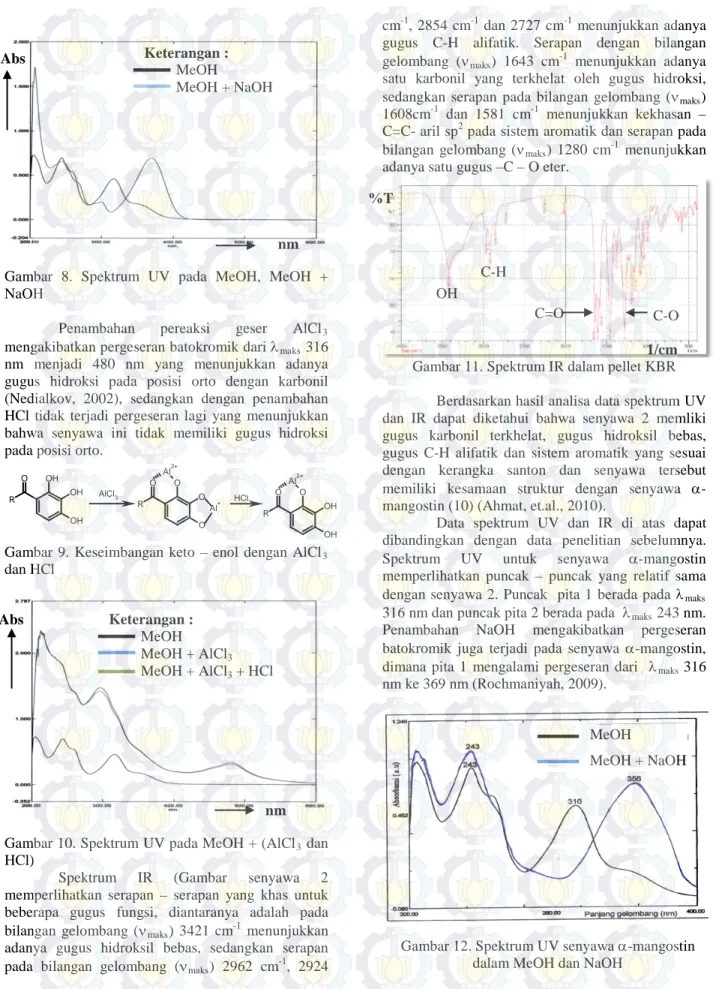
Spektrum UV (Gambar 8) untuk senyawa 2 memperlihatkan serapan pada pita 1 dengan λmaks
316 nm yang menunjukkan adanya eksitasi elektron dari orbital n→π* yang menyatakan adanya sistem konjugasi dari suatu heteroatom dengan ikatan rangkap terkonjugasi (-C=C-C=O). Sedangkan serapan dengan λmaks 243 nm pada pita 2 yang
menunjukkan adanya eksitasi elektron dari orbital
π→π* yang merupakan gugus kromofor yang khas untuk sistem ikatan rangkap terkonjugasi (-C=C-C=C-) dari cincin aromatik. Sehingga dapat disarankan bahwa senyawa 1 memiliki sistem aromatik dan karbonil terkonjugasi (Nilar, et.al., 2005) yang khas untuk kerangka santon (Lannang, et.al., 2005; Kosela, et.al., 2006; Ito, et.al., 1997).
Selanjutnya penambahan basa (NaOH) sebagai pereaksi geser mengakibatkan pergeseran batokromik pada pita 1 dari serapan dengan λmaks 316
nm menjadi λmaks 369 nm yang menunjukkan adanya
gugus penarik elektron (-C=O) pada posisi para dengan gugus pendorong electron yang diakibatkan oleh keseimbangan keto enol yang khas untuk senyawa fenolat (Ito, et.al., 1997; Sen, et.al., 1982).
R O OH NaOH R O O -R O O - Na+
+
OH2(a)
(b)
O O H OH H MeO O H OMe(1)
Prosiding Kimia-FMIPA ITS
Gambar 8. Spektrum UV pada MeOH, MeOH + NaOH
Penambahan pereaksi geser AlCl3
mengakibatkan pergeseran batokromik dari λmaks 316
nm menjadi 480 nm yang menunjukkan adanya gugus hidroksi pada posisi orto dengan karbonil (Nedialkov, 2002), sedangkan dengan penambahan HCl tidak terjadi pergeseran lagi yang menunjukkan bahwa senyawa ini tidak memiliki gugus hidroksi pada posisi orto.
R O O O O Al2+ Al+ R O OH OH OH AlCl3 R O OH OH O Al2+ HCl
Gambar 9. Keseimbangan keto – enol dengan AlCl3
dan HCl
Gambar 10. Spektrum UV pada MeOH + (AlCl3 dan
HCl)
Spektrum IR (Gambar senyawa 2
memperlihatkan serapan – serapan yang khas untuk beberapa gugus fungsi, diantaranya adalah pada bilangan gelombang (νmaks) 3421 cm-1 menunjukkan
adanya gugus hidroksil bebas, sedangkan serapan pada bilangan gelombang (νmaks) 2962 cm-1, 2924
cm-1, 2854 cm-1 dan 2727 cm-1 menunjukkan adanya gugus C-H alifatik. Serapan dengan bilangan gelombang (νmaks) 1643 cm-1 menunjukkan adanya
satu karbonil yang terkhelat oleh gugus hidroksi, sedangkan serapan pada bilangan gelombang (νmaks)
1608cm-1 dan 1581 cm-1 menunjukkan kekhasan – C=C- aril sp2 pada sistem aromatik dan serapan pada bilangan gelombang (νmaks) 1280 cm-1 menunjukkan
adanya satu gugus –C – O eter.
Gambar 11. Spektrum IR dalam pellet KBR Berdasarkan hasil analisa data spektrum UV dan IR dapat diketahui bahwa senyawa 2 memliki gugus karbonil terkhelat, gugus hidroksil bebas, gugus C-H alifatik dan sistem aromatik yang sesuai dengan kerangka santon dan senyawa tersebut memiliki kesamaan struktur dengan senyawa α -mangostin (10) (Ahmat, et.al., 2010).
Data spektrum UV dan IR di atas dapat dibandingkan dengan data penelitian sebelumnya. Spektrum UV untuk senyawa α-mangostin memperlihatkan puncak – puncak yang relatif sama dengan senyawa 2. Puncak pita 1 berada pada λmaks
316 nm dan puncak pita 2 berada pada λmaks 243 nm.
Penambahan NaOH mengakibatkan pergeseran batokromik juga terjadi pada senyawa α-mangostin, dimana pita 1 mengalami pergeseran dari λmaks 316
nm ke 369 nm (Rochmaniyah, 2009). Keterangan : MeOH MeOH + NaOH Abs nm Abs nm %T 1/cm Keterangan : MeOH MeOH + AlCl3 MeOH + AlCl3 + HCl OH C-H C=O C-O MeOH MeOH + NaOH
Gambar 12. Spektrum UV senyawa α-mangostin dalam MeOH dan NaOH
Prosiding Kimia-FMIPA ITS
Spektrum IR (Gambar 4.21) senyawa α -mangostin (10) memperlihatkan serapan – serapan yang relatif sama dengan senyawa 2 yaitu 3421 cm-1, 1643 cm-1, 2916 cm-1, 1608 cm-1 (Rochmaniyah, 2009).
Gambar 13. Spektrum IR senyawa α-mangostin Perbandingan spektrum UV dan IR kedua senyawa yang relatif sama tersebut membenarkan hipotesis bahwa senyawa 2 adalah α-mangostin, yaitu senyawa yang memiliki gugus hidroksi bebas yang berada pada posisi para dengan gugus pendorong electron, gugus hidroksi yang terkhelat dengan karbonil, gugus –C-H alifatik dan sistem cincin aromatik dengan struktur berikut :
O O OH O H H H MeO OH
Kedua senyawa tersebut yaitu α dan β -mangostin ternyata memiliki perbedaan dengan senyawa yang ditemukan dari fraksi etil asetat pada kulit buah manggis. Senyawa α-mangostin merupakan komponen utama yang terdapat pada spesies Garcinia mangostana secara kualitasnya sama, tetapi secara kuantitasnya berbeda karena adanya pengaruh ekosistem tumbuhan tersebut (Venkataraman, 1972).
4. Kesimpulan
Berdasarkan penelitian yang telah dilakukan terhadap kayu akar Garcinia mangostana, Linn asal Nganjuk dihasilkan dua senyawa mangostin dari ekstrak n-heksana yaitu β-mangostin (1) dan α -mangotin (2). Senyawa β-mangostin berupa kristal jarum berwarna kuning sebanyak 0,2714 gram dengan titik leleh 170 – 173 °C, sedangkan senyawa
α-mangostin berupa padatan kuning sebanyak 0.0458
gram dengan titik leleh 172 – 174 °C, Penentuan struktur kedua senyawa tersebut dilakukan dengan menggunakan data spektroskopi UV, IR, 1 H-NMR, 13C-NMR, DEPT 135, HMBC dan dilakukan perbandingan data senyawa yang sama dengan yang telah dilaporkan oleh peneliti sebelumnya.
5. Saran
Penelitian ini masih berpotensi untuk dilakukan penelitian lebih lanjut karena masih banyak fraksi – fraksi lain yang belum diperlakukan, sehingga dapat berpeluang untuk mendapatkan senyawa mangostin atau senyawa turunan fenolat lainnya dan diuji sebagai bioaktifitasnya.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada :
1. Allah SWT yang Maha Pengasih lagi Maha Penyayang yang selalu memberikan ilmu, rahmat dan kasih sayang-Nya,
2. Orang tua dan keluarga tercinta atas segala doa dan dukungannya,
3. Bapak Prof. Dr. Taslim Ersam selaku dosen pembimbing yang telah berkenan memberikan bimbingan, arahan, pemahaman dan segala diskusi serta semua ilmu yang bermanfaat selama penyusunan tugas akhir,
4. Semua sahabatku angkatan 2007 atas segala doa, bantuan, semangat dan kerjasamanya.
DAFTAR PUSTAKA
Ahmat, N., Azmin, N.F.N., Ab Ghani, N., Aris, S.R.S., (2010), Bioactive Xanthones from the Pericarp of Garcinia mangostana, Middle-East Journal of Scientific Research 6 (2), Malaysia, 123-127
Chaverri JP, Rodriguez NC, Ibarra MO, and Rojas JMP, (2008), Medicinal Properties of Mangosteen (Garcinia Mangostana), Food and Chemical Toxicology, 46, 3227-3239, Elsevier
Ersam, T. (2001), Senyawa Kimia Mikromolekul beberapa Tumbuhan Artocarpus Hutan Tropika Sumatera Barat, Disertasi, PPs. ITB, Bandung
Hay, A.E., Merza, J., Landreeau, A., Litaudon, M., Pagniez, F., Le Pape, P., Richomme, P., (2004), Antileismanial polyphenols from Garcinia vieillardii, Pitoterapia., 79, 42-46 Ito, C., Miyamoto, Y., Nakayama, M., Kawai, Y.,
(1997), A Novel Depsidone and Some New Xanthones from Gacinia Species, Chem. Pharm. Bull., 45 (9), 1403–1413
Kosela, S., Hanafi, M., Kardono,L.B.S., Sherley, G., Harrison, L.J., (2006), Bioactive Constituens of Garcinia porrecta and G. parvivolia Grown
Prosiding Kimia-FMIPA ITS
in Indonesia, Biological Sciences, 9, (3) 483-486
Lanang, A.M., Komguen, J., Nginzeko, F.N., Tangmouo, J.G., Lontsi, D., Ajaz, A.,Choudary, M.I., Ranjit, R., Devkota, K.P., Sondengam, B.L., (2005), Bangasantone A dan B, Two Xanthones from The Stembark of Garcinia polyantha Oliv., Phytochemistry. 66, 2351-2355
Manitto, P.,(1992), Biosintesis Produk Alami, Penerjemah Koensoenardiyah, IKIP
Nedialkov, P.T., Kitanov, G.M., (2002), Two Benzophenone O-Arabinosides and A Chromone from Hypericum annulatum, Phytochemistry, 59, 867-887
Nilar, Nguyen, L.D., Venkataraman, G., Sim, K., Harrison, L.J., (2005), Xanthones and Benzophenones from Garcinia griffithii and Garcinia mangostana, Phytochemistry, 66, 1718-1723
Peres, V., Nagem, T.J., de Olivera, F.F., (1997), Tryoxygenated Naturally Occuring Xanthones, Phytochemistry, 44, No.2, 191 Rukachaisirikul, V., Ritthiwigrom, T., Pinsa, A.,
Sawangchote, P., Taylor, W.C., (2003), Xanthones from the stem bark of Garcinia nigrolineata, Phytochemistry, 64, 1149-1156 Rochmaniyah, N., (2009), Aktivitas Antioksidan
Senyawa β-mangostin dari Kulit Batang Garcinia mangostana L, Skripsi, ITS, Surabaya
Ryu, H.W., Marcus, J., Long, C., Jung, S., Jin, Y.M., Cho, J.K., Ryu, Y.B., Lee, W.S., Park, K.H., (2010), Xanthones with Neuraminidase Inhibitor Activity from the Seedcases of Garcinia mangostana, Bioorganic & Medicinal Chemistry 18, 6258-6264
Saxena, S. Pant,N., Jain, D.C, Bhakuin, R.S, (2003), Antimalarial Agents from plant sources, Current science Vol 85, Hal 1314-1329 Sen, A.K., Saukar, K.K., Majumdu, P.C., Banerji, N.,
(1982), Garcinon D, A New Xanthone from Garcinia mangostana, Linn, Indian Journal of Chemistry, 25B, 1157-1158
Sumaryono, W., (1999), Produksi Metabolit Sekunder Tanaman Secara Bioteknologi, Prosiding Seminar Nasional Kimia Bahan Alam ’99, Penerbit UI, Jakarta Tetrahedron 27, 1625-1634
Venkataraman, K., (1972), Wood Phenolic in The Chemotaxonomy of The Moraceae, Phytochemistry, Vol. 11, page 1571-1586 Waterman, P.G., Elizabeth, (1980), Xanthones and
Biflavonoids from Garcinia densivenia Stem Bark, Phytochemistry, 19, 2723-2726