ANALISIS JARINGAN TANAMAN LINDUR
(Bruguiera gymnorrhiza) DAN PEMANFAATAN PATINYA
SEBAGAI EDIBLE FILM DENGAN PENAMBAHAN
GLISEROL DAN KARAGENAN
SILUH PUTU SRI DIA UTARI C3480013
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
RINGKASAN
SILUH PUTU SRI DIA UTARI. C34080013. Analisis jaringan tanaman lindur (Bruguiera gymnorrhiza) dan pemanfaatan patinya sebagai edible film dengan penambahan gliserol dan karagenan. Dibimbing oleh AGOES MARDIONO JACOEB dan RONI NUGRAHA.
Edible film merupakan salah satu kemasan yang ramah lingkungan dan
aman bagi kesehatan yang telah berkembang dewasa ini. Salah satu sumber hayati yang dapat dikaji sebagai bahan baku edible film adalah buah lindur (Bruguiera
gymnorrhiza), buah ini adalah salah satu jenis buah dari tumbuhan mangrove yang
keberadaannya cukup banyak ditemui di Indonesia. Kandungan karbohidrat buah lindur relatif tinggi sehingga berpotensi untuk dimanfaatkan menjadi edible film berbasis pati.
Penelitian ini bertujuan untuk mempelajari karakteristik jaringan tanaman lindur B. gymnorrhiza, memanfaatkan pati buah lindur sebagai edible film, dan mempelajari karakteristik edible film yang dihasilkan. Penelitian ini terdiri dari dua tahap yaitu penelitian awal dan penelitian lanjutan. Penelitian awal bertujuan untuk mengetahui kandungan proksimat, karakteristik histologi tanaman lindur, dan karakteristik tepung pati buah lindur yang dihasilkan. Penelitian lanjutan bertujuan untuk mendapatkan edible film dan mengatahui karakteristik edible film yang dihasilkan. Penggunaan konsentrasi tepung pati buah lindur adalah 4%, gliserol 1% dan 1,5%, dan konsentrasi karagenan 2%, 2,5% dan 3%. Pengujian karakteristik edible film yang dihasilkan meliputi pengujian ketebalan, kuat tarik (tensile strength), persen pemanjangan (elongation), dan laju transmisi uap air (WVTR).
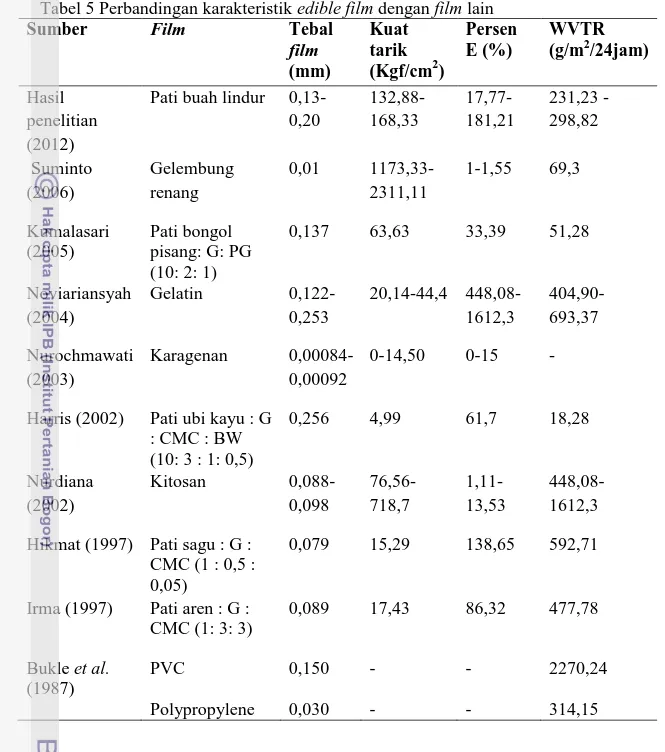
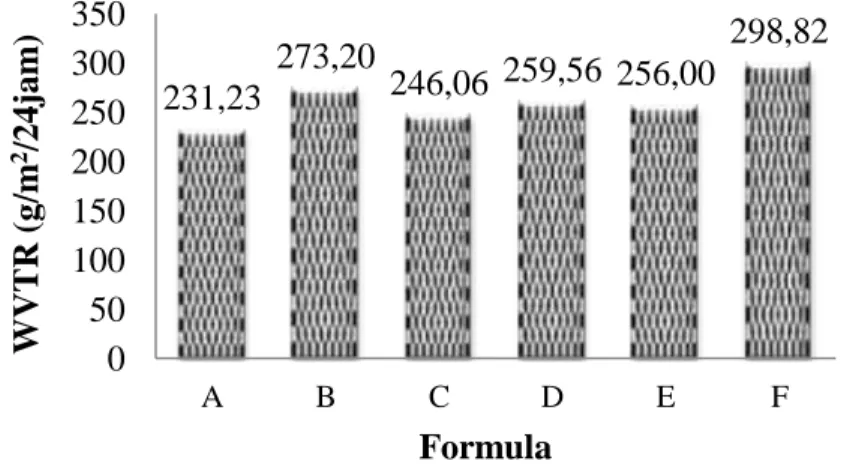
Hasil penelitian menunjukan bahwa granula pati banyak terdapat pada korteks buah dan batang muda tanaman lindur. Bentuk granula pati buah lindur adalah lonjong dan melebar pada bagian atas, dengan panjang dan lebar granula antara 11,21-28,9μm. Tepung pati buah lindur yang dihasilkan memiliki derajat putih sebesar 37,73 %. Adapun nilai ketebalan edible film yang dihasilkan dari keenam formula berkisar 0,13-0,20 mm dengan nilai kuat tarik berkisar 132,88-168,33 kgf/cm2. Nilai persen pemanjangan yang dihasilkan dari keenam edible film yang dihasilkan berkisar 181,21-17,77% dan nilai laju transmisi uap air hasil penelitian berkisar 231,23-298,82 g/m2/24 jam.
ANALISIS JARINGAN TANAMAN LINDUR
(Bruguiera gymnorrhiza) DAN PEMANFAATAN PATINYA
SEBAGAI EDIBLE FILM DENGAN PENAMBAHAN
GLISEROL DAN KARAGENAN
SILUH PUTU SRI DIA UTARI C3480013
Skripsi
sebagai salah satu syarat untuk mendapatkan gelar sarjana pada Departemen Teknologi Hasil Perairan
Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul : Analisis Jaringan Tanaman Lindur (Bruguiera
gymnorrhiza) dan Pemanfaatan Patinya sebagai Edible
Film dengan Penambahan Gliserol dan Karagenan
Nama : Siluh Putu Sri Dia Utari
NRP : C34080013
Program Studi : Teknologi Hasil Perairan
Menyetujui
Pembimbing I Pembimbing II
Dr. Ir. Agoes Mardiono Jacoeb, Dipl.-Biol NIP. 19591127 198601 1 005
Roni Nugraha, S.Si, M.Sc NIP. 19830421 200912 1 003
Mengetahui
Ketua Depertemen Teknologi Hasil Perairan
Dr.Ir. Ruddy Suwandi, MS., M.Phill. NIP.19580511 198503 1 002
DAFTAR RIWAYAT HIDUP
Siluh Putu Sri Dia Utari lahir di Tabanan, Bali tanggal 15 Januari 1990. Penulis merupakan anak pertama dari tiga bersaudara pasangan Bapak I Gede Putra Widiarsa dan Ibu Ni Nyoman Parwati. Pada masa kecil penulis menyelesaikan pendidikan Taman Kanak-kanak di TK Rama Bawa Kerambitan serta pendidikan Sekolah Dasar di SD 2 Kukuh Kelod.
Penulis melanjutkan pendidikan Sekolah Menengah Pertama di SMPN 1 Kerambitan, Tabanan, Bali. Penulis menyelesaikan Pendidikan Menengah Atas di SMAN 2 Tabanan pada tahun 2008. Pada tahun yang sama diterima di kampus IPB sebagai mahasiswi melalui jalur USMI. Penulis sekarang tercatat sebagai mahasiswi Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Selama berada di IPB penulis aktif di berbagai organisasi antara lain KMHD (Kesatuan Mahasiswa Hindu Dharma) pada tahun 2008 hingga sekarang, Brahmacarya Bogor pada tahun 2008 hingga sekarang, HIMASILKAN (Himpunan Mahasiswa Hasil Perikanan) sebagai anggota Divisi Kewirausahaan pada 2010-2011, FPC (Fish Processing Club) pada tahun 2011 hingga sekarang. Selain itu penulis pernah menjadi asisten luar biasa mata kuliah Ikhtiologi pada tahun 2010-2011 dan asisten luar biasa mata kuliah Avertebrata Perairan 2011- 2012. Penulis melaksanakan kegiatan praktek lapangan di PT Bali Maya Permai Jembrana, Bali pada tahun 2011. Aktif dalam mengikuti kegiatan PKM 2012 yang didanai oleh DIKTI.
Penulis melakukan penelitian dengan judul Analisis Jaringan Tanaman Lindur (Bruguiera Gymnorrhiza) Dan Pemanfaatan Patinya Sebagai Edible Film Dengan Penambahan Gliserol Dan Karagenan sebagai salah satu syarat untuk mendapatkan gelar sarjana di Departemen Teknologi Hasil Perairan, Fakultas Perikanan Dan Ilmu Kelautan, Institut Pertanian Bogor, dibawah bimbingan Dr.Ir. Agoes Mardiono Jacoeb, Dipl.-Biol dan Roni Nugraha, S.Si, M.Sc
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi dengan judul “Analisis jaringan tanaman lindur (Bruguiera gymnorrhiza) dan pemanfaatan patinya sebagai edible film dengan penambahan gliserol dan karagenan” adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang telah diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, September 2012
Siluh Putu Sri Dia Utari C3480013
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Ida Sang Hyang Widhi Wasa, karena berkat wara nugraha-NYA penulis dapat menyelesaikan skripsi sabagai tugas akhir yang Berjudul Analisis Jaringan Tanaman Lindur (Bruguiera
Gymnorrhiza) Dan Pemanfaatan Patinya Sebagai Edible Film Dengan
Penambahan Gliserol Dan Karagenan dengan baik.
Penulis menyadari bahwa banyak dukungan dari berbagai pihak dalam penyelesaian skripsi ini. Oleh karena itu, pada kesempatan ini penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam penyelesaian skripsi ini, diantaranya :
1) Bapak Dr. Ir. Agoes Mardiono Jacoeb, Dipl.-Biol dan Roni Nugraha, S.Si, M.Sc selaku dosen pembimbing yang telah memberikan bimbingan dan pengarahan kepada penulis.
2) Dr. Pipih Suptijah, MBA selaku dosen penguji atas arahan dan perbaikan yang teah diberikan.
3) Dr.Ir. Ruddy Suwandi, MS., M.Phill. selaku Ketua Departemen Teknologi Hasil Perairan yang telah memberikan nasihat, kritik dan saran dalam penulisan skripsi.
4) Bapak Dr. Ir. Agoes Mardiono Jacoeb, Dipl.-Biol selaku Ketua Program Studi Departemen Teknologi Hasil Perairan atas bimbingan kepada penulis.
5) Seluruh dosen, pegawai dan staf tata usaha Departemen Teknologi Hasil Parairan atas bantuannya selama ini.
6) Ibu Rubiyah di Laboratorium Rekayasa Pengolahan Pangan, Ibu Ati dan Bapak Lubis di Balai Kemasan dan Mutu DISPERINDAG, Bapak Atin di Laboratorium Kimia Kayu, Bapak Wahyu di Laboratorium Histologi, FKH, Bapak Sudrajad di Ekowisata Mangrove, Ibu Emma dan Mba Dini di Laboratorium Mikrobiologi, Mas Zakcy di Laboratorium Preservasi dan Pengolahan Hasil Parairan atas arahan, bantuan dan kerjasamanya selama penulis melakukan penelitian.
7) Bapak dan Ibu tersayang yang selalu memberikan doa, semangat cinta kasih dan dukungan kepada penulis baik moril maupun materil. Lode dan Dehan, adik-adik tersayang yang telah memberikan semangat dan doanya.
8) Arya Dharmawan atas motivasi, perhatian, pengertian dan dukungannya yang diberikan.
9) Teman seperjuangan ”Tim Lindur” : Niswani Seknun, Selviyani, Helmy,
Zahida, dan Hardi dan terimakasih atas kebersamaannya.
10) Sahabat – sahabat seperjuangan Hana, Dibar, Kurnia, Fitriyani-ase, Dwi, Andi, Steven, Esa, Emen, Aninta, Aulia, Lidia, Mpit, Wina atas semangat, bantuan, dan canda tawa selama ini.
11) Tim Edible Film : Ryan, Mawaddah, Gia ginanjar (THP 47) dan Annisa
Shylina (THP 47) atas kekompakkan dan perjuangan PKM 2012.
12) Teman – teman “Kontrakan Grhya Sandat” : Putri, Debby, Sindra, Keswari, dan Lunas atas kebersamaan, canda tawa dan suka duka yang dilalui bersama dan telah memberikan kenangan tersendiri selama ini.
13) Teman-teman THP 47, 46, dan 45 yang telah membantu dan memberikan semangat kepada penulis.
Penulis menyadari bahwa penulisan tugas akhir ini masih belum sempurna. Oleh karena itu penulis mengharapkan masukan berupa kritik dan saran yang bersifat membangun dari pembaca. Semoga tulisan ini dapat bermanfaat bagi semua pihak yang memerlukannya.
Bogor, September 2012
DAFTAR ISI
Halaman
DAFTAR ISI ... v
DAFTAR TABEL. ... vii
DAFTAR GAMBAR. ... viii
DAFTAR LAMPIRAN ... ix
1 PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
2 TINJAUAN PUSTAKA ... 3
2.1 Buah Lindur (Bruguiera gymnorrhiza) ... 3
2.2 Pati ... 4
2.3 Edible Film ... 5
2.4 Plasticizer. ... 7
2.5 Karagenan. ... 8
2.6 Pemeriksaan Histologi Tumbuhan. ... 9
2.7 Persiapan Preparat Dengan Metode Parafin. ... 10
2.7.1 Fiksasi. ... 10
2.7.2 Dehidrasi (dehydration). ... 11
2.7.3 Penjernihan, infiltasi, penanaman ... 11
2.7.4 Penyayatan (sectioning) dan penempelan sayatan... 11
2.7.5 Pewarnaan (staining). ... 12
3 METODOLOGI ... 13
3.1 Waktu dan Tempat ... 13
3.2 Bahan dan Alat Penelitian ... 13
3.3 Penelitian Awal ... 14
3.3.1 Analisis proksimat buah lindur segar. ... 14
3.3.2 Analisis histologi buah lindur segar. ... 14
3.3.3 Pembuatan tepung pati buah lindur. ... 14
3.3.4 Analisa karakteristik tepung pati buah lindur. ... 15
3.4. Penelitian Lanjutan... 16
3.4.1 Pembuatan edible film ... 16
3.4.2 Karakteristik edible film. ... 18
a. Ketebalan edible film (ASTM 1989).. ... 18
b. Kuat tarik dan persen pemanjangan (ASTM 1989).. ... 18
4 HASIL DAN PEMBAHASAN. ... 20
4.1 Penelitian awal. ... 20
4.1.1 Morfologi tumbuhan tindur. ... 20
4.1.2 Anatomi daun. ... 21
4.1.3 Anatomi batang... 23
4.1.4 Anatomi buah. ... 24
4.2 Komposisi Kimia Buah Lindur Segar. ... 26
4.2.1 Kadar air (AOAC 2007) ... 26
4.2.2 Kadar abu (AOAC 2007) ... 27
4.2.3 Kadar lemak (AOAC 2007) ... 27
4.2.4 Kadar Protein (AOAC 2007). ... 27
4.2.5 Kadar Karbohidrat (AOAC 2007). ... 28
4.3 Karakteristik Tepung Pati Buah Lindur... 28
4.4 Penelitian Lanjutan. ... 33
4.4.1 Ketebalan. ... 34
4.4.2 Kuat tarik (Tensile Strenght). ... 36
4.4.3 Persen elongasi (persen pemanjangan). ... 38
4.4.4 WVTR / Water Transmissoin Rate. ... 39
5 KESIMPULAN. ... 42
5.1 Kesimpulan. ... 42
5.2 Saran. ... 42
DAFTAR PUSTAKA ... 43
DAFTAR TABEL
Nomor Halaman
1 Komposisi kimia buah lindur segar... 26
2 Komposisi kimia tepung pati buah lindur. ... 28
3 Komposisi fisik tepung pati buah lindur. ... 30
4 Perbandingan kadar pati buah lindur dengan dengan pati lainnya. ... 33
5 Perbandingan karakteristik edible film dengan film lain. ... 36
6 Data hasil pengukuran karakteristik edible film. ... 59
DAFTAR GAMBAR
Nomor Halaman
1 Buah Lindur (Bruguiera gymnorrhiza). ... 3
2 Ekstrak pati buah lindur Bruguiera gymnorrhiza. ... 15
3 Diagram alir proses pembuatan edible film. ... 17
4 Morfologi tumbuhan lindur (Bruguiera gymnorrhiza). ... 20
5 Daun, bunga dan buah lindur. ... 21
6 Penampang melintang daun tumbuhan lindur. ... 22
7 Stomata pada bagian atas daun tumbuhan lindur. ... 23
8 Penampang melintang batang tumbuhan lindur. ... 24
9 Penampang melintang buah lindur. ... 24
10 Berkas pembuluh pada buah lindur. ... 25
11 Perbesaran granula tepung pati buah lindur 100 kali dan 200 kali. ... 30
12 Beberapa jenis granula pati lainnya. ... 31
13 Perubahan warna buah lindur saat dikupas dan setelah dikupas. ... 32
14 Reaksi pencoklatan secara enzimatis. ... 32
15 Histogram ketebalan... 34
16 Histogram Kuat tarik. ... 37
17 Histogram persen pemanjangan. ... 38
18 Histogram laju transmisi uap air. ... 40
19 Edible film yang dihasilkan sesuai formulasi. ... 40
DAFTAR LAMPIRAN
Nomor Halaman
1 Alat – alat pembuatan dan pengukuran edible film. ... 48
2 Analisis proksimat buah lindur segar. ... 50
3 Analisis histologi jaringan buah lindur segar. ... 53
4 Analisa karakteristik tepung pati buah lindur. ... 56
5 Data uji karakterstik edible film. ... 59
6 Contoh perhitungan. ... 61
1 PENDAHULUAN
1.1 Latar Belakang
Perkembangan era globalisasi dan semakin bertambahnya jumlah penduduk di dunia menyebabkan kebutuhan pangan meningkat. Masyarakat dunia semakin memahami akan pentingnya kualitas pangan, yaitu dengan meningkatnya kesadaran penggunaan kemasan yang mudah terdegradasi dan aman bagi kesehatan. Penggunaan kemasan sintetis yang umum digunakan selama ini menimbulkan masalah baru bagi kesehatan dan lingkungan hidup, oleh karena itu diperlukan suatu teknologi kemasan yang aman dan tidak merusak lingkungan, salah satunya dengan penggunaan edible film (Donhowe dan Fannema 1994).
Edible film adalah lapisan tipis yang terbuat dari bahan yang dapat dimakan,
digunakan sebagai pelapis permukaan komponen makanan atau diletakkan antara komponen makanan yang berfungsi untuk menghambat migrasi kelembaban, oksigen, karbon dioksida, aroma, lipid; sebagai carrier bahan makanan dan aditif; untuk meningkatkan penanganan makanan (Krochta dan Johnston 1997). Edible film dapat dibuat dari tiga komponen penyusun dasar yaitu, hidrokoloid (misal protein, polisakarida, alginat), lipid ( misal asam lemak, acil gliserol, wax atau lilin) dan komposit (campuran hidrokoloid dan lipid) (Donhowe dan Fannema 1994). Pati sering digunakan dalam industri pangan sebagai biodegradable film untuk menggantikan polimer plastik karena ekonomis, dapat diperbaharui, dan memberikan karakteristik fisik yang baik. Pati yang termasuk ke dalam polisakarida dapat digunakan sebagai bahan baku pembuatan edible film (Bourtoom 2007).
Hasil penelitian Institut Pertanian Bogor bekerja sama dengan badan BIMAS Ketahanan Pangan Nusa Tenggara Timur, menyatakan bahwa kandungan karbohidrat buah lindur 85,1 gram per 100 gram, lebih tinggi dari kandungan karbohidrat beras 78,9 gram per 100 gram dan jagung 63,3 per 100 gram (Fortuna 2005). Buah lindur (Bruguiera gymnorrhiza) adalah salah satu jenis buah dari tumbuhan mangrove yang keberadaannya cukup banyak ditemui di Indonesia. Penyebaran buah lindur yaitu di daerah tropis Afrika Selatan dan Timur, Madagaskar, Asia Tenggara dan Selatan (termasuk Indonesia dan negara di
kawasan Malaysia), sampai timur laut Australia, Mikronesia, Polinesia dan kepulauan Ryukyu (Duke et al. 2006). Hal tersebut yang mendasari penelitian ini, untuk memanfaatkan buah lindur sebagai bahan baku edible film yang dapat digunakan sebagai kemasan makanan.
1.2 Tujuan
Penelitian ini bertujuan untuk mempelajari karakteristik jaringan tanaman lindur B. gymnorrhiza, memanfaatkan pati buah lindur sebagai edible film, dan mempelajari karakteristik edible film yang dihasilkan.
2 TINJAUAN PUSTAKA
2.1 Buah Lindur (Bruguiera gymnorrhiza)
Buah lindur (B. gymnorrhiza), yang dikenal dengan berbagai nama lokal tumu, tanjang, putut, tongke, dan kandeka merupakan salah satu buah dari tumbuhan mangrove berdaun besar. Ketinggian tumbuhan lindur dapat mencapai 30 m. Pohon lindur memiliki akar papan dan akar lutut, melebar ke samping di bagian pangkal pohon. Kulit kayu memiliki lentisel, permukaannya halus hingga kasar, berwarna abu-abu tua sampai cokelat. Daun berbentuk elips dengan ujung meruncing, berwarna hijau pada lapisan atas dan hijau kekuningan pada bagian bawahnya dengan bercak-bercak hitam (Glen 2005). Bentuk dan warna buah lindur segar dapat dilihat pada Gambar 1. Menurut Duke et al (2006) klasifikasi buah lindur adalah sebagai berikut :
Kingdom Divisi Kelas Ordo Family Genus Species : : : : : : : Plantae Magnoliophyta Magnoliopsida Myrtales Rhizophoraceae Bruguiera Bruguiera gymnorrhiza
Gambar 1 Buah Lindur.
Buah lindur berwarna hijau dengan kelopak bunga di ujung buah yang berwarna merah, hipokotil buah berbentuk silinder memanjang 12-30 cm dengan diameter 1,5-2 cm. B. gymnorrhiza tersebar di daerah tropis Afrika Selatan dan
Timur dan Madagaskar, ke Asia Tenggara dan Selatan (termasuk Indonesia dan negara di kawasan Malaysia), sampai timur laut Australia, Mikronesia, Polinesia and kepulauan Ryukyu (Duke et al. 2006). Tanaman lindur mampu membantu menstabilkan tanah, melindungi pantai, dan sebagai habitat aneka fauna. Kayunya dapat digunakan sebagai kayu bakar dan untuk membuat arang. Pepagan (kulit batang) dimanfaatkan sebagai bahan penyamak kulit dan pengawet jala ikan yang baik karena mengandung tanin rata-rata antara 28,5–32,2% (Glen 2005). Selain itu penduduk Solomon memanfaatkan papagan untuk menyembuhkan luka bakar. Di pulau-pulau kecil Indonesia digunakan untuk mengobati diare dan demam, sementara di Kamboja dimanfaatkan sebagai anti malaria (Duke et al. 2006). Penduduk di pulau-pulau terpencil memanfatkan daun mudanya sebagai lalap atau sayuran. Bagian dalam hipokotil buah lindur dapat dimakan (manisan kandeka), dicampur dengan gula. Penduduk Indonesia bagian timur memanfaatkan buah lindur sebagai sumber pangan saat musim paceklik tiba (Glen 2005).
2.2 Pati
Pati merupakan homopolimer glukosa dengan ikatan α-glikosidik. Pati terdapat pada tumbuhan tingkat tinggi sebagai granula semi kristalin dari bahan polimer. Dalam bentuk aslinya tepung pati merupakan butir-butir kecil yang disebut granula pati. Granula pati mempunyai bentuk dan ukuran yang berbeda-beda tergantung dari jenis patinya (Swinkle 1985). Granula pati tersusun atas tiga komponen utama yaitu amilosa, amilopektin dan bahan antara yang merupakan komponen minor berupa lemak dan protein.
Pati terdiri dari dua fraksi yang dapat dipisahkan dengan air panas di bawah suhu gelatinisasi. Fraksi terlarut disebut amilosa dan fraksi tidak terlarut disebut amilopektin. Amilosa mempunyai struktur lurus dengan ikatan (1,4)-D-glukosa sedangkan amilopektin terdiri dari struktur bercabang dengan ikatan α-(1,6)-D-glukosa sebanyak 4-5% berat total (Winarno 2008). Konsentrasi amilosa berpengaruh terhadap karakteristik gel yang terbentuk. Gel yang mengandung banyak amilosa mempunyai karakteristik mekanik film yang dihasilkan lebih baik dibandingkan dengan gel yang kaya akan amilopektin (Leloup et al. 1991).
Pati dapat diekstrak dengan berbagai cara, berdasarkan bahan baku dan penggunaan dari pati itu sendiri. Pati dapat diproses dengan cara ekstraksi yang terdiri perendaman, disintegrasi, dan sentrifugasi. Perendaman dilakukan dalam larutan natrium bisulfit pada pH yang diatur untuk menghambat reaksi biokimia misal perubahan warna. Disintegrasi dan sentrifugasi dilakukan untuk memisahkan pati dari komponen lainnya (Cui 2005).
2.3 Edible Film
Edible Film adalah suatu lapisan tipis dan kontinu, terbuat dari bahan-bahan yang dapat dimakan, dibentuk di atas komponen makanan (coating) atau diletakkan antara komponen makanan (film) yang berfungsi sebagai penghalang terhadap transfer massa (misalnya, kelembaban, oksigen, lipid dan zat terlarut) (Hui, 2006). Fungsi edible film adalah sebagai penghambat perpindahan uap air, menghambat pertukaran gas, mencegah kehilangan aroma, mencegah perpindahan lemak, meningkatkan karakteristik fisik, dan sebagai pembawa zat aditif. Bahan – bahan yang biasa digunakan dalam pembentukan edible film adalah protein, polisakarida, lemak, waxes dan turunannya (Canes et al. 1998). Komponen utama penyusun edible film dapat digolongkan kedalam tiga kategori, yaitu hidrokoloid, lipid, dan komposit (gabungan hidrokoloid dan lipid). Hidrokoloid dapat berupa protein, turunan selulosa, alginat, pektin, pati dan polisakarida lain. Lipid yang umum digunakan antara lain lilin (waxes), gliserol, dan asam lemak. Edible film dengan komponen campuran komposit dapat berupa film emulsi lipid hidrokoloid atau beberapa bilayer film dengan satu muka film hidrofilik dan muka lain yang hidrofobik (Donhowe dan Fennema 1994).
Ruan et al. (1998) menyatakan bahwa film dari bahan dasar lipid mempunyai laju transmisi uap air dan kekuatan mekanik yang rendah, sedangkan protein dan karbohidrat bersifat kuat tapi laju transmisi uap airnya tinggi. Komposit film yang merupakan gabungan dari protein dan lipid atau gabungan dari karbohidrat dan lipid, mempunyai laju transmisi yang lebih rendah dibandingkan film dengan bahan dasar protein dan karbohidrat, tapi memiliki kekuatan mekanik yang lebih kuat dibandingkan dengaan film yang berbahan dasar lipid. Iwata et al. (2000) menyatakan protein sebagai komponen penyusun 5
edible film memiliki banyak kelebihan diantaranya protein mengandung asam-asam amino yang dibutuhkan tubuh, dan edible film yang dihasilkan dari bahan dasar protein dapat digunakan untuk mengurangi kehilangan kelembaban, membatasi absorpsi O2, dan mengurangi perpindahan lemak.
Menurut Gennadios (1990) keuntungan-keuntungan yang dapat diperoleh dari penggunaan edible film dibandingkan dengan penggunaan pengemas tradisional non-edible adalah:
(1) edible film dapat langsung dikonsumsi bersama produk yang dikemas sehingga
tidak ada sampah kemasan;
(2) jika edible film tidak dapat dikonsumsi, maka film masih dapat didegradasi oleh bakteri sehingga mengurangi polusi lingkungan;
(3) edible film dapat meningkatkan sifat-sifat organoleptik produk pangan karena
didalamnya dapat ditambahkan flavor, pewarna, dan pemanis;
(8) edible film cocok digunakan untuk mikroenkapsulasi flavor pangan dan
leaving agent;
(9) edible film dapat dipakai bersama-sama non-edible sebagai lapisan dalam
untuk mencegah migrasi komponen kimia berbahaya ke dalam makanan. Pada umumnya edible film yang terbuat dari polisakarida (hidrokoloid) mempunyai sifat penghambatan terhadap gas yang lebih baik daripada terhadap uap air (Baldwin et al. 1995). Edible film yang larut dalam air memiliki penghalang lebih buruk dibandingkan dengan edible film yang larut dalam pelarut selain air. Hal ini terjadi karena uap air tidak dapat larut dengan cepat pada edible
film yang larut dalam pelarut selain air. Menurut Krochta et al. (1994),
permeabilitas dipengaruhi oleh sifat kimia bahan, struktur polimer, kondisi uji, dan sifat dari bahan yang akan berdifusi. Untuk memperbaiki sifat tersebut biasanya polisakarida dikombinasikan dengan beberapa pangan fungsional yaitu resin, platicizer, surfaktan, minyak, lilin dan emulsifier yang memiliki fungsi memberikan permukaan yang halus dan mencegah kehilangan uap air (Krochta et al.1994).
Kemampuan edible film dalam melindungi pangan dapat ditingkatkan dengan penambahan zat antioksidan dan antimikroba pada film.Edible film dapat menambah flavor, nutrisi (carrier), dan lain-lain pada produk pangan yang 6
dikemas untuk meningkatkan kualitas pangan. Selain itu dengan penggunaan
edible film dapat memberikan penampakan produk yang dikemas menjadi halus,
berwarna, tidak berminyak, tidak lengket dan tidak terjadi pemudaran warna pada permukaan produk (Kroctha 2002).
Menurut Donhowe dan Fannema (1994), beberapa metode dalam pembuatan edible film/coating adalah:
(1) Dipping
Metode ini merupakan aplikasi dari coating. Produk yang akan di-coating dicelupkan ke dalam larutan yang akan digunakan sebagai bahan coating. Metode ini sudah digunakan, diantaranya sebagai pengemas/pelapis pada produk daging, sayur, dan buah-buahan.
(2) Spraying
Metode ini menggunakan larutan bahan yang akan di-coating dengan cara disemprotkan, kemudian dikeringkan sehingga lapisan dapat menempel pada produk dengan baik.
(3) Casting
Casting atau penuangan, merupakan metode yang digunakan dalam
pembuatan edible film. Metode ini diawali dengan pembuatan larutan bahan pembentuk film, kemudian dituangkan dalam cetakan dengan ketebalan tertentu, yang kemudian dilanjutkan dengan pengeringan. Setelah kering film diangkat dari cetakan dan siap untuk diaplikasikan. Dengan metode ini ketebalan film dapat dikontrol sehingga dihasilkan film dengan ketebalan yang lebih rata.
2.4 Plasticizer
Plasticizer adalah bahan organik dengan bobot molekul rendah yang
ditambahkan dengan maksud memperlemah kekakuan film (Gennadios 2002).
Plasticizer memiliki titik didih yang tinggi dan jika ditambahkan ke dalam suatu
materi dapat mengubah sifat fisik maupun sifat mekanik materi tersebut. Penggunaan plasticizer dapat mengurangi gaya intermolekul sepanjang rantai polimer, sehingga meningkatkan fleksibilitas edible film tetapi mengakibatkan turunnya permeabilitas film tersebut. Bahan ini larut dalam tiap-tiap rantai polimer 7
sehingga akan mempermudah gerakan molekul polimer dan bekerja menurunkan suhu transisi gelas, suhu kristalisasi, atau suhu pelelehan dari suatu polimer (Sperling 1992). Kester dan Fannema (1989) menyatakan bahwa plasticizer dapat ditambahkan pada pembuatan edible coating, untuk mengurangi kerapuhan, meningkatkan fleksibilitas, dan ketahanan film terutama jika disimpan pada suhu rendah.
Jenis plasticizer yang biasanya ditambahkan antara lain; gliserin, gliserol, trietil glikol, asam lemak, dan monogliserin yang diasetilisasi. Salah satu plasticizer yang digunakan dalam penelitian ini adalah gliserol. Plasticizer ini merupakan senyawa alkohol polianhidrat dengan tiga gugus hidroksil dalam satu molekul (alkohol trivalen). Rumus kimia gliserol adalah C3H8O3 dengan nama kimia 1,2,3-propanatriol. Berat molekul gliserol adalah 92,10 dan titik didih sebesar 204 °C (Winarno 2008). Gliserol efektif digunakan sebagai plasticizer pada hidrofilik film. Penambahan gliserol akan mengahasilkan film yang lebih fleksibel dan halus. Menurut Gontard et al.(1993) gliserol dapat meningkatkan permeabilitas film terhadap uap air karena sifat gliserol yang hidrofilik. Gliserol mempunyai sifat mudah larut dalam air, meningkatkan kekentalan larutan, mengikat air dan menurunkan aw (Lindsay 1985). Selain itu gliserol juga bersifat humektan dan bagian dari aksi plasticizing yang berasal dari kemampuannya untuk menahan air pada film tersebut (Kristanoko 2000).
2.5 Karagenan
Karegenan merupakan senyawa hidrokoloid yang terdiri atas ester, kalium, magnesium, natrium, dan kalsium sulfat dengan galaktosa 3,6 anhidrogalaktosa kopolimer dengan ikatan glikosidik α-1,3 dan β-1,4 (Angka dan Suhartono 2000). Karagenan dibuat dari rumput laut yang dikeringkan, rumput laut diayak untuk menghilangkan kotoran-kotoran seperti pasir dan kemudian dicuci. Sumber karagenan yang umum dijumpai adalah Kappaphycus cottonii, Eucheuma
spinosum, Gigartina sp. Melalui perlakuan dengan larutan basa selulosa dalam
karagenan akan terpisah (Angka dan Suhartono 2000). Larutan karagenan yang didapat dipekatkan melalui evaporasi, kemudian dikeringkan dan dipisahkan lagi menurut spesifikasinya. Penggunaan karagenan dalam jumlah yang lebih besar 8
menyebabkan kemampuan mengikat air yang lebih baik sehingga memberikan matrik gel yang dapat meningkatkan sifat mekanik dari pengemas. Menurut Carriedo (1994), gel yang dihasilkan dari karagenan dapat digunakan dalam pelapisan makanan. Dalam bidang industri karaginan berfungsi sebagai stabilisator , thickener (bahan pengental), pembentuk gel dan lai-lain. Karagenan dapat diperoleh dari hasil pengendapan rumput laut yang dihancurkan dengan alkohol, pengeringan dengan alat (drum dryer) dan dengan proses pembekuan.
Beberapa sifat yang berperan penting dalam karagenan antara lain; kelarutan, stabilitas pH, pembentukan gel, dan viskositas. Karagenan larut dalam air, kelarutannya dipengaruhi oleh beberapa faktor, yaitu tipe karagenan, pengaruh ion, suhu, komponen organik larutan, dan pH. Semua karagenan larut dalam air panas terutama pada suhu >70 °C. Dalam air dingin hanya lamda-karagenan, garam sodium dari kappa-karagenan, dan iota-karagenan yang dapat larut (Gliksman 1983).
2.6 Pemeriksaan Histologi Tumbuhan
Jaringan merupakan sekelompok sel yang mempunyai asal, struktur, dan fungsi yang sama (Nugroho et al. 2006). Ilmu yang mempelajari struktur internal tanaman disebut histologi tanaman. Histologi tumbuhan umumnya dikaji melalui teknik mikroskopis. Kajian objektif untuk mengidentifikasi histologi pada tanaman diukur dalam gambaran mikroskopis. Morfologi sel digambarkan dengan ukuran sel dan bentuk dan dengan ketebalan dinding sel (Guillemin et al. 2004).
Metode umum untuk mempelajari jaringan diantaranya metode beku, metode seloidin, metode parafin, metode pananaman rangkap. Metode parafin banyak digunakan karena hampir semua matriks jaringan dapat dipotong baik bila menggunakan metode ini. Kelebihan metode parafin diantaranya irisan dapat jauh lebih tipis dibandingkan dengan menggunakan metode beku atau metode seloidin. Irisan-irisan yang bersifat seri dapat dikerjakan dengan mudah bila menggunakan metode ini dan prosesnya jauh lebih cepat dibandingkan dengan metode seloidin (Suntoro 1983).
Metode pembuatan preparat terlebih dahulu dilakukan sebelum mempelajari hitologi tanaman. Metode pembuatan preparat dapat dibagi menjadi 9
tiga macam yaitu preparat segar, preparat utuh (whole mount) dan preparat yang dilakukan dengan proses penanaman (embedding). Pembuatan preparat segar dilakukan dengan pembuatan sayatan tipis melintang dan diletakkan pada gelas objek kemudian diwarnai. Pembuatan preparat utuh merupakan metode pembuatan preparat sampel secara utuh biasanya untuk tanaman dengan ukuran kecil. Tahapan untuk preparat ini terdiri atas fiksasi bertahap, penggunaan silol berseri, pewarnaan, inkubasi, dehidrasi dan perekatan ke gelas preparat kemudian dilakukan penutupan. Proses pembuatan preparat embedding terdiri atas gelatin
embedding, parafin embedding, nitrocellulose embedding, double embedding, dan
embedding pada plastik (Keirnan 1990, diacu dalam Kristiono 2009).
2.7 Persiapan Preparat Dengan Metode Parafin
Hal yang penting dalam persiapan jaringan adalah meningkatkan kemampuan pewarnaan dari bagian-bagian jaringan dan mengubah indeks bias ke arah jarak penglihatan (Humason 1967). Tahapan dalam persiapan preparat adalah fiksasi, dehidrasi, penjernihan, infiltasi, penanaman, penyayatan, penempelan sayatan, dan pewarnaan.
2.7.1 Fiksasi
Adapun tujuan tahap ini adalah untuk mencegah efek post-mortem pada jaringan, memisahkan fase solid protoplasma dari fase yang mengandung air, mengubah bagian sel menjadi material yang tidak larut selama perlakuan selanjutnya dan melindungi sel dari penyimpangan dan penyusutan. Larutan fiksasi disebut fiksatif. Fiksatif yang digunakan adalah fiksatif Geomori, Susu, Zenker, Helly, Bouin, Formalin, Carnoy dan sebagainya (Humason 1967). Waktu yang dibutuhkan untuk mematikan jaringan dan pengerasan material sangat beragam dan hal tersebut ditentukan oleh karakteristik cairan fiksatif yang digunakan. Salah satu jenis fiksatif yang banyak digunakan adalah (Formalin, Alkohol, Asam asetat glasial) FAA. Formula FAA adalah campuran yang terdiri dari Alkohol (95%) sebanyak 55 cc, Asam asetat glasial sebanyak 5 cc, Formaldehid (37 - 40%) sebanyak 10 cc, dan air sebanyak 35 cc (Sass 1951).
2.7.2 Dehidrasi (dehydration)
Jaringan yang telah difiksasi akan mempertahankan kandungan air yang tinggi, suatu kondisi yang menjadi penghambat untuk proses selanjutnya, sehingga jaringan perlu didehidrasi. Cairan dalam jaringan dapat menyebabkan jaringan lunak, berisi lumen atau celah cekung dan mudah rusak oleh penyayatan. Penghilangan air dari jaringan biasanya dicapai dalam suatu rangkaian larutan alkohol dengan persentase yang meningkat secara bertahap, yakni 30%, 50%, 70%, 80% dan 95% dan alkohol absolut yang bertujuan untuk mengurangi penyusutan pada jaringan. Jika tahap dehidrasi tidak dilakukan dalam suatu rangkaian, maka dapat dilakukan dengan langkah 30% dan 80% alkohol, dan penggantian tetap 50%. Waktu yang dibutuhkan untuk setiap tahap bergantung pada ukuran objek yakni ½ jam hingga 2 jam, 3 jam untuk kasus yang ekstrim. Penggantian kedua dari alkohol absolut harus dapat menghilangkan air dengan sempurana (Humason 1967). Sampel yang difiksasi dengan (Formalin, Alkohol, Asam asetat glasial) FAA mulai didehidrasi dalam alkohol 50% (Sass 1951). Dehidrasi dengan Tertiary Butyl Alkohol (TBA) merupakan metode yang lebih memuaskan. Setiap tingkatan dari dehidrasi TBA membutuhkan waktu minimal 1 jam. Rangkain tersebut kemudian diikuti dengan 100% TBA murni yang dilakukan sebanyak 3 kali (Johansen 1940).
2.7.3 Penjernihan (clearing), infiltasi, penanaman (embedding) dengan metode parafin
Hidrokarbon benzene, toluene dan xylene merupakan reagen, umumnya digunakan untuk tujuan penjernihan. Jika selama penjernihan, zat penjernih (benzene, toluene dan xylene) menjadi keruh menunjukkan bahwa air masih ada dalam jaringan dan jaringan tidak terdehidrasi dengan sempurna. Hal ini dapat dilakukan pengulangan ke dalam alkohol absolut. Penjernihan menghilangkan atau menjernihkan jaringan yang tidak tembus cahaya menjadi transparan (Humason 1967).
2.7.4 Penyayatan (sectioning) dan penempelan sayatan
Material siap disayat apabila parafin telah membeku. Blok jaringan dipotong dengan pisau tajam. Panjang blok kurang dari 2 cm dan dimensi blok 11
dibedakan dengan bentuk seperti empat persegi panjang. Blok parafin ditanamkan di atas blok kayu. Faktor yang mempengaruhi penyayatan adalah kualitas parafin, infiltrasi yang tepat, orientasi penempelan material, kekakuan penempelan, suhu, kekerasan atau kerapuhan material. Pemotongan dilakukan dengan menggunakan mikrotom ( Sass 1951).
2.7.5 Pewarnaan (staining)
Sebelum sayatan dapat diwarnai parafin harus dihilangkan dengan menggunakan xilol. Slide ditempatkan pada rak dan dimasukkan dalam wadah xilol selama 5 menit, xilol hendaknya dapat menutupi slide. Slide kemudian dipindahkan dalam campuran etanol absolut dan xilol dengan jumlah yang sama. Pemindahan selanjutnya dilakukan ke dalam campuran alkohol absolut dan eter selama 5-10 menit. Slide lalu diangin-anginkan hingga sayatan menunjukan tanda keputih-putihan. Slide kemudian dimasukkan dalam serangkaian alkohol, dimulai dengan 95%, 70%, 35% masing-masing 5 menit (Johansen 1940).
Toluidine blue merupakan salah satu zat warna yang tergolong dalam
golongan pewarna kationik yang bersifat basa. Sel mast akan teramati cukup jelas pada pewarnaan toluidine blue dibandingkan dengan pewarnaan lainnya misal
alcian blue dan alcian blue-safranin (Agung dan Kazutaka 2011). Zat pewarna ini
dapat bereaksi spesifik untuk komponen-komponen penyusun sel tumbuhan.
Toluidine blue biasanya digunakan untuk mengidentifikasi sel mast dan pengujian
kandungan lignin. Selain itu juga digunakan untuk mengidentifikasi makromolekul karbohidrat. Penggunaan pewarna ini biasanya untuk pewarnaan bagian jaringan semi tipis yang berukuran 0,5 sampai 1pM. Pewarnaan toluidine blue dilarutkan ke dalam buffer McIlvaine pada pH 4,0. Setelah diwarnai preparat dicuci dengan air mengalir lalu dikeringkan. Setelah selesai dilakukan pewarnaan kemudian slide ditetesi dengan Canada Balsam dan ditutup dengan cover slip. Canada Balsam digunakan untuk merekatkan objek dengan slide dan cover glass agar objek tidak berpindah-pindah. Preparat kemudian siap untuk diamati dengan mikroskop (Agung dan Kazutaka 2011).
3 METODOLOGI PENELITIAN
3.1 Lokasi dan Waktu
Penelitian dilaksanakan pada bulan November 2011 hingga Juni 2012 yang bertempat di Laboratorium Karakteristik Bahan Baku dan Pengolahan Hasil Perikanan, Laboratorium Biokimia Hasil Perikanan, Laboratorium Mikrobiologi Hasil Perikanan, Preservasi dan Pengolahan Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor; Laboratorium Kimia Pangan, Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian IPB; International Join Research
Laboratory Pusat Antar Universitas IPB dan Laboratorium Kemasan Balai
Pengujian Mutu Barang Ekspor dan Impor Departemen Perindustrian dan Perdagangan, Jakarta.
3.2 Bahan dan Alat
Bahan baku utama yang digunakan dalam penelitian ini adalah beberapa buah lindur (Bruguiera gymnorrhiza) yang diperoleh dari Pulau Kay, Kota Tual, Kabupaten Maluku Tenggara. Bahan lain yang digunakan adalah natrium bisulfit (Na2S2O3) sebagai campuran pada perendaman dan aquades. Bahan tambahan yang digunakan untuk pembuatan edible film adalah tepung pati buah lindur, gliserol, kappa-karagenan komersil, aquades. Bahan yang digunakan untuk pengujian karakteristik fisik edible film adalah silika gel dan vaselin. Bahan – bahan yang digunakan untuk pewarnaan preparat adalah parafin, xylol, toluidine blue, etanol, larutan seri Johansen, FAA.
Alat yang digunakan untuk ekstraksi pati adalah blender, timbangan digital, corong plastik, kain blacu, nilon 150 mesh. Alat yang digunakan untuk pembuatan edible film adalah beaker glass, gelas ukur, magnetic stirrer, hot plate
stirer MAG- Mixer type MH-61, termometer, timer, plat kaca, oven dan alat-alat
untuk analisi karaketristik fisik dari edible film (Lampiran1) yaitu: tensile strength
and elongation tester (Stograph-Mi Toyoseiki), moisture cup Moisture Pervios
digunakan untuk pemeriksaan jaringan adalah mikrotom, cover glass, dan mikroskop cahaya (Olympus BH-2).
3.3 Penelitian Awal
Penelitian awal meliputi tahapan berupa analisis proksimat, analisis histologi tanaman lindur, dan pembuatan tepung pati dari buah lindur (B.
gymnorrhiza). Pengujian karakteristik tepung pati buah lindur meliputi pengujian
kadar air, pati, amilosa, amilopektin.
3.3.1 Analisis proksimat buah lindur segar
Analisis proksimat buah lindur segar meliputi pengujian kadar air, kadar abu, kadar protein, lemak dan karbohidrat. Metode analisis dari masing-masing pengujian tersebut dapat dilihat pada pada Lampiran 2.
3.3.2 Analisis jaringan daun, batang, dan buah lindur segar
Analisis jaringan menggunakan metode pembenaman dalam parafin, pewarnaan dengan larutan toluidine blue dan pemeriksaan dengan menggunakan mikroskop brightfield Olympus BH-2. Pengambilan gambar dilakukan dengan kamera Olympus VG-120. Langkah kerja dari masing-masing tahapan tersebut dapat dilihat pada lampiran 3.
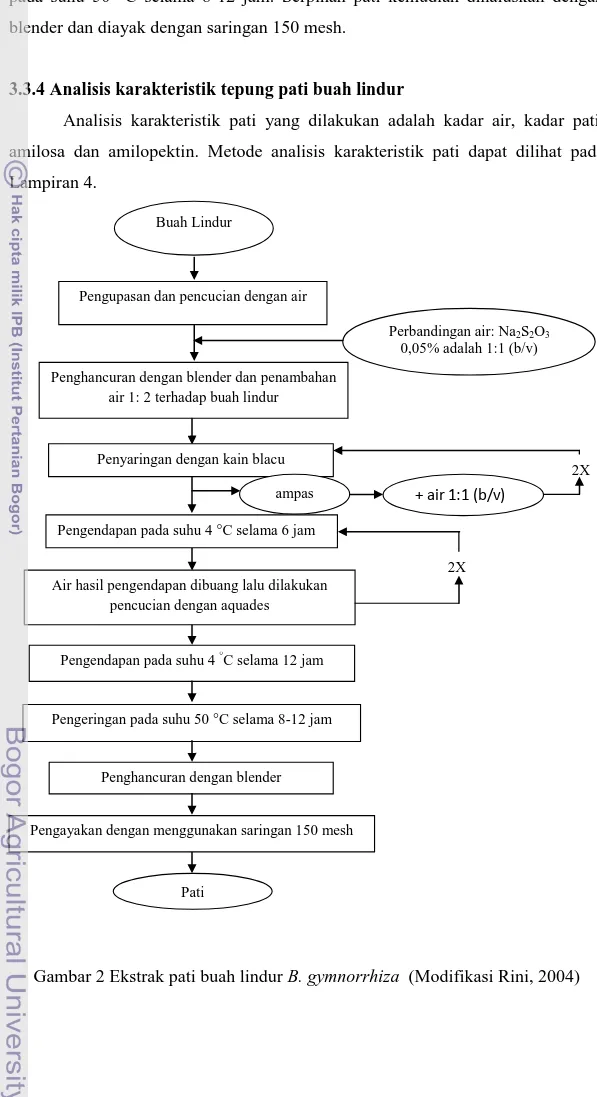
3.3.3 Pembuatan tepung pati buah lindur
Tahapan pembuatan tepung pati buah lindur dapat dilihat pada Gambar 2. Cara pembuatan tepung pati buah lindur adalah buah lindur yang telah dikupas dan dibersihkan kemudian dipotong, dihaluskan menggunakan blender yang sebelumnya ditambah natrium metabisulfit sebanyak 0,05% (b/v) dan air 1: 2 (b/v). Bubur buah lindur yang dihasilkan kemudian disaring dengan kain blacu sehingga terpisah antara susu pati dan ampas. Ampas ditambah air 1: 1 untuk mengekstraksi pati yang tertinggal, dilakukan sebanyak dua kali. Susu pati yang diperoleh diendapkan pada suhu 4 °C selama 6 jam. Air hasil pengendapan dibuang, lalu pati dicuci dengan menambahkan air sebanyak 1 : 1 dan diendapkan pada suhu 4 °C selama 6 jam. Pati yang didapat setelah pencucian dikeringkan 14
pada suhu 50 °C selama 8-12 jam. Serpihan pati kemudian dihaluskan dengan blender dan diayak dengan saringan 150 mesh.
3.3.4 Analisis karakteristik tepung pati buah lindur
Analisis karakteristik pati yang dilakukan adalah kadar air, kadar pati, amilosa dan amilopektin. Metode analisis karakteristik pati dapat dilihat pada Lampiran 4.
Gambar 2 Ekstrak pati buah lindur B. gymnorrhiza (Modifikasi Rini, 2004) Pati
Pengendapan pada suhu 4 °C selama 12 jam
Pengeringan pada suhu 50 °C selama 8-12 jam
Penghancuran dengan blender
Pengayakan dengan menggunakan saringan 150 mesh Air hasil pengendapan dibuang lalu dilakukan
pencucian dengan aquades Pengendapan pada suhu 4 °C selama 6 jam
Buah Lindur
Penghancuran dengan blender dan penambahan air 1: 2 terhadap buah lindur
Pengupasan dan pencucian dengan air
Perbandingan air: Na2S2O3
0,05% adalah 1:1 (b/v)
2X
2X Penyaringan dengan kain blacu
ampas + air 1:1 (b/v)
3.4 Penelitian lanjutan
Penelitian lanjutan terdiri dari formulasi edible film dari pati buah lindur dan pengujian karakteristik edible film yang dihasilkan. Pengujian karakteristik fisik edible film meliputi analisis proksimat buah lindur, ketebalan, kuat tarik, persen pemanjangan edible film, dan laju trasnmisi uap air edible film.
3.4.1 Pembuatan edible film
Edible film yang dibuat pada penelitian ini menggunakan pati buah lindur,
gliserol, karagenan dan akuades. Perlakuan yang diberikan pada penelitian ini adalah pati buah lindur 4% (% bobot/ volume larutan), konsentrasi gliserol 1,5% dan 2% (% volume/volume larutan), dan konsentrasi karagenan 2%, 2,5% dan 3% (% bobot/volume larutan). Berdasarkan perlakuan yang diberikan diperoleh enam kode perlakuan edible film dengan rincian perbedaan konsentrasi antara pati, gliserol dan karagenan sebagai berikut:
A : Pati buah lindur 4%, Gliserol 1%, Karagenan 2%, B : Pati buah lindur 4%, Gliserol 1%, Karagenan 2,5% C : Pati buah lindur 4%, Gliserol 1%, Karagenan 3% D : Pati buah lindur 4%, Gliserol 1,5%, Karagenan 2% E : Pati buah lindur 4%, Gliserol 1,5%, Karagenan 2,5% F : Pati buah lindur 4%, Gliserol 1,5%, Karagenan 3%
Tahapan pembuatan edible film dapat dilihat pada Gambar 3. Pati buah lindur yang telah dibuat sebelumnya dilarutkan dalam akuades sambil diaduk dengan magnetic stirrer dan dipanaskan di atas hot plate stirrer pada suhu 60-70 °C selama 20 menit. Karagenan sesuai dengan formula dilarutkan dalam aquades sambil diaduk dengan magnetic stirrer dan dipanaskan di atas hot plate hingga suhu mencapai 80 °C. Kemudian larutan karagenan dicampurkan dengan larutan pati pada suhu 70-80 °C, dan diaduk dengan magnetic stirrer hingga homogen. Gliserol ditambahkan sesuai formula ke dalam larutan tersebut. Larutan edible
film dihasilkan kemudian dituangkan pada plat kaca sesuai ukuran yang telah
disiapkan dan diratakan, sebelumnya plat kaca tersebut dialasi terlebih dahulu dengan plastik mika yang bertujuan untuk memudahkan pengangkatan edible film dari cetakan. Film pada plat kaca dikeringkan dalam oven pada suhu 60 °C selama 5-6 jam, edible film yang telah kering kemudian dilepas dari cetakan ( metode casting plate). Sebelum dilepas dari alas mika film didiamkan terlebih dahulu 16
pada inkubator bersuhu ruang selama 24 jam. Selanjutnya dilakukan pengujian karakteristik edible film yang meliputi pengujian ketebalan edible film, kuat tarik edible film, persen pemanjangan edible film, dan laju trasmisi uap air edible film.
Gambar 3. Diagram alir proses pembuatan edible film (Modifikasi Fransiska, 2008)
Pati 4 % (b/v) Karagenan 2%, 2,5%
dan 3% (b/v)
Pencampuran pada suhu 70-80 °C
Penambahan gliserol 1,5%, dan 2% (v/v)
Penambahan aquades hingga 50 ml
Pencetakan di atas plat kaca 15 x 20 cm
Pengeringan dalam oven (60°C selama 5-6 jam)
Pelepasan film dari cetakan plat kaca
Pelepasan film dari alas mika film yang (sebelumnya didiamkan pada inkubator bersuhu ruang, ± 24 jam)
Edible Film Pemanasan dan pengadukan
(80 °C ± 5 menit) Homogenisasi (Penambahan air 20 ml
dipanaskan dalam suhu 60-70 °C ±20 menit) Homogenisasi (Penambahan air 20 ml dipanaskan hingga suhu 80 °C) 17
3.4.2 Karakteristik edible film
Pengujian yang dilakukan terhadap edible film yang dihasilkan meliputi ketebalan edible film, kuat tarik edible film, persen pemanjangan edible film, dan laju transmisi uap air edible film.
a) Ketebalan edible film (American Society For Testing and Material/ASTM) 1989)
Film diukur ketebalannya dengan alat pengukur ketebalan digital thickness (Adamel Lhomargy) dengan ketelitian 0,0001 mm pada lima tempat yang berbeda. Nilai ketebalan yang diukur menggunakan rata-rata hasil lima pengukuran tersebut.
b) Kuat tarik (Tensile Strengh) dan persen pemanjangan (Elongasi) (ASTM 1989)
Kuat tarik dan persen pemanjangan film diukur menggunakan alat tensile
strength and elongation teste strograph (MI Toyoseiki). Sebelum pengukuran,
film dikondisikan dalam ruangan bersuhu 25 °C, RH 50% selama 24 jam. Alat ukur pada initial grip separation 10 cm, load cells 5 kg dan kecepatan cross head 50 mm per menit. Kuat tarik ditentukan berdasarkan beban maksimum pada saat film pecah, dan persentase pemanjangan didasarkan pada pertambahan panjang saat film pecah.
Kuat tarik = F/A Keterangan : F = Gaya Tarik (kgf) A = Luas contoh (cm2) %E = Persentase pemanjangan Kuat tarik = kgf/ cm2
c) Laju transmisi uap air metode cawan / WVTR (ASTM 1989)
Laju transmisi uap air terhadap film diukur menggunakan metode cawan
(moisture cup). Sebelum pengukuran, film disimpan pada ruangan bersuhu 25°C,
RH 50% selama 24 jam untuk pengkondisian. Cawan diisi dengan silika gel dan sampel film disimpan menutupi cawan tersebut dan ditimbang. Luasan film yang
% E = x 100%
menutupi cawan dihitung. Selanjutnya cawan disimpan dalam inkubator pada suhu 25 °C, selama 24 jam. Setelah itu cawan ditimbang. Pengambilan data dilakukan selama 4 hari. Kehilangan berat selama penyimpanan dihitung sebagai fungsi waktu. Kemudian dihitung dengan menggunakan rumus :
Keterangan :
A = Selisih berat film setelah disimpan dalam cawan 0,002462 = Konstanta
t = Waktu pengujian (jam) Laju transmisi uap air =
4 HASIL DAN PEMBAHASAN
4.1 Penelitian Awal
Tahapan penelitian ini meliputi analisis proksimat buah lindur segar, analisis histologi jaringan tumbuhan lindur meliputi batang, daun dan buah, dan pembuatan tepung pati dari buah lindur. Pengujian karakteristik tepung pati buah lindur meliputi pengujian kadar air, pati, amilosa, amilopektin.
4.1.1 Morfologi tumbuhan lindur (Bruguiera gymnorrhiza)
Tanaman lindur yang digunakan pada penelitian ini diperoleh dari Pulau Kay, Kabupaten Maluku tenggara. Morfologi dari tanaman lindur dapat dilihat pada Gambar 5.
Gambar 4 Morfologi tumbuhan lindur (Bruguiera gymnorrhiza) Sumber : James dan Duke (2006)
Tumbuhan lindur memiliki daun yang umumnya berwarna hijau tua dan berbentuk elips. Daunnya dikenal dengan large-leafed mangrove karena memiliki panjang antara 8-22 cm dan lebar antara 5-8 cm. Ujung daun meruncing, berwarna hijau pada bagian atas dan hijau kekuningan pada bagian bawah dengan bercak-bercak hitam. Letak daun biasanya saling berhadapan dengan posisi menyilang. Batang dari tumbuhan ini umumnya berwarna abu-abu sampai hitam, memiliki lentisel yang besar dengan percabangan simpodial. Kulit kayu memiliki lentisel, permukaannya halus hingga kasar dengan warna abu-abu tua sampai coklat. Akar
Akar Daun
membentuk akar papan dan melebar kesamping tetapi juga memiliki sejumlah akar lutut. Tumbuhan lindur juga memiliki bunga dan buah, bunga terletak diujung buah dengan kelopak berwarna merah muda hingga merah serta panjang bunga berkisar antara 1,5-3,5 cm. Buah berbentuk silinder (hipokotil), melingkar spiral dengan lebar 2-2.5 cm dan panjang antara 12-30 cm. Gambar 5 menunjukkan bagian daun (a), bagian bunga (b) dan bagian buah (c).
(a) (b) (c) Gambar 5 Daun, bunga dan buah lindur.
4.1.2 Anatomi daun
Salah satu bagian yang penting pada tumbuhan untuk melakukan fotosintesis adalah daun. Daun mengandung sejumlah besar zat berwarna hijau yang disebut klorofil. Bagian – bagian daun biasanya terdiri atas pelepah daun
(vagina), tangkai daun (petiolus) dan helaian daun (lamina). Berdasarkan Gambar
5 diketahui bahwa warna daun bagian atas tampak lebih cerah dan mengkilap dibandingkan dengan bagian bawah daun. Hal ini sesuai dengan pernyataan Tjitrosoepomo (1996) bahwa pada umumnya warna daun pada sisi atas tampak lebih hijau, licin, atau mengkilap jika dibandingkan dengan sisi bawah daun.
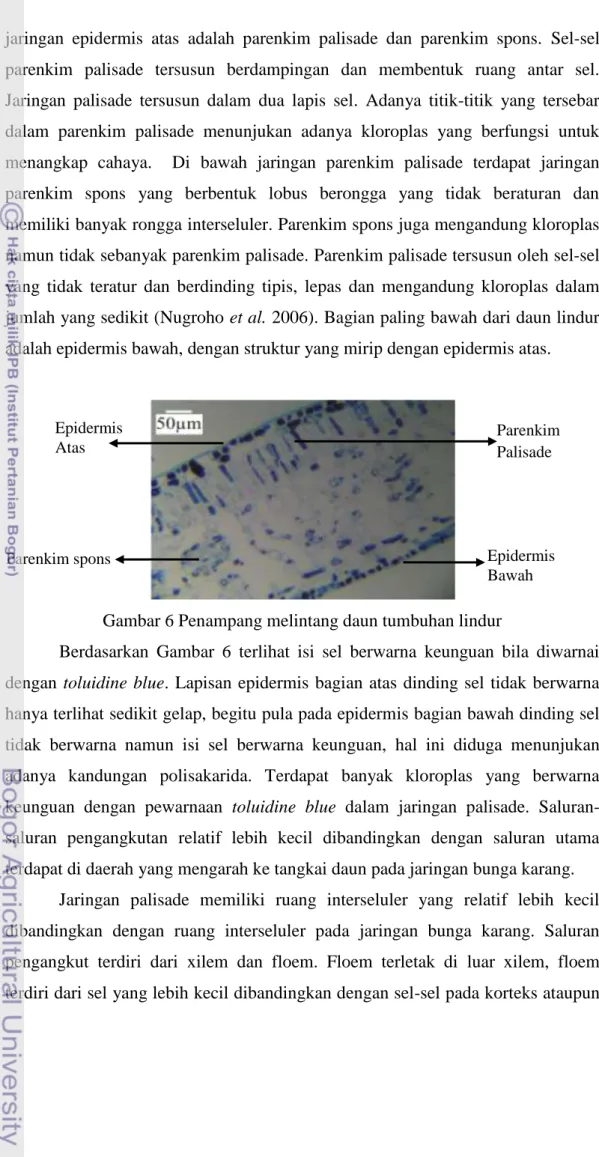
Sesuai dengan Gambar 6 terlihat bahwa lapisan daun tumbuhan lindur terdiri atas jaringan epidermis atas, dua lapis jaringan palisade, parenkim spons, dan lapisan yang terakhir adalah epidermis bawah. Bagian epidermis atas dan bawah daun lindur tersusun dari satu lapis sel yang berbentuk segi empat memanjang, yang tersusun rapat membentuk lapisan padat dan tidak terdapat ruang antar sel. Dinding sebelah luar epidermis bagian atas tertutup oleh kutikula yang merupakan lapisan tipis dan mengkilat. Menurut Mulyani (2006) bahwa epidermis tumbuhan air tidak berfungsi untuk perlidungan tetapi untuk pengeluaran zat makanan, senyawa air dan pertukaran gas. Lapisan di bawah 21
jaringan epidermis atas adalah parenkim palisade dan parenkim spons. Sel-sel parenkim palisade tersusun berdampingan dan membentuk ruang antar sel. Jaringan palisade tersusun dalam dua lapis sel. Adanya titik-titik yang tersebar dalam parenkim palisade menunjukan adanya kloroplas yang berfungsi untuk menangkap cahaya. Di bawah jaringan parenkim palisade terdapat jaringan parenkim spons yang berbentuk lobus berongga yang tidak beraturan dan memiliki banyak rongga interseluler. Parenkim spons juga mengandung kloroplas namun tidak sebanyak parenkim palisade. Parenkim palisade tersusun oleh sel-sel yang tidak teratur dan berdinding tipis, lepas dan mengandung kloroplas dalam jumlah yang sedikit (Nugroho et al. 2006). Bagian paling bawah dari daun lindur adalah epidermis bawah, dengan struktur yang mirip dengan epidermis atas.
Gambar 6 Penampang melintang daun tumbuhan lindur
Berdasarkan Gambar 6 terlihat isi sel berwarna keunguan bila diwarnai dengan toluidine blue. Lapisan epidermis bagian atas dinding sel tidak berwarna hanya terlihat sedikit gelap, begitu pula pada epidermis bagian bawah dinding sel tidak berwarna namun isi sel berwarna keunguan, hal ini diduga menunjukan adanya kandungan polisakarida. Terdapat banyak kloroplas yang berwarna keunguan dengan pewarnaan toluidine blue dalam jaringan palisade. Saluran-saluran pengangkutan relatif lebih kecil dibandingkan dengan Saluran-saluran utama terdapat di daerah yang mengarah ke tangkai daun pada jaringan bunga karang.
Jaringan palisade memiliki ruang interseluler yang relatif lebih kecil dibandingkan dengan ruang interseluler pada jaringan bunga karang. Saluran pengangkut terdiri dari xilem dan floem. Floem terletak di luar xilem, floem terdiri dari sel yang lebih kecil dibandingkan dengan sel-sel pada korteks ataupun Parenkim spons Epidermis Atas Parenkim Palisade Epidermis Bawah 22
xilem. Xilem mengalami penebalan dinding dan bentuknya poligonal dengan sisi yang bersudut, adanya pewarnaan dengan toluidine blue akan menjadikan xilem berwarna biru kehijauan dan lebih mengkilat. Sel-sel xilem tumbuhan lindur tersusun berbentuk menjari.
Stomata adalah lubang atau celah yang terdapat pada epidermis organ tumbuhan yang berwarna hijau, dibatasi oleh sel khusus yang disebut penutup (Nugroho et al. 2006). Stomata pada daun tumbuhan lindur terdapat pada bagian atas dan bawah daun. Jumlah stomata pada sisi epidermis atas daun lindur lebih banyak dibandingkan jumlah stomata pada sisi epidermis bawah daun lindur. Stomata tanaman lindur terdiri atas stoma dan sel penjaga. Adanya warna kehijauan pada stomata yang tampak pada gambar 7 dikarenakan terdapatnya kloroplast yang merupakan tempat berlangsungnya fotosintesis. Sel penjaga berfungsi untuk mengatur pertukaran gas dan air pada daun (Nugroho et al.2006). Stomata diperlihatkan pada Gambar 7.
Gambar 7 Stomata pada bagian atas daun tumbuhan lindur
4.1.2 Anatomi batang
Batang merupakan bagian tubuh tumbuhan yang amat penting, batang memiliki kedudukan sebagai tubuh tumbuhan sehingga batang dapat disamakan dengan sumbu tubuh tumbuhan. Batang tanaman lindur berwarna hijau muda hingga hijau kecoklatan, batang tanaman diduga lindur memiliki stomata pada bagian epidermisnya. Sesuai dengan Gambar 8 dapat diketahui bahwa bagian paling luar adalah jaringan epidermis yang terdiri dari satu lapis sel dan tersusun secara rapat. Dinding luar batang tampak tidak mengalami penebalan oleh zat kutin, diduga kutikula yang terdapat pada batang sangat tipis sehingga penebalan yang terjadi tidak terlihat. Korteks batang tanaman lindur terdiri atas sel parenkim.
Sel-sel tetangga
Stoma
Sel penjaga 23
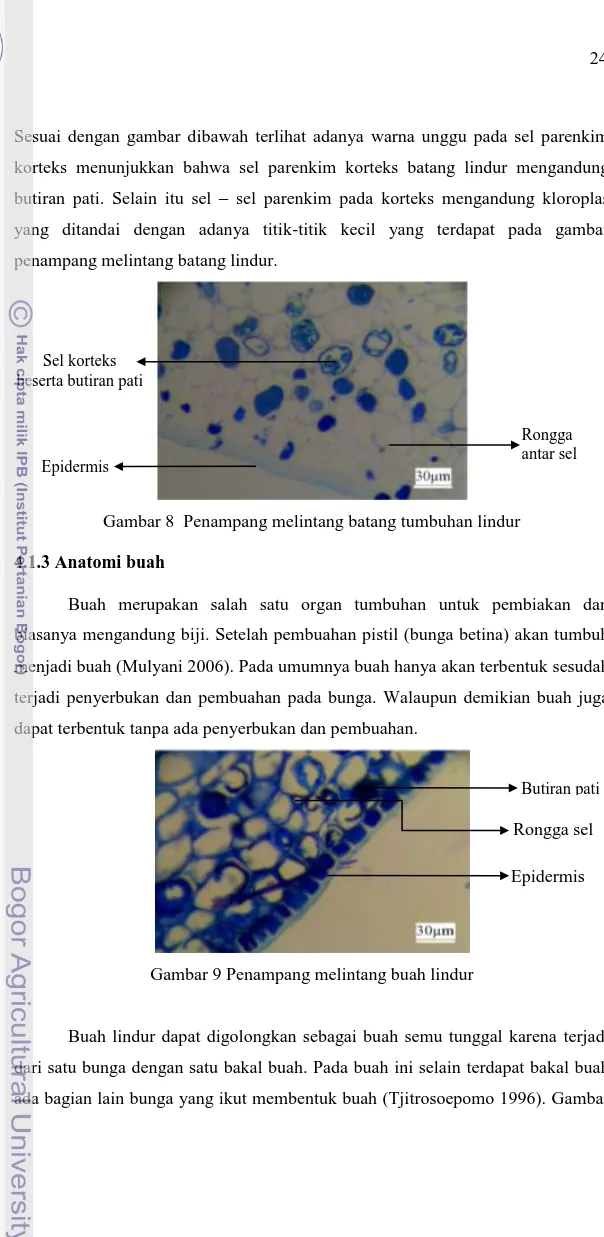
Sesuai dengan gambar dibawah terlihat adanya warna unggu pada sel parenkim korteks menunjukkan bahwa sel parenkim korteks batang lindur mengandung butiran pati. Selain itu sel – sel parenkim pada korteks mengandung kloroplas yang ditandai dengan adanya titik-titik kecil yang terdapat pada gambar penampang melintang batang lindur.
Gambar 8 Penampang melintang batang tumbuhan lindur
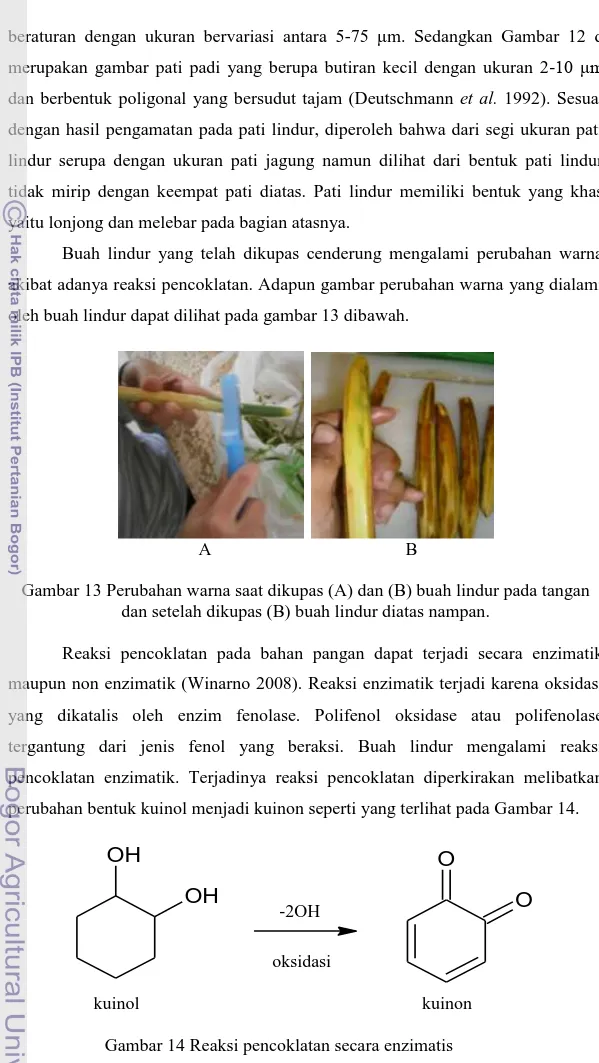
4.1.3 Anatomi buah
Buah merupakan salah satu organ tumbuhan untuk pembiakan dan biasanya mengandung biji. Setelah pembuahan pistil (bunga betina) akan tumbuh menjadi buah (Mulyani 2006). Pada umumnya buah hanya akan terbentuk sesudah terjadi penyerbukan dan pembuahan pada bunga. Walaupun demikian buah juga dapat terbentuk tanpa ada penyerbukan dan pembuahan.
Gambar 9 Penampang melintang buah lindur
Buah lindur dapat digolongkan sebagai buah semu tunggal karena terjadi dari satu bunga dengan satu bakal buah. Pada buah ini selain terdapat bakal buah ada bagian lain bunga yang ikut membentuk buah (Tjitrosoepomo 1996). Gambar
Sel korteks beserta butiran pati
Rongga antar sel Epidermis Epidermis Butiran pati Rongga sel 24
9 menunjukkan penampang melintang buah lindur yang terdiri dari epidermis, rongga sel dan butiran pati. Sel epidermis terlihat tersusun rapat satu sama lain yang membentuk persegi tanpa ruang antar sel. Tipisnya dinding sel epidermis buah lindur dikarenakan tidak adanya penebalan oleh kutin pada bagian kulit buah lindur sehingga lignin yang ada terlihat kurang begitu jelas.
Gambar 10 Berkas pembuluh pada buah lindur
Gambar 10 menunjukkan adanya granula pati pada buah ditandai dengan adanya warna keunguan dengan menggunakan pewarnaan toluidine blue yang terdapat dalam vakuola. Menurut Tjitrosoepomo (1996) vakuola merupakan ruang dalam sel yang berisi cairan, berupa rongga yang diselaputi membran (tonoplas). Cairan ini adalah air dan berbagai zat yang terlarut di dalamnya. Vakuola memiliki beberapa fungsi seperti sebagai tempat penyimpanan zat cadangan makanan seperti amilum dan glukosa, tempat menyimpan pigmen (daun, bunga dan buah), tempat penyimpanan minyak atsiri yang merupakan golongan minyak yang memberikan bau khas seperti minyak kayu putih dan sebagai pengatur tirgiditas sel atau tekanan osmotik sel. Terlihat sejumlah besar granula pati yang terdapat pada vakuola baik pada penampang melintang buah lindur maupun pada berkas pembuluh buah lindur. Bagian korteks terlihat tidak berwarna dengan adanya pewarnaan menggunakan toluidine blue. Korteks buah lindur tersusun dari lapisan-lapisan sel yang berdinding tipis. Koteks memiliki ruang-ruang antarsel yang berfungsi untuk pertukaran gas. Peran korteks adalah sebagai tempat penyimpanan cadangan makanan. Berkas pembuluh xylem pada buah berfungsi untuk transpor air dan garam-garam mineral dari akar ke buah. Penyusun utama
Vakuola dgn butiran pati Floem Xilem Korteks 25
xylem buah lindur adalah trakeid dan trakea sebagai saluran pengangkut air dengan penebalan dinding sel yang cukup tebal pada Gambar 10 sekaligus berfungsi sebagai penyokong. Sedangkan pembuluh floem berfungsi untuk mengedarkan gula, asam amino serta hasil fotosintesis lainnya dari daun ke buah dan disinilah cadangan makanan disimpan. Umumnya pembuluh floem memiliki dua bentuk yaitu sel tapis (sieve plate) berupa sel tunggal yang memanjang dan buluh tapis (sieve tubes) yang serupa pipa. (Nugroho et al. 2006).
4.2 Komposisi Kimia Buah Lindur Segar
Buah lindur (B. gymnorrhiza) biasanya dimanfaatkan oleh masyarakat sebagai makanan pengganti nasi pada saat musim paceklik, khususnya di Kabupaten Maluku Tenggara dan dibeberapa wilayah nusantara. Buah ini biasanya diolah dengan cara direbus dan dikeringkan agar dapat disimpan dalam jangka waktu yang lama. Masyarakat umumnya tidak mengonsumsi buah ini dalam keadaan mentah. Analisis proksimat buah lindur ini perlu dilakukan agar dapat mengetahui komposisi kimia buah segar. Komposisi kimia buah lindur dapat dilihat pada Tabel 1.
Tabel 1 Komposisi kimia buah lindur segar Analisa Proksimat Jumlah (%)
Air 62,92 Abu Lemak 1,29 0,79 Protein 2,11 Karbohidrat 32,91 4..2.1 Air
Buah lindur merupakan tumbuhan mangrove yang habitatnya berada di dekat wilayah perairan dan umumnya tumbuh di pesisir pantai. Berdasarkan hasil analisis proksimat dari buah lindur segar menunjukkan bahwa nilai kadar air adalah 62,92 % yang lebih kecil dibandingkan dengan kadar air buah lindur hasil penelitian sebelumnya yaitu sebesar 73,76 (Fortuna 2005) dan kadar air dari buah
Sonneratia sp. sebesar 79,24 % (Febrianti 2010). Kadar air hasil penelitian lebih
besar dari kadar air Avecennia marina yang diteliti oleh Wibowo et al. (2009) yaitu 61,95%.
4.2.2 Abu
Analisis proksimat yang telah dilakukan pada buah lindur segar menunjukan bahwa kadar abu yang dikandung adalah 1,29 %. Nilai kadar abu buah lindur hasil penelitian Fortuna (2005) yang sebesar 0,34% jauh lebih kecil dibandingkan dengan kadar abu hasil penelitian. Apabila dibandingkan dengan kadar abu dari berbagai jenis buah mangrove lain misalnya Sonneratia sp. dan Avecennia marina maka kadar abu hasil penelitian lebih kecil. Sonneratia sp. menghasilkan kadar abu sebesar 4,35% (Febrianti 2010) dan kadar abu buah buah mangrove jenis Avecennia marina sebesar 1,27% (Wibowo et al. 2009) sedikit lebih kecil dari kadar abu buah lindur hasil penelitian.
4.2.3 Lemak
Kadar lemak yang didapatkan dari hasil analisa proksimat buah lindur segar adalah 0,79 %. Pada tanaman, lemak disintesis dari satu molekul gliserol dengan tiga molekul asam lemak yang terbentuk dari kelanjutan oksidasi karbohidrat dalam proses respirasi (Winarno 2008). Pada penelitian sebelumnya terhadap buah lindur Fortuna (2005) memperoleh kadar lemak sebesar 1,25% yang lebih besar dari kadar lemak hasil penelitian ini. Begitu pula dengan kadar lemak buah Sonneratia sp. yang dilakukan oleh Febrianti (2010) sebesar 0,89 % yang lebih besar dari kadar lemak hasil penelitian. Sedangkan jika dibandingkan dengan kadar lemak Avecennia marina yang sebesar 0,04%. Dibandingkan dengan penelitian yang dilakukan oleh Wibowo et al. (2009) kadar lemak buah lindur hasil penelitian lebih besar.
4.2.4 Protein
Kadar protein yang didapatkan dari hasil analisa proksimat buah lindur segar adalah 2,11 %. Umumnya kadar protein buah mangrove relatif kecil. Kadar protein buah lindur hasil penelitian lebih besar dibandingkan dengan kadar protein buah lindur dari penelitian sebelumnya dan dari kadar protein buah pedada
(Sonneratia sp.) yang berturut-turut sebesar 1,13% dalam penelitian yang
dilakukan oleh Fortuna (2005) dan 1,17% dalam penelitian yang dilakukan oleh Febrianti (2010).
4.2.5 Karbohidrat
Karbohidrat merupakan sumber kalori utama bagi hampir seluruh penduduk dunia, khususnya bagi penduduk negara yang sedang berkembang. Buah lindur memiliki kandungan karbohidrat yang lebih besar dari komponen gizi lainnya. Karbohidrat yang terdapat pada buah lindur segar yang telah dianalisis adalah 32,91 %. Hasil pengujian kadar pati lebih lanjut yang menggunakan metode Luff Scrhrool diperoleh kadar pati sebesar 57,73%, kadar amilosa 31,56 %, dan kadar amilopektin sebesar 26,17%.
Kandungan karbohidrat buah lindur hasil penelitian memiliki nilai yang paling besar jika dibandingkan dengan kadar karbohidrat buah lindur dari penelitian sebelumnya maupun dari kadar karbohidrat beberapa buah mangrove lainnya. Kadar karbohidrat buah lindur sebelumnya yang telah diteliti oleh Fortuna (2005) adalah 23,53%, buah Sonneratia sp. memiliki kadar karbohidrat sebesar 14,35 % (Febrianti 2010) dan kadar karbohidrat Avecennia marina yang diteliti oleh Wibowo et al. (2009) adalah 21,43%.
4.3 Karakteristik Tepung Pati Buah Lindur
Karakteristik kimia yang dianalisa pada tepung buah lindur adalah kadar air, kadar pati, kadar amilosa, dan kadar amilopektin. Hasil analisa pengujian karakteristik kimia dapat dilihat pada Tabel 2.
Tabel 2 Komposisi kimia tepung pati buah lindur Komposisi Jumlah (%) Kadar Air 6,19 Pati 57,73 Amilosa 31,56 Amilopektin 26,17 Lain-lain 36,08
Semakin tinggi kadar air tepung pati buah lindur maka akan menimbulkan gelembung yang semakin banyak pada larutan edible film. Adanya gelembung-gelembung ini akan menjadikan edible film yang dihasilkan memiliki penampakan
yang kurang baik setelah dikeringkan. Selain ini dengan kandungan kadar air tepung pati yang dihasilkan dibawah 14% yaitu sebesar 6,19 % yang menjadikan tepung pati buah lindur dapat disimpan hingga jangka yang lama. Tepung yang baik hendaknya memiliki kadar air yang tidak lebih dari 14%, karena batas toleransi mikroba masih dapat tumbuh pada 14-15% (Fardias 1989). Kandungan amilosa dan amilopektin akan menentukan karakteristik film yang dihasilkan. Rasio amilosa dan amilopektin tergantung dari jenis pati. Semakin tinggi kandungan amilosa maka film akan semakin kuat (Schultz 1969). Kandungan amilosa dan amilopektin buah lindur dari hasil penelitian diperoleh sebesar 31,56% dan 26,17 %.
Pati terbentuk dari proses asimilasi dalam tumbuhan yang disebut fotosintesis. Pati terbentuk pada siang hari ketika proses fotosintesis melebihi laju gabungan antara respirasi dan translokasi. Dalam butiran pati, rantai-rantai amilosa dan amilopektin tersusun dalam bentuk semi kristal, yang menyebabkannya tidak larut dalam air dan memperlambat pencernaannya oleh amilase pankreas. Bila dipanaskan dengan air, struktur kristal akan rusak dan rantai polisakarida akan mengambil posisi acak. Hal inilah yang menyebabkan pati mengalami pengembangan dan pemadatan (gelatinisasi). Proses pemanasan pati disamping menyebabkan pembentukan gel juga akan melunakkan dan memecah sel, sehingga memudahkan pencernaanya apabila pati dikonsumsi (Muchtadi 2011).
Adapun sifat fisik tepung pati yang diuji meliputi derajat putih, bentuk granula, ukuran granula, suhu gelatinisasi, dan warna tepung pati. Hasil dari pengujian karakteristik fisik tepung pati dapat dilihat pada Tabel 3. Derajat putih merupakan tingkat warna putih dari pati dibandingkan dengan warna putih BaSO4 (100 %). Derajat putih tepung pati buah lindur berdasarkan hasil penelitian mempunyai derajat putih sebesar 37,37%. Nilai ini lebih rendah jika dibandingkan dengan derajat putih tepung pati bonggol pisang sebesar 64% (Kumalasari 2005). Hal ini disebabkan oleh senyawa polifenol yang menyebabkan adanya rekasi pencoklatan pada tepung pati buah lindur.
Tabel 3 Karakteristik fisik tepung pati buah lindur
No Uji Keterangan
1 Derajat Putih 37,37%
2 Bentuk Granula lonjong melebar 3 Ukuran Granula panjang 11,21 μm
lebar 28,9μm
4 Warna putih kecoklatan
Bentuk granula pati buah lindur adalah lonjong dan melebar pada bagian atas, dengan panjang dan lebar granula antara 11,21μm - 28,9μm. Granula pati umumnya banyak ditemukan pada berbagai jaringan tanaman, mempunyai bentuk, ukuran, keseragaman dan bentuk hilum (sentrik dan eksentrik) yang khas untuk setiap jenis pati, sehingga dapat digunakan untuk identifikasi dari jenis pati (Swinkels 1985). Granula pati mempunyai sifat birefringence, yaitu sifat yang dapat merefleksikan cahaya terpolarisasi membentuk bidang berwarna jingga dan biru. Adanya warna biru menunjukkan kandungan amilosa dan warna jingga menunjukan adanya kandungan amilopektin. Granula pati buah lindur dapat dilihat pada Gambar 11
A B
Gambar 11 Granula pati buah lindur perbesaran100 kali (A) dan granula pati di bawah mikroskop polarisasi perbesaran 200 kali (B)
Granula pati umumnya tidak larut dalam air dingin. Jika dilakukan pemanasan pati dalam air maka akan terjadi difusi air pada dinding granula pati