METODOLOGI Waktu dan Tempat Penelitian Bahan Ekstrak Teh Hijau Hewan coba
Teks penuh
Gambar
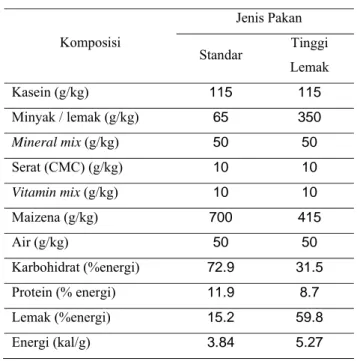
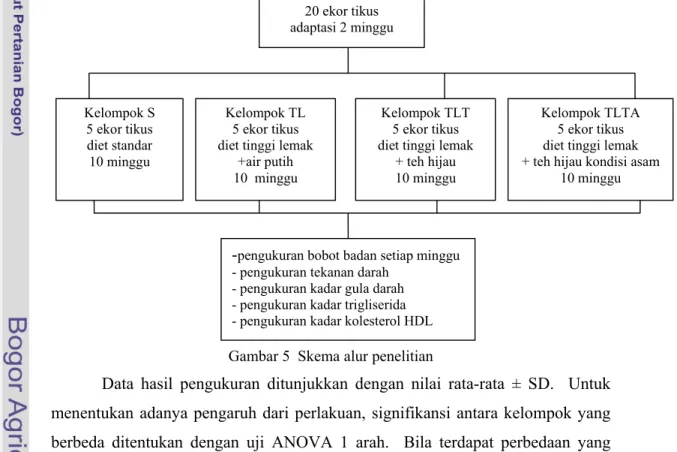
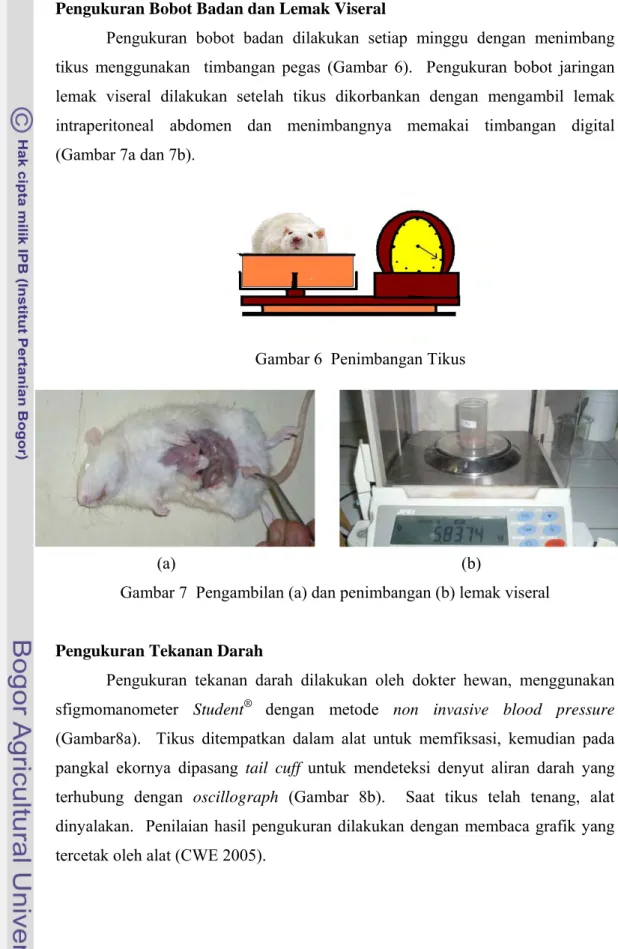

Dokumen terkait
Penanda molekuler ISSR dapat digunakan untuk mengetahui keragaman intraspesifik pada aksesi ekinase terpilih hasil seleksi massa tahun I yaitu aksesi BH2, BHU3 dan
Kemampuan perusahaan dalam menghasilkan keuntungan jika dilihat dari return on equity adalah kurang baik karena memiliki tren yang menurun. Akan tetapi, jika dilihat dari
Pada tahap awal dilakukan wawancara singkat berdasarkan kriteria inklusi dan kriteria ekslusi, kemudian pada subjek penelitian yang memenuhi kriteria inklusi dan eksklusi
gangguan sistem pernafasan karena masalah bersihan jalan nafas tidak efektif. Bersihan jalan nafas tidak efektif adalah ketidakmampuan dalam membersihkan sekresi
Gambar 4.20 adalah pengaruh dari kenaikan frekuensi dan pengaruh jumlah piezoeletric, trendline yang dihasilkan cukup meningkat, pada jumlah piezoelectric sebanyak 10
(1) Seluruh pendapatan BLUD RSUD Simeulue sebagaimana dimaksud dalam Pasal 67 ayat (2), kecuali yang berasal dari hibah terikat, dapat dikelola langsung untuk
Teknik pengumpulan data yang digunakan untuk memperoleh data dalam penelitian ini adalah dengan mengumpulkan berbagai buku-buku dan literatur yang berkaitan dengan pemikiran
Harapan hidup tiap fasenya dapat dilihat dari nilai ex dengan harapan tertinggi pada fase instar 1 yaitu 5.75% dan terendah pada fase imago yaitu 0.50%.. Nilai lx