TINJAUAN PUSTAKA
Pengaruh Nitrogen terhadap Tanaman
Penggunaan pupuk nitrogen (N) meningkat sekitar sepuluh kali lipat menjadi 90 juta metrik ton antara tahun 1950 dan tahun 1995 (Frink et al. 1999). Hauck (1988) memperkirakan sekitar 60 juta ton pupuk nitrogen dewasa ini digunakan untuk peningkatan produksi lahan pertanian, terutama untuk memproduksi biji-bijian. Berdasarkan kebutuhan nitrogen, maka kebutuhan pupuk nitrogen diperkirakan akan mencapai 100 juta ton pada tahun 2000. Vance (2001) mengemukakan bahwa untuk memenuhi kebutuhan pangan dalam tahun 2040 diperlukan sekitar 40 juta metric ton pupuk nitrogen untuk pertanian.
Di Indonesia, permintaan pupuk N meningkat dari tahun ke tahun terutama Urea yang bila dibandingkan antara tahun 1999 dengan 2002 meningkat sebesar 37,5% (Soedjais, 2003). Di samping itu terdapat pula peningkatan permintaan terhadap pupuk Amonium Sulfat sebesar 12,4% dan TSP/SP36 sebesar 6,2%, serta penurunan permintaan pupuk KCl sebesar 19,1% (Tabel 1).
Tabel 1. Kebutuhan pupuk di Indonesia (ton)
Tahun Urea Amonium sulfat TSP/SP36 KCl 1999 3.140.033 541.580 673.193 530.057 2000 3.959.650 507.005 687.653 359.453 2001 3.934.985 511.170 655.734 426.019 2002 4.318.407 608.605 714.872 428.620 Sumber: Soedjais, 2003.
Hauck (1988) memperkirakan bahwa sekitar 90 juta ton nitrogen diperoleh sebagai hasil penambatan secara proses biologis, dimana sekitar 50 juta ton ditambat oleh leguminosa tanaman pakan ternak. Menurut Arshad dan Frankenberger (1993) fiksasi N2 secara biologi menyumbang sekitar 70% dari semua nitrogen yang difiksasi di bumi dan sekitar 90% kebutuhan nitrogen tanaman dapat dihasilkan oleh gabungan ini. Smill (1999) mengemukakan bahwa sekitar 40 hingga 60 juta metrik ton N2 ditambat oleh tanaman leguminosa setiap tahun.
Unsur hara N merupakan bahan penting penyusun asam amino, amida, nukleotida, dan nukleoprotein, serta esensial untuk pembelahan sel, pembesaran sel, dan karenanya untuk pertumbuhan (Gardner et al. 1991). Defisiensi N mengganggu proses pertumbuhan, menyebabkan tanaman kerdil, dan menguning.
Nitrogen (N) merupakan suatu unsur hara esensial yang dibutuhkan tanaman dalam jumlah banyak, yang berfungsi sebagai penyusun protein, termasuk enzim dan molekul chlorofil (Hakim et al. 1986). Nitrogen merupakan unsur hara yang penting hubungannya dengan pertumbuhan tanaman. Unsur ini dijumpai dalam jumlah besar di dalam bagian muda tanaman, terutama terakumulasi pada daun dan biji. Nitrogen merupakan penyusun setiap sel hidup, karenanya terdapat pada seluruh bagian tanaman. Tanaman memerlukan suplai nitrogen pada semua tingkat pertumbuhan, terutama pada awal pertumbuhan, sehingga adanya sumber N yang murah akan sangat membantu mengurangi biaya produksi. Sebagai contoh untuk menghasilkan 1 kg biji kedelai, tanaman menyerap 70-80 g N dari dalam tanah (Pasaribu et al. 1989).
Grant and Flaten (1998) dalam Grant et al. (2002) mengemukakan bahwa unsur hara N diperlukan untuk menjamin kualitas tanaman yang optimum yang ditunjukkan oleh kandungan protein dari tanaman yang berhubungan langsung dengan supplai N. N diberikan kepada tanah dalam bentuk-bentuk amida, ammonium, maupun nitrat. Tidak semua pupuk yang diberikan dapat diserap oleh tanaman, sebagian besar akan hilang. Kehilangan N di dalam tanah selain terjadi melalui pencucian dan diangkut oleh tanaman, juga terjadi melalui penguapan seperti N2, nitrous oksida (N2O) dan NH3. Gas ini terbentuk karena reaksi-reaksi dalam tanah dan kegiatan mikrobia. Mekanisme kehilangan N dalam bentuk gas melalui denitrifikasi, reaksi kimia karena temperatur dalam suasana aerobik dan lainnya, serta penguapan gas NH3 dari pemupukan pada tanah alkalis (Maryam et al. 1998).
Unsur hara N biasanya defisien, yang mengakibatkan penurunan produksi pertanian di seluruh dunia. Hakim et al. (1986) mengemukakan bahwa nitrogen yang terdapat dalam tanah sedikit, sedangkan yang diangkut tanaman berupa panen setiap tahun cukup besar. Di samping itu senyawa nitrogen anorganik mudah larut dan mudah hilang dalam air drainase/irrigasi atau menguap ke atmosfer. Jika unsur N terdapat dalam keadaan
kurang, maka pertumbuhan dan produksi tanaman akan terganggu. Masalah ini dapat diatasi antara lain dengan pemupukan.
Kebutuhan nitrogen untuk komoditas pertanian pada umumnya dipenuhi dengan dua cara yaitu (1) pupuk kimia/buatan, manure, dan/atau mineralisasi dari bahan organik, dan (2) melalui penambatan N atmosfir melalui proses simbiosis (Vance, 2001).
Pemakaian pupuk N buatan yang terus menerus atau berlebihan akan mengakibatkan kerusakan lingkungan baik tanah maupun air tanah (Rogers dan Whitman, 1991). Tumbuhan kehilangan sedikit nitrogen ke dalam atmosfer dalam bentuk NH3, N2O, NO2 dan NO yang mudah menguap, khususnya bila dipupuk nitrogen (Salysbury dan Ross, 1995). Bentuk teroksidasi nitrogen di atmosfer secara ekologi penting karena bila diubah menjadi NO3- akan menyumbang HNO3- bagi hujan asam. Selanjutnya Campbell et al. (1995) dalam Grant et al. (2002) mengemukakan bahwa pencucian NO3 akan menurunkan kualitas air tanah dan emisi N2O berkontribusi terhadap efek rumah kaca dan menyebabkan terjadinya pemanasan global. Residu pupuk N yang cukup besar tertinggal dalam tanah sebagai akibat tidak efisiennya tanaman menggunakan pupuk N berimplikasi negatif terhadap lingkungan dan kesehatan (Galloway et al. 1995 dalam Vance, 2001). Nitrifikasi oleh mikrobia dan denitrifikasi N tanah merupakan kontributor utama emisi NO2 dan N2O (Socolow, 1999). Pupuk N yang tidak dimanfaatkan oleh tanaman secara cepat akan memasuki permukaan tanah dan air tanah melalui runoff dan leaching. Ekses dari NO3- pada air minum yang berasal dari pupuk berakibat methemoglobin anemia pada bayi dan anak-anak bila konsentrasinya melebihi 10 mg NO3 L-1 (Smill, 1999).
Proses fiksasi N oleh leguminosa tidak mempengaruhi kualitas air tanah. Hal ini karena ammonium (NH4+) yang dihasilkan oleh hasil fiksasi, secara langsung digunakan untuk pertumbuhan tanaman (Killpack dan Buchholz, 1993). Pada proses penambatan N, tanaman leguminosa menyediakan lingkungan reduksi dan karbohidrat untuk metabolisme bakteri, sedangkan bakteri mengubah N2 udara menjadi N tersedia bagi tanaman. Tanaman leguminosa mampu tumbuh baik pada tanah yang miskin N karena adanya simbiosis dengan rhizobium, sehingga mampu meningkatkan kualitas dan kuantitas tanaman leguminosa, serta mampu meningkatkan dan menjaga kesuburan tanah (Gardner et al. 1991).
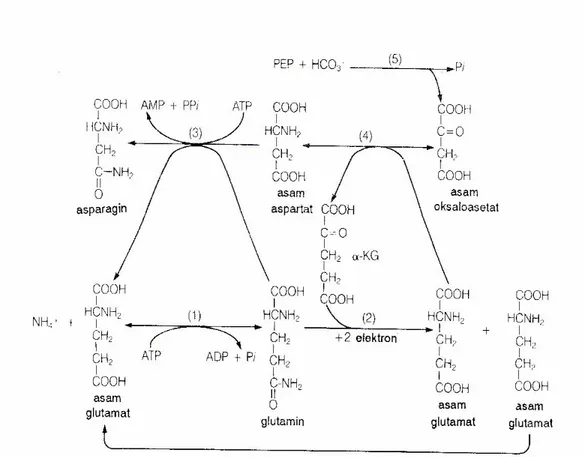
Menurut Salisbury dan Ross (1995) semua NH4+ pertama-tama diubah menjadi gugus amina dari glutamin. Perubahan ini dan reaksi lainnya akan membentuk asam glutamat, asam aspartat, dan asparagin (Gambar 1).
Gambar 1. Perubahan amonium menjadi senyawa organik utama (Salisbury dan Ross, 1995)
Glutamin dibentuk dengan penambahan satu gugus NH2 dari NH4+ ke gugus karboksil terjauh dari karbon alfa asam glutamat, lalu terbentuk ikatan amida (reaksi 1). Enzim yang diperlukan adalah glutamin sintase. Hidrolisis ATP menjadi ADP dan Pi sangat penting untuk mendorong reaksi lebih lanjut. Reaksi ini membutuhkan asam glutamat sebagai reaktan, harus terdapat mekanisme untuk menyediakannya yang dapat dipenuhi oleh reaksi 2 yang dikatalisis oleh glutamate sintase. Glutamat sintase mengangkut gugus amida dari glutamin ke karbon karbonil asam α-ketoglutarat, sehingga terbentuk dua molekul asam glutamat. Proses ini membutuhkan pereduksi yang mampu menyumbang dua elektron, yaitu feredoksin (dua molekul) di kloroplas dan NADH atau
NADPH di proplastid sel non-fotosintetik. Salah satu dari dua glutamat yang dibentuk pada reaksi 2 penting untuk mempertahankan reaksi 1, sedangkan glutamat yang satunya dapat diubah secara langsung menjadi protein, klorofil, dan asam nukleat. Selain membentuk glutamat, glutamin dapat menyumbangkan gugus amidanya ke asam aspartat untuk membentuk asparagin (reaksi 3). Reaksi ini membutuhkan asparagin sintetase, dan hidrolisi tak-terbalikkan ATP menjadi AMP dan Ppi menyediakan energi untuk mendorong reaksi ini. Nitrogen dalam aspartat dapat berasal dari glutamat, tapi empat karbonnya mungkin berasal dari oksaloasetat (reaksi 4) yang dibentuk dari PEP dan HCO3- oleh kerja PEP karboksilase (reaksi 5).
Sejumlah besar nitrogen gas terdapat di atmosfer yaitu sekitar 78% (Hakim et al. 1986; Salisbury dan Ross, 1995), tetapi secara aktif sulit bagi organisme hidup untuk mendapatkan atom nitrogen dari dinitrogen (N2) dalam bentuk yang berguna (Salisbury dan Ross, 1995). Walaupun N2 masuk ke dalam sel tumbuhan bersama-sama CO2 lewat stomata, enzim yang ada hanya dapat mereduksi CO2 sehingga N2 keluar lagi secepat ia masuk.
Sebagian besar nitrogen yang terdapat di dalam organisme hidup berasal dari penambatan (reduksi) oleh mikroorganisme prokariot, sebagian di antaranya terdapat di akar tumbuhan tertentu, atau dari pupuk kimia secara industri. Sebagian kecil nitrogen juga masuk ke tanah dari atmosfer dalam bentuk ion amonium (NH4+) dan nitrat (NO3-) bersama hujan dan kemudian diserap akar (Salisbury dan Ross, 1995).
Penyerapan NO3- dan NH4+ oleh tumbuhan memungkinkan tumbuhan untuk membentuk berbagai senyawa nitrogen, terutama protein. Pupuk dan tumbuhan yang mati, mikroorganisme, serta hewan, merupakan sumber penting nitrogen yang dikembalikan ke tanah, tetapi sebagian besar nitrogen tersebut tidak larut dan tidak segera tersedia bagi tumbuhan. Hampir semua tanah mengandung sedikit asam amino, yang dihasilkan terutama dari perombakan bahan organik oleh mikroba, tapi juga pengeluaran dari akar. Walaupun asam amino tersebut dapat diserap dan dimetabolismekan oleh tumbuhan, senyawa ini dan senyawa nitrogen komplek lainnya hanya menyumbang sedikit bagi hara nitrogen tumbuhan secara langsung. Walaupun demikian, mereka merupakan cadangan nitrogen yang sangat penting, yang akan menghasilkan NH4+ dan NO3-. Nyatanya, 90% nitrogen total di tanah terdapat dalam bentuk bahan organik,
walaupun dalam beberapa kasus sejumlah besar nitrogen terdapat dalam bentuk NH4+ yang terikat pada koloid liat (Salisbury dan Ross, 1995).
Rhizobium
Bakteri Rhizobium spp. merupakan salah satu jenis jasad mikro yang hidup bersimbiosis dengan tanaman leguminosa dan berfungsi menambat nitrogen secara hayati mulai diperkenalkan pada tahun 1888 oleh Hellriegel dan Wilfarth (Hirsch et al. 2001). Penambatan nitrogen secara simbiotik merupakan interaksi kompleks antara tanaman inang, lingkungan dan bakteri Rhizobium (Graham, 1981; Singleton et al. 1985; Long, 1996). Setiap jenis leguminosa menghendaki strain Rhizobium tertentu untuk keserasian simbiosisnya (Hirsch et al. 2001). Sebagai contoh Sinorhizobium meliloti efektif untuk spesies Medicago, Melilotus, dan Trigonella; sedangkan Rhizobium leguminosarum bv. viciae sesuai untuk tanaman Pisum, Vicia, Lens, dan Lathyrus spp. Untuk itu inokulasi perlu dilaksanakan agar tercapai penambatan nitrogen yang efektif (Yutono, 1985).
Limpens dan Bisseling (2003) mengemukakan bahwa penambatan nitrogen adalah merupakan bentuk simbiosis antara tanaman leguminosa (Fabaceae) dengan bakteri gram-negatif yang termasuk ke dalam genera Azorhizobium, Bradyrhizobium, Mesorhizobium, Rhizobium dan Sinorhizobium yang secara kolektif disebut rhizobia. Interaksi ini akan membentuk organ baru yang disebut dengan bintil akar, dimana rhizobia bersatu secara intraselluler ke dalam induk semang dan menambat nitrogen dari atmosfer untuk digunakan oleh induk semang.
Rhizobium termasuk divisi Protophyta, kelas Schizomycetes, order Eubacteriales, famili Rhizobiaceae dan genus Rhizobium. Jordan (1982) mengklasifikasikan genus Rhizobium menjadi dua group yaitu Rhizobium dengan ciri tumbuh cepat dan bereaksi asam pada medium agar dan Bradyrhizobium dengan ciri tumbuh lambat dan bereaksi alkaline pada media agar Morfologi koloni Rhizobium pada media agar berdiameter 2-4 µm (Vincent, 1982; Setiadi, 1989), sedangkan Bradyrhizobium adalah genus bakteri dengan diameter 1 µm dan mempunyai kecepatan pertumbuhan lebih lambat pada agar mannitol ekstrak khamir dibandingkan dengan Rhizobium (Setiadi, 1989). Rhizobium mempunyai kecepatan tumbuh 3-5 hari, sedangkan Bradyrhizobium 5-7 hari.
Rhizobium merupakan pemasok utama kebutuhan N tanaman leguminosa bila tidak memperoleh pemupukan N atau dapat mengurangi pemakaian pupuk N (Lynch, 1983).
Pada kondisi lingkungan yang ideal dengan bintil akar yang baik tanaman kedelai dapat memperoleh sumbangan N hasil penambatan N2 oleh bakteri Rhizobium setara dengan 65-115 kg N ha –1 tahun -1 (Alexander, 1977).
Tanaman leguminosa baik herba maupun perdu/pohon mempunyai kemampuan mengikat N udara (bentuk N yang tidak tersedia bagi tanaman) dan merubahnya menjadi bentuk N yang tersedia bila bersimbiose dengan bakteri Rhizobium. Usaha memanipulasi faktor-faktor yang terlibat secara optimal akan dihasilkan fiksasi N yang optimal pula. Interaksi tanaman inang dan bakteri Rhizobium bervariasi, dari yang moderat sampai yang spesifik, sehingga perlu diidentifikasi kombinasi antara spesies dan rhizobia yang superior mengikat N2. Purwantari (1994) melaporkan bahwa Sesbania grandiflora termasuk dalam kategori spesifik dalam kebutuhannya akan Rhizobium. Berbeda halnya dengan Paraserianthes falcataria kurang spesifik. Pada tanaman Siratro (Macroptilium atropurpureum (DC) Urb. Cv Siratro), bintil akar yang efektif dapat terbentuk dari berbagai strain rhizobium atau bradyrhizobium (Appelbaum, 1990 dalam Khan et al. 1999). Menurut Broughton (2003) Azorhizobium caulinodans efektif membentuk bintil akar pada tanaman Sesbania rostrata, Synorhizobium meliloti pada tanaman Medicago, Melilotus dan Trigonella, sedangkan Rhizobium sp. NGR234 efektif membentuk bintil akar pada lebih dari 112 genera leguminosa, termasuk tanaman non-leguminosa yaitu Parasponia andersonii.
Selanjutnya, Khan et al. (1999) menyatakan bahwa nodulasi dan penambatan nitrogen pada tanaman dapat ditingkatkan bila tanaman tersebut diinokulasi dengan strain (Brady)rhizobium yang kompetitif dan efektif serta konsentrasi bakteri yang tinggi.
Pembentukan bintil akar terjadi antara 7-14 hari setelah perkecambahan dengan membentuk akar rambut pada akar primer dan sekunder (Gardner et al. 1991; Salisbury dan Ross, 1995). Akar mengeluarkan senyawa triptofan yang menyebabkan bakteri berkembang pada ujung akar rambut. Triptofan diubah oleh rhizobium menjadi IAA (Indole Acetic Acid) yang menyebabkan akar membengkok karena adanya interaksi antara akar dengan rhizobium. Kemudian bakteri merombak dinding sel akar tanaman sehingga terjadi kontak antara keduanya. Benang infeksi terbentuk, yang merupakan perkembangan dari membran plasma yang memanjang dari sel terinfeksi. Setelah itu rhizobium berkembang di dalam benang infeksi yang menjalar menembus sel-sel kortek
sampai parenkim. Di dalam sel kortek, rhizobium dilepas di dalam sitoplasma untuk membentuk bakteroid dan menghasilkan stimulan yang merangsang sel kortek untuk membelah. Pembelahan tersebut menyebabkan proliferasi jaringan, membentuk struktur bintil akar yang menonjol sampai keluar akar tanaman, yang mengandung bakteri rhizobium.
Semua rhizobia adalah bakteri aerobik yang bertahan secara saprofit di dalam tanah sampai mereka menginfeksi bulu akar (Salisbury dan Ross, 1995). Pembentukan bintil akar yang efektif bersimbiose melibatkan signal antara tanaman (macrosimbiont) dan bakteri (microsymbion). Flavonoids dan/atau isoflavonoids dilepaskan dari akar tanaman leguminosa induk semang membuat transkrip dari gene rhizobia bintil akar yang sesuai, kemudian membentuk molekul lipochitooligosaccharide, yang memberi tanda pada tanaman leguminosa untuk mulai membentuk bintil akar (Long, 1996).
Bakteri Rhizobium yang masuk ke dalam sel akar melalui epidermis akar dan membentuk formasi bintil akar melalui pengaturan ulang perkembangan sel luar akar (Limpens dan Bisseling, 2003). Keberhasilan interaksi ini memerlukan koordinasi dari kedua proses tersebut. Secara umum, proses infeksi dimulai dengan pengeritingan rambut akar, yang diduga disebabkan oleh reorientasi gradual dan konstant arah pertumbuhan bulu akar (Emons dan Mulder, 2000 dalam Limpens dan Bisseling, 2003). Bakteria tertangkap dalam gulungan bulu akar, kemudian dinding sel tanaman ditempat tertentu terdegradasi, sel membran membentuk liang dan material baru disimpan oleh tanaman dan bakteri.
Enzim dari bakteri merombak bagian dinding sel sehingga bakteri dapat masuk ke dalam sel bulu akar. Kemudian, bulu akar membentuk struktur lir-benang yang disebut benang infeksi, yang terdiri dari membran plasma lurus dan memanjang dari sel yang terserang, bersamaan dengan pembentukan selulosa baru di sebelah dalam membran ini. Bakteri tersebut membelah dengan cepat di dalam benang yang menjalar masuk dan menembus melalui dan di antara sel korteks. Di sel korteks sebelah dalam, bakteri dilepas ke dalam sitoplasma dan merangsang beberapa sel (khususnya sel tetraploid) untuk membelah. Pembelahan ini menyebabkan proliferasi jaringan, membentuk bintil akar dewasa, yang terbuat sebagian besar dari sel tetraploid yang mengandung bakteri dan beberapa sel diploid tanpa bakteri (Salisbury dan Ross, 1995). Tiap bakteri yang
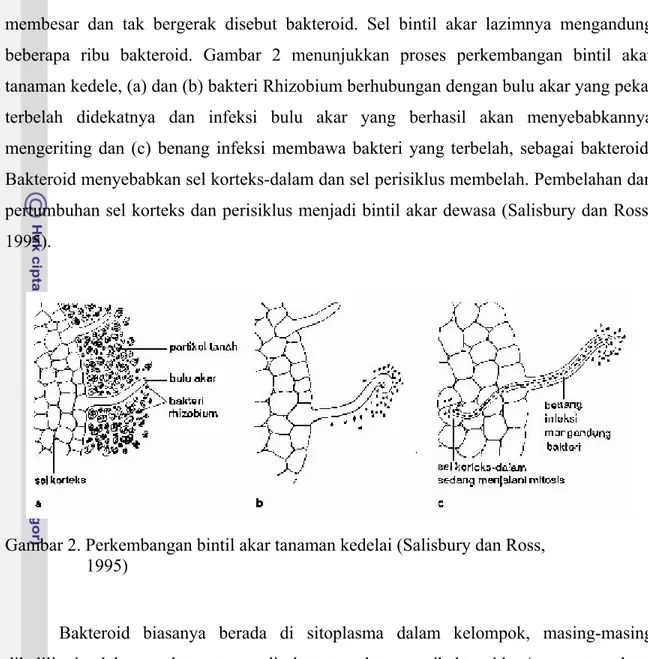
membesar dan tak bergerak disebut bakteroid. Sel bintil akar lazimnya mengandung beberapa ribu bakteroid. Gambar 2 menunjukkan proses perkembangan bintil akar tanaman kedele, (a) dan (b) bakteri Rhizobium berhubungan dengan bulu akar yang peka, terbelah didekatnya dan infeksi bulu akar yang berhasil akan menyebabkannya mengeriting dan (c) benang infeksi membawa bakteri yang terbelah, sebagai bakteroid. Bakteroid menyebabkan sel korteks-dalam dan sel perisiklus membelah. Pembelahan dan pertumbuhan sel korteks dan perisiklus menjadi bintil akar dewasa (Salisbury dan Ross, 1995).
Gambar 2. Perkembangan bintil akar tanaman kedelai (Salisbury dan Ross, 1995)
Bakteroid biasanya berada di sitoplasma dalam kelompok, masing-masing dikelilingi oleh membran yang disebut membran peribakteroid. Antara membran peribakteroid dan kelompok bakteroid terdapat daerah yang disebut ruang peribakteroid. Di luar ruang peribakteroid, di sitoplasma tumbuhan, terdapat protein yang dinamakan leghemoglobin (Appleby, 1984 dalam Salisbury dan Ross, 1995).
Kemampuan penambatan N secara biologis untuk mengkonversi N2 menjadi N organik adalah sangat substansial, sering mencapai 100 kg per ha -1tahun -1 yang lebih dari cukup untuk mempertahankan kebutuhan N dan mengganti N yang hilang (Vitousek et al. 2002).
Penelitian tentang inokulasi bakteri rhizobia pada tanaman leguminosa tidak selalu berhasil dengan baik, bahkan sering mengalami kegagalan. Hal ini kemungkinan disebabkan oleh berbagai faktor antara lain rendahnya kemampuan bakteri inokulan
untuk bersaing dengan bakteri yang alami (Triplet dan Sadoswky, 1992); rendahnya konsentrasi dari bakteri inokulan (Nambiar et al. 1987). Faktor yang juga mempengaruhi perkembangan dan aktifitas rhizobium di dalam tanah antara lain kelembaban, aerasi, suhu, kandungan bahan organik, kemasaman tanah, suplai hara anorganik, jenis tanah dan persentase pasir serta liat (Alexander, 1977). Tekstur tanah berpasir dengan bahan organik rendah mengurangi penambatan N di dalam tanah. Tekstur tanah liat berat dengan bahan organik rendah mengurangi aktifitas dan efektivitas bakteri rhizobium dalam membentuk bintil akar dan pada akhirnya mempengaruhi penambatan N (Kentjanasari et. al. 1998).
Lynch (1983) mengatakan bahwa efektivitas bakteri rhizobium hilang pada kondisi tanah yang anaerob.
Subowo et al. (1989) melaporkan bahwa penurunan populasi rhizobium pada tanah dengan perlakuan inokulasi legin lebih tajam dibandingkan dengan perlakuan tanpa legin. Keadaan ini menunjukkan bahwa daya adaptasi rhizobium inokulan yang merupakan mikroorganisme masukan lebih rendah dibandingkan dengan rhizobia alami.
Melalui penelitian sejak tahun 1980, Balitbio telah menghasilkan formulasi pupuk mikroba multiguna (PMMG) yang diberi nama Rhizo-plus. Keunggulan Rhizo-plus dibandingkan dengan pupuk mikroba lain yang sejenis yaitu: merupakan mixed microbial fertilizer mengandung mikroba efektif mengikat N udara dan melarutkan fosfat serta dilengkapi dengan unsur hara mikro dan zat pemacu tumbuh yang diperlukan oleh mikroba dan tanaman (Suhaya et al. 1999). Dengan demikian aplikasi pupuk mikroba Rhizo-plus merupakan salah satu cara yang dapat mengurangi penggunaan pupuk kimia khususnya Urea dan TSP/Sp36 dalam upaya meningkatkan produktivitas tanaman sehingga dapat menekan biaya produksi.
Penelitian di daerah Pati, Magetan, Banyumas, Pasuruan, Cianjur dan Pandeglang menunjukkan bahwa penggunaan Rhizo-plus pada tanaman kedele selain dapat menekan penggunaan Urea sampai 100% dan mengurangi penggunaan TSP/SP36 sampai 50% ternyata juga dapat menekan kebutuhan kapur pertanian sebesar 50% (Herman dan Goenadi, 1999). Saraswati et al. (1998) melaporkan bahwa dengan menggunakan Rhizo-plus pada tanaman kedele dapat menghemat biaya produksi sebesar Rp. 50.000 per hektar dan meningkatkan produksi antara 2,45-57,48%, serta keuntungan yang diperoleh petani
naik rata-rata Rp. 292.000 per hektar. Selanjutnya Suhaya et al. (1999) melaporkan bahwa di desa Karya Mukti Kecamatan Rimbo Melintang Kabupaten Rokan Hilir sebagai salah satu sentra produksi kedelai di Propinsi Riau, penggunaan Rhizo-plus dapat meningkatkan efisiensi usahatani yaitu dapat menekan biaya produksi sebesar Rp 172.000 per hektar dan peningkatan hasil sampai 11,86% pada varitas Argomulyo dibandingkan dengan pupuk lengkap sesuai anjuran setempat.
Molibdenum
Berdasarkan jumlah kebutuhan, unsur hara tanaman diklasifikasikan ke dalam dua kelompok besar yaitu unsur hara makro yaitu hidrogen (H), karbon (C), Oksigen (O), Nitrogen (N), fosfor (P), kalium (K), sulfur (S), kalsium (Ca), magnesium (Mg) dan sulfur (S) yang diperlukan relatif dalam jumlah besar serta unsur hara mikroyaitu molibdenum (Mo), tembaga (Cu), seng (Zn), mangan (Mn), boron (B), besi (Fe) dan klor (Cl) ) yang diperlukan dalam jumlah relatif sedikit (Rosmarkam dan Yuwono, 2002; Gardner et al. 1991).
Gardner et al. (1991) mengemukakan bahwa molibdenum mungkin berasal dari pelapukan sejumlah mineral yang meliputi MoS2 (tereduksi), komplek oksida seperti CaMoO4, dan bentuk terhidrasi. Mo diserap dalam bentuk anion divalen (MoO42-).
Gupta dan Vyas (1994) melaporkan bahwa molibdenum merupakan komponen meta-protein nitrogenase dan membantu proses penambatan nitrogen. Selanjutnya, Salisbury dan Ross (1995), mengemukakan bahwa fungsi molibdenum dalam tumbuhan yang paling dikenal baik adalah menjadi bagian dari enzim nitrat reduktase yang mereduksi ion nitrat menjadi ion nitrit. Mo berperan sebagai katalitis dan hanya ada dalam satu atau beberapa senyawa (enzim) saja.
Mo berperan dalam enzim nitrit reduktase dan nitrat reduktase (Gardner et al.1991). Peran Mo adalah sebagai suatu carrier (alat pengangkut) elektron antara tahap teroksidasi dan tahap reduksi. Selanjutnya Vitousek et al. (2002) mengemukakan bahwa untuk berfungsi dengan baik nitrogenase memerlukan unsur hara Molibdenum. Bakteri penambat N mungkin juga memerlukan lebih banyak unsur hara P dan Fe dibandingkan dengan organisme lain. Molibdenum merupakan komponen yang sangat esensial bagi dua co-factor yang diperlukan untuk metabolisme N bakteria (Thiel et al. 2002). Mo-nitrogenase memerlukan suatu cofaktor berupa iron-molybdenum (Newton, 1992 dalam
Thiel et al. 2002). Selanjutnya Rosmarkam dan Yuwono (2002) mengemukakan bahwa fungsi Mo dalam tanaman adalah mengaktifkan enzim nitrogenase, nitrat reduktase, dan xantine oksidase.
Mendel dan Hansch (2002) mengemukakan bahwa elemen molibdenum esensial hampir pada semua organisme dan terdapat pada lebih dari 40 enzim katalisator berbagai reaksi redox. Empat jenis ditemukan pada tanaman yaitu (1) Nitrate reductase katalisator yang merupakan kunci awal pada assimilasi inorganik nitrogen; (2) aldehyde oxidase(s) yang berperan sebagai katalisator dalam proses akhir biosintesa phytohormone abscisic acid; (3) xanthine dehydrogenase yang terlibat dalam katabolisme purine dan reaksi stress dan (4) sulphite oxidase yang kemungkinan terlibat dalam detoksifikasi ekses sulphite (Mendel dan Hansch, 2002).
Mo merupakan elemen yang sangat jarang (Fortescue, 1992 dalam Mendel dan Hansch, 2002). Oksidasi Mo dalam tanah bervariasi dari II hingga IV, tetapi hanya bentuk soluble Mo (IV) yang tersedia bagi tanaman. Defisiensi unsur hara Mo telah dilaporkan terjadi pada beberapa spesies tanaman (Gupta, 1997 dalam Mendel dan Hansch, 2002). Kemungkinan gejala defisiensi Mo pada tanaman sangat bervariasi dan gejala yang sering timbul adalah klorosis atau daun berwarna kekuning-kuningan (Mendel dan Hansch, 2002). Gejala yang timbul karena kekurangan Mo hampir menyerupai kekurangan N. Kekurangan Mo dapat menghambat pertumbuhan tanaman, daun menjadi pucat dan mati, pembentukan bunga terlambat, dan pembentukan benang sari berkurang (Rosmarkam dan Yuwono, 2002). Gejala defisiensi Mo umumnya terdapat pada tanah asam. Pada tanah asam umumnya kadar Fe, Al, dan kadang-kadang Mn berlebihan (toksis). Oleh karena itu, gejala defisiensi Mo sering bergabung dengan adanya gejala keracunan Fe3+ dan Mn2+.
Molibdenum merupakan salah satu unsur hara mikro yang diperlukan untuk pertumbuhan dan perkembangan tanaman. Penambahan unsur hara Mo dapat meningkatkan produksi sebesar 28% pada tanaman Arachis hypogaea dan kandungan N daun lebih tinggi (Quaggio et al. 2004). Molibdenum merupakan bagian dari enzim nitrogenase, yang esensial dalam proses penambatan nitrogen, sehingga defisiensi Molibdenum lebih sering ditemukan pada tanaman leguminosa (Bailey dan Laidlaw, 1999 dalam Quaggio et al. 2004).
Rosmarkam dan Yuwono (2002) melaporkan bahwa ketersediaan Mo dalam tanah dipengaruhi oleh adanya pengapuran, perubahan suasana reduksi oksidasi, mikroorganisme, dan harkat Mo tersedia. Hakim et al. (1986), mengemukakan bahwa keadaan tanah sangat mempengaruhi ketersediaan unsur hara molibdenum. Ketersediaannya sangat dipengaruhi oleh pH tanah. Pada pH rendah hampir tidak ada molibdenum yang tersedia. Selanjutnya Rosmarkam dan Yuwono (2002) mengemukakan bahwa Mo yang larut dalam air sangat sedikit (<0,1 ppm) dan kelarutannya dipengaruhi oleh pH tanah. Makin rendah pH tanah, makin rendah pula tingkat kelarutannya dan sebaliknya. Hal ini diduga karena makin rendah pH makin tinggi kelarutan Fe dan Al (seskuioksida) yang kemudian Fe ini mengikat Mo. Ikatan ini tergolong kuat sehingga tidak tersedia untuk tanaman. Ion MoO4- sebagai anion terikat sering menyelimuti lempung yang bermuatan negatif pada permukaan luarnya. Ketersediaan Mo meningkat dengan meningkatnya pH, sehingga pemberian kapur meningkatkan ketersediaan Mo (Gardner et al. 1991).
Tanah asam yang disebabkan antara lain oleh meningkatnya hujan asam dan pemupukan N secara terus menerus, menghambat produksi tanaman leguminosa (Graham dan Vance, 2000). Konsentrasi ion H per se, keracunan Al dan Mn, dan defisiensi P, Mo atau Ca berkontribusi terhadap penurunan produksi leguminosa (Graham, 1992). Nodulasi dan ketahanan hidup rhizobia dalam tanah terutama dipengaruhi oleh kondisi keasaman tanah (Graham dan Vance, 2003).
Sifat unsur hara ini sangat mobil di dalam tanah. Jumlah Mo dalam tanah sangat sedikit yaitu berkisar antara 0,2 hingga 10 ppm dan umumnya antara 0,5 hingga 3,5 ppm (Hakim et al. 1986). Jumlah ini relatif lebih banyak pada tanah liat daripada tanah pasir dan tanah organik. Mengel dan Kirby (1987) dalam Rosmarkam dan Yuwono (2002) mengemukakan kisaran kadar Mo dalam berbagai jenis tanah yaitu Marsh 0,17-1,4 ppm; Podsolik kelabu coklat 0,1-0,5 ppm, Gambut 0,1-0,5 ppm; dan Podsolik coklat 0,09-0,36 ppm. Menurut Rosmarkam dan Yuwono (2002) harkat Mo dalam tanah adalah sangat tinggi bila lebih besar dari 1,50 ppm; tinggi 1,10-1,50 ppm; sedang 0,51-1,00 ppm, rendah 0,11-0,50 ppm dan sangat rendah bila lebih rendah dari 0,10 ppm.
Tanah-tanah yang sering mengalami kekurangan Mo adalah dicirikan oleh (a) tanah pasir, (b) tanah yang mengalami podsolisasi, dan (c) tanah yang banyak mengandung
sulfat. Hubungan antara serapan Mo dengan ketersediaan sulfat adalah keterbalikan. Pada keadaan dimana menurunnya sulfat, maka ini berarti serapan Mo akan meningkat. Kadar Mo yang tinggi dalam tanaman akan mempengaruhi translokasi Fe dari akar ke bagian atas tanaman (Hakim et al. 1986).
Salisbury dan Ross (1995), mengemukakan bahwa molibdenum banyak terdapat di tanah sebagai garam molibdat (MoO4) dan juga sebagai MoS2. Pada bentuk pertama Mo berada dalam keadaan tereduksi Mo6+, tapi berbentuk Mo4+ pada garam sulfida. Rosmarkam dan Yuwono (2002) mengemukakan bahwa Mo diserap dalam bentuk ion MoO4-.
Rosmarkam dan Yuwono (2002) mengemukakan bahwa Mo dapat membentuk kompleks dengan bahan organik tanah. Ikatan ini dikenal dengan khelat yang bermanfaat melindungi Mo dari fiksasi oleh lempung. Senyawa organik yang mengikat Mo tersebut adalah gugus ortho hidroksil yang meliputi alkohol, phenol, asam hidroksi dan asam organik mono basis. Mo dalam tanah juga dapat bergabung dengan senyawa yang mengandung N, misalnya tirosin, tiramin, lisitin, dan protein.
Penambahan unsur hara Mo sebesar 0,45 kg ha-1 dalam bentuk sodium molybdate secara nyata meningkatkan jumlah bintil akar dan produksi pigeon pea (Khurana dan Dudeja, 1981 dalam Wani et al., 1995), sedangkan penambahan 1 kg cobalt chloride, 1 kg sodium molybdate dan 25 kg ZnSO4 ha-1 meningkatkan produksi chickpea berturut-turut sebesar 10, 7 dan 4% dibandingkan kontrol (Wani et al. 1995).
Enzim nitrogenase
Enzim adalah protein katalisator untuk reaksi-reaksi kimia pada sistem biologi. Sebagian besar reaksi sel-sel hidup akan berlangsung sangat lambat bila reaksi tersebut tidak dikatalisis oleh enzim. Enzim adalah katalisator yang reaksi-spesifik karena semua reaksi biokimia perlu dikatalisis oleh enzim.
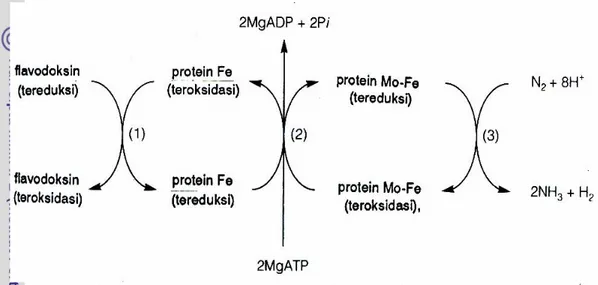
Salisbury dan Ross (1995) mengemukakan bahwa nitrogenase terdiri dari dua protein yang berlainan, sering disebut protein Fe dan protein Fe-Mo. Protein Fe-Mo mempunyai 2 atom molibdenum dan 28 atom besi; protein Fe mengandung 4 atom besi dari kelompok Fe4S4. Baik molibdenum maupun besi menjadi tereduksi dan kemudian dioksidasi saat nitrogenase menerima elektron dari feredoksin dan mengangkutnya ke N2 untuk membentuk NH4+. ATP penting untuk penambatan karena menempel pada protein
Fe dan menjadikan protein tersebut bahan pereduksi yang lebih kuat. Protein Fe mengangkut elektron ke protein Fe-Mo, disertai dengan hidrolisis ATP menjadi ADP. Protein Fe-Mo kemudian meneruskan pengangkutan elektron menuju N2 dan menuju proton untuk membuat dua NH4 dan satu H2 (Gambar 3).
Gambar 3 : Ikhtisar pengangkutan elektron dari flavodoksin tereduksi ke N2 dan H+ di tiga tahap utama (Salisbury dan Ross, 1995)
Shilov (1992) mengemukakan bahwa nitrogenase yang diisolasi dari berbagai bakteri penambat nitrogen terdiri dari dua protein yaitu Fe protein (ca. 60 kD) dan MoFe protein (ca. 230 kD). Fe protein terdiri dari satu Fe4S4 cluster, sedangkan MoFe protein terdiri dari dua FeMo cofactors dan empat Fe4S4 cluster (P-cluster).
Enzim nitrogenase sangat sensitif terhadap oksigen (Salisbury dan Ross, 1995), karena protein Fe dan protein Fe-Mo dari nitrogenase didenaturasi secara oksidatif oleh oksigen. Leghemoglobin mengendalikan sebagian ketersediaan oksigen di dalam bakteroid, tetapi sifat anatomi yang rumit dari bakteroid itu sendiri (seperti korteks dan endodermis yang mengelilingi berkas pembuluh dan sel yang mengandung bakteroid) nampak jauh lebih penting untuk mempertahankan tingkat oksigen yang rendah di sekitar nitrogenase dengan bertindak sebagai pembatas difusi ke udara di dalam tanah.
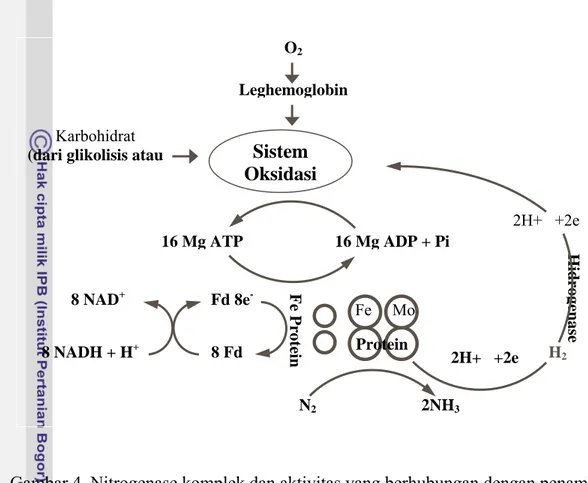
Moat dan Foster (1988) mengemukakan bahwa nitrogenase terdiri dari dua protein yang sensitif terhadap oxygen, yaitu molibdenum iron protein (dinitrogenase) dan iron – sulfur protein (dinitrogen reductase). Kedua protein ini bersama dengan ATP, Mg2+ dan electron, adalah esensial dalam aktivitas penambatan nitogen (Gambar 4). Secara umum
proses penambatan nitrogen memerlukan energi sekitar 12 – 16 molekul ATP dan 6-8 electron.
Gambar 4. Nitrogenase komplek dan aktivitas yang berhubungan dengan penambatan nitrogen (Moat dan Foster, 1988)
Jumlah leghemoglobin dan luasnya jaringan bakteroid pada bintil akar berhubungan dengan jumlah N2 yang tertambat oleh tanaman leguminosa (Moat dan Foster, 1988).
Reaksi katalisis oleh enzim nitrogenase membutuhkan energi dalam bentuk ATP dan reduktan. Kebutuhan ATP dan reduktan dipenuhi dari hasil fotosintesis yang ditranslokasikan dari daun ke bintil akar. Pasangan enzim nitrogenase menghidrolisis ATP menjadi ADP dengan memindahkan elektron dari reduktan untuk mereduksi N2 menjadi NH3 (Yousafzai et al. 1996). Persamaan keseluruhan dari proses penambatan N2 dapat ditulis sebagai berikut (Salisbury dan Ross 1995; Moat dan Foster, 1988):
N2+ 8e + 16 MgATP + 16 H2O 2 NH3 + H2+16 MgADP+ 16 Pi + 8 H+
O2 Leghemoglobin Karbohidrat
(dari glikolisis atau Sistem
Oksidasi 16 Mg ATP 16 Mg ADP + Pi 8 NAD+ 8 NADH + H+ 8 Fd Fd 8e -N2 2NH3 2H+ +2e H2 2H+ +2e Fe Protein Hidro g enase Fe Mo Protein
Proses tersebut memerlukan sumber elektron dan proton yang bersumber dari karbohidrat, dan molekul ATP. Juga diperlukan kompleks enzim yang disebut nitrogenase, yang mengkatalisis reduksi beberapa substrat lain seperti asetilen (Salisbury dan Ross, 1995). Reduksi asetilen menjadi etilen sering diukur sebagai perkiraan laju penambatan nitrogen.
Nitrogenase yang dihasilkan oleh Rhizobium dalam bintil akar akan mengkatalisis N2 menjadi NH3 dan C2H2 menjadi C2H4. Aktivitas nitrogenase biasanya diekspresikan dalam µmol C2H4 (Sprent dan Sprent, 1990). Efisiensi penambatan nitrogen dapat diukur dengan Acetylene (C2H2) Reduction Assay (ARA) dan nilai ARA dihitung dari banyaknya etilen (ethelene, C2H4) yang dihasilkan dari C2H2 (Hardy et al. 1968). ARA terutama digunakan untuk mengetahui pengaruh perlakuan terhadap penambatan nitrogen dan bukan untuk memperkirakan jumlah nitrogen yang ditambat (Herridge dan Danso, 1995).
Kardinahl et al. (1999) mengemukakan bahwa molibdenum yang terdapat dalam enzim berperan sangat penting dalam sistem biologi dan berfungsi penting dalam berbagai proses metabolisme. Secara umum enzim molibdenum ditemukan dalam dua bentuk yaitu yang terintegrasi dengan multinuclear iron-centres seperti yang terdapat pada enzim nitrogenase dan yang berkoordinasi dengan pterin moiety dalam bentuk molybdopterin cofactors.
Nitrate reductase (EC 1.6.6.1) adalah suatu cytoplasmic enzyme dan mempunyai massa molekul sebesar 200 kDa pada dimer (Mendel dan Hansch, 2002). Monomer dari nitrate reductase tanaman terdiri dari tiga fungsional domain yaitu N-terminal domain berhubungan dengan Moco, central haem domain dan C-terminal FAD-domain, masing-masing redox-active prosthetic group dihubungkan ke monomer dengan rasio 1:1:1 (Campbell, 1999 dalam Mendel dan Hansch, 2002). Nitrate reductase katalisator merupakan langkah pertama dalam asimilasi nitrate dan merupakan kunci utama untuk nutrisi tanaman (Mendel dan Hansch, 2002). Regulasi dari asimilasi nitrate merupakan bagian dari suatu kerjasama yang sangat komplek untuk merespon berbagai signal dari lingkungan ataupun internal tanaman seperti nitrate, cahaya, CO2, phytohormone, dan metabolisme karbon dan nitrogen dengan tujuan untuk menghubungkan asimilasi nitrate dengan kunci proses metabolisme lainnya. Pada tanaman kedele aktifitas nitrate reductase
pada bakteroids mencapai 90% dari total nitrate reductase bintil akar (Lucinski et al. 2002), sehingga terdapat nitrite yang bersifat toksik sebagai produk dari nitrate reductase, yang diduga menyebabkan penurunan aktifitas nitrogenase.
Konsentrasi oksigen bebas dalam bintil akar merupakan faktor utama yang mempengaruhi aktivitas enzim nitrogenase (Layzell dan Hunt, 1990 dalam Lucinski et al. 2002). Ketersedian oksigen di daerah bintil akar yang terinfeksi diatur oleh tanaman (Minchin, 1997 dalam Lucinski et al. 2002), ketersediaan leghemoglobin dan dibatasi oleh diffusion resistance (Appelby, 1984).
Nitrate membatasi aktivitas nitrogenase pada bintil akar (Lucinski et al. 2002). Pengaruh nitrate terhadap simbiose antara leguminosa dan rhizobia antara lain adalah peranan ketersediaan nitrate selama proses infeksi pada akar; hubungan antara ketersediaan nitrate dan aktivitas nitrogenase; dan pengaruh nitrate terhadap ratio antara massa nodule dengan massa seluruh tanaman (Streeter,1988 dalam Lucinski et al. 2002).
Tanaman Leguminosa Pakan Ternak dalam Pertanian
Kemampuan tanaman leguminosa untuk menambat nitrogen sangat bervariasi. People et al. (1995) mengemukakan bahwa kondisi percobaan jumlah nitrogen yang ditambat berkisar antara 1 – 380 kg N ha-1 (Tabel 2).
Tabel 2. Perkiraan jumlah N2 yang ditambat oleh tanaman leguminosa
Spesies Jumlah N2 yang
ditambat (kg N ha-1)
Waktu pengukuran
Arachis pintoii 1-7 84 hari
Calopogonium spp 64 - 182 setahun
Centrosema spp 41 – 43 119 hari
67 – 280 setahun
Clitoria ternatea 197 – 249 190-195 hari
Desmodium spp 24 – 380 setahun
Desmanthus virgatus 193 – 228 190-195 hari
Macroptilium atropurpureum cv.
Siratro 15 – 167 setahun
Pueraria spp 9 – 115 72-199 hari
Stylosnthes spp 2 – 75 63-77 hari
20 – 263 setahun
Zornia glabra 61 119 hari
Thomas (1995) mengemukakan bahwa tanaman leguminosa mempunyai kapasitas untuk memenuhi kebutuhan nitrogen melalui penambatan nitrogen dari udara. Efisiensi penambatan nitrogen (% kebutuhan N tanaman yang diperoleh dari penambatan nitrogen) umumnya sangat tinggi di daerah tropis dan dapat mencapai 80%. Namun demikian kemampuan ini akan menurun apabila terjadi kekurangan unsur hara yang diperlukan oleh tanaman leguminosa, dengan kata lain, penambatan N2 hanya akan optimal bila semua unsur hara yang diperlukan tanaman optimal kecuali hara N
Arachis pintoi Krap.& Greg, tanaman ini berasal dari lembah Jequitinhonha, San Fransisko dan pinggiran sungai Tocantins Brazil (t’Mannetje dan Jones, 1992). Sejak dikoleksi pada tahun 1954, telah menyebar ke Argentina, Australia, Colombia dan Amerika Serikat, dan akhir-akhir ini ke daerah Asia Tenggara, Amerika Tengah dan Pasifik. Arachis merupakan salah satu leguminosa herba yang hidupnya menahun dan diharapkan mempunyai potensi sebagai sumber hijauan makanan ternak. Tanaman ini tumbuh baik diberbagai tipe tanah, mulai dari tanah ringan yang beririgasi baik sampai tanah berat berlapis batu atau tanpa irigasi. Prawiradiputra et al. (2003) melaporkan daya tumbuh tanaman leguminosa herba yang ditanaman di lokasi penelitian Subang tertinggi terdapat pada tanaman Arachis glabrata dan Arachis pintoii. Dari hasil evaluasi di Sulawesi dan Nusa Tenggara Timur, Arachis merupakan salah satu spesies yang mempunyai performans bagus, dilihat dari daya tahannya terhadap kekeringan, penggembalaan, pemotongan, hama dan penyakit (Nulik et al. 1986; Rustam dan Jacobsen, 1986). Penelitian adaptasi Arachis yang dilakukan di Balai Penelitian Ternak Ciawi didapatkan dari 20 jenis Arachis yang ditanam dan mempunyai prospek baik untuk dikembangkan adalah Arachis hybrid IRFL 3014, Arachis glabrata cv.florigraze, Arachis sp IRFL 3059 dan 3064, dengan produksi hijauan segar rata-rata pertahun 12-19 ton/ha (3-6 ton/ha bahan kering) dengan kandungan protein kasar berkisar antara 15,9-19,2% (Yuhaeni, 1989). Arachis spp. Termasuk jenis tanaman leguminosa herba yang dapat berkembang biak dengan kemampuan menyebar yang luas melalui rhizoma atau stolon dan ini sangat menguntungkan dalam perbanyakan tanaman. Kemampuan ini terbukti dengan meningkatnya produksi hijauan dari tahun ke tahun dan tidak dipengaruhi oleh musim. Di samping itu sifat adaptasinya cukup baik dan tahan terhadap gangguan hama, penyakit dan kekeringan. Walaupun musim kemarau panjang, tanaman tetap berdaun
segar dan berproduksi. Suratmini et al. (1994) melaporkan bahwa berat segar dan berat kering tanaman Arachis meningkat dengan adanya inokulasi Rhizobium yang dikombinasi dengan pupuk PK dan pengapuran. Namun demikian, Arachis glabrata cv. Florigraze dan Arachis sp. IRFL 3053 yang diinokulasi dengan strain Rhizobium CB 756 tidak ditemukan adanya bintil akar, sehingga perlu dilakukan suatu penelitian untuk evaluasi inokulan yang dapat membentuk bintil akar pada tanaman tersebut.
Clitoria ternatea L merupakan leguminosa pakan ternak yang palatable dan lebih disenangi ternak dibandingkan leguminosa lainnya (Gomez dan Kalamani, 2003; Rout, 2004). Pertumbuhan kembali sangat baik setelah di potong atau di rumput, bertumbuh dalam waktu yang relatif singkat, dan produksi cukup tinggi. Clitoria ternatea termasuk ke dalam family Fabaceae dan terdistribusi di Asia, Philippine, Madagaskar (Rout, 2004) Afrika dan Amerika Tengah (Hall, 1992), kepulauan Pasifik (t’Mannetje dan Jones, 1992). Tanaman ini dapat ditanam dengan tanaman lainnya sebagai cover crops, atau sebagai green manure dan tanaman obat. (Gomez dan Kalamani, 2003; Rout, 2004). Prawiradiputra et al. (2003) melaporkan bahwa ditinjau dari pertumbuhan tanaman di lokasi penelitian Subang, maka jenis yang terbaik adalah Clitoria ternatea. Pada saat kekeringan tanaman Clitoria ternatea terlihat masih segar.
Macroptilium atropurpureum (DC.) Urban terdapat di Meksiko utara hingga Kolumbia dan Brasil utara, dan merupakan spesies leguminosa pertama yang tersedia secara komersial. Kultivar Siratro saat ini telah menyebar luas di daerah tropis dan subtropis. Tanaman ini biasanya digunakan sebagai pastura atau diintroduksikan sebagai tanaman campuran dengan rumput alam dan sebagai cover crops. (t’Mannetje dan Jones, 1992). Prawiradiputra et al. (2003) melaporkan daya tumbuh tanaman Macroptilium cv. Siratro di lokasi penelitian Subang tergolong rendah. Pada saat kekeringan tanaman tanaman Siratro terlihat layu.
Kedelai merupakan tanaman semusim, berupa semak rendah, tumbuh tegak, berdaun lebat dengan beragam morfologi (Hidajat, 1985). Tinggi tanaman berkisar antara 10 sampai 200 cm, dapat bercabang sedikit atau banyak tergantung kultivar dan lingkungan hidup. Nama botani kedelai yang dibudidayakan adalah Glycine max (L.) Merill dengan klasifikasi ordo Polypetales; famili Leguminosae; sub-famili Papilionoideae; genus Glycine; sub-genus Soja; species max
Kon et al. (1990) melaporkan bahwa di Malaysia tanaman jagung dan kacang-kacangan akan lebih baik hasilnya apabila ditanam di antara tanaman glirisidia, kaliandra dan albizia. Selanjutnya Grant et al. (2002) mengemukakan bahwa sistem pertanaman yang mengikut sertakan tanaman leguminosa berpotensi tinggi untuk mengkontribusi N untuk tanaman berikutnya, dan tingkat NO3 yang moderat dalam tanah sehingga dapat mengurangi pencucian unsur hara nitrogen.