–72–
Studi Kesetimbangan Adsorpsi Zat Warna Tekstil
Remazol Brilliant (RB) Red F3B pada Selulosa
Jerami Padi
Muhammad Ali Zulfikar, Tri Widiyansyah, Saepudin Suwarsa
KK Kimia Analitik, Institut Teknologi Bandung
Jl. Ganesa 10, Bandung 40132 zulfikar@chem.itb.ac.id
Abstrak
Tujuan penelitian ini adalah menentukan kesetimbangan adsorpsi zat warna reaktif Remazol Brilliant Red F3B (RBRF3B) pada selulosa jerami padi sebagai adsorben pada berbagai konsentrasi. Konsentrasi zat warna yang digunakan divariasikan antara 10-200 mg L-1. Data yang diperoleh dari hasil eksperimen kemudian dianalisis
menggunakan model isoterm Langmuir, Freundlich dan Sips. Hasil penelitian menunjukkan bahwa waktu kesetimbangan adsorpsi terjadi pada waktu 120 menit dan kapasitas adsorpsi selulosa jerami padi meningkat dengan meningkatnya konsentrasi zat warna. Dari hasil penelitian ditemukan bahwa proses adsorpsi zat warna RBRF3B pada selulosa jerami padi mengikuti model isoterm adsorpsi Freundlich. Dengan menggunakan model isoterm Sips ditemukan bahwa faktor heterogenitas selulosa jerami padi adalah sebesar 0,386. Dari model isoterm Langmuir diketahui bahwa kapasitas adsorpsi maksimum selulosa jerami padi terhadap zat warna RBRF3B adalah sebesar 37,40 mg g-1 pada konsentrasi 100 mg L -1.
Kata kunci: Adsorpsi, Isoterm, Kesetimbangan, RBRF3B, Selulosa.
a. Pendahuluan
Beberapa industri, seperti tekstil, karet, kertas, plastik, kosmetik menggunakan zat warna untuk memberikan warna pada produk yang dihasilkannya (Abdullah et al., 2005; Binupriya et al., 2008; Namasivayam and Kavitha, 2002). Zat warna sintesis merupakan salah satu pencemar yang seringkali ditemukan pada limbah industri yang menggunakan zat warna tersebut. Penghilangan zat warna dari limbah tersebut sangat penting dilakukan, karena pada konsentrasi yang rendah zat warna tersebut bersifat mutagenic dan carsinogenic pada manusia (Binupriya et al., 2008; Chatterjee et al., 2009a; 2009b; Chen and Zhao, 2009; Ehrampoush et al., 2011; Elkady et al., 2011; Kannan and Meenakshisundaram, 2002). Selain itu adanya zat warna dalam air menyebabkan penetrasi cahaya matahari ke dalam air berkurang, sehingga mempengaruhi kehidupan makhluk air lainnya (Amran and Zulfikar, 2010; Chatterje et al., 2009b; 2010; Mumin et al., 2007; Patil and Shrivastava, 2010). Oleh karena zat warna yang terdapat di dalam limbah mempunyai sifat tidak terbiodegradasi, stabil terhadap cahaya, panas dan zat pengoksidasi (Ozcan et al., 2005; Amran and
–73–
Zulfikar, 2010; Chatterjee et al., 2010; Vimonses et al., 2009; Wang and Wang, 2008a) dan sangat beracun, menyebabkan pengolahan limbah yang mengandung zat warna menjadi sukar. Sejumlah teknologi telah dikembangan dan telah digunakan untuk menghilangkan zat warna dari air limbah, di antaranya koagulasi-flokulasi, oksidasi-ozonasi, fotokatalisis, biosorpsi, biodegradasi, elektrokimia dan osmosis balik (Chen and Zhao, 2009 ; Kim et al., 2004 ; Chatterjee et al., 2009a ; 2009b; 2010 ; Elkady et al., 2011 ; Pramanpol and Nitayapat, 2006; Vimonses et al., 2009 ; Wang and Wang, 2008b). Bagaimanapun, metoda tersebut mempunyai kelemahan, di antaranya biaya operasional tinggi, sehingga tidak ekonomis. Teknik adsorpsi merupakan teknik yang banyak digunakan untuk menghilangkan zat warna dari limbah, hal ini dikarenakan prosesnya sederhana, murah, lebih efektif dan mudah direcovery (Chatterjee et al., 2009a; 2009b; 2010; Chen and Zhao, 2009; Elkady et al., 2011; Han et al., 2008; Rachakornkij et al., 2004; Vimonses et al., 2009; Yavuz and Aydin, 2006).
Karbon aktif banyak digunakan sebagai adsorben, hal ini disebabkan karena karbon aktif sangat efektif dalam menghilangkan senyawa organik dan anorganik dari limbah, termasuk zat warna dan pigmen (Abdullah at al., 2005; Binupriya et al., 2008; Chatterjee et al., 2009a; 2009b; 2010; 2011; Ehrampoush et al., 2011; Elkady et al., 2011; Han et al., 2008; Kannan and Meenakshisundaram, 2002; Namasivayam and Kavitha, 2002; Patil and Shrivastava, 2010; Rachakornkij et al., 2004; Vimonses et al., 2009; Wang and Wang, 2008b; Zhang et al., 2011). Bagaimanapun juga, penggunaan karbon aktif sebagai adsorben mempunyai beberapa kelemahan, di antaranya harganya yang mahal dan sukar untuk diregenerasi (Abdullah et al., 2005; Binupriya et al., 2008; Chatterjee et al., 2009a; 2009b; 2010; Ehrampoush et al., 2011; Elkady et al., 2011; Kannan and Meenakshisundaram, 2002; Han et al., 2008; Jumasiah et al., 2006; Patil and Shrivastava, 2010; Rachakornkij et al., 2004; Vimonses et al., 2009; Wang and Wang, 2008b; Zhang et al., 2011). Oleh sebab itu penghilangan zat warna yang murah dari limbah industri yang murah secara ekonomi masih menjadi masalah hingga kini.
Hal ini mendorong dilakukannya pencarian dan penelitian mengenai adsorben yang lebih murah sebagai adsorben alternative pengganti karbon aktif. Beberapa adsorben alternatif telah diteliti untuk menghilangkan zat warna dari air, di antaranya adalah karbon aktif yang diproduksi dari dari limbah pertanian (Namasivayam and Kavitha, 2002; Jumasiah et al., 2006), clay (Vimonses et al., 2009; Mumin et al., 2007; Wang and Wang, 2008; Yavuz and Aydin, 2006; Amran and Zulfikar, 2010), abu terbang (Acemioglu, 2004), kulit jeruk (Namasivayam et al., 1996), red mud (Namasivayam and Arasi, 1997), biomassa (Binupriya et al., 2008), tumbuhan (Patil and Shrivastava, 2010), bagas tebu (Abdullah et al., 2005; Zhang et al., 2011), cangkang dan membran telur (Ehrampoush et al., 2011; Elkady et al., 2011; Pramanpol and Nitayapat, 2006; Tsai et al., 2006; Tao, 2011), limbah pertanian (Han et al., 2008; Rachakornkij et al., 2004; Reddy, 2006) kitosan dan turunannya (Chatterjee et al., 2009; 2011; Wang and Wang, 2008a), alga (Jayaraj, et al., 2011).
–74–
Pada penelitian ini, selulosa yang berasal dari jerami padi digunakan untuk menghilangkan zat warna RBRF3B dari larutannya. Pada penelitian ini akan dipelajari pengaruh konsentrasi terhadap penghilangan zat warna RBRF3B dari larutannya. Selain itu juga akan dipelajari isotherm adsorpsi penghilangan zat warna RBRF3B dari larutannya menggunakan model isoterm Langmuir, Freundlich dan Sips.
b. Metodologi
b.1 Alat dan Bahan
Spektrofotometer UV-Vis (Shimadzu 1601, Japan), neraca analitik (Sartorius, USA), shaker bath (Innova 3000, USA) dan pH meter (Orion, USA).
Jerami padi, NaOH (Sigma), H2SO4 (Sigma), aqua d.m dan zat warna Remazol
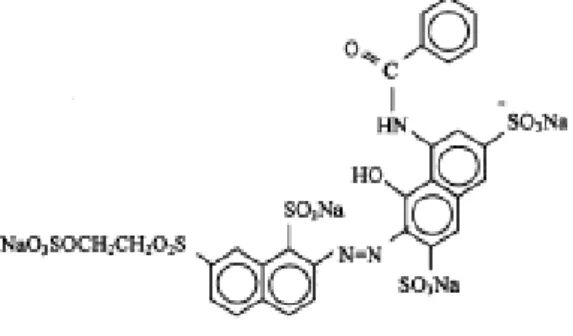
Brilliant Red F3B (RBRF3B) (Sigma-Aldrich). Struktur RBRF3B dapat dilihat pada Gambar 1.
Gambar 1. Struktur zat warna RBRF3B
2.2 Isolasi selulosa dari jerami padi
Isolasi selulosa dari jerami padi dilakukan dengan cara merendam 100 g jerami padi dalam larutan NaOH 20%. Campuran kemudian dipanaskan pada suhu 100 oC
selama 4 jam. Bubur selulosa yang dihasilkan kemudian disaring dan dibilas sehingga bebas NaOH dan dikeringkan pada suhu kamar dan disimpan dalam eksikator.
b.2 Eksperimen adsorpsi
Eksperimen adsorpsi dilakukan pada suhu kamar dalam gelas kimia 100 mL yang mengandung 1 g selulosa jerami padi dan 50 mL zat warna RBRF3B dengan sistem batch pada pH 7. Campuran diaduk menggunakan shaker bath (Innova 3000, USA) selama 2 – 200 menit pada konsentrasi 10, 20, 30, 40, 50, 75, 100, 150 dan 200 mg L -1. Persentase zat warna RBRF3B yang dapat dihilangkan dihitung menggunakan
persamaan berikut: % Penghilangan = i e i
C
C
C
x 100% (1)–75–
di mana Ci dan Ce adalah konsentrasi awal dan akhir zat warna RBRF3B dalam
larutan (mg L-1). Jumlah zat warna yang dapat diadsorpsi oleh per unit adsorben
pada kesetimbangan dengan volume sampel, dihitung menggunakan persamaan berikut:
qe = m
C
Ci e x V (2)
di mana V adalah volume sampel (L) dan m adalah massa adsorben (g) yang digunakan. Konsentrasi zat warna RBRF3B dalam larutan awal dan sesudah proses adsorpsi diukur menggunakan spektrofotometer UV-Vis (Shimadzu 1601, Japan) pada maksimum 538 nm.
c. Hasil dan Pembahasan
3.1 Proses adsorpsi
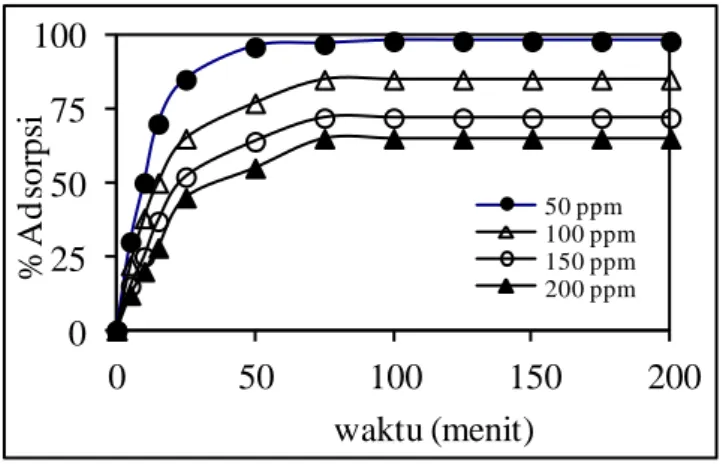
Pengaruh konsentrasi awal terhadap penghilangan zat warna RBRF3B pada berbagai waktu kontak dapat dilihat pada Gambar 2. Dari Gambar 2 dapat dilihat bahwa persentase penghilangan zat warna RBRF3B terjadi sangat cepat pada waktu-waktu awal dan terus meningkat dengan meningkatnya waktu kontak, sehingga mencapai nilai yang tetap pada waktu 120 menit. Pada waktu ini jumlah zat warna RBRF3B yang terserap pada adsorben mengalami kesetimbangan dengan larutannya. Waktu yang diperlukan untuk mencapai keadaan kesetimbangan ini disebut waktu setimbang dan jumlah zat warna yang terserap pada waktu setimbang akan menggambarkan kapasitas adsorpsi maksimum dari adsorben yang digunakan (Elkady et al., 2011). Dari Gambar 2 dapat dilihat bahwa keadaan setimbang dicapai pada waktu 120 menit pada semua konsentrasi zat warna.
0
25
50
75
100
0
50
100
150
200
%
A
d
so
rp
si
waktu (menit)
50 ppm 100 ppm 150 ppm 200 ppmGambar 2. Pengaruh konsentrasi awal terhadap % penghilangan zat warna RBRF3B
Dari Gambar 2 juga dapat dilihat bahwa persen penghilangan zat warna menurun dengan meningkatnya konsentrasi awal. Hal ini kemungkinan disebabkan karena dengan meningkatnya konsentrasi menyebabkan molekul zat warna cenderung
–76–
membentuk agregat, sehingga difusi molekul zat warna RB RF3B dari larutan menuju permukaan adsorben terhambat (Amran and Zulfikar, 2010; Wang and Wang, 2008b). Kemungkinan lainnya disebabkan karena berkurangnya ketersediaan atau tertutupnya gugus aktif adsorben yang diperlukan untuk zat warna RBRF3B pada konsentrasi tinggi (Han et al., 2008; Kannan and Meenakshisundaram, 2002; Elkady et al., 2011). Hasil yang sama juga telah dilaporkan dalam beberapa literatur yang berkaitan dengan penghilangan warna (Abdullah et al., 2005; Binupriya et al., 2008; Kannan and Meenakshisundaram, 2002; Namasivayam and Kavitha, 2002; Patil and Shrivastava, 2010; Rachakornkij et al., 2004; Reddy, 2006; Yavuz and Aydin, 2006; Zhang et al., 2011).
3.2 Mekansime adsorpsi
Mekanisme penghilangan zat warna RBRF3B dari larutannya dapat dijelaskan sebagai berikut. Dari analisis FTIR (Gambar tidak ditampilkan), diketahui bahwa selulosa jerami padi mengandung gugus hidroksil (3390 cm-1) yang terdapat pada
karbohidrat dan karbonil (1637 cm-1) yang berasal dari hemiselulosa. Selain itu
terdapat puncak pada 1062 cm-1, yang merupakan puncak khas untuk komponen
polisakarida (Ramadevi et al., 2012). Dari hasil pengukuran potensial zeta selulosa oleh Tan et al. (2012) diketahui bahwa nilai potensial zeta selulosa adalah 8.2. Pada pH kondisi eksprimen (pH = 7), selulosa akan bermuatan positif, yang kemungkinan disebabkan karena terprotonasinya gugus hidroksil dan karbonil yang terdapat pada selulosa jerami padi.
Sebaliknya molekul RBRF3B berada dalam bentuk anion trivalen dan bermuatan negatif. Ketika larutan yang mengandung zat warna RBRF3B dikontakkan dengan selulosa jerami padi, molekul RBRF3B akan tertarik menuju ke permukaan adsorben (selulosa jerami padi ) dan akan teradsorpsi melalui interaksi elektrostatik.
3.3 Isoterm adsorpsi
Analisis isotherm adsorpsi merupakan dasar yang sangat penting untuk menggambarkan bagaimana molekul adsorbat berinteraksi dengan permukaan adsorben. Kapasitas adsorpsi adsorben dan pola isotherm adsorpsi yang diperoleh dari nilai tetapan isotherm akan menggambarkan sifat permukaan dan afinitas dari adsorben. Hubungan antara data kesetimbangan dengan persamaan teoritis dan praktikal pada persamaan isotherm adsorpsi adalah sangat penting untuk menginterpretasi dan memprediksi proses adsorpsi (Vimonses et al., 2009).
Dalam rangka mempelajari pengaruh konsentrasi terhadap kapasitas adsorpsi dari selulosa jerami padi dalam proses penghilangan zat warna RBRF3B dari larutannya, data kesetimbangan yang didapat dianalisis dengan menggunakan isotherm Langmuir, Freundlich dan Sips.
Teori isoterm Langmuir mengasumsikan terjadinya lapisan monolayer adsorbat pada permukaan adsorben yang homogen. Adsorpsi diasumsikan terjadi pada sisi aktif
–77–
yang homogen dan hanya satu molekul zat warna yang menutupi sisi aktif tersebut. Bentuk persamaan non-linier dari isotherm Langmuir dapat ditulis sebagai:
qe = e e m
C
b
C
b
q
.
1
.
.
(3)di mana qe dan qm merupakan jumlah zat warna yang terserap pada kesetimbangan
dan pada kondisi maksimum (mg g-1). C
e merupakan konsentrasi pada
kesetimbangan (mg L-1) dan b merupakan tetapan isotherm Langmuir (L mg-1) yang
menggambarkan energi proses adsorpsi (Chatterjee et al., 2009a; 2010; Kannan and Meenakshisundaram, 2002; Namasivayam and Kavitha, 2002; Patil and Shrivastava, 2010; Rachakornkij et al., 2004; Reddy, 2006; Yavuz and Aydin, 2006; Zhang et al., 2011). Parameter adsorpsi model Langmuir dapat dilihat pada Tabel 1.
Data eksperimen yang diperoleh juga dianalisis menggunakan isoterm Freundlich. Pada isoterm adsorpsi Freundlich, model mengasumsikan bahwa permukaan adsorben bersifat heterogen. Persamaan non-linier isoterm adsorpsi Freundlich dapat ditulis sebagai:
qe = KfCe1/n (4)
di mana Ce merupakan konsentrasi larutan pada kesetimbangan (mg L-1), qe
merupakan jumlah adsorbat yang diadsorpsi per unit massa adsorben (mg g-1), K f dan
n merupakan tetapan isotherm Freundlich. Nilai dari 1/n, antara 0 dan 1, merupakan ukuran dari intensitas adsorpsi atau keheterogenan permukaan (Chatterjee et al., 2009a; 2010; Kannan and Meenakshisundaram, 2002; Namasivayam and Kavitha, 2002; Patil and Shrivastava, 2010; Pramanpol and Nitayapat, 2006; Rachakornkij et al., 2004; Reddy, 2006; Tsai et al., 2006) dan dipergunakan untuk verifikasi jenis adsorpsi (Vimonses et al., 2009). Nilai n lebih besar dari 1 menunjukkan proses adsorpsi yang favourable dan bersifat fisik (Vimonses et al., 2009; Zhang et al., 2011). Tetapan isotherm Freundlic yang lain, Kf
menunjukkan kapasitas adsorpsi adsorben (Kannan and Meenakshisundaram, 2002; Mumin et al., 2007; Pramanpol and Nitayapat, 2006; Rachakornkij et al., 2004; Reddy, 2006). Parameter isotherm Freundlich dapat dilihat pada Tabel 1.
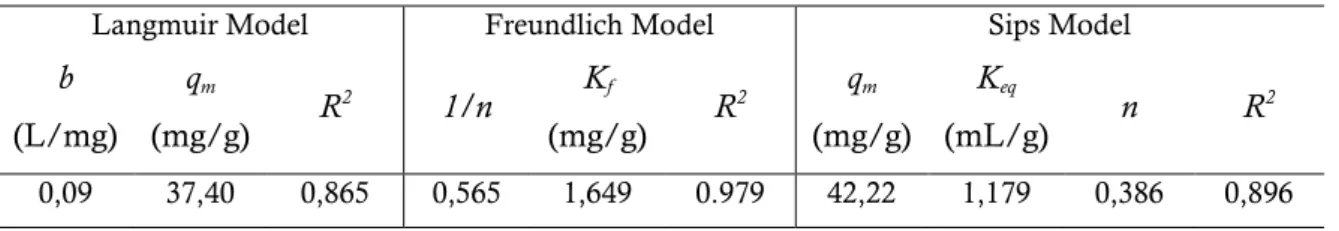
Tabel 1. Tetapan Langmuir, Freundlich dan Sips pada proses penghilangan zat
warna RBRF3B
Langmuir Model Freundlich Model Sips Model
b (L/mg) qm (mg/g) R 2 1/n Kf (mg/g) R 2 qm (mg/g) Keq (mL/g) n R 2 0,09 37,40 0,865 0,565 1,649 0.979 42,22 1,179 0,386 0,896
–78–
Model isotherm adsorpsi Sips merupakan gabungan dari model isotherm Langmuir dan Freundlich, yang mempunyai karakteristik persamaan Langmuir dan Freundlich. Persamaan model isotherm Sips dapat ditulis sebagai:
qe = n e eq n e eq m C K C K q . 1 . . (5)
di mana Keq (L mg-1) menggambarkan tetapan kesetimbangan persamaan Sips dan qm
(mg g-1) merupakan kapasitas adsorpsi maksimum. Model isoterm Sips dicirikan
dengan adanya faktor keheteroganan, n, dan khusus untuk n = 1, persamaan isotherm Sips akan menjadi persamaan isoterm Langmuir dan proses adsorpsi menjadi homogen (Chatterjee et al., 2009a; 2010).
Dari Tabel 1 dapat dilihat bahwa nilai koefisien korelasi model isotherm Freundlich lebih besar dibandingkan dengan koefisien korelasi model isotherm Langmuir dan Sips. Hal ini berarti isotherm Freundlich merupakan isotherm yang sesuai untuk menggambarkan data kesetimbangan pada proses penghilangan zat warna RBRF3B oleh selulosa jerami padi. Fenomena yang mirip juga telah dilaporkan dalam beberapa literatur yang berkaitan dengan penghilangan warna (Pramanpol and Nitayapat, 2006; Tsai et al., 2006; Vimonses et al., 2009; Zhang et al., 2011). Dari Tabel 1 juga dapat dilihat bahwa nilai 1/n kurang dari 1 menunjukkan bahwa proses isotherm adsorpsi sedikit favorable (Tsai et al., 2006; Zhang et al., 2011).
d. Kesimpulan
Dari hasil penelitian diperoleh bahwa persentase penghilangan zat warna RBRF3B dari larutannya menggunakan selulosa jerami padi menurun dengan meningkatnya konsentrasi larutan. Dari data kesetimbangan isoterm adsorpsi, ditemukan bahwa proses penghilangan zat warna RBRF3B menggunakan selulosa jerami padi mengikuti model isotherm Freundlich. Dengan menggunakan model isoterm Sips ditemukan bahwa faktor heterogenitas selulosa jerami padi adalah sebesar 0,386. Dari model isoterm Langmuir diketahui bahwa kapasitas adsorpsi maksimum selulosa jerami padi terhadap zat warna RBRF3B adalah sebesar 37,40 mg g-1 pada
konsentrasi 100 mg L-1.
e. Daftar Pustaka
Abdullah, A.G.L., M.A.M. Salleh, S. Mazlina, M.J.M.M. Noor, M.R. Osman, R. Wagiran, R. and S. Sobri,. 2005. « Azo dye removal by adsorption using waste biomass: sugarcane bagasse” Int. J. Eng. Technol. 2(1): 8-13.
Acemioglu, B. 2004. “Adsorption of Congo red from aqueous solution onto calcium-rich fly ash” J. Colloid Interface Sci. 274(2): 371-379.
Amran, M.B. and M.A. Zulfikar,. 2010. « Removal of Congo red dye by adsorption onto phyrophyllite” Int. J. Environ. Studies. 67(6): 11-921.
Binupriya, A.R., M. Sathishkumar, K. Swaminathan, C.S. Ku and S.E. Yun,. 2008. “Comparative studies on removal of Congo red by native and modified
–79–
mycelial pellets of Trametes versicolor in various reactor modes” Bioresource Technol. 99: 1080-1088.
Chen, H. and J. Zhao,. 2009. “Adsorption study for removal of Congo red anionic dye using organo-attapulgite” Adsorption. 15: 381-389.
Chatterjee, S., M.W. Lee S.H. and Woo,. 2010. “Adsorption of Congo red by chitosan hydrogel beads impregnated with carbon nanotubes” Bioresource Technol. 101: 1800-1806.
Chatterjee, S., T. Chatterjee and S.H. Woo,. 2011. “Adsorption of Congo red from aqueous solutions using chitosan hydrogel beads formed by various anionic surfactants” Sep. Sci. Technol. 46: 986-996.
Chatterjee, S., D.S. Lee, M.W. Lee and S.H. Woo,. 2009a. “Enhanced adsorption of congo red from aqueous solutions by chitosan hydrogel beads impregnated with cetyl trimethyl ammonium bromide” Bioresource Technol. 100: 2803-2809. Chatterjee, S., D.S. Lee, M.W. Lee and S.H. Woo,. 2009b. “Congo red adsorption
from aqueous solutions by using chitosan hydrogel beads impregnated with nonionic or anionic surfactan” Bioresource Technol. 100: 3862-3868.
Elkady, M.F., A.M. Ibrahim and M.M.A. El-Latif,. 2011. « Assesment of the adsorption kinetics, equilibrium and thermodynamic for the potential removal of reactive red dye using eggshell biocomposite beads « Desalination. 278: 412-423.
Ehrampoush, M.H., G. Ghanizadeh and M.T. Ghaneian,. 2011. “Equilibrium and kinetics study of reactive red 123 dye removal from aqueous solution by adsorption on eggshell” Iran J. Environ. Health Sci. Eng. 8(2): 101-108.
Han, R., D. Ding, Y. Xu, W. Zou, Y. Wang, Y. Li and L. Zou,. 2008. “Use of husk for the adsorption of congo red from aqueous solution in column mode” Bioresource Technol. 99: 2938-2946.
Jayaraj, R., P.J. Thanaraj, S.T. Natarajan and P.M.D. Prasath,. 2011. “Removal of Congo red dye from aqueous solution using acid activated eco-friendly low cost carbon prepared from marine algae Valoria bryopsis” J. Chem. Pharm. Res. 3(3): 389-396.
Jumasiah, A., T.G. Chuah, J. Gimbon, T.S.Y. Choong and I. Azni,. 2006. “Adsorption of basic dye onto palm kernel shell activated carbon: sorption equilibrium and kinetics studies” Desalination. 186: 57-64.
Kannan, N. and M. Meenakshisundaram,. 2002. “Adsorption of Congo red on various activated carbons” Water Air Soil Pollut. 138: 289-305.
Mumin, M.A., M.M.R. Khan, K.F. Akhter and M.J. Uddin,. 2007. “Potentiality of open burnt clay as an adsorbent for removal of Congo red from aqueous solution” Int. J. Environ. Sci. Tech. 4(4): 525-532.
Patil, A.K. and V.S. Shrivastava,. 2010. “Alternanthera bettzichiana plant powder as low cost adsorbent for removal of Congo red from aqueous solution” Int. J. ChemTech. Res. 2(2): 842-850.
Namasivayam, C., N. Muniasamy, K. Gayathri, M. Rani and K. Ranganathan,. 1996. “Removal of dyes from aqueous solutions by cellulosic waste orange peel” Bioresource Technol. 57: 37-43.
–80–
Namasivayam, C. D.J.S.E. and Arasi,. 1997. “Removal of Congo red from wastewater by adsorption onto waste red mud” Chemosphere. 34(2): 401-417. Namasivayam, C. and D. Kavitha,. 2002. “Removal of Congo red from water by
adsorption onto activated carbon prepared from coir pith, an agricultural solid waste” Dye Pigments. 54: 47-58.
Pramanpol, N. and N. Nitayapat,. 2006. “Adsorption of reactive dye by eggshell and its membrane” Kasetsart J. (Nat. Sci.). 40: 192-197.
Rachakornkij, M., S. Ruangchuay and S. Teachakulwiroj,. 2004. “Removal of reactive dyes from aqueous solution using bagasse fly ash” Songklanakarin J. Sci. Technol. 26: 13-24.
Ramadevi, P., D. Sampathkumar, C.V. Srinivasa B. and Bennehalli,. 2012. ”Effect of alkali treatment on water absorption of single cellulosic abaca fiber” BioResources. 7(3): 3515-3524.
Reddy, M.C.S. 2006. “Removal of direct dye from aqueous solutions with an adsorbent made from tamarid fruit shell, an agricultural solid waste” J. Sci. Ind. Res. 65: 443-446.
Tan, J., X. Zhang, X. Wei and L. Wang,. 2012. “Removal of Malachite green from aqueous solution using waste newspaper fiber” BioResources. 7(3): 4307-4320. Tao, L. 2011. “Treatment of model wastewater including Eriochrome Blact T based
on eggshell membrane” Adv. Mater. Res. 183-185: 2120-2123.
Tsai, W.T., J.M. Yang, C.W. Lai, Y.H. Cheng, C.C. Lin and C.W. Yeh,. 2006. “Characterization and adsorption properties of eggshells and eggshell membrane” Bioresource Technol. 97: 488-493.
Wang, L. and A. Wang,. 2008a. “Adsorption properties of Congo red from aqueous solution onto N,O-carboxymethyl-chitosan” Bioresource Technol. 99: 1403-1408. Wang, L. and A. Wang,. 2008b. “Adsorption properties of Congo red from aqueous
solution onto surfactant-modified montmorillonite” J. Hazard. Mater. 160: 173-180.
Vimonses, V., S. Lei, B. Jin, C.W.K. Chow and C. Saint,. 2009. “Kinetic study and equilibrium isotherm analysis of Congo red adsorption by clay materials” Chem. Eng. J. 148: 354-364.
Yavuz, O. and A.H. Aydin,. 2006. “Removal of direct dyes from aqueous solution using various adsorbents” Polish. J. Environ. Studies. 15(1): 155-161.
Zhang, Z., L. Moghaddam, I.M. O’Hara and W.O.S. Doherty,. 2011. “Congo red adsorption by ball-milled sugarcane bagasse” Chem. Eng. J. 178: 122-128.