III.1. Kerangka Pemikiran
Aktinomisetes merupakan mikroba penghasil senyawa aktif terbanyak dibandingkan dengan bakteri ataupun kapang, baik itu senyawa aktif sebagai antimikroba, antikanker, antivirus, maupun antikolesterol. Eksplorasi senyawa aktif dari yang berasal dari mikroba, selama ini diambil dari sampel tanah (teristorial) atau dari tumbuhan. Namun demikian eksplorasi senyawa aktif dari biota laut seperti hewan, tumbuhan, dan mikroba laut belum banyak dilakukan.
Aktinomisetes tersebar di lingkungan yang berbeda-beda. Pada daerah kondisi panas, misalnya di daerah yang bersuhu lebih dari 60 °C maka kemungkinan ditemukannya aktinomisetes thermofil menjadi lebih besar. Di daerah yang berkadar garam tinggi, akan banyak diperoleh jenis aktinomisetes yang tahan terhadap kadar garam tinggi. Menurut Lam (2006) peluang untuk mendapatkan senyawa aktif baru aktinomisetes laut masih sangat besar. Seperti halnya pada populasi aktinomisetes tanah, kondisi ekosistem laut juga berpengaruh terhadap jenis populasi aktinomisetes laut. Biodiversitas ekosistem laut sangat besar, seperti diketahui tingkat kedalaman laut, kadar garam, dan pertemuan arus laut berpengaruh terhadap populasi biota laut.
Iklim suatu wilayah juga berpengaruh terhadap populasi mikroba. Sebagai contoh aktinomisetes yang hidup di daerah subtropik menunjukkan jumlah populasi aktinomisetes yang berbeda dengan daerah tropis. Populasi mikroba pada daerah tropis biasanya lebih tinggi dibandingkan dengan daerah subtropis.
Diversitas aktinomisetes berkaitan erat dengan jenis metabolit sekunder yang dihasilkan, demikian juga habitat mikroba berpengaruh terhadap jenis metabolit sekunder yang dihasilkan. Dalam spesies yang sama, metabolit sekunder yang dihasilkan bisa saja berbeda-beda. Ekskresi metabolit sekunder oleh mikroba merupakan fungsi dari lingkungan mikroba itu berada, dan bukan merupakan fungsi dari biomassa sel mikroba. Semakin besar keragaman ekologi dalam habitat tertentu maka tingkat keragaman metabolit sekunder semakin tinggi.
Dengan demikian masih banyak peluang untuk mendapatkan senyawa aktif baru atau spesies baru yang berasal dari aktinomisetes laut.
Penapisan dan isolasi senyawa aktif ditentukan oleh metode isolasi dan
bioassay yang digunakan. Metode isolasi berkaitan dengan medium isolasi dan
metode preparasi sampel, termasuk didalamnya metode pra-perlakuan sampel. Beberapa strategi yang dapat ditempuh untuk mendapatkan senyawa aktif potensial adalah sebagai berikut;
• Dilakukan kombinasi beberapa medium isolasi dengan metode pra-perlakuan sampel.
• Pengambilan sampel dengan mempertimbangkan keadaan lingkungan yang berbeda-beda.
• Pemilihan mikroba uji pada proses penapisan.
Pada penelitian ini digunakan medium starch–casein agar yang dikombinasikan dengan penambahan antibiotik (anti bakteri dan antifungi) serta pra-perlakuan pemanasan dan pengasaman. Menurut Pisano et al. (1989) medium
starch-casein sangat cocok digunakan untuk isolasi aktinomisetes. Aktinomisetes
mampu menghidrolisis pati menjadi glukosa dengan mudah dan cepat untuk proses pertumbuhannya. Di sisi lain mikroba kontaminan tumbuh lambat dalam medium pati tanpa penambahan glukosa. Medium starch-casein agar memiliki keunggulan warna medium agar yang putih. Hal ini memudahkan untuk mengamati hifa horisontal dan adanya zat pewarna yang dihasilkan oleh aktinomisetes. Selektifitas medium terhadap aktinomisetes dapat ditingkatkan dengan penambahan antibiotik dan pra-perlakuan untuk menekan bakteri dan fungi kontaminan.
Setelah diperoleh isolat yang potensial untuk menghasilkan senyawa aktif tertentu, maka perlu dilakukan identifikasi mikroba. Disamping untuk mengetahui spesies isolat yang diisolasi, identifikasi juga mempermudah untuk merunut dan mempelajari sifat-sifat mikroba terpilih dengan membandingkan mikroba lain yang memiliki hubungan genetika terdekat. Identifikasi mikroba dapat dilakukan melalui analisis genetika dengan 16S rRNA. Metode ini memiliki keunggulan hasil identifikasi yang lebih akurat dibanding metode konvensional dan juga mempermudah merunut hubungan terdekat dengan mikroba target.
Disamping proses isolasi dan penapisan mikroba penghasil antibiotik, rekayasa proses produksi antibiotika merupakan tahapan yang penting. Teknologi proses produksi antibiotika mencakup optimasi medium fermentasi, optimasi kondisi fermentasi, penentuan profil fermentasi, dan proses hilir antibiotik. Profil fermentasi perlu dilakukan untuk mengetahui karakter mikroba yang digunakan, khususnya fermentasi yang menggunakan isolat-isolat wild strain. Dalam optimasi medium fermentasi, penentuan komposisi medium fermentasi menjadi hal yang penting untuk dipelajari.
Komposisi medium ditentukan oleh pemilihan sumber karbon, sumber nitrogen dan mineral. Sumber karbon merupakan penyusun konstituen organik sel dan sumber energi. Sumber karbon merupakan bahan dasar sintesis polisakarida, protein, lipida, dan asam lemak. Kurang lebih 50% bahan utama penyusun sel mikroba berasal dari sumber karbon. Selain sebagai sumber energi dan penyusun sel, sumber karbon juga digunakan sebagai bahan penyusun senyawa metabolit. Jenis sumber karbon berpengaruh terhadap senyawa metabolit yang dihasilkan. Sedangkan nitrogen merupakan konstituen pembentuk protein, asam nukleat, koenzim, DNA, dan RNA. Jenis nitrogen juga berpengaruh terhadap pertumbuhan dan pembentukan produk Mineral seperti K, Mg, Ca, Fe banyak digunakan sebagai kofaktor dalam reaksi enzim yang berkaitan dengan proses metabolisme. Sedangkan mineral fosfat dalam bentuk K2HPO4 dan KH2PO4 banyak digunakan dalam pembentukan asam nukleat, fosfolipida, ATP dan sebagai buffer. Penambahan Fe dan Zn dapat meningkatkan produksi aktinomisin, kloramfenikol, neomisin, penisilin, dan patulin, serta penambahan mineral Mn mampu meningkatkan produksi basitrasin dan protease (Stanbury dan Whitaker 1987).
Terdapat 2 kategori sumber karbon dan sumber nitrogen, yaitu sumber karbon kompleks atau sumber nitrogen kompleks, dan sumber karbon sederhana atau sumber nitrogen sederhana. Sumber karbon dan sumber nitrogen kompleks biasanya lebih murah dibandingkan sumber karbon dan nitrogen sederhana. Dalam aplikasinya di industri lebih banyak digunakan sumber karbon dan nitrogen kompleks. Namun demikian dalam beberapa kasus masih digunakan sumber karbon dan nitrogen dasar.
Dalam proses fermentasi untuk mendapatkan hasil yang paling optimum, maka terlebih dahulu dipelajari sifat fisiologis dari mikroba tersebut. Sifat fisiologis mikroba dapat diketahui dengan menentukan kurva pertumbuhan mikroba, laju pertumbuhan spesifik, laju penggunaan substrat, laju pertumbuhan biomassa, dan rendemen pembentukan biomassa per massa substrat.
Tahapan proses hilir merupakan rangkaian pencarian senyawa aktif untuk mendapatkan senyawa aktif murni dan teridentifikasi. Dalam bioproses, tahapan proses hilir meliputi tahap pemisahan sel, ekstraksi, pemekatan, dan pemurnian senyawa target. Dalam industri bioproses tahapan proses hilir dapat mencakup sampai 60% dari total biaya produksi (Stanbury dan Whitaker 1987), sehingga pemilihan metode pemisahan, pemurnian, dan pemilihan pelarut organik yang tepat akan menjadi pertimbangan yang sangat penting.
Dalam proses isolasi senyawa aktif yang dihasilkan oleh mikroba, besar kecilnya aktivitas biologi seperti antibakteri, antikanker, antifungi atau aktivitas lainnya seperti enzim inhibitor, imunosupresan menjadi hal yang penting untuk diketahui. Pengukuran daya hambat senyawa aktif terhadap pertumbuhan mikroba uji biasanya dilakukan dengan menggunakan metode MIC (Minimum Inhibitory
Concentration). Kekuatan daya hambat senyawa aktif juga dapat diketahui dengan
cara membandingkan MIC antibiotik umum seperti tetrasiklin, penisilin, eritromisin dan lainnya.
Identifikasi dan elusidasi senyawa aktif perlu dilakukan untuk mendapatkan gambaran struktur dan karakteristik senyawa aktif. Dengan mengetahui struktur senyawa aktif maka sebagian sifat-sifat kimia dapat diprediksi untuk aplikasi medis dan dapat ditentukan golongan atau kelompok senyawa tersebut.
III.2. Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Mikrobiologi, Laboratorium Analisa Kimia, dan Laboratorium Teknologi Gen Balai Pengkajian Bioteknologi BPPT dari Bulan September 2007 sampai dengan Bulan Desember 2010.
III.3. Bahan dan Peralatan Penelitian
Bahan yang digunakan dalam penelitian ini meliputi Pepton/Bacto
Pentone (Difco), ekstrak khamir (Difco), ekstrak malt (Oxoid), glukosa (Merck) , Marine agar (Difco), Fe (III) sitrat hidrat (Merck), metanol p.a (JT Baker), etil
asetat p.a (JT Baker), kloroform p.a (JT Baker), metanol HPLC (Merck), kloroform HPLC (Merck), maltosa (Merck), laktosa (Merck), sukrosa (Merck), molase, dekstrin (Oxoid), asam glutamat (Merck), amonium sulfat (Merck), kasein hidrolisat/Casamino acid (Difco), K2HPO4 (Merck), MgSO4.7 H2O (Merck), ZnSO4 7 H2O (Merck), CaCl2.2 H2O (Merck), FeSO4 7 H2O (Merck), Cu.SO4.5 H2O (Merck), MnCl2.4 H2O (Merck), CuSO4. H2O (Merck), CoCl2.6 H2O (Merck), NaCl, KH2PO4 (Merck), HCl (Merck), NaOH (Merck), DNS (Sigma), H2SO4 95-97% (Merck), H3BO4 (Merck), silika gel 60 (0,063-0,200mm) Merck.
Peralatan yang digunakan dalam penelitian ini meliputi peralatan alat gelas, rotavapor Buchi 461, microcentrifuge (Tomy/MX-301), incubator shaker (Takasaki Scientific Instrument), freeze drying (HETO CD 2.5), centrifugal
concentrator (TOMY CC-105), Kjeldahl (Velp Scientifica UDK 132),
Spektrofotometer (Shimadzu UV-160A), HPLC (Waters 2695), 1H & 13C NMR (Bruker AV-500), FTIR Shimadzu 8300, LCMS (LCT Premier-XE Waters), ABI 300 genetic analyzer (Perkin Elmer), Gallen Kamp Melting Point, Sonicator Ultrasonic Processor XL 2020, Centrifuge Beckman J2-HS.
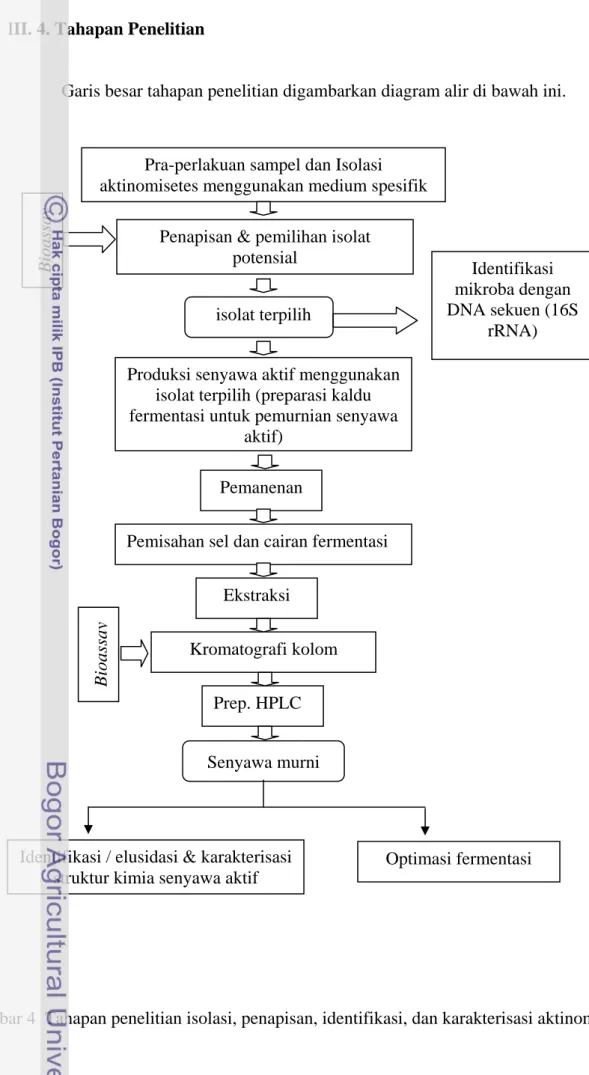
III. 4. Tahapan Penelitian
Garis besar tahapan penelitian digambarkan diagram alir di bawah ini.
Pra-perlakuan sampel dan Isolasi aktinomisetes menggunakan medium spesifik
Bioassa
y
Penapisan & pemilihan isolat potensial
Identifikasi mikroba dengan DNA sekuen (16S
rRNA)
Produksi senyawa aktif menggunakan isolat terpilih (preparasi kaldu fermentasi untuk pemurnian senyawa
aktif)
Pemanenan
Pemisahan sel dan cairan fermentasi
Ekstraksi Kromatografi kolom Prep. HPLC Bioassa y Senyawa murni isolat terpilih
Identifikasi / elusidasi & karakterisasi struktur kimia senyawa aktif
Optimasi fermentasi
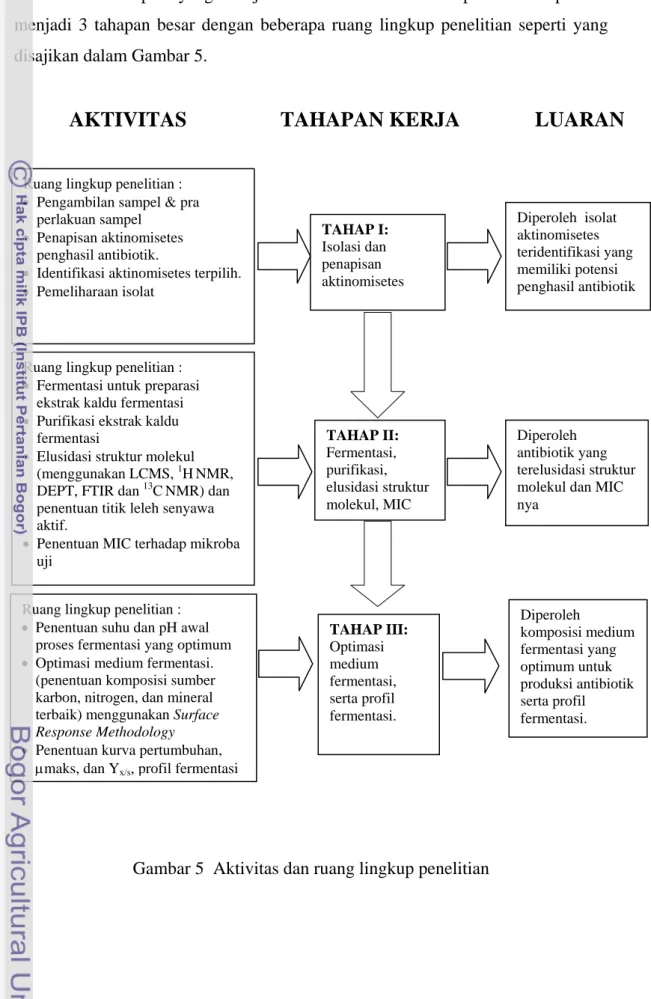
Dari tahapan yang disajikan dalam Gambar 4 dapat dikelompokkan menjadi 3 tahapan besar dengan beberapa ruang lingkup penelitian seperti yang disajikan dalam Gambar 5.
AKTIVITAS
TAHAPAN KERJA LUARAN
TAHAP I:
Isolasi dan penapisan aktinomisetes Ruang lingkup penelitian :
• Pengambilan sampel & pra perlakuan sampel
• Penapisan aktinomisetes penghasil antibiotik.
• Identifikasi aktinomisetes terpilih. • Pemeliharaan isolat TAHAP II: Fermentasi, purifikasi, elusidasi struktur molekul, MIC Ruang lingkup penelitian :
• Fermentasi untuk preparasi ekstrak kaldu fermentasi • Purifikasi ekstrak kaldu
fermentasi
• Elusidasi struktur molekul (menggunakan LCMS, 1HNMR, DEPT, FTIR dan 13CNMR) dan penentuan titik leleh senyawa aktif.
• Penentuan MIC terhadap mikroba uji TAHAP III: Optimasi medium fermentasi, serta profil fermentasi. Ruang lingkup penelitian :
• Penentuan suhu dan pH awal proses fermentasi yang optimum • Optimasi medium fermentasi.
(penentuan komposisi sumber karbon, nitrogen, dan mineral terbaik) menggunakan Surface Response Methodology • Penentuan kurva pertumbuhan,
μmaks, dan Yx/s, profil fermentasi
Diperoleh isolat aktinomisetes Diperoleh komposisi medium fermentasi yang optimum untuk produksi antibiotik serta profil fermentasi. teridentifikasi yang memiliki potensi penghasil antibiotik Diperoleh antibiotik yang terelusidasi struktur molekul dan MIC nya
III.4.1. Pra-perlakuan Sampel dan Isolasi Aktinomisetes
Metode isolasi yang digunakan mengacu pada metode yang dilakukan oleh Mincer et al. (2005) yang dimodifikasi. Namun demikian sebelum dilakukan proses isolasi aktinomisetes, terlebih dahulu dilakukan percobaan pendahuluan untuk menentukan metode pra-perlakuan sampel yang paling tepat, yang meliputi (1) tanpa pra-perlakuan (kontrol), (2) pra-perlakuan dengan metode heat shock yang dilakukan dengan memanaskan sampel selama 4 jam pada suhu 60 °C (Pisano et al. 1986), (3) pengasaman sampel yang dilakukan dengan cara mengasamkan sampel sampai dengan pH 2 menggunakan asam klorida, dan didiamkan selama 2 jam, selanjutnya dinetralkan kembali menggunakan NaOH. (4) Pemanasan sampel (metode ke-2) yang dikombinasikan dengan penambahan 100 μg mL-1 sikloheksimid dan 25 μg mL-1 nistatin, (5) Pengasaman sampel (metode ke-3) yang dikombinasikan dengan penambahan 100 μg mL-1 sikloheksimid dan 25 μg mL-1
nistatin, (6) Metode ke-4 yang dikombinasikan dengan penambahan 20 μg mL-1 asam nalidiksat dan 5 μg mL-1
rifampisin. (7) Metode ke-5 yang dikombinasikan dengan penambahan 20 μg mL-1
asam nalidiksat dan 5 μg mL-1
rifampisin. (8) Metode ke-4 yang dikombinasikan dengan penambahan 40 μg mL-1 asam nalidiksat dan 10 μg mL-1
rifampisin (9). Metode ke-5 yang dikombinasikan dengan penambahan 40 μg mL-1
asam nalidiksat dan 10 μg mL-1
rifampisin. Antibiotik ditambahkan setelah medium agar disterilisasi. Komposisi medium isolasi adalah sebagai berikut; 10 g soluble
starch, 2 g pepton, 4 g ekstrak khamir, 16 g agar dalam 1000 mL air laut. Sampel
yang digunakan untuk percobaan pendahuluan adalah sampel dari Pantai Anyer Banten. Setelah diperoleh metode pra-perlakuan sampel yang paling tepat, selanjutnya digunakan untuk proses isolasi aktinomisetes pada tahap selanjutnya.
Pengambilan sampel diambil dari tiga lokasi pantai, antara lain dari pantai utara Cirebon, Desa Gebang (koordinat 6°48'37"S 108°45'27"E), Pantai Anyer Banten (koordinat 6°3'19"S 105°54'29"E) dan Pantai Kukup Gunung Kidul Yogyakarta (koordinat 8°8'3"S 110°33'19"E ) dengan kedalaman rata-rata 0,5 sampai dengan 1 m. Sebanyak 5 g masing-masing sedimen sampel disimpan dalam falcon tube 14 mL dan diletakkan dalam dryice box selama pengambilan
sampel di lapangan. Selanjutnya sedimen sampel dicuci dengan menggunakan air demineral steril dan dilakukan pra-perlakuan dengan menggunakan metode yang telah dipilih dalam percobaan pendahuluan. Cairan sampel yang telah mengalami pra-perlakuan selanjutnya diencerkan secara seri dari 10-1 sampai dengan 10-5. Sebanyak 0,1 mL sampel yang telah diencerkan, disebarkan pada permukaan agar medium isolasi. Komposisi medium agar untuk isolasi adalah sebagai berikut; 10 g soluble starch, 2 g pepton, 4 g ekstrak khamir, 16 g agar dalam 1000 mL air laut (Pisano et al. 1989).
Medium isolasi yang telah diinokulasikan diinkubasi di dalam inkubator dengan suhu 30 °C selama kurang lebih 25 hari. Koloni tunggal dipilih dan dimurnikan kembali dengan melakukan pemindahan koloni ke dalam medium baru yaitu dengan medium marine agar sampai diperoleh koloni tunggal. Masing-masing koloni diberi kode sesuai dengan asal lokasi sampling. Kode A digunakan untuk sampel dari Pantai Anyer Banten, kode YK berasal dari pantai Kukup Yogyakarta, Kode PCl berasal dari pantai utara Cirebon Desa Gebang.
Isolat yang telah dimurnikan dari hasil isolasi disebarkan kembali dalam medium marine agar untuk proses peremajaan sebelum digunakan untuk proses fermentasi. Sebagian isolat murni yang telah diremajakan dipindahkan dalam gliserol 15% dan disimpan dalam suhu -40 °C untuk proses preservasi. Kultur stok yang akan digunakan diremajakan lagi sebelum digunakan untuk fermentasi.
III.4.2. Kultur Vegetatif dan Fermentatif pada Proses Penapisan dan Penggandaan Skala untuk Preparasi Ekstrak Fermentasi.
Sejumlah koloni yang telah dimurnikan dikulturkan (vegetatif) dengan menggunakan medium ekstrak khamir-ekstrak malt (YEME). Inkubasi kultur vegetatif dilakukan selama 48 jam pada suhu 30 °C dengan komposisi medium: pepton 5 g L-1, ekstrak khamir 3 g L-1, ekstrak malt 3 g L-1, glukosa 10 g L-1, air demineral 250 mL, and air laut 750 mL. Sebelum sterilisasi, pH medium diatur pada 7,6 dengan menggunakan NaOH 0,1 N dan HCl 0,1 N. Sepuluh persen (v/v) medium vegetatif diinokulasikan ke dalam medium fermentatif. Komposisi
-1
, Fe (III) citrate hydrate 0,3 g L-1, air demineral 250 mL, dan air laut 750 mL (Kanoh et al. 2005). Sebelum sterilisasi, pH medium diatur pada 7,6. Fermentasi dilakukan pada suhu 30 ºC selama 144 jam dengan kecepatan agitasi 200 rpm menggunakan incubator shaker. Volume kerja kultur vegetatif dan fermentatif pada tahap penapisan dilakukan pada volume 3 mL dalam BD falcon (around
bottom) volume 14 mL.
Preparasi ekstrak kaldu fermentasi untuk uji aktivitas aktinomisetes (bioassay) pada tahap penapisan, dilakukan dengan cara mengeringkan 3 mL kaldu fermentasi dengan metode kering beku, selanjutnya ditambahkan 3 mL metanol dan divorteks selama 15 menit. Biomassa dan supernatan dipisahkan menggunakan sentrifugasi pada kecepatan 14000 x g selama 15 menit.
Pada tahap penggandaan volume fermentasi untuk preparasi kaldu fermentasi, medium vegetatif dan fermentatif adalah sama dengan medium vegetatif dan fermentatif proses penapisan, namun volume kerja kultur vegetatif dilakukan pada volume masing-masing 100 mL dalam labu erlenmeyer 250 mL sebanyak 5 labu erlenmeyer dan fermentasi dilakukan selama 48 jam pada suhu 30 °C dengan kecepatan agitasi sebesar 150 rpm. Sedangkan tahap fermentatif volume kerja masing-masing 1 l dalam labu erlenmeyer 2 l sebanyak 5 labu erlenmeyer. Sebelum sterilisasi pH medium diatur pada 7,6. Fermentasi dilakukan pada suhu 30 ºC selama 144 jam dengan kecepatan agitasi sebesar 150 rpm.
III.4.3. Uji Aktivitas Antimikroba (Bioassay)
Penapisan aktinomisetes penghasil antimikroba dan uji aktivitas antimikroba (bioassay) dilakukan dengan metode difusi agar dengan menggunakan kertas cakram diameter 6 mm. Mikroba uji yang digunakan adalah Escherichia coli ATCC 25922, Staphylococcus aureus ATCC25923, Pseudomonas aeruginosa ATCC27853, Bacillus subtilis ATCC 66923, Candida albicans BIOMCC00122 and Aspergillus niger BIOMCC00134. Escherichia coli ATCC 25922,
Staphylococcus aureus ATCC25923, Pseudomonas aeruginosa ATCC27853, dan Bacillus subtilis ATCC 66923 ditumbuhkan pada medium nutrient agar dan
Candida albicans BIOMCC00122 dan Aspergillus niger BIOMCC00134.
ditumbuhkan pada Potato Dextrose Agar.
Sebanyak 15 μL ekstrak sampel diteteskan dalam kertas cakram, kemudian dikeringkan dengan cara diangin-anginkan. Selanjutnya diletakkan pada permukaan agar yang telah diinokulasikan 15 μL (106
sel mL-1) mikroba uji per cawan petri. Inkubasi dilakukan pada suhu 30 °C selama 24 jam. Zona bening yang terbentuk diukur diameter zonanya (Prescott et al. 2002)
III. 4.4. Analisis Sekuen Gen 16S rRNA
Isolat murni hasil preservasi dalam gliserol stok diremajakan kembali dan dilakukan identifikasi. Identifikasi didasarkan pada analisis 16S rRNA. DNA diisolasi dengan menggunakan FastPrep, kit khusus untuk isolasi DNA. Sampel dilisis menggunakan lysing matrix kit dan dihomogenasi menggunakan FastPrep selama 40 detik pada 4500 rpm.
Amplifikasi DNA dikerjakan menggunakan PCR dengan primers 8 F dan 1492R. PCR yang mengandung primer 8F dan 1492R ditambahkan ke dalam larutan DNA, selanjutnya dipurifikasi menggunakan kit ekstraksi Gel/DNA. Gen 16S rRNA yang diperoleh selanjutnya dilakukan sekuen DNA menggunakan Dye® terminator V 3.1 cycle sequencing kit. Peralatan DNA sekuen yang digunakan adalah ABI 300 genetic analyzer. Selanjutnya sekuen yang diperoleh dibandingkan dengan database yang tersedia dalam NCBI menggunaan BLAST
search engine http://blast.ncbi.nlm.nih.gov/Blast.cgi. Pohon filogenik dibuat
menggunakan program ClustalW (Mega 3.1) dengan membandingkan beberapa DNA sekuen dari spesies aktinomisetes yang diperoleh dari database gen di NCBI. Analisis digunakan metode neighbor-joining dengan bootstrap dataset 100 kali pengulangan yang telah tersedia dalam program Mega 3.1.
III.4.5. Pemisahan dan Pemurnian Senyawa Aktif Kaldu Fermentasi
Proses pemisahan dan pemurnian dilakukan dengan mengikuti metode Shindo et al. (1995) yang dimodifikasi. Kaldu fermentasi yang mengandung
campuran sisa medium, biomassa, dan senyawa aktif dipisahkan padatannya dengan sentrifugasi pada kecepatan 14000 x g selama 15 menit. Fase padat (biomassa) dipisahkan dari cairannya dan dilakukan pemecahan sel dengan sonikator. Padatan sel diekstraksi menggunakan metanol dua kali. Fasa cair (supernatan) diekstraksi menggunakan etil asetat dengan perbandingan volume yang sama, dan ekstraksi dilakukan sebanyak 2 kali. Ekstrak supernatan dan biomassa dipekatkan dengan rotavapor sampai diperoleh ekstrak pekat.
Ekstrak yang sudah dipekatkan selanjutnya difraksinasi menggunakan kromatografi kolom (φ25 x 500 mm), dengan fasa diam yang digunakan adalah silika gel 60 (0,063-0,200mm) dan fasa gerak yang digunakan campuran metanol-kloroform, dengan elusi gradien bertahap dari kloroform:metanol (100%:0) berubah dengan berkurangnya 10% kloroform, sampai diperoleh elusi kloroform:metanol (0:100%). Sebanyak 30 fraksi dikumpulkan dan diuji (bioassay) aktivitas antimikrobanya.
Fraksi aktif dimurnikan kembali menggunakan HPLC preparatif. Semua fraksi hasil pemurnian dengan HPLC preparatif dikumpulkan dan diuji (bioassay) aktivitas antimikrobanya. Fraksi aktif murni dikumpulkan dan ditentukan bobot dan struktur molekulnya.
III.4.6. Identifikasi Struktur Kimia Senyawa Aktif
Gugus fungsional senyawa aktif diidentifikasi menggunakan FTIR (Infra
Red Spectrofotometry) (FTIR Shimadzu 8300), bobot molekul senyawa aktif
ditentukan dengan LCMS (Liquid Chromatography Mass Spetrofotometry) (LCT Premier-XE Waters), hubungan tata letak atom karbon dan proton dideteksi dengan 13C NMR, DEPT, dan 1HNMR Bruker AV-500 (500 MHz). Titik leleh (melting point) ditentukan dengan menggunakan Gallen Kamp Melting Point Bicasa.
III. 4.7. HPLC Preparatif
HPLC preparatif dilakukan untuk memurnikan fraksi aktif hasil fraksinasi dari kromatografi kolom pada tahap pemurnian sebelumnya. Purifikasi menggunakan HPLC preparatif dilakukan dengan menggunakan Waters 2695 HPLC, dengan detektor Photo Diode Array (PDA), dan jenis kolom puresil 5μ C18 4,6x150 mm. Volume injeksi sebesar 100 uL per injeksi dibawah kondisi tekanan 1267 psi, dan kecepatan alir 1 mL menit-1 dengan fasa geraknya adalah 0-45% campuran metanol–air dan selama 25 menit (Kazakevich dan Lobrutto 2007).
III. 4.8. HPLC Analitik
Pada HPLC analitik digunakan kolom analitik Sunfire C18 column (4,6 x 250 mm, Shiseido Co. Ltd., Tokyo, Japan). Fasa gerak yang digunakan adalah campuran metanol-air (0-100%) dengan elusi linier gradien selama 25 menit dan selanjutnya elusi isokratik 100% metanol selama 10 menit, dengan kecepatan alir 1 mL menit-1, volume injeksi 10μL, dan diamati pada panjang gelombang λ 210 nm (Kazakevich dan Lobrutto 2007). Kurva standar senyawa aktif dibuat yang selanjutnya digunakan untuk menentukan konsentrasi senyawa aktif yang akan ditentukan konsentrasinya. Kurva standar senyawa aktif siklo(tirosil-prolil) disajikan dalam Lampiran 1.
III. 4.9. Penentuan Minimum Inhibitory Concentration (MIC)
Minimum Inhibitory Concentration (MIC) ditentukan dengan cara
melarutkan senyawa antibiotik hasil purifikasi dalam beberapa konsentrasi, yaitu dari konsentrasi 6500 μg mL-1, 3250 μg mL-1
, 1625 μg mL-1, 812,5 μg mL-1, 406,3 μg mL-1
, 203,1 μg mL-1, 101,6 μg mL-1, dan 50,5 μg mL-1. Masing-masing konsentrasi diuji aktivitasnya menggunakan metode disc diffusion agar. MIC ditentukan terhadap 4 macam bakteri uji yaitu Escherichia coli ATCC 25922,
Pseudomonas aeruginosa ATCC 27853. Diameter kertas cakram yang digunakan
adalah 6 mm. Zona bening yang terbentuk diukur diameternya. Selanjutnya dibuat kurva Log [C] (konsentrasi) sebagai sumbu Y terhadap X2
(diameter zona bening) sebagai sumbu X. Titik potong sumbu Y pada X=0 merupakan nilai Log MIC. Metode penentuan MIC ini mengikuti Bonev et al. (2008) dan Andrews (2001).
III.4.10. Penentuan Kurva Pertumbuhan Mikroba pada Fase Vegetatif
Kurva pertumbuhan ditentukan dengan melakukan pengamatan perubahan biomassa, pH medium,dan gula pereduksi per satuan waktu (jam). Sebanyak 2 Ose isolat terpilih diinokulasikan dalam 15 mL medium ekstrak khamir–ekstrak malt pada pH 7,6. Jumlah sel dihitung dan ditentukan, sehingga jumlah sel menjadi kurang lebih 106-108 sel mL-1. Sebanyak 3 % (v/v) kultur pre-vegetatif diinokulasikan kedalam 100 mL medium vegetatif dalam labu erlenmeyer 250 mL. Komposisi medium vegetatif yang digunakan meliputi; pepton 5 g L-1, ekstrak khamir 3 g L-1, ekstrak malt 3 g L-1, glukosa 10 g L-1, air demineral 250 mL, and air laut 750 mL. Selanjutnya diinkubasi pada suhu 30 °C selama 64 jam dengan kecepatan agitasi sebesar 150 rpm. Pengamatan dilakukan setiap 8 jam sekali dengan mencatat perubahan parameter yang diamati. Kurva pertumbuhan diperoleh dengan melakukan plot perubahan biomassa (bobot kering sel), pH, dan gula reduksi sebagai sumbu Y serta waktu pengamatan masing-masing parameter pada sumbu X. Waktu transfer fase vegetatif ke fase fermentatif ditentukan pada saat sebelum berakhirnya fase logaritmik.
III.4.11. Profil Fermentasi Isolat Streptomyces sp. A11
Profil fermentasi dilakukan dengan mengamati perubahan beberapa parameter seperti pH, biomassa, gula pereduksi, nitrogen total, dan antibiotik yang dihasilkan selama proses fermentasi. Perubahan parameter tersebut digambarkan dalam bentuk kurva dengan parameter pH, biomassa, gula pereduksi, nitrogen total, dan antibiotik diplotkan dalam sumbu Y dan interval waktu pengamatan
masing-masing parameter pada sumbu X. Komposisi medium yang digunakan adalah maltosa 10 g L-1, glukosa 2 g L-1, pepton 5 g L-1, ekstrak khamir 1 g L-1, Fe.citrate nH2O 0,3 g L-1, pH: 7,6, air demineral 250 mL, air laut 750 mL. Fermentasi dilakukan dengan menggunakan labu erlenmeyer 250 mL dengan volume kerja sebesar 100 mL. Fermentasi dilakukan pada suhu 30 °C selama 144 jam dengan kecepatan agitasi 150 rpm. Laju pertumbuhan spesifik maksimum (μmaks) dan rendemen pembentukan biomassa per massa substrat (Yx/s) juga ditentukan. Laju pertumbuhan spesifik maksimum (μmaks) diperoleh dari gradien koefisien arah kurva selama fase eksponensial dari ln X (biomassa) pada sumbu X terhadap waktu (jam) pada sumbu Y. Rendemen pembentukan biomassa per massa substrat (Yx/s) diperoleh dari gradien yang dibentuk oleh kurva Xt–Xo pada sumbu Y versus So-S pada sumbu X (Mangunwidjaya et al. 1994). Pertumbuhan biomassa, perubahan pH, gula pereduksi, nitrogen total, dan konsentrasi siklo(tirosil-prolil) diukur dalam setiap interval waktu 8 jam. Prosedur penentuan konsentrasi gula pereduksi, nitrogen total, dan bobot kering sel berturut-turut disajikan dalam Lampiran 2, 3, dan 4.
III. 4.12. Penentuan Suhu dan pH Awal Terbaik pada Proses Fermentasi
Suhu terbaik proses fermentasi ditentukan dalam rentang 26, 28, 30, 32, dan 34 °C. Inkubasi dilakukan dengan menggunakan shaker inkubator. Komposisi medium fermentasi yang digunakan adalah maltosa 10 g L-1, glukosa 2 g L-1, pepton 5 g L-1, ekstrak khamir 1 g L-1, Fe.citrate nH2O 0,3 g L-1, air demineral 250 mL, dan air laut 750 mL, serta pH medium ditentukan sebelum proses sterilisasi pada pH 7,6. Fermentasi dilakukan dengan menggunakan labu erlenmeyer 250 mL dengan volume kerja sebesar 100 mL. Fermentasi lakukan selama 144 jam dengan kecepatan agitasi 150 rpm, dan kriteria suhu terbaik dipilih pada suhu fermentasi yang menghasilkan konsentrasi siklo(tirosil-prolil) paling tinggi.
Penetapan pH awal medium fermentasi terbaik ditentukan dalam beberapa titik yaitu pH 4,5 ; 5 ; 5,5 ; 6 ; 6,5 ; 7 ; 7,5 dan 8. Variasi pH awal medium fermentasi diatur sebelum sterilisasi dilakukan. Komposisi medium fermentasi
yang digunakan adalah maltosa 10 g L-1, glukosa 2 g L-1, pepton 5 g L-1, ekstrak khamir 1 g L-1, Fe.citrate nH2O 0,3 g L-1, air demineral 250 mL, dan air laut 750 mL. Fermentasi dilakukan dengan menggunakan labu erlenmeyer 250 mL dengan volume kerja sebesar 100 mL. Fermentasi dilakukan selama 144 jam dengan kecepatan agitasi 150 rpm, dan kriteria pH terbaik dipilih pH fermentasi yang menghasilkan konsentrasi siklo(tirosil-prolil) paling tinggi.
III.4.13. Optimasi Medium Fermentasi
Optimasi medium fermentasi diawali dengan percobaan pendahuluan untuk mendapatkan jenis sumber karbon, sumber nitrogen, dan mineral terbaik. Pada penentuan sumber karbon terbaik, komposisi medium utamanya adalah komposisi menurut Kanoh et al. (2005); pepton 5 g L-1, ekstrak khamir 1 g L-1, Fe.citrate nH2O 0,3 g L-1, pH: 7,5, air demineral 250 mL, air laut 750 mL yang ditambahkan 10 g L-1 sumber karbon yang akan diuji. Dalam hal ini jenis sumber karbon yang diuji adalah glukosa, maltosa, laktosa, sukrosa, molase, dan dektrin.
Penentuan sumber nitrogen terbaik dilakukan dengan komposisi medium adalah 10 g L-1 glukosa, Fe.citrate hydrate 0,3 g L-1, air demineral 250 mL, air laut 750 mL, sumber nitrogen dengan bobot masing-masing disesuaikan dengan nitrogen total seperti yang disajikan dalam Lampiran 5. Sumber nitrogen yang digunakan antara lain asam glutamat, ekstrak khamir, pepton, amonium sulfat dan hidrolisat kasein. Konsentrasi masing-masing sumber nitrogen mengacu pada Kanoh et al. (2005), yaitu konsentrasi nitrogen ditentukan menjadi 0,76 g L-1.
Penentuan komposisi mineral terbaik dilakukan dengan mengacu dari beberapa sumber literatur yang disajikan dalam Tabel 2. Kompisisi medium fermentasi untuk penentuan mineral terbaik adalah komposisi medium menurut Kanoh et al. (2005) yang dimodifikasi; glukosa 10 g L-1, pepton 5 g L-1, ekstrak khamir 1 g L-1, Fe.citrate hydrate 0,3 g L-1, pH: 7,5, air demineral 250 mL, air laut 750 mL. Proses fermentasi penentuan sumber karbon, nitrogen, dan mineral terbaik dilakukan selama 144 jam dengan volume kerja 100 mL dalam labu erlenmeyer 250 mL, suhu 30 °C, dengan kecepatan agitasi 150 rpm. Kriteria
yang digunakan untuk menentukan sumber karbon, sumber nitrogen, dan mineral terbaik adalah yang menghasilkan konsentrasi siklo(tirosil-prolil) paling tinggi.
Tabel 2 Komposisi mineral yang digunakan dalam medium fermentasi
No Mineral Komposisi
1 Komposisi mineral menurut Sousa et al. (2001) K2HPO4 1 g L-1, MgSO4.7 H2O 0,025 g L-1, ZnSO4 7 H2O 0,025 g L-1, CaCl2.2 H2O 0,025 g L-1, FeSO4 7 H2O 0,025 g L-1.
2 Komposisi mineral menurut Furtado et al. (2005)
KH2PO4 0,6 g L-1, Mg.SO4.7 H2O 5 g L-1, Cu.SO4.5 H2O 0,001 g L-1, FeSO4.7 H2O 0,003 g L-1 3 Komposisi mineral menurut
Dhananjeyan et al. (2010)
K2HPO4 0,1 g L-1, Mg.SO4.7 H2O 0,5 g L-1, CaCl2.2H2O 0,1 g L-1, FeSO4.5H2O 0,05 g L-1 4 Komposisi mineral menurut
Voelker & Altaba (2001)
CaCl2.2H2O 0,011 g L-1, FeSO4.5H2O 0,007 g L-1, MnCl2.4 H2O 0,002 g L-1, ZnSO4.7 H2O 0,002 g L-1, CuSO4. H2O 0,0004 g L-1, CoCl2.6 H2O 0,0004 g L-1 5 Komposisi mineral menurut
Dharmaraj et al. (2010) NaCl 0,8 g L-1, NH4Cl 1 g L-1, KCl. 0,1 g L-1, KH2PO4 0,1 g L-1, 0,2 g L-1 MgSO4. 7H2O, 0,04 g L-1 CaCl22H2O.
Komposisi medium yang digunakan dalam optimasi medium fermentasi menggunakan Response Surface Methodology meliputi 3 variabel terpilih, yaitu sumber karbon, nitrogen, dan mineral, ditambah 2 g L-1 glukosa, air demineral 250 mL, air laut 750 mL. Keasaman medium fermentasi diatur pada pH 7,5 sebelum dilakukan sterilisasi. Fermentasi dilakukan dengan menggunakan labu erlenmeyer 250 mL dengan volume kerja sebesar 100 mL. Fermentasi dilakukan selama 144 jam dengan kecepatan agitasi 150 rpm. Ketiga variabel terpilih digunakan sebagai variabel bebas. Sedangkan konsentrasi senyawa aktif yang dihasilkan akibat dari perlakuan 3 variabel bebas tersebut merupakan respon yang akan dicari dalam penelitian ini. Rancangan percobaan untuk mendapatkan data respon yang muncul akibat dari perlakuan digunakan metode Central Composite
Design. Selanjutnya untuk menentukan daerah optimum pada respon digunakan
metode permukaan respon (Response Surface Methodology). Untuk membantu penyelesaian optimasi ini akan digunakan perangkat lunak Design Expert 7. Kisaran dan taraf variabel yang diuji pada optimasi disajikan dalam Tabel 3.
Tabel 3 Kisaran dan taraf variabel yang diuji pada optimasi komposisi medium Kisaran dan taraf
Variabel yang diuji
-1,68 -1 0 1 1,68 Konsentrasi sumber karbon (g L-1) 21,6 25 30 35 38,4 Konsentrasi sumber nitrogen (g L-1) 6,64 8 10 12 13,36 Penambahan mineral (mL larutan
stok per liter kaldu fermentasi)
3,3 5 7,5 10 11,7
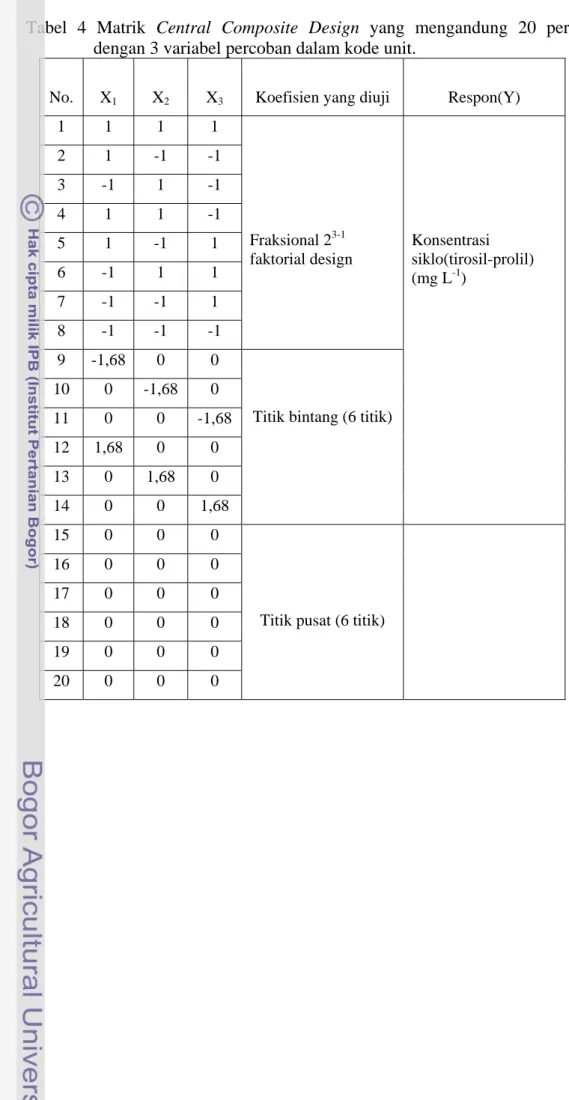
Dalam studi ini digunakan 8 titik faktorial fraksional 23-1, 6 titik bintang, dan 6 titik pusat, sehingga total percobaan adalah 20 percobaan. Nilai pusat perlakuan yang digunakan adalah konsentrasi sumber karbon 30 g L-1, konsentrasi nitrogen 10 g L-1, dan konsentrasi mineral adalah 7,5 mL L-1. Tabel 4 menunjukkan matrik satuan-satuan percobaan pada optimasi medium fermentasi dalam kode dan nilai asli. Dengan 3 variabel yang diuji maka model kuadratiknya persamaan sebagai berikut (Mongomery 1997).
Y = bo + b1X1i + b2 X2i + b3 X3i + b11X1i2 + b22X2i2 + b33X3i2 + b12X1iX2i + b12X1iX2i + b13X1iX3i + b23X2iX3i
Keterangan : Y = konsentrasi senyawa aktif (mg L-1) X1 = konsentrasi sumber karbon (g L-1) X2 = konsentrsi sumber nitrogen (g L-1) X3 = volume penambahan mineral (mL).
Tabel 4 Matrik Central Composite Design yang mengandung 20 percobaan dengan 3 variabel percoban dalam kode unit.
No. X1 X2 X3 Koefisien yang diuji Respon(Y)
1 1 1 1 2 1 -1 -1 3 -1 1 -1 4 1 1 -1 5 1 -1 1 6 -1 1 1 7 -1 -1 1 8 -1 -1 -1 Fraksional 23-1 faktorial design 9 -1,68 0 0 10 0 -1,68 0 11 0 0 -1,68 12 1,68 0 0 13 0 1,68 0 Konsentrasi siklo(tirosil-prolil) (mg L-1) 14 0 0 1,68
Titik bintang (6 titik)
15 0 0 0 16 0 0 0 17 0 0 0 18 0 0 0 19 0 0 0 20 0 0 0