HALAMAN PENGESAHAN Nama Materi : Hidrolisa Pati
Kelompok : 13 Selasa Siang
Anggota :
Semarang, Maret 2016 Asisten Pembimbing
Ihdina Sulistyanigtiyas 1. Anindita Indriana NIM : 21030114120002
2. Eunice Elizabeth NIM : 21030114130118 3. Hibatullah Arif Y. NIM : 21030114130152
Pati dan juga produk turunannya merupakan bahan yang multiguna dan banyak digunakan pada berbagai industri antara lain pada minuman, makanan yang diproses, kertas, makanan ternak, farmasi dan bahan kimia serta industri nonpangan seperti tekstil, detergent, kemasan dan sebagainya. Dalam industri makanan pembentuk gel dan encapsulating agent. Dalam industri kertas digunakan sebagai zat aadtive seperti wet-end untuk surface size dan coating binder, bahan perekat, dan glass fiber sizing. Tujuan dari percobaan hidrolisa pati yaitu mempelajari pengaruh suhu terhadap reaksi hidrolisa pati dan menghitung konstanta kecepatan reaksi dan menganalisa pengaruh suhu terhadap konstanta kecepatan reaksi.
Hidrolisa merupakan reaksi pengikatan gugus hidroksil (-OH) oleh suatu senyawa. Gugus OH dapat diperoleh dari senyawa air. Hidrolisis pati terjadi antara suatu reaktan pati dengan reaktan air. Reaksi ini adalah orde satu, karena reaktan air yang dibuat berlebih, sehingga perubahan reaktan dapat diabaikan. Reaksi hidrolisis pati dapat dilakukan menggunakan katalisator H+ yang dapat diambil dari asam. Variabel-variabel yang berpengaruh terhadap reaksi hidrolisa yaitu katalisator, suhu dan tekanan, pengadukan, perbandingan zat pereaksi.
Pati yang kami gunakan pada percobaan ini yaitu tepung tapioka dengan variabel katalis HCl dan H2SO4. Langkah awal yang kami lakukan yaitu menghitung densitas pati, HCl, dan H2SO4, membuat glukosa standar, dan menghitung kebutuhan gram pati. Kemudian melakukan standarisasi larutan gula standart. Setelah itu penentuan kadar pati awal dan hidrolisa pati.
Pada percobaan kami, konversi hidrolisa pati pada varabel katalis H2SO4 lebih besar daripada katalis HCl karena H2SO4 lebih reaktif. Karena reaksi yang berjalan lambat, maka konversi berjalan kecil. Nilai konstanta kecepatan reaksi katalis H2SO4 yaitu 0.0945/menit dan HCl 0.0762/menit. Secara teori, percobaan kami sesuai dengan teori, yang mana semakin tinggi konversi, semakin tinggi pula konctanta kecepatan reaksi. Salah satu reaksi reduksi oksidasi dalam proses adalah pembentukan endapan Cu2O.
Saran untuk percobaan hidrolisa pati adalah usahakan suhu operasi dijaga konstan 70oC usahakan motor pengaduk di gunakan secara terus menerus supaya pati dapat terdispersi dengan baik, dan usahakan titrasi dilakukan diatas kompor dalam keadaan mendidih.
PRAKATA
Puji dan syukur kehadirat Tuhan Yang Maha Esa, karena berkat rahmat-Nya kami dapat menyelesaikan Laporan Praktikum Proses Kimia berjudul Absorpsi CO2 dengan NaOH dengan baik dan tepat waktu.
Adapun tujuan dari penulisan laporan ini adalah sebagai syarat untuk menyelesaikan Praktikum Proses Kimia.Selain itu pembuatan Laporan Praktikum Proses Kimia ini adalah sebagai bukti hasil dari percobaan-percobaan yang dilakukan saat praktikumdan melengkapi tugas dari Praktikum Proses Kimia.Penulisan laporan ini didasarkan pada hasil percobaan yang dilakukan selama praktikum serta literatur-literatur yang ada baik dari buku maupun sumber lainnya.
Dengan ini, kami juga menyampaikan terima kasih kepada:
1. Bapak Prof. Dr. Ir. Purwanto, DEA. sebagai Penanggung jawab Laboratorium Proses Kimia.
2. Bapak Dr. Siswo Sumardiono, ST, MT sebagai dosen pengampu materi Hidrolisis Pati. 3. Asisten Laboratorium Proses Kimia.
4. Teman-teman Dedikatif yang membantu dalam penyusunan laporan ini.
Laporan ini merupakan tulisan yang dibuat berdasarkan percobaan yang telah dilakukan.Tentu ada kelemahan dalam teknik pelaksanaan maupun dalam tata penulisan laporan ini.Maka kritik dan saran dari pembaca sangat kami harapkan dalam untuk peningkatan mutu dari laporan serupa di masa mendatang.Akhir kata, selamat membaca dan terimakasih.
Semarang, Maret 2016
DAFTAR ISI INTISARI...ii PRAKATA...iii DAFTAR ISI...iv DAFTAR GAMBAR...v BAB I PENDAHULUAN...1 1.1 Latar Belakang...1 1.2 Tujuan Percobaan...2 1.3 Manfaat Percobaan...2
BAB II TINJAUAN PUSTAKA...3
2.1 Pengertian Pati...3
2.2 Hidrolisa Pati...3
2.3 Modifikasi Pati...5
2.4 Tepung Tapioka...5
2.5 Variabel yang Berpengaruh...7
BAB III METODOLOGI PERCOBAAN...9
3.1. Bahan dan Alat yang digunakan...9
3.2. Gambar Alat Utama...9
3.3. Prosedur Percobaan...10
BAB IV HASIL DAN PEMBAHASAN...13
4.1 Hasil dan Pembahasan Pengaruh Variabel Jenis Katalis Terhadap Konversi Pati...13
4.2 Hasil dan Pembahasan Pengaruh Variabel Jenis Katalis Terhadap Kecepatan Reaksi Hidrolisa Pati...14
4.3 Mekanisme Reaksi Hidrolisis Pati dengan Asam...15
BAB V PENUTUP...17
5.1 Kesimpulan...17
5.2 Saran...17
DAFTAR PUSTAKA...18 LAMPIRAN
DAFTAR GAMBAR
Gambar 3.1 Rangkaian alat percobaan……….9 Gambar 4.1 hubungan waktu vs konversi pati dengan variabel jenis katalis……….13 Gambar 4.2 Pengaruh waktu terhadap vs -ln(1-xa) dengan variabel jenis katalis HCl……..14 Gambar 4.3 Pengaruh waktu terhadap vs -ln(1-xa) dengan variabel jenis katalis H2SO4 ……14
BAB I
PENDAHULUAN
1.1 Latar Belakang
Nilai impor produk berbasis gandum masih di peringkat pertama di Indonesia, dan terus meningkat dari tahun ke tahun. Hal ini mengakibatkan peningkatan volume impor gandum. Pada tahun 2012, Indonesia telah mengimpor 6 juta ton gandum. Oleh karena itu, terobosan dan strategi yang efisien diperlukan untuk mengurangi impor gandum. Salah satu upaya yang bisa dilakukan adalah dengan mengoptimalkan dan meningkatkan sumber alternatif karbohidrat dari umbi tanaman ous seperti singkong (Manihot esculenta Crantz., Euphorbiaceae). Singkong merupakan sumber karbohidrat makanan penting untuk sekitar 800 juta orang di daerah tropis. Afrika adalah produsen utama singkong di seluruh dunia, diikuti oleh Asia dan Amerika Latin, dengan total produksi sekitar 200 juta ton. Dalam perdagangan global singkong, Thailand dan Indonesia adalah eksportir singkong utama; mengekspor terutama keripik singkong, ubi kayu pelet, singkong pati, dan tepung (Khumaida, 2015).
Pati dan juga produk turunannya merupakan bahan yang multiguna dan banyak digunakan pada berbagai industri antara lain pada minuman, makanan yang diproses, kertas, makanan ternak, farmasi dan bahan kimia serta industri nonpangan seperti tekstil, detergent, kemasan dan sebagainya (Oladebeye, 2009). Dalam industri makanan pembentuk gel dan encapsulating agent. Dalam industri kertas digunakan sebagai zat aadtive seperti wet-end untuk surface size dan coating binder, bahan perekat, dan glass fiber sizing (Chiu & Solarek, 2009).
Berbagai varian pati didasarkan pada perbedaan struktural, kandungan amilosa, amilopketin, protein dan lipid. Secara umum kandungan pati yang utama yaitu polimer anhidroglukosa meliputi amilosa dan amilopketin, keduanya diikat dengan ikatan α(1,4) dalam segmen linear; serta ikatan α(1,6) di titik percabangan. Amilopektin merupakan kandungan utama pati, berkisar 70-80% dan berpengaruh pada physiochemical serta cita rasa pati (Dona et al, 2010).
Pada reaksi hidrolisa biasanya dilakukan dengan menggunakan katalisator asam seperti HCl (asam klorida). Bahan yang digunakan untuk proses hidrolisis adalah pati. Di indonesia banyak dijumpai tanaman yang menghasilkan pati. Tanaman-tanaman itu
seperti seperti padi, jagung, ketela pohon, umbi-umbian, aren dan sebagainya.
1.2 Tujuan Percobaan
1. Mempelajari pengaruh variable terhadap reaksi hidrolisa pati.
2. Menghitung konstanta kecepatan reaksi dan menganalisa pengaruh variable terhadap konstanta kecepatan reaksi.
1.3 Manfaat Percobaan
1. Mahasiswa dapat mengetahui pengaruh variable terhadap reaksi hidrolisa pati. 2. Mahasiswa dapat menghitung konstanta kecepatan reaksi dan menganalisa
BAB II
TINJAUAN PUSTAKA
2.1 Pengertian Pati
Pati termasuk dalam polisakarida yang merupakan polimer glukosa, yang terdiri atas amilosa dan amilopektin. Amilosa merupakan bagian polimer linier dengan ikatan α-(1,4) unit glukosa yang meruapakan rantai linear . Derajat polimerisasi (DP) amilosa berkisar antara 500−6.000 unit glukosa, bergantung pada sumbernya. Adapun amilopektin merupakan polimer α-(1,4) unit glukosa dengan rantai samping α-(1,6) unit glukosa. Ikatan α-(1,6) unit glukosa ini jumlahnya sangat sedikit dalam suatu molekul pati, berkisar antara 4−5%. Namun, jumlah molekul dengan rantai cabang, yaitu amilopektin, sangat banyak dengan DP berkisar antara 105 dan 3x106 unit glukosa dan merupakan komponen utama yang dapat mempengaruhi physiochemical dan cita rasa dari pati. Amilosa merupakan hidrokoloid konformasi yang menyebabkan viskositas tinggi pada pati yang larut dalam air yang bervariasi relatif kecil dengan suhu, memiliki permukaan bagian dalam yang relatif hidrofobik yang tidak mampu menahan air. Bentuk amilosa gel berguna dan film. Kristalisasi pada stabilitas pendinginan dan penyimpanan, menyebabkan penyusutan dan pelepasan air (sineresis). Peningkatan konsentrasi amilosa menyebabkan menurunnya kelengketan gel, tetapi meningkatkan ketegasan gel. Modifikasi pati sederhana dan paling umum adalah dengan hidrolisis asam, yang secara luas digunakan dalam makanan, kertas, tekstil, dan industri farmasi (Wuttisela, 2008).
2.2 Hidrolisa Pati
Hidrolisa merupakan reaksi pengikatan gugus hidroksil (-OH) oleh suatu senyawa. Gugus OH dapat diperoleh dari senyawa air. Hidrolisis dapat digolongkan menjadi hidrolisis murni, hidrolisis katalis asam, hidrolisis katalis basa, hidrolisis gabungan alkali dengan air dan hidrolisis dengan katalis enzim. Dua teknologi yang umum digunakan dalam konversi pati menjadi glukosa adalah hidrolisis asam dan hidrolisis enzimatik. Konsentrasi asam, suhu operasi dan durasi hidrolisis memiliki peran penting dalam menentukan baik kuantitas dan kualitas glukosa. Selama hidrolisis molekuler pati dipecah ke unit yang lebih kecil lebih sederhana. Sedangkan berdaasarkan fase reaksi yang terjadi diklasifikasikan menjadi hidrolisis fase cair dan hidrolisis fase uap (Ayoola, 2013).
Hidrolisis pati terjadi antara suatu reaktan pati dengan reaktan air. Reaksi ini adalah orde satu, karena reaktan air yang dibuat berlebih, sehingga perubahan reaktan dapat
diabaikan. Reaksi hidrolisis pati dapat dilakukan menggunakan katalisator H+ yang dapat diambil dari asam. Reaksi yang terjadi pada hidrolisis pati adalah sebagai berikut :
(C6H10O5)x + H2O xC6H12O6
Berdasarkan teori kecepatan reaksi : -rA = k. Cpati. Cair ...(1)
karena volume air cukup besar, maka dapat dianggap konsentrasi air selama perubahan reaksi sama dengan k’, dengan besarnya k’ :
k’ = k. Cair ...(2)
sehingga persamaan 1 dapat ditulis sebagai berikut -rA = k’. C pati dari persamaan kecepatan reaksi ini, reaksi hidroisis merupakan reaksi orde satu. Jika harga –rA = - dCA/dt maka persamaan 2 menjadi :
−dCa dt =k ' Ca …(3) −dCa Ca =k ' dt ...(4)
Apabila CA = CA0 (1-XA) dan diselesaikan dengan integral dan batas kondisi t1, CA0 dan t2 : CA akan diperoleh persamaan :
Apabila CA = CA0 (1-XA) dan diselesaikan dengan integral dan batas kondisi t1, CA0 dan t2 : CA akan diperoleh persamaan :
−
∫
Cao Ca dCa Ca =k∫
t 1 t 2 dt . ..(5) ln Ca Cao=k (t 2−t 1) . ..(6) ln 1 1−XA=k ' (t 2−t 1) . ..(7)Persamaan 7 dapat diselesaikan dengan menggunakan pendekatan regresi y = mx + c, dengan :
y=ln 1
1− XAdan x=t 2
Prosedur yang digunakan untuk hidrolisis pati singkong, yaitu: hidrolisis asam, hidrolisis asam-enzim dan hidrolisis enzim-enzim. Pengaruh suhu, konsentrasi pati awal, konsentrasi asam dan waktu pada hidrolisis asam memiliki peran penting dalam proses hidrolisis. Hasil penelitian menunjukkan bahwa dalam hidrolisis asam kondisi operasi optimum lokal adalah: 15% konsentrasi pati ubi kayu, 0.5M HCl, pada 70 oC dan waktu operasi 10 jam, maka konsentrasi gula yang dihasilkan 32,5 g / l dan dekstrosa ekuivalen (DE) 22. Jika menggunakan 30% konsentrasi awal pati singkong dan total waktu operasi yang efektif dari 50 jam, menghasilkan konsentrasi gula 72 g/l dan DE dari 24,8 (Salomon, 2006).
2.3 Modifikasi Pati
Pati asli pada umumnya memiliki struktur granular, tidak larut air, dan dalam bentuk ini digunakan hanya dalam beberapa aplikasi spesifik yang terbatas. Modifikasi adalah pati yang gugus hidroksinya telah mengalami perubahan. Pati memiliki sifat tidak dapat digunakan secara langsung dan oleh karena itu harus dimodifikasi secara kimia atau fisik untuk meningkatkan sifat positif dan mengurangi sifat yang tidak diinginkan. Pati biasanya digunakn untuk produk makanan, bahan perekat dan glass fiber sizing. Selain itu juga ditambahkan dalam plastik unutk mempercepat proses degradasi. Modifikasi secra kimia umunya meliputi esterifikasi, etherifikasi, hidrolisis, oksidasi dan cross-linking (Chiu & Solarek, 2009). Pati yang telah termodifikasiakan mengalami perubahan sifat yang dapat disesuaikan untuk keperluan-keperluan tertentu. Akan tetapi sama seperti pati alami, pati termodifikasi bersifat tidak larut dalam air dingin (Koswara, 2009).
2.4 Tepung Tapioka
Singkong merupakan salah satu varietas umbi-umbian yang tidak asing bagi penduduk Indonesia, hal ini dikarenakan keberadaannya dapat disejajarkan dengan beras dan jagung yang merupakan bahan pokok sebagian besar masyarakat Indonesia. Disamping itu, singkong juga dapat diolah menjadi tepung tapioka atau pati, yang nantinya dapat dimanfaatkan pada berbagai industri pangan dan industri kimia lainnya. Namun, pati asli
memiliki keterbatasan yang mengurangi sifat fungsional mereka. Oleh karena itu, pati yang dimodifikasi untuk meningkatkan kinerja mereka dalam aplikasi yang berbeda. Pati dapat dimodifikasi oleh enzim, kimia dan metode fisik. Granula pati berpori terbentuk oleh hidrolisis parsial pati menggunakan amilase pada suhu di bawah titik gelatinisasi. Dua amilase yang umum digunakan adalah α -amylase dan glukoamilase. Selain itu, asam mineral yang umum digunakan adalah klorida (HCl) dan sulfat (H2SO4) Asam juga diterapkan untuk menghidrolisis pati pada suhu gelatinisasi lebih rendah (Tongta, 2014). Pati alami (belum dimodifikasi) mempunyai beberapa kekurangan pada karakteristiknya yaitu membutuhkan waktu yang lama dalam pemasakan (sehingga membutuhkan energi tinggi), pasta yang terbentuk keras dan tidak bening, selain itu sifatnya terlalu lengket dan tidak tahan perlakuan dengan asam. Dengan berbagai kekurangan tadi, maka dikembangkan berbagai modifikasi terhadap tepung tapioka yang diharapkan dapat memenuhi kebutuhan pasar (industri) baik dalam skala nasional maupun internasional (ekspor). Berbagai proses kimia yang dapat diterapkan pada modifikasi pati diantaranya oksidasi, hidrolisa, cross-linking atau cross bonding dan subtitusi. Manihot utillisima mempunyai kemampuan untuk membentuk gel melalui proses pemanasan (90oC atau lebih) sebagai akibat pecahnya struktur amilosa dan amilopektin. Dengan terbentuknya gel ini, ketela mampu menjebak udara dan air bebas. Pemecahan ikatan amilosa dan amolopektin akan menyebabkan terjadinya perubahan lebih lanjut seperti peningkatan molekul air sehingga terjadi penggelembungan molekul, pelelehan kristal, dan terjadi peningkatan viskositas (Halley, 2014).
Tepung tapioka merupakan sumber potensial dari glukosa. Tepung tapioka dihidrolisis parsial dalam asam klorida pada suhu kamar untuk berbagai panjang waktu. Kristalinitas pati meningkat sementara kandungan amilosa yang menurun dengan bertambahnya waktu reaksi. Selama hidrolisis terjadi perubahan morfologi dan reaksi asam (Varavinit, 2007). Dalam suatu percobaan, didapatkan data bahwa tingkat pelarutan pulp singkong meningkat dengan meningkatnya suhu pemanasan dan mencapai maksimum (92,54%) pada 220 ° C, sedangkan tepung tapioka mencapai hampir 100% pada 140 ° C. Yield glukosa tertinggi dari pulp singkong dan tepung tapioka dalam suatu percobaan adalah 28,59 dan 58,76% bahan kering, masing-masing. Variasi waktu pra-pemanasan pada 230 ° C tidak memberikan pengaruh yang signifikan terhadap hasil glukosa dari pulp singkong. Namun, hasil glukosa dari tepung tapioka menurun karena meningkatkan waktu pemanasan (Hermiati, 2011).
Pati singkong memiliki beberapa karakteristik yang mendukung keperluan industri, termasuk sebagai bahan baku dalam produksi etanol. Beberapa karakteristik pati singkong adalah kemurniannya tinggi, rasa netral, dan kelarutan, sangat kental, dan memiliki kecenderungan yang rendah untuk retrograsi dibandingkan dengan pati lain seperti kentang, beras, dan jagung (Collares, 2013).
2.5 Variabel yang Berpengaruh
Variabel - variabel yang berpengaruh dalam reaksi hidrolisa pati meliputi 1. Katalisator
Hampir sama semua reaksi hidrolisa membutuhkan katalisator untuk mempercepat jalannya reaksi. Katalisator yang dipakai dapat berupa enzim atau Tepung tapioka merupakan sumber potensial dari glukosa. Tingkat pelarutan pulp singkong meningkat dengan meningkatnya suhu pemanasan dan mencapai maksimum (92,54%) pada 220 ° C, sedangkan tepung tapioka mencapai hampir 100% pada 140 ° C. Yield glukosa tertinggi dari pulp singkong dan tepung tapioka dalam suatu percobaan adalah 28,59 dan 58,76% bahan kering, masing-masing. Variasi waktu pra-pemanasan pada 230 ° C tidak memberikan pengaruh yang signifikan terhadap hasil glukosa dari pulp singkong. Namun, hasil glukosa dari tepung tapioka menurun karena meningkatkan waktu pemanasan.
2. Suhu dan Tekanan
Pengaruh suhu terhadap kecepatan reaksi mengikuti persamaan Arrhenius, dimana semakin tinggi suhu maka semakin cepat laju reaksinya. Untuk mencapai konversi tertentu, diperlukan waktu sekitar 3 jam untuk menghidrolisa pati ketela rambat pada suhu 100 °C. Tetapi jika suhunya dinaikkan hingga 135 °C, konversi yang sama dapat dicapai dalam waktu 40 menit. Hidrolisis pati gandum dan jagung dengan katalisator H2SO4 memerlukan suhu 160 °C. Karena panas reaksi mendekati nol dan
reaksi berjalan dalam fase cair maka suhu dan tekanan tidak banyak mempengaruhi keseimbangan.
3. Pencampuran (pengadukan)
Supaya zat pereaksi dapat saling bertumbukan dengan sebaik-baiknya perlu adanya pencampuran. Untuk proses Batch, hal ini dapat dicapai dengan bantuan pengaduk atau alat pengocok. Apabila prosesnya berupa proses alir (kontinyu), maka pecampuran dilakukan dengan cara mengatur aliran didalam reaktor supaya terbentuk
olakan.
4. Perbandingan zat pereaksi
Jika salah satu zat pereaksi dibuat berlebihan jumlahnya maka keseimbanga n dapat bergeser kearah kanan dengan baik. Oleh karena itu, suspensi pati yang kadarnya rendah memberi hasil yang lebih baik dibandingkan dengan yang kadarnya tinggi. Bila kadar suspensi pati diturunkan dari 40% menjadi 20% atau 1% maka konversi akan bertambah dari 80% menjadi 87 atau 99 %. Pada permukaan, kadar suspensi pati yang tinggi sehingga molekul-molekul zat pereaksi akan sulit bergerak. Untuk menghasilkan glukosa biasanya dipergunakan suspensi pati sekitar 20%
BAB III METODOLOGI PERCOBAAN
3.1. Bahan dan Alat yang digunakan 3.1.1 Bahan
1. Glukosa anhidrit 5. Indikator MB
2. Tepung gandum 6. Fehling A
3. NaOH 7. Fehling B 4. HCl/H2SO4 8. Aquades 3.1.2 Alat 1. Gelas ukur 2. Termometer 3. Erlenmeyer 4. Statif dan klem 5. Buret
6. Labu leher tiga 7. Labu takar
3.2. Gambar Alat Utama Keterangan:
3.Labu leher tiga 4.Termometer 5.Pendingin balik 6.Klem
7.Statif
3.3. Prosedur Percobaan 1. Persiapan awal
a. Menghitung densitas pati
Ke dalam gelas ukur, 5 ml aquades dimasukkan 1 gram pati, catat penambahan volume.
ρpati=mpati ∆ V
b. Menghitung densitas HCl
Timbang berat picnometer kosong (m1), masukkan HCl/H2SO4 kedalam picnometer yang telah diketahui volumenya (v), timbang beratnya (m2), hitung densitas HCl/H2SO4.
ρHCl / H2SO4=
m2−m1 V
c. Membuat glukosa standar
Glukosa anhidrit sebanyak 2 gram dilarutkan dalam 1000 ml aquades.
2. Penentuan kadar pati
a. Standarisasi larutan fehling
5 ml Fehling A + 5 ml Fehling B + 15 ml glukosa standar, dipanaskan sampai
mendidih. Setelah mendidih ditambahkan 3 tetes MB, kemudian larutan dititrasi dengan glukosa standard hingga warna berubah menjadi merah bata. Catat volume titran (F) yang diperlukan, proses titrasi dilakukan dalam keadaan mendidih (diatas kompor).
b. Penentuan kadar pati awal
Untuk variabel 1 (Katalis HCl) , sebanyak 22.586 gram pati, 11.26 ml katalis HCl dan 418.41 ml aquadest. Untuk variabel 2 (Katalis H2SO4) , sebanyak 22.533 gram pati, 2.505 ml katalis HCl dan 427.213 ml aquadest. Kemudiandimasukkan ke dalam labu leher tiga dan dipanaskan hingga suhu 90oC, selama 1 jam. Setelah itu larutan didinginkan, diencerkan dengan aquades sampai 500 ml lalu
diambil 20 ml dan dinetralkan dengan NaOH (PH = 7). Larutan diambil 5 ml diencerkan sampai 100 ml, diambil 5 ml. Ke dalam Erlenmeyer dimasukkan 5 ml larutan + 5 ml Fehling A + 5 ml fehling B + 15 ml glukosa standard, kemudian dipanaskan sampai mendidih. Lalu ditambahkan 3 tetes indikator MB. Kemudian larutan dititrasi dengan glukosa standard sehingga berubah warna menjadi warna merah bata. Catat volum titran yang dibutuhkan (M). Yang perlu diperhatikan, proses titrasi dilakukan dalam keadaan mendidih diatas kompor. Lakukan hal yang sama untuk variabel lain
c. Hidrolisa pati
Untuk variabel 1 (Katalis HCl) , sebanyak 22.586 gram pati, 11.26 ml katalis HCl dan 418.41 ml aquadest. Untuk variabel 2 (Katalis H2SO4) , sebanyak 22.533 gram pati, 2.505 ml katalis HCl dan 427.213 ml aquadest. Kemudian dimasukkan ke dalam labu leher tiga dan dipanaskan hingga suhu 90oC, anggap sebagai t0 diambil
sampel sebanyak 20 ml. Kemudian sampel dinetralkan dengan NaOH (PH = 7). Larutan diambil 5 ml diencerkan sampai 100 ml, diambil 5 ml. Kedalam Erlenmeyer dimasukkan 5 ml larutan +5 ml Fehling A + 5 ml fehling B + 15 ml glukosa standard, kemudian dipanaskan sampai mendidih. Lalu ditambahkan3 tetes indikator MB.Kemudian larutan dititrasi dengan glukosa standard sehingga berubah warna menjadi warna merah bata. Catat V titran yang dibutuhkan (M). Yang perlu diperhatikan, proses titrasi dilakukan dalam keadaan mendidih diatas kompor. Pengambilan sampel dilakukan setiap selang waktu 5 menit sebanyak 5 kali yaitu 20 menit. (t0=menit ke-0 ,t1=menit ke-5, t2=menit ke-10, t3=menit
ke-15, t4=menit ke-20). Lakukan hal yang sama untuk variabel 2
Rumus penentuan kadar pati awal =
Xp 0= (F−M )× Nglukosa× 500 volume basis× 100 5 × 0.9 W Dimana N = 0,002 gr/ml
W = berat pati
Perhitungan kebutuhan reagen
a) Menghitung kebutuhan HCl/H2SO4 Dimana : VHCl/ H2SO4= NHCl / H2SO4× BMHCl/ H2SO4× Vlarutan ρHCl/ H2SO4× KadarHCl / H2SO4× 1000× grek kadar HCl = 0,25 untuk 25% 0,37 untuk 37% grek HCl = 1
b) Menghitung kebutuhan pati
Suspensi= Xp× Wpati
WHCl / H2SO4+Wair+Wpati
Dimana :
Wpati = ρpati x Vpati WHCl = ρHCl x VHCl
Wair = ρair x (Vlarutan -Vpati- VHCl )
Prosedur titrasi
5 ml fehling A + 5 ml fehling B + 5 ml glukosa standar
(jika ada hasil hidrolisa, prosedur diatas ditambah 5 ml sampel hasil hidrolisa)
↓
Dipanaskan sampai mendidih ↓
100 detik dari mendidih ditambah 3 tetes indikator MB ↓
2 menit kemudian dititrasi dengan glukosa standar, catat volume titran (titrasi dijalankan maks 1menit)
BAB IV
HASIL DAN PEMBAHASAN
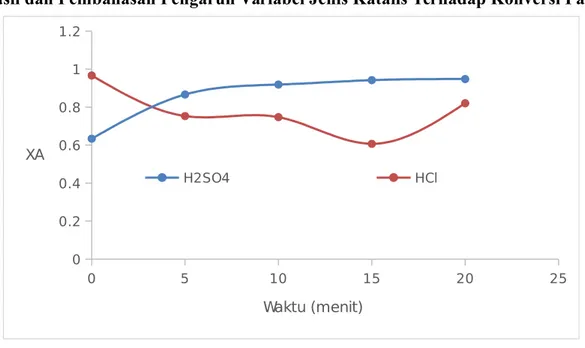
4.1 Hasil dan Pembahasan Pengaruh Variabel Jenis Katalis Terhadap Konversi Pati
0 5 10 15 20 25 0 0.2 0.4 0.6 0.8 1 1.2 H2SO4 HCl Waktu (menit) XA
Gambar 4.1 Hubungan Waktu Vs Konversi Pati dengan Variabel Jenis Katalis
Berdasarkan gambar 4.1 dapat diketahui bahwa nilai konversi dari katalis H2SO4 lebih besar dibandingkan katalis HCl dimana konversi pati dengan menggunakan katalis HCl relatif mengalami penurunan, sedangkan dengan katalias H2SO4 mengalami kenaikan. Hal ini dikarenakan pada hidrolisa pati dapar meningkat dengan adanya penambahan katalis yang mengandung senyawa anorganik seperti Cloride atau SO4 dimana ion SO4 lebih efektif karena akan lebih mengaktifkan ion H+ yang bereaksi (Hermiati et al, 2011).
Ion H+ pada katalis asam akan menyerang pada komponen amilosa yang terdapat pada pati. Hal ini karena amilosa merupakan rantai lurus molekul D-glucopyranose dimana
molekul tersebut dihubungkan oleh ikatan 1-4α glukosida. Ikatan 1-4α glukosida inilah yang akan diserang oleh ion H+. Sedangkan pada amilopektin lebih dominan oleh ikatan 1-6α glukosida. Selain itu, Bagian dalam heliks amilosa mengandung atom hydrogen. Itu
sebabnya, interior dari amilosa memiliki sifat hidrophobik sehingga dapat menjebak senyawa asam, asam lemak dari gliserida, alkohol dan iodine (Ayoola et al., 2013).
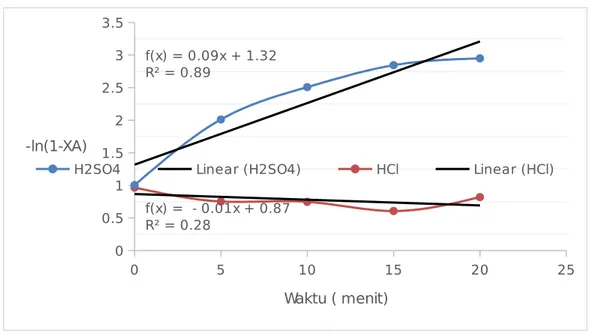
4.2 Hasil dan Pembahasan Pengaruh Variabel Jenis Katalis Terhadap Kecepatan Reaksi Hidrolisa Pati 0 5 10 15 20 25 0 0.5 1 1.5 2 2.5 3 3.5 f(x) = - 0.01x + 0.87 R² = 0.28 f(x) = 0.09x + 1.32 R² = 0.89
H2SO4 Linear (H2SO4) HCl Linear (HCl)
Waktu ( menit) -ln(1-XA)
Gambar 4.2 Pengaruh Waktu Terhadap Vs -ln(1-XA) dengan Variabel Jenis Katalis HCl dan Katalis H2SO4
Pada praktikum ini digunakan katalis asam jenis HCl 0,2 N dan H2SO4 0,2 N dengan membentuk grafik hubungan waktu Vs -ln(1-XA) dapat diperoleh data persamaan regresi liner dan slope nya. Dari gambar 4.2 dan 4.3 dapat dilihat bahwa nilai kecepatan reaksi dengan menggunakan katalis HCl adalah -0,0762 hal ini dikarenakan nilai konversi pati yang relatif menurun seiring bertambahnya waktu hidrolisa, sementara pada katalis H2SO4
diperoleh kecepatan reaksi sebesar 0,0945/menit. Hai ini menunjukan bahwa pada hidrolisa pati dengan sampel tepung tapioka lebih baik menggunakan katalisa H2SO4 dibandingkan katalis HCl.
Katalis asam pada proses hidrolisa pati akan menurunkan energi aktivasi, Energi aktivasi reaksi merupakan banyaknya energi minimum yang dibutuhkan oleh reaksi agar suatu reaksi dapat berlangsung, jadi semakin kecil energi aktivasi, kecepatanreaksi yang berlangsung akan semakin cepat (Levenspiel, 1970)
k =A x e( −Ea
RT )
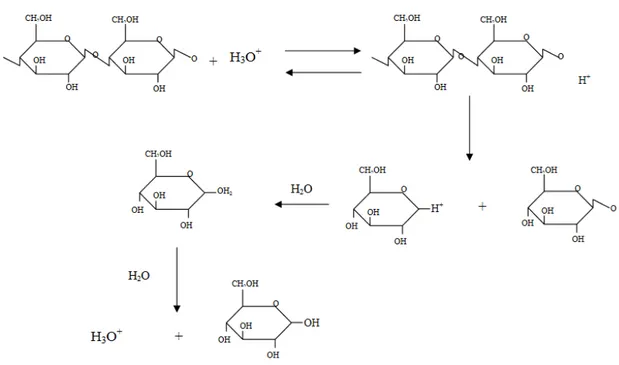
4.3 Mekanisme Reaksi Hidrolisis Pati dengan Asam
Hidrolisis merupakan metode modifikasi yang pertama dan sering digunakan. Untuk menghidrolisis ikatan glikosidik pati biasa digunakan asam atau enzim sebagai katalisator. Pada metode ini suspensi pati dimasukkan ke dalam air dengan asam atau enzim yang mampu menghidrolisis pati. Kemudian pati digelatinisasi sampai mendapatkan kekentalan yang diinginkan. Pada proses hidrolisis ini terjadi pemecahan ikatan α-D-glukosa dari molekul pati serta terjadi pelemahan struktur granula pati sehingga akan mengubah kekentalannya. Pati yang dimodifikasi dengan metode ini mempunyai kekentalan dalam keadaan panas yang rendah dan daya lekatnya tinggi. Pati jenis ini banyak digunakan dalam industri kertas, tekstil dan perekat (Tonukari, 2015). Sebagai bahan makanan pati semacam ini digunakan pada pembuatan gum candy. Apabila hidrolisis dengan menggunakan asam terhadap pati dengan kandungan air terbatas maka akan diperoleh fraksi yang lebih kecil yang disebut dekstrin. Karena itu proses ini sering juga disebut dengan dekstrinisasi (Sarifudin, 2013). Metode hidrolisis ini paling sering digunakan karena metodenya mudah dengan bahan baku yang mudah pula.
Setiap jenis pati dapat dimodifikasi dengan berbagai cara untuk menghasilkan suatu bahan dengan sifat fungsional yang diinginkan. Produk pati termodifikasi umumnya mengalami perubahan karakteristik tertentu yang dapat dimanfaatkan untuk pengembangan produk pangan olahan. Modifikasi pati umumnya dirancang untuk tujuan mengubah karakteristik gelatinisasi, kekentalan dalam medium air, pembentukan gel, kestabilan suspensi karena pengaruh asam, panas dan proses pengolahan lainnya. Modifikasi pati dilakukan dengan mengubah struktur kimia pati baik secara fisik, kimia atau enzimatis (Lewicka, 2015). Namun yang akan dibicarakan disini hanyalah modifikasi pati secara kimia. Modifikasi pati secara kimia pada umumnya meliputi hidrolisis, oksidasi, esterifikasi dan eterifisasi (Lewicka, 2015). Pati dapat dimodifikasi melalui hidrolisis parsial secara kimia atau enzimatis menghasilkan thin boiling starch, dekstrin dan maltodekstrin (Doue, 2014). Reaksi hidrolisis pati dapat dilihat pada gambar 3. Thin boiling starch adalah produk hidrolisis parsial pati menggunakan asam dan pH tertentu dan pemanasan pada suhu tertentu sampai diperoleh derajat konversi yang diinginkan. Karena sebagian pati terhidrolisis menjadi komponen berantai lurus yang berukuran lebih pendek dari asalnya, maka porsi
fraksi polimer rantai lurus tersebut menjadi lebih rendah, serta peluang untuk terjadinya retrogasi semakin besar. Komponen karbohidrat berantai lurus yang pendek sukar membentuk senyawa yang kaku. Perlakuan pati dengan asam disamping menurunkan kekentalan, juga menurunkan kekuatan gel. Penggunaan thin boiling starch pada produk pangan antara lain dalam kembang gula, pastiles, dan jeli (Shandu, 2007).
BAB V PENUTUP
5.1 Kesimpulan
1. Pada variabel katalis H2SO4 menghasilkan konversi hidrolisa pati lebih besar dari katalis HCl karena H2SO4 lebih reakstif disbanding HCl.
2. Nilai konstanta kecepatan reaksi pada katalis HCl yaitu 0,0762/menit dan pada katalis H2SO4 yaitu 0,0945/menit. Nilai konstanta kecepatan reaksi pada katalis H2SO4 lebih tinggi dari pada HCl
3. Hasil yang didapatkan antara teori dan praktek sama, yaitu semakin besar konversi, semakin besar pula konstanta kecepatan reaksinya.
4. Salah satu reaksi reduksi-oksidasi adalah pada pembentukan Cu2O sebagai endapan merah bata
5.2 Saran
1. Usahakan menjaga suhu secara konstan pada suhu 70oC.
2. Usahakan kecepatan pengadukan konstan untuk menjaga disperse pati yang terbentuk
3. Usahakan melakukan titrasi pada kondisi mendidih diatas kompor. 4. Gunakan sarung tangan dan masker untuk proteksi diri.
DAFTAR PUSTAKA
Ayoola, et al. 2013. Optimum Hydrolysis Conditions Of Cassava Starch For Glucose Production. International Journal of Advanced Research in IT and Engineering ISSN: 2278-6244 Vol. 2 | No. 1
Chiu, C.-w., & Solarek, D. 2009. Modification of starch. Starch: Chemistry and Technology, Third Edition ISBN: 978-0-12-746275-2.
Collares, Renata M, et al. 2012. Optimization of Enzymatic Hydrolysis of Cassava to Obtain Fermentable Sugars. J Zhejiang Univ Sci B.
Dona, A. C., Pages, G., & Kuchel, P. W. 2010. Digestion of Starch:In Vivo and In Vitro Kinetic Models used to Characterise. Carbohydrate Polymers 80 (2010) 599–617. Doue, Ginette., et al. 2014. Enzymatic and Acid Conversion of New Starches from Improved
Orphan Crops: Prospects for Renewable Materials uses in Food and Non-Food Industries. Journal List Springplus 2014 ; 3:489
Halley, P and L. Averous. 2014. Starch Polymers: From Genetic Engineering to Green Applications. Elsevier
Hermiati, et al.2011. Hydrolysis Of Carbohydrates In Cassava Pulp And Tapioca Flour Under Microwave Irradiation. Indo. J. Chem., 2011,11(3),238-245
Khumaida, et al. 2015. Cassava (Manihot esculenta Crantz.) Improvement through Gamma Irradiation. Department of Agronomy and Horticulture, Faculty of Agriculture, Bogor Agricultural University (IPB).
Koswara, S. 2009. Teknologi Modifikasi Pati. ebookpangan.com.
Levenspiel. O., “Chemical Reaction Engineering” 2nd ed, Mc. Graw Hill Book Kogakusha Ltd, Tokyo, 1970
Lewicka, Kamila., et al. 2015. Chemical Modifications of Starch: Microwave Effect. International Journal of Polymer Science Volume 2015, Article ID 867697, 10 pages Oladebeye, et al. 2009. Physicochemical Properties of Starches of Sweet Potato
(Ipomeabatata) and Red Cocoyam (Colocasiaesculenta) Cormels. Pakistan Journal of Nutrition 8 (4): 313-315, 2009. ISSN 1680-5194.
Sarifudin, Achmat and Alhussein M. Assiry. 2014. Some Phsycochemical Properties of Dextrin Produced by Extrusion Process. Journal of the Saudi Society of Agricultural Sciences (2014) 13, 100–106
Shandu, Kawaljit Singh., et. al. 2007. A Comparison of Native and Acid Thinned Normal and Waxy Corn Starches: Physicochemical, Thermal, Morphological and Pasting Properties. LWT 40 (2007) 1527–1536
Tongta, Sunanta and Kewalee Prompiputtanapon. 2014. Modification of Tapioca Starch Granule Surfaces on Soluble Fiber Formation. School of Food Technology, Institute of Agricultural Technology, Suranaree University of Technologh, Nakhon Ratchasima 30000 Thailand
Tonukari, Nyerhovwo J. et al. 2015. White Gold: Cassava as an Industrial Base. American Journal of Plant Sciences, 2015, 6, 972-979
Varavinit, Saiyavit. 2007. Morphological Properties of Acid-modified Tapioca Starch. Starch Volume 52, Issue 8-9 September 2000 Pages 283–289
Wuttisela, at al. 2008. Amylose/Amylopectin Simple Determination In Acid Hydrolyzed Tapioca Starch. J. Chil. Chem. Soc, 53, N° 3 (2008) págs: 1565-1567.