IV. HASIL DAN PEMBAHASAN
4.1 Inverse Polymerase Chain Reaction (Inverse PCR)
PCR dengan primer P1 : ATCCTTGCCGCCATTGACCTG-3’ dan P2: 5’-CCACCGAACTTGAACTGGTC-3’ pada kromosom Xag YR32 menunjukkan dua pita yang berukuran sekitar 1,3 kb dan 3,0 kb (Gambar 9). Kemungkinan munculnya lebih dari satu pita sangat besar, tergantung pada probabilitas adanya urutan nukleotida yang sama di dalam kromosom.
M 1
Gambar 9. Elektroforesis gel agarosa DNA produk dari hasil inverse PCR. Keterangan : M: marker DNA (1 kb DNA ladder, NEB, USA)
1 : hasil inverse PCR.
Hasil PCR dipurifikasi dan disisipkan pada pGEM-T Easy (3,015 kb). Transformasi pada E. coli DH 5α menghasilkan 400 koloni. Verifikasi plasmid dilakukan secara sampling, yaitu 10 persen dari jumlah total. Verifikasi plasmid dilakukan masing-masing dengan digesti EcoRI, PstI, dan SacI. Hasilnya menunjukkan 61,1 persen sisipan berukuran 1,3 kb, 19,4 persen sisipan berukuran 3,0 kb dan 19,4 persen hanya vektor saja. Hasil verifikasi dengan EcoRI menunjukkan fragmen dengan ukuran 3,0 kb dan 1,3 kb. Verifikasi dengan PstI menunjukkan ukuran 4,3 kb, sedangkan dengan SacI menunjukkan ukuran 4,3 kb. Berdasarkan hasil verifikasi dengan EcoRI, PstI, dan SacI maka dapat disimpulkan bahwa ukuran sisipan adalah 1,3 kb (pFT3551) dan urutan nukleotida 1,3 kb tidak mempunyai situs EcoRI, PstI, dan SacI. Hasil verifikasi dapat dilihat pada Gambar 10.
1,3 1,5
3,0
1,0
M 1 2 3
Gambar 10. Elektroforesis gel agarosa DNA hasil verifikasi pFT3551. Keterangan : M= Marker DNA (1 kb DNA ladder, NEB, USA), 1=pFT3551 -EcoRI, 2=pFT3551-PstI, 3=pFT3551 -SacI.
Hasil inverse PCR yang berukuran 1,3 kb disisipkan pada pGEM-T Easy dan plasmid rekombinannya dinamai pFT3551 seperti dapat dilihat pada Gambar 11.
Gambar 11. Plasmid rekombinan pFT3551.
4.2 Analisis Urutan DNA
Fragmen ukuran 1,3 kb dan 3,0 kb disisipkan pada pGEM-T Easy, disekuen untuk mengetahui urutan nukleotidanya. Urutan nukleotida dianalisis penyejajarannya dengan sekuen Pratiwi (2004). Sekuen 1,3 kb mempunyai 33 nukleotida yang sama dengan sekuen
4,3 3,0 1,3 3,0 1,5 kb kb
asal sedangkan 3,0 kb hanya primer saja. Berdasarkan data di atas, maka salah satu flanking DNA yang tersisipi transposon adalah sekuen 1,3 kb. Oleh karena itu, analisis dilakukan lebih lanjut pada sekuen 1,3 kb.
Fragmen yang berukuran 1,3 kb yang disisipkan pada pGEM-T Easy, disekuen untuk mengetahui urutan nukleotidanya. Urutan nukleotida yang diperoleh dianalisis dengan BLAST (Altschul et al. 1997) untuk mengetahui kemiripan urutan nukleotida yang diperoleh dengan database. Hasil penyejajaran dengan database menunjukkan bahwa urutan nukleotida yang diperoleh dari Xag pv glycines YR32 sangat mirip dengan Xanthomonas axonopodis pv. citri str.306 (Xac). Hasil BLASTN dan penyejajarannya dapat dilihat pada Gambar 12 dan Gambar 13.
Score E Value (Bits)
Gambar 12. Hasil analisis BLASTN.
Gambar 13. Hasil penyejajaran urutan nukleotida ukuran 1,3 kb Xag dengan Xac. Score : 2430, Expect : 0,0 ,Identities : 1244/1250 (90%), Gaps : 0%.
Berdasarkan hasil analisis BLASTN, Xag YR32 mirip dengan Xac str. 306 dengan nilai score sangat tinggi, yaitu 2430. Selain itu, E-value menunjukkan angka nol, hal ini berarti kemiripan sekuen DNA antara keduanya sangat ajeg (reliable). Hasil penyejajaran (alignment) menunjukkan bahwa Xag YR32 dengan Xac str.306 mempunyai kesamaan (identity) 99%.
Untuk mengetahui fungsi dari urutan nukleotida tersebut, maka dilakukan analisis menggunakan program BLASTX BLOSUM62. Fragmen ukuran 1,3 kb Xag YR32
menyandikan Inner membrane protein (Imp) dengan kemiripan 90% dan Cystein protease (Cp) dengan kemiripan 99% pada Xac str.306. E-value untuk Imp dan Cp masing-masing adalah 4e-78 dan 2e-52. Hasil analisis dapat dilihat pada Tabel 2.
Tabel 2. Hasil analisis BLASTX.
DB:ID Source Length Score Identity % Positives % E
Q8PIP3 XANAC Inner membrane protein 439 824 90 92 4e-78 Q8P7B9 XANCP Inner membrane protein 439 744 87 93 1e-69 Q4UWT2 XANC8 Inner membrane protein 439 744 87 93 1e-69 Q9PIP2 XANAC Cystein protease 270 581 99 99 2e-52 Q5H2TO XANOR Cystein protease 312 542 74 78 2e-48 Q8P7B8 XANCP Cystein protease 241 519 85 92 6e-46
Untuk lebih meyakinkan, maka dilakukan juga analisis FASTX dan hasilnya menunjukkan bahwa fragmen ukuran 1,3 kb Xag YR32 menyandikan Imp dengan kemiripan 90,8% dan Cp dengan kemiripan 99% pada Xac str 306. E-value untuk Imp dan Cp masing-masing adalah 7,4e-48 dan 1,1e-31. Hasil analisis dapat dilihat pada Tabel 3.
Tabel 3. Hasil analisis FASTX.
DB:ID Source Length Identity % Ungapped % Overlap E
Q8PIP3 XANAC Inner membrane protein 439 90,860 92,857 186 7,4e-48 Q4UWT2 XANC8 Inner membrane protein 439 87,349 87,349 166 1,4e-42 Q8P7B9 XANCP Inner membrane protein 439 87,349 87,349 166 1,4e-42 Q8PIP2 XANAC Cystein protease 270 91,129 91,129 124 1,1e-31 Q5H2TO XANOR Cystein protease 312 69,697 69,697 165 1,1e-29 Q4UWT3 XANC8 Cystein protease 241 79,839 79,839 124 5,4e-28
Hasil BLASTX dan FASTX menunjukkan kecenderungan yang sama, kedua hasil program ini memperlihatkan bahwa nukleotida1,3 kb menyandikan Imp dan Cp.
4.3 Analisis Struktur Gen
Hasil BLASTX dan FASTX memberikan informasi bahwa urutan nukleotida yang diperoleh mengekspresikan protein Imp dan Cp. Untuk mengetahui lebih lanjut tentang kedua gen ini, maka dilakukan analisis open reading frame finder (ORF Finder). Analisis ORF menggunakan situs http://www.ncbi.nlm.nih.gov/orf yang akan memberi informasi ada
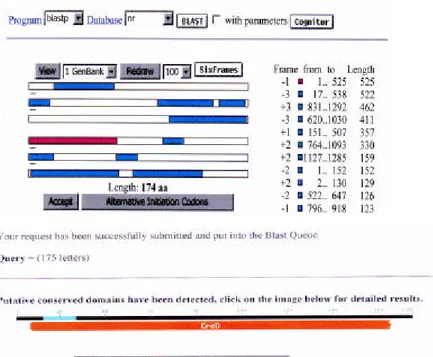
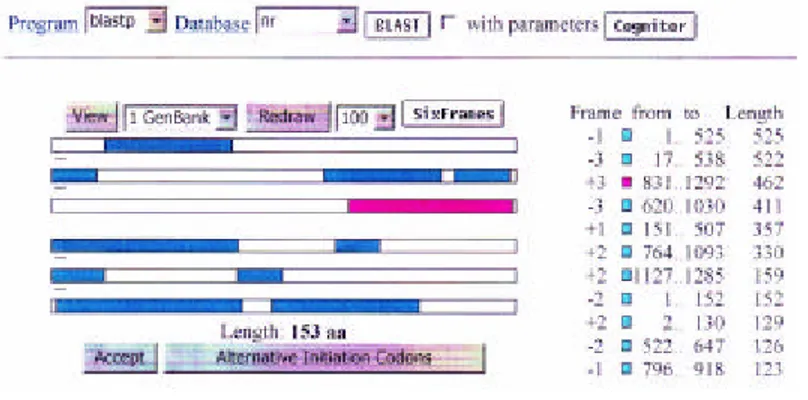
tidaknya kodon awal (ATG) dan kodon akhir (TAA/TAG/TGA). Hasil analisis menunjukkan bahwa ada dua ORF pada urutan nukleotida 1,3 kb (Gambar 14 dan 15).
Gambar 14. Hasil analisis open reading frame (ORF) untuk inner membrane protein (imp).
Analisis ORF di atas menginformasikan bahwa ada satu ORF dari urutan nukleotida satu sampai dengan 525. Urutan tersebut membawa kodon awal (ATG) pada posisi 525 tetapi belum ada kodon akhir, hal ini berarti, ORF tersebut belum lengkap. ORF mempunyai 174 asam amino. Setelah dilakukan BLASTP,ORF ini diduga mengekspresikan protein CreD.
Analisis ORF yang lain menunjukkan bahwa ada satu ORF dari urutan nukleotida 831 sampai dengan 1292. Urutan tersebut membawa kodon awal (ATG) pada posisi 831 dan kodon akhir (TAG) pada posisi 1292. ORF mempunyai 153 asam amino. Hasil BLASTP memberi informasi bahwa ORF ini mengekspresikan suatu peptidase, yaitu cystein protease.
Berdasarkan hasil analisis ORF Finder, maka nukleotida ukuran 1,3 kb menyandikan dua protein yaitu Imp dan Cp. Kedua ORF ini tidak pada operon yang sama, ditandai dengan adanya kodon awal dengan posisi yang berlawanan.
Gambar 15. Hasil analisis open reading frame (ORF) untuk Cystein Protease (Cp).
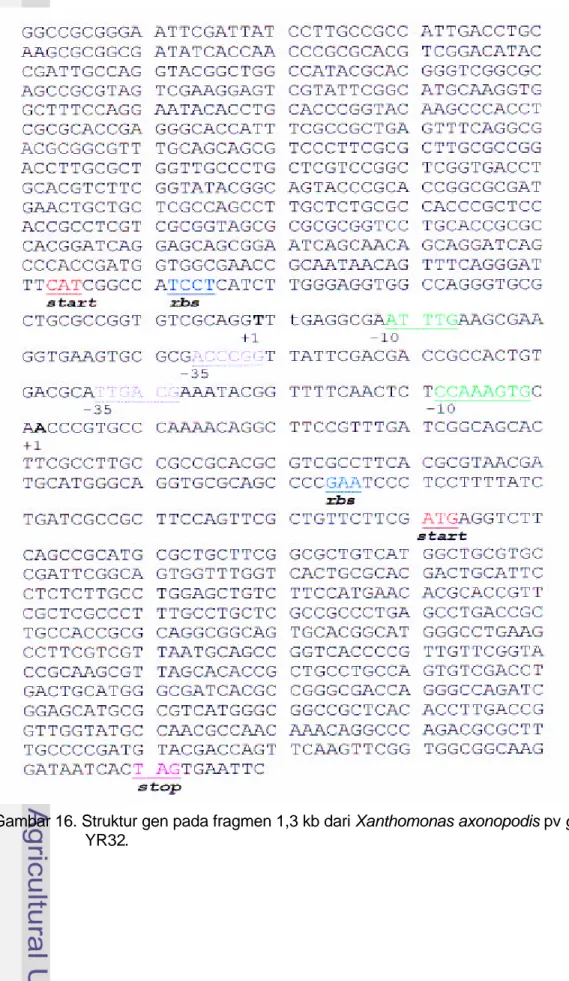
Data menunjukkan bahwa ada dua ORF dengan arah operon yang berbeda, oleh karena itu perlu diketahui ribosom binding site (RBS) atau Shine Delgarno, dan promoter untuk masing-masing operon (Tang et al. 1991, Katzen et al. 1996, Baldini et al. 1999). Berdasarkan analisis promotor, ternyata arah transkripsi ke dua gen ini berlawanan. Hasil analisis struktur gen dapat dilihat pada Gambar 16.
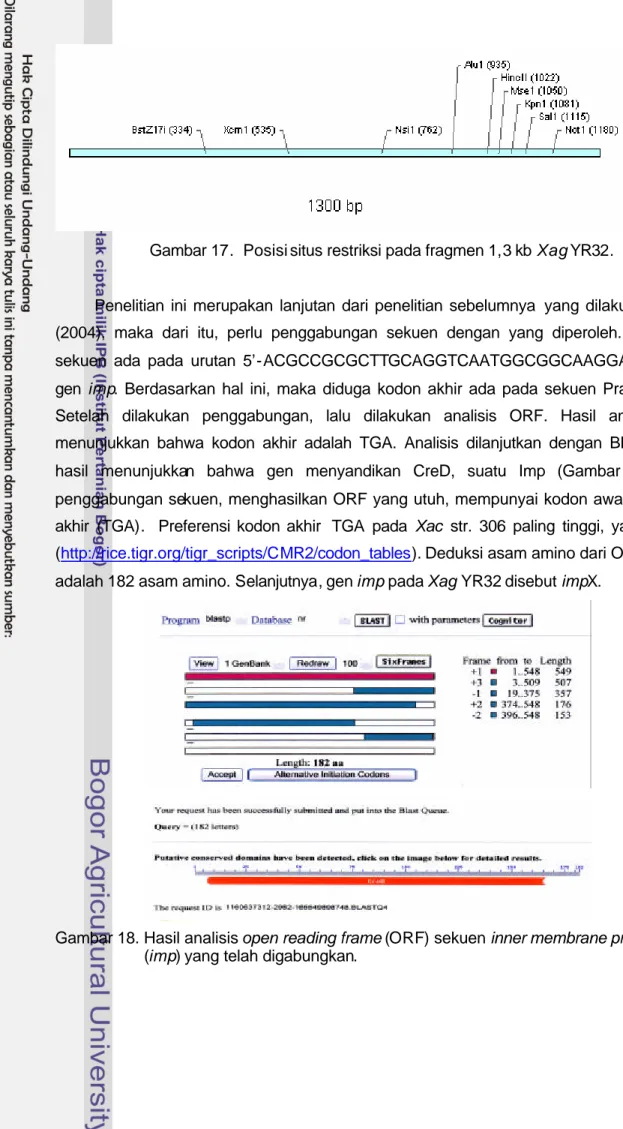
Selain itu dilakukan juga analisis restriksi pada kedua operon. Situs restriksi perlu diketahui untuk kepentingan kloning lainnya, seperti Gene Knock out, ekspresi gen, IPCR dan lainnya. Hasil analisis dapat dilihat pada Gambar 17. Pada Gambar tersebut, dapat diketahui bahwa tidak ada situs EcoRI, PstI dan SacI seperti yang dilakukan pada verifikasi plasmid pFT3551 (Gambar 10).
Gambar 16. Struktur gen pada fragmen 1,3 kb dari Xanthomonas axonopodis pv glycines YR32.
Gambar 17. Posisi situs restriksi pada fragmen 1,3 kb Xag YR32.
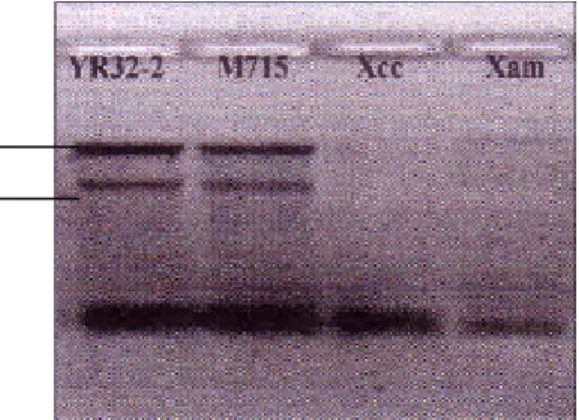
Penelitian ini merupakan lanjutan dari penelitian sebelumnya yang dilakukan Pratiwi (2004), maka dari itu, perlu penggabungan sekuen dengan yang diperoleh. Pertemuan sekuen ada pada urutan 5’-ACGCCGCGCTTGCAGGTCAATGGCGGCAAGGAT-3’ pada gen imp. Berdasarkan hal ini, maka diduga kodon akhir ada pada sekuen Pratiwi (2004). Setelah dilakukan penggabungan, lalu dilakukan analisis ORF. Hasil analisis ORF menunjukkan bahwa kodon akhir adalah TGA. Analisis dilanjutkan dengan BLASTP, dan hasil menunjukkan bahwa gen menyandikan CreD, suatu Imp (Gambar 18). Hasil penggabungan sekuen, menghasilkan ORF yang utuh, mempunyai kodon awal (ATG) dan akhir (TGA). Preferensi kodon akhir TGA pada Xac str. 306 paling tinggi, yaitu 70,89% (http://rice.tigr.org/tigr_scripts/CMR2/codon_tables). Deduksi asam amino dari ORF tersebut adalah 182 asam amino. Selanjutnya, gen imp pada Xag YR32 disebut impX.
Gambar 18. Hasil analisis open reading frame (ORF) sekuen inner membrane protein (imp) yang telah digabungkan.
Berdasarkan penelusuran data GenBank, panjang ORF imp pada Xanthomonas berbeda-beda. Xanthomonas axonopodis pv citri str 306 (Xac str 306) 1300 nukleotida, Xanthomonas campestris pv campestris 8004 (Xcc) 1320 nukleotida, Xanthomonas oryzae pv oryzae (Xoo) 10331 573 nukleotida, sedangkan Xag YR32 546 nukleotida. Hasil ClustalW memberi informasi bahwa Xag YR32 dan Xac str 306 mempunyai score 91, Xag YR32 dan Xcc score 79, Xag YR32 dan Xoo score 45. Berdasarkan penyejajaran nukleotida tersebut, maka Xag YR32 sangat dekat dengan Xac str 306, tetapi nukleotida Xag YR32 jauh lebih pendek. Hal ini merupakan keunikan dari impX Xag YR32. Data didukung oleh hasil hibridisasi Northern (dijelaskan kemudian), bahwa impX merupakan gen monosistronik dengan ukuran gen sekitar 546 bp.
Analisis dilanjutkan dengan analisis penentuan RBS, promotor, dan terminator untuk impX. Struktur gen dapat dilihat pada Gambar 19. Posisi penyisipan transposon diketahui berdasarkan data sebelumnya (Pratiwi 2004). Transposon menyisip pada posisi 500 dari sekuen Pratiwi (2004), setelah disesuaikan dengan urutan nukleotida maka diketahui posisi penyisipan transposon pada gen impX. Bagan penyisipan transposon dapat dilihat pada Gambar 20. Transposon menyisip pada bagian C -terminal gen impX.
acagtggcggtcgtcgaataaccgg -35 gtcgcgcacttcaccttcgcttcaaat tcgcctcaaacctgcgac -10 accggcgcagcgcaccctggccacctcccaagatgaggatggccg rbs atgaaatccctgaaactgttattgcggttcgccaccatcggtggg M K S L K L L L R F A T I G G start ctgatcctgctgttgctgattccgctgctcctgatccgtggcgcg L I L L L L I P L L L I R G A gtgcaggaccgcgcgcgctaccgcgacgaggcggtggagcgggtg V Q D R A R Y R D E A V E R V gcgcagagcaaggctggcgagcagcagttcatcgcgccggtgcgg A Q S K A G E Q Q F I A P V R gtactgccgtataccgaagacgtgcaggtcaccgagccggacgag V L P Y T E D V Q V T E P D E cagggcaaccagcgcaaggtccggcgcaagcgcgaagggacgctg Q G N Q R K V R R K R E G T L ctgcaaacgccgcgtcgcctgaaactcagcggcgaaatggtgccc L Q T P R R L K L S G E M V P tcggtgcgcgaggtgggcttgtaccgggtgcaggtgtattcctgg S V R E V G L Y R V Q V Y S W aaagccaccttgcatgccgaatacgactccttcgactacgcggct K A T L H A E Y D S F D Y A A gcgccgacccgtgcgtatggccagccgtacctggcaatcggtatg A P T R A Y G Q P Y L A I G M tccgacgtgcgcgggttggtgggcacgccgcgcttgcaggtcaat S D V R G L V G T P R L Q V N ggcggcaaggatcgggtgcgcttccagagcgctatcgaacgcttt G G K D R V R F Q S A I E R F cgaaagtgactgttgacacgactctta gag accataagaatcaac R K * putative terminator putative terminator Stop
tccactgaattggtactttccagtcagggccgttgatcagcaatg
Gambar 19. Urutan DNA dari struktur gen impX dan asam amino yang dideduksi dari impX serta posisi penyisipan transposon (anak panah).
Keterangan : -35, -10: putative promoter, rbs: putative ribosome binding site; start: putative kodon awal (ATG); stop: putative kodon akhir (TGA).
2198 bp
Gambar 20. Peta fisik gen imp, cp dan tonB-dependent receptor Keterangan : ORF1 : cystein protease
ORF2 : inner membrane protein X (impX) ORF3 : tonB-dependent receptor
4.4 Analisis Fungsi ImpX
Hasil BLASTX menggambarkan bahwa gen yang tersisipi transposon pada kromosom Xag M715 diduga adalah gen impX. Jika ditelusuri lebih jauh, maka gen impX ini termasuk pfam CreD (Marchler-Bauer dan Bryant 2004). Inner membrane protein CreD merupakan famili protein yang terdiri atas beberapa CreD yang terdapat pada bakteri atau disebut juga Cet inner membrane protein. Mutasi dominan gen cet pada E. coli menyebabkan bakteri ini toleran terhadap colicin E2. Colicin merupakan salah satu bakteriosin yaitu senyawa antibakteri atau antibiotik yang dapat mematikan bakteri pada spesies yang berdekatan atau strain yang berbeda tapi spesies yang sama (Madigan et al. 2003). Parker dan Feil (2004) menyatakan bahwa ketika terjadi induksi, colicin diekspresikan dalam jumlah banyak dan disekresikan ke medium ekstraseluler dengan bantuan protein yang dikode plasmid Sel yang mempunyai plasmid dilindungi dari serangan colicinnya sendiri dengan adanya protein immunity yang dikode oleh plasmid yang sama. Molekul colicin yang disekresikan terikat pada protein reseptor pada membran luar sel target lalu ditranspor melintasi membran luar menuju periplasmik sel target menggunakan sistem transpor bakteri, Tol atau Ton. Colicin dapat menyebabkan kematian sel melalui beberapa proses termasuk perusakan membran sitoplasma dengan terbentuknya pori atau masuk ke dalam sitoplasma menghambat sintesis protein atau berperan sebagai suatu DNAse atau RNAse.
Untuk lebih meyakinkan hasil di atas, maka dilakukan lagi analisis fungsi protein ImpX dengan melakukan perbandingan urutan asam amino ImpX dengan database. Urutan
asam amino ImpX yang diperoleh relatif pendek, sehingga dicari alternatif lain yang memungkinkan. Metode yang dipakai, yaitu melalui Model Navigator dari
http://swissmodel.expasy.org/repository. Model Navigator yang dipakai adalah Inner Membrane Protein X. campestris pv. campes tris yang sudah ada di database. Alasannya, berdasarkan hasil BLASTN Xcc mempunyai score 291 dan E-value 2e-77 terhadap Xag YR32. Selain itu, hasil penyejajaran DNA Imp Xcc dan Xag YR32 dengan ClustalW menunjukkan score 79. Data-data di atas menggambarkan kedekatan hubungan Imp Xcc dengan ImpX. Hasil yang diperoleh menunjukkan bahwa Imp Xcc merupakan domain dari Secretion protein HlyD, identity 52,6%, E-value 4,2E-32. Omori dan Idei (2003) menjelas kan bahwa Hly merupakan salah satu sistem ATP Binding Cassette (ABC) exporter yang terlibat dalam transpor hemolysin pada E. coli. Ada tiga protein, yaitu HlyB sebagai ABC protein, HlyD sebagai membrane fusion protein (MFP) di periplasmik, dan protein membran luar TolC.
Data di atas memberi keterangan yang lebih jelas tentang fungsi dari ImpX. Berdasarkan karakter-karakter yang dimiliki ABC transporter, maka ImpX memenuhi beberapa kriteria sebagai ABC transporter yaitu N-terminal hidrofobik, mempunyai signal peptida, mempunyai transmembrane region, C-terminal mempunyai Walker Motif A (GXXGKT), signature motif, dan Walker Motif B (KXHD) yang hidrofilik (Gambar 21). Walker Motif A adalah situs tempat menempelnya α dan β fosfat dari ATP, sedangkan Walker Motif B adalah tempat menempelnya ion Mg , signature motif sebagai situs hidrolisis (Pearson et al. 2004).
ImpX mempunyai N-terminal hidrofobik sebagai domain putative transmembrane region. Putative transmembrane region menunjukkan prediksi lokasi heliks transmembran dan prediksi lokasi intervening loop regions. Berdasarkan analisis bioinformatika pada ImpX, dengan panjang asam amino 182 terdapat satu transmembran, artinya ImpX sangat memungkinkan sebagai protein transmembran.
Berdasarkan analisis Model Hidden Markov menunjukkan bahwa ImpX mempunyai signal peptida dengan probabilitas 0,930. Maximum cleaveage site probability 0,640 antara posisi asam amino 29 dan 30. Protein sekresi pada prokariot melibatkan suatu signal sequence di awal urutan asam amino, yang akan dikenali oleh signal recognition particle (SRP). Signal peptida akan dipotong oleh enzim signal peptidase (Turner et al. 2000). Hasil bioinformatika ini menggambarkan bahwa ImpX adalah protein sekresi.
M K S L K L L L R F A T I G G L I L L L L I P L L L I R G A V Q D R A R Y R D E A V E R V A Q S K A G E Q Q F I A P V R V L P Y T E D V Q V T E P D E Q G N Q R K V R R K R E G T L L Q T P R R L K L S G E M V P S V R E V G L Y R V Q V Y S W K A T L H A E Y D S F D Y A A A P T R A Y G Q P Y L A I G M S D V R G L V G T P R L Q V N G G K D R V R F Q S A I E R F R K
Gambar 21. Karakter-karakter putative ABC-ATPase transporter ImpX pada Xag YR32. Keterangan : Huruf merah : signal peptida
Huruf hitam: putative transmembran Huruf coklat : putative Walker Motif A
Huruf oranye : putative signature motif Huruf ungu : putative Walker Motif B
Putative ABC transporter memiliki Walker Motif A dan B. ImpX mempunyai diagnostic ABC ATPase Walker Motif A dan B dimulai pada posisi 155 dan 168 yang hidrofilik. Adanya putative Walker Motif A dan B menunjukkan bahwa bagian C-terminal ImpX sebagai ATPase. Putative Signature motif berada diposisi 162. ImpX tidak mempunyai EAA motif, hal ini memberi informasi bahwa ImpX merupakan ABC sistem ekspor.
Berdasarkan analisis bioinformatik maka dapat dijabarkan bahwa ImpX merupakan protein transmembran, suatu protein sekresi, suatu putative ABC transporter, mempunyai ATPase, dan ABC sistem ekspor. Tipe ABC–ATPase pada Xag mempunyai N-terminus daerah hidrofobik dan transmembran yang menyatu dengan C-terminus suatu ATPase. Tipe ini termasuk tipe ABC-A1 (Pearson et al. 2004). Demikian juga Saurin et al. (1999) mengemukakan bahwa ABC-A1 juga sebagai alat ekspor protein, bakteriosin, maupun
toksin. ABC-A1 dapat dijumpai pada prokariot dan eukariot. Diagram putative ABC transporter pada Xag dapat dilihat pada Gambar 22.
Gambar 22. Peta fisik Putative ABC-ATPase transporter ImpX pada Xag YR32. Keterangan : A : N-terminal hidrofobik transmembran
B : Signal peptida
C : putative transmembran D : C-terminal hidrofilik E : putative Walker Motif A F : putative signature motif G : putative Walker Motif B
Jika dihubungkan dengan posisi penyisipan transposon, maka C-terminal ImpX Xag M715 yang merupakan ATPase akan tidak stabil. Hal ini berarti situs penempelan α dan β dari ATP dan ion Mg , serta situs hidrolisis ATP akan terganggu dan diduga situs -situs ini rusak karena berada masing-masing 19, 11, dan 6 asam amino dari posisi penyisipan transposon, sangat dekat dengan posisi penyisipan transposon. Kemungkinan lain, protein hasil translasi tidak sempurna sehingga kedua situs pada ATPase berubah konform asi pada saat pelipatan protein, atau bahkan tidak terjadi pelipatan, sehingga polipeptida dicacah protease sel nya sendiri, dan tidak ada ABC transporter untuk ekspor molekul toksin dan virulen determinan pada Xag M715. Dugaan lain, kalaupun terjadi pelipatan protein, ATPase Xag M715 tidak berfungsi secara baik, artinya ATP tidak dapat menempel pada situsnya, sehingga tidak terjadi perubahan ATP menjadi ADP + Pi. Tidak adanya perubahan tersebut menyebabkan tida k terbentuk energy motive force sehingga tidak ada energi untuk mendorong molekul toksin dan virulen determinan yang terlibat patogenisitas pustul bakteri dari sitoplasma menuju lingkungan melintasi membran dalam, periplasmik dan membran luar. Hal serupa terjadi pada Staphylococcus aureus , mutasi pada sekuen Walker Motif A akan menyebabkan hilangnya aktivitas ATPase dan transpor pada FhuC. FhuC adalah ATPase yang terlibat dalam transpor besi (Speziali et al. 2006).
4. 5 Analisis RNA
RNA total yang terisolasi dari Xag YR32 dan Xag M715 dilihat kualitasnya melalui elektroforesis gel agarosa terdenaturasi dan hasilnya terlihat pada Gambar 23.
Gambar 23. Hasil elektroforesis sampel RNA total yang diisolasi dari berbagai Xanthomonas.
Gambar 23 memperlihatkan ada dua pita yang dominan, yaitu 23S rRNA dan 16S rRNA. Adanya dua pita tersebut berarti kualitas RNA total yang terisolasi sangat baik (Jaakola et al. 2001). RNA total dalam sel terdiri atas rRNA, tRNA, dan mRNA, kira-kira 80-85% dari total RNA adalah rRNA, 15-20% tRNA, sedangkan mRNA sekitar 1-5%. Total RNA muncul smear dengan dua pita dominan. Pita ini adalah rRNA dan yang terlihat smear adalah mRNA dengan ukuran yang berbeda. Level mRNA steady state dalam sel merupakan integral dari hasil transkripsi dan degradasi. Pita RNA pada Xag YR32 dan Xag M715 sangat baik, sedangkan pada Xcc dan Xam, pita 16S rRNA dan 23S rRNA sangat tipis yang menunjukkan adanya degradasi RNA selama proses isolasi dan elektroforesis.
RNA total yang diisolasi kemudian ditranskripsi terbalik (Reverse Transcriptase, RT) dengan Gene Specific Primer (GSP) yaitu primer reverse impX, sehingga diperoleh cDNA. cDNA di PCR dengan primer reverse dan forward impX. Primer didisain dari urutan nukleotida impX yang sudah diperoleh. Hasil PCR dilarikan pada gel agarosa dan diperoleh pita ukuran sekitar 375 bp. Ukuran nukleotida sesuai dengan panjang nukleotida impX yang diapit oleh primer forward dan reverse impX (Gam bar 24).
Hasil RT-PCR pada Xag YR32 berbeda nyata dengan Xag M715, pada Xag YR32 jumlah amplikon jauh lebih banyak dibandingkan dengan Xag M715. Fenomena ini mengindikasikan bahwa jumlah mRNA impX M715 jauh lebih sedikit dibandingkan mRNA impX YR32. Seperti sudah diketahui Xag M715 adalah mutan Xag YR32 yang telah disisipi transposon mini-Tn5-KmR-TpR. Transposon mini-Tn5-KmR-TpR merupakan turunan dari
23S rRNA 16S rRNA
mini-Tn5-KmR, suatu transposon komposit yang memiliki stop transkripsi pada kedua batas gen penyandi antibiotik kanamisin (de Lorenzo et al. 1990). Konstruksi plasmid telah dilakukan oleh Rukayadi (1998). Mutagenesis transposon Xag YR32 dilakukan melalui pUTmini-Tn5KmR-TpR (pYR103). Tersisipnya transposon mini-Tn5-KmR-TpR pada kromoson YR32 akan menyebabkan ketidakstabilan transkrip mRNA dari gen yang tersisipi sehingga terjadi pemutusan ikatan fosfodiester pada mRNA. Kemungkinan lain, singkatnya waktu paruh mRNA dapat menyebabkan cepatnya proses degradasi RNA, sehingga jumlah mRNA sangat sedikit. Pada hasil PCR dengan primer 16S rDNA tidak menghasilkan amplikon. Hal ini berarti cDNA yang terbentuk adalah hanya impX, tidak yang lainnya.
1 2 3 4 5 6 7
Gambar 24. Elektroforesis gel agarosa DNA hasil RT-PCR dari RNA total sampel.
Keterangan :
1 = marker DNA ladder (Nugen, Indonesia)
2 = Xag YR32 (RT YR32; PCR dengan primer impX) 3 = Xag M715 (RT M715; PCR dengan primer impX) 4 = kontrol negatif (RT ddH2O; PCR dengan primer impX) 5 = kontrol negatif (RT YR32; PCR dengan primer 16S rDNA) 6 = kontrol negatif (RT M715; PCR dengan primer 16S rDNA) 7 = kontrol positif (pFT3551; PCR dengan primer impX)
Mutagenesis transposon dapat menyebabkan perubahan nukleotida pada posisi menyisipnya transposon. Adanya terminator transkripsi akan menyebabkan berhentinya transkripsi pada situs penyisipan dan bersifat polar. Fenomena ini yang menyebabkan terjadinya perubahan nukleotida dan asam amino yang ditranslasi.
Berdasarkan hasil analisis molekuler, transposon menyisip di gen impX di bagian C-terminal. Berdasarkan analisis bioinformatika, gen ini menyandikan suatu putative ABC-ATPase yang berperan dalam ekspor molekul toksin dan virulen determinan dari dalam sel ke lingkungannya, dalam hal ini ke inang. Mekanisme ekspor molekul ini sangat tergantung
0,375 kb 0,4
0,7 1,25 kb
energi, dalam hal ini perubahan ATP menjadi ADP dan Pi. ABC transporter juga berperan dalam transportasi molekul ion dari dalam sel ke lingkungan vice versa. Swarts et al. (1998) melaporkan bahwa adanya mutasi tunggal pada H+, K+-ATPase lambung menyebabkan adanya aktivasi konstitutif ATPase. Menurut Tateno et al. (2006), adanya perubahan asam amino C-terminal yang disebabkan oleh mutagenesis pada membran Calsium channel dapat mempengaruhi lokalisasi protein mem bran. Selain itu, Takazaki et al. (2006) menjelaskan bahwa mutasi pada C-terminal dari transporter anion manusia, mempengaruhi perubahan konformasi protein. Mereka menyimpulkan bahwa C-terminus sangat berperan dalam perubahan konfirmasi protein pada sebagian besar anion transpor. Han et al. (2006) melaporkan bahwa C-terminal dari pori kalium memainkan peran kritis dalam aktivasi dan fungsional pori. C-terminal dari pori ini berimplikasi juga pada lokalisasi dan gerbang pori. Analisis RNA dilanjutkan dengan analisis hibridisasi Northern untuk mengetahui ukuran transkrip impX dan statusnya dalam kromosom terhadap gen lainnya. Hasil hibridisasi Northern dapat dilihat pada Gambar 25. Analisis Northern menunjukkan bahwa transkrip impX berukuran sekitar 0,6 kb. Berdasarkan data di atas, impX merupakan gen yang monosistronik karena ukuran transkrip sama dengan ukuran gen. Data ini sangat mendukung data bioinformatik, bahwa pada impX terdapat terminator atau stop transkripsi sehingga RNA polymerase akan berhenti melakukan transkripsi dan ini yang menyebabkan ukuran transkrip sama dengan ukuran gen. Selain itu, hal ini sangat memungkinkan untuk suatu ABC-ATPase. Ukuran transkrip impX pada Xag M715 sedikit lebih kecil dibandingkan Xag YR32, karena pada Xag M715 terdapat transposon yang menyisip di C-terminal, sekitar tiga asam amino dari stop kodon. Pada transposon ini terdapat terminator atau stop transkripsi di sekitar awal penyisipan sehingga ukuran transkrip akan berbeda dengan tipe liarnya.
M 1 2 3 4 1 2 3 4
(A) (B)
Gambar 25. Elektroforesis gel agarosa terdenaturasi RNA dan analisis hibridisasi RNA Xag YR32 dan Xag M715.
Keterangan :
(A) elektroforegram RNA YR32 dan M715. B) hibridisasi RNA YR32 dan M715 dengan probe hasil RT-PCR. A dan B) Lajur 1 dan 2 : YR32, lajur 3 dan 4 : M715; lajur M : Mark er 1 kb DNA ladder (NEB, USA)
4.6 Uji Komplementasi
Uji komplementasi dilakukan untuk mengetahui ada tidaknya proses pemulihan sifat mutan non patogenik Xag M715 menjadi patogenik kembali jika diintroduksikan gen yang tersisipi transposon. Pada uji komplementasi ini DNA ukuran 1,3 kb hasil isolasi dengan inverse PCR disisipkan pada plasmid berspektrum luas pRK415 (10,5 kb) menjadi pRP06 (11,8 kb). Konstruksi plasmid pRP06 yang diintroduksikan pada Xag M715 untuk uji komplementasi dapat dilihat pada Gambar 26.
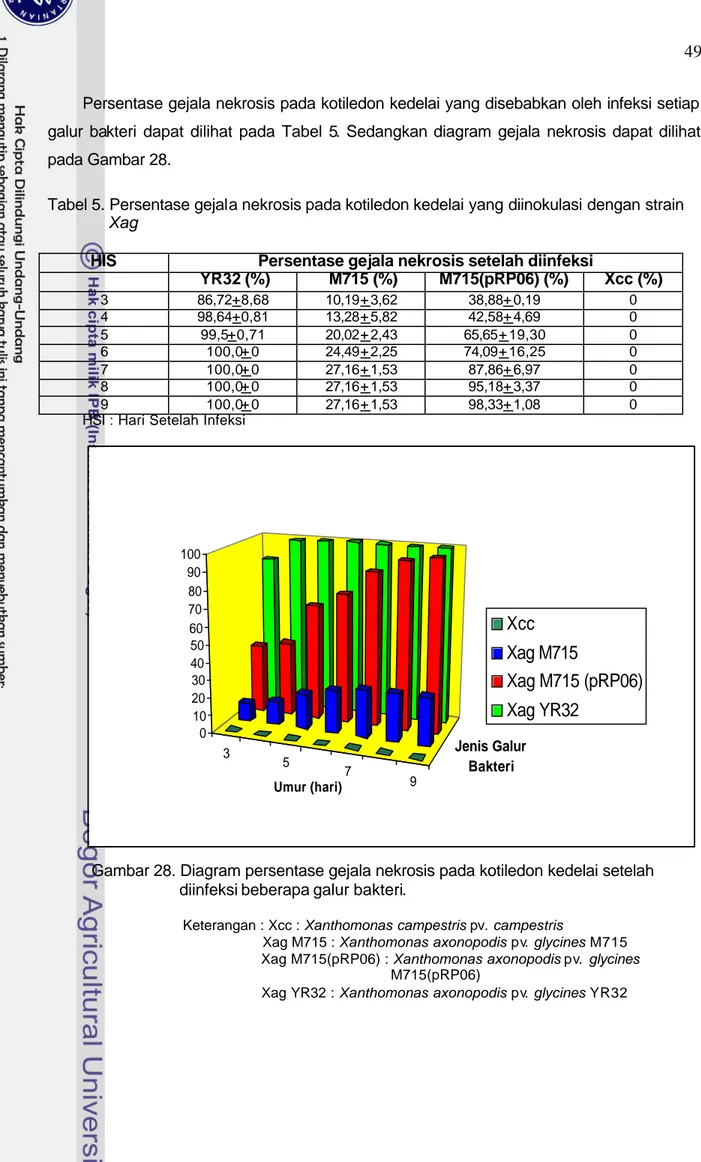
pRP06 diintroduksikan ke Xag M715 dengan cara konjugasi tiga tetua. Hasil verifikasi plasmid pRP06 yang diisolasi dari E. coli DH5α dan transkonjugan Xag M715 dan dipotong dengan EcoRI dapat dilihat pada Gambar 27. Berdasarkan Gambar 29, maka dapat dipastikan pRP06 sudah masuk ke dalam Xag M715. Hal ini dibuktikan dengan adanya pita ukuran 1,3 kb yang berasal dari Xag YR32. Adanya pi ta-pita lain menunjukkan plasmid endogen. 0,6 1,5 2,9 kb kb
EcoRI EcoRI Ligasi
Gambar 26. Konstruksi plasmid pRP06.
M 1 M 2
(A) (B) Gambar 27. Hasil verifikasi pRP06.
Keterangan :
(A) pRP06 diisolasi dari E. coli DH5α dan dipotong EcoRI;
(B) plasmid diisolasi dari transkonjugan Xag M715 dan dipotong EcoRI M : Marker 1 kb DNA ladder (NEB, USA)
1 : pRP06 dari E. coli DH5α dipotong EcoRI
2 : plasmid dari transkonjugan Xag M715 dipotong EcoRI
4.7 Bioesai Kotiledon
Transkonjugan yang membawa pRP06 diinokulasikan pada kotiledon kedelai melalui bioesai untuk mengetahui pengaruhnya terhadap pemulihan sifat patogenisitas Xag M715. Sebagai kontrol positif digunakan Xag YR32 tipe liar, sebagai kontrol negatif digunakan Xag M715 dan X. campestris pv. campestris . Data hasil pengamatan bioesai kotiledon dapat dilihat pada Tabel 4.
Tabel 4. Hasil pengujian patogenisitas dengan bioesai kotiledon
HSI ULANGAN 1* ULANGAN 2*
YR32 M715 M715(pRP06) Xcc YR32 M715 M715(pRP06) Xcc 3 83/103 10/131 48/123 0/63 117/126 13/115 43/111 0/75 4 101/103 12/131 54/123 0/63 125/126 20/115 54/111 0/75 5 102/103 24/131 64/123 0/63 126/126 29/115 88/111 0/75 6 103/103 30/131 77/123 0/63 126/126 25/115 95/111 0/75 7 103/103 37/131 102/123 0/63 126/126 30/115 103/111 0/75 8 103/103 37/131 120/123 0/63 126/126 30/115 109/111 0/75 9 103/103 37/131 120/123 0/63 126/126 30/115 110/111 0/75 10 Coklat 37/131 120/123 0/63 coklat 30/115 110/111 0/75 Rata 2 99,7/103 28/131 82,6/123 0/63 124,6/126 24,4/115 89/111 0/75
HSI : Hari Setelah Infeksi
* : perbandingan jumlah kotiledon yang menunjukkan nekrosis terhadap jumlah kotiledon uji 1.3 1,3 1,0 2,0 3,0 1,0 2,0 3,0 kb 10, 5 kb kb 10,5
Persentase gejala nekrosis pada kotiledon kedelai yang disebabkan oleh infeksi setiap galur bakteri dapat dilihat pada Tabel 5. Sedangkan diagram gejala nekrosis dapat dilihat pada Gambar 28.
Tabel 5. Persentase gejala nekrosis pada kotiledon kedelai yang diinokulasi dengan strain Xag
HIS Persentase gejala nekrosis setelah diinfeksi
YR32 (%) M715 (%) M715(pRP06) (%) Xcc (%) 3 86,72+8,68 10,19+ 3,62 38,88+ 0,19 0 4 98,64+0,81 13,28+ 5,82 42,58+ 4,69 0 5 99,5+0,71 20,02+ 2,43 65,65+ 19,30 0 6 100,0+ 0 24,49+ 2,25 74,09+ 16,25 0 7 100,0+ 0 27,16+ 1,53 87,86+ 6,97 0 8 100,0+ 0 27,16+ 1,53 95,18+ 3,37 0 9 100,0+ 0 27,16+ 1,53 98,33+ 1,08 0 HSI : Hari Setelah Infeksi
3 5 7 9 0 10 20 30 40 50 60 70 80 90 100 Jenis Galur Bakteri Umur (hari)
Xcc
Xag M715
Xag M715 (pRP06)
Xag YR32
Gambar 28. Diagram persentase gejala nekrosis pada kotiledon kedelai setelah diinfeksi beberapa galur bakteri.
Keterangan : Xcc : Xanthomonas campestris pv. campestris
Xag M715 : Xanthomonas axonopodis pv. glycines M715 Xag M715(pRP06) : Xanthomonas axonopodis pv. glycines M715(pRP06)
Berdasarkan data di atas, gejala nekrosis muncul pada hari ke tiga pada kotiledon kedelai yang diinfeksi Xag YR32 dan Xag M715 (pRP06). Pada kotiledon kedelai yang diinfeksi oleh Xag M715 terlihat ada gejala kuning, hal ini disebabkan oleh pelukaan ketika permukaan abaksial kotiledon dilukai jarum sehingga ada sel-sel yang mati. Efek nekrosis terus bertambah, pada hari ke enam kotiledon yang diinfeksi Xag YR32 100% nekrosis, sementara pada Xag M715(pRP06) terus bertambah sampai hari ke sembilan (98,33%). Pada hari ke sepuluh, terjadi pencoklatan pada kotiledon yang diinfeksi Xag YR32 , sementara Xag M715(pRP06) efek nekrosis terus menguat tetapi jumlahnya relatif tetap. Pada Xcc tidak terjadi nekrosis. Gejala nekrosis dapat dilihat pada Gambar 29.
(A)
(B)
(C)
(D)
(E)
Gambar 29. Hasil uji komplementasi pada hari ke-14 (D dan E) (Lanjutan)
Pada hari ke 14, kotiledon yang diinfeksi oleh Xag M715(pRP06) mengering dan coklat lebih cepat dari pada Xag M715. Hal ini memperkuat bukti bahwa pada Xag M715(pRP06) terjadi pemulihan sifat patogenisitas. Pemulihan sifat patogenisitas pada Xag M715(pRP06) lebih lambat dibandingkan Xag YR32, hal ini disebabkan gen impX yang dimasukkan ke dalam M715 melalui pRK415 masih belum lengkap.
Untuk mengetahui lebih jelas ada atau tidak ada signifikansi perbedaan antara setiap perlakuan galur bakteri, maka dilakukan uji statistik dengan Uji Fisher’s Exact pada rata-rata perbandingan jumlah kotiledon yang menunjukkan nekrosis terhadap jumlah kotiledon uji. Hasil Uji Fisher’s Exact dapat dilihat pada Tabel 6.
Tabel 6. Tabel kontingensi efek nekrosis setiap perlakuan galur bakteri
Perlakuan Nilai P value
Xag YR32 vs Xag M715 122/126 vs 28/131 4.53e-11* Xag YR32 vs Xag M715(pRP06) 122/126 vs 90/123 0.159
Xag YR32 vs Xcc 122/126 vs 0/75 5.607e-19*
Xag M715 vs Xag M715(pRP06) 28/131 vs 90/123 3.369e-7*
Xag M715 vs Xcc 28/131 vs 0/75 0.0000145*
Xag M715(pRP06) vs Xcc 90/123 vs 0/75 3.205e-15* P value dihitung dengan Uji Fisher’s Exact.
* Berbeda signifikan (P < 0.05 ; Uji Fisher’s Exact)
Hasil Uji Fisher’s Exact menunjukkan bahwa Xag M715 berbeda secara signifikan dengan Xag M715(pRP06). Data ini menginformasikan jumlah kuning nekrosis antara Xag M715 dan Xag M715(pRP06) sangat berbeda. Hal ini berarti kuning nekrosis pada Xag M715(pRP06) disebabkan oleh adanya pemulihan sifat patogenisitas atau masuknya gen impX melalui pRK415 ke dalam Xag M715. Informasi ini didukung oleh data yang menunjukkan bahwa antara Xag YR32 dengan Xag M715(pRP06) tidak ada perbedaan. Data ini mengartikan bahwa nekrosis yang disebabkan determinan virulen pada Xag YR32 dengan Xag M715(pRP06) sama. Selain itu, jumlah nekrosis yang disebabkan oleh Xag M715 dan Xag M715(pRP06) berbeda nyata. Data ini memberi informasi bahwa sifat Xag M715 dan Xag M715(pRP06) sudah berbeda.
Hasil bioesai kotiledon sangat mendukung hasil bioinformatika untuk fungsi gen impXA. Hasil bioinformatika menunjukkan bahwa ImpX adalah suatu putative ABC-ATPase transporter yang mengekspor toksin dan virulen determinan dari patogen ke lingkungannya, dalam hal ini inangnya. Pada penelitian ini belum membuktikan jenis molekul yang diekspor Xag YR32 ke lingkungannya tetapi fakta hasil bioesai kotiledon sangat mendukung bahwa molekul yang dikeluarkan merupakan suatu virulen determinan.
Pada dasarnya, munculnya nekrosis pada kotiledon kedelai disebabkan oleh adanya faktor-faktor determinan virulen pada galur bakteri yang diujikan. Umumnya, determinan virulen pada Xanthomonas ini antara lain suatu protease (Brunings dan Gabriel 2003). Ekspresi protease diregulasi oleh Quorum Sensing (QS). Mekanisme QS pada Xag belum diketahui, tetapi pada Xanthomonas campestris pv campestris (Xcc) sudah dipelajari dengan baik. Setelah jumlah bakteri mencapai quorum tertentu, maka konsentrasi feromon atau autoinduser akan meningkat dan pada Xcc, autoinduser berupa diffusible signal factor (DSF) yang diekspresikan oleh kluster gen regulation of pathogenicity factors (rpf). DSF merupakan asam cis-11-methyl-2-dodecenoat, suatu α,β-asam lemak tak jenuh (Wang et al. 2006). DSF akan masuk ke dalam sel patogen sebagai ligan yang akan berinteraksi dengan reseptor sitoplasma. Konfigurasi protein ini akan menjadi aktivator untuk proses transkripsi gen DSF, termasuk gen-gen lain diantaranya adalah protease tersebut (He et al. 2006). Protease yang diekspresikan akan disekresikan melalui jalur sekresi.
Gejala nekrosis pada sel-sel kotiledon kedelai yang diujikan disebabkan oleh masuknya determinan virulen dari patogen ke dalam sel inang melalui alat transportasi T1SS. Protein ini akan membentuk konfigurasi dengan protein inang dan masuk ke dalam inti sel. Di dalam inti sel, mode of action dari konfigurasi protein ini sangat tergantung dari genotip tanaman. Pada kasus nekrosis sel-sel kotiledon kedelai, sel mempunyai genotip rr sehingga konfigurasi protein ini tidak dapat mengaktivkan transkriptom untuk transkripsi gen-gen tertentu (Buttner dan Bonas 2002) . Belum diketahui dengan jelas mekanisme dan regulasi transkripsi pada kasus ini, yang pasti gen-gen ini mengekspresikan protein atau enzim yang terlibat dalam sintesis senyawa metabolit sekunder untuk pertahanan inang terhadap patogen. Shirasu et al. (1997) menyatakan bahwa asam salisilat merupakan salah satu senyawa yang mengontrol aktivasi mekanisme pertahanan pada tumbuhan dari serangan patogen.
Secara fisiologis dapat dijelaskan bahwa, kondisi metabolisme in vivo pada kotiledon yang diinfeksi Xag YR32 tidak jauh berbeda dengan metabolisme in vivo kotiledon yang diinfeksi Xag M715(pRP06). Pada kotiledon yang diinfeksi Xag YR32, molekul-molekul virulen determinan dari Xag YR32 masuk dengan baik ke dalam sel inang, sehingga molekul-molekul ini dapat menyebabkan reaksi metabolisme yang luar biasa pada sel inang. Sel inang tidak dapat mensintesis senyawa antibodi, berupa senyawa metabolit sekunder tertentu sehingga masuknya molekul virulen tersebut dapat mematikan sel inang. Pada kotiledon yang diinfeksi Xag M715(pRP06), terjadi perpindahan molekul-molekul virulen
determinan, tetapi arus ke luar nya molekul virulen tidak sesempurna pada Xag YR32. Akibatnya, proses patogenisitas berjalan agak lambat jika dibandingkan dengan Xag YR32. Pada kotiledon yang diinfeksi Xag M715, hampir tidak ada gejala patogenisitas. Hal ini berarti alat transportasi molekul-molekul virulen determinan tidak bekerja dengan baik atau bahkan tidak ada, sehingga sebagian besar molekul-molekul virulen determinan tidak dapat masuk ke dalam sel inang.
Jika diperhatikan, berdasarkan hasil bioesai kotiledon Xag M715(pRP06) bisa mengembalikan patogenisitas meskipun memerlukan waktu yang lebih lama dari pada Xag YR32. Fenomena ini dapat dijelaskan bahwa berdasarkan hasil RT-PCR, transkrip impX pada Xag M715 sangat sedikit karena tersisipnya transposon di sekitar gen tersebut sehingga ImpX pun tidak ada dan tidak terjadi transportasi toksin dan determinan virulen dari patogen ke sel inang. Oleh karena itu tidak ada gejala nekrosis pada kotiledon yang diinfeksi Xag M715. Pada Xag M715(pRP06), materi genetiknya berbeda dengan M715, yaitu terdapat plasmid tambahan pRP06 yang diintroduksikan melalui konjugasi tiga tetua pada Xag M715. Adanya pRP06 ini tentu saja menambah jumlah transkrip impX dan protein ImpX, dan diduga T1SS pada Xag M715(pRP06) lebih banyak jumlahnya dan fungsional meskipun tidak sesempurna pada Xag YR32. Inilah yang menyebabkan terjadi proses pemulihan sifat patogenisitas pada Xag M715(pRP06). Toksin dan determinan virulen dari Xag M715(pRP06) dapat diekspor ke lingkungan (sel inang) meskipun tidak sesempurna pada Xag YR32. Hal ini yang menyebabkan virulensi dari Xag M715(pRP06) lebih rendah dibandingkan Xag YR32.
Ada beberapa sarana transportasi molekul virulen yang terlibat patogenisitas pada suatu bakteri patogen, seperti T1SS (Omori dan Idei 2003), T2SS (Johnson et al. 2006), T3SS (Mota dan Cornelis 2005), T4SS (Li et al. 2005) dan T5SS. Setiap sarana transportasi akan mentraspor molekul yang spesifik. Kalau diperhatikan lebih jauh, sarana transportasi yang disisipi transposon pada Xag M715 sangat menentukan patogenisitas pustul bakteri, dalam hal ini protein ABC-ATPase tidak dapat berfungsi artinya protein ini tidak dapat mengekspor molekul-molekul virulen determinan yang sangat penting untuk patogenisitas pustul bakteri. Bakteri Xag M715(pRP06) dapat memulihkan sifat patogenisitas bakteri pustul pada Xag M715, hal ini berarti sarana transportasi yang rusak dapat diperbaiki dengan masuknya gen dari Xag YR32 (pRP06).
4.8 Analisis Ekspresi Gen impX
Gen impX menyandikan protein putative ABC-ATPase, suatu protein membran. Untuk membuktikan bahwa gen ini diekspresikan maka dilakukan kloning gen impX pada plasmid overekspresi sehingga diharapkan gen ditranskripsi dan ditranslasi menjadi suatu protein heterologous.
Strategi kloning impX dapat dilihat pada Gambar 30. Hasil PCR impX (519 bp) dengan primer A dan B dapat dilihat pada Gambar 31 (A). pET15b (Novagen) merupakan plasmid fusi translasi. Gen impX tersisip pada pET15b melalui NdeI dan BamHI. Hasil verifikasi pemotongan pEG01 yang diisolasi dari E. coli BL21 (DE3) pLysS dengan NdeI dan BamHI dapat dilihat pada Gambar 31 (B).
Plasmid pEG01 ditransformasikan ke dalam sel E. coli BL21 (DE3) pLysS dan di kultur dengan perlakukan induksi dan tidak induksi IPTG. Setelah dilakukan isolasi protein total dan penghitungan konsentrasi protein total dari sel yang diinduksi dan tidak diinduksi. Protein total dilarikan pada SDS-PAGE. Ukuran protein Imp sekitar 16,11 kD, tidak jauh dari hasil penghitungan bobot molekul Imp dengan http://ca.expasy.org/cgi-bin, yaitu sekitar 20,99 kD. Hasil SDS-PAGE dapat dilihat pada Gambar 32. Hasil SDS-PAGE menunjukkan indikasi awal bahwa gen impX diekspresikan pada E. coli BL21 (DE3) pLysS, dan pada sel diinduksi IPTG 1 mM terjadi ekspresi berlebih. Konsentrasi protein total sama untuk kedua macam sel, yaitu 111,4166 µg/ml.
Ligasi
NdeI + Bam HI NdeI + Bam HI
Ligasi
1 M M 1
(A) (B)
Gambar 31. Verifikasi hasil PCR impX dan verifikasi plasmid pEG01 dengan NdeI dan BamHI.
Keterangan :
(A). Hasil PCR gen imps (0,519 kb) (1); (B) verifikasi plasmid pEG01 dengan NdeI dan BamHI (0,519 kb dan 5,708 kb) (1); (A) dan (B) M: marker 1kb ladder (NEB, USA).
M 1 2
Gambar 32. Hasil SDS-PAGE protein total. Keterangan :
M : Marker bobot molekul protein LMW (Amersham, USA), 1: sel diinduksi dengan IPTG 1 mM,
2: sel tidak diinduksi dengan IPTG 1 mM 0,519 kb 0,519 5,708 16,11 14,4 20,1 0,5 3,0 30,0 66,0 kb kb kb kDa kDa
4.9 Implikasi Hasil Penelitian dengan Penelitian Sebelumnya
Penelitian ini merupakan penelitian lanjutan dari beberapa peneliti sebelumnya. Hasil penelitian ini menunjukkan bahwa gen yang terlibat patogenisitas pada Xanthomonas axonopodis pv glycines adalah impX yang menyandikan suatu ABC-ATPase, suatu protein membran dalam yang berperan penting sebagai sarana ekspor molekul virulen determinan. Hasil ini sangat memperkuat hasil analisis bioesai in planta yang dilakukan Rukayadi et al. (2000). Hasil bioesai menunjukkan bahwa M715 yang mempunyai mutan Imp tidak menyebabkan sakit pustul bakteri pada kedelai dan tidak juga menyebabkan reaksi hipersensitif pada daun tomat (Gambar 33). Hal ini berarti, molekul virulen determinan tidak dapat ke luar sel karena protein ABC-ATPase sebagai sarana transportasi tidak berfungsi atau bahkan tidak ada.
(A) (B) Gambar 33. Uji patogenisitas Xag YR32 dan Xag M715 in planta Keterangan :
(A) daun kedelai.
A. diaplikasi Xag YR32, B. diaplikasi Xag M715 dan
(B) daun tomat. A. diaplikasi Xag YR32, B. diaplikasi Xag M715, C. diaplikasi P.fluorencens 5064, D. diaplikasi buffer kalium fosfat (KP)
(Rukayadi et al. 2000).
Reaksi hipersensitif hanya terjadi pada sel daun yang diaplikasi oleh Xag YR32. Mutan Xag M715, P.fluorescens 5064 dan buffer kalium fosfat tidak menyebabkan nekrosis pada daun tomat.
4.10 Hipotesis Mekanisme Patogenisitas pada Xanthomonas axonopodis pv glycines
Berdasarkan hasil penelitian yang sudah dilakukan, maka dapat dibuat suatu hipotesis mekanisme patogenisitas pada Xanthomonas axonopodis pv glycines YR32 (Gambar 34).
ATP ADP ATP ADP
IM P OM ST (A) (B)
Gambar 34. Hipotesis mekanisme patogenisitas pada Xag YR32 dan Xag M715 Keterangan :
(A) YR32; (B) M715; IM: membran dalam; P: periplasmik;
OM: membran luar; ST : Sel Tanaman;kuning muda:ATP-ase; merah:ABC protein; biru:MFP (membrane fusion protein);merah muda: protein membran luar
Determinan virulen
Pada Xag YR32, molekul virulen determinan di ekspor melalui ABC-ATPase ke luar sel menuju sel tanaman, sehingga menyebabkan gejala penyakit pada kedelai. Pada Xag M715, molekul virulen determinan tidak dapat melintasi membran plasma karena ATP-ase rusak sehingga tidak terbentuk perubahan ATP menjadi ADP dan tidak ada energy motive force. Dalam hal ini tidak ada gejala penyakit pada kedelai.