PENGOLAHAN ZAT WARNA TEKSTIL RHODAMINE B MENGGUNAKAN BENTONIT TERPILAR TITANIUM DIOKSIDA (TiO2)
SKRIPSI
VRIDAYANI ANGGI LEKSONO
DEPARTEMEN KIMIA
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS AIRLANGGA
PENGOLAHAN ZAT WARNA TEKSTIL RHODAMIEN B
MENGGUNAKAN BENTONIT TERPILAR TITANIUM DIOKSIDA (TiO2)
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh
Gelar Sarjana Sains Bidang Kimia
Pada Fakultas Sains dan Teknologi
Universitas Airlangga
Disetujui oleh :
Pembimbing I Pembimbing II
LEMBAR PENGESAHAN NASKAH SKRIPSI
Judul : Pengolahan Zat Warna Tekstil Rhodamine B menggunakan Bentonit Terpilar Titanium Dioksida (TiO2)
Penyusun : Vridayani Anggi Leksono
NIM : 080810638
Tanggal Sidang : 19 Juli 2012
Disetujui oleh :
Pembimbing I, Pembimbing II,
Dr. Muji Harsini, M.Si Yanuardi Raharjo, S.Si., M.Sc NIP. 19640502 198903 2 002 NIK. 139 090 961
Mengetahui,
Ketua Program Studi S-1 Kimia/ Departemen Kimia Fakultas Sains dan Teknologi
Universitas Airlangga
PEDOMAN PENGGUNAAN SKRIPSI
Skripsi ini tidak dipublikasikan, namun tersedia di perpustakaan dalam
lingkungan Universitas Airlangga, diperkenankan untuk dipakai sebagai referensi
kepustakaan, tetapi pengutipan harus seijin penyusun dan harus menyebutkan
sumbernya sesuai kebiasaan ilmiah.
KATA PENGANTAR
Puji syukur kepada Allah SWT yang telah melimpahkan kuasaNya,
sehingga penulis dapat menyelesaikan penulisan naskah skripsi dengan judul ”
Pengolahan Zat Warna Tekstil Rhodamine B menggunakan Bentonit
Terpilar Titanium Dioksida (TiO2) ” dengan lancar dan tepat waktu. Naskah
skripsi ini dibuat dalam rangka memenuhi persyaratan akademis pendidikan
sarjana sains dalam bidang kimia Fakultas Sains dan Teknologi Universitas
Airlangga.
Pada kesempatan ini, penulis menyampaikan ucapan terima kasih kepada :
1. Dr. Muji Harsini, M.Si selaku dosen pembimbing I dan Yanuardi Raharjo,
S.Si., M.Sc selaku dosen pembimbing II yang telah memberikan bimbingan,
saran, dan nasihat dalam penyusunan naskah skripsi ini.
2. Drs. Yusuf Syah, M.S selaku dosen wali yang banyak memberikan informasi
dan saran kepada penulis dalam permasalahahan akademik.
3. Dra. Usreg Sri Handajani, M.Si selaku dosen penguji I dan Dr. Purkan, M.Si
selaku dosen penguji II yang telah memberikan informasi dan saran kepada
penulis hingga selesainya naskah skripsi ini.
4. Bapak dan Ibu dosen kimia yang telah mendidik dan memberikan dukungan
selama perkuliahan.
5. Ayah dan Ibu serta adik Anggun dan adik Alya yang telah memberikan
segalanya. Terima kasih untuk semangat, cinta, kasih sayang, dan doa yang
6. Sahabat terbaikku selama menempuh kuliah Siti Maryam dan KB (Asri
Zulchana, Ayu Eprilita, Nadya Aisya, Puji Lestari, Nourmalasari, Yan Polan,
Ryan Rachmawan, dan Jemmy Kurniajaya) yang selalu memberikan
semangat, bantuan, masukan, dan kebahagiaan.
7. Teman-teman terbaikku Ike Silviyanti, Haidy Okta, Deby Heruwati, Bela
Kharisma, terima kasih untuk semua masukan dan dukungan selama ini.
8. Rekanku Fatman Wandy, terima kasih untuk semua motivasi, doa, dan
semangat yang besar.
9. Teman-teman Kimia 2008 yang telah memberikan semangat dan selalu bisa
menghibur selama kuliah di Universitas Airlangga.
10. Karyawan dan karyawati FSAINTEK UNAIR dan petugas laboratorium, serta
pihak-pihak lain yang telah banyak membantu namun tidak bisa disebutkan
satu persatu.
11. Kakak-kakak alumnus Kimia (angkatan 2005, 2006, dan 2007), adik-adik
Kimia (angkatan 2009 dan 2010), serta semua pihak yang telah membantu
penyelesaian naskah skripsi ini.
Penulis menyadari bahwa masih terdapat banyak kekurangan dalam
penyusunan naskah skripsi ini, oleh karena itu penulis sangat mengharapkan kritik
dan saran yang bersifat membangun untuk kesempurnaan penulisan naskah skripsi
ini agar bermanfaat bagi semua pihak.
Surabaya, Juli 2012
Leksono, V. A., 2012, Pengolahan Zat Warna Tekstil Rhodamine B Menggunakan Bentonit Terpilar TiO2. Skripsi ini di bawah bimbingan Dr. Muji Harsini, M.Si. dan Yanuardi Raharjo, S.Si., M.Sc., Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya.
ABSTRAK
Telah dilakukan penelitian terhadap pengolahan zat warna tekstil rhodamine B menggunakan bentonit terpilar TiO2 yang bertujuan untuk mengetahui serta menentukan optimasi waktu, optimasi pH, kapasitas degradasi, dan adanya pengaruh berbagai macam perlakuan dalam proses degradasi ini . Proses degradasi dilakukan dalam suatu reaktor tertutup yang disinari 3 buah Lampu UV 3 x 8 watt. Larutan rhodamine B dan 0,5000 g bentonit terpilar TiO2, disinari dengan lampu UV selama waktu optimum pada pH 3 selama 2 jam dan pada pH 6 selama 3 jam. Untuk mengetahui adanya perubahan struktur pada bentonit, maka dilakukan karakterisasi menggunakan difraksi sinar-X (XRD) pada bentonit alam, Ti4+/bentonit, dan TiO2/bentonit. Hasil penelitian menunjukkan bahwa dengan adanya sinar UV larutan rhodamine B dapat didegradasi, namun sangat lambat, yaitu sebesar 2,58 % pada pH 3 dan 1,37 % pada pH 6. Saat diberi penambahan bentonit terpilar TiO2 proses degradasi lebih efektif, yaitu menghasilkan persen degradasi pada pH 3 sebesar 93,24 % dan pada pH 6 sebesar 93,1 %. Dalam penelitian ini juga dilakukan degradasi berdasarkan perbedaan konsentrasi untuk mengetahui besarnya kapasitas degradasi bentonit/TiO2. Telah didapatkan konsentrasi kesetimbangan rhodamine B berada pada konsentrasi 75 ppm.
Leksono, V. A., 2012, processing textile dyes rhodamine B using bentonite pillared TiO2. This thesis under the guidance Dr. Muji Harsini, M.Si. and Yanuardi Raharjo, S.Si., M.Sc., Chemistry Department, Faculty of Science and Technology, University of Airlangga, Surabaya.
ABSTRACT
Processing of textile dye rhodamine B using bentonite pillared TiO2 has been studied which aims to identify and determine the time of optimization, optimization of pH, capacity degradation, and the influence of various treatments in this degradation process. The photodegradation process was carried out in a closed reactor equipped with three UV lamps 3 x 8 watt (Yumiko T8). Rhodamine B solution and 0,5000 g bentonite pillared TiO2 was irradiated with UV light while stiring with magnetic stirrer during the optimum at pH 3 is 2 hours and at pH 6 at 3 hours. To detect changes in the structure of the bentonite, the characterization performed using X-Ray Diffraction (XRD) on natural bentonite, Ti4+/bentonit, and TiO2/bentonite. The research results showed that the presence of UV light can degrade rhodamine B solution, but very slow, that is equal to 2,58 % at pH 3 and 1,37 % at pH 6. When given the addition of bentonite pillared TiO2 degradation process more effective, the percentage of degradation at pH 3 for 93,24 % and at pH 6 for 93,1 %. While the rhodamine B solution at a concentration of 75 ppm is the result of equilibrium based on the capacity of bentonite pillared TiO2 degradation.
DAFTAR ISI
2.3.1 Komposisi bentonit ... 10
2.3.2 Kegunaan bentonit ... 10
2.4 Titanium Dioksida (TiO2) ... 12
2.4.1 Semikonduktor TiO2 ... 13
2.4.2 Mekanisme fotokatalitik seminkonduktor TiO2 ... 14
2.5 Zat Warna Tekstil ... 15
2.5.1 Senyawa azo ... 16
2.5.2 Zat warna rhodaminE B ... 17
BAB 3 METODE PENELITIAN ... 20
3.1 Tempat dan Waktu Penelitian ... 20
3.2 Bahan dan Alat Penelitian ... 20
3.2.1 Bahan-bahan ... 20
3.2.2 Alat-alat ... 20
3.3 Diagram Alir ... 21
3.4 Prosedur Penelitian... 22
3.4.1 Pembuatan larutan HCl 0,1 M ... 22
3.4.2 Pembuatan larutan HCl 6,0 M ... 22
3.4.3 Pembuatan larutan TiCl4 0,1 M ... 22
3.4.5 Pembuatan larutan rhodamine B 50 ppm ... 22
3.4.6 Pembuatan larutan standar rhodamine B... 23
3.4.7 Pembuatan dan karakterisasi bentonit terpilar TiO2 ... 23
3.4.7.1Preparasi bentonit alam ... 23
3.4.7.2Karakterisasi bentonit alam menggunakan (difraksi sinar-X) XRD ... 23
3.4.7.3Interkalasi bentonit alam dengan Ti4+ ... 24
3.4.7.4 Karakterisasi Ti4+/bentonit menggunakan difraksi sinar-X (XRD) ... 24
3.4.7.5 Pilarisasi bentonit dengan TiO2 ... 24
3.4.7.6 Karakterisasi bentonit terpilar TiO2 menggunakan (difraksi sinar-X) XRD ... 25
3.4.8 Penentuan panjang gelombang maksimum ... 25
3.4.9 Pembuatan kurva standar rhodamine B... 25
3.4.10 Penentuan waktu optimum degradasi rhodamine B ... 26
3.4.11 Penentuan pH optimum degradasi rhodamine B ... 26
3.4.12 Degradasi rhodamine B menggunakan bentonit/UV ... 27
3.4.13 Degradasi rhodamine B menggunakan TiO2/UV ... 27
3.4.14 Degradasi rhodamin e B menggunakan bentonit terpilar TiO2 ... 28
3.4.15 Degradasi rhodamin e B menggunakan bentonit terpilar TiO2/UV ... 28
3.4.16 Degradasi rhodamine B/UV ... 29
3.4.17Penentuan kapasitas degradasi TiO2/ bentonitterhadap rhodamine B ... 29
BAB4 HASIL DAN PEMBAHASAN ... 31
4.1 Pembuatan Bentonit Terpilar TiO2 ... 31
4.2 Penentuan Panjang Gelombang Maksimum Larutan Rhodamine B ... 34
4.3 Pembuatan Kurva Kalibrasi Rhodamine B ... 35
4.4 Penentuan Waktu dan pH Optimum Degradasi Larutan Rhodamine B ... 36
4.5 Mempelajari Pengaruh Perlakuan Terhadap Hasil Degradasi .... 38
4.6 Penentuan Kapasitas Degradasi Bentonit/TiO2 terhadap Konsentrasi yang Berbeda... 41
BAB 5 KESIMPULAN DAN SARAN ... 44
5.1 Kesimpulan ... 44
5.2 Saran ... 44
DAFTARPUSTAKA ... 46
DAFTAR GAMBAR
Gambar JudulGambar Halaman
Gambar2.1 Proses fotokatalitik ... 8
Gambar 2.2 Struktur TiO2 (a) anatase (b) rutile (c) brookit ... 13
Gambar 2.3 Rhodamin B ... 18
Gambar 2.4 Mekanisme degradasi rhodamin b ... 19
Gambar 3.1 Reaktor fotokatalitik... 20
Gambar 4.1 Hasil Analisa X-Ray Diffraction pada (a) bentonitalam, (b) bentonit/Ti4+, dan (c) bentonit/TiO2 ... 32
Gambar 4.2 Grafik kurva standar larutan rhodamin b pada pH 3; 4,5; dan 6 35 Gambar 4.3 Grafik hubungan antara waktu degradasi laruta nrhodamin b 50 ppm pada pH 3; 4,5; dan 6 menggunakan 0.5000 g bentonit terpilar TiO2 dan lampu UV 3 x 8 watt dengan persen degradasi ... 36
Gambar 4.4 Grafik hubungan antara pH dengan persen degradasi larutan rhodamin b 50 ppm pada pH 3; 4,5; dan 6 menggunakan 0.5000 g bentonit/TiO2 dan lampu UV 3 x 8 watt ... 38
Gambar 4.5 Grafik perbandingan hasil perlakuan larutan rhodamin b 50 ppm pada pH 3 dan pH 6 dengan 5 macam perlakuan ... 39
DAFTAR TABEL
Tabel JudulTabel Halaman
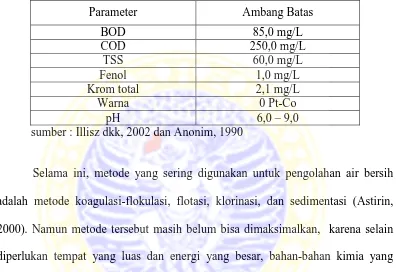
Tabel 1.1 Baku mutu limgkungan limbah cair industri tekstil
berdasarkan SK Men LH No: 51/MENLH/10/1995 ... 2
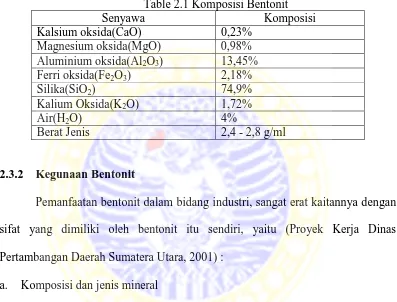
Tabel 2.1 Komposisi Bentonit ... 10
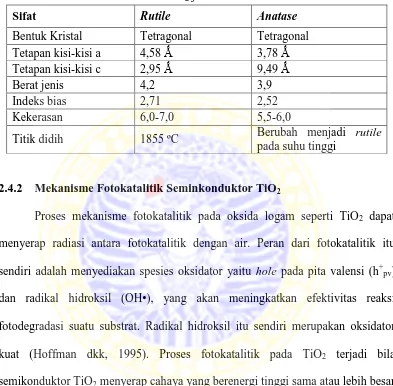
Tabel 2.2 Sifat TiO2 jenis rutile dan anatase ... 14
Tabel 4.1 Hasil analisa difraksi sinar-X ... 33
Tabel 4.2 Panjang gelombang maksimum larutan rhodamin b pada pH 3; 4,5; dan 6 ... 34
DAFTAR LAMPIRAN
Lampiran Judul Lampiran
Lampiran 1 Hasil Analisa X-Ray Diffraction
Lampiran 2 Panjang Gelombang Maksimum Rhodamin B
Lampiran 3 Data Persen Degradasi Rhodamin B pada pH 3 dan pH 6
Lampiran 4 Perhitungan Persen Degradasi Rhodamin B
Lampiran 5 Perhitungan Kapasitas Degradasi TiO2/bentonit terhadap Konsentrasi yang Berbeda
BAB I PENDAHULUAN
1.1 Latar Belakang
Indonesia mempunyai banyak wilayah perairan yang digunakan sebagai
kawasan industri, pariwisata, ataupun sekedar untuk tempat tinggal. Namun,
ternyata masih sangat kurang kesadaran masyarakat kita untuk tetap menjaga
kebersihan di lingkungan sekitar mereka. Semakin hari, pencemaran air di
Indonesia semakin memprihatinkan. Pencemaran air dapat diartikan sebagai suatu
perubahan keadaan di suatu tempat penampungan air, seperti danau, sungai,
lautan, dan air tanah, akibat ulah manusia (Arifin, 2007). Dengan semakin
banyaknya industri tekstil di Indonesia, maka akan semakin banyak pula zat
warna tekstil yang digunakan. Salah satu penyebab pencemaran air adalah limbah
zat warna yang dipakai oleh industri tekstil. Adanya limbah pewarna tekstil di
wilayah perairan sangat membahayakan biota laut dan manusia. Limbah pewarna
tekstil dapat bersifat karsinogen, menimbulkan bau, dan menyebabkan proses
eutrofikasi. Eutrofikasi secara umum adalah pencemaran air yang disebabkan oleh
munculnya nutrien yang berlebihan ke dalam ekosistem air. Eutrofikasi
merupakan masalah lingkungan hidup yang diakibatkan oleh limbah fosfat
(PO43-), khususnya dalam ekosistem air tawar. Air dikatakan eutrofik jika
konsentrasi total phosphorus (TP) dalam air berada dalam rentang 35-100 µg/L
Parameter layak tidaknya hasil pengolahan limbah cair industri tekstil
ditentukan oleh beberapa parameter kualitas air buangan , terutama parameter
kualitas hasil pengolahan limbah yang disajikan pada Tabel 1.1
Tabel 1.1 Baku mutu lingkungan limbah cair industri tekstil berdasarkan SK Men. LH No: 51/MENLH/10/1995
adalah metode koagulasi-flokulasi, flotasi, klorinasi, dan sedimentasi (Astirin,
2000). Namun metode tersebut masih belum bisa dimaksimalkan, karena selain
diperlukan tempat yang luas dan energi yang besar, bahan-bahan kimia yang
dibutuhkan dalam jumlah yang cukup besar dan memerlukan biaya yang tinggi,
bahkan seringkali membahayakan apabila dosis yang diberikan terlalu tinggi.
Dalam penelitian ini akan digunakan metode fotokatalis, yaitu salah satu metode
untuk pengolahan limbah cair, proses ini juga biasa disebut dengan Advanced
Oxidation Process (AOP), yaitu proses yang sangat cocok untuk mengoksidasi pewarna tekstil. Metode AOP ini didasarkan pada pembentukan radikal hidroksil.
Proses ini dimulai dengan penyerapan foton oleh semi konduktor seperti titanium
Titanium dioksida adalah fotokatalis yang paling banyak diteliti untuk
degradasi polutan organik dari air limbah. Katalis ini menguntungkan dari
semikonduktor lain karena stabilitas, tidak beracun, biaya rendah, dan
ketersediannya yang sudah komersil (Suwanchawalit dan Wongnawa, 2008;
Wang dkk, 2008). Titanium oksida banyak dilaporkan sebagai material
semikonduktor yang aktif sebagai fotokatalis. Aktivitas fotokatalis (fotoaktivitas)
TiO
2 dapat ditingkatkan melalui proses pemilaran pada material pendukung. Salah
satu yang dapat digunakan untuk kepentingan tersebut adalah bentonit alam.
Beberapa keuntungan diharapkan dari pemilaran TiO
2 pada bentonit alam antara
lain ketersediaan bentonit alam yang melimpah di Indonesia serta stabilitas yang
tinggi pada kondisi asam. Material TiO
2 terpilar pada bentonit alam memiliki
fungsi ganda yaitu sebagai adsorben (dari sifat bentonit yang berpori dan memiliki
kation yang dapat dipertukarkan) serta sebagai fotokatalis. Peranan fotokatalis
akan terlihat dari peningkatan kualitas hasil yang diperoleh berdasarkan
penurunan angka COD, angka total suspended solid (TSS) serta kadar ion sianida
dari limbah hasil olahan. Untuk dapat selanjutnya diterapkan pada skala industri,
perlu dilakukan pengujian efektivitas fotokatalis TiO
2/bentonit. Untuk
kepentingan tersebut, perlu diamati beberapa faktor yang berpengaruh pada
efektivitas adsorpsi-fotokatalis meliputi karakter fisika TiO
2/bentonit yang
digunakan berkaitan dengan kadar Titanium yang terpilar (Wijaya dkk, 2006).
Pada proses fotokatalitik konvensional, digunakan titanium dioksida
TiO2 dari suspensi. Pemisahan ini memerlukan waktu yang lama dan biaya yang
relatif mahal. Kedua, dalam sistem suspensi, penetrasi sinar UV menjadi sangat
terbatas karena adanya absorpsi yang kuat dari TiO2. Untuk mengatasi masalah ini
digunakanlah TiO2 yang telah diimmobilisasi pada suatu zat pendukung. Beberapa
peneliti telah melakukan immobilisasi TiO2 dengan karbon aktif untuk proses
fotodekomposisi propizamida didapatkan bahwa laju fotodekomposisi semakin
besar dengan adanya karbon aktif pada film fotokatalisis, sehingga dapat
mencapai jumlah yang optimal (Haarstrick dkk, 1996).
Fotokatalisis ini dilakukan terhadap zat warna tekstil yaitu rhodamine B.
Rhodamine B adalah salah satu zat pewarna yang dipakai untuk industri cat, tekstil, dan kertas yang sangat berbahaya (Subramani dkk, 2007). Limbah dari zat
warna rhodamine B ini dikhawatirkan akan mengkontaminasi perairan yang
nantinya juga akan dikonsumsi oleh masyarakat sekitar. Kontaminasi ini bisa dari
ikan-ikan yang mengkonsumsi air limbah dan kemudian ikan tersebut dikonsumsi
oleh manusia, bahkan bukan tidak mungkin jika masyarakat menggunakan air
tersebut untuk memasak.
Berdasarkan dari uraian di atas, maka akan dilakukan penelitian yang
bertujuan untuk mendegradasi zat warna tekstil, dalam penelitian ini digunakan
1.2 Rumusan Masalah
Berdasarkan latar belakang yang ada, maka dapat dirumuskan masalah
sebagai berikut:
1. Bagaimana optimasi waktu dan pH yang terjadi antara bentonit terpilar TiO2
dengan zat warna tekstil rhodamine B pada kondisi optimumnya?
2. Bagaimana kapasitas degradasi bentonit terpilar TiO2 terhadap konsentrasi
awal larutan rhodamine B?
3. Bagaimana pengaruh perlakuan UV, TiO2/UV, bentonit/UV, TiO2/ bentonit,
TiO2/bentonit/UV terhadap hasil degradasi larutan rhodamine B?
1.3 Tujuan Penelitian
Tujuan dari penelitian ini adalah:
1. Mengetahui dan menentukan optimasi waktu dan pH yang terjadi antara
bentonit terpilar TiO2 dengan zat warna tekstil rhodamine B pada kondisi
optimumnya.
2. Mengetahui dan menentukan kapasitas degradasi bentonit terpilar TiO2
terhadap konsentrasi awal larutan rhodamine B.
3. Mengetahui dan menetukan pengaruh perlakuan UV, TiO2/UV, bentonit/UV,
TiO2/ bentonit, TiO2/bentonit/UV terhadap hasil degradasi larutan rhodamine
1.4 Manfaat Penelitian
Manfaat penelitian ini adalah memberikan solusi alternatif
pengolahan limbah zat warna rhodamine B dengan cara fotodegradasi
BAB II
TINJAUAN PUSTAKA
2.1 Fotodegradasi
Fotodegradasi merupakan proses peruraian suatu senyawa, biasanya
senyawa organik, dengan bantuan energi foton. Proses fotodegradasi memerlukan
suatu fotokatalisis yang umumnya merupakan bahan semikonduktor. Prinsip
fotodegradasi adalah adanya loncatan elektron dari pita valensi ke pita konduksi
pada logam semikonduktor apabila dikenai oleh suatu energi foton. Adanya
loncatan elektron ini menimbulkan adanya hole (lubang elektron) yang dapat
berinteraksi dengan pelarut air membentuk radikal •OH. Radikal ini bersifat aktif
dan dapat berlanjut untuk menguraikan senyawa organik target (Malldotti dkk,
2000).
Fotodegradasi berbeda dari oksidasi termal karena fotodegradasi selalu
dimulai dari penyerapan sinar UV. Kebanyakan polimer murni secara teoritis
mampu menyerap sinar UV secara langsung. Senyawa dalam jumlah kecil di
dalam sebuah polimer sebagai produk degradasi atau residual katalis sisa
polimerisasi dapat mempercepat proses penyerapan sinar UV. Karenanya
stabilisasi termal dan pengolahan yang efektif merupakan prasyarat untuk
stabilisasi polimer terhadap cahaya yang efektif dalam jangka waktu yang
2.2 Fotokatalitik
Fotokatalitik adalah suatu proses yang mengkombinasikan antara proses
fotokimia dan katalis, yang merupakan proses sintesis secara kimiawi dengan
melibatkan cahaya dan katalis. Peningkatan kecepatan reaksi akibat adanya katalis
yang mengabsorbsi energi cahaya UV. Reaksi yang diinduksi oleh sinar UV
tersebut terjadi pada permukaan suatu katalis. Adanya induksi ini menimbulkam
terjadinya eksitasi elektron dari pita valensi ke pita konduksi (Gunlazuardi, 2001).
Pada proses fotokatalitik, ketika semikonduktor mengadsorpsi cahaya yang
berenergi sama atau lebih besar dari energi celah pitanya maka akan terjadi
pemisahan muatan atau fotoeksitasi dalam semikonduktor. Elektron (e) akan
tereksitasi ke pita konduksi dan meninggalkan lubang positif (h+) pada pita
valensi (Gerishcher, 1993) seperti pada gambar 2.1 dibawah ini.
Proses fotokatalitik banyak diaplikasikan untuk penghilangan atau
pendegradasian polutan cair menjadi senyawa yang lebih ramah lingkungan,
misalnya untuk pengolahan fenol. Suatu teknologi yang didasarkan pada iradiasi
fotokatalis semikonduktor seperti titanium dioksida (TiO2), seng oksida (ZnO)
atau cadmium sulfide (CdS) yang tergolong sebagai fotokatalis heterogen
(Hermann dkk, 1999). Fotokatalis heterogen didefinisikan sebagai proses katalisis
dimana satu atau lebih tahapan reaksi berlangsung dengan kehadiran pasangan
elektron-hole yang dihasilkan pada permukaan bahan semikonduktor yang
diiluminasi oleh cahaya pada tingkat energi yang sesuai. Adapun prosesnya dapat
dilakukan dalam berbagai media, yaitu organik murni fase cair dan larutan encer.
2.3 Bentonit
Istilah “Bentonite” pertama kali diperkenalkan oleh Knight pada tahun
1898, berselang satu tahun setelah menemukan sejenis lempung ini sebagai
“Taylorit”. Sementara istilah “Bentonite” diambil dari kata “Benton Shale”, yakni nama tempat lempung ini pertama kali ditemukan.
Ross dan Earl (1926) mendefinisikan bentonit sebagai batuan yang
tersusun oleh suatu lempung kristalin (seperti mineral lempung) yang terbentuk
akibat devitrifikasi yang diikuti dengan alterasi kimiawi suatu mineral yang
bersifat gelas (glassy) yang biasanya berupa tufa gelas atau abu vulkanik, dan
mengandung berbagai macam butiran kristal, seperti feldspar (umumnya ortoklas
dan oligoklas), biotit, kaca, piroksen, zircon, dan mineral-mineral lainnya seperti
2.3.1 Komposisi bentonit
Berdasarkan hasil analisis terhadap sampel bentonit, diperoleh komposisi
bentonit adalah sebagai berikut (Proyek Kerja Dinas Pertambangan Daerah
Sumatera Utara, 2001) :
Table 2.1 Komposisi Bentonit
Senyawa Komposisi
Kalsium oksida(CaO) 0,23%
Magnesium oksida(MgO) 0,98%
Aluminium oksida(Al2O3) 13,45% Ferri oksida(Fe2O3) 2,18%
Silika(SiO2) 74,9%
Kalium Oksida(K2O) 1,72%
Air(H2O) 4%
Berat Jenis 2,4 - 2,8 g/ml
2.3.2 Kegunaan Bentonit
Pemanfaatan bentonit dalam bidang industri, sangat erat kaitannya dengan
sifat yang dimiliki oleh bentonit itu sendiri, yaitu (Proyek Kerja Dinas
Pertambangan Daerah Sumatera Utara, 2001) :
a. Komposisi dan jenis mineral
Untuk mengetahui komposisi dan jenis mineral yang terkandung dalam
bentonit, dilakukan pengujian dengan menggunakan Difraksi Sinar-X.
b. Sifat Kimia
Pengujian terhadap beberapa sifat kimia yang terkandung di dalam bentonit
c. Sifat Teknologi
Pemanfaatan terhadap beberapa sifat teknologi yang dimiliki bentonit
tersebut, yaitu antara lain adalah sifat pemucatan, sifat bagian suspense, sifat
mengikat dan melapisi untuk pembuatan makanan ternak dan industri logam.
d. Sifat Pertukaran Ion
Pengujian terhadap sifat pertukaran ion bertujuan untuk mengetahui seberapa
besar jumlah air (uap air) yang dapat diserap oleh bentonit, sehingga akan
tercapai kesetimbangan reaksi kimia yang diperlukan untuk proses
selanjutnya.
e. Daya Serap
Sifat daya serap yang dimiliki bentonit terjadi karena adanya ruang pori-pori
antar ikatan mineral lempung, serta ketidakseimbangan antara muatan listrik
dalam ion-ionnya. Daya serap tersebut pada umumnya berada pada ujung
permukaan kristal, serta diameter ikatan mineral lempung. Hal ini disebabkan
karena bentonit dapat digunakan sebagai bahan penyerap dalam berbagai
keperluan, baik dalam keadaan basah (suspense), maupun kering (tepung).
f. Luas Permukaan
Luas permukaan bentonit dinyatakan dalam jumlah luas permukaan kristal,
atau butir kristal bentonit yang berbentuk tepung, setiap gram massa bentonit
tersebut (m2/g). Semakin tinggi luas permukannya, maka semakin banyak
pula zat-zat yang terbawa atau melekat pada bentonit. Sifat ini dimanfaatkan
sebagai bahan pengisi (filler) dalam industri kertas (pulp), dan bahan
pengembang industri makanan dan plastik.
g. Kekentalan dan Suspensi
Sifat kekentalan dan daya serap yang tinggi sangat diharapkan terutama untuk
pengeboran minyak, eksplorasi, industri cat, dan industri kertas.
2.4 Titanium Dioksida (TiO2)
Titanium dioksida (TiO2) merupakan oksida logam Ti (Titanium) yang
paling banyak dijumpai (Greenwood dkk, 1997). Titanium dioksida dikenal
sebagai senyawa dioksida berwarna putih yang tahan karat, tidak berbau, tidak
beracun, stabil terhadap fotokorosi, serta ditemukan di alam dalam bentuk mineral
anatase, rutil, dan brookit. Berdasarkan sifatnya ini TiO2 telah lama digunakan
sebagai bahan pemberi warna putih pada makanan maupun produk kosmetik.
Konfigurasi elektron atom titanium (22Ti) adalah 1s2,2s2,2p6,3s2,3p6,4s2,3d2.
Sementara atom oksigen (8O) yaitu 1s2,2s2,2p4. Dapat dikatakan bahwa orbital
molekul TiO2 terbentuk antara ikatan kulit 3d Ti dengan kulit 2p O. Tingkat
energi kulit 3d menjadi daerah konduktif molekul sedangkan kulit 2p menjadi area
valensi molekul (Merck, 2000).
Titanium dioksida (TiO2) secara mikroskopis memiliki dua bentuk utama
yaitu kristal dan amorf (Gunlazuardi, 2001). Titanium dioksida amorf tidak
memiliki keteraturan susunan atom sehingga bahan tersebut tidak memiliki
keteraturan pita konduksi dan valensi, namun TiO2 amorf dikenal memiliki
2.4.1 Semikonduktor TiO2
Seperti yang telah disinggung di atas, titanium dioksida dalam bentuk
kristal diketahui memiliki tiga fase kristal yang berbeda yaitu rutile, anatase, dan
brookite. Rutile dan anatase mempunyai struktur tetragonal. Sedangkan brookit
berstruktur heksagonal. Rutile merupakan bentuk kristal yang paling stabil
dibandingkan dua fase lainnya, oleh karena itu kristal jenis ini lebih mudah
ditemukan dalam bentuk yang paling murni (bijih). Anatase dikenal sebagai fase
kristal yang paling reaktif terhadap cahaya, eksitasi elektron ke pita konduksi
dapat dengan mudah terjadi apabila kristal ini dikenai cahaya dengan energi yang
lebih besar dari pada celah energinya. Kristal ini juga dapat terbentuk akibat
pemanasan TiO2 amorf pada suhu 400oC hingga 600oC. Sedangkan pemanasan
hingga 700oC akan menyebabkan kristal anatase bertransformasi menjadi rutile.
Brookite merupakan jenis kristal yang paling sulit diamati karena sifatnya yang
tidak mudah dimurnikan. Namun pada suhu yang lebih rendah, struktur kristal
anatase akan lebih stabil dibandingkan dengan yang lainnya (Greenwood dkk,
1997).
(a) (b) (c)
Gambar 2.2 Struktur TiO2 (a) anatase (b) rutile (c) brookit
Rutile dan anatase merupakan kristal TiO2 yang stabil, karena itu
memiliki aktivitas fotokatalisis yang baik. Tetapan kisi kristal dan sifat fisika dari
struktur anatase dan rutil telah disajikan dalam bentuk tabel.
Tabel 2.2 Sifat TiO2 jenis rutile dan anatase
2.4.2 Mekanisme Fotokatalitik Seminkonduktor TiO2
Proses mekanisme fotokatalitik pada oksida logam seperti TiO2 dapat
menyerap radiasi antara fotokatalitik dengan air. Peran dari fotokatalitik itu
sendiri adalah menyediakan spesies oksidator yaitu hole pada pita valensi (h+pv)
dan radikal hidroksil (OH•), yang akan meningkatkan efektivitas reaksi
fotodegradasi suatu substrat. Radikal hidroksil itu sendiri merupakan oksidator
kuat (Hoffman dkk, 1995). Proses fotokatalitik pada TiO2 terjadi bila
semikonduktor TiO2 menyerap cahaya yang berenergi tinggi sama atau lebih besar
dari energi celah yang dimilikinya sehingga elekron (e-) pada pita valensi (pv)
tereksitasi ke pita konduksi (pk) dan meninggalkan hole positif (h+) pada pita
valensi. Tahapan reaksinya dapat dituliskan sebagai berikut :
1. Pembentukan pasangan pembawa muatan (e- dan h+) oleh foton
TiO2 + hv TiO2 (h+pv + e-pk)
Sifat Rutile Anatase
Bentuk Kristal Tetragonal Tetragonal
2. Rekombinasi kedua pembawa muatan dengan membebaskan energi panas
e-pk + (TiIVOH.)+ TiIVOH
h+pv + (TiIIIOH) TiIVOH
3. Inisiasi reaksi oksidasi oleh hole positif pada pita valensi
(TiIVOH.)+ + red TiIVOH + red .+
4. Inisiasi reaksi reduksi oleh elektron pada pita konduksi
e-tr + oks TiIVOH + oks.+
5. Reaksi fotokatalitik menghasilkan radikal pendegradasi senyawa organik dan
sel bakteri, dimana (TiIVOH·)+ akan mengoksidasi senyawa organik.
2.5 Zat Warna Tekstil
Zat warna tekstil, berdasarkan sumber diperolehnya dibedakan menjadi 2
(dua), yaitu :
a. Zat warna alam
Zat yang berasal dari hewan ataupun tumbuhan (akar, batang, daun, kulit, dan
bunga).
b. Zat warna sintesis
Adalah zat pewarna yang berasal dari bahan kimia.
Namun sebagian besar zat warna diperoleh dari produk tumbuhan. Karena di
dalam tumbuhan terdapat pigmen tumbuhan penimbul warna yang berbeda
tergantung pada struktur kimianya (Lemmens dkk, 1999). Molekul zat warna
merupakan gabungan dari zat organik tak jenuh dengan kromofor sebagai
kromofor adalah gugus yang menyebabkan molekul menjadi berwarna
(Manurung, 2004).
2.5.1 Senyawa azo
Salah satu pencemar organik yang bersifat non biodegradable adalah zat
warna tekstil. Zat warna tekstil umumnya dibuat dari senyawa azo dan turunannya
yang merupakan gugus benzena. Diketahui bahwa gugus benzena sangat sulit
didegradasi, kalaupun dimungkinkan dibutuhkan waktu yang lama. Senyawa azo
bila terlalu lama berada di lingkungan, akan menjadi sumber penyakit karena
sifatnya karsinogen dan mutagenik. Oleh karena itu perlu dicari alternatif efektif
untuk menguraikan limbah tersebut.
Zat warna azo adalah senyawa yang paling banyak terdapat dalam limbah
tekstil, yaitu sekitar 60 % - 70 % (Waite, 2006). Senyawa azo memiliki struktur
umum R─N═N─R’, dengan R dan R’ adalah rantai organik yang sama atau
berbeda. Senyawa ini memiliki gugus ─N═N─ yang dinamakan struktur azo.
Nama azo berasal dari kata azote, merupakan penamaan untuk nitrogen bermula
dari bahasa Yunani a (bukan) + zoe (hidup).
Senyawa azo dapat berupa senyawa aromatik atau alifatik. Senyawa azo
aromatik bersifat stabil dan mempunyai warna menyala. Senyawa azo alifatik
seperti dimetildiazin lebih tidak stabil. Dengan kenaikan suhu atau iradiasi, ikatan
nitrogen dan karbon akan pecah secara simultan melepaskan gas nitrogen dan
radikal. Dengan demikian, beberapa senyawa azo alifatik digunakan sebagai
inisiator radikal. Senyawa azo digunakan sebagai bahan celup, yang dinamakan
Beberapa zat warna azo dapat diurai secara anaerobik setelah diolah dengan
kondisi aerobik.
2.5.2 Zat Warna Rhodamine B
Rhodamine B merupakan zat warna golongan xanthenes dyes. Rhodamine B adalah bahan kimia yang digunakan untuk pewarna merah pada industri tekstil dan plastik. Untuk makanan, rhodamine B dan metanil yellow sering dipakai
mewarnai kerupuk, makanan ringan, terasi, kembang gula, sirup, biskuit, sosis,
makaroni goreng, minuman ringan, cendol, manisan, gipang, dan ikan asap.
Makanan yang diberi zat pewarna ini biasanya berwarna lebih terang dan
memiliki rasa agak pahit (Kusumawardani, 2008).
Rhodamine B adalah pewarna sintetis yang berasal dari metanlinilat dan dipanel alanin yang berbentuk serbuk kristal berwarna kehijauan, berwarna merah keunguan dalam bentuk terlarut pada konsentrasi tinggi dan berwarna merah
terang pada konsentrasi rendah. Rhodamine B sering disalahgunakan untuk
pewarna pangan (kerupuk,makanan ringan,es-es dan minuman yang sering dijual
di sekolah) serta kosmetik dengan tujuan menarik perhatian konsumen.
Rhodamine B (C28N31N2O3Cl) adalah bahan kimia sebagai pewarna dasar untuk berbagai kegunaan, semula zat ini digunakan untuk kegiatan histologi dan
sekarang berkembang untuk berbagai keperluan yang berhubungan dengan
Gambar 2.3 Rhodamine B
Rhodamine B termasuk senyawa atau molekul yang memberikan warna akibat adanya gugus kromofor, dimana gugus kromofor tersebut yaitu quinoid.
Kuantitas warna yang ditimbulkan rhodamine B sangat tajam, hal ini disebabkan
oleh adanya dua gugus auksokrom, dimana gugus auksokrom tersebut adalah
dimetil amin. Proses pembuatan zat warna sintetik biasanya melalui perlakuan
pemberian asam sulfat dan asam nitrat yang sering kali terkontaminasi oleh logam
berat seperti arsen, atau logam berat lain yang bersifat racun. Pada pembuatan zat
pewarna organik sebelum mencapai produk akhir harus melalui suatu senyawa
antara dulu, yang kadang-kadang berbahaya. Sering kali dalam proses reaksi
tersebut terbentuk senyawa baru yang berbahaya yang lebih tertinggal sebagai
residu dalam bahan pewarna tersebut.
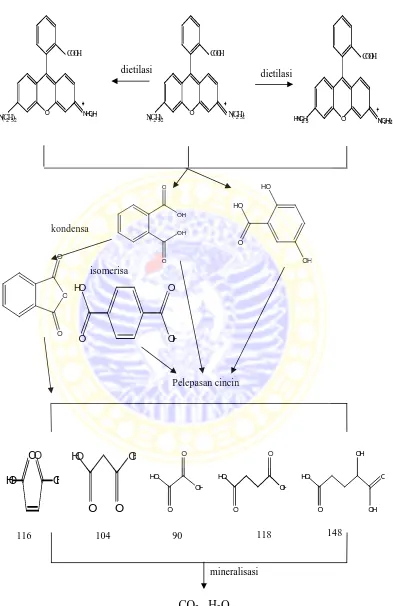
Berdasarkan jurnal yang ditulis oleh Zhong, dkk (2008), apabila zat warna
rhodamine B didegradasi menggunakan TiO2 maka akan melewati beberapa tahapan, yaitu kondensasi, isomerisasi, dan adanya pelepasan cincin yang setelah
melewati tahap akhir, mineralisasi, akan menjadi CO2 dan H2O. Mekanisme
degradasi dapat dilihat pada Gambar 2.4.
3.1 Tempat dan W
emen Kimia Fakultas Sains dan Teknolog
bulan Februari 2012 sampai Juni 2012.
Alat Penelitian an
n kimia yang digunakan pada penelitian ini a
,, HCl, rhodamine B, AgNO3, dan akua DM.
digunakan dalam penelitian ini adalah spektrofot
fuge (fisher scientific 22B), X-Ray Diffraction E-200), reaktor fotokatalitik, pH meter, lam
3.3 Diagram Alir
direndam dan diaduk selama 4 jam
dikalsinasi pada suhu 450°C selama 4 jam 150 g bentonit yang dikeringkan pada
suhu 120°C dan diayak dengan ayakan 100 mesh
450 ml larutan TiCl4 0,1 M
Karakterisasi menggunakan
difraksi sinar-X (XRD) Ti4+/bentonit
TiO2/bentonit
Degradasi rhodamine B dengan berbagai zat pendegradasi pada kondisi optimum
UV TiO2/UV bentonit/UV TiO2/bentonit TiO2/bentonit /UV
3.4 Prosedur Penelitian
3.4.1 Pembuatan larutan HCl 0,1 M
Diambil 4,2 ml larutan HCl 37 % dengan massa jenis sebesar 1,18 g/cc
dan dimasukkan ke dalam labu ukur 500 ml. Kemudian diencerkan dengan akua
DM hingga volume 500 ml.
3.4.2 Pembuatan larutan HCl 6,0 M
Diambil 50,0 ml larutan HCl 37 % dengan massa jenis sebesar 1,18 g/cc
dan dimasukkan ke dalam labu ukur 100 ml. Kemudian diencerkan dengan akua
DM hingga volume 100 ml.
3.4.3 Pembuatan larutan TiCl4 0,1 M
Diambil 5,6 ml larutan TiCl4 99 % dengan massa jenis sebesar 1,728
g/cc dituangkan dalam 4 ml larutan HCl 6,0 M.. Kemudian diencerkan dengan
akua DM hingga volume 500 ml dan di aduk dengan pengaduk magnit selama 2
jam.
3.4.4 Pembuatan larutan induk rhodamine B 1000 ppm
Ditimbang dengan tepat 1000 mg rhodamine B yang kemudian dilarutkan
dengan 500 ml akua DM dalam gelas beaker. Kemudian memindahkan larutan
rhodamine B ke dalam labu ukur 1000 ml dan diencerkan dengan akua DM sampai tanda batas.
3.4.5 Pembuatan larutan rhodamine B 50 ppm
Sebanyak 5,0 ml larutan induk rhodamine B 1000 ppm diencerken
Selanjutnya larutan ini dihomogenkan sehingga akan diperoleh laruan kontrol
rhodamine B dengan konsentrasi 50 ppm.
3.4.6 Pembuatan larutan standar rhodamine B
Dipipet larutan kontrol rhodamine B 50 ppm sebanyak 0,4; 0,6; 0,8; 1,0;
1,2; 1,4; dan 1,6 ml kedalam labu ukur 10 ml. Kemudian diencerkan dengan akua
DM dan dihomogenkan, sehingga diperoleh larutan standar rhodamine B dengan
konsentrasi 2, 3, 4, 5, 6, 7, dan 8 ppm. Untuk pembuatan larutan standar pada pH
3 dan 4,5 sama dengan pembuatan larutan standar di atas (dengan pH 6). Hanya
saja sebelum diencerkan dengan akua DM, larutan standar tersebut diberikan
pengaturan pH dengan penambahan larutan HCl 0,1 M menggunakan pH-meter.
3.4.7 Pembuatan dan karakterisasi bentonit terpilar TiO2 3.4.7.1 Preparasi bentonit alam
Sebanyak kurang lebih 100 gram bentonit alam yang trlah dicuci dengan
akua DM dan disentrifugasi, digerus sampai halus dan diayak dengan ayakan 100
mesh setelah sebelumnya dioven selama 5 jam pada temperature 120°C,
kemudian dicuci dengan akua DM sampai bersih dan disaring dengan penyaring
vakum.
3.4.7.2 Karakterisasi bentonit alam menggunakan difraksi sinar-X (XRD)
Ditimbang 1 gram bentonit alam yang telah dipreparasi untuk diuji
karakterisasi menggunakan X-Ray Diffraction. Uji karakterisasi menggunakan
3.4.7.3 Interkalasi bentonit alam dengan Ti4+
Ditimbang 150 gram lempung bentonit alam yang telah dipreparasi dan
lolos ayakan 100 mesh. Kemudian ke dalam larutan bentonit dituangkan sedikit
demi sedikit larutan 450 ml TiCl4 0,1 M sambil diaduk dengan pengaduk magnit
selama 4 jam. Hasil interkalasi dipisahkan dengan penyaring vakum kemudian
dicuci beberapa kali dengan air bebas ion sampai terbebas dari ion klorida.
Pencucian dihentikan jika filtrat diuji dengan perak nitrat tidak menghasilkan
endapan putih. Lempung bentonit yang telah diinterkalasi dengan TiCl4
dikeringkan dalam oven pada suhu 120oC selama 5 jam.
3.4.7.4 Karakterisasi Ti4+/bentonit menggunakan difraksi sinar-X (XRD)
Ditimbang 1 gram bentonit yang telah melalui proses interkalasi dengan
Ti4+ untuk diuji karakterisasi menggunakan X-Ray Diffraction. Uji karakterisasi
menggunakan XRD bertujuan untuk perubahan struktur kristal bentonit yang telah
diinterkalasi dengan Ti4+.
3.4.7.5 Pilarisasi bentonit dengan TiO2
Lempung bentonit yang telah diinterkalasi dengan TiCl4 tersebut
dikeringkan kemudian digerus sampai halus dan diayak dengan ayakan 100 mesh.
Bentonit selanjutnya dikalsinasi pada suhu 450oC selama 4 jam. Proses kalsinasi
bertujuan untuk mengubah kation logam Ti4+ menjadi logam oksida TiO2.
3.4.7.6 Karakterisasi bentonit terpilar TiO2 menggunakan difraksi sinar-X (XRD)
Ditimbang 1 gram bentonit terpilar TiO2 untuk diuji karakterisasi menggunakan
X-Ray Diffraction. Uji karakterisasi menggunakan XRD bertujuan untuk perubahan struktur kristal bentonit yang telah terpilar TiO2.
3.4.8 Penentuan panjang gelombang maksimum
Larutan rhodamine B 10 ppm pada pH 3; 4,5; dan 6 diukur
absorbansinya menggunakan spektrofotometer UV-Vis pada rentang panjang
gelombang 450-600 nm. Blanko yang digunakan adalah akua DM pada pH 6,
sedangkan untuk pH 3 dan 4,5 adalah akua DM yang telah disesuaikan pHnya
dengan penambahan HCl 0,1 M menggunakan pH-meter.
3.4.9 Pembuatan kurva standar rhodamine B
Larutan standar rhodamine B pada pH 3; 4,5; dan 6 yang telah dibuat
pada prosedur 3.4.8 diukur absorbansinya dengan spektrofotometer UV-Vis pada
panjang gelombang maksimum menggunakan blanko akua DM untuk pH 6 dan
akua DM yang telah diatur pHnya menggunakan HCl 0,1 M untuk pH 3 dan 4,5.
Dari data absorbansi yang diperoleh dibuat kurva yang kemudian ditentukan
persamaan garis regresi linier. Persamaan regresi linier secara umum adalah:
y = a + bx (3.1)
dimana sumbu y adalah absorbansinya dan sumbu x sebagai konsentrasi zat warna
rhodamine B dalam ppm.
3.4.10 Penentuan waktu optimum degradasi rhodamine B
Larutan rhodamine B yang telah dibuat dengan konsentrasi 50 ppm
sebanyak 500 ml pada variasi pH 3; 4,5; dan 6 dimasukkan ke dalam gelas beaker
1000 ml yang telah diberikan 0,5000 g TiO2/bentonit, kemudian disinari dengan
sinar UV dengan daya 3 x 8 watt selama 180 menit. Hasil degradasi pada menit
ke-5, 10, 20, 30, 45, 60, 90, 120, dan 180 diambil 5,0 ml kemudian disentrifugasi
dan disaring menggunakan kertas saring untuk memisahkan larutan rhodamine B
dengan TiO2/bentonit. Kemudian diukur absorbansinya dengan spektrofotometer
UV-Vis menggunakan blanko akua DM untuk pH 6 dan akua DM yang telah
diatur pHnya menggunakan HCl 0,1 M untuk pH 3 dan 4,5. Data absorbansi yang
diperoleh dimasukkan dalam persamaan kurva standar rhodamine B untuk
mengetahui konsentrasi rhodamine B yang tersisa. Selanjutnya dibuat kurva
hubungan antara persen degradasi terhadap waktu degradasi.
3.4.11 Penentuan pH optimum degradasi rhodamine B
Larutan rhodamine B yang telah dibuat dengan konsentrasi sebesar 50
ppm sebanyak 500 ml dimasukkan ke dalam gelas beaker 1000 ml kemudian
dicampur dengan 0,5000 g bentonit terpilar TiO2. Selanjutnya dilakukan variasi
pH 3; 4,5; dan 6. Pengaturan pH tersebut dilakukan dengan penambahan HCl 0,1
M yang diukur menggunakan pH meter. Sebelum diiradiasi, larutan rhodamine B
didiamkan terlebih dahulu selama 15 menit agar homogen kemudian diradiasi
dengan lampu UV sebesar 3 x 8 watt sesuai dengan waktu optimum. Hasil
degradasi diambil 5,0 ml kemudian disentrifugasi dan disaring menggunakan
dapat diukur absorbansinya dengan spektrofotometer UV-Vis menggunakan
blanko akua DM untuk pH 6 dan akua DM yang telah diatur pHnya
menggunakan HCl 0,1 M untuk pH 3 dan 4,5. Nilai absorbansi yang diperoleh
dimasukkan ke dalam kurva standar rhodamine B untuk mengetahui konsentrasi
rhodamine B yang tersisa.
3.4.12 Degradasi rhodamine B menggunakan bentonit/UV
Larutan rhodamine B 50 ppm sebanyak 500 ml dimasukkan ke dalam
gelas beaker 1000 ml lalu dicampur dengan 0,5000 g bentonit. Larutan tersebut
diaduk dengan pengaduk magnit selanjutnya diiradiasi menggunakan sinar UV
pada kondisi optimum. Hasil degradasi diambil 5,0 ml kemudian disentrifugasi
dan disaring menggunakan kertas saring untuk memisahkan larutan rhodamine B
dengan TiO2/bentonit. Lalu larutan dapat diukur absorbansinya dengan
spektrofotometer UV-Vis menggunakan blanko akua DM untuk pH 6 dan akua
DM yang telah diatur pHnya menggunakan HCl 0,1 M untuk pH 3 dan 4,5. Nilai
absorbansi yang diperoleh dimasukkan ke dalam kurva standar rhodamine B
untuk mengetahui konsentrasi rhodamine B yang tersisa.
3.4.13 Degradasi rhodamine B menggunakan TiO2/UV
Larutan rhodamine B 50 ppm sebanyak 500 ml dimasukkan ke dalam
gelas beaker 1000 ml kemudian dicampur dengan 0,5000 g TiO2. Larutan
tersebut diaduk dengan pengaduk magnit selanjutnya diiradiasi menggunakan
sinar UV pada kondisi optimum. Hasil degradasi diambil 5,0 ml kemudian diukur
absorbansinya dengan spektrofotometer UV-Vis menggunakan blanko akua DM
pH 3 dan 4,5. Nilai absorbansi yang diperoleh dimasukkan ke dalam kurva standar
rhodamine B untuk mengetahui konsentrasi rhodamine B yang tersisa. 3.4.14 Degradasi rhodamine B menggunakan bentonit terpilar TiO2
Larutan rhodamine B 50 ppm sebanyak 500 ml dimasukkan ke dalam
gelas beaker 1000 ml kemudian dicampur dengan 0,5000 g bentonit terpilar TiO2.
Larutan tersebut diaduk dengan pengaduk magnit pada kondisi optimum tanpa
diiradiasi sinar UV. Hasil degradasi diambil 5,0 ml kemudian disentrifugasi dan
disaring menggunakan kertas saring untuk memisahkan larutan rhodamine B
dengan TiO2/bentonit. Lalu larutan dapat diukur absorbansinya dengan
spektrofotometer UV-Vis menggunakan blanko akua DM untuk pH 6 dan akua
DM yang telah diatur pHnya menggunakan HCl 0,1 M untuk pH 3 dan 4,5. Nilai
absorbansi yang diperoleh dimasukkan ke dalam kurva standar rhodamine B
untuk mengetahui konsentrasi rhodamine B yang tersisa.
3.4.15 Degradasi rhodamine B menggunakan bentonit terpilar TiO2/UV
Larutan rhodamine B 50 ppm sebanyak 500 ml dimasukkan ke dalam
gelas beaker 1000 ml kemudian dicampur dengan 0,5000 g bentonit terpilar TiO2.
Larutan tersebut diaduk dengan pengaduk magnit selanjutnya diiradiasi
menggunakan sinar UV pada kondisi optimum. Hasil degradasi diambil 5,0 ml
kemudian disentrifugasi dan disaring menggunakan kertas saring untuk
memisahkan larutan rhodamine B dengan TiO2/bentonit. Lalu larutan dapat diukur
absorbansinya dengan spektrofotometer UV-Vis menggunakan blanko akua DM
pH 3 dan 4,5. Nilai absorbansi yang diperoleh dimasukkan ke dalam kurva standar
rhodamine B untuk mengetahui konsentrasi rhodamine B yang tersisa. 3.4.16 Degradasi rhodamine B/UV
Larutan rhodamine B 50 ppm sebanyak 500 ml dimasukkan ke dalam
gelas beaker 1000 ml. Larutan tersebut diaduk dengan pengaduk magnit
selanjutnya diiradiasi menggunakan sinar UV pada kondisi optimum. Hasil
degradasi diambil 5,0 ml kemudian diukur absorbansinya dengan
spektrofotometer UV-Vis menggunakan blanko akua DM untuk pH 6 dan akua
DM yang telah diatur pHnya menggunakan HCl 0,1 M untuk pH 3 dan 4,5. Nilai
absorbansi yang diperoleh dimasukkan ke dalam kurva standar rhodamine B
untuk mengetahui konsentrasi rhodamine B yang tersisa.
3.4.17 Penentuan Kapasitas Degradasi Bentonit/TiO2 terhadap Konsentrasi yang Berbeda
Larutan kontrol rhodamine B pada pH optimum, dibuat dengan berbagai
macam variasi konsentrasi, yaitu 25, 50, 75, 100, 150, dan 200 ppm sebanyak 500
ml masing-masing dimasukkan ke dalam gelas beaker 1000 ml kemudian diatur
pada pH optimumnya. Larutan tersebut dicampur dengan 0,5000 g TiO2/bentonit.
Sebelum diirradiasi, terlebih dahulu larutan tersebut diaduk dengan pengaduk
magnit selama 15 menit agar rhodamine B dan TiO2/bentonit dapat homogen,
kemudian diirradiasi menggunakan lampu UV 3 x 8 watt sesuai dengan waktu
optimumnya. Hasil degradasi diambil sebanyak 5,0 ml kemudian disentrifugasi
dan disaring menggunakan kertas saring agar larutan rhodamine B dapat terpisah
dengan TiO2/bentonit, lalu diukur absorbansinya. Nilai absorbansi yang diperoleh
yang tersisa. Dari konsentrasi rhodamine B yang tersisa tersebut dihitung
selisihnya sehingga dapat diketahui kapasitas optimum larutan rhodamine B pada
BAB IV
HASIL DAN PEMBAHASAN
4.1 Pembuatan Bentonit Terpilar TiO2
Bentonit alam yang masih berbentuk batuan lunak dicuci menggunakan
akua DM selama beberapa kali untuk menghilangkan pengotor-pengotor, seperti
pasir dan kerikil, yang terdapat pada permukaan bentonit alam. Setelah proses
pencucian, bentonit alam ini berubah menjadi lempung lunak seperti bubur. Untuk
mendapatkan lempung bentonit alam yang murni maka lempung bentonit alam ini
desentrifugasi untuk memisahkannya dari akua DM dan pasir yang tersisa.
Lempung bentonit alam yang tepisah dari pengotornya dikeringkan dalam oven
selama 5 jam dengan suhu 120° C. lempung bentonit yang telah kering digerus
dan disaring dengan ayakan 100 mesh.
Sebanyak 150 g bentonit didispersikan ke dalam 450 ml larutan pemilar,
yaitu TiCl4, dan diaduk dengan menggunakan pengaduk magnet selama 4 jam.
Pada proses pemilaran ini akan terjadi pertukaran kation dalam bentonit (seperti
Na dan Ca) dengan kation Ti4+. Larutan pemilar dibuat dengan penambahan 5,6
ml TiCl4 9,01 M ke dalam 4 ml HCl 6,0 M, kemudian dilarutkan dengan akua DM
hingga volume 500 ml. Larutan ini harus didiamkan selama 2 jam, agar dapat
terhidrolisis sempurna (Yuan, dkk., 2006).
Setelah bentonit didispersikan ke dalam larutan TiCl4, larutan yang
mulanya tidak berwarna, berubah menjadi berwarna kuning. Untuk mendapatkan
menggunakan penyari
aring vakum dan dicuci berulang kali mengguna
ri ion klorida. Untuk mengetahui masih ada at
l interkalasi tersebut dilakukan pengujian filtrat
bentonit yang telah diinterkalasi dengan TiC
oven dengan suhu 120°C selama 4 jam. Setelah
diayak dengan ayakan 100 mesh dan dilanjutkan
anasan pada suhu 450° C selama 5 jam, yang
menjadi oksida logam TiO2. Hasil akhir inil
onit. Kemudian dilakukan uji karakterisasi
RD) terhadap bentonit alam, Ti4+/bentonit, dan
perubahan struktur bentonit sebelum dan se
. Hasil karakterisasi menggunakan XRD tersebut
erta Lampiran 1.
Difraktogram bentonit montmorillonit menunjukkan adanya puncak
karakteristik montmorilonit, yaitu pada d = 5.69477 dengan d001 = 15.50614 Å.
Selain adanya puncak bentonit, ada beberapa puncak yang menunjukkan
kandungan mineral lain, seperti adanyamineral kuarsa pada d = 20.88837 dengan
d001 = 4.24917 Å dan pada d = 26.64409 dengan d001 = 3.34288 Å, kemudian
mineral kristobalit pada d = 21.98366 dengan d001 = 4.03988 Å dan pada d =
31.94875 dengan d001 = 2.79891 Å (Grim, 1968). Pada Tabel 4.1 dijelaskan
tentang hasil XRD terhadap bentonit alam, bentonit/Ti4+, dan bentonit/TiO2.
Tabel 4.1 Hasil analisa difraksi sinar-X
Parameter Bentonit
Goenadi dalam Sekewael(2008), adanya pemanasan dalam montmorilonit dengan
temperatur di atas 100° C akan membuat struktur suatu zat berubah menjadi
sebuga puncak yang lebih rendah. Sedangkan berubahnya nilai d001 menunjukkan
bahwa terjadi perubahan kation dalam interlayer bentonit (Yahiaoui, et al., 2003).
Dalam hal ini perubahan kation terjadi karena adanya proses cation exchange
spesi Ti4+ dalam interlayer bentonit. Berdasarkan hasil karakterisasi tersebut,
diketahui bahwa telah terbentuk pilar TiO2 pada anatarlapis bentonit. Pilar TiO2
tersebut dapat membuat bentonit menjadi lebih stabil dan dapat digunakan sebagai
4.2 Penentuan Panjang Gelombang Maksimum Larutan Rhodamine B
Larutan standar rhodamine B yang telah dibuat pada konsentrasi 10 ppm,
dengan pH tertentu (3; 4,5; dan 6), masing-masing diukur absorbansinya dengan
menggunakan spektrofotometer UV-Vis pada rentang panjang gelombang
300-700 nm dengan menggunakan larutan blanko akua DM untuk pH 6 dan blanko
akua DM yang telah diatur pHnya dengan penambahan HCl 0,1 M untuk pH 3 dan
4,5. Data panjang gelombang maksimum larutan rhodamine B tiap pH dapat
dilihat pada Tabel 4.2, sedangkan spektrum UV-Vis larutan rhodamine B pada
berbagai pH (3; 4,5; dan 6) dapat dilihat pada Lampiran 2.
Tabel 4.2 Panjang gelombang maksimum larutan rhodamine B pada pH 3; 4,5; dan 6
Panjang gelombang yang didapatkan relatif tidak bergeser. Hal ini juga
dapat dilihat dari warna larutan rhodamine B yang tetap berwarna merah muda.
Larutan rhodamine B dalam keadaan normal mempunyai pH 6, sehingga untuk
mengkondisikan larutan rhodamine B pada pH 4,5 dan 3 perlu ditambahkan
larutan asam, yaitu HCl. Adanya penambahan asam ini, dapat berakibat pada
panjang gelombang yang bergeser karena dengan bertambahnya ikatan rangkap
yang terkonjugasi, sehingga terjadi pergeseran kearah batokromik (Fessenden,
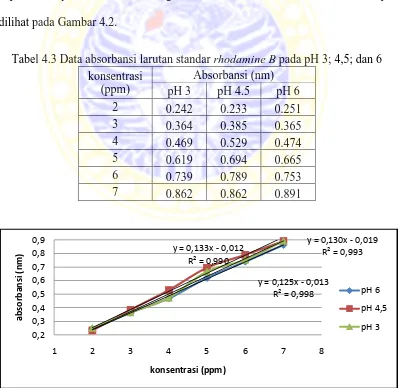
4.3 Pembuatan Kurva Kalibrasi Rhodamine B
Larutan standar rhodamine B yang telah dibuat dalam beberapa
konsentrasi (2, 3, 4, 5, 6, dan 7 ppm), diukur absorbansinya dengan menggunakan
spektrofotometer UV-Vis pada panjang gelombang pada masing-masing pH
dengan larutan blanko akua DM untuk pH 6 dan blanko akua DM yang telah
diatur pHnya dengan penambahan HCl 0,1 M untuk pH 3 dan 4,5.. Dan dari data
absorbansi yang didapatkan digunakan untuk membuat kurva standar dan regresi
liniernya. Data absorbansi larutan standar rhodamine B pada pH 3; 4,5; dan 6
dapat dilihat pada Tabel 4.3, sedangkan kurva kalibrasi larutan rhodamine B dapat
dilihat pada Gambar 4.2.
Persamaan regresi linier tersebut digunakan untuk menetukan konsentrasi
larutan rhodamine B.
4.4 Penentuan Waktu dan pH Optimum Degradasi Larutan Rhodamine B
Untuk mengetahui waktu degradasi optimum, maka larutan kontrol
rhodamine B dengan konsentrasi 50 ppm dengan variasi pH 3; 4,5; dan 6 diambil sebanyak 500 ml dan ditambahkan 0,5000 g TiO2/bentonit, kemudian disinari
dengan sinar UV yang mempunyai daya 3 x 8 watt selama 180 menit. Hasil
degradasi pada menit ke-5, 10, 20, 30, 45, 60, 90, 120, dan 180 diambil sebanyak
5,0 ml kemudian disentrifugasi dan disaring menggunakan kertas saring untuk
memisahkan larutan rhodamine B dengan TiO2/bentonit, lalu diukur
absorbansinya dengan spektrofotometer UV-Vis. Hasil absorbansi yang
didapatkan dimasukkan kedalam persamaan regresi linier yang sudah didapatkan
pada hasil 4.5 untuk mencari persen degradasi yang dihasilkan selama proses
degradasi tersebut. Berdasarkan perhitungan yang telah dilakukan, persen
degradasi yang didapatkan disajikan dalam sebuah grafik pada Gambar 4.3 berikut
Gambar 4.3 Grafik hubungan antara waktu degradasi larutan rhodamine B 50 ppm pada pH 3; 4,5; dan 6 menggunakan 0,5000 g bentonit terpilar TiO2 dan lampu UV 3 x 8 watt dengan persen degradasi
Dapat dilihat bahwa persen degradasi pada grafik terus menanjak, namun
pada 2 jam terakhir kemampuan TiO2/bentonit untuk mendegradasi sudah mulai
berkurang. Hal ini dikarenakan adanya proses adsorbsi pada bentonit yang
mengakibatkan ketidakstabilan pada multilayernya, sehingga larutan rhodamine B
yang terserap akan terlepas kembali. Sehingga dapat diketahui bahwa waktu
optimum pada pH 6 adalah pada menit ke 180 walaupun pada menit ke 240 persen
degradasi tetap mengalami kenaikan. Hal ini dikarenakan lonjakan yang
dihasilkan antara menit ke 180, dan 240 sangat jauh. Melalui Tabel 4.3 di atas
dapat disimak bahwa dari menit ke 120 ke menit 180 menghasilkan persen
degradasi yang sangat besar (dengan selisih persen degradasi sebesar 7,9 %),
sedangkan dari menit ke 180 ke menit ke 240 hanya mengalami kenaikan sebesar
1,68%. Sehingga dalam rentang waktu yang sama (60 menit), pada menit ke 180
proses degradasi masih lebih optimal dibanding dengan menit ke 240. Dengan
alasan yang sama, penentuan waktu optimum pada pH 4,5 ada pada menit ke 120,
dan untuk pH 3 terletak pada menit ke 90.
Untuk mengetahui pH optimum degradasi larutan rhodamin b, maka
dilakukan variasi pH larutan. Variasi pH yang dipilih adalah variasi terhadap
trayek pH kerja rhodamin b, yaitu antara pH 4 – 5, sehingga dipilih tiga pH yang
berbeda, yaitu 3; 4,5; dan 6 (Suwannawong, dkk., 2010). Berdasarkan grafik pada
Gambar 4.3 dapat dilihat suatu garis yang linier (pada orde 1), sehingga pada garis
lurus tersebut dapat didapatkan persamaan regresi y = ax + b, dimana berdasarkan
harga a yang didapatkan akan dapat ditentukan pH yang paling optimum. Semakin
dimana harga a sebagai harga kecepatan. Pada grafik dapat dilihat bahwa harga a
yang paling besar ditunjukkan oleh pH 3, yaitu sebesar 0,3834. Sehingga
didapatkan bahwa pH optimum untuk mendegradasi rhodamin b ini berada pada
pH 3. Hal ini juga ditunjang dengan dengan Gambar 4.4 dibawah ini.
Gambar 4.4 Grafik hubungan antara pH dengan persen degradasi larutan rhodamin b 50 ppm pada pH 3; 4,5; dan 6 menggunakan 0,5000 g
TiO2/bentonit dan lampu UV 3 x 8 watt
Dari Gambar 4.4 dapat diketahui bahwa persen degradasi untuk pH 3; 4,5;
dan 6 berturut-turut adalah 97,8%, 91,48%, dan 93,28%. Dari hasil tersebut
diketahui bahwa kondisi optimumnya ditunjukkan pada pH 3. Larutan rhodamin b
lebih mudah didegradasi pada keadaan asam, karena adanya ion H+ yang
melepaskan kation-kation lain (Fe, Al, dan Mg) pada kisi-kisi struktur sehingga
turut larut dalam larutan yang mengakibatkan bentonit tersebut menjadi lebih
aktif.
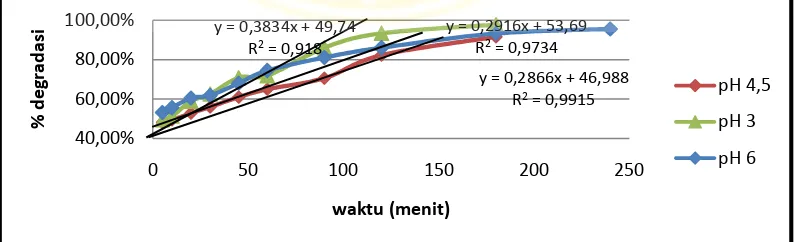
4.5 Mempelajari Pengaruh Perlakuan Terhadap Hasil Degradasi
Pada prosedur ini dilakukan pemberian perlakuan yang berbeda pada
proses degradasi larutan rhodamine B 50 ppm sebanyak 500 ml yang disinari oleh
lampu UV 3 x 8 watt selama 3 jam pada pH 6 dan 2 jam pada pH 3. Perbedaan
waktu degradasi ini berdasarkan waktu optimum yang dijelaskan pada prosedur
4.4. Adapun perlakuan yang diberikan yaitu 500 ml larutan rhodamine B 50 ppm
dengan disinari UV, 500 ml larutan rhodamine B 50 ppm ditambahkan 0,5000 g
TiO2 dengan disinari UV, 500 ml larutan rhodamine B 50 ppm ditambahkan
0.5000 g bentonit dengan disinari UV, 500 ml larutan rhodamine B 50 ppm
ditambahkan 0,5000 g TiO2/bentonit tanpa disinari UV, dan 500 ml larutan
rhodamine B 50 ppm ditambahkan 0.5000 g TiO2/bentonit dengan disinari UV. Dari semua data setelah didegradasi di ambil sebanyak 5,0 ml kemudian
disentrifugasi dan disaring menggunakan kertas saring untuk memisahkan
rhodamine B dengan TiO2, bentonit, dan TiO2/bentonit (kecuali perlakuan dengan UV saja). Dan setelah diukur absorbansinya, data dimasukkan kedalam persamaan
regresi linier untuk mengetahui konsentrasi rhodamine B yang tersisa untuk dapat
dihitung nilai persen degradasinya. Dan data hasil perhitungan tersebut dapat
dilihat pada Gambar 4.5
Gambar 4.5 Grafik perbandingan hasil perlakuan larutan rhodamine B 50 ppm pada pH 3 dan pH 6 dengan 5 macam perlakuan
UV TiO2-UV bentonit-UV bentonit/TiO
2
bentonit/TiO 2-UV
pH 3 3,85 8,13 51,16 75,76 93,24
Berdasarkan grafik pada Gambar 4.5 diketahui bahwa semua perlakuan
dapat memberikan pengaruh degradasi larutan rhodamine B. Persen degradasi
paling rendah diberikan pada perlakuan larutan rhodamine B dengan UV saja,
yaitu 1,48% pada pH 3 dan 3,85 % pada pH 6. Sedikitnya persen degradasi yang
dihasilkan ini dikarenakan tidak adanya faktor pendukung dari material
fotokatalitik ataupun katalis.
Penambahan media fotokatalitik TiO2, dapat meningkatkan persen
degradasi sebesar 8,13 % pada pH 3 dan 37,49 % pada pH 6. Persen degradasi
pada pH asam lebih kecil dibanding persen degradasi pada pH 6 karena TiO2 lebih
mudah membentuk radikal secara optimum pada pH 4 – pH 8 (Hoffmann, et al.,
1995). Proses degradasi TiO2 terhadap larutan rhodamine B terjadi setelah TiO2
mengadsorpsi radiasi sinar UV sehingga terjadi eksitasi elektron dari pita valensi
ke pita konduksi yang akan menghasilkan e-, dan menyebabkan adanya
kekosongan (hole h+vb). Hole (h+vb) inilah yang akan bereaksi dengan TiO2 untuk
mengoksidasi larutan rhodamine B. sedangkan elektron yang ada pada permukaan
semikonduktor akan terjebak dalam hidroksida logam dan dapat bereaksi dengan
penangkap elektron yang ada dalam larutan (seperti H2O) untuk membentuk
radikal hidroksil (•OH) yang berfungsi mengoksidasi rhodamine B dalam larutan
(Lacheb, et al., 2002).
Bentonit yang berfungsi sebagai adsorben, mengadsorbsi larutan
rhodamine B sebesar 51,16 % pada pH 3 dan 20,28 % pada pH 6. Bentonit yang bermuatan negatif akan mengadsorpsi larutan rhodamine B dengan karena zat
muatan positif dalam struktur rhodamine B menjadi bertambah sehingga bentonit
akan mengadsorpsi rhodamine B lebih baik. Pada Lampiran 3 terdapat data persen
degradasi yang dilakukan oleh bentonit terpilar TiO2 yang menyatakan bahwa
persen degradasi pH 3 pada menit yang sama, yaitu 180 menit, lebih besar
dibandingkan dengan persen degradasi pH 6 pada menit ke-180.
Berdasarkan Gambar 4.5, hasil paling baik ditunjukkan oleh degradasi
larutan rhodamine B dengan TiO2/bentonit dengan disinari UV, yaitu 93,23%
pada pH 3 dan 93,11% pada pH 6. Hal ini dikarenakan adanya bentonit yang
berperan sebagai adsorben dan TiO2 sebagai media fotokatalitik, yang bekerja
secara bersamaan yang dibantu juga dengan sinar UV akan menghasilkan hasil
yang paling optimum. Selain itu pengaruh penambahan asam (HCl) pada saat
pengaturan pH yang membuat bentonit lebih stabil daripada keadaan awal.
Adanya penyinaran UV tampaknya memberikan pengaruh yang cukup besar
dalam proses degradasi ini. Hal ini juga terlihat dari persen degradasi yang
dihasilkan pada degradasi TiO2/bentonit tanpa adanya sinar UV yang memberikan
persen degradasi 75,76 % pada pH 3 dan 79,64 % pada pH 6.
4.6 Penentuan Kapasitas Degradasi TiO2/bentonit terhadap Konsentrasi
yang Berbeda
Dari larutan induk rhodamine B 1000 ppm dibuat dengan berbagai macam
variasi konsentrasi sebesar 25, 50, 75, 100, 150, dan 200 ppm dengan pH
optimum yaitu pH 3. Sebanyak 500 ml larutan rhodamine B dengan konsentrasi
diatas, ditambahkan sebanyak 0,5000 g TiO2/bentonit. Proses degradasi larutan
disinari sinar UV. Setelah itu diukur absorbansi sebelum didegradasi dan sesudah
didegradasi agar dapat diketahui selisih konsentrasi akibat proses degradasi ini.
Kurva hubungan antara konsentrasi awal dengan kapasitas penyerapan bentonit
terhadap rhodamine B dapat dilihat pada Gambar 4.6
Gambar 4.6 Grafik hubungan antara konsentrasi awal dengan kapasitas penyerapan larutan rhodamine b berbagai konsentrasi menggunakan 0.5000 g bentonit terpilar TiO2 dengan disinari sinar UV 3 x 8 watt selama 2 jam pada pH 3
Berdasarkan Gambar 4.6 tersebut terlihat bahwa semakin tinggi
konsentrasi rhodamine B semakin meningkat pula kapasitas bentonit menyerap
rhodamine B. Peningkatan terlihat sampai konsentrasi rhodamine B 75 ppm, namun demikian kapasitas telah menurun pada kenaikan konsentrasi yang lebih
besar. Hal ini menunjukkan bahwa konsentrasi larutan rhodamine B dapat
terdegradasi dengan maksimal pada konsentrasi 75 ppm, pada konsentrasi ini pula
larutan rhodamine B mengalami konsentrasi kesetimbangan, sehingga apabila
terus dilakukan degradasi terhadap konsentrasi yang lebih besar lagi akan
mengalami kejenuhan (penurunan). Hal ini disebabkan terbatasnya jumlah
bentonit/TiO2 pada larutan rhodamine B, sementara konsentrasi yang diberikan
juga semakin besar menyebabkan kemampuan TiO2 untuk melepaskan radikal
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Waktu optimum degradasi larutan rhodamine B 50 ppm adalah selama
180 menit.
Sedangkan pH optimum yang didapatkan dalam degradasi larutan
rhodamine B 50 ppm adalah pada pH 3 dengan waktu optimum 120 menit.
2. Kapasitas degradasi bentonit terpilar TiO2 terhadap konsentrasi awal
larutan rhodamine B yang didapatkan adalah pada konsentrasi 75 ppm.
Pada konsentrasi ini larutan rhodamine B telah mencapai konsentrasi
kesetimbangan, sehingga apabila proses degradasi dilanjutkan pada
konsentrasi lebih tinggi maka kapasitas konsentrasi akan menurun.
3. Pengaruh perlakuan terhadap hasil degradasi larutan rhodamine B 50
ppm hasil terbaik ditunjukkan pada degradasi larutan rhodamine B
menggunakan bentonit terpilar TiO2 dengan sinar UV, yaitu sebesar
93,24% pada pH 3 dan 93,1% pada pH 6.
5.2 Saran
Hasil penelitian ini dapat digunakan sebagai cara untuk menanggulangi limbah
industri maupun rumah tangga yang berasal dari zat warna tekstil. Dengan adanya
tekstil, dalam penelitian ini rhodamine B, akan lebih optimal. Kemudian
diharapkan untuk kedepannya diadakan penelitian lebih lanjut mengenai
keefektifan adanya bentonit saja atau TiO2 saja dengan menggunakan variasi berat