PRODUKSI ASAM SITRAT DARI Aspergillus niger DALAM
BIOREAKTOR
ABSTRAK
Percobaan mengenai produksi asam sitrat dalam bioreaktor menggunakan
Aspergillus niger telah dilakukan. Medium propagasi untuk inokulum terdiri dari Gula pasir; Ekstrak tauge 20% (b/v); (NH4)2SO4; KH2PO4. Medium fermentasi
terdiri dari Gula pasir 15% (b/v); (NH4)2SO4 0,6% (b/v); KH2PO4 0,3% (b/v); pH
medium fermentasi 6,0. Kondisi selama fermentasi, yaitu suhu : 29±1oC; Agitasi 150 rpm dan lama proses fermentasi selama 5 hari. Produksi asam sitrat tertinggi terjadi pada hari ke 5 sebesar 9,024 g/l. Kadar glukosa meningkat sampai hari ke 3 (208, 75 g/l) kemudian menurun sampai hari ke 5 (101 g/l). Sedangkan konsentrasi biomassa tertinggi pada hari ke 3 (16,8079 g/l) dengan laju pertumbuhan spesifik sebesar 0.165/hari. Koefisien Y x/s = 0.054 g biomassa/ g glukosa; koefisien Y p/x = 0.91 g asam sitrat/ g biomassa, sedangkan koefisien Y p/s = 0,023 g asam sitrat/ g glukosa.
PENDAHULUAN
Asam sitrat adalah asam organik yang secara alami terdapat pada buah-buahan seperti jeruk, nenas dan pear. Asam sitrat pertama kali diekstraksi dan dikristalisasi dari buah jeruk, sehingga asam sitrat hasil ektraksi dari buah-buahan ini dikenal sebagai asam sitrat alami.
Wehner (1893) pertama kali melaporkan produksi asam sitrat sebagai hasil sampingan pada fermentasi produksi asam oksalat dengan menggunakan
Penicillium glaucum. Tahun 1917, Currie juga melaporkan bahwa Aspergillus niger dapat menghasilkan asam sitrat pada medium pH rendah dengan kadar gula tinggi. Sejak saat itu asam sitrat diproduksi secara komersial dengan menggunakan kapang A. niger.
Ustulina vulgaris dll. Selain kapang, beberapa bakteri dan kamir juga dapat memproduksi asam sitrat, diantaranya: Brevibacterium, Corynebacterium, Arthrobacter dan Candida.
Kapang A. niger merupakan mikroorganisme yang dapat tumbuh dan banyak digunakan secara komersial dalam produksi asam sitrat, asam glukonat, dan beberapa enzim seperti pektinase dan amilase (Broekhuijsen et al., 1993; Okada, 1985). A. niger mampu mensintesis asam sitrat dalam medium fermentasi ekstraseluler dengan konsentrasi yang cukup tinggi, jika dibiakkan dalam media yang kadar garamnya rendah dan mengandung gula sebagai sumber karbon (Hang
et al., 1977; Ji et al., 1992).
Asam sitrat (C6H8O7) banyak digunakan dalam industri terutama industri
makanan, minuman, dan obat-obatan. Kurang lebih 60% dari total produksi asam sitrat digunakan dalam industri makanan, dan 30% digunakan dalam industri farmasi, sedangkan sisanya digunakan dalam industri pemacu rasa, pengawet, pencegah rusaknya rasa dan aroma, sebagai antioksidan, pengatur pH dan sebagai pemberi kesan rasa dingin. Dalam industri makanan dan kembang gula, asam sitrat digunakan sebgai pemacu rasa, penginversi sukrosa, penghasil warna gelap dan penghelat ion logam. Dalam industri farmasi asam sitrat digunakan sebgai pelarut dan pembangkit aroma, sedangkan pada industri kosmetik digunakan sebagai antioksidan (Bizri & Wahem, 1994).
Proses fermentasi asam sitrat dapat dilakukan dengan sistem terendam, fermentasi kultur permukaan. Fermentasi kultur terendam dibagi dua yaitu dilakukan pada fermentor berpengaduk dan pada air lift fermentor. Sedangkan pada fermentasi kultur permukaan dapat menggunakan media cair maupun media padat. Fermentasi sistem terendam lebih sulit dilakukan dibandingkan prosedur permukaan, tetapi dapat dilakukan secara curah, proses curah terumpani, atau sinambung. Fermentasi curah digunakan untuk substrat glukosa, dan curah terumpani lebih layak diterapkan untuk untuk tetes tebu. Biakan sinambung mempunyai produktivitas yang lebih tinggi (Mangunwidjaja & Suryani, 1994).
media tumbuh (substrat) dan mikroorganisme yang digunakan (Friedrich et al., 1994).
Pada umumnya hasil samping pertanian dan perkebunan seperti jerami padi, onggok, bagas, dan kulit kakao masih mengandung lignoselulosa. Limbah ini masih mengandung pati, protein, lemak, dan senyawa kimia lainnya. Dengan teknologi fermentasi, hasil samping ini dapat dimanfaatkan lebih lanjut menjadi produk lain yang berguna seperti pangan, pakan ternak, pelarut organik, asam-asam organik seperti asam-asam sitrat dan lain-lain (Judoamidjojo et al., 1989).
TUJUAN
Percobaan bertujuan untuk mempelajari produksi asam sitrat pada proses fermentasi menggunakan A. niger.
METODOLOGI
Bahan yang diguankan dalam percobaan ini: Mikroorganisme : Aspergillus niger berumur 5 hari. Medium propagasi untuk inokulum terdiri dari:
Gula pasir 15 gram
Ekstrak tauge 20% (b/v) 11 ml
(NH4)2SO4 450 mg
KH2PO4 225 mg
Semuanya bahan kemudian dilarutkan dalam 100 ml akuades, pH 6,0 Medium fermentasi terdiri dari:
Gula pasir 15% (b/v)
(NH4)2SO4 0,6% (b/v)
KH2PO4 0,3% (b/v)
pH medium fermentasi 6,0 Kondisi fermentasi : Suhu : 29±1oC
Agitasi 150 rpm
Alat yang digunakan adalah spektrofotometer, tabung reaksi, gelas ukur, timbangan, vortex, erlenmeyer, labu ukur, pipet, kertas pH, shaker, autoklaf, kertas saring, oven, alat titrasi dan alat vakum.
Prosedur kerja:
1. Membuat media propagasi dengan komposisi yang sudah ditentukan. Namun, gula dipisahkan dari bahan lainnya. Lalu semua bahan disterilisasi pada suhu 121oC selama 15 menit dan dinginkan.
2. Melakukan inokulasi dengan suspense spora A.niger sebanyak 2% (v/v). Selanjutnya hasil inokulasi pada media propagasi yang telah diinkubasi ini disebut inokulum.
3. Kemudian lakukan inkubasi pada incubator goyang pada suhu 29±1oC (suhu kamar) selama 24 jam.
4. Bioreaktor tangki pengaduk (CSTR) yang akan digunakan juga dilakukan sterilisasi.
5. Membuat media fermentasi dengan komposisi yang telah ditentukan dalam Erlenmeyer 1000 ml dengan melarutkan 900 ml media dan inokulum 100 ml. Namun gula dan bahan lainnya dpisahkan. Kemudian disterilisasi pada suhu 121oC, 15 menit dan dinginkan.
6. Kemudian melakukan inokulasi inokulum.
7. Pengambilan sample dilakukan setiap hari selama 5 hari. 8. Pada setiap pengamatan, yang diamati adalah sebagai berikut :
- pH : dilakukan dengan mengukur pH cairan fermentasi dengan pH meter
- Biomassa : dilakukan dengan menyaring cairan fermentasi pada kertas saring yang telah dikeringkan dan diketahui bobotnya. Biomassa dihitung sebagai bobot residu kering hasil penyaringan per ml cairan kultivasi
absorbansinya menggunakan spektrofotometer pada panjang gelombang 550 nm. Kurva standar dibuat untuk pengukuran gula dengan metode DNS. Hasil mengukuran diplotkan pada kurva standar sehingga dapat diketahui kadar gula sisa.
- Total asam : Pengukuran asam organic dilakukan dengan metode titrasi. Mengambil 10 ml sampel kemudian dititrasi dengan larutan NaOH 0.1 N yang telah distandarisasi. Titrasi dilakukan dengan bantuan indicator PP. Titrasi dihentikan bila telah terbentuk warna merah muda. Penentuan kadar total asam organic tertitrasi adalah :
10 192 /
HASIL
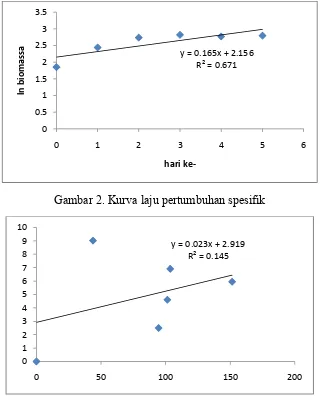
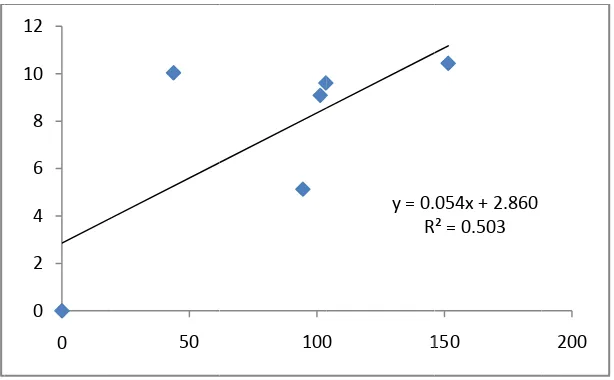
Produksi asam sitrat meningkat selama proses fermentasi dan maksimum sebesar 9,024 g/l pada hari ke 5. Kadar glukosa meningkat sampai hari ke 3 (208, 75 g/l) kemudian menurun sampai hari ke 5 (101 g/l). Sedangkan konsentrasi biomassa tertinggi pada hari ke 3 (16,8079 g/l) (Tabel 1 & Gambar 1) dengan laju pertumbuhan spesifik sebesar 0.165/hari (Gambar 2). Koefisien Y x/s = 0.054 g biomassa/ g glukosa, nilai ini menunjukkan bahwa dalam 1 gram glukosa terbentuk 0,054 g biomassa. Koefisien Y p/x = 0.91 g asam sitrat/ g biomassa, nilai ini menunjukkan bahwa dalam 1 gram biomassa terbentuk 0,91 g asam sitrat. Koefisien Y p/s = 0,023 g asam sitrat/ g glukosa, nilai ini menjunjukkan bahwa dalam 1 g glukosa terbentuk 0,023 asam sitrat (Gambar 3-5).
Tabel 1. Data pengamatan selama proses fermentasi
hari ke- pH biomassa
1 2 11,50 151,75 2,496 2,442197
2 2 15,46 158,5 4,608 2,738107
3 2 16,81 208,75 5,952 2,821851
4 2 15,98 160,75 6,912 2,771427
0
biomassa asam sitrat glukosa
glukosa
Gambar 1. Kurva pertumbuhan biomassa, konsentrasi asam sitrat yang terbentuk, dan konsentrasi glukosa selama proses fermentasi
y = 0.165x + 2.156
Gambar 2. Kurva laju pertumbuhan spesifik
y = 0.023x + 2.919
PEMBAHASAN pH medium
pH medium dalam proses fermentasi sangat penting. Pada proses awal fermentasi diketahui bahwa pH medium sebesar 4,5 kemudian menurun pada hari ke 2 sampai ke 5 sebesar 2,0 (Gambar 6). Pada awal fermentasi merupakan awal saat spora mulai terbentuk untuk memulai germinasi. Sedangkan selama proses fermentasi untuk produksi asam sitrat diperlukan pH ≤ 2. pH yang rendah akan mengurangi resiko kontaminasi pada saat fermentasi oleh mikroorganisme lain. pH yang rendah juga menghambat produksi dari asam organik yang tidak diinginkan (misalnya asam glukonat, asam oksalat) dan hal ini membuat perbaikan asam sitrat dari media cair. Pengambilan amonia dalam proses germminasi spora menyebabkan dilepaskannya proton pada pH rendah setelah fase germinasi terbentuk. Menurut Papagianni (1995), meningkatnya pH menjadi 4,5 selama fase produksi akan menurunkan hasil asam sitrat sampai 80%.
pH pada media juga mempengaruhhi produksi asam sitrat dari A. niger
karena beberapa enzim yang berperan dalam siklus TCA sensitif terhadap pH. pH yang rendah selama fermentasi untuk produksi asam sitrat yang optimal diperlukan pH sekitar 2. Jika kondisi tersebut tidak diperoleh hasil produksi akan berkurang (Mattey, 1992). Papagianni (1995) & Papagianni et al. (1999) melaporkan bahwa pH mempengaruhi morfologi dan produktivitas asam sitrat dari A. niger dari hasil data kuantitatif. Morfologi dengan agregat yang kecil dan filament yang pendek berkaitan dengan meningkatnya produksi asam sitrat pada pH sekitar 2,0 ± 0,2. Pada pH 1,6 morfologi akan berkembang abnormal (bulbous hyphae) dan produksi asam sitrat akan menurun secara drastis. Pada pH 3,0 agregat mempunyai bentuk perimeter yang lebh panjang dan terbentuk asam oksalat.
Sintesis asam sitrat
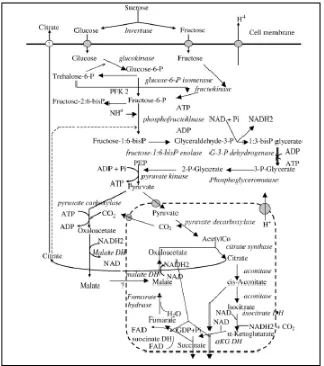
Asam sitrat merupakan senyawa antara pada siklus kreb (siklus asam trikarboksilat). Lintasan reaksi katabolik yang mendahului pembentukan asam sitrat ini diantaranya adalah lintasan glikolisis dan lintasan Entner-Doudoroff yang menyediakan senyawa antara asam piruvat yang merupakan senyawa kunci dalam metabolisme sel. Sebagian besar (80%) dari glukosa diubah menjadi piruvat melalui lintasan glikolisis. Piruvat akan mengalami dekarboksilasi dan berikatan dengan koenzim-A membentuk asetil-CoA dan selanjutnya masuk kedalam siklus krebs untuk bergabung dengan oksaloasetat membentuk asam sitrat. Piruvat juga bisa langsung masuk ke siklus krebs dengan bantuan enzim piruvat karboksilase yang mengubah piruvat menjadi oksaloasetat.
Gambar 7. Skema reaksi metabolik dalam produksi asam sitrat (Sumber: Pagianni, 2007)s
oksaloasetat untuk membentuk asam sitrat. Pertama-tama, asetil ko-A hasil dari reaksi antara (dekarboksilasi oksidatif) masuk ke dalam siklus dan bergabung dengan asam oksaloasetat membentuk asam sitrat. Setelah "mengantar" asetil masuk ke dalam siklus Krebs, ko-A memisahkan diri dari asetil dan keluar dari siklus. Kemudian, asam sitrat mengalami pengurangan dan penambahan satu molekul air sehingga terbentuk asam isositrat. Lalu, asam isositrat mengalami oksidasi dengan melepas ion H+, yang kemudian mereduksi NAD+ menjadi NADH, dan melepaskan satu molekul CO2 dan membentuk asam a-ketoglutarat
(baca: asam alpha ketoglutarat). Setelah itu, asam a-ketoglutarat kembali melepaskan satu molekul CO2, dan teroksidasi dengan melepaskan satu ion H+
yang kembali mereduksi NAD+ menjadi NADH. Selain itu, asam a-ketoglutarat mendapatkan tambahan satu ko-A dan membentuk suksinil ko-A. Setelah terbentuk suksinil ko-A, molekul ko-A kembali meninggalkan siklus, sehingga terbentuk asam suksinat. Pelepasan ko-A dan perubahan suksinil ko-A menjadi asam suksinat menghasilkan cukup energi untuk menggabungkan satu molekul ADP dan satu gugus fosfat anorganik menjadi satu molekul ATP. Kemudian, asam suksinat mengalami oksidasi dan melepaskan dua ion H+, yang kemudian diterima oleh FAD dan membentuk FADH2, dan terbentuklah asam fumarat.
Satu molekul air kemudian ditambahkan ke asam fumarat dan menyebabkan perubahan susunan (ikatan) substrat pada asam fumarat, karena itu asam fumarat berubah menjadi asam malat. Terakhir, asam malat mengalami oksidasi dan kembali melepaskan satu ion H+, yang kemudian diterima oleh NAD+ dan membentuk NADH, dan asam oksaloasetat kembali terbentuk. Asam oksaloasetat ini kemudian akan kembali mengikat asetil ko-A dan kembali menjalani siklus Krebs.
isositrat diubah menjadi glioksilat, selanjutnya glioksilat diubah menjadi malat oleh sintetase. Bila glukosa ditambahkan siklus tersebut akan terhambat.
Pada pembentukan asam sitrat dalam proses fermentasi dibatasi oleh ketersediaan beberapa unsur kelumit (P, Mn, Zn). Peranan ion logam dalam proses ini belum diketahui secara menyeluruh. Nilai pH optimum sekitar 1,7 – 2,0. Jika pH lebih tinggi (alkalis) menyebabkan pembentukan asam – asam oksalat dan glukonat dalam jumlah banyak. Karenanya pengendalian kondisi proses secara cermat merupakan prasyarat untuk mempertahankan keteraturan metabolik dan mendukung pembentukan asam sitrat yang lebih banyak. Kondisi yang sesuai tersebut memungkinkan stimulasi glikolisis untuk penyediaan aliran karbon yang tidak terbatas ke dalam metabolisme antara. Akumulasi sitrat selanjutnya tergantung pada pemasokan oksaloasetat (Mangunwidjaja & Suryani 1994).
Mangunwidjaja & Suryani (1994) juga menjelaskan bahwa kekurangan mangan akan menurunkan aktivitas enzim dalam siklus asam trikarboksilat yang diikuti oleh penurunan anabolisme. Gangguan metabolisme ini menyebabkan perbedaan tingkat ion amonium intraselluler yang dapat membantu menghilangkan penghambatan enzim fosfofruktose oleh sitrat. Mangan juga terlibat dalam biokimia permukaan sel dan morfologi hifa. Kebutuhan oksigen yang tinggi memungkinkan reoksidasi sitoplasma NADH tanpa pembentukan ATP dan melibatkan suatu cabang respirasi alternatif yang berbeda dari rantai respirasi normal.
Sumber karbon dalam proses fermentasi
et al. (1984) dan Xu et al. (1989) melaporkan keunggulan penggunaan sukrosa dari pada glukosa dan fruktosa pada proses fermentasi asam sitrat.
Aerasi
Industri produsen asam sitrat sejak lama tengah mengetahui bahwa variasi dalam laju aerasi memiliki efek buruk bagi perolehan produksi. Jika laju aerasi tertalu tinggi (contohnya kondisi yang biasa terjadi pada skala laboratorium), tekanan parsial dari CO2 terlarut dalam medium dapat menjadi rendah.
Karbondioksida penting sebagai substrat bagi enzim piruvat karboksilase yang memulihkan kembali cadangan oksaloasetat yang menjadi substrat sitrat sintase. Co2 yang memadai dihasilkan dari reaksi piruvat dekarboksilase untuk
mencukupu kebutuhan stoikiometrik dari reaksi piruvat karboksilase, akan tetapi aerasi yang berlebihan berakibat pada hilangnya CO2 (Papagianni, 2007).
McIntyre & McNeil (1997) dalam Papagianni (2007) menunjukkan bahwa kadar CO2 yang meningkat dalam gas yang disemburkan memiliki efek buruk
terhadap konsentrasi sitrat akhir dan konsentrasi biomassa akhir. Efek oksigen terlarut telah banyak dipelajari secara terperinci. Tekanan oksigen terlarut (DOT) yang menurun bahkan dalam rentang waktu yang pendek dapat menyebabkan perubahan ireversibel dalam produksi asam sitrat (Kubicek et al., 1980). A. niger
komponen ensial untuk mempertahankan aliran yang tinggi melalui jalur glikolisis.
KESIMPULAN
Produksi asam sitrat tertinggi terjadi pada hari ke 5 sebesar 9,024 g/l. Kadar glukosa meningkat sampai hari ke 3 (208, 75 g/l) kemudian menurun sampai hari ke 5 (101 g/l). Sedangkan konsentrasi biomassa tertinggi pada hari ke 3 (16,8079 g/l) dengan laju pertumbuhan spesifik sebesar 0.165/hari. Koefisien Y x/s = 0.054 g biomassa/ g glukosa; koefisien Y p/x = 0.91 g asam sitrat/ g biomassa, sedangkan koefisien Y p/s = 0,023 g asam sitrat/ g glukosa.
DAFTAR PUSTAKA
Bizri, N.J. dan A.L. Wahem. 1994. Citric Acid and Antimicrobials Affect Microbiological Stability and Quality of Tomato Juice. J. of Food Science
59 (1) : 130-134
Boddy L.M., T. Berges, C. Barreau, M.H. Vainstain, M.J. Johnson dan D.J. Balance. 1993. Purification and characterisation of an Aspergillus niger
invertase and its DNA sequence. Curr Genet24: 60–6.
Broekhuijsen M.P, I.E. Mattern, R. Contreras, dan J.R. Kinghorn. 1993. Secretion of Heterologons Protein by Aspergillus niger. J.Biotech. 31 : 135-145
Friedrich J., A. Cimerman, dan W. Steiner. 1994. Concomitant Biosynthesis of Aspergillus niger Pectolytic Enzymes and Citric Acid on Sucrosa. J. Enzym and Microbial Technology 16 : 703-710
Gupta J.K., L.G. Heding dan O.B. Jorgensen. 1976. Effect of sugars, hydrogen ion concentration and ammonium nitrate on the formation of citric acid by
Aspergillus niger. ActaMicrobiol Acad Sci Hung 23: 63–7.
Hang Y.D, D.F. Splittstoessitr, R.E.E. Woodams, dan R.M. Sherman. 1977.Citric Acid Fermentation of Brewery Waste. J. of Food Science. 42 (2) : 383-388 Hossain M., J.D. Brooks dan I.S. Maddox. 1984. The effect of the sugar source
on citric acid production by Aspergillus niger. Appl Microbiol Biotechnol
Ji L.N., X.R. Zhao, dan H.Y. Yang. 1992. Effects of Trace Elements on Citric Acid Fermentation by Aspergillus niger and Treatment of cane Molasses as
Raw Material. J. Industriall Microbiology 22(2) : 16-21
Judoamidjojo M, E.G. Sa'id, dan L. Hartoto. 1989. Biokonversi. PAU-BIOTEK. IPB. Bogor
Judoamidjojo M., A.A. Darwis dan E.G. Sa'id. 1992. Teknologi Fermentasi. CV.Rajawali pers. Jakarta
Kubicek C.P. dan M. Röhr. 1989. Citric acid fermentation. Crit Rev Biotechnol 4: 331–73.
Mangunwidjaja D. dan A. Suryani. 1994. Teknologi Bioproses. Penebar Swadaya. Jakarta
Mattey M. 1992. The production of organic acids. Crit Rev Biotechnol 12:87– 132.
Okada, G. 1985. Purification and Properties of a Cellulase from Aspergillus niger. J. Biochem. 49 (5) : 1257-1265.
Papagianni M, M. Mattey, M. Berovic dan B. Kristiansen. 1999. Aspergillus niger
morphology and citric acid production in submerged batch fermentation: effects of culture pH, phosphate and manganese levels. Food Technol Biotechnol37:165–71.
Papagianni M. 1995. Morphology and citric acid production of Aspergillus niger in submerged culture. PhD Thesis, University of Strathclyde.
Papagianni M. 2007. Advances in citric acid fermentation by Aspergillus niger: Biochemical aspects, membrane transport and modeling. Biotechnology Advances 25 (2007) 244–263.
Rubio M.C. dan M.C. Maldonado. 1995. Purification and characterisation of invertase from Aspergillus niger. Curr Microbiol31:80–3.
Wehner. 1893 dalam Rusmana I. 2005. Petunjuk Praktikum Bioteknologi Mikrobia. FMIPA IPB. Bogor.