PENGELOMPOKAN UNSUR-UNSUR
Logam
Unsur Logam
1.Kerapatannya Tinggi (keras)
2.Padat (dapat
ditempa/dibentuk)
3.Bersifat konduktor
4.Mengkilap
Non Logam
Unsur Non Logam
1.Kerapatannya rendah
2.Rapuh
3.Bersifat isolator
1. TRIADE ( DOBEREINER )
• Unsur-unsur dikelompokkan berdasarkan kemiripan sifat-sifatnya dan kenaikan massa atom.
• Tiap kelompok beranggotakan tiga unsur, sehingga disebut triad.
• Di dalam triad, unsur kedua mempunyai
sifat-sifat yang berada di antara unsur pertama dan ketiga
– Contoh :
2. SISTEM OKTAF ( NEWLANDS )
•
Unsur-unsur dikelompokkan
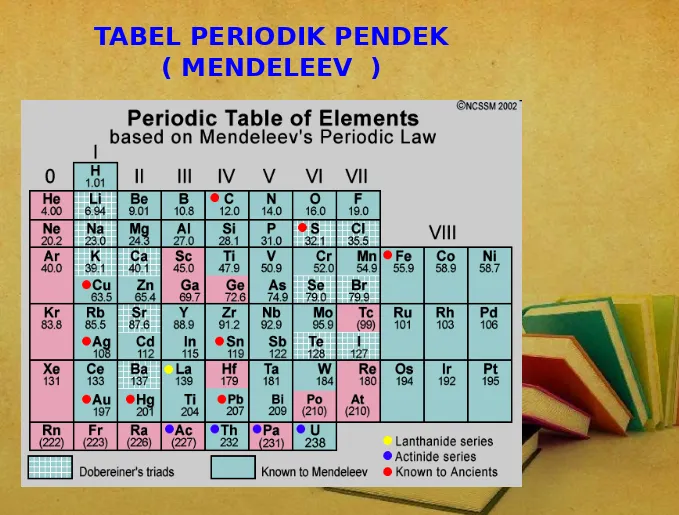
3. SISTEM PERIODIK PENDEK ( MENDELEEV )
• Ia mengelompokkan unsur-unsur berdasarkan kenaikan massa atom secara horisontal membentuk baris yang disebut periode.
Penyususnan pada periode akan berhenti dan berganti pada periode berikutnya jika terjadi pengulangan sifat unsur.
Kelemahan
dan
Kelebihan
Sistem Periodik Mendeleev
• Kelebihan :
1.Melakukan koreksi terhadap massa atom dan letak unsur yang
salah dalam
penggolongan. Massa atom Cr bukan 43 melainkan 52.
2.Mendeleev juga mampu meramalkan unsur-unsur yang pada saat itu belum ditemukan, yakni dengan memberikan tempat yang kosong.
• Kelemahan :
1.Adanya unsur-unsur
dengan massa atom
relatif lebih besar
terletak di depan unsur
dengan massa atom
relatif yang lebih kecil.
2.Penempatan unsur-unsur
transisi, yang
persamaan sifat lebih
mendekati dengan
unsur-unsur yang
4. SISTEM PERIODIK LOTHAR MEYER
• Sistem periodik pertama yang dibuat berdasarkan kenaikan massa atom dan kemiripan sifat unsur.
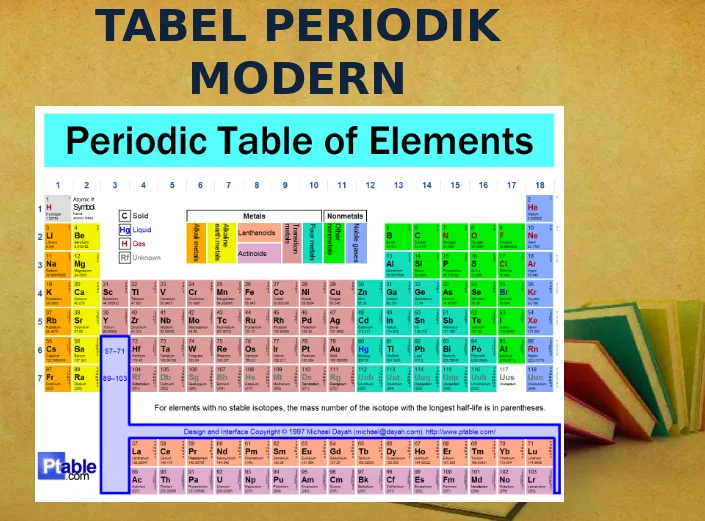
5. SISTEM PERIODIK BENTUK
MODERN (
Henry Moseley)
• Unsur-unsur disusun berdasarkan kenaikan nomor atom-nya
• Golongan A sesuai dengan elektron valensi
GOLONGAN
2.Sistem periodik dibagi dalam 18 golongan, yaitu golongan 1 sampai dengan 18, dimulai dari kiri.
•Kolom-kolom vertikal dalam sistem periodik.
•Ada 2 cara penamaan golongan, yaitu :
PERIODE
• Lajur-lajur
horisontal dalam sistem periodik
• Sistem periodik modern terdiri dari 7 periode.
Hubungan konfigurasi
elektron dengan SPU
1. Nomor periode sama dengan jumlah kulit. 2. Nomor golongan
sama dengan jumlah elektron valensi ( khusus golongan utama ).
Letak
unsur
dalam
sistem
periodik
dapat
ditentukan
berdasarkan
konfigurasi
elektronnya,
atau
sebaliknya,
konfigurasi elektron dapat
ditentukan
berdasarkan
letak unsur dalam sistem
periodik.
Sifat
1.Jari-Jari Atom
• Dalam 1 golongan
11 Na 2, 8, 1(IA/3)
19 K 2, 8, 8, 1(IA/4)
Jari-jari atom Na < K
• Dalam 1 Periode
11 Na 2, 8, 1 (IA/3)
12 Mg 2, 8, 2 (IIA/3) Jari-jari atom Na > Mg
Simpulan :
• Dalam satu golongan dari atas ke bawah semakin besar atau panjang.
2. Energi Ionisasi
• Dalam 1 golongan
11 Na 2, 8, 1(IA/3)
19 K 2, 8, 8, 1(IA/4)
Energi Ionisasi Na > K
• Dalam 1 Periode
11 Na 2, 8, 1 (IA/3)
12 Mg 2, 8, 2 (IIA/3) Energi Ionisasi Na < Mg
•
Energi ionisasi adalah
besarnya
energi
yang
diperlukan untuk melepas
satu elektron dari suatu
atom netral dalam wujud
gas sehingga terbentuk
ion berwujud gas dengan
muatan +1.
•
Unsur-unsur
yang
se-golongan : energi ionisasi
makin ke bawah makin
kecil karena gaya tarik
inti makin lemah
•
Unsur-unsur
yang
se-periode : energi ionisai
pada umumnya makin ke
kanan
makin
besar,
karena makin ke kanan
gaya tarik inti makin kuat.
3. Afinitas Elektron
• Dalam 1 golongan
9F 2, 7 (VIIA/2)
17Cl 2, 8, 7 (VIIA/3) Afinitas Elektron F > Cl
• Dalam 1 Periode
8O 2, 6 (VIA/2) 9F 2, 7 (VIIA/2)
Energi Ionisasi Na < Mg
•Afinitas elektron ialah energi
yang dibebaskan atau yang diserap apabila suatu atom menerima elektron.
•Dalam satu periode dari kiri ke
kanan, jari-jari semakin kecil dan gaya tarik inti terhadap elektron semakin besar, maka afinitas elektron semakin besar.
•Pada satu golongan dari atas ke bawah, jari-jari atom makin besar, sehingga gaya tarik inti terhadap elektron makin kecil, maka afinitas elektron semakin kecil.
4. Keelektronegatifan
•
Kelektronegatifan
adalah
kemampuan
suatu atom untuk
menarik elektron dari
atom lain
•
Faktor
yang
mempengaruhi
keelektronegatifan
adalah gaya tarik dari
inti terhadap elektron
dan jari-jari atom.
•
Unsur-unsur
yang
• Dalam 1 golongan
8X 2, 6 (VIA/2) 9Y 2, 7 (VIIA/2) Afinitas Elektron X < Y
• Dalam 1 Periode
9Y 2, 7
(VIIA/2)
17Z 2, 8, 7
(VIIA/2)
Energi Ionisasi Y > Z