Daftar Isi
2.2 Syarat Uji Klinik Fitofarmaka... 2
2.3 Persiapan Pelaksanaan... 3
3. ASAS UJI KLINIK... 6
3.1 Asas Menghormati Orang (Principle of Respect for Persons)... 6
3.2 Asas Kebaikan (Principle of Beneficence)... 6
3.3 Asas Keadilan (Principle of Justice)... 7
4. TAHAPAN FASE UJI KLINIK... 7
4.1 Uji Klinik Pra-Pemasaran... 7
5. PIHAK YANG TERLIBAT DALAM UJI KLINIK... 11
6.1.2 Desain menyilang (cross-over)... 14
6.2 Pengacakan Perlakuan (Ramdomisasi)... 14
6.3 Penyamaran/Pembesaran (Blinding)... 14
6.3.1 Single Blind... 15
6.3.2 Double Blind... 15
6.3.3 Triple Blind... 15
6.4 Analisis Data... 15
7. PEDOMAN UJI KLINIK... 16
7.1 Uji Klinik Fitofarmaka/Obat Herbal... 16
7.2 Uji Klinik Terdiri atas... 16
7.2.1 Uji Klinik Prapemasaran... 16
7.2.2 Uji Klinik Pascapemasaran... 16
7.3 Pengembangan Obat Herbal... 16
7.4 Diagram Pengelompokkan Herbal... 17
7.5 Dasar Pemilihan Metodologi atau Desain Uji Klinik... 17
7.6 Penentuan Dosis... 18
7.7 Tata Laksana Uji Klinik... 18
7.7.1 Klinik pra-pemasaran... 18
7.7.2 Uji Klinik pada Pemasaran... 18
7.7.3 Uji klinik terbatas untuk pendidikan... 19
Lampiran ... 20
1. DEFINISI UJI KLINIK
1.1 Uji Klinik
Uji klinik adalah kegiatan penelitian dengan mengikutsertakan subjek manusia disertai adanya intervensi produk uji, untuk menemukan atau memastikan efek klinik, farmakologik dan/atau farmakodinamik lainnya, dan/atau mengidentifikasi setiap reaksi yang tidak diinginkan, dan/atau mempelajari absorbsi, distribusi, metabolisme dan ekskresi dengan tujuan untuk memastikan keamanan dan/atau efektifitas produk yang diteliti. (BPOM, 2014)
1.2 Uji Klinik Fitofarmaka
Uji Klinik Fitofarmak adalah pengujian pada manusia, untuk mengetahui atau memastikan adanya efek farmakologik, tolerabilitas, keamanan dan manfaat klinik untuk pencegahan penyakit, pengobatan penyakit atau pengobatan gejala penyakit. (Menkes RI, 1992)
DASAR PEMIKIRAN
1. Obat tradisional baik dalam bentuk simplisia tunggal maupun ramuan sebagian besar penggunaan dan kegunaannya masih berdasarkan pengalaman.
2. Data yang meliputi kegunaan, dosis dan efek samping sebagian besar belum didasarkan pada landasan ilmiah, karena penggunan obat tradisional baru didasarkan kepada kepercayaan terhadap Informasi berdasarkan pengalaman. 3. Dalam rangka upaya pembangunan di bidang kesehatan, obat tradisional perlu
dikembangkan dan secara berangsur-angsur dimanfaatkan berdasarkan atas landasan ilmiah, sehingga dapat digunakan dalam upaya pelayanan kesehatan normal kepada masyarakat.
4.Dalam rangka pengembangan obat tradisional tersebut maka obat tradisional perlu dikelompokkan kedalam 2 golongan yaitu:
a)Obat tradisional jamu b) Fitofarmaka.
kesehatan, perlu dibuktikan manfaat kliniknya melalui uji klinik fitofarmaka pada manusia. (Menkes RI, 1992)
2. TUJUAN UJI KLINIK
Tujuan pokok uji klinik fitofarmaka adalah:
1. Memastikan keamanan dan manfaat klinik fitofarmaka pada manusia dalam pencegahan atau pengobatan penyakit maupun gejala penyakit.
2. Untuk mendapatkan fitofarmaka yang dapat dipertanggung jawabkan keamanan dan manfaatnya.(Menkes RI, 1992)
2.1 Persyaratan Uji Klinik
Syarat Uji Klinik, Uji Klinik Obat Herbal yang dilakukan harus:
a. Memberikan manfaat nyata bagi perkembangan ilmu pengetahuan dan kepentingan masyarakat;
b. Mendapatkan persetujuan etik dari Komisi Etik;
c. Mendapatkan persetujuan atau menyampaikan notifikasi kepada Kepala Badan sebagaimana dimaksud dalam Peraturan Kepala Badan Pengawas Obat dan Makanan Nomor 9 Tahun 2014 tentang Tata Laksana Persetujuan Uji Klinik; dan
d. Mengacu kepada Pedoman CUKB dan Pedoman Uji Klinik Obat Herbal. (BPOM, 2014)
2.2 Syarat Uji Klinik Fitofarmaka
Beberapa syarat yang harus dipenuhi dalam uji klinik Fitofarmaka
a. Terhadap calon fitofarmaka dapat dilakukan pengujian klinik pada manusia apabila sudah melalui penelitian toksisitas dan kegunaan pada hewan coba yang sesuai dan dinyatakan memenuhi syarat, yang membenarkan dilakukannya pengujian klinik pada manusia.
b. Alasan untuk melaksanakan uji klinis terhadap suatu fitofarmaka dapat didasarkan pada :
- Adanya pengalaman empirik dan / atau histori bahwa fitofarmaka tersebut mempunyai manfaat klinik dalam pencegahan dan pengobatan dan pengobatan penyakit atau gejala penyakit.
c. Uji Klinik Fitofarmaka merupakan suatu kegiatan pengujian multidisiplin.
d. Uji klinik Fitofarmaka harus memenuhi syarat-syarat ilmiah dan metodologi suatu uji klinik untuk pengembangan dan evaluasi khasiat klinik suatu obat baru. Protokol uji klinik suatu calon fitofarmaka harus selaras dengan Pedoman Fitofarmaka yang ditetapkan oleh Menteri Kesehatan Rl. Protokol uji klinik dengan rancangan dan metodologi yang sesuai dikembangkan dulu oleh tim peneliti. Protokol uji klinik harus dinilai dahulu oleh suatu Panitia llmiah yang independent untuk mendapatkan persetujuan.
e. Uji Klinik Fitofarmaka harus memenuhi prinsip-prinsip etika sejak perencanaan sampai pelaksanaan dan penyelesaian uji klinik. Setiap pengujian harus mendapatkan ijin kelaikan etik (ethical clearance) dari Panitia Etika Penelitian Biomedik pada manusia.
f. Uji Klinik Fitofarmaka hanya dapat dilakukan oleh tim peneliti yang mempunyai keahlian, pengalaman, kewenangan dan tanggung jawab dalam pengujian klinik dan evaluasi khasiat klinik obat.
g. Uji Klinik Fitofarmaka hanya dapat dilakukan oleh unit-unit pelayanan dan penelitian yang memungkinkan untuk pelaksanaan suatu uji klinik, baik dipandang dari segi kelengkapan sarana, keahlian personalia, maupun tersedianya pasien yang mencukupi. Pengulian klinik dalam unit-unit pelayanan kesehatan di luar Sentra Uji Fitofarmaka, misalnya di Puskesmas atau Rumah Sakit, harus mendapatkan supervisi dan monitoring dari Sentra Uji Fitofarmaka sejak perencanaan, pelaksanaan sampai dengan penyelesaiannya. (Menkes RI, 1992)
2.3 Persiapan Pelaksanaan
Langkah-langkah berikut dapat digunakan sebagai acuan dalam rangka persiapan pelaksanaan uji klinik:
1. Karakteristik produk uji:
- Tidak termasuk dalam daftar tumbuhan yang dilarang di Indonesia
- Riwayat penggunaan harus dapat ditelusur apakah herbal yang akan diuji klinik memiliki riwayat empiris baik untuk indigenus ataupun nonindigenus.
- Bagian tumbuhan yang digunakan
- Identifikasi senyawa aktif/senyawa identitas untuk keperluan standardisasi 2. Standardisasi bahan baku dan produk uji:
- Cara penyiapan bahan baku dan produk uji, termasuk metode ekstraksi yang digunakan,
- Metode analisa kualitatif dan kuantitatif senyawa aktif atau senyawa identitas. Proses standardisasi dilakukan agar produk uji di tiap fase uji serta bila
kemudian dipasarkan/diedarkan memiliki keterulangan yang sama.
3. Pihak sponsor ataupun produsen harus memahami bahwa proses pembuatan produk uji harus konsisten pada setiap tahap atau fase, dan proses pembuatan tersebut harus mengacu kepada standar CPOTB.
4. Lakukan penilaian terhadap data nonklinik yang ada/telah dilakukan, bagaimana profil keamanan dan/atau aspek lainnya. bagaimana LD50, data toksisitas akut, subkronik dan atau kronik sesuai kebutuhan untuk kondisi yang diujikan.
5. Pertimbangkan untuk mengontrak ORK bila diperlukan. Bila melakukan kontrak dengan ORK, lengkapi dengan surat perjanjian kontrak dan dijelaskan fungsi sponsor apa yang dikontrakkan kepada ORK.
6. Persiapkan kompetensi monitor (sponsor/ORK).
7. Pemilihan tempat pelaksanaan uji klinik dan pemilihan peneliti serta persiapkan tempat pelaksanaan tersebut. Sponsor memiliki peran penting dalam pemilihan tempat uji klinik. Pertimbangan utama yang harus dijadikan landasan pemilihan, antara lain :
- Terdapat peneliti dengan latar belakang keahlian yang sesuai.
- Ketersediaan sumber daya, sistem dan fasilitas/perangkat penunjang di tempat penelitian.
Elemen dalam protokol uji klinik yang disusun harus jelas dan lengkap, dimulai dari hal administratif seperti judul, nomor/versi dan tanggal, nama Peneliti Utama, Nama Koordinator Peneliti (bila ada), hingga yang bersifat ilmiah, seperti:
- Desain
a. Menjelaskan secara singkat desain studi dan secara umum bagaimana desain dapat menjawab pertanyaan/tujuan uji.
b. Dapat memberikan gambaran tipe/desain uji (misal placebo controlled, double blind, single blind atau open label)
- Tujuan
a. Harus tepat sasaran, jelas dan fokus, harus dapat diakomodir oleh parameter pengukuran khasiat maupun keamanan.
b. Tujuan dapat terdiri dari tujuan primer dan sekunder ataupun bahkan tersier. Namun perlu diperhatikan adalah bahwa tujuan uji klinik harus jelas, tepat sasaran dan fokus.
- Parameter/endpoint untuk efikasi/khasiat dan keamanan.
Parameter endpoint dimaksud harus dapat menjawab tujuan uji. 9. Penyediaan dokumen uji lain terkait dengan pelaksanaan uji klinik.
10. Persiapkan untuk adanya penjaminan mutu pelaksanaan uji klinik dan untuk dapat dihasilkannya data yang akurat dan terpercaya.
11. Pengajuan persetujuan untuk dokumen/ pelaksanaan uji klinik.
12. Pertimbangan/peninjauan dan persetujuan uji klinik oleh Komisi Etik dan regulator. 13. Persetujuan subjek (Informed Consent) dan rekrutmen subjek
Rekrutmen subjek merupakan salah satu tahapan penting sebelum dimulainya uji klinik. Hal prinsip yang harus diperhatikan dalam hal ini adalah bahwa (calon) subjek tidak boleh dilakukan tindakan apapun yang terkait dengan prosedur uji klinik sebelum subjek mendapat penjelasan dan menyatakan persetujuan yang ditandai dengan menandatangani informed consent. Pelanggaran terhadap proses informed consent merupakan pelanggaran yang bersifat critical.
14. Penapisan (screening) dan penyertaan (enrollment) subjek.
15. Pengelolaan pelaporan Kejadian Tidak Diinginkan maupun pelaporan lain. 16. Pengelolaan data penelitian
3. ASAS UJI KLINIK
Semua penelitian yang melibatkan subjek manusia harus dilakukan sesuai dengan prinsip-prinsip etika yang terkandung dalam versi saat ini dari Deklarasi Helsinki. Tiga prinsip dasar etika didefinisikan oleh revisi dari International Ethical Guidelines for Biomedical Research Involving Human Subjects yang dikeluarkan oleh Council for International Organizations of Medical Sciences (CIOMS). (WHO, 1995)
3.1 Asas Menghormati Orang (Principle of Respect for Persons)
Asas menghormati orang menggabungkan setidaknya dua pertimbangan etis yang mendasar, yaitu:
a. Menghormati otonomi; calon subjek harus mampu diajak bermusyawarah untuk menentukan keputusan mengenai pilihan pribadi mereka dengan menghormati kapasitas mereka untuk menentukan nasib sendiri; dan
b. Perlindungan terhadap penyandang cacat atau otonomi yang dikecilkan, yang mensyaratkan bahwa mereka yang tergantung atau rentan akan diberikan keamanan terhadap bahaya atau kekerasan.
c. Pelaksanaan prinsip umum ini adalah persyaratan untuk persetujuan dari masing-masing calon subjek.(CIOMS, 2002)
3.2 Asas Kebaikan (Principle of Beneficence)
Asas kebaikan mengacu pada kewajiban etik untuk memaksimalkan manfaat dan meminimalkan bahaya. Prinsip ini menimbulkan norma-norma yang membutuhkan bahwa risiko penelitian harus masuk akal dalam menerangkan manfaat yang diharapkan, bahwa desain penelitian harus diberitahukan, dan bahwa para peneliti akan kompeten baik untuk mengarahkan penelitian dan untuk menjaga kesejahteraan dari subjek penelitian. Asas kebaikan pun melarang peneliti untuk membahayakan subjek secara sengaja. Aspek kebaikan biasanya dinyatakan sebagai prinsip tidak membahayakan (nonmaleficence). (CIOMS, 2002)
Asas keadilan mengacu pada kewajiban etik untuk memperlakukan setiap orang sesuai dengan apa yang secara moral benar dan tepat, untuk memberikan yang wajar bagi subjek. Dalam etika penelitian yang melibatkan subjek manusia, asas merujuk untuk keadilan distributif yang memerlukan pemerataan baik beban dan manfaat dari partisipasi dalam penelitian. Perbedaan dalam distribusi beban dan manfaat yang dibenarkan hanya jika mereka didasarkan pada perbedaan yang relevan secara moral antara orang-orang; satu perbedaan tersebut adalah kerentanan. '' Kerentanan '' mengacu pada ketidakmampuan substansial untuk melindungi kepentingan sendiri karena hambatan. (CIOMS, 2002)
4. TAHAPAN FASE UJI KLINIK
Uji Klinik Yaitu suatu pengujian khasiat obat baru pada manusia, dimana sebelumnya diawali oleh pengujian pada binatang atau pra klinik. (Katzung, 1989) Pada dasarnya uji klinik memastikan efektivitas, keamanan dan gambaran efek samping yang sering timbul pada manusia akibat pemberian suatu obat. Uji klinik ini terdiri dari uji fase I sampai fase IV. (Gunawan, 2005)
4.1 Uji Klinik Pra- Pemasaran
Uji Klinik Tahap Awal adalah suatu uji klinik tanpa pembanding (uncontrolled trial). Tahap ini bertujuan untuk melihat adanya kemungkinan manfaat klinik, menentukan dosis yang dapat menimbulkan efek tersebut serta untuk Uji Klinik Tahap Lanjut merupakan uji klinik yang definitif dengan jumlah penderita yang lebih banyak dan dilakukan dengan persyaratan-persyaratan metodologi dan monitoring yang ketat (exploratory trial). Uji klinik dilakukan dengan kelompok pembanding dapat berupa placebo atau obat standar( baku) yang sudah diketahui secara pasti. Uji klinik dapat dilakukan disalah satu pusat penelitian (mono centre) atau di beberapa pusat penelitian (multi centre). (Menkes, 1996)
4.1.1 Fase I
awal farmakokinetik, dan jika memungkinkan profil farmakodinamik dari bahan aktif pada manusia. (WHO, 1995)
Tujuan fase ini adalah menentukan besarnya dosis maksimal yang dapat toleransi (maximally tolerated dose = MTD), yakni dosis sebelum timbul efek toksik yang tidak dapat diterima. Hasil penelitian farmakokinetik ini digunakan untuk meningkatkan ketepatan pemilihan dosis pada penelitian selanjutnya. Uji klinik fase I dilaksanakan secara terbuka, artinya tanpa pembanding dan tidak tersamar, dengan jumlah subyek bervariasi antara 20-50orang. (Gunawan, 2005)
4.1.2 Fase II
Percobaan ini sering dilakukan pada subjek yang terbatas, pada antar tahap, dan perbandingan antar desain (misalnya plasebo terkontrol). Tujuan fase ini adalah untuk menunjukkan aktivitas terapeutik dan untuk menilai keamanan jangka pendek dari bahan aktif pada pasien yang menderita penyakit atau kondisi dimana bahan aktif diharapkan. Fase ini juga bertujuan untuk menentukan rentang dosis yang tepat atau rejimen dan jika memungkinkan juga menjelaskan hubungan respon dosis untuk memberikan dasar yang optimal untuk desain uji coba terapi jangka panjang.
(WHO, 1995).
Fase II ini dilaksanakan oleh dokter ahli farmakologi klinik dan dokter ahli klinik dalam bidang yang bersangkutan. Seleksi pasien harus ketat, tidak ada penyakit penyerta dan tidak mendapat terapi lain, dan setiap pasien harus dimonitor dengan intensif. Pada fase II awal, pengujian efek terapi obat dikerjakan secara terbuka karena masih merupakan penelitian eksploratif, karena itu belum dapat diambil kesimpulan yang mantap mengenai efikasi obat yang bersangkutan. Untuk menjamin validitas uji klinik komparatif ini, alokasi pasien harus acak dan pemberian obat dilakukan secara tersamar ganda. Ini disebut uji klinik berpembanding, acak, tersamar ganda.
Pada fase II ini tercakup juga studi kisaran dosis (dose-ranging study) untuk menentapkan dosis optimal yang akan digunakan selanjutnya, dan penelitian lebih lanjut mengenai eliminasi obat, terutama metabolismenya. Jumlah subjek yang mendapat obat baru pada fase ini antara 100-200 penderita. (Gunawan, 2005).
Pada fase ini, uji coba dilakukan pada kelompok pasien yang lebih besar (dan mungkin bervariasi) dengan tujuan menentukan keseimbangan keamanan / khasiat jangka pendek dan panjang dari formulasi bahan aktif, dan menentukan indeks terapi secara relatif dan keseluruhan. Pola dan profil dari setiap reaksi yang merugikan harus sering diselidiki dan fitur khusus dari produk harus diolah lebih lanjut (misalnya interaksi obat yang berhubungan dengan klinis, faktor yang menyebabkan perbedaan efek seperti usia). Percobaan ini sebaiknya menjadi metode acak double-blind, tetapi metode lainnya dapat diterima, misalnya studi keamanan jangka panjang. Umumnya, kondisi di mana percobaan ini dilakukan harus sedekat mungkin dengan kondisi normal penggunaan. (WHO,1995).
Uji klinik fase III dilakukan pada sejumlah besar pasien yang tidak terseleksi ketat (ada penyakit penyerta dan/atau mendapat terapi lain) dan dikerjakan oleh peneliti klinik yang tidak terlalu ahli, sehingga menyerupai keadaan sebenarnya dalam penggunaan sehari-hari di masyarakat. Pada uji klinik fase III ini biasanya pembandingan dilakukan dengan plasebo, obat yang sama tapi dosis berbeda, obat standar dengan dosis ekuiefektif, atau obat lain yang indikasinya sama dengan dosis yang ekuiefektif.
Jika hasil uji klinik fase III menunjukan bahwa obat baru ini cukup aman dan efektif, maka obat dapat diberikan ijin pemasaran. Jumlah pasien yang diikutsertakan pada fase III ini paling sedikit 500 orang. (Gunawan, 2005).
4.2 Uji Klinik Pasca-Pemasaran
Uji klinik tahap pemantauan merupakan survailan efek samping yang langka (rare, side effects) yang baru muncul setelah pemberian jangka panjang yang tidak mungkin terkendali pada fase-fase uji klinik sebelum pemasaran. Sistem survailan ini seyogyanya merupakan bagian dari sistem Monitoring Efek Samping Obat (MESO) Nasional. Disamping itu, Uji Klinik Tahap Phemantauan dilakukan untuk melihat manfaat obat pada keadaan yang sesungguhnya dalam klinik, pada populasi penderita yang khusus misalnya anak-anak, orang lanjut usia dan lain-lain.(Menkes, 1992).
Pada fase ini, penelitian dilakukan setelah pemasaran produk farmasi. Uji coba di fase IV dilakukan atas dasar karakteristik produk yang telah diizinkan untuk beredar dan biasanya dalam bentuk pengawasan pasca-pemasaran, atau penilaian dari indeks terapi atau strategi pengobatan. Meskipun memungkinkan metode yang berbeda, penelitian ini harus menggunakan standar ilmiah dan etika yang sama seperti yang diterapkan dalam penelitian sebelum pemasaran. Setelah produk telah ditempatkan di pasar, uji klinis dirancang untuk meneliti indikasi baru, metode administrasi baru atau kombinasi baru, dll. Biasanya dianggap sebagai uji coba untuk produk farmasi baru. (WHO,1995).
Fase ini sering disebut post-marketing drug surveillance karena merupakan pengamatan terhadap obat yang telah dipasarkan. Pada fase ini kepatuhan penderita makan obat merupakan masalah. Penelitian fase IV merupakan survei epidemiologik menyangkut efek samping maupun efektivitas obat. Pada fase IV ini dapat diamati Efek samping yang frekuensinya rendah atau yang timbul setelah pemakaian obat bertahun-tahun lamanya.
Efektifitas obat pada penderita berpenyakit berat atau berpenyakit ganda, penderita anak atau usia lanjut, atau setelah penggunaan berulangkali dalam jangka panjang dan masalah penggunaan berlebihan, penyalahgunaan (abuse), dan lain-lain.
Dewasa ini waktu yang diperluka untuk pengembangan suatu obat baru, mulai dari sintetis bahan kimianya sampai dipasarkan, mencapai waktu 10 tahun atau lebih. (Gunawan, 2005)
4.3 Pembanding
Pembanding adalah produk farmasetika atau lainnya (yang mungkin plasebo) digunakan sebagai refrensi dalam percobaan klinis. (WHO,1995).
Pemilihan pembanding yang digunakan harus memiliki justifikasi ilmiah. Kelompok pembanding diperlukan untuk mengontrol variabel-variabel perancu, sehingga hasil akhir uji merupakan efek obat herbal yang diuji. Sebagai pembanding digunakan produk yang merupakan pilihan untuk kondisi dalam uji klinik dimaksud serta sudah terdaftar.
tidak etis bila salah satu kelompok pada penelitian obat hipertensi mendapatkan plasebo karena akan membahayakan keselamatan subjek. (BPOM, 2014).
5. PIHAK YANG TERLIBAT DALAM UJI KLINIK 5.1 Peniliti
Peneliti adalah seseorang yang bertanggung jawab atas pelaksanaan Uji Klinik di suatu tempat Uji Klinik. (BPOM, 2001).
Peneliti yang terlibat dalam uji klinik harus memahami secara benar prinsip CUKB yang merupakan standar yang telah diterima secara Internasional dalam melakukan uji klinik serta mempersiapkannya dengan baik. Hal tersebut sangat diperlukan mengingat peran peneliti sangat menentukan diperolehnya data klinik yang shahih, akurat dan terpercaya selain perlindungan kepada manusia yang menjadi subjek uji klinik. Untuk dapat menjalankan peran secara optimal, peneliti yang terlibat dalam uji klinik untuk memperhatikan hal-hal seperti:
a. Memiliki latar belakang yang sesuai dan memahami GCP/CUKB serta memiliki sertifikat GCP/CUKB.
b. Memiliki sumber daya yang kompeten dan memahami prinsip GCP serta regulasi yang berlaku. (BPOM,2014)
5.2 Subyek
Subyek uji Klinik adalah seorang individu yang ikut serta dalam suara Uji Klinik yang memiliki hak dan kewajiban saat keikutsertaannya dalam Uji Klinik.
(BPOM, 2014). Dalam uji klinik harus ditentukan secara jelas kriteria pemilihan pasien, yaitu: Kriteria inklusi dan kriteria eklusi.
a. Kriteria inklusi: syarat - syarat yang secara mutlak harus dipenuhi oleh subjek untuk dapat diikutsertakan dalam penelitian. Meliputi antara lain kriteria diagnostik, baik klinis maupun laboratoris, derajat penyakit, asal pasien umur dan jenis kelamin. b. Kriteria eklusi: kriteria yang tidak memungkinkan diikutsertakannya subjek dalam
Dalam pemilihan pasien hendaknya ditetapkan bahwa kriteria diagnostik yang dipilih benar - benar merupakan indikasi utama pemakaian obat yang diujikan.
(Rahmatini, 2010) 5.2.1 Syarat Subjek
Seorang individu yang berpartisipasi dalam uji klinis harus memenuhi syarat sebagai berikut:
a. Individu yang sehat yang sukarela berpartisipasi dalam uji klinik.
b. Individu dengan kondisi yang tidak terkait dengan penggunaan produk dalam uji klinik.
c. Individu (biasanya pasien) yang kondisinya relavan dengan penggunaan produk uji klinik. (WHO, 1995)
5.3 Tempat Penelitian (site)
Tempat penelitian harus memiliki fasilitas yang cukup, seperti ketersediaan ruang–ruang sesuai fungsi masing–masing, peralatan medis serta obat untuk keadaan darurat, peralatan elektronik yang menunjang pelaksanaan uji klinik. Sponsor memiliki peran penting dalam pemilihan tempat uji klinik. (BPOM, 2014)
5.4 Sponsor dan ORK
Sponsor adalah perorangan, perusahaan, Institusi atau organisasi yang mengambil tanggung jawab untuk memprakarsai,, mengelola, dan/atau membiayai suatu Uji Klinik. Organisasi Riset Kontrak, yang selanjutnya disebut ORK, adalah seseorang atau suatu organisasi (komersial atau lainnya) yang dikontrak oleh sponsor untuk melaksanakan satu atau lebih tugas dan fungsi sponsor dalam uji klinik. Sponsor dan ORK harus memiliki pemahaman yang seimbang mengenai CUKB. Untuk dapat menjalankan peran secara optimal, sponsor dan ORK terlibat dalam uji klinik harus memperhatikan hal-hal seperti:
a. Memiliki sumber daya yang kompeten dan memahami prinsip GCP serta regulasi yang berlaku.
5.5. Komisi etik
Komisi Etik adalah suatu badan independen (suatu dewan penilai atau suatu komisi, institusional, regional, nasional, atau supranasional), yang terdiri dari profesional medik/ ilmiah dan anggota non-medik/non –ilmiah, dan kesejahteraan Subyek Uji Klinik yang terlibat dalam suatu Uji Klinik dan untuk memastikan terlaksananya perlindungan itu, antara lain dengan mengkaji dan menyetujui/memberikan pendapat yang mendukung terhadap Protokol Uji Klinik, kelayakan para peneliti, fasilitas, cara dan bahan yang digunakan untuk memperoleh dan mendokumentasi persetujuan setelah penjelasan dari Subyek Uji Klinik tersebut.
Komisi Etik dan Regulator memiliki sumber daya yang kompeten dalam rangka mengawal bahwa protokol uji serta dokumen uji lainnya dapat dipertanggungjawabkan secara etis dan ilmiah untuk dilaksanakan serta melakukan pengawasan terhadap pelaksanaan uji tersebut. (BPOM, 2014)
6. RANCANGAN UJI 6.1 Desain Uji
Pada uji klinik dilakukan uji untuk mengetahui hubungan sebab akibat antara variabel bebas (prediktor) dengan variebel tergantung (efek) dalam periode waktu tertentu. Hasil uji klinik ditentukan berdasarkan atas perbedaan efek yang terjadi pada kelompok perlakan dengan pada kelompok kontrol. Efek yang dinilai dapat merupakan kejadian klinik, ataupun hasil laboratorium, dan dapat berskala nominal, ordinal, ataupun numerik.
Di antara banyak jenis desain uji klinik, yang banyak digunakan adalah desain paralel dan desain menyilang. (Rachmadi, 2008).
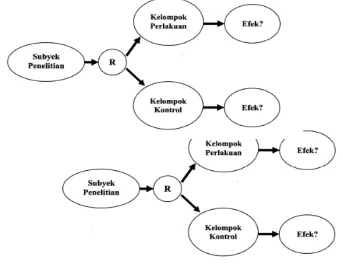
6.1.1 Desain paralel
Gambar 1: Desain uji paralel (Rachmadi, 2008)
6.1.2 Desain menyilang (cross-over)
Subjek yang terpilih dilakukan randomisasi (R). Kelompok A diberikan obat yang diteliti, dan kelompok B menjadi kontrol. Setelah waktu yang ditentukan, perlakuan dihentikan selama beberapa waktu (periode wash out), kemudian dilakukan silang. Subjek pada kelompok A menjadi kelompok perlakuan (A'), sedangkan kelompok B menjadi kelompok kontrol (B'). Efek pengobatan dibandingkan.
Gambar 2: Desain uji menyilang (Rachmadi, 2008)
6.2 Pengacakan Perlakuan (Ramdomisasi)
kesempatan yang sama dalam mendapatkan perlakuan dan subjek - subjek yang memenuhi kriteria inklusi akan terbagi sama rata dalam tiap kelompok perlakuan, dimana ciri-ciri subjek dalam satu kelompok praktis seimbang. (Rahmatini, 2010).
6.3 Penyamaran/Pembesaran (Blinding)
Penyamaran adalah merahasiakan bentuk terapi yang diberikan. Dengan penyamaran, maka pasien dan/atau pemeriksa tidak mengetahui yang mana obat yang diuji dan yang mana pembandingnya. Biasanya bentuk obat yang diuji dan pembandingnya dibuat sama. Tujuan utama penyamaran ini adalah juga untuk menghindari bias pada penilaian respons terhadap obat yang diujikan. Penyamaran dapat dilakukan secara : single blind, double blind, dan triple blind.
6.3.1 Single Blind
Jika identitas obat tidak diberitahukan pada pasien.
6.3.2 Double Blind
Jika baik pasien maupun dokter pemeriksa tidak diberitahu obat yang diuji maupun pembandingnya.
6.3.3 Triple Blind
Jika pasien, dokter pemeriksa maupun individu yang melakukan analisis tidak diberitahu identitas obat yang diuji dan pembandingnya.
Kesehatan dan keselamatan pasien tetap dipantau sepenuhnya oleh penanggung jawab medik, sehingga sewaktu - waktu terjadi hal - hal yang tidak diharapkan (adverse effect) dapat segara dilakukan penanganan secara medik. (Rahmatini, 2010)
6.4 Analisis data
Kemungkinan dan keadaan dari analisis sementara juga harus dicantumkan dalam protokol.
Peneliti dan monitor harus memastikan bahwa data adalah berkualitas pada saat pengumpulan data dan ahli statistik harus memastikan integritas data selama pemprosesan. (WHO, 1995)
7. PEDOMAN UJI KLINIK
7.1 Uji Klinik Fitofarmaka/Obat Herbal
Uji Klinik Fitofarmaka harus memenuhi prinsip- prinsip etika sejak perencanaan sampai pelaksanaan dan penyelesaian uji klinik. Setiap pengujian harus mendapatkan ijin kelaikan etik (ethical clearance) dari Panitia Etika Penelitian Biomedik pada manusia. (Menkes RI, 1992)
Uji Klinik Obat Herbal yang dilakukan harus:
a. Memberikan manfaat nyata bagi perkembangan ilmu pengetahuan dan kepentingan masyarakat;
b. mendapatkan persetujuan etik dari Komisi Etik;
c. mendapatkan persetujuan atau menyampaikan notifikasi kepada Kepala Badan sebagaimana dimaksud dalam Peraturan Kepala Badan Pengawas Obat dan Makanan Nomor 9 Tahun 2014 tentang Tata Laksana Persetujuan Uji Klinik; dan mengacu kepada Pedoman CUKB dan Pedoman Uji Klinik Obat Herbal. (BPOM RI, 2014)
7.2 Uji Klinik Terdiri atas 7.2.1 Uji Klinik Prapemasaran
Uji Klinik Prapemasaran adalah Uji Klinik yang menggunakan Produk Uji yang belum memiliki izin edar di Indonesia, termasuk Uji Klinik dengan Produk Uji yang telah memiliki izin edar untuk mengetahui indikasi/posologi baru.
7.2.2 Uji Klinik Pascapemasaran.
mendapatkan data keamanan dan/atau untuk konfirmasi khasiat/manfaat yang telah disetujui. (BPOM RI, 2014)
7.3 Pengembangan obat herbal
Pengembangan obat herbal meningkat akhir-akhir ini, baik yang ditujukan sebagai upaya promotif, paliatif, preventif, kuratif, maupun rehabilitatif. Untuk dapat memanfaatkan kondisi tersebut bila diinginkan oleh pihak industri maka obat herbal tradisional berupa jamu atau OHT dapat dikembangkan menjadi fitofarmaka.
(BPOM RI, 2014)
7.4 Diagram pengelompokkan herbal
Diagram di atas menggambarkan pengelompokkan herbal berdasarkan riwayat tradisional dan bukti dukungnya serta alur bila memerlukan pelaksanaan uji klinik. (BPOM RI, 2014)
7.5 Dasar Pemilihan Metodologi atau Desain Uji Klinik
diajukan. Oleh karenanya pemilihan desain harus dipertimbangkan dengan cermat, mempertimbangkan antara lain:
- karakteristik produk uji
- tujuan uji klinik dimaksud harus selaras dengan klaim yang akan diajukan saat registrasi produk. (BPOM RI, 2014)
7.6 Penentuan Dosis
Studi penentuan dosis (dose ranging study) dalam tahapan uji klinik merupakan hal penting yang harus dilakukan. Studi penentuan dosis tersebut, dimaksudkan untuk dapat menentukan dosis efektif yang kemudian konsisten diberikan pada fase-fase selanjutnya dalam uji klinik maupun setelah kemudian dapat diedarkan. Bila telah ada konversi yang pasti dari dosis efektif pada hewan coba kepada manusia, studi penentuan dosis dapat tidak dilakukan.
Studi penentuan dosis dilakukan sebelum fase III uji klinik dengan memperhatikan hasil uji LD50, serta uji toksisitas dan farmakodinamik pada hewan coba. (BPOM RI, 2014)
7.7 Tata Laksana Uji Klinik 7.7.1 Klinik pra-Pemasaran
a. Pengajuan pelaksanaan Uji klinik Pra-Pemasaran dilakukan oleh sponsor yang bertindak sebagai Sponsor kepada Kepala Badan.
b. Pengajuan sebagaimana dimaksud pada ayat (1) menggunakan contoh Formulir UK-1 sebagaimana tercantum dalam Lampiran UK-1 Keputusan ini.
c. Khusus untuk pengajuan Uji Klinik Pra-Pemasaran vaksin dan produk biologi, di samping formulir tersebut pada ayat (2), harus dilengkapi dengan Ringkasan Protokol Batch Produksi yang akan digunakan sesuai ketentuan Badan Kesehatan Dunia.
d. Alur Tata Persiapan Uji Klinik Pra-Pemasaran adalah sebagaimana tercantum dalam lampiran II a dan Lampiran II b Keputusan II.
a. Pemberitahuan pelaksanaan Uji Klinik Pasca-Pemasaran dilakukan oleh Sponsor atau yang bertindak sebagai Sponsor kepada Kepala Badan.
b. Pemberitahuan sebagaimana dimaksud pada ayat (1) menggunakan contoh Formulir UK-1 sebagaimana tercantum dalam Lampiran 1 Keputusan ini.
c. Khusus untuk pengajuan Uji Klinik pada Pemasaran vaksin dan produk biologi, di samping formulir tersebut pada ayat (2), harus dilengkapi dengan Ringkasan Protokol Batch Produksi dari 3 (tiga) batch berurutan yang akan digunakan sesuai Ketentuan Badan Kesehatan Dunia.
d. Alur Tata Cara Persiapan Uji Klinik Pasca-Pemasaran adalah sebagaimana tercantum dalam Lampiran III a dan Lampiran III b Keputusan ini.
7.7.3 Uji klinik Terbatas untuk Pendidikan
a. Pemberitahuan pelaksanaan Uji klinik Terbatas untuk Pendidikan dilakukan oleh Peneliti / Institusi kepada Kepala Badan.
b. Dokumen yang diperlukan untuk pelaksanaan Uji Klinik sebagaimana dimaksud pada ayat (1) ditetapkan oleh Institusi.
Lampiran
BPOM RI. 2014. Pedoman Uji Klinik Obat Herbal. Peraturan Kepala Badan Pengawas Obat dan Makanan Republik Indonesia Nomor 13 Tahun 2014. Badan Pengawas Obat dan Makanan Republik Indonesia. Jakarta.
CIOMS. 2002. International Ethical Guidelines for Biomedical Research Involving Human Subjects. Council for International Organizations of Medical Sciences. Geneva.
Gunawan, S. G. , Setiabudy R., Nafrialdi, Elysabeth (Editor). 2005. Farmakologi dan Terapi Edisi 5. Departemen Farmakologi dan Terapeutik FK UI: Jakarta.
Katzung.1989.Farmakologi Dasar dan Klinik Edisi 3.EGC: Jakarta.
Peraturan Menteri Kesehatan Republik lndonesia No. 761/Menkes/SK/IX/1992. Pedoman Fitofarmaka. Menteri Kesehatan Republik Indonesia. Jakarta.
WHO. 1995. Guidelines for Good Clinical Practice (GCP) for Trials on Pharmaceutical Products. World Health Organization. Manila.
BPOM. 2014. Tata Laksana Persetujuan Uji Klinik. Peraturan Kepala BPOM Nomor 9 Tahan 2014. Badan Pengawas Obat dan Makanan Republik Indonesia.
BPOM. 2001. Tata Laksana Uji Klinik. Peraturan Kepala BPOM Nomor 02002/SK/KBPOM Tahun 2001. Badan Pengawas Obat dan Makanan Republik Indonesia.
Rahmatini. 2010. Evaluasi Khasiat dan Tanaman Obat (Uji Klinik). Sumatera. Bagian Farmakologi Fakultas Kedokteran Universitas Andalas.
WHO. 1995. Guidelines for good clinical practice (GCP) for trials on pharmaceutical products. WHO Technical Report Series, No. 850, 1995, Annex 3. World Health Organization.