LAPORAN LENGKAP PRAKTIKUM
KIMIA DASAR
KELOMPOK 4
PROGRAM STUDI AGROTEKNOLOGI
JURUSAN BUDIDAYA PERTANIAN
FAKULTAS PERTANIAN
UNIVERSITAS TADULAKO
LAPORAN LENGKAP PRAKTIKUM
MATA KULIAH KIMIA
Disusun sebagai Salah Satu Syarat untuk Menyelesaikan
Matakuliah Kimia Dasar pada
Fakultas Pertanian Universitas Tadulako
Oleh
KELOMPOK 4 BABUL RAHMAN
E 281 16 278
PROGRAM STUDI AGROTEKNOLOGI
JURUSAN BUDIDAYA PERTANIAN
FAKULTAS PERTANIAN
UNIVERSITAS TADULAKO
HALAMAN PENGESAHAN
Judul : Laporan Lengkap Praktikum Kimia Dasar
Kelompok : 4 (empat)
Golongan : K
Palu, November 2016
Menyetujui,
Kordinator Asisten Asisten Penanggung jawab
Elsafiana , SP. Nurahmadi
E 281 14 047
Disahkan Oleh,
Dosen Penanggung Jawab Praktikum
Mata Kuliah Kimia Dasar
Dr.Ir Gatot Siswo Hutomo.Mp
RINGKASAN
Kimia merupakan bagian dari ilmu pengetahuan alam yang mempelajari komposisi, struktur, sifat dan berbagai zat. Kimia mencakup materi tentang berbagai substansi yang berpengaruh dalam kehidupan alam sekitar, mulai dari air yang sederhana hingga molekul-molekul kompleks yang berpengaruh terhadap genetic makhluk hidup. Hasil pembelajaran ini adalah pengembangan teori yang bertujuan untuk menjelaskan sifat-sifat zat baik secara umum maupun secara lebih spesifik.
Contohnya teori atom dan teori kinetik. Bagian kedua dari kimia yang tidak bisa dipisahkan adalah pembelajaran tentang sintesis atau pembentukan substansi/zat baru dan identifikasi sifat-sifatnya. Contoh yang termasuk di
dalamya adalah pembuatan obat obatan, seperti aspirin, dan bahan-bahan bermanfaat lainnya seperti nilon dan keramik.
superkonduktor. Sedangkan bagian ketiga dari kimia terletak pada kegiatan analisis kimiawinya. Misalnya penentuan komposisi suatu sampel mineral, analisis kualtas air minum, dan identifikasi peningkatan penggunaan obat-obatan secara ilegal.
Dari pengamatan yang telah kami lakukan tentang percobaan stoikiometri, kami menggunakan bahan Tanah, Kacang Ijo, Kacang Kedelai, dari perhitungan kadar air kacang ijo, kami mendapatkan hasil yaitu 0,88%, kadar air tanah yaitu 1,272%, kadar air kedelai yaitu 0,8. Jadi, kesimpulannya adalah dari hasil
praktikum yang telah kami lakukan, kadar air tertinggi terdapat pada bahan tanah. Sedangkan kadar air terendah terdapat pada bahan kacang ijo.
Dari pengamatan yang telah kami lakukan tentang percobaan Larutan 1, kami menggunakan bahan NaOH teknis, HCl teknis, Aquades, Indikator pp, Larutan NaOH, Larutan NaOH 1 N, Larutan HCl 1 N, dari perhitungan larutan dari zat padat, konsentrasi NaOH yang dibuat adalah 1,04 N, konsentrasi NaOH hasil titrasi adalah 1,028 N. dari perhitungan larutan dari zat cair, konsentrasi HCl yang di buat adalah 1 N, konsentrasi HCl hasil titrasi adalah 0,912 N. dari hasil pengamatan hasil konsentrasi larutan yang dibuat dan konsentrasi hasil titrasi memberikan keterangan terdapat perbedaan antara konsentrasi yang di buat dengan konsentrasi hasil titrasi, yang besarnya sama dengan 0,028 perbedaan tersebut disebabkan oleh hasil perhitungan molaritas dalam hal ini terjadi perbadaan yang jelas dengan data yang ada dengan perhitungan konsentrasi, larutan NaOH yng diencerkan lebih tinggi dari lautan yang belum mengalami pengenceran dimana larutan telah tercampur dengan HCl dan aquades. Dari hasil pengamatan konsentrasi HCl yang di buat dan hasil titrasi tersebut memberikan keterangan terdapat perbedaan antara konsentrasi yang di buat dan hasil
konsentrasi titrasi yang esarya sama dengan 0,088. Perbedaan tersebut di seabkan oleh jumlah larutan yang di gunakan atau di teteskan pada konsentrasi yang dibuat dengan konsentrasi hasil titrasi dan perbedaan hasil juga di sebabkan karena konsentrasi yang di buat belum di titrasi dengan larutan NaOH kedalamlarutan konsentrasi HCl yang di buat sehingga terjadi perubahan zat asam menjadi zat cair.
Dari pengamatan yang telah kami lakukan pada percobaan asam basa, dengan menggunakan bahan tanah, air murni, larutan kalium klorida 1 M, buah tomat, buah jeruk nipis, buah nanas, tepung tapioka, dan kertas pH universal, kami mendapatkan hasil dari pH tanah yaitu pH riil pH meter 7,67 dan kertas pH universal 8. pH potensial pH meter 7,16 dan kertas pH universal 7. Pada pH buah-buahan, pH buah nanas yaitu pH meter 3,94, kertas pH universal 4. pH buah jeruk yaitu pH meter 3,45 dan keras pH universal yaitu 2. Pada buah tomat, pH meter yaitu 4,36 dan kertas pH universal yaitu 4. Pada pH larutan NaOH 0,01 N pH meter 10,83, kertas pH universal 9. Pada pH larutan HCl 0,01 N pH meter 3,36, kertas pH universal 2.jadi kesimpulan perhitungan pOH dari NaOH adalah 2 sedangkan pH nya adalah 12. Kalau pada pH HCl yaitu 2.
Dari pengamatan aldehid dan keton kami menggunakan bahan yaitu pereaksi tollens, formaldehid, aseton, fehling A, fehling B, benzaldehid, larutan KMNO 0,05%. Dari hasil percobaan uji dengan pereaksi tollens, pada tabung A setelah di tambahkan pereaksi tollens terbentuk cermin perak pada permukaan tabung . Tabung B setelah di tambah dengan pereaksi tollens tidak terbentuk cermin perak pada permukaan tabung. Uji dengan pereaksi fehling, pada tabung A setelah di tambah dengan pereaksi fehling terdapat endapan yang berwarna merah bata. Sedangkan tabung B setelah di tambah dengan pereaksi fehling tidak
terdapat endapan yang berwarna merah bata. Dari percobaan ini kami mendapat kesimpulan bahwa formaldehid mengalami reaksi oksidasi sebab pada
penambahan reaksi tollens terjadi cermin perak. Sedangkan aseton tidak
pereaksi fehling terjadi endapan merah bata sedangkan aseton tidak mengalami reaksi oksidasi sebab pada penambahan pereaksi fehling tidak terjadi endapan merah bata.
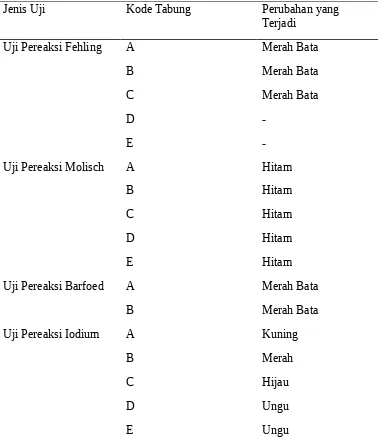
Dari pengamatan percobaan karbohidrat, kami menggunakan bahan asam sulfat pekat, larutan alfa naftol 10% dalam alcohol 95%, reagen fehling A, reagen fehling B, reagen barfoed, larutan iodiun 0,1 N, larutan glukosa 10%, larutan maltose 10%, larutan sukrosa 10%, larutan pati 1%, tepung ubi jalar. Dari hasil pengamatan uji dengan pereaksi fehling, tabung A setelah di tambahkan dengan pereaksi fehling terbentuk endapan yang berwarna merah bata. Tabung B setela di tambahkan dengan pereaksi fehling terbentuk endapan yang berwarna merah bata. Tabung C setelah ditambahkan dengan pereaksi fehling berbentuk endapan yang berwarna merah bata. Tabung D setelah di tambahkan dengan pereaksi fehling tidak terbentuk endapan yang berwarna merah bata. Tabung E setelah di tambah dengan pereaksi fehling tidak terbentuk endapan yang berwarna merah bata.uji dengan pereaksi molisch, tabung A setelah di tambah dengan pereaksi alfa naftol dan asam sulfat pekat terbentuk warna hitam. Tabung B setelah di tambah dengan pereaksi alfa naftol dan asam sulfat pekat terbentuk warna hitam, Tabung
BCsetelah di tambah dengan pereaksi alfa naftol dan asam sulfat pekat terbentuk warna hitam, Tabung D setelah di tambah dengan pereaksi alfa naftol dan asam sulfat pekat terbentuk warna hitam, Tabung E setelah di tambah dengan pereaksi alfa naftol dan asam sulfat pekat terbentuk warna hitam. Uji dengan pereaksi barfoed, tabung A setelah di tambah pereaksi barfoed terjadi endapan yang berwarna merah bata setelah reaksi berlangsung selama 10,35 menit. Tabung B setelah di tambah dengan pereaksi barfoed terjadi endapan yang berwarna merah bata setelah reaksi berlangsung selama 9,42 menit. Uji dengan pereaksi iodium, tabung A setelah di tambah dengan pereaksi iodium terbentuk larutan yang berwarna kuning.tabung B setelah di tambah dengan pereaksi iodium terbentuk larutan yang berwarna merah. tabung C setelah di tambah dengan pereaksi iodium terbentuk larutan yang berwarna hijau. tabung D setelah di tambah dengan
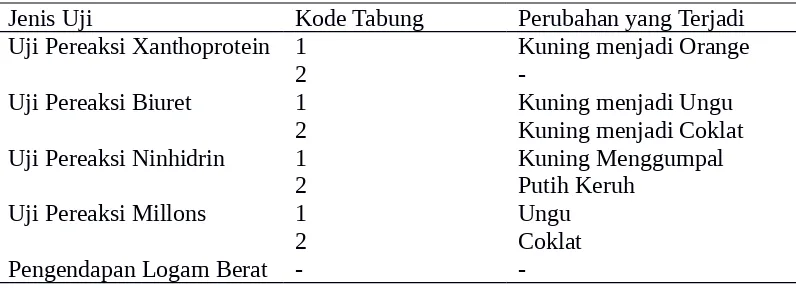
Pada percobaan protein , kami menggunakan bahan kacang kedelai, tauge, asam nitrat pekat, larutan natrium hidroksida 10%, larutan ninhidrin 0,1%, larutan NaOH 2 N, larutan CuSO4 0,01 N, larutan tembaga sulfat 0,5%, reagen millons, larutan NaOH 0,1 N, larutan timbal asetat 0,2 N, larutan asam klorida 0,1 N, reagen biuret. Pada uji dengan pereaksi Xanthoprotein, tabung berkode 1 setelah di tambah dengan asam nitrat terjadi denaturasi protein, setelah di tambahkan larutan NaOH 10% terjadi perubahan warna dari warna kuning menjadi orange yang menunjukan bahan mengandung protein. Tabung berkode 2 setelah di tambah asam nitrat pekat terjadi denaturasi protein dan setelah di tambahkan larutan NaOH 10% tidak terjadi perubahan warna yang menunjukan bahan yang di uji tidak mengandung protein. Pada pengamatan uji dengan pereaksi biuret, tabung berkode 1 setelah di tambah larutan tembaga sulfat 0,5 % dan NaOH 10% terjadi perubahan warna dari kuning mejadi ungu yang menunjukan bahan yang diuji mengandung asam amino. Tabung berkode 2 setelah di tambahkan dengan larutan tembaga sulfat 0,5% dan NaOH 10% terjadi perubahan warna dari kuning menjadi coklat yang menunjukan bahan yang diuji tidak mengandung protein. Pada uji dengan pereaksi ninhidrin, tabung berkode 1 setelah di tambahkan larutan ninhidrin 0,1% terjadi warna kuning menggumpal yang menunjukan bahan yang diuji mengandung protein. Tabung berkode 2 setelah di tambah larutan ninhidrin 0,1% terjadi warna putih keruh yang menunjukan bahan yang diuji tidak
mengandung protein. Uji dengan pereaksi millons tabung berkode 1 setelah di tambah pereaksi millons terjadi warna ungu yang menunjukan bahan yang diuji mengandung protein. Tabung berkode 2 setelah di tambah pereaksi millons terjadi warna coklat yang menunjukan bahan yang diuji mengandung protein.
Pengendapan dengan logam berat, tabung berkode 1 setelah di tambahkan larutan timbale asetat terjadi denaturasi protein yang menunjukan bahan yang diuji mengandung protein. Dari percobaan ini kita bias menyimpulkan bahwa ekstrak kacang kedelai mengandung protein dan ekstrak tauge mengandung protein.
Pada percobaan lipida kami menggunakan bahan aquades, etanol, heksana, aseton, minyak kelapa, NaOH 2% dalam etanol, NaOH 2% dalam methanol. Pada uji kelarutan, tabung A setelah dicampur air dengan minyak kelapa dan dikocok terjadi dua lapisan yang terisah yang menunjukan minyak tidak larut dalam air. Tabung B setelah dicampur etanol dengan minyak kelapa dan dikocok terjadi dua lapisan yang terisah yang menunjukan minyak larut dalam etanol. Tabung C setalah dicampur dengan heksana dengan minyak kelapa dan dikocok terjadi dua lapisan yang terisah yang menunjukan minyak larut dalam heksana. Tabung B setelah dicampur aseton dengan minyak kelapadan dikocok terjadi dua lapisan yang terisah yang menunjukan minyak larut dalam aseton. Pada reaksi
Erlenmeyer berkode A setelah ditambahkan dengan KOH 0,5 % dan di panaskan tidak terbentuk sabun yang diindikasikan oleh adanya partikel-partikel berwarna putih. Erlenmeyer berkode B setelah ditambahkan dengan KOH 0,5 % dan di panaskan terbentuk sabun yang diindikasikan oleh adanya partikel-partikel berwarna putih. Pada uji pembentukan emulsi, tabung reaksi berkode A setelah ditambahkan dengan minyak kelapa dan dikocok tidak terjadi emulsi, sebab campurannya tidak terpisah satu terhadap yang lainnya. Tabung reaksi berkode B setelah ditambahan dengan minyak kelapa dan dikocok terjadi emulsi, sebab campurannya terpisah satu terhadap yang lain. Dari percobaan ini kita dapat menyimpulkan, minyak kelapa larut didalam heksana dan aseton, tetapi tidak larut di dalam pelarut air dan etanol. Minyak kelapa dapat membentuk ester dengan etanol maupun methanol, sebab pada pencampuran dengan NaOH dalam
KATA PENGANTAR
Puji syukur kehadirat Tuhan Yang Maha Esa yang telah memberikan kita
berbagai macam nikmat, sehingga aktifitas hidup yang kita jalani ini akan selalu
membawa keberkahan, baik di kehidupan di alam dunia ini, lebih-lebih lagi pada
kehidupan akhirat kelak, sehingga semua cita-cita serta harapan yang ingin kita
capai menjadi lebih mudah dan penuh manfaat.
Terimah kasih sebelum dan sesudah penulis ucapkan kepada dosen-dosen
dan kakak-kakak asisten dosen serta teman- teman sekalian yang telah
membantu, baik bantuan moril maupun materil, sehingga penyusun dapat
menyelesaikan penulisan praktikum yang berjudul ''Laporan Lengkap Kimia
Dasar''
Penyusun menyadari sekali, didalam penulisan laporan ini masih jauh dari
kesempurnaan serta banyak kekurangan-kekurangannya, baik dari segi tata
bahasa, sehingga masih diharapkan kritik dan saran yang dapat menyempurnakan
laporan ini. Harapan yang paling besar dari penulis, mudah-mudahan apa yang
pnulis susun ini kiranya dapat bermanfaat, baik untuk pribadi, teman-teman, serta
orang lain yang ingin mengambil hikmah dari isi laporan ini sebagai tambahan
dalam menambah referensi yang telah ada
Palu, November 2016
DAFTAR ISI
2.7 Identifikasi Protein... 16
2.8 Sifat-Sifat Minyak dan Lemak... 18
III. METODE PRAKTEK 3.1 Tempat dan Waktu... 22
3.2 Alat dan Bahan... 22
3.3 Cara Kerja... 24
3.3.1 Stoikiometri... 24
3.3.2 Sitem periodik unsur-unsur... 24
3.3.3 Larutan 1... 26
3.3.4 Asam basa... 27
3.3.5 Aldehid dan keton... 29
3.3.6 Identifikasi karbohidrat... 30
3.3.7 Identifikasi protein... 31
IV. HASIL DAN PEMBAHASAN
4.1 Stoikiometri... 36
4.2 Sistem Periodik Unsur-Unsur... 37
4.3 Larutan 1... 38
4.4 Asam Basa... 39
4.5 Aldehid dan Keton... 41
4.6 Identifikasi Karbohidrat... 43
4.7 Identifikasi Protein... 45
4.8 Sifat-sifat Minyak dan Lemak... 47
V. KESIMPULAN DAN SARAN 5.1 Kesimpulan... 49
5.2 Saran... 52
DAFTAR PUSTAKA LAMPIRAN
BIODATA PENYUSUN
No. Teks Halaman
1. Hasil Pengamatan Kadar Air Bahan... 35
2. Hasil Pengamatan Sistem Periodik Unsur-Unsur... 37
3. Hasil Pengamatan Larutan 1... 38
4. Hasil Pengamatan Asam Basa... 39
5. Hasil Pengamatan Aldehid Dan Keton... 41
6. Identifikasi Karbohidrat... 43
7. Identifikasi Protein... 45
DAFTAR LAMPIRAN
No. Teks Halaman
I. PENDAHULUAN
1.1 Latar Belakang
Kimia merupakan ilmu yang mempelajari mengenai komposisi dan sifat zat
atau materi dari skala atom hingga molekul serta perubahan atau transformasi
serta interaksi mereka untuk membentuk materi yang ditemukan sehari-hari.Tanpa
kita sadari sebenarnya kita sangat akrab dengan kimia dimana bahan kimia ada
dimana-mana,kita tidak bisa hidup tanpa bahan kimia.Ditengah masyarakat istilah
kimia telah mengalami arti sempit. Istilah bahan kimia biasa digunakan untuk
bahan-bahan berbahaya. Dalam ilmu kimia, yang dimaksudkan dengan bahan
kimia adalah semua benda yang ada dialam ini (Vogel, 1985).
Stoikiometri berasal ari bahasa Yunani, yaitu stoicheion yang berati unsur,
metron artinya mengukur.Jadi stoikiometri adalah perhitungan kimia. Stoikiometri
behubungan dengan hubungan kuantitatif antar unsur dalam satu senyawa dan
antar zat dalam suatu reaksi. Dasar dari semua hitungan stoikiometri adalah
pengetahuan tentang massa atom dan massa molekul. Oleh karena itu,
stoikiometri akan dimulai dengan membahas upaya para ahli dalam penentuan
massa atom dan massa molekul (Achmad, dkk. 2001).
Ketika mempelajari kimia dikenal adanya larutan. Larutan pada dasarnya
adalah fase yang homogen yang mengandung lebih dari satu komponen.
Komponen yang terdapat dalam jumlah besar disebut pelarut atau solvent.
Sedangkan komponen dalam jumlah sedikit disebut zat terlarut atau solute.
molalitas, normalitas dan sebagainya. Larutan didefinisikan sebagai campuran
homogen antara dua atau lebih zat yang terdispersi dengan baik sebagai molekul,
atom maupun ion yang komposisinya dapat berpariasi ( Athur dan Gotman, 2002).
Asam dan basa secara tidak sadar merupakan bagian dari kehidupan
kita.Makanan yang kita konsumsi sebagian besar bersifat asam, sedangkan
pembersih yang kita gunakan (sabun, detergen) adalah basa.Asam dan basa sangat
berpengaruh terhadap kondisi lingkungan. Keasaman tanah akan berpengaruh
terhadap kondisi tumbuhan yang ada di atasnya. Kualitas air juga dapat ditentukan
dengan mengukur tingkat keasamannya. Kebanyakan asam dan basa (yang belum
bercampur dengan senyawa lain) Meskipun asam dan basa yang kita konsumsi
sehari-hari berupa padatan seperti makanan dan sabun, namun pada akhrinya tetap
butuh diencerkan juga (direaksikan atau dicampur dengan air)
(Koenan, dkk. 1985).
Aldehid berasal dari alkohol primer yang teroksidasi, sedangkan keton
berasal dari alkohol sekunder yang teroksidasi.Aldehid dan keton adalah contoh
senyawa-senyawa karbonil yang banyak ditemukan di alam bebas. Aldehid
adalah senyawa organik yang karbon karbonilnya selalu berikatan dengan paling
sedikit satu atom hidrogen. Sedangkan keton adalah senyawa organik yang
karbon karbonilnya dihubungkan dengan 2 karbon lain. Contoh senyawa aldehid
adalah formalin yang sering digunakan dalam pengawetan zat organik.
Sedangkan contoh senyawa keton adalah aseton yang dapat digunakan untuk
pembersih kuteks.Gugus karbonil ialah satu atom karbon dansatu atom oksigen
gugus fungsi yang paling lazim di alam dan terdapat dalam karbohidrat, lemak
protein, dan steroid (Petruci, dkk. 1987)
Karbohidrat sangat akrab dengan kehidupan manusia. Karbohidrat adalah
sumber energi utama manusia. Contoh makanan sehari-hari yang mengandung
karbohidrat adalah pada tepung, gandum, jagung, beras, kentang,
sayur-sayuran,dll.Karbohidrat mempunyai rumus umum Cn(H2O)n. Rumus itu
membuat para ahli kimia zaman dahulu menganggap karbohidrat adalah hidrat
dari karbon. Karbohidrat, berdasarkan massa, merupakan kelas biomolekul yang
paling melimpah di alam. Rumus empiris karbohidrat dapat dituliskan sebagai
berikut: Cm(H2O)n atau (CH2O). Tetapi ada juga karbohidrat yang mempunyai
rumus empiris tidak seperti rumus diatas, yaitu deoksiribosa, deoksiheksosa dan
lain-lain. Semua jenis karbohidrat terdiri atas unsur-unsur karbon (C), hidrogen
(H), dan Oksigen (O). Dalam bentuk sederhana, formula umum karbohidrat
adalah CnH2nOn. Hanya heksosa (6-atom karbon), serta pentosa(5-atom karbon),
Protein (protos yang berarti paling utama) adalah senyawa organik
kompleks yang mempunyai bobot molekul tinggi yang merupakan polimer dari
monomer-monomer asam amino yang dihubungkan satu sama lain dengan ikatan
peptida. Protein merupakan polimer kondensasi asam amino dengan
penghilangan unsur air dari gugus amino dan gugus karboksil.
Proetin banyak terkandung di dalam makanan yang sering dikonsumsi oleh
manusia. Seperti pada tempe, tahu, ikan dan lain sebagainya (Syukri, S. 1999).
Minyak dan lemak berperan sangat penting dalam gizi kita karena
dapat digolongkan makhluk omnivora, artinya makanannya terdiri dari bahan
hewani maupun nabati, karena itu dapat menerima minyak dan lemak dari
berbagai sumber ternak mapun tanaman (Syukri, S. 1999).
1.2 Tujuan
Tujuan dari percobaan satu (stoikiometri) yaitu untuk mempelajari cara
penetapan kadar air tanah dan bahan nabati. Percobaan dua (system periodik
unsur-unsur) yaitu untuk mempelajari cara mendeteksi unsure hara nitrogen,
fosfor dan kalium dalam tanah dan tanaman. Percobaan tiga (larutan I) yaitu untuk
mempelajari cara membuat larutan natrium hidroksida dan asam klorida, serta
mempelajari cara menentukan konsentrasi larutan yang telah dibuat. Percobaan
empat (asam basa) yaitu untuk mempelajari cara menentukan pH larutan NaOH,
HCl, tanahdan pH buah-buahan menggunakan pH meter dan kertas pH universal.
Percobaan lima (aldehid dan keton) yaitu untuk mempelajari cara membedakan
antara aldehid dan keton. Percobaan enam (identifikasi karbohidrat) yaitu untuk
mempelajari cara uji/identifikasi senyawa-senyawa yang termasuk kelompok
karbohidrat. Percobaan tujuh (identifikasi protein) yaitu untuk mempelajari cara
uji/identifikasi protein dalam suatu bahan dan mempelajari sifat-sifat protein.
Percobaan delapan (sifat-sifat minyak dan lemak) yaitu untuk mempelajari tingkat
pembentukan sabun dan ester beraroma, dan untuk mempelajari pembentuk
emulsi minyak dalam air.
1.3 Manfaat
Manfaat dari percobaan satu (stoikiometri) yaitu kita dapat mengetahui
cara penetapan kadar air tanah dan bahan nabati. Percobaan dua (system periodik
unsur-unsur) yaitu kita dapat mengetahui cara mendeteksi unsure hara nitrogen,
fosfor dan kalium dalam tanah dan tanaman. Percobaan tiga (larutan I) yaitu kita
dapat mengetahui cara membuat larutan natrium hidroksida dan asam klorida,
serta cara menentukan konsentrasi larutan yang telah dibuat. Percobaan empat
(asam basa) yaitu kita dapat mengetahui cara menentukan pH larutan NaOH, HCl,
tanah dan pH buah-buahan menggunakan pH meter dan kertas pH universal.
Percobaan lima (aldehid dan keton) yaitu kita dapat mengetahui cara membedakan
antara aldehid dan keton. Percobaan enam (identifikasi karbohidrat) yaitu kita
dapat mengetahui cara uji/identifikasi senyawa-senyawa yang termasuk kelompok
karbohidrat. Percobaan tujuh (identifikasi protein) yaitu kita dapat menggetahui
cara uji/identifikasi protein dalam suatu bahan dan mempelajari sifat-sifat protein.
tingkat kelarutan minyak/lemak pada berbagai jenis pelarut, reaksi pembentukan
sabun dan ester beraroma, dan pembentuk emulsi minyak dalam air.
II. TINJAUAN PUSTAKA
2.1 Stoikiometri
2.1.1 Air bebas dan air terikat
Air yang terkandung dalam suatu bahan berupa air bebas dan air terikat. Air
bebas mudah menguap, sedangan air terikat tidak mudah menguap. Fenomena
tersebut menjadi faktor penyebab bahan tidak dapat dibebaskan dari air melalui
cara pengeringan dengan sinar matahari. Agar air tidak dapat menguap, diperlukan
pemanasan dengan suhu tinggi, yakni suhu didih air atau diperlukan bahan
penarik air dengan pelarut tak bercampur. Penetapan kadar air dengan pemanasan
suhu tinggi, dikenal dengan nama gravimetri. Sedangkan penarikan dengan
pelarut dikenal dengan penatapan kadar air cara volumetrik (Subowo, 2008).
2.1.2 Penetapan kadar air cara gravimetri
Gravimetri merupakan cara pemeriksaan jumlah zat yang paling tua dan
yang paling sederhana dibandingkan dengan cara pemeriksaan kimia lainnya.
Analisis gravimetri adalah analisis kuantitatif berdasarkan berat tetap
(berat konstannya). Bagian terbesar analisis gravimetri menyangkut perubahan
unsur atau gugus dari senyawa yang dianalisis menjadi senyawa lain yang murni
gugus yang dianalisis selanjutnya dihitung dari rumus senyawa atau berat atom
penyusunnya (Rohman, 2007).
2.1.3 Penetapan kadar air cara volumetri
Analisis volumetri merupakan teknik penetapan jumlah sampel melalui
perhitungan volume. Sehingga dalam teknik alat pengukur volume menjadi bagian
terpenting, dalam hal ini buret adalah alat pengukur volume yang dipergunakan
dalam analisis volumetric. Penetapan sampel dengan analisa volumetri didasari
pada hubungan stoikiometri sederhana dari reaksi-reaksi kimia (Dwi, 2005).
Indikator adalah suatu senyawa organik kompleks merupakan pasangan
asam basa konyugasi dalam konsentrasi yang kecil indikator tidak akan
mempengaruhi pH larutan. Indikator memiliki dua warna yang berbeda ketika
dalam bentuk asam dan dalam bentuk basanya. Perubahan warna ini yang sangat
bermanfaat, sehingga dapat dipergunakan sebagai indicator pH dalam titrasi
(Dwi, 2005).
Pada saat perubahan warna, maka telah terjadi reaksi sempurna antara analit
dengan pereaksi dan pada kondisi ini terjadi kesetaraan jumlah molekul zat yang
bereaksi sesua dengan persamaan reaksinya. Dari percobaan seperti ini kita dapat
informasi awal, yaitu konsentrasi dan volume dari pereaksi atau larutan standar.
Perhitungan atau penetapan analit didasari pada keadaan ekivalen dimana ada
kesetaraan zat antara analit dengan pereaksi, sesuai dengan koofisien reaksinya
(Stoker, 2010).
Analisis volumetri ini sering diistilah dengan titrimetri dengan satu dasar
yaitu penetapan sebuah sampel merujuk pada jumlah volume titran yang
kerancuan, mengingat pengukuran volume tidak hanya terjadi pada reaksi dalam
bentuk larutan, namun juga untuk reaksi-reaksi yang menghasilkan dimana titrasi
tidak dilakukan (Lasinda, 2012).
2.2 Sistem Periodik Unsur-unsur
2.2.2 Golongan alkali tanah
Logam alkali tanah adalah unsur-unsur yang terdapat pada golongan 2
(juga disebut golongan IIA) pada tabel unsur peroidik. Unsur-unsur dalam
kelompok termasuk berilium (Be), magnesium (Mg), kalsium (Ca), stronsium
(Sr), barium (Ba), dan radium (Ra) (Subowo, 2008).
2.2.3 Unsur logam
Unsur logam adalah unsur yan memiliki sifat mengkilap dan umumnya
merupakan penghantar listrik dan penghantar panas yang baik. Unsur-unsur logam
umumnya berwujud padat pada suhu dan tekanan normal, kecuali raksa yang
berwujud cair. Pada umumnya unsur logam dapat ditempu sehingga dapat
dibentuk menjadi benda-benda lainnya (Bayu, 2012).
2.2.4 Unsur non logam
Unsur non logam adalah unsur yang tidak memiliki sifat seperti logam.
Contoh unsur nonologam yang berwujud gas adalah oksigen, nitrogen, dan
helium. Contoh unsur nonlogam yang berwujud padat adalah belerang, karbon
fosfor, dan iodin. Zat padat nonlogam biasanya keras dan getas. Unsur nonlogam
2.2.5 Unsur hara
Unsur hara adalah nutrisi yang dibutuhkan tanaman yang terbentuk dari
bahan organik dan anorganik. Unsur hara tidak hanya zat hara utama yang
berperan dalam pertumbuhan tanaman tapi juga ada zat hara mikro yaitu mangan
(Mn). Perana dari unsur ini adalah mangan merupakan salah satu penyusun
ribosom, selain itu berperan dalam sintesis protein, mengaktifasi sejumlah enzim.
Contoh lainnya yaitu seng (Zn), fungsi dari unsur Zn diantaranya adalah sebagai
pengaktif dari beberapa enzim adolase (Suhendra, dkk. 2009).
2.3 Larutan I
2.3.1 Larutan
Larutan adalah pengkajian keadaan koloid, suatu keadaan subdivisi yang
terletak antara suatu larutan dan suatu suspensi. Partikel-partikel dalam suatu
dispersi koloid terlalu besar untuk dianggapbenar-benar terlarut, tetapi
partikel-partikel ini begitu kecil sehingga tidak mengendap seperti partikel-partikel suspensi
(Pudjaatmaka, 2006).
Larutan adalah campuran homogen. Dikatakan homogeny karena komposisi
dan sifatnya seragam, dan disebut campuran karena mengandung 2 atau lebih zat
yang proporsinya bias saja bervariasi.Pelarut (solvent) adalah komponen yang
kuantitasnya terbesar atau yang menentukan wujud materi larutan
2.3.2 Zat terlarut dan zat pelarut
Pelarut (solvent) adalah komponen yang kuantitasnya terbesar atau yang
menentukan wujud materi larutan. Komponen larutan lainnya, yang dinamakan
zat terlarut (solute), dikatakan terlarut dalam pelarut (Ralph dan Petrucci, 2007).
2.3.3 Titrasi dan pengenceran
Pengenceran pada prinsipnya hanya menambahkan pelarut saja, sehingga
jumlah mol zat terlarut sebelum pengenceran sedikit di banding jumlah molzat
terlarut sesudah pengenceran atau jumlah gram sama dengan gram zat terlarut
sesudah pengenceran (Lasinda, 2012 ).
Titrasi merupakan metode analisi kimia secara kuantitatif yang biasa di
gunakan untuk laboratorium untuk menentukan konsentrasi dari reaktan. Karena
pengukuran volume memainkan peranan penting dalam titrasi, maka teknik ini
juga di kenali dengan analisis volumetik (Bayu, 2011).
2.4 Asam Basa
2.4.1 Derajat keasaman
Sifat asam basa suatu larutan dapat di tunjukkan dengan mengukur pH-nya.
pH adalah parameter yang digunakan untuk menyatakan tingkat keasaman
larutan.Larutan asam mempunyai pH kurang lebih7, sedangkan larutan netral
2.4.2 Larutan asam dan basa
Menurut Arrhenius, adalah zat yang dalam air melepaskan ion H+,
sedangkan basa adalah yang dalam air melepaskan ion OH-. Jadi pembawa sifat
asam adalah ion H+, sedangkan pembawa sifat basa adalah ion OH- (Kean, 2007).
Istilah basa berasal dari bahasa arab yang berarti abu. Suatu senyawa
dikelompokan menjadi basa jika zat tersebut dilarutkan ke dalam air
menghasilkan ion hidroksida (OH). Zat yang bersifat basa antara lain: Natrium
Hidroksida (NaOH), Kalium Hidroksida (KOH), pasta gigi dan sabun. Secara
umum senyawa basa memiliki ciri-ciri sebagai berikut:Mempunyai rasa pahit,
Terasa licin jika terkena air, misalnya sabun, Dapat menghantarkan arus listrik
(konduktor), Jika dilarutkan ke dalam air menghasilkan ion hidroksida (OH),
Bersifat kaustik artinya dapat merusak kulit, Dapat merubah warna indikator
kertas lakmus merah menjadi biru dan Memiliki pH lebih dari 7. Semakin besar
nilah pH suatu zat maka semakin kuat derajat kebasaanya (Irmalita, 2012).
Istilah asam berasal dari bahasa latin yaitu acetum yang berarti cuka.
Pengertian asam menurut Arhenius adalah zat yang menghasilkan ion H+ didalam
air. Jadi asam dapat diartikan sebagai senyawa yang menghasilkan ion hydrogen
(H+) ketika dilarutkan ke dalam air. Zat yang bersifat asam antara lain : asam
khlorida (HCI), air aki (asam sulfat) dan pembersih porselin. Secara umum
senyawa asam memiliki ciri-ciri sebagai berikut: Mempunyai rasa asam, Dapat
merubah warna indikator misalnya kertas lamus biru menjadi merah, Bersifat
korosif terhadap logam, Dapat menghantarkan listrik (konduktor), Jika dilarutkan
keasaman) kurang dari 7. Semakin kecil nilai pH suatu zat maka semakin kuat
sifat keasamannya (Irmalita, 2012).
2.4.3 pH rill dan pH potensial
Harga pH yang diukur dalam pelarut air menyatakan kepekatan ion
hidrogen tersedia dalam tubuh tanah, dikenal dengan pH riil. Sedangkan nilai pH
yang diukur dalam pelarut KCl 1 M menyatakan kepekatan ion hidrogen yang ada
dalam tanah dikenal sebagai pH potensial. Harga pH potensial biasanya lebih
besar dibandingkan dengan harga pH riil, sebab pH yang terukur bukan hanya
hidrogen bebas akan tetapi juga hidrogen terikat sedangkan pH riil yang terukur
hanya hidrogen bebas (Stoker, 2010).
Pengukuran harga pH tanah yang dilakukan dalam laboratorium pada
umumnya menggunakan 2 macam pelarut,yakni air dan larutan kalium klorida
(KCl) 1 molar. Harga pH yang diukur dalam pelarut air menyatakan kepekatan ion
hidrogen tersedia dalam tubuh tanah, dikenal sebagai pH rill, sedangkan nilai pH
yang diukur dalam pelarut KCl 1 M menyatakan kepekatan ion hidrogen yang ada
dalam tanah dikenal sebagai pH potensial (Dian, 2005).
2.5 Aldehid dan Keton
2.5.1 Aldehid
Aldehid merupakan salah satu kelompok senyawa karbon yang memiliki
gugus karbonil. Gugus tersebut terletak di ujung rantai karbon induk yang diakhiri
menggunakan nama trivial sering dipakai. Menurut sistem IUPAC, nama aldehid
diturunkan dari nama alkana dengan mengganti akhiran –a menjadi –al. Oleh
karena itu, aldehid disebut juga alkanal. Tata nama pada aldehid sama dengan tata
nama pada alkohol, rantai terpanjang harus mengandung gugus aldehid. Aldehid
disintesis melalui oksidasi alkohol primerSelain dengan cara oksidasi alkohol
primer, sintesis aldehid dapat juga dilakukan dengan reaksi riedel-craft
menggunakan aril halogen dan katalis AlCl3 atau AlBrO3. Disamping itu, dapat
juga dilakukan dengan pereaksi Grignard (R–Mg–X). Hal ini disebabkan oleh
atom oksigen dan karbon mempunyai perbedaan keelektronegatifan cukup besar.
Kepolaran gugus karbonil ditunjukkan oleh sifat fisika aldehid, seperti titik didih
lebih tinggi (50–80 °C) dibandingkan senyawa hidrokarbon dengan masa molekul
relatif sama (Maulana, 2013).
Aldehid dengan berat molekul rendah memiliki bau yang tajam. Misalnya,
HCHO (metanal atau formaldehid) dan CH3CHO (etanal atau asetaldehid).
Dengan meningkatnya massa molekul aldehid, baunya menjadi lebih harum.
Beberapa aldehid dari hidrokarbon aromatis memiliki bau khas yang menyegarkan
(Sutresna, 2005).
2.5.2 Keton
Keton adalah senyawa-senyawa sederhana yang mengandung sebuah
gugus karbonil – sebuah ikatan rangkap C=O. Keton termasuk senyawa yang
sederhana jika ditinjau berdasarkan tidak adanya gugus-gugus reaktif yang lain
seperti yang bisa ditemukan misalnya pada asam-asam karboksilat yang
mengandung gugus –COOH (Rohman, 2007).
Keton bisa berarti gugus fungsi yang dikarakterisasikan oleh sebuah gugus
karbonil (O=C) yang terhubung dengan dua atom karbon ataupun senyawa kimia
yang mengandung gugus karbonil. Keton memiliki rumus umum: R1(CO)R2.
Senyawa karbonil yang berikatan dengan dua karbon membedakan keton dari
asam karboksilat, aldehida, ester, amida, dan senyawa-senyawa beroksigen
lainnya. Ikatan ganda gugus karbonil membedakan keton dari alkohol dan eter.
Keton yang paling sederhana adalah aseton (Achmad, 2001).
2.6 Identifikasi Karbohidrat
2.6.1 Karbohidrat
Karbohidrat yaitu senyawa organik terdiri dari unsur karbon, hidrogen, dan
oksigen. Terdiri atas unsur C, H, O dengan perbandingan satu atom C, dua atom
H, satu atom O. karbohidrat banyak terdapat pada tumbuhan dan binatang yang
berperan struktural & metabolik. sedangkan pada tumbuhan untuk sintesis CO2 +
H2O yang akan menghasilkan amilum / selulosa, melalui proses fotosintesis,
sedangkan Binatang tidak dapat menghasilkan karbohidrat sehingga tergantung
tumbuhan. sehingga tergantung dari tumbuhan. karbohidrat merupakan sumber
energi dan cadangan energi, yang melalui proses metabolism. Banyak sekali
makanan yang kita makan sehari hari adalah suber karbohidrat seperti beras,
singkung, umbi-umbian, gandum, sagu, jagung, kentang, dan beberapa
2.6.2 Sifat-sifat karbohidrat
Semua karbohidrat bersifat optis aktif, Monosakarida dan disakarida
rasanya manis dan larut pada air, sedangkan polisakarida rasanya tawar dan tidak
larut pada air. Beberarapa reaksi pada karbohidrat: Hidrolisis yaitu polisakarida
H2 O, disakarida H2O, monosakarida, Fermentasi adalah glukosa ragi etanol +
CO2 , Dehidrasi adalah karbohidrat H2 S O4 karbon + H2 O.
2.6.3 Monosakarida
Monosakarida (gula sederhana) merupakan karbohidrat sederhana yang
merupakan molekul terkecil karbohidrat. Tiga golongan monosakarida yaitu
Glukosa disebut juga dextrosa , terdapat dalam buah-buahan dan sayur-sayuran.
Fruktosa disebut juga levulosa, terdapat dalam buah2an dan sayur-sayuran,
terutama terdapat dalam madu. Galaktosa pemecahan dari disakarida (laktosa),
terdapat dalam susu (Rohman, 2007).
2.6.4 Disakarida
Disakarida gabungan dari dua macam monosakarida. Tiga golongan
disakarida, Sukrosa, terdapat dalam gula tebu dan gula aren. Dalam proses
pencernaan sukrosa akan dipecah menjadi glukosa dan fruktosa. Maltosa: hasil
pecahan zat tepung (pati), yang selanjutnya dipecah menjadi dua molekul glukosa.
Laktosa: banyak terdapat dalam susu, lebih sulit dicerna dibanding sukrosa dan
maltosa. Dalam proses pencernaan akan dipecah menjadi satu molekul glukosa
2.6.5 Polisakarida
Polisakarida, gabungan dari beberapa molekul monosakarida. 3 golongan
monosakarida: Pati, merupakan sumber kalori yang sangat penting karena
sebagian besar karbohidrat dalam makanan terdapat dalam bentuk pati. Serat,
merupakan komponen dinding sel tanaman yang tak dapat dicerna oleh sistem
pencernaan manusia. Glikogen, disebut juga pati binatang, adalah jenis
karbohidrat semacam gula yang disimpan di hati dan otot dalam jumlah kecil
sebagai cadangan karbohidrat (Achmad, 2001).
2.7 Identifikasi Protein
2.7.1 Protein
Protein merupakan salah satu zat penting yang diperlukan untuk tubuh kita
agar tetap sehat. Protein merupakan kelompok dari makromolekul organik
kompleks dimana didalamnya terkandung hidrogen, karbon, nitrogen, oksigen dan
sulfur serta terdiri dari satu atau beberapa rantai asam amino. Ini adalah
komponen utama dari semua sel hidup yang mencakup banyak zat seperti hormon,
enzim, serta antibodi yang dibutuhkan untuk fungsi organisme. Zat ini sangat
penting karena digunakan untuk perbaikan jaringan dan pertumbuhan. Zat ini bisa
diperoleh dari berbagai sumber makanan seperti telur, susu, ikan, daging, dan
kacang-kacangan dan karbohidrat sangat dibutuhkan oleh manusia
2.7.2 Sifat-sifat Protein
Sifat fisikokimia setiap protein berbeda, tergantung pada jumlah dan jenis
asam aminonya.Berat molekul protein sangat besar sehingga bila protein di
larutjkan dalam air akan membentuk suatu disperse koloidal. Molekul protein
tidak dapat melalui membrane semipermiabel, tetapin masing-masing dapat
menimbulkan tegangan pada membrane tersebut.Ada protein yang larut dalam air,
dan ada pula yang tidak larut dalam air, tetapi semua protein tidak larut dalam
pelarut lemak seperti etil eter. Bila dalma suatu larutan protein di tambahkan
garam, maka daya larut protein akan berkurang, akibatnya protein mengendap.
Prinsi ini di gunakan untuk memisahkan protein dari larutannya (Andi 2011).
2.7.3 Asam amino
Fungsi utama sekaligus yang paling penting adalah untuk pemeliharaan dan
pertumbuhan semua sel-sel di dalam tumbuh dan struktur tubuh seperti sel darah,
otot, tulang, rambut, dan kulit. Selain itu, mereka juga merupakan komponen
utama dari enzim karena asam amino tersebut membantu memfasilitasi berbagai
reaksi kimia di dalam tubuh, termasuk terjadinya pencernaan. Protein juga turut
berperan penting dalam produksi berbagai hormon penting bagi tubuh seperti
hormon tiroid, hormon insulin, hormon testosteron, dan hormon estrogen
(Riska dan Aryabuana, 2008).
Fungsi protein Protein yang membangun tubuh di sebut protein structural,
pada umumnya bersenyawa dengan zat lain di dalam tubuh makhluk hidup,
sebagai protein fungsional. Fungsi asam amino : Asam amino yang di hasilkan
dari proses pencernaan makanan berperan sangat penting di dalam tubuh seperti,
bahan dalam sintesis substansi penting seperti hormone, zat antibody, dan arganel
sel lainnya dan juga sebagai sumber energy, setiap gramnya akan menghasilkan
4,1 kalori.Mengatur dan melaksanakan metabolism tubuh yaitu sebagai enzim dan
juga menjaga keseimbangan asam basa dan keseimbangan cairan tubuh
(Usman, 2008).
2.8 Sifat-sifat minyak dan lemak
2.8.1 Minyak
Minyak adalah istilah umum untuk semua cairan organik yang tidak
larut/bercampur dalam air (hidrofobik) tetapi larut dalam pelarut organik. Dalam
arti sempit, kata “minyak” biasanya mengacu ke minyak bumi (petroleum) atau
olahannya : minyak tanah (kerosena). Namun demikian, kata ini sebenarnya
berlaku luas, baik untuk minyak sebagai bagian dari menu makanan (misalnya
minyak goreng), sebagai bahan bakar (misalnya minyak tanah), sebagai pelumas
(misalnya minyak rem), sebagai medium pemindahan energi, maupun sebagai
wangi-wangian (misalnya minyak nilam). Lemak dan minyak merupakan zat
makanan yang penting untuk menjaga kesehatan tubuh manusia dan sangat
2.8.2 Lemak
Lemak dan minyak merupakan sumber energi yang efektif dibandingkan
dengan karbohidrat dan protein. Satu gram minyak atau lemak dapat
menghasilkan 9 kkal sedangkan karbohidrat dan protein hanya menghasilkan 4
kkal/gram. Minyak dan lemak juga berfungsi sebagai sumber dan pelarut bagi
vitamin-vitamin A, D, E dan K (Dian, 2005).
2.8.3 Reaksi- reaksi pengenal lipid
Uji kelarutan, pada uji kelaruatan lipid hampir semua jenis lipid tidak larut
dalam pelarut seperti aquadest, alkohol, dan larutan Na2Co3 tetapi larut dalm
pelarut non polar seperti eter dan kloroform. Lemak hewan dan minyak kelapa
terdispersi menjadi sabun. Ketengikan pada lemak / minyal berarti triglederol
dodalamnya telah teroksidasidalam udara bebas oleh O2. Trigleserida adalah tri
erter yang terbentuk dari gliserol asam-asam lemak. Asam lemak jenuh umumnya
merupakan rantai tidak bercabang dan jumlah atom kanbonnya selalu genap.
Trigleserida dibagi menjadi dua macam yaitu sederhana dan campuran
(Mithel, 2009)
Reaksi pembentukan ester, ester dibuat dengan mereaksikan alkohol atau
fenol dengan asam karboksilat kemudian direfluks. Fenol yaitu senyawa organik
dimana gugus -OH langsung terikat pada cincin benzena. Reaksi pembuatan ester
disebut esterifikasi dan reaksi yang terjadi disebut reaksi esterifikasi Fischer.
Reaksi esterifikasi merupakan reaksi reversibel yang sangat lambat, tetapi bila
menggunakan katalis asam mineral seperti asam sulfat (H2SO4) dan asam klorida
Ester tidak bereaksi dengan ion halida atau dengan ion karboksilat sebab
nukleofil ini merupakan basa lebih lemah daripada gugus pergi ester. Suatu ester
bereaksi dengan air membentuk suatu asam karboksilat dan alkohol. Ini
merupakan suatu contoh reaksi hidrolisis – suatu reaksi dengan air yang
mengubah satu senyawa menjadi dua senyawa. Suatu ester bereaksi dengan
alkohol membentuk ester baru dan alkohol baru. Ini merupakan contoh reaksi
alkoholisis (Mavira, 2013).
Reaksi penyabunan, saponifikasi adalah reaksi pembentukan sabun, yang
biasanya dengan bahan awal lemak dan basa. Nama lain reaksi saponifikasi adalah
reaksi penyabunan. Dalam pengertian teknis, reaksi saponifikasi melibatkan basa
(soda kaustik NaOH) yang menghidrolisis trigliserida. Trigliserida dapat berupa
ester asam lemak membentuk garam karboksilat. Minyak sayuran dan lemak
hewani merupakan bahan utama untuk reaksi saponifikasi. Trigliserida dapat
diubah menjadi sabun dalam proses satu atau dua tahap. Pada proses satu tahap,
trigliserida diperlakukan dengan basa kuat yang akan memutus ikatan ester dan
menghasilkan garam asam lemak dan gliserol. Proses ini digunakan dalam
industri gliserol. Dengan cara ini, sabun juga dihasilkan dengan cara
pengendapan. Peristiwa ini disebut dengan salting out oleh NaCl jenuh. Dalam
reaksi saponifikasi, dikenal dengan angka saponifikasi atau angka penyabunan.
Angka penyabunan adalah jumlah basa yang diperlukan untuk dapat
melangsungkan saponifikasi terhadap sampel lemak (Mavira, 2013).
Uji pembentukan emulsi, emulsi adalah campuran antara partikel-partikel
satu campuran yang terdiri dari dua bahan tak dapat bercampur, dengan satu
bahan tersebar di dalam fasa yang lain. Dikarenakan setiap bahan pangan memilki
karakteristik masing-masing maka setiap bahan pangan memiliki jenis emulsi dan
pengaruh jenis emulsi yang berbeda-beda. Kestabilan Emulsi, yaitu apabila dua
larutan murni yang tidak saling campur/ larut seperti minyak dan air dicampurkan
lalu dikocok kuat-kuat, maka keduanya akan membentuk sistem dispersi yang
disebut emulsi. Secara fisik terlihat seolah-olah salah satu salah satu fasa berada
fasa berada di sebelah dalam fasa yang lainnya. Bila proses pengocokkan
dihentikan, maka dengan sangat cepat akan terjadi pemisahan kembali, sehingga
kondisi emulsi yang sesungguhnya muncul dan teramati pada sistem dispersi
terjadi dalam waktu yang sangat singkat (Khopkar, 2008).
3.1 Tempat dan Waktu
Praktikum kimia dasar dilaksanakan di Laboratorium Agronomi,
Fakultas Pertanian, Universitas Tadulako, Palu. Dilaksanakan mulai tanggal 28
September 2016 sampai tanggal 16 November 2016. Serta waktu praktikum dari
jam 13.00 sampai 17.30. Praktikum dilaksanakan setiap hari senin, praktikum
pertama dilaksanakan pada tanggal 28 September 2016, praktikum kedua pada
tanggal 04 Oktober 2016, praktikum ketiga pada 12 Oktober 2016, praktikum
keempat pada tanggal 19 Oktober 2016, praktikum kelima pada tanggal 26
Oktober 2016, praktikum keenam pada tanggal 02 November 2016, praktikum
ketujuh pada tanggal 09 November 2016, dan praktikum kedelapan pada tanggal
16 November 2016.
3.2 Alat dan Bahan
Adapun alat yang digunakan pada percobaan satu sampai delapan yaitu
oven, neraca analitik, tang, kaca arloji atau sejenisnya, desikator, tabung reaksi,
lumpang dan alu, rak tabung, pengayak, pamanas, pipa bengkok dan gabus, gelas
ukur 100 ml, pipet tetes, erlenmeyer, corong, cawan penguap, labu ukur 100 ml,
labu semprot, gelas kimia 250 ml, batang pengaduk, pipet tetes, pipet volume 25
ml, buret 50 ml, pH meter, pengaduk magnetik, penangas air, stop watch,
Adapun bahan yang digunakan pada percobaan satu sampai delapan yaitu
tanah, kacang kedelai, kacang ijo, kapur tohor, kertas lakmus merah, indikator PP,
air destilata, reagen nesler, asam sulfat pekat, difenil amin, asam nitrat, amonium
molibdat, asam klorida, natrium kobalti nitrit, spiritus bakar, NaOH teknis, HCL
teknis, aquades, larutan NaOH 1 N, larutan HCl 1 N, air murni, larutan kalium
klorida 1 M, buah tomat, buah jeruk nipis, buah nenas, tepung tapioka, kertas pH
universal, pereaksi tollens, formaldehid, aseton, fehling A, fehling B, benzaldehid,
larutan KmnO4 0,05 %, larutan alfa naftol 10 % dalam alcohol 95 %, reagen
barfoed, larutan iodium 0,1 N, larutan glukosa 10 %, larutan maltosa 10 %,
larutan sukrosa 10 %, larutan pati 1 %, tepung ubi jalar, tauge, asam nitrat pekat,
larutan natrium hidroksida 10 %, larutan ninhidrin 0,1 %, larutan CuSO4 0,01 N,
larutan tembaga sulfat 0,5 %, reagen millons, larutan timbal asetat 0,2 N, larutan
asam klorida 0,1 N, reagen biuret, etanol, heksana, aseton, minyak kelapa, NaOH
2 % dalam etanol, NaOH 2 % dalam metanol.
3.3 Cara Kerja
Cuci bersih kaca arloji yang hendak digunakan kemudian masukkan ke
dalam oven bersuhu 100˚C selama 20 menit, gelas arloji yang telah dipanaskan
keluarkan dari oven dengan tang dan masukkan kedalam desikator sekitar 10
menit (agak dingin), timbang gelas arloji yang telah dipanaskan tersebut dengan
neraca analitik dan nyatakan beratnya sebagai berat gelas arloji kosong (W1),
kemudian isi dengan bahan yang hendak ditetapkan kadar airnya, kaca arloji yang
telah terisi dengan bahan selanjutnya ditimbang kembali dengan neraca analitik
dan catat beratnya(W2), masukkan kembali kaca arloji yang berisi bahan kedalam
oven yang bersuhu sama dengan kaca arloji kosong, kemudian panaskan hingga
beratnya constant (pemanasan berlangsung sekitar 2 jam) dan catat beratnya (W3).
3.3.2 Sistem priodik unsur-unsur
3.3.2.1. Nitrogen organik
1. Siapkan tabung reaksi yang bersih, isi sesuai tabung berikut
Jenis bahan Kode tabung
A B C D E F
Tanah 2 g - - 2 g -
-Kacang kadelai - 2 g - - 2 g
-Kacang ijo - - 2 g - - 2 g
Kapur tohor 2 g 2 g 2 g 2 g 2 g 2 g
2. Tabung A, B dan C beri kertas lakmus merah pada permukaan tabung,
kemudian panaskan dan amati perubahan warna kertas lakmus
3. Tabung D, E dan F sumbat dengan gabus yang dilengkapi dengan pipa bengkok
4. Panaskan tabung selama 30 menit dan keluarkan tabung berisi air, kemudian
tetesi dengan indicator PP. Amati perubahan warna yang terjadi.
3.3.2.2 Nitrogen nitrat-amoniak
1. Masukkan 20 g tanah halus ke dalam Erlenmeyer, kemudian tambahkan 100
ml air destilata dan kocok selama 10 menit
2. Saring campuran dan tampung filtratnya dalam Erlenmeyer
3. Sumbat dengan gabus yang dilengkapi pipa bengkok. Pipa ini dihubungkan
dengan tabung reaksi berisi 5 ml air destilata
4. Panaskan selama 30 menit, pisahkan tabung berisi air, kemudian tetesi dengan
reagen Nesler dan amati perubahan warna yang terjadi
5. Cairan dalam Erlenmeyer pada butir d pindahkan ke dalam cawan penguap,
kemudian panaskan hingga hampir kering, dinginkan
6. Tambahkan 5 tetes asam sulfat pekat, kemudian masukkan ke dalam tebung
reaksi yang berisi reagen difenil amin
7. Amati dan catat perubahan warna larutan
3.3.2.3 Unsur fosfat
1. Siapkan 3 buah cawan forselin, kemudian ini masing-masing dengan 2 g
tanah, 2 g bubuk kacang kedelai dan 2 g bubuk kacang ijo. Bahan-bahan
dalam cawan bakar dengan api Bunsen
2. Dinginkan, kemudian tambahkan 10 ml asam nitrat pekat dan panaskan
hingga mendidih
3. Dinginkan, kemudian tambahkan air destilata dengan volume yang sama
4. Saring dan tampung filtratnya dalam tabung reaksi, kemudian tetesi dengan
3.3.2.4 Kalium
1. Masukkan 10 g tanah halus ke dalam Erlenmeyer, kemudian tambahkan 25
ml asam klorida 0,1 N dan didihkan selama lima menit
2. Saring kemudian uapkan filtratnya hingga kering dan bakar residunya
3. Dinginkan, kemudian tambahkan air panas sebanyak 25 ml, saring kembali
dan tampung filtratnya dalam tabung reaksi
4. Tambahkan beberapa tetes larutan natrium kobalti nitrat dan amati perubahan
yang terjadi
3.3.3 Larutan I
3.3.3.1 Membuat larutan dari zat padat
Timbang NaOH sebanyak 4 gram dan masukkan ke dalam gelas kimia
yang berisi air murni sebanyak 95 mL (air yang digunakan bebas dari karbon
dioksida) lalu aduk dengan batang pengaduk hingga semua zat NaOH larut,
kemudian pindahkan larutan kedalam labu ukur dan tambahkan air murni dengan
pipet hingga tanda batas. Kemudian ambil larutan sebanyak 25 mL dengan pipet
volume, lalu masukkan kedalam erlenmeyer, dan tambahkan 3 tetes indikator PP.
Setelah itu siapkan buret 50 mL lalu isi dengan asam klorida 1 N, titrasi larutan
NaOH dalam erlenmeyer hingga larutan tidak berwarna, langkah terakhir catat
volume larutan HCl yang digunakan.
3.3.3.2 Membuat larutan dari zat cair
Ukur larutan HCl teknis (konsentrasinya 10 N) sebanyak 10 mL
menggunakan pipet volume 10 mL, kemudian dimasukkan kedalam gelas ukur
pipet tetes sampai tanda terang (volumenya tepat 100 mL), lalu kocok campuran
hingga homogen, kemudian ambil dengan pipet tetes volume sebanyak 25 mL dan
masukan ke dalam erlenmeyer, tambahkan 3 tetes indikator PP. Setelah itu siapkan
buret 50 mL, kemudian isi dengan larutan NaOH 1 N lalu titrasi larutan HCl
dalam erlenmeyer hingga larutan berwarna merah muda.kemudian catat volume
larutan NaOH yang digunakan.
3.3.4 Asam basa
3.3.4.1 Menentukan pH tanah
Timbang contoh tanah sebayak 10 gram, kemudian dimasukkan kedalam
lumpang dan tumbuk hingga halus, setelah itu masukkan ke dalam erlenmeyer dan
tambahakan aquades sebanyak 50 mL lalu kocok selama 30 menit, setelah itu
diamkan sampai tanahnya mengendap dan ukur pH-nya menggunakan pH meter
dan kertas universal, kemudian lakukan hal yang sama pada butir 1, 2 , 3, akan
tetapi aquadesnya ganti dengan menggunakan KCl 1 M.
3.3.4.2 Menentukan pH buah-buahan
Ambil buah pepaya,jeruk nipis dan tomat kemudian timbang
masing-masing sebanyak 10 gram. Setiap buah dihancurkan dalam lumpang dan
pindahkan kedalam gelas kimia 250 mL (gunakan tiga buah gelas kimia),
kemudian tambahkan masing-masing gelas kima dengan 50 mL air, lalu aduk
hingga homogen kemudian biarkan sampai terjadi pemisahan cairan dan endapan
lalu ukur pH-nya dengan pH meter dan pH universal.
Timbang dengan tepat 1 gram tepung tapioka, kemudian masukkan ke
dalam gelas kimia 100 mL, lalu tambahkan 20 mL air kemudian aduk-aduk
sampai basah sempurna, kemudian ditambahkan kembali 50 mL air. Setelah itu
biarkan selama 30 menit hingga terjadi endapan, kemudian ukur pH-nya dengan
pH meter dan kertas pH universal.
3.3.4.4 Menentukan pH larutan NaOH 0,01 N dan larutan HCl 0,01 N
Ambil larutan NaOH dengan menggunakan gelas ukur sebanyak 25 mL,
lalu masukkan ke dalam gelas kimia 100 mL, kemudian ukur pH-nya dengan pH
meter dan kertas pH universal. Ambil larutan HCl dengan gelas ukur sebanyak 25
mL lalu masukkan ke dalam gelas kimia 100 mL, kemudian ukur pH-nya dengan
pH meter dan kertas pH universal.
3.3.5 Aldehid dan keton
3.3.5.1 Uji dengan pereaksi tollens
Siapkan dua buah tabung reaksi yang bersih dan beri kode A dan B,
kemudian masing-masing tabung isi dengan 2,5 mL air. Tabung A ditambahkan 5
tetes formaldehid, sedangkan tabung B tambahkan 5 tetes aseton. Masing-masing
tabung ditambahkan 2,5 mL pereaksi tollens. Kocok campuran dan panaskan
didalam penangas air, amati perubahan yang terjadi pada permukaan tebung,
apabila terbentuk cermin perak pada permukaan tabung menunjukkan terjadi
reaksi, sebaliknya jika tidak terbentuk cermin perak pada permukaan tabung
3.3.5.2 Uji dengan pereaksi fehling
Siapkan dua buah tabung reaksi yang bersih dan diberi kode A dan B,
kemudian tabung A dimasukkan 1 mL formaldehid dan 1,5 mL air sedangkan
tabung B dimasukkan 1 mL aseton dan 1,5 mL air, lalu masing-masing tabung
ditambahkan 2,5 mL reagen fehling A dan 2,5 mL reagen fehling B. Kocok kedua
tabung dan masukkan kedalam penangas air mendidih, lalu amati perubahan yang
terjadi. Jika terjadi endapan merah bata menunjukkan terjadi reaksi.
3.3.6 Identifikasi karbohidrat
3.3.6.1 Uji fehling
Siapkan lima buah tabung reaksi, kemudian beri kode A, B, C, D, dan E,
kelima tabung reaksi tersebut disimpan dalam rak tabung. Masing-masing tabung
ditambahkan 2 mL larutan fehling A dan fehling B. Kemudian masing-masing
tabung reaksi tambahkan 2 mL larutan glukosa 10% untuk tabung A, 2 mL larutan
maltosa 10% untuk tabung B, 2 mL larutan sukrosa 10% untuk tabung C, 2 mL
larutan pati 1% untuk tabung D dan 2 mL larutan ubi jalar 1% untuk tabung E,
setelah itu kocok kelima tabung tersebut, lalu dimasukkan kedalam penangas air
dan dipanaskan selama kurang lebih 15 menit lalu amati dan catat perubahan yang
terjadi.
Siapkan lima buah tabung reaksi, kemudian diberi kode A, B, C, D, dan
E. Kelima tabung tersebut disimpan kedalam rak tabung.masing-masing tabung
ditambahkan 1 mL larutan glukosa 10 % untuk tabung A,1 mL larutan maltosa 10
% untuk tabung B, 1 mL larutan sukrosa 10 % untuk tabung C,1 mL larutan pati 1
% untuk tabung D dan 1 mL larutan ubi jalar 1 % untuk tabung E. Kemudian
masing-masing tabung ditambahkan 3 tetes larutan alfa natfol, kocok
perlahan-lahan lalu tambahkan 1 mL asam sulfat pekat melalui dinding tabung secara
hati-hati (jangan dikocok) dan amati warna yang terbentuk.
3.3.6.3 Uji barfoed
Siapkan dua buah tabung reaksi yang bersih dan beri kode A dan B,
selanjutnya simpan dalam rak tabung, ke dalam tabung reaksi A masukkan 3 mL
larutan glukosa 10 % dan tabung B masukkan 3 mL larutan sukrosa 10 %,
masing-masing tabung tambahkan 3 mL reagen barfoed, kocok campuran dan
masukkan ke dalam penangas air, kemudian amati dan catat waktu terbentuknya
endapan merah bata.
3.3.6.4 Uji iodium
Siapkan lima buah tabung reaksi, kemudian diberi kode A, B, C, D, dan
E. Kelima tabung tersebut disimpan kedalam rak tabung, untuk tabung A,
tambahkan 1 mL larutan glukosa 10% untuk tabung B, 1 mL larutan maltosa 10%
%, dan untuk tabung E, 1 mL larutan ubi jalar 1%. Kemudian masing-masing
tabung reaksi tambahkan 5 tetes larutan iodium 0,1 N, kocok perlahan-lahan dan
amati warna yang terbentuk.
3.3.7 Identifikasi protein
3.3.7.1 Uji xanthoprotein
Siapkan 2 buah tabung reaksi yang bersih dan diberi kode 1 dan 2.
Kemudian dimasukkan kedalam rak tabung. Pada tabung yang berkode 1 diisi
dengan 2 mL ekstrak kacang kedelai(ekstrak kacang kedelai dilakukan dengan
cara kacang kedelai berbentuk tepung sebanyak 20 gram ditambahkan larutan
NaOH 0,1 N dikocok selama 30 menit kemudian didekantasi.Filtrat yang
dihasilakn merupakan ekstrak kacang kedelai, ini dilakukan oleh laboran). Pada
tabung yang berkode 2 diisi dengan 2 mL ekstrak tauge (ekstrak tauge dibuat
dengan cara tauge sebanyak 30 gram diblender dengan 200 mL air, kemudian
disaring, filtratnya merupakan ekstrak tauge). Kemudian masing-masing tabung
tambahkan 5 tetes asam nitrat pekat lalu panaskan dan amati perubahan warna
yang terjadi, setelah itu tambahkan larutan NaOH 10% secara
perlahan-lahandengan pipet tetes sampai terjadi perubahan warna, amati dan catat
perubahan warna yang terjadi.
3.3.7.2 Uji biuret
Siapkan dua buah tabung reaksi yang bersih dan diberi kode 1 dan 2,
kemudian dimasukkan kedalam rak tabung. Pada tabung berkode 1 diisi 2 mL
tauge. Setelah itu masing-masing tabung ditambahkan 2 mL larutan tembaga
sulfat 0,5% dan secara perlahan ditambahkan 2 mL NaOH 10% kemmudian
dikocok dan amati perubahan warna yang terjadi.
3.3.7.3 Uji ninhidrin
Siapkan 2 buah tabung reaksi yang bersih dan diberi kode 1 dan 2 lalu
dimasukkan kedalam rak tebung. Pada tabung yang berkode 1 diisi dengan 2 mL
ekstrak kacang kedelai sedangkan pada tabung yang berkode 2 diisi dengan 2 mL
ekstrak tauge, lalu masing-masing tabung ditambahkan 2 mL larutan tembaga
sulfat 0,5% dan secara perlahan ditambahkan 2 mL NaOH 10% lalu kocok dan
terakhir amati dan catat perubahan warna yang terjadi.
3.3.7.4 Uji millons
Siapkan dua buah tabung reaksi yang bersih, dan beri kode 1 dan 2,
kemudian masukkan ke dalam rak tabung teaksi, selanjutnya tambahkan 2 mL
ekstrak kacang kedelai pada tabung berkode 1, 2 mL ekstrak tauge pada tabung
yang berkode 2, kemudian masing-masing tabung tambahkan 10 tetes reagen
millons, panaskan di atas penangas air selama 10 menit, amati dan catat warna
yang terbentuk.
3.3.7.5 Uji pengendapan dengan logam berat
Siapkan 2 buah tabung reaksi yang bersih dan diberi kode 1 dan 2 lalu
dimasukkan kedalam rak tabung. Pada tabung yang berkode 1 diisi dengan 2 mL
ekstrak tauge. Masing-masing tabung ditambahkan 10 tetes timbal asetat lalu
Kemudian masukkan ke dalam rak tabung, setiap tabung isi dengan bahan sesuai
dengan tabel berikut:
Kode tabung reaksi Jenis pelarut Minyak kelapa A Air 2
Tutup tabung dengan sumbat karet lalu kocok dengan vorteks selama 1 menit,
kemudian diamkan selama 10 menit lalu amati kelarutan minyak dalam tabung.
3.3.8.2 Uji reaksi pembentukan ester (alkoholisis)
Siapkan 2 buah tabung reaksi yang diberi kode A dan B lalu masukkan ke
dalam rak tabung. Masing-masing tabung diisi dengan 2 mL minyak kelapa, pada
tabung A ditambahkan 4 mL larutan NaOH 2% dalam etanol sedangkan pada
tabung B ditambahkan 4 mL NaOH 2% dalam metanol, kocok kedua tabung
selama 5 menit kemudian amati aroma yang timbul dan catat bau yang dihasilakan
3.3.8.3 Uji reaksi penyabunan
Siapkan dua buah erlenmeyer 50 mL yang diberi kode A dan B, pada
erlenmeyer berkode A diisi dengan 1 mL air, kemudian ditambahkan 10 mL KOH
0,5 N, sedangkan pada erlenmeyer berkode B diisi dengan 1 mL minyak kelapa,
kemudian ditambahkan 10 mL KOH 0,5 N. Kedua erlenmeyer dipanaskan diatas
penangas air sambil diaduk selama kurang lebih 10 menit. Lalu amati dan catat
perubahan-perubahan yang terjadi.
3.3.8.4 Uji pembentukan emulsi
Siapkan dua buah tabung reaksi kemudian diberi kode A dan B,
kemudian dimasukkan kedalam rak tabung. Pada tabung berkode A diisi dengan
10 mL air, kemudian ditambahkan 2 mL minyak kelapa, sedangkan pada tabung
berkode B diisi dengan 10 ml air, kemudian ditambahkan 2 mL minyak kelapa
dan dan 2 mL twin 80. Kocok kedua tabung dengan vortex selama 5 menit,
kemudian diamkan pada suhu ruang selam 15 menit. Terakhir amati dan catat
IV. HASIL DAN PEMBAHASAN
4.1 Stoikiometri
Dari hasil pengamatan mengenai percobaan stoikiometri maka diperoh
hasil sebagai berikut:
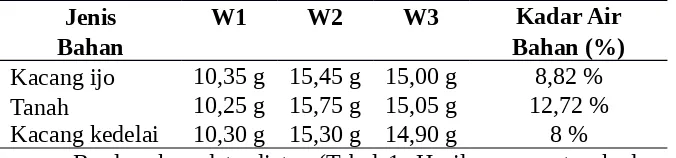
Tabel 1. Hasil Pengamatan Kadar Air bahan
Jenis W1 W2 W3 Kadar Air
Bahan Bahan (%)
Kacang ijo 10,35 g 15,45 g 15,00 g 8,82 % Tanah 10,25 g 15,75 g 15,05 g 12,72 % Kacang kedelai 10,30 g 15,30 g 14,90 g 8 %
Berdasarkan data diatas (Tabel 1. Hasil pengamatan kadar air bahan) di
peroleh hasil yaitu memberikan keterangan kadar air tertinggi terdapat pada bahan
tanah sedangkan kadar air terendah terdapat pada kacang kedelai.
Pengukuran kadar air bertujuan untuk mengetahui jangka waktu simpan
bahan, tekstur, dan mutu suatu bahan. Penentuan kadar air dalam suatu bahan
oven biasa), metode destilasi, metode kimia, dan metode khusus (kromatografi,
nuclear magnetic resonance / NMR). Pada praktikum kali ini, metode yang
digunakan adalah metode pengeringan dengan oven, namun metode oven ini
kurang akurat dan memerlukan waktu yang cukup lama yaitu sekitar 2 jam
(Ralp, 2007).
Metode oven memiliki beberapa kekurangan, yaitu bahan lain ikut
menguap, terjadi penguraian karbohidrat, menghasilkan air yang ikut terhitung,
ada air yang terikat kuat pada bahan yang tidak terhitung. Berat sampel yang
dihitung setelah dikeluarkan dari oven harus didapatkan berat konstan. Berat
sampel setelah konstan dapat diartikan bahwa air yang terdapat dalam sampel
telah menguap dan yang tersisa hanya padatan dan air yang benar-benar terikat
kuat dalam sampel, setelah itu dapat dilakukan perhitungan untuk mengetahui
persen kadar air dalam bahan (Putri, 2012).
4.2 Sistem Periodik Unsur-unsur
Dari hasil pengamatan mengenai percobaan sistem periodik unsur-unsur
maka diperoleh hasil sebagai berikut:
Tabel 2. Hasil pengamatan identifikasi adanya unsur hara NPK dalam tanah dan
tanaman
Jenis uji Bahan Utama
Warna yang Terjadi
N-Organik Tanah Biru
Biru
Biru
-Fosfor Kacang ijo
-Berdasarkan data diatas (Tabel 2. Hasil pengamatan identifikasi adanya
unsur hara NPK dalam tanah dan tanaman) maka diperoleh hasil bahwa sampel
tanah yang diuji mengandung Nitrogen-Organik dan Nitrogen Nitrat-Amoniak,
dan sampel kacang kedelai yang diuji mengandung Nitrogen-Organik, sedangkan
sampel kacang ijo yang diuji mengandung Nitrogen-Organik dan Fosfor.
4.3 Larutan 1
Dari hasil pengamatan mengenai percobaan larutan I maka diperoleh hasil
sebagai berikut :
Tabel 3. Hasil pengamatan menentukan konsentrasi larutan zat padat (NaOH) dan
larutan zat cair (HCl)
Jenis Larutan Volume Titrasi Konsentrasi Hasil Titrasi
NaOH 22,7 1,028 N
HCl 22,8 0,912 N
Berdasarkan data diatas (Tabel 3. Hasil pengamatan menentukan
konsentrasi larutan zat padat NaOH dan menentukan konsentrasi larutan zat cair
HCl) konsentrasi larutan NaOH yang dibuat adalah 1 N, sedangkan konsentrasi
NaOH hasil titrasi adalah 1,028 N. Hasil pengamatan tersebut memberikan
hasil titrasi, yang besarnya sama dengan 0,028. Perbedaan tersebut disebabkan
oleh jumlah +H¿¿ yang semakn berkurang serta penambahan pada larutan yang
dititrasi sehingga titik akhir titrasi ditandai dengan perubahan warna merah muda
menjadi bening.
Konsentrasi larutan HCl yang dibuat adalah 1 N, sedangkan konsentrasi
HCl hasil titrasi adalah 0,912 N. Hasil pengamatan tersebut memberikan
keterangan terdapat perbedaan antara konsentrasi yang dibuat dengan konsentrasi
hasil titrasi, yang besarnya sama dengan 0,088 N. Perbedaan tersebut disebabkan
oleh pemberian volume NaOH yang digunakan mempengaruhi hasil konsentrasi.
Proses standarisasi merupakan suatu proses yang digunakan untuk
menentukan secara teliti konsentrasi suatu larutan. Suatu larutan umumnya
distandarisai dengan cara titrasi. Pemilihan suatu indikator untuk titrasi asam basa
bergantung pada kuat relatif asam dan basa yang digunakan dalam titrasi
(Heltina, 2009).
4.4 Asam Basa
Dari hasil pengamatan mengenai percobaan asam basa maka diperoleh
hasil sebagai berikut :
Bahan Utama pH Universal pH Meter
Tanah 8 7,67
Buah nenas 4 3,94
Buah jeruk 2 3,45
Tepung tapioka 7 6,51
NaOH 0,01 N 9 10,83
HCl 0,01 N 2 3,36
Pada pengamatan pH tanah yang diukur pH-nya termasuk tanah basa,
sebab nilai pH-nya lebih tinggi dari pH 7. Buah nenas termasuk buah yang
bersifat asam, sebab nilai pengukuran pH menunjukkan pH buah nenas adalah
3,94 dan lebih rendah dari pH 7, buah jeruk termasuk buah yang bersifat asam
sebab hasil pengukuran pH menunjukkan pH buah jeruk adalah 3,45 dan lebih
rendah dari pH 7, buah tomat termasuk buah yang bersifat asam, sebab nilai
pengukuran pH menunjukkan pH buah tomat adalah 4,36 dan lebih rendah dari
pH 7. Tepung tapioca bersifat asam sebab hasil pengukuran pH tapioca adalah
6,51 dan lebih rendah dari pH 7. Dan berdasarkan perhitungan pH NaOH 0,01 N
adalah pH 12, sedangkan berdasarkan pengukuran ditemukan pH adalah 10,83.
Dengan demikian terdapat perbedaan pH sebesar 1,17. Perbedaan tersebut
disebabkan oleh factor konsentrasi dan temperatur. Pada larutan NaOH semakin
besar konsentrasi maka nilai pH semakin besar dan semakin rendah temperature
maka nilai pH juga semakin besar, perbedaan tersebut disebabkan oleh factor
pengaruh indicator universal yang diletakkan terlalu lama di platetes hingga
mengubah warna kertas atau larutan, juga mungkin karena adanya pengaruh dari
konsentrasi larutan yang berubah jarena temperature dan larutan lain. Sedangkan
pH HCl 0,01 N adalah pH 2, sedangkan berdasarkan pengukuuran ditemuukan pH
HCl adalah 3,36. Denga demikian perbedaan pH sebesar 1,36. Perbedaan tersebut
digunakan terkontaminasi dengan senyawa-senyawa, kurang telitinya pengamat
dalam menimbang bahan dan dalam mengamati pH larutan.
Proses standarisasi merupakan suatu proses yang digunakan untuk
menentukan secara teliti konsentrasi suatu larutan. Suatu larutan umumnya
distandarisai dengan cara titrasi. Pemilihan suatu indikator untuk titrasi asam basa
bergantung pada kuat relatif asam dan basa yang digunakan dalam titrasi
(Heltina, 2009).
4.5 Aldehid dan Keton
Dari hasil pengamatan mengenai percobaan aldehid dan keton maka di
peroleh hasil sebagai berikut :
Tabel 5. Hasil pengamatan cara menentukan dan membedakan aldehid dan keton
Jenis Uji Kode Tabung Perubahan yang terjadi Uji Pereaksi Tollens A Cermin Perak
B
-Uji Pereaksi Fehling A Merah Bata
B
-Berdasarkan data diatas (Tabel 7. Hasil pengamatan cara menentukan dan
membedakan aldehid dan keton) dapat diperoleh hasil yaitu prinsip dari uji ini
adalah digunakan untuk membedakan senyawa aldehid dan keton dalam suatu
sampel dengan menambahkan reagen tollens di mana akan terjadi reaksi oksidasi.
Dan uji positif ditandai dengan terbentuknya cermin perak pada dinding dalam
tabung reaksi. Sedangkan prinsip dari uji fehling ini adalah membedakan gugus
aldehid dan keton dalam suatu sampel dengan menambahkan fehling A dan
fehling B. Hasil uji positif ditandai dengan apabila dalam suatu sampel terbentuk