BUKU AJAR
BUKU AJAR
REAKTOR DAN KATALIS
REAKTOR DAN KATALIS
(Bagian 2)
(Bagian 2)
Oleh
Oleh
Dr. Megawati, S.T.,M.T.
Dr. Megawati, S.T.,M.T.
NIP. 197211062006042001
NIP. 197211062006042001
PROGRAM STUDI S1 TEKNIK KIMIA
PROGRAM STUDI S1 TEKNIK KIMIA
FAKULTAS TEKNIK
FAKULTAS TEKNIK
UNIVERSITAS NEGERI SEMARANG
UNIVERSITAS NEGERI SEMARANG
2013
2013
KATA PENGANTAR
KATA PENGANTAR
Bahan ajar ini
Bahan ajar ini disusun untuk menyediakan bacaan disusun untuk menyediakan bacaan akademik akademik yang berbahasa Indonesiayang berbahasa Indonesia bagi mahasiswa Prodi Teknik Kimia, Fakultas Teknik, Universitas Negeri Semarang, yang bagi mahasiswa Prodi Teknik Kimia, Fakultas Teknik, Universitas Negeri Semarang, yang mengambil mata kuliah Reaktor dan Katalis. Materi yang disajikan dalam bahan ajar ini terdiri dari mengambil mata kuliah Reaktor dan Katalis. Materi yang disajikan dalam bahan ajar ini terdiri dari kinetika reaksi dengan katalis, yang meliputi reaksi homogen (reaks
kinetika reaksi dengan katalis, yang meliputi reaksi homogen (reaksi dengan katalis cair-cair), reaksii dengan katalis cair-cair), reaksi heterogen padat-cair, reaksi heterogen gas-ciar, dan reaksi heterogen padat-gas-cair. Mengingat heterogen padat-cair, reaksi heterogen gas-ciar, dan reaksi heterogen padat-gas-cair. Mengingat luasnya cakupan materi, maka dalam bahan ajar ini, contoh soal yang dipilih ha
luasnya cakupan materi, maka dalam bahan ajar ini, contoh soal yang dipilih ha nya diambilkan padanya diambilkan pada beberapa studi kasus reaktor dan katalis. Penulis mengakui bahwa bahan ajar ini belum mampu beberapa studi kasus reaktor dan katalis. Penulis mengakui bahwa bahan ajar ini belum mampu menjawab seluruh permasalahan yang berkaitan dengan Reaktor dan Katalis, khususnya berbagai menjawab seluruh permasalahan yang berkaitan dengan Reaktor dan Katalis, khususnya berbagai jenis reaktor.
jenis reaktor. Jenis-jenis reaktor Jenis-jenis reaktor dan unjuk dan unjuk kerjanya akan disusun kerjanya akan disusun dalam buku lain. dalam buku lain. Namun demikian,Namun demikian, bahan ajar ini diharapkan dapat membantu mahasiswa untuk mengetahui dasar-dasar pengetahuan bahan ajar ini diharapkan dapat membantu mahasiswa untuk mengetahui dasar-dasar pengetahuan yang berkenaan dengan kinetika reaksi dengan katalis
yang berkenaan dengan kinetika reaksi dengan katalis, untuk selanjutnya digunakan dalam kegiatan, untuk selanjutnya digunakan dalam kegiatan pembelajaran di dalam ruang kuliah.
pembelajaran di dalam ruang kuliah.
Pada beberapa bagian contoh dan latihan soal terlihat bahwa keahlian di dalam Pada beberapa bagian contoh dan latihan soal terlihat bahwa keahlian di dalam menyelesaikan persamaan matematis berbentuk integral dan turunan mulai terasa sulit. Demikian menyelesaikan persamaan matematis berbentuk integral dan turunan mulai terasa sulit. Demikian juga, beberapa materi penting juga perlu diselesaian dengan metode grafis. Oleh karena itu, tingkat juga, beberapa materi penting juga perlu diselesaian dengan metode grafis. Oleh karena itu, tingkat
pemahaman yang tinggi tentang teknik perhitungan k
pemahaman yang tinggi tentang teknik perhitungan k inetika reaksi dengan katalis akan inetika reaksi dengan katalis akan dapat dicapaidapat dicapai jika
jika metode metode pembelajaran pembelajaran yang yang dipakai dipakai tidak tidak hanya hanya pemahaman pemahaman tetapi tetapi juga juga penerapan penerapan caracara perhitungan secara langsung. Penulis mengucapkan terima kasih pada semua pihak yang telah perhitungan secara langsung. Penulis mengucapkan terima kasih pada semua pihak yang telah membantu tersusun dan terbitnya bahan ajar ini, juga berbagai masukan dan kritikan demi membantu tersusun dan terbitnya bahan ajar ini, juga berbagai masukan dan kritikan demi kesempurnaannya di masa datang. Semoga bermanfaat.
kesempurnaannya di masa datang. Semoga bermanfaat.
Semarang, Desember 2013 Semarang, Desember 2013 Megawati Megawati
DAFTAR ISI
DAFTAR ISI
HALAMAN
HALAMAN JUDUL JUDUL ... ... ii
KATA
KATA PENAGANTAR PENAGANTAR ... ii... ii
DAFTAR ISI
DAFTAR ISI ... ... iiiiii
PENDAHULUAN...
PENDAHULUAN... ... 11
BAB
BAB I KATALISATOR ...I KATALISATOR ... ... 66
BAB III KINETIKA REAKSI DENGAN KATALIS CAIR-CAIR
BAB III KINETIKA REAKSI DENGAN KATALIS CAIR-CAIR ... 13... 13
BAB IV
BAB IV KINETIKA REAKSI DENGAN KATALIS KINETIKA REAKSI DENGAN KATALIS PADAT-CAIR PADAT-CAIR ... 16... 16
BAB V KINETIKA REAKSI DENGAN
BAB V KINETIKA REAKSI DENGAN KATALIS GAS-CAIR... 20KATALIS GAS-CAIR... 20
BAB VI KINETIKA REAKSI DENGAN
BAB VI KINETIKA REAKSI DENGAN KATALIS PADAT-GAS-CAIR ... 41KATALIS PADAT-GAS-CAIR ... 41
DAFTAR
DAFTAR PUSTAKA...PUSTAKA... 51... 51
INDEX
PENDAHULUAN
PENDAHULUAN
Setiap industri kimia selalu didesain untuk memproduksi suatu produk dari bahan Setiap industri kimia selalu didesain untuk memproduksi suatu produk dari bahan bakunya secara ekonomis. Bahan baku perlu dilakukan
bakunya secara ekonomis. Bahan baku perlu dilakukan pretreatment pretreatment sebelum direaksikan sebelum direaksikan untuk menjadi produk. Produk yang dihasilkan selanjutnya perlu dimurnikan, dipisahkan untuk menjadi produk. Produk yang dihasilkan selanjutnya perlu dimurnikan, dipisahkan untuk menjadi
untuk menjadi final product final product yang berkualitas ketika dipasarkan. Proses sederhana dan yang berkualitas ketika dipasarkan. Proses sederhana dan singkat di atas memberikan gambaran bahwa reaksi kimia memegang peranan yang cukup singkat di atas memberikan gambaran bahwa reaksi kimia memegang peranan yang cukup penting, karena merupakan faktor utama untuk mendesain sebuah reaktor kimia, sebagai penting, karena merupakan faktor utama untuk mendesain sebuah reaktor kimia, sebagai tempat untuk mengubah bahan baku menjadi produk.
tempat untuk mengubah bahan baku menjadi produk.
Kinetika reaksi kimia dengan katalis merupakan bagian yang sangat penting Kinetika reaksi kimia dengan katalis merupakan bagian yang sangat penting dipelajari dengan tujuan untuk mengetahui tentang katalis, fungsi katalis pada reaksi kimia, dipelajari dengan tujuan untuk mengetahui tentang katalis, fungsi katalis pada reaksi kimia, mekanisme reaksi dengan katalis, kinetika reaksi homogen (dengan katalis cair-cair), dan mekanisme reaksi dengan katalis, kinetika reaksi homogen (dengan katalis cair-cair), dan kinetika reaksi heterogen (padat-cair, gas-cair, dan padat-gas-cair). Beberapa hal sangat kinetika reaksi heterogen (padat-cair, gas-cair, dan padat-gas-cair). Beberapa hal sangat penting untuk disiapkan sebelum mempelajari tentang kinetika reaksi kimia homogen dan penting untuk disiapkan sebelum mempelajari tentang kinetika reaksi kimia homogen dan heterogen, diantaranya: menyusun persamaan reaksi dengan katalis, menyelesaikan heterogen, diantaranya: menyusun persamaan reaksi dengan katalis, menyelesaikan persamaan diferensial secara numeris,
persamaan diferensial secara numeris, menganalisis mekanisme perpindahan massa danmenganalisis mekanisme perpindahan massa dan reaksi kimia, dan menentukan tahapan yang mengontrol reaksi kimia dengan katalis.
reaksi kimia, dan menentukan tahapan yang mengontrol reaksi kimia dengan katalis. Adapun tinjau
Adapun tinjauan mata kuliaan mata kuliah dapat ditulih dapat dituliskan sebaskan sebagai berikut.gai berikut.
A. Deskripsi Singkat Mata kuliah A. Deskripsi Singkat Mata kuliah
Bagian-bagian yang akan dipelajari meliputi katalis, fungsi dan mekanisme reaksi dengan Bagian-bagian yang akan dipelajari meliputi katalis, fungsi dan mekanisme reaksi dengan katalis, kinetika reaksi dengan katalis cair-cair, kinetika reaksi dengan katalis padat-cair, katalis, kinetika reaksi dengan katalis cair-cair, kinetika reaksi dengan katalis padat-cair, kinetika reaksi dengan katalis gas-cair, dan kinetika reaksi dengan katalis padat-gas-cair. kinetika reaksi dengan katalis gas-cair, dan kinetika reaksi dengan katalis padat-gas-cair.
B. Kegunaan Mata kuliah B. Kegunaan Mata kuliah
Buju ajar ini berguna sebagai buku panduan mahasiswa dalam mata kuliah Reaktor dan Buju ajar ini berguna sebagai buku panduan mahasiswa dalam mata kuliah Reaktor dan Katalis. Melalui buku ajar ini mahasiswa diharapkan dapat menyusun persamaan Katalis. Melalui buku ajar ini mahasiswa diharapkan dapat menyusun persamaan matematika sesuai mekanisme reaksi dan
matematika sesuai mekanisme reaksi dan menghitung parameter perpindahan massa danmenghitung parameter perpindahan massa dan reaksi kimianya serta menganalisis manakah mekanisme yang
C. Standar Kompetensi Mata kuliah
Menyusun persamaan kinetika reaksi dengan katalis, menyelesaikannya, dan menganalisis mekanisme yang mengontrol.
Bagian-bagian tersebut di atas akan dikemas untuk mengantarkan mahasiswa menguasai perhitungan kinetika reaksi homogeny dan heterogen dan melakukan analisis. Tidak hanya suatu usaha yang membutuhkan modal dasar, pemahaman materi kuliah juga memerlukan modal dasar, yang salah satunya adalah memahami materi sebelumnya yang berkaitan dengan materi yang akan diajarkan.
BAB 1. KATALISATOR
Katalisator mempunyai kontribusi, yang dapat dilihat pada Tabel 1, yang sangat besar pada berbagai bidang terutama di dalam industri kimia. Membeli, menggunakan, dan mengganti katalisator yang digunakan di dalam suatu proses produksi adalah yang dilakukan oleh industri di Indonesia. Hal ini disebabkan karena sampai saat ini peranan dan fungsi katalisator di dalam reaksi terutama di Indonesia baru pada tahap hafalan terhadap definisi klasik katalisator, maka dipandang sangat membantu untuk membicarakan pula contoh –contoh katalisator di dalam industri.
Tabel 1. Awal penggunaan katalisator di dalam industir, 1935-1976
Tahun Pertama Katalisator Bidang Industri
1936 Katalisator Perengkah Petroleum
1941 Teknologi Fluid - bed Petroleum dan Petrokimia 1942 Katalisator Perengkah
Thermofor
Petroleum
1942 Alkilasi Parafin Petroleum
1950 Katalisator Reforming Nafta (Katalisator Pt)
Petroleum
1955 Katalisator Polimerisasi Ziegler - Natta
Polimer
1960 Asetaldehida dari asetilena Kemikalia
1963 Sintesis Amonia Pupuk
1964 Katalisator Zeolit Petroleum dan Petrokimia
1964 Oksiklorinasi Monomer
1966 Disproporsionasi Petrokimia
1967 Katalis Logam ganda Petroleum
1976 Katalis Kontrol Emisi Automotif
Sebelum proses katalitik dikomersilkan, banyak dilakukan penelitian tentang pengembangan reaksi katalitik yang dilakukan di dalam reaktor kimia. Dengan demikian sifat-sifat reaktor juga harus diketahui bagaimana dan untuk apa reaktor digunakan serta bagaimana menginterpretasikan hasil yang diperoleh.
1. Kecepatan reaksi
Dua alasan utama mengapa kecepatan (laju) reaksi dipelajari. Pertama adalah untuk memperkirakan waktu yang diperlukan oleh reaktan berubah menjadi hasil reaksi sampai diperolehnya keadaan kesetimbangan. Waktu yang diperlukan di dalam suatu reaksi dipengaruhi oleh beberapa faktor misalnya suhu, tekanan, dan adanya katalisator. Di dalam suatu proses industry, laju reaksi biasanya diusahakan berlangsung cepat tetapi tidak sangat cepat, sehingga terjadi peledakan. Sedangkan pada proses biologi laju reaksi biasanya dipertahankan untuk berlangsung lambat. Alasan kedua dipelajarinya adalah untuk menentukan mekanisme reaksi. Dengan mengetahui langkah –langkah yang dilalui reaktan untuk menjadi produk, dan peranannya masing-masing maka memungkinkan untuk dilakukan usaha-usaha untuk pengembangannya .
Pada tahun 1838 diketahui bahwa kecepatan reaksi dapat dipengaruhi oleh zat-zat yang mempercepat atau memperlambat reaksi, yang mana zat-zat tersebut akan dilepaskan kembali setelah reaksi selesai, zat-zat semacam itu disebut katalisator. Katalisator yang mempercepat reaksi disebut sebagai katalisator positif (atau katalisator saja), sedangkan katalisator yang menghambat laju reaksi disebut sebagai katalisator negatif atau inhibitor. Dari pengertian-pengertian yang diperoleh pada masa itu disusunlah definisi tentang katalisator.
2. Definisi Klasik Katalisator
Penurunan tenaga pengaktifan reaksi katalisis dapat digambarkan sebagai berikut: YANG MENJADI MASALAH UTAMA ADALAH:
BAGAIMANA KITA MENGARTIKAN DEFINISI KATALISATOR DAN MEMAHAMINYA?
Gambar 8. Tenaga Pengaktifan Reaksi
a. Partisipasi katalisator di dalam reaksi adalah bahwa secara kimiawi katalisator tetap pada akhir reaksi, tetapi sering bentuk fisiknya berubah. Dengan demikian dapat dikatakan bahwa katalisator ikut bereaksi tetapi pada akhir reaksi akan terbentuk lagi.
b. Katalisator tidak mempengaruhi posisi kesetimbangan, tetapi hanya mempercepat dicapainya keadaan kesetimbangan.
c. Katalisator tidak memulai reaksi, tetapi hanya mempercepat reaksi dengan menurunkan tenaga pengaktifan (Gambar 1).
Keterangan Gambar 1
A. Tingkat tenaga reaktan
B. Tingkat tenaga kompleks reaktan teradsorpsi. C. Tingkat tenaga reaktan teradsorpsi.
D. Tingkat tenaga reaksi hasil antara teraktifkan tanpa katalisator. E. Tingkat tenaga hasil antara teraktifkan reaksi dengan katalisator F = E = A
H. Tingkat tenaga hasil reaksi teradsorpsi
I. Tingkat tenaga kompleks hasil reaksi teradsorpsi J. Tingkat tenaga hasil reaksi
Gambar di atas adalah merupakan hubungan antara jalannya reaksi (koordinat reaksi = reaction progress) melawan tenaga untuk reaksi eksotermis. Reaktan dengan tenaga A mendekati katalis dengan melepaskan tenaga yang relatif kecil dan biasanya tidak diperhitungkan. B-x adalah tenaga pengaktifan sorpsi reaktan pada katalisator. C-y adalah tenaga adsorpsi yaitu panas yang dilepaskan pada proses sorpsi reaktan pada katalisator. D-F, tenaga pengaktifan reaksi dengan menggunakan katalisator; E-G, tenaga pengaktifan reaksi tanpa menggunakan katalisator. Ada anggapan bahwa garis D-F dan E-G harus berhimpit, dengan demikian garis-garis D-F adalah bagian dari garis E-G. Anggapan tersebut tidak selalu benar, karena hasil antara reaksi dengan katalisator mungkin berbeda sama sekali. Z-H adalah tenaga desorpsi, yakni tenaga yang diperlukan oleh hasil reaksi untuk melepaskan diri dari katalisator. I-g adalah tenaga pengaktifan difusi yang mungkin sangat kecil sehingga biasanya diabaikan. Sedangkan H adalah panas reaksi yang di dalam hal ini berarti panas yang dilepaskan oleh reaksi yang bersangkutan.
Biasanya reaksi katalisis melibatkan katalisator homogen atau katalisator heterogen. Katalisator heterogen berarti bahwa fasa katalisator berbeda dengan fasa reaktan sedangkan katalisator homogen fasa katalisator sama dengan fasa reaktan. Contoh katalisis heterogen yang melibatkan katalisator padat adalah besi sebagai katalisator sintesis amonia dari gas hidrogen dan gas nitrogen. Sedangkan katalisis homogen adalah pada reaksi belerang dioksida dengan gas oksigen menghasilkan SO3 dengan menggunakan katalisator
nitrogen monoksida.
3. Mekanisme katalisis
Suatu bahan untuk dapat menjalankan fungsinya, maka harus b erinteraksi dengan reaktan. Dimisalkan reaksi antara molekul A dengan molekul B pada permukaan katalisator.
Gambar 2. Perubahan Tingkat Tenaga Pereaksi untuk Reaksi dengan Intermediate Rigid
Untuk terjadinya reaksi antara molekul A dengan molekul B maka kedua molekul harus bertemu. Kalau kedua molekul sudah bertemu maka tidak otomatis reaksi terjadi. Agar reaksi dapat terjadi maka kedua reaktan tersebut harus mempunyai tenaga yang cukup untuk melewati tingkatan tenaga tertentu (tenaga pengaktifan). Fungsi pertama katalisator di dalam reaksi ini adalah menyediakan situs aktif untuk mempertemukan kedua reaktan. Fungsi yang kedua adalah menyumbangkan tenaga dalam bentuk panas sehingga kontribusi ini akan memudahkan molekul reaktan untuk melewati tenaga pengaktifan. Kontribusi panas ini adalah sebagai akibat dari proses difusi dan adsorpsi. Dengan pengertian tersebut maka penurunan tenaga pengaktifan terjadi sebagai berikut.
Identik dengan gambar tersebut maka proses inhibisi dapat diterangkan. Reaktan yang mengalami stabilisasi (tingkat tenaga diturunkan) dengan demikian tenaga pengaktifan menjadi lebih tinggi. Keadaan kesetimbangan mengandung arti bahwa laju reaksi reaktan menjadi hasil reaksi sama dengan laju reaksi produk menjadi reaktan. Di dalam suatu eksperimen, keadaan kesetimbangan kadang memerlukan waktu yang sangat lama, sehingga yang teramati adalah bahwa katalisator dapat memulai reaksi. Hal ini ditunjukkan oleh diperolehnya hasil reaksi dengan menggunakan katalisator dan tidak diperolehnya hasil reaksi dengan menggunakan katalisator dan tidak diperolehnya suatu hasil reaksi tanpa menggunakan katalisator. Dengan hasil percobaan tersebut juga tampak bahwa katalisator mempengaruhi kesetimbangan. Dengan definisi klasik tentang katalisator dan contoh data
percobaan tersebut maka menghafalkan definisi tentang katalisator menjadi tidak penting. Yang paling penting adalah mengerti dan memahami proses-proses yang terjadi pada katalisator. Para ahli katalisator dewasa ini pada tahapan perolehan material/bahan katalisator yang aktif, selektif, dan murah.
a. Situs aktif
Pada permukaan katalisator terdapat situs aktif yang berfungsi sebagai tempat di mana molekul-molekul reaktan teradsorpsi dan teraktivasi. Karena sangat vitalnya fungsi situs aktif maka di dalam suatu proses perlu diusahakan agar supaya di dalam setiap satu satuan berat terdapat situs aktif yang sebanyak-banyaknya. Usaha ini dapat dilakukan dengan memperluas permukaan katalisator. Perluasan katalisator dapat dilakukan dengan membuatnya di dalam suatu sistem larutan atau dengan membuat ukuran partikel yang sekecil mungkin.
b. Difusi
Perpindahan elektron di dalam suatu atom dari suatu tingkat tenaga tertentu ke tingkatan tenaga yang lain selalu disertai dengan perubahan tenaga. Perpindahan elektron menjauh dari inti diperlukan tenaga sedangkan perpindahan elektron mendekati inti dilepaskan tenaga. Mengacu kepada pengertian tersebut maka gerakan/perpindahan molekul reaktan mendekati permukaan katalisator juga melepaskan tenaga.
c. Adsorpsi
Atom-atom di permukaan tidak mempunyai tetangga yang lengkap, bilangan koordinasinya lebih kecil daripada atom-atom di dalam bulk sehingga terdapat gaya tak terimbangi di permukaan dengan resultan gaya ke dalam. Hal ini merupakan fenomena gaya permukaan, yang berhubungan dengan tegangan permukaan pada sistem cair. Adsorpsi adalah merupakan hasil dari interaksi molekul dengan valensi-valensi bebas, yang boleh diartikan sebagai reaksi kimia karena menyangkut perubahan susunan elektron di dalam molekul. Adsorpsi semacam ini biasa disebut sebagai adsorpsi kimia atau kemisorpsi.
Bentuk adsorpsi yang lain adalah sebagai konsekuensi dari gaya van der Waals seperti halnya antar molekul-molekul itu sendiri. Hal ini menyangkut gaya tarik-menarik
elektrostatis antar molekul. Bila gaya ini terjadi antara atom atau molekul dengan permukaan maka yang terjadi adalah hanya gaya tarik-menarik secara fisika tanpa disertai perubahan kimia. Adsorpsi semacam ini disebut sebagai adsorpsi fisika atau fisisorpsi.
Pada reaksi yang melibatkan katalisator hanya adsorpsi kimia yang dapat menghasilkan reaksi. Panas yang dilepaskan adsorpsi kimia ini biasanya berkisar antara 800 kJ/mol. Untuk adsorpsi fisika, harga ini sama dengan panas pencairan atau penguapan yang biasanya kurang dari 20 kJ/mol. Dari keterangan tersebut jelaslah bahwa katalisator ikut bereaksi.
Adsorpsi tidak hanya terjadi antara reaktan dengan katalisator tetapi juga terjadi antara hasil reaksi baik hasil utama maupun hasil samping. Proses melepasnya kembali molekul teradsorpsi (adsorbat) dari permukaan pengadsorpsi (adsorben) disebut sebagai desorpsi. Desorpsi memerlukan panas atau pemvakuman atau keduanya. Pemanasan untuk mendesorpsi tidak boleh dilakukan pada suhu tinggi karena akan merubah struktur katalisator. Dengan demikian desorpsi dengan pemvakuman pada suhu rendah menghasilkan katalisator yang mengikat secara kimia baik reaktan maupun hasil reaksi. Sedangkan pemvakuman pada suhu tinggi terhadap katalisator setelah reaksi akan dihasilkan struktur katalisator yang berbeda dengan katalisator awal. Dengan keterangan tersebut maka beralasan pula untuk mengatakan bahwa katalisator dilepaskan kembali bukan dalam bentuk senyawaan kimia aslinya.
4. Inhibitor
Di dalam suatu proses produksi untuk mendapatkan reaksi yang benar-benar selektif (100% hasil yang diharapkan). Hasil samping biasanya menyertai reaksi. Hasil samping suatu reaksi kadang merupakan hasil yang harus dicegah untuk keluar bersama-sama dengan hasil utama yang diharapkan. Di dalam ilmu katalisator, ilmu tentang kimia permukaan mutlak perlu untuk dipelajari. Dengan mempelajari kimia permukaan maka akan dapat ditentukan jumlah dan macam situs aktif yang ada di permukaan katalisator dan interaksi yang terjadi dengan molekul-molekul reaktan, hasil antara dan hasil akhir yang kemudian akan dapat ditentukan sifat-sifat reaksi yang dapat terjadi. Kalau ikatan suatu molekul distabilkan oleh adsorpsi pada permukaan suatu bahan maka reaksi akan lebih sulit terjadi dan dengan demikian bahan tersebut akan menghambat reaksi. Bahan yang bersifat
demikian disebut inhibitor. Yang lebih sering terjadi adalah suatu bahan ditambahkan kepada suatu katalisator untuk mendeaktivasi situs yang aktif menghasilkan produk samping. Hal ini biasa dilakukan dengan penutupan (blocking) situs di permukaan.
5. Katalisis di dalam Industri a. Penggunaan Katalisator
Katalisator mempunyai kontribusi yang sangat besar terhadap industri kimia. Contoh proses industri yang menggunakan katalisator sebagai bahan pendukung yang sangat penting adalah misalnya:
i. Di dalam pabrik pupuk
Hidrogenasi katalitik berdasarkan aktivasi dinitrogen molekuler adalah merupakan kunci dari proses ini.
ii. Di dalam pengolahan minyak
Banyak proses di dalam pengolahan minyak mentah menjadi bahan bakar yang hampir semuanya menggunakan bantuan katalisator.
RINGKASAN
Katalisator mempunyai kontribusi yang sangat besar pada berbagai bidang terutama di dalam industri kimia. Kontribusinya dapat dilihat pada kecepatan suatu reaksi. Zat-zat yang mempercepat atau memperlambat reaksi, dan akan dilepaskan kembali setelah reaksi selesai disebut katalisator. Katalisator yang mempercepat reaksi disebut sebagai katalisator positif (atau katalisator saja), sedangkan katalisator yang menghambat laju reaksi disebut sebagai katalisator negatif atau inhibitor. Sifat-sifat katalisator di antaranya tidak mempengaruhi posisi kesetimbangan, tetapi hanya mempercepat dicapainya keadaan kesetimbangan dan katalisator tidak memulai reaksi, tetapi hanya mempercepat reaksi dengan menurunkan tenaga pengaktifan. Reaksi dengan katalisis dibedakan menjadi katalisator homogen atau katalisator heterogen. Katalisator heterogen berarti bahwa fasa katalisator berbeda dengan fasa reaktan, sedangkan katalisator homogen fasa katalisator sama dengan fasa reaktan.
LATIHAN SOAL PENDALAMAN
Diskusikan pertanyaan di bawah ini dan buatlah resumnya!
1. Suatu reaksi kimia dapat dipercepat reaksinya juga dapat mengalami perlambatan. Bagaimanakah caranya untuk mempercepat reaksi dan bagaimana prinsip kerjanya sehingga dapat mempercepat reaksi?
2. Bagaimanakah perbedaan kinerja katalisator pada reaksi homogen dengan reaksi heterogen?
3. Bagaimanakah peranan katalisator pada industri pembuatan pupuk? Susunlah pathway reaction untuk reaksi-reaksi yang terlibat pada pembuatan pupuk! 4. Bagaimanakah peranan katalisator pada industri pengolahan minyak? Susunlah
BAB 2. DESAIN KATALISATOR DENGAN ZEOLIT
Zeolit dapat dipandang sebagai padatan yang analog dengan asam klasik seperti asam sulfat atau alumunium klorida. Senyawa-senyawa ini mempunyai kemampuan untuk mempromosikan sejumlah reaksi yang dikatalisis oleh asam, termasuk polimerisasi, perengkahan, isomerasi olefin, parafin dan aromatis, alkilasi aromatis dan parafin, transalkilasi dan lain-lain. Penggunaan sebagai katalisator perengkah adalah yang paling biasa dilakukan.
Katalisator asam padatan yang pertama kali digunakan adalah lempung alam teraktivasi dan oksida biner sintetis seperti alumina-silika. Sifat-sifat asamnya telah banyak diteliti. Zeolit mempunyai sistem pori yang mendekati seragam dan mempunyai luas permukaan dalam yang besar. Ada 34 jenis zeolit yang diantaranya aktif untuk katalisator. Sampai sekarang terdapat lebih dari 100 macam zeolit sintetis dengan struktur kerangka yang berbeda - beda dengan ukuran pori antara 0,5 sampai 1 nm.
Di dalam proses katalisis heterogen yang harus ditinjau yaitu aktivas selektivitas terhadap satu diantara produk dan stabilitas operasi yakni berhubungan dengan waktu hidup katalisator. Sifat-sifat ini sangat kompleks yang melibatkan tenaga adsorpsi dan reaktan, intermediate, dan produk, laju transport molekul dari dan ke situs aktif, difusi molekul, dan aktivitas intrinsik untuk berbagai reaksi.
Dengan demikian teknik molekuler dalam desain katalisator zeolit merupakan penggabungan permasalahan antara reaksi kimia dengan sifat-sifat adsorpsi dan difusi zeolit, termasuk efek molecular shieves (saringan molekuler) untuk merubah jalan reaksi dan selektivitas produk kimia tertentu.
Hal yang perlu diperhatikan dalam desain katalisator diantaranya adalah: a. Manipulasi bentuk dan ukuran kristal
b. Sifat sistem channel c. Bentuk dan ukuran pori d. Sifat dan jumlah situs aktif
Sifat-sifat katalisator yang perlu ditentukan adalah komposisi dari struktur katalisator, sifat-sifat adsorbsi dan difusi. Aktivitas katalitik intrinsik dan aplikasinya.
7,4 Ao
1. Klasifikasi Zeolit
Zeolit adalah tektosilikat, kerangka 3 dimensi tersusun atas tetrahidral TO 4 (T = Si
atau heteroatom), di mana setiap dari empat atom oksigen digunakan untuk bergabung antara dua tetrahedron. Bentuk yang paling umum adalah alumunosilikat. Walaupun demikian struktur yang mengandung boron, gallium, atau besi pada alumunium dan germanium pada tempat yang seharusnya ditempati silikon juga memungkinkan. Walaupun lebih dari 100 macam zeolit telah disintesis namun yang sudah diketahui struktur kristalnya baru sekitar 50 macam.
Struktur karakteristik yang paling menarik untuk katalisis adalah sistem kanal, yang dilukiskan untuk beberapa zeolit yang penting dalam Tabel 2. Berdasarkan pada besarnya channel, zeolit dibedakan sebagai zeolit dengan pori kecil, medium, dan besar. Yakni apabila tersusun atas 8, 10, atau 12 cincin yang dihubungkan oleh tetrahedral. Struktur kerangka dan pori zeolit representatif dari setiap grup ditunjukkan pada Gambar 3. Di dalam setiap grup ada variasi lubang baik dalam ukuran maupun eliptisitasnya. Misalnya, pembukaan pada linda A adalah bulat dengan (4,1 A) sedangkan pada arionit adalah elips (3,6 x 5,2 A).
Projeksi satu seri zeolit sejenis (Gambar 4) menunjukkan banyaknya variasi dimensi kanal dan juga bentuknya. Sistem kanal mungkin satu dimensi, misalnya Z SM –48, dan dimensi seperti farierit, atau tiga dimensi pada Z SM –5 (Gambar 5). Kanal multidimensi sering saling memotong antara yang satu dengan yang lain, tetapi tidak selalu demikian. Interkoneksi kanal dapat terjadi antara ukuran yang sama (misalnya Fanjasit) atau yang lebih kecil (ferriete), mungkin lurus (Z SM –11) atau tortuous (Z SM –5). Konektivitas sistem kanal mempunyai konsekuensi utama terhadap difusivitas dan aging . Misalnya zeolit dengan kanal satu dimensi merupakan yang lebih potensial terhadap diaktivasi dibandingkan dengan sistem pori tiga.
Ring 8 Ring 10 Ring 12
Gambar 3. ZEOLIT – A Gambar 4. ZEOLIT PENTASIL Gambar 5. ZEOLIT-Y
4,1 A0
Dimensi pori untuk zeolit yang banyak dituliskan di dalam literatur didasarkan atas dasar kristalografi yang hanya merupakan harga nominal. Biasanya molekul dengan ukuran 1 A sangat mudah untuk berdifusi khususnya pada suhu tinggi. Zeolit dengan anggota hanya 8 cincin hanya mengadsorbsi molekul rantai lurus misalnya n-parafin, n-alafin, dan alkohol-alkohol primer. Zeolit dengan pori yang lebih tinggi juga mempunyai sifat seperti halnya zeolit dengan pori kecil kalau dalam strukturnya mengalami banyak gangguan, seperti pada gelinite, stilbite, dakiardit, linda T, ZSM-34, apistilbite, heulandite/clinoptilolite, ferierite, dan sebagainya.
Zeolit dengan anggota 10 cincin baik digunakan untuk desain katalisator yang selektif bentuk. Katalis ini bukan hanya menyerap molekul-molekul rantai lurus tetapi juga mendeskriminasikan baik dengan eksklusif ukuran dan dengan laju difusi antara variasi cabang dan molekul linier. Termasuk dalam group ini ZSM-5, ZSM-11, ZSM-22, ZSM-23, dan ZSM-48.
Tabel 2. Contraint Index (C.I) untuk katalisator pada 316 oC
Zeolit dengan anggota 12-ring mencakup zeolit dengan pori besar. Faujasit sintetis, zeolit X dan Y mordenit. Laju relatif perengkahan n-heksana dan 3-metilpentana mendefinisikan “Constraint Index”, yang lebih kecil sebesar 1 sampai 2 untuk zeolit dengan pori besar, antara 2-12 untuk perindium dan >12 untuk zeolit dengan pori kecil (Tabel 2). Perbandingan sillika dan alumina di dalam setiap group dapat bervariasi, khususnya untuk zeolit dengan pori medium. Dengan demikian seleksi katalisator akan menemukan variasi
Katalisator C.I ZSM - 5 8,3 ZSM 11 8,7 ZSM - 12 2,3 TMA affrete 3,7 Beta 0,6 ZSM - 4 (mazzite) 0,5 H - zealon (mordenite) 0,5 REY 0,4
Silika - alumina amorf 0,6
katalisator yang sangat besar. Lagi pula ukuran kristal beberapa zeolit dapat dibuat 2 sampai 3 kali dengan sintesis.
2. Preparasi katalisator logam terdispersi
Cara yang paling sering digunakan untuk mendispersikan logam kepada bahan pengemban adalah dengan cara impregnasi dengan larutan garam logam dan pertukaran ion dengan kation atau anion yang mengandung logam. Yang akan dibicarakan saat ini adalah interaksi yang terjadi pertukaran logam dengan pengemban dan bagaimana interaksi merubah sifat-sifat katalisator tereduksi. Impregnasi pengemban dengan larutan garam logam adalah cara yang paling mudah untuk memasukkan logam prekursor. Pengeringan terhadap larutan menghasilkan pengendapan partikel-partikel kecil garam ke dalam permukaan pengemban. Interaksi antara komponen garam dengan pengemban kecil. Sebagai akibatnya selama kalsinasi dan/atau reduksi akan terjadi migrasi dan sintering logam sehingga dispersi tinggi sulit dicapai.
Interaksi yang jauh lebih kuat dengan pengemban akan terjadi bila kondisi dipilih untuk mencapai pertukaran ion antara logam prekursor dan pengemban. Sampai di mana pertukaran ion dapat dicapai bergantung pada komposisi pengemban dan pH larutan. Seperti pada reaksi 1, gugus hidroksil pada permukaan pengemban merupakan fungsi asam Bronsted atau basa Bronsted, bergantung pada pH.
S+(s) > S+OH - (s) > S+O2 - (s) > (1)
Kecenderungan oksida untuk menjadi bermuatan negatif atau positif merupakan fungsi komposisi yang dapat ditunjukkan oleh pH yang diperlukan untuk mencapai muatan total permukaan nol, seperti pada Tabel 3, yang menunjukkan bahwa pada pH tertentu, SiO dan TiO lebih mudah melepas proton dari Al2O3 atau MgO.
Tabel 3. Harga pH dimana dicapai muatan permukaan nol untuk beberapa oksida dalam lingkungan air
Bahan pH muatan permukaan nol Silika 2(b) (b)densitas muatan sangat
kecil pada pH < 6 Alumina 9 Krom 7 Titania 5 Eirkonia 4 - 7 Magnesia 12
Pertukaran ion logam di dalam larutan air dengan pengemban dapat dilukiskan dengan reaksi:
nS+OH-(s) + Mn+(as) + aOH - > [S+O2- ]nMn+(s)+ n H2O (2)
dari sifat reaksi ini, maka reaksi akan meningkat dengan semakin tingginya pH. Dengan beberapa logam, pH dapat ditinggikan dengan menggunakan amonia cair agar larutan bersifat basis, ion amonia logam terbentuk dan teradsorpsi. Cara lain adalah dengan menggunakan logam alkali atau ion logam alkali pada pH tinggi. Setelah itu dicuci untuk menghilangkan kelebihan larutan, ion alkali, dan alkali tanah ditukar dengan logam yang lain pada daerah pH netral.
RINGKASAN
Desain katalisator padat sering menggunakan zeolit, merupakan senyawa yang analog dengan asam sulfat atau aluminium klorida. Senyawa-senyawa ini mempunyai kemampuan untuk mempromosikan sejumlah reaksi yang dikatalisis oleh asam. Selain itu, zeolit mempunyai sistem pori yang mendekati seragam dan mempunyai luas permukaan dalam yang besar. Sifat-sifat adsorbsi dan difusi dan jenis preparasi pada zeolit sangat penting untuk dipelajari guna menentukan aktivitas katalitik intrinsik dan aplikasinya.
LATIHAN SOAL PENDALAMAN
1. Diskusikan tentang peranan zeolit dalam desain dan sebagai katalisator itu sendiri! 2. Buatlah karya ilmiah tentang zeolit sebagai tugas kelompok dengan ketentuan
sebagai berikut:
- Kelompok terdiri dari 3 mahasiswa
- Karya ilmiah diketik dengan format kertas ukuran A4, font 12, dan spasi 1,5, maksimal 5 halaman
BAB 3. DEAKTIFASI KATALISATOR
Pada pembicaraan reaksi –reaksi dengan katalisator padat, dianggap bahwa effectiveness factor nilainya tetap. Dalam praktek sering hal ini tidak benar. Aktifitas katalisator menurun dengan waktu pada waktu dipakai. Kadang-kadang, aktifitasnya menurun dengan sangat cepat; kadang-kadang penurunannya sangat lambat sekali, sehingga penggantian katalisator dilakukan setelah operasinya berjalan beberapa tahun. Dalam beberapa hal penggantian katalisator perlu dilakukan dari waktu ke waktu yang relatif singkat.
Jika deaktifasi sangat cepat dan menyebabkan suatu pengendapan dan pemblokan fisis pada permukaan katalisator maka proses ini disebut “fouling”. Penghilangan padatan ini disebut dengan “regeneration”. Pengendapan karbon selama catalytic cracking adalah suatu contoh proses fouling.
C12H22 C5H12 + C4H10+ C mengendap pada permukaan (3)
Jika permukaan katalisator mengalami perubahan karena terjadi chemisorption maka proses ini disebut poisoning. Pengaktifan kembali katalisator yang mengalami proses poisoning disebut reactivation. Jika proses reversible maka dengan merubah keadaan operasi mungkin sudah cukup untuk proses reactivation. Jika proses adsorpsi irreversible maka deaktifasi menjadi permanent (permanent poisoning). Dalam hal ini diperlukan proses kimia untuk mengaktifkan kembali katalisator yang mengalami keracunan atau harus diganti dengan yang baru.
Deaktifasi dapat merata di seluruh permukaan atau pada tempat-tempat tertentu dan umumnya yang terserang adalah permukaan yang paling aktif.
Pada bagian ini akan di bahas bergantian adalah:
a. Mekanisme deaktifasi katalisator (mechanism of catalyst decay) b. Bentuk persamaan kecepatan
c. Pengembangan persamaan kecepatan berdasarkan data percobaan d. Mendapatkan mekanisme deaktifasi berdasarkan data percobaan e. Pengaruhnya pada perancangan
1.1. MEKANISME DEAKTIFASI KATALISATOR
Deaktifasi katalisator porus yang teramati tergantung pada beberapa faktor antara lain: (1) deaktifasi sesungguhnya yang terjadi, (2) ada tidaknya difusi komponen yang terlibat pada sistem (misalnya reaktan, produk, dan racun) pada pore, (3) cara racun mempengaruhi permukaan.
1. Deaktifasi sesungguhnya Deaktifasi dapat terjadi melalui 4 cara:
(a) Terbentuk hasil yang terserap pada permukaan dan mengakibatkan terjadinya penurunan aktifitas. Proses ini disebut parallel deactivation. (b) Hasil terurai lebih lanjut sehingga membentuk hasil yang terserap pada
permukaan katalisator dan mengakibatkan terjadinya deaktifasi katalisator. Proses ini disebut series deactivation.
(c) Impurities pada umpan dapat merupakan racun terhadap katalisator dan proses ini disebut side-by-side deactivation.
(d) Terjadinya modifikasi struktur atau sintering katalisator pada kondisi yang sangat ekstrem. Misalnya pada suhu yang sangat tinggi dan dalam waktu yang relatif lama. Proses ini disebut indepent deactivation.
Parallel deactivation: R A R + P atau A (4) P Series deactivation: A R P (5)
Side – by – side deactivation:
A R (6)
Perbedaan utama ketiga diaktifasi ini terletak pada cara pengendapan racun pada permukaan katalisator. Apakah tergantung pada konsentrasi reaktan, hasil, dan zat-zat lainnya di dalam umpan. Karena distribusi zat-zat ini merupakan fungsi posisi pada pellet maka lokasi deaktifasi tergantung pada dimana terjadi proses deaktifasi.
Pore difussion dapat sangat berpengaruh terhadap kemajuan deaktifasi. Pertimbangkanlah suatu parallel deactivation. Reaktan dapat terdistribusi merata di dalam pellet (mL < 1 dan s = 1) atau mungkin hanya berada dekat pada permukaan saja (mL > 1 dan s < 1). Jadi poisoning terjadi merata di seluruh bagian pellet bila tidak ada hambatan pore diffusional dan terjadi poisoning pada permukaan luar jika hambatan pore diffusional mengontrol proses yang terjadi. Jika hambatan pore diffusional sangat dominan maka akan terbentuk thin cell pada bagian luar katalisator. Tebal shell makin tebal dengan bertambahnya waktu reaksi dan front bergerak ke dalam. Ini disebut the shell model for poisoning.
Sebaliknya, pertimbangkanlah series deactivation. Dalam hal hambatan pore diffusional yang menentukan, konsentrasi R lebih tinggi pada pellet dibandingkan dengan di permukaan. Karena R merupakan sumber racun, maka pengendapan R di dalam pellet mempunyai konsentrasi yang lebih tinggi dibandingkan konsentrasi R pada permukaan. Sehingga poisoning terjadi dari dalam pellet ke permukaan pellet.
Sekarang pertimbangkanlah side-by-side deactivation. Poison pada umpan yang bereaksi dengan permukaan akan menentukan proses pengendapan atau proses deaktifasi. Untuk nilai konstanta kecepatan reaksi kecil, penetrasi racun ke dalam pellet akan merata dan deaktifasi semua elemen permukaan katalisator terjadi dengan cara yang sama. Untuk nilai konstanta kecepatan deaktifasi besar, keracunan terjadi pada permukaan luar pellet begitu racun mencapai permukaan.
1.2. BENTUK PERMUKAAN YANG TERSERANG RACUN
Pertimbangkanlah suatu elemen pada permukaan aktif yang berada pada suatu gas yang sangat reaktif. Permukaan aktif mungkin terserang merata di seluruh permukaan dan dapat juga terserang pada tempat –tempat tertentu saja. Jika terserang merata disebut homogeneous site attack dan jika penyerangan tidak merata disebut prefrential site attack .
Homogeneous site attack diwakili oleh physical deposition pada permukaan, seperti fouling . Sebaliknya, prefrential site attack akan terjadi pada chemisorption racun yang jumlahnya sangat sedikit. Pada homogeneous site attack , jika physical deposition menghasilkan porous layer aktifitas katalisator menurun secara pelan –pelan sementara reaktan akan mengalami hambatan untuk mendifusi melalui layer ini.
Faktor lain yang Mempengaruhi Deaktifasi
Beberapa faktor lain yang mempengaruhi deaktifasi antara lain:
a. Mulut pori yang tertutup (pore mouth blocking) karena tertutup oleh solid b. Kesetimbangan atau reversible poisoning dimana selalu ada permukaan aktif c. Pengaruh regenerasi (sering menyebabkan permukaan aktif hanya bagian luar
sedangkan bagian dalam tetap tidak aktif).
RANGKUMAN
Aktifitas katalisator menurun seiring dengan waktu pada saat digunakan, kadang-kadang menurun dengat sangat cepat; kadang-kadang sangat lambat. Hal ini mengakibatkan katalisator perlu untuk diganti. Katalisator dapat dideaktifasi jika akan digunakan kembali. Deaktifitas katalisator poros yang teramati tergantung beberapa faktor antara lain: (1) deaktifasi sesungguhnya yang terjadi, (2) ada tidaknya difusi komponen yang terlibat pada sistem; dan (3) cara senyawa lain mempengaruhi kinerja di permukaan.
LATIHAN SOAL PENDALAMAN
Buatlah karya ilmiah tentang deaktifasi katalisator sebagai tugas kelompok dengan ketentuan sebagai berikut:
- Kelompok terdiri dari 3 mahasiswa
- Karya ilmiah diketik dengan format kertas ukuran A4, font 12, dan spasi 1,5, maksimal 5 halaman
BAB IV. KINETIKA REAKSI KATALIS CAIR-CAIR
Reaksi dengan katalis ada dua jenis, yaitu reaksi homogen dan heterogen. Disebut reaksi homogen sering karena reaktan dan katalisator memiliki fase yang sama. Sebaliknya, reaksi heterogen karena reaktan dan katalisator tidak memiliki fase yang sama. Reaksi heterogen juga dapat terjadi pada fase sama untuk kondisi khusus. Contoh reaksi homogen gas-gas adalah reaksi pembentukan SO3 dari SO2 dan O2 yang dijalankan pada kondisi
eksotermis dan energi aktivasinya sangat tinggi. Reaksi ini berjalan lambat pada suhu rendah dan sebaliknya pada suhu tinggi kecepatan reaksi akan meningkat, namun yieldnya rendah. Namun, bila ditambahkan dengan katalis oksida nitrit (gas) akan menurunkan energi aktivasi, sehingga reaksi dapat berjalan lebih cepat pada suhu yang tidak terlalu tinggi.
(g) 2SO (g) O (g) SO 2 2
2
catalyst
NO(g)
3 (1)Adapun mekanisme reaksi dengan katalis cair-cair di atas dapat dilihat seperti di bawah ini.
(2) Penyusunan dan penyelesaikan kinetika reaksi yang akan dipelajari pada buku ini adalah cair-cair. Diharapkan dapat dikembangkan sendiri untuk fase lain. Pada reaksi homogen cair-cair, larutan katalis dibedakan antara katalis asam (donor proton/H 3O+) dan
basa (aseptor proton/OH-). Contoh reaksi dengan katalis cair-cair dapat dipelajari dari
hidrolisis selulosa dan hemiselulosa menjadi gula. Mekanisme reaksi hidrolisis dengan menggunakan katalisator asam (donor proton) seperti terlihat pada Gambar 6. Menurut Philipp (1984) mekanisme reaksi hidrolisis didahului oleh ion H+ yang berasal dari katalisator menyerang selulosa, sehingga struktur ikatannya menjadi tidak stabil, akibatnya akan memudahkan selulosa bereaksi dengan air (H2O).
Gambar 6. Mekanisme reaksi hidrolisis dengan katalisator asam (Philipp, 1984)
Sedangkan hidrolisis menggunakan katalisator basa (alkalin) dapat dijelaskan sebagai berikut. Alkaline hydrolysis is a simple, natural process by which complex molecules are broken down into their constituent building blocks by the insertion of ions of water (H 2O), H+,
and OH- between the atoms of the bonds that held those building bocks together. The
process occurs in nature when animal tissues and carcasses are buried in soil of neutral or alkaline pH. In this case, alkaline hydrolysis is aided by the digestive processes of soil organisms. Alkaline hydrolysis also occurs in our small intestines after we eat; the complex molecules of proteins, fats, and nucleic acids are hydrolyzed with the aid of digestive enzymes that function most efficiently at a slightly alkaline pH (~pH8.0 to 8.5). Historically, alkaline hydrolysis has been used to study the chemical structure of biological molecules, to make soaps from animal fats by cooking the fat with lye to release the fatty acids.
Persamaan kecepatan reaksi homogen cair-cair sering dituliskan seperti persamaan berikut. = pseudo order 1 (3) b c a k H O 3 log . log (4)
Persamaan (4) menunjukkan bahwa kecepatan reaksi memiliki hubungan linear terhadap konsentrasi katalis, berarti terhadap pH katalisator. Secara spesifik, pengaruh pH katalisator
terhadap kecepatan reaksi dapat dipelajari pada Gambar 7, untuk reaksi oksimasi aseton pada suhu 25 oC (Pers. 5). Pada Gambar 7 nampak bahwa jenis katalisator asam atau basa
sangat berpengaruh terhadap kecepatan reaksi. Untuk katalisator jenis asam (pada garis putus-putus), kecepatan reaksi mulai menurun pada pH katalisator sekitar 5-6.
(5)
Gambar 7. Pengaruh pH katalisator pada reaksi oksimasi aseton (25 oC)
Kinetika reaksi homogen cair-cair seperti Persamaan (3) dapat diselesaikan menggunakan cara analitis dan numeris. Cara analitis sudah dikenal lama dan mudah digunakan untuk persamaan diferensial sederhana. Namun, cara numeris relatif baru sehingga sering terasa sulit, akan tetapi dapat digunakan untuk persamaan diferensial yang sulit. Salah satu cara numeris yang dapat digunakan adalah Runge-Kutta dan dapat dijabarkan sebagai berikut. Penurunan dari persamaan (3) seperti di bawah ini dan merupakan persamaan diferensial order 1.
= −. (6)
dengan Cr merupakan konsentrasi reaktan yang berkurang dan k merupakan tetapan
satuan waktu adalah sebagai berikut. Nilai konsentrasi reaktan awal (Cr0) tentu diketahui,
kemudian tentukan nilai awal k (k trial) dan hitunglah masing-masing nilai k1, k2, k3, dan k4. Hitunglah nilai Crmenggunakan persamaan (11). Nilai k dicari menggunakan metode curve
fitting sampai diperoleh nilai Cr yang mendekati data percobaan. Nilai k akan berubah karena
perbedaan konsentrasi katalis, sehingga dapat dicari korelasi antara persamaan log k versus log konsentrasi senyawa H3O+, seperti pada Persamaan (4). Masing-masing parameter
pada hubungan konsentrasi katalis dengan konstanta kecepatan reaksi, yaitu a dan b, dapat diperoleh.
x y
t k C t f k 1
1, 1
trial
A0
(7) t k C k t k y t x f k trial A 2 2 , 2 1 0 1 1 1 2 (8) t k C k t k y t x f k trial A 2 2 , 2 2 0 2 1 1 3 (9)
x t y k
t k
C k
t f k 4
1
, 1
3
trial
A0
3
(10)
1 2 3 4
0 2 2 6 1 1 C k k k k yi A (11)Selain Pers. 4, hubungan konsentrasi katalisator dengan konstanta kecepatan reaksi juga diekspresikan seperti pada persamaan berikut. Jadi, konstanta kecepatan reaksi selain dipengaruhi oleh pH katalisator juga dipengaruhi oleh konstanta kesetimbangan asam. Sebagai contoh, pada reaksi dehidrasi asetaldehida dengan katalis asam, pengaruh konstanta kesetimbangan asam terhadap kecepatan reaksi dapat dipelajari pada Gambar 8 dan persamaan reaksinya dituliskan sebagai persamaan (16).
(12)
. log
logk K A const
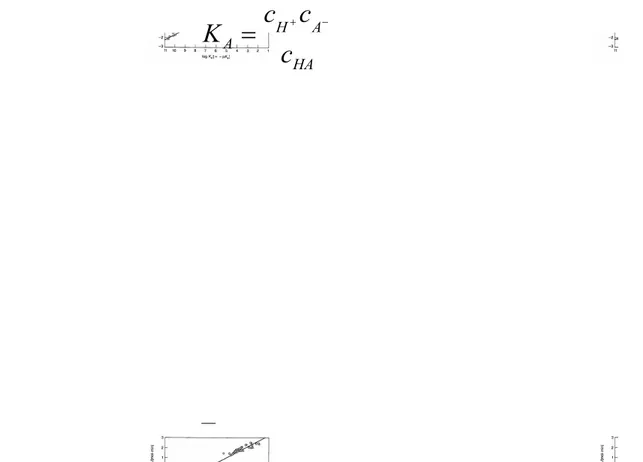
(13) (14) HA r
c
c
k
r
2 nd orderHA A H A
c
c
c
K
(15)Gambar 8. Pengaruh konstanta kesetimbangan asam terhadap konstanta kecepatan reaksi pada dehidrasi asetaldehida
(16) Penyelesaian untuk kasus di atas tentu mirip dengan model kecepatan reaksi homogen cair-cair order satu. Model order 2 ini dicoba bila order satu tidak sesuai dan model ini dapat menggambarkan hubungan konstanta kecepatan reaksi karena variasi jenis katalis (berbeda nilai konstanta kesetimbangan asam). Jadi, nilai k akan berubah karena nilai Ka yang berubah, sementara itu nilai konsentrasi asamnya dimasukkan sebagai faktor pengali reaktan. Untuk lebih jelasnya kita dapat mencobanya dengan mengerjakan soal-soal.
CONTOH SOAL
Susunlah formula perhitungan konsentrasi gula hasil reaksi hidrolisis sekam padi menggunakan asam sulfat sebagai katalisator (homogen cair-cair) mengikuti reaksi berikut (A = bahan baku dan B = gula).
Adapun data konsentrasi gula yang terbentuk pada T reaksi suhu 70 oC dan konsentrasi
asam sulfat 0,6 mol/L dan gula total dalam bahan baku (C A0 = 0,011 mol/L) dapat dilihat
pada Tabel 4.
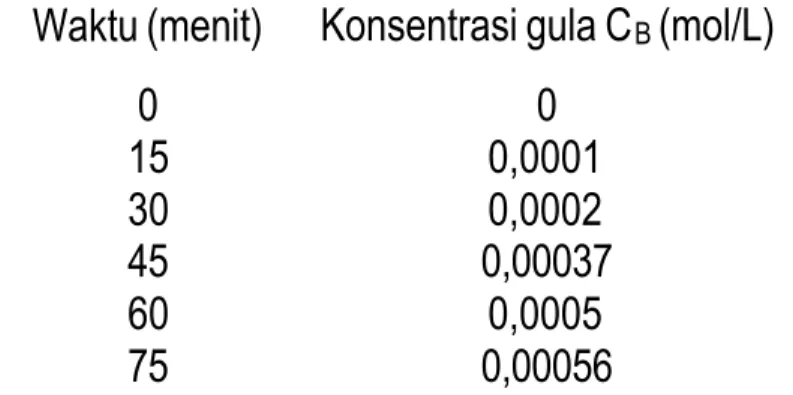
Tabel 4. Konsentrasi gula hasil reaksi hidrolisis dengan katalis cair-cair Waktu (menit) Konsentrasi gula CB(mol/L)
0 0 15 0,0001 30 0,0002 45 0,00037 60 0,0005 75 0,00056 Pengelesaian:
Persamaan neraca massa gula yang terbentuk dapat diekspresikan dari persamaan kecepatan terbentuknya gula yang tahap awal dicoba order 1 dulu, seperti (6) dengan modifikasi (CR diganti CB = konsentrasi gula).
−
=
= . (18)
Karena terbentuknya gula sebanding dengan berkurangnya gula dalam reaktan, maka Persamaan (18) dapat disederhanakan menjadi.
= . (() − ) (19)
= . (0,011 − )
Persamaan (19) sudah dapat diaplikasikan untuk menghitung nilai k pada kondisi tertentu. Hasil perhitungan mendapatkan nilai E = 107.570 J/mol dan A = 1,6.1013 1/menit dan hasil
perhitungan dapat dilihat pada tabel berikut. Sementara itu, hasil perhitungan tersebut diplot seperti pada Gambar 9.
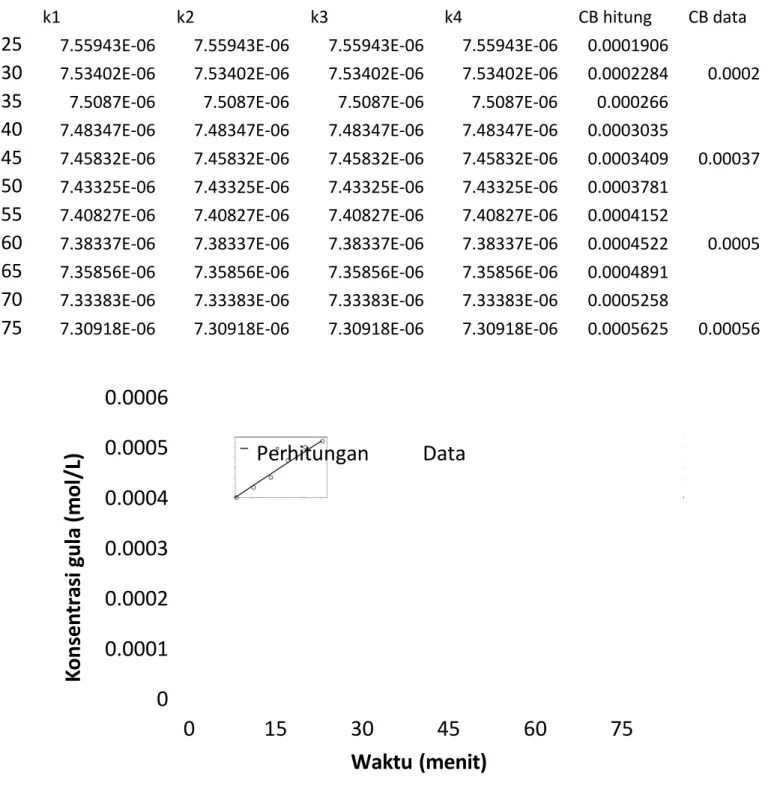
Tabel 5. Hasil perhitungan konsentrasi gula menggunakan Runge-Kutta
k1 k2 k3 k4 CB hitung CB data
0 7.68774E-06 7.68774E-06 7.68774E-06 7.68774E-06 0 0
5 7.6619E-06 7.6619E-06 7.6619E-06 7.6619E-06 3.839E-05
10 7.63616E-06 7.63616E -06 7.63616E-06 7.63616E-06 7.664E-05
15 7.61049E-06 7.61049E-06 7.61049E-06 7.61049E-06 0.0001148 0.0001
k1 k2 k3 k4 CB hitung CB data
25 7.55943E-06 7.55943E-06 7.55943E-06 7.55943E-06 0.0001906
30 7.53402E-06 7.53402E-06 7.53402E-06 7.53402E-06 0.0002284 0.0002
35 7.5087E-06 7.5087E-06 7.5087E-06 7.5087E-06 0.000266
40 7.48347E-06 7.48347E-06 7.48347E-06 7.48347E-06 0.0003035
45 7.45832E-06 7.45832E-06 7.45832E-06 7.45832E-06 0.0003409 0.00037
50 7.43325E-06 7.43325E-06 7.43325E-06 7.43325E-06 0.0003781
55 7.40827E-06 7.40827E-06 7.40827E-06 7.40827E-06 0.0004152
60 7.38337E-06 7.38337E-06 7.38337E-06 7.38337E-06 0.0004522 0.0005
65 7.35856E-06 7.35856E-06 7.35856E-06 7.35856E-06 0.0004891
70 7.33383E-06 7.33383E-06 7.33383E-06 7.33383E-06 0.0005258
75 7.30918E-06 7.30918E-06 7.30918E-06 7.30918E-06 0.0005625 0.00056
Gambar 9. Perbandingan data dan hasil hitungan untuk hidrolisis pada konsentrasi katalisator 0,6 mol/L
Cobalah menggunakan data konsentrasi gula berikut ini, yang dilakukan pada variasi konsentrasi katalis, kemudian carilah korelasi antara konsentrasi katalis dengan nilai k yang diperoleh, seperti pada persamaan (4). Jika asumsi order 1 tidak sesuai, maka dapat mencoba order 2, seperti (12).
Hasil perhitungan parameter konstanta kecepatan reaksi disajikan pada Tabel 6 dan grafik korelasinya dapat dilihat pada Gambar 10. Jadi, persamaan hubungan antara konstanta kecepatan reaksi dengan konsentrasi katalis dinyatakan seperti pada persamaan (20). 0 0.0001 0.0002 0.0003 0.0004 0.0005 0.0006 0 15 30 45 60 75 K o n s e n t r a s i g u l a ( m o l / L ) Waktu (menit) Perhitungan Data
Tabel 5. Konsentrasi gula hasil hidrolisis pada variasi konsentrasi katalisator Konsentrasi katalisator (mol/L) Waktu (menit) Konsentrasi gula (mol/L)
0,3 0 0 15 0,0001 30 0,00018 45 0,000286 60 0,00035 75 0,00044 0,4 0 0 15 0,0001 30 0,00018 45 0,000286 60 0,00035 75 0,00044 0,5 0 0 15 0,0001 30 0,00018 45 0,000286 60 0,00035 75 0,00044
Tabel 6. Nilai k pada variasi konsentrasi katalisator Konsentrasi katalisator (mol/L) k (1/menit)
0,3 0.00052287
0,4 0.00054343
0,5 0.00065673
0,6 0.00067305
Gambar 10. Korelasi k versus konsentrasi katalisator
y = 0.4069x - 3.2009 -3.3 -3.28 -3.26 -3.24 -3.22 -3.2 -3.18 -3.16 -0.3 -0.2 -0.1 0 0.1 l o g k log [H3O+]
RANGKUMAN
Kinetika reaksi kimia dengan katalis dapat didekati menggunakan pendekatan reaksi homogen dan heterogen. Pendekatan homogen karena katalisator memiliki fase yang sama dengan reaktan. Selain itu, kecepatan transfer massa sangat cepat dibandingkan reaksi kimia, sehingga dapat diasumsi sebagai reaksi homogen. Penyelesaian persamaan diferensial dari penurunan neraca massa pada reaksi homogen dapat diselesaikan menggunakan metode Runge-Kutta.
LATIHAN SOAL PENDALAMAN
Selesaikanlah beberapa pertanyaan berikut!
1. Reaksi apakah ini? Bagaimana mekanisme reaksinya? (ramalkanlah) Apakah variabel yang mempengaruhinya? Bagaimana pengaruh variabel tersebut pada reaksinya?
3. Idem juga dengan nomor 2 untuk reaksi berikut. O O O OH OH OH O R1 O R2 O R3 + 3MeOH OH – catalyst + R2COOMe R1COOMe R3COOMe
triglycerides glycerol fatty acid methyl esters
(FAME) used as biodiesel
4. Hitunglah nilai k dan carilah korelasi antara k dengan konsentrasi katalisator untuk reaksi hidrolisis bagas tebu (konsentrasi gula total = 0,0011 mol/L) yang dilakukan pada suhu 80 oC. Adapun data konsentrasi gula hasil seperti tabel berikut.
Konsentrasi katalisator (mol/L) Waktu (menit) Konsentrasi gula (mol/L)
0,3 0 0 15 0,0001 30 0,00018 45 0,000286 60 0,00035 75 0,00044 0,4 0 0 15 0,0001 30 0,00018 45 0,000286 60 0,00035 75 0,00044 0,5 0 0 15 0,0001 30 0,00018 45 0,000286 60 0,00035 75 0,00044 0,6 0 0 15 0,0001 30 0,00018 45 0,000286 60 0,00035 75 0,00044
BAB V. KINETIKA REAKSI KATALIS PADAT-CAIR
Pada pembahasan sebelumnya, tipe reaksi dengan katalisator sudah dipaparkan bahwa salah satu contoh reaksi dengan katalisator heterogen adalah cair dan padat-gas. Most reactions involving liquids and gases use inert metals or metal oxides as catalysts. These solid catalysts provide surface areas for effective molecular to interactions. The solid surface facilitates the breaking and formation of bonds. For examples, Ni, Pd and Pt are often used in the hydrogenation of vegetable oil to make margarine and Crisco oil.
Rates in Heterogeneous Catalysis
Rate with respect to mass or surface area. Jadi, pada reaksi heterogen kecepatan reaksi sering tidak dinyatakan pada tiap volum tapi pada tiap berat katalisator atau luas permukaan katalisator yang digunakan (lihat Gambar 11). Persamaan satuan kecepatan reaksi dengan katalisator padat dapat dilihat pada (1) dan (2). Ternyata tidak semua permukaan katalis merupakan daerah aktif sehingga dapat berperan dalam suatu reaksi, sehingga dikembangkan formula hubungan kecepatan reaksi dengan jumlah situs aktif pada katalisator, seperti Gambar 12 dan persamaan (3).
Gambar 11. Ilustrasi bentuk katalisator
[
.] (1)
[
. 2 ] (2)
Low site density high site density Gambar 12. Ilustrasi adanya situs aktif pada katalisator
Rate with respect to number of active sites
Turnover frequency is the number of molecules formed per active site per second (in a stage of saturation with reactant, i.e. a zero order reaction with respect to the reactant)
1 s s site molecules (3)Reaction Steps in Heterogeneous Catalysis 1. Diffusion of reactant to catalyst
2. Adsorption of reactant on catalyst surface 3. Reaction
4. Desorption of products from catalyst surface 5. Diffusion of products away from catalyst
Jadi, tahapan reaksi katalis padat-cair diawali oleh perpindahan massa terlebih dahulu, baru reaksi kimia, disusul pemisahan produk dari katalisator. Mekanisme ini lebih jelas dapat dilihat pada Gambar 13, 14, dan 15, masing-masing untuk sistem padat-cair, cair-gas, dan padat-gas. Sementara itu, Gambar 16 memberikan ilustrasi secara detail bagaimanakah tahapan mekanisme reaksi dengan katalis heterogen. Kinetika reaksi yang kompleks tentu dapat menggambarkan mekanisme reaksi yang sebenarnya. Namun, penyusunan persamaan matematikan dan penyelesaiannya sangat rumit. Padahal, evaluasi bentuk kinetika suatu reaksi kimia merupakan faktor penting untuk memilih jenis reaktor yang sesuai dan perhitungan desainnya.
Gambar 14. Tahapan reaksi katalis gas-cair
Gambar 15. Tahapan reaksi katalis padat-gas
Selanjutnya, bagaimanakah menyederhanakan tahapan reaksi supaya lebih mudah diselesaikan. Dalam hal ini tentu membutuhkan beberapa asumsi. Langkah 1, 2, 6, dan 7 dapat diabaikan karena tahanan lapisan film dan difusi pada poros katalisator sangat kecil, sehingga dapat diabaikan. Langkah yang sangat penting dievaluasi adalah 3, 4, dan 5, yaitu adsorpsi, reaksi, dan desorpsi. Kecepatan reaksi secara keseluruhan ditentukan oleh langkah yang paling lambat. Terdapat tiga pilihan mekanisme yang mengontrol, yaitu adsorpsi pada permukaan katalisator, reaksi kimia, atau desorpsi produk dari permukaan katalisator. Analisis terhadap model reaksi kimia sudah dipelajari pada mata kuliah Kinetika Reaksi Kimia. Ketiga tahapan tersebut memberikan tahanan total yang analog dengan tahan listrik pada rangkaian alat listrik (Gambar 17). Masing-masing parameter, yaitu tahanan
transfer massa adsorpsi dan reaksi kimia dapat dihitung melalui persamaan matematikan yang sesuai dengan mekanismenya dan data percobaan (Gambar 18).
Gambar 16. Tahapan mekanisme pada reaksi heterogen
Gambar 18. Algoritma menyelesaikan kinetika reaksi heterogen
Terdapat dua pendekatan transfer massa reaktan ke partikel katalisator, yaitu eksternal dan internal transfer massa. Pada pendekatan eksternal, transfer massa hanya terjadi antara reaktan dengan permukaan katalisator dan reaksi terjadi di permukaan katalisator. Sedangkan pada pendekatan internal, transfer massa tidak hanya sampai di permukaan katalis tetapi sampai masuk dalam partikel dan terjadi reaksi, sehingga ada gradien transfer massa dalam partikel padatan (Gambar 19). Untuk lebih jelasnya dijabarkan sebagai berikut.
Interfacial Gradient Effects-Mass transfer bulk of fluid to surface
Case 1: reaction at surface instantaneous global rate controlled through mass transfer “diffusion control”, favored at high T
Case 2: reactant concentration at surface same as in bulk fluid global rate controlled through reaction rate “reaction controlling”, favored at low T and high turbulence
Intraparticle Gradient Effects-Mass transfer within the pores of a catalyst Vary particle size
Persamaan matematis untuk kinetika reaksi dengan katalisator padat-cair dapat dijabarkan seperti ini. Misal untuk reaksi isomerasi A menjadi B (Persamaan 4) pada permukaan katalisator padat berbentuk pellet (Gambar 20). Profil perpindahan massanya dilukiskan pada Gambar 21. Persamaan perpindahan massa A ke permukaan padatan dan reaksi isomerasi A menjadi B di permukaan padatan dituliskan seperti di bawah ini.
Gambar 19. Ilustrasi transfer massa eksternal dan internal
Gambar 20. Ilustrasi isomerisasi A cair menjadi B cair dengan katalisator pellet
Gambar 21. Perpindahan massa A cair ke permukaan padatan katalisator
= ( − ) =
2. (4)
= =
2. (5)
Pada percobaan, data hasil pengamatan yang mudah diperoleh adalah konsentrasi reaktan (C A) tiap satu satuan waktu, nilai konsentrasi kesetimbangan pada permukaan padatan sulit
dievaluasi, sehingga persamaan (4) dan (5) dapat disubstitusi dengan menghilangkan variabel C AS. r A AS k W C (6) A r A A A r A A A A W k k C k k W C k W ( ) (7)
A A A r A A W k C k k W (8) A A A r A C k W k k ) 1 ( (9) A r A A A A k x k k C k W 1 ) 1 ( (10) A eff r A A A k C k k C W 1 1 (11) r A r A eff k k k k k (12)
Analog dengan Gambar 17, perubahan A dipengaruhi oleh k A dan kr , kedua parameter ini
masing-masing adalah tetapan perpindahan massa dan kecepatan reaksi. Yang perlu diperhatikan adalah yang lambat yang mengontrol. Jadi, bila proses perpindahan massa cepat, maka k A >>>>, sehingga 1/k A <<<<, maka reaksi kimia yang mengontrol dan
persamaan yang sesuai menjadi persamaan (12). Namun, bila kecepatan reaksi kimia cepat, maka kr >>>>, sehingga 1/kr <<<<, sehingga perpindahan massa yang mengontrol dan
persamaan (13) dapat digunakan. Bila keduanya seimbang, maka persamaan (11) yang dipakai untuk menghitung proses perpindahan massanya.
A r r A A k C k C W 1 (12) A A A A A k C k C W 1 (13)
Penentuan jenis reaksi cepat atau lambat terhadap suatu mekanisme reaksi juga dapat dilakukan dengan mengevaluasi beberapa nilai bilangan tak berdimensi, di antaranya bilangan Hatta dan bilangan Damkohler II. Bilangan Hatta dapat dituliskan sebagai berikut (Bird, 2002): ) ( ) ( massa transfer A reaksi A H N N M (14)