PENGARUH PENGADUKAN TERHADAP KONSTANTA REAKSI
PENYABUNAN ETIL ASETAT DENGAN NaOH PADA REAKTOR
IDEAL ALIRAN KONTINYU
Zaedir Syah Maulana, Siti Munfarida, Danu Purnawan
Jurusan Teknik Kimia, Fakultas Teknik, Universitas Diponegoro Semarang Jl. Prof Soedharto – 50239 Semarang, Telp./Fax. 024-7460058
Abstrak
Reaktor tangki berpengaduk merupakan reaktor yang paling sering dijumpai dalam industri kimia. Hal ini dikarenakan kemampuan operasinya yang dapat diatur kapasitasnya. Percobaan reaktor alir kontinyu bertujuan untuk menghitung harga konstanta reaksi penyabunan (k) etil asetat dengan NaOH, mengetahui pengaruh pengadukan terhadap konstanta reaksi penyabunan etil asetat dengan NaOH, mengetahui hubungan orde reaksi dengan harga konstanta reaksi penyabunan (k) etil asetat dengan NaOH, membandingkan hasil percobaan dengan perhitungan model matematis reaksi penyabunan pada reaktor ideal aliran kontinyu. Pada percobaan ini variabel tetap yang digunakan adalah tinggi cairan 10 cm, konsentrasi NaOH dan etil asetat 0,1 N, dan konsentrasi HCl 0,05 N sedangkan variabel berubahnya adalah pengadukan lambat, sedang, dan cepat. Dari hasil percobaan diperoleh bahwa semakin cepat pengadukan, NaOH sisa (Ca) semakin sedikit sehingga orde reaksi dan harga konstanta reaksi penyabunan etil asetat dengan NaOH (k) semakin besar. Ca model lebih kecil dari Ca percobaan karena perhitungan Ca model yang menggunakan metode Runge Kutta yang keakuratannya tinggi, sedangkan Ca percobaan diperoleh dari percobaan.
Kata kunci : Reaktor tangki berpengaduk, pengadukan, konstanta reaksi penyabunan
Abstract
Continuous stirer tank is a reactor that usually use in chemical industry. Because of the control capacity in process is easy. Purposes of continuous stirrer tank experiment are to count the value of saponification reaction constants (k) between ethyl acetate and NaOH, to know the effect of stiring in saponification reaction constants (k) between ethyl acetate and NaOH, to know the relation of reaction order with saponification reaction constants (k) between ethyl acetate and NaOH, compare experiment result with mathematics model from reaction ethyl acetate and NaOH in continuous stirer tank. In this experiment the dependent variabel is fluid height 8 cm, NaOH and ethyl acetate 0.1 N, and HCl 0,05 N. The independent variabel is low stirrer, medium stirrer and high stirrer. From the experiment result, rest of NaOH (Ca) decreasing in higher stirrer, this effect of increasing reaction orde and (k) between etil asetat and NaOH. Ca models smaller than Ca experiment because the calculation Ca model that using Runge kutta method with high accuration, and Ca experiment got from experiment.
1. PENDAHULUAN
Reaktor tangki berpengaduk merupakan reaktor yang paling sering dijumpai dalam industri kimia. Pada industri berskala besar, reaktor alir tangki berpengaduk lebih sering diaplikasikan karena kemampuan operasinya yang dapat diatur kapasitasnya. Untuk kerja reaktor alir berpengaduk perlu dipelajari untuk mengetahui karakteristik aliran fluida, reaksi yang terjadi secara optimasi pengoperasian reaktor. Untuk itu, dilakukan percobaan reaktor alir kontinyu dengan tujuan untuk menghitung harga konstanta reaksi penyabunan (k) etil asetat dengan NaOH, mengetahui pengaruh pengadukan terhadap konstanta reaksi penyabunan etil asetat dengan NaOH, mengetahui hubungan orde reaksi dengan harga konstanta reaksi penyabunan (k) etil asetat dengan NaOH, membandingkan hasil percobaan dengan perhitungan model matematis reaksi penyabunan pada reaktor ideal aliran kontinyu.
Pada reaktor tangki berpengaduk dipelajari 2 macam reaktor, yaitu reaktor batch dan kontinyu (CSTR). Reaktor batch merupakan reaktor yang tidak ada input dan output selama reaksi. Sehingga didapat neraca massa reaktor batch adalah
t = Nao ∫
Reaktor kontinyu (CSTR) merupakan reaktor yang pengoperasiannya meliputi tiga tahap yaitu pengisian reaktor tinggi overflow, kondisi kontinyu dan kontinyu steady state. Evaluasi variabel-variabel operasi sangat mudah dilakukan pada kondisi steady state (Hill, 1977).
Pemodelan matematik diperlukan untuk mempermudah analisa permasalahan yang timbul dalam pengoperasian reaktor alir tangki berpengaduk (Charles, 1987). Model matematika yang diusulkan diuji keakuratannya dengan membandingkan data-data percobaan. Model matematika yang diusulkan diselesaikan dengan cara
analisis jika persamaan itu mudah diselesaikan. Namun untuk reaksi yang kompleks akan diperoleh model matematika yang kompleks juga. Penyelesaian numerik sangat dianjurkan untuk memperoleh nilai k, tetapan transfer massa, dan orde reaksi yang merupakan adjustable parameter.
Reaksi yang terjadi pada reaktor adalah:
CH3COOC2H5 + NaOH → CH3COONa + C2H5OH
Jika ditinjau secara thermodinamika, dengan harga ∆H sebagai berikut:
∆H CH3COOC2H5 = -444.500 J/mol
∆H NaOH = -425.609 J/mol
∆H CH3COONa = -726.100 J/mol ∆H C2H5OH = -235 J/mol
Didapat ∆H bernilai negatif, maka reaksi tersebut bersifat eksotermis yaitu menghasilkan panas.
Jika ditinjau secara kinetika, dengan harga ∆G sebagai berikut:
∆G CH3COOC2H5 = -328 000 J/mol
∆G NaOH = -379 494 J/mol
∆G CH3COONa = -631 200 J/mol ∆G C2H5OH = -168 490 J/mol Dan dengan menggunakan rumus mencari K standar (pada T=25oC) yaitu:
∆G = -RT ln K
Kemudian menggunakan rumus mencari harga K saat suhu operasi yaitu:
ln = -
Maka didapat harga K > 1 artinya reaksi berlangsung searah (irreversible).
Sifat fisis dan kimia reagen (NaOH dan etil asetat adalah sebagai berikut:
1) NaOH Sifat fisis :
- Berat Molekul = 40 gr/mol - Titik didih = 134 °C - Titik lebur = 318, 4 °C - Berat jenis = 2, 130 gr/mol
- Kelarutan dalam 100 bagian air dingin 10°C = 42
- Kelarutan dalam 100 bagian air panas 100°C = 32
Sifat kimia :
- Dengan Pb(NO3)2 membentuk endapan Pb(OH)2 yang larut dalam reagen excess, merupakan basa kuat, mudah larut dalam air. 2) Etil Asetat
Sifat fisis
Titik didih = 85 °C Berat molekul = 88 gr/mol Titik lebur = -111 °C Sifat kimia:
Bereaksi dengan Hg+ membentuk endapan Hg2Cl2 putih yang tidak larut dalam air panas dan asam encer tetapi larut dalam ammonia encer dan KCN tiosulfat, beraksi dengan Pb2+ membentuk PbCl2 putih, mudah menguap apabila dipanaskan.
Faktor yang mempengaruhi harga k (konstanta kecepatan reaksi) adalah:
Persamaan Arhenius k = A
1. Frekuensi tumbukan
Pengadukan akan memperbesar tumbukan partikel sehingga akan menurunkan energi aktivasi,jika energi aktivasi turun, maka kecepatan reaksi juga naik.
2. Energi aktivasi
Energi aktivasi merupakan energi minimum yang diperlukan bagi reaksi untuk berlangsung. Semakin rendah energi aktivasi, maka reaksi akan berjaan semakin cepat.
3. Suhu
Semakin tinggi suhu, maka reaksi akan berjalan semakin cepat.
4. Katalis
Katalis dapat mempercepat reaksi karena kemammpuannya mengadakan reaksi dengan paling sedikit satu molekul reaktan untuk menghasilkan senyawa yang lebih aktif. Interaksi ini akan meningkatkan laju reaksi (Levenspiel, 1999).
Untuk mengetahui harga k (konstanta reaksi penyabunan) dari reaksi NaOH +CH3COOC2H5 CH3COONa + C2H5OH, dapat dihitung dengan cara:
dimana Ca=Cb ∫ ∫ [ ] y = mx + c
Harga k didapat dari least square. Dimana harga k merupakan nilai dari m.
Sedangkan untuk mengetahui orde reaksi antara NaOH dan etil asetat dapat dihitung menggunakan cara berikut ini:
y = mx + c m = n = orde reaksi
Orde reaksi didapat dari least square. Dimana orde reaksi merupakan nilai dari m. 2. METODE DAN PROSEDUR
1. Percobaan Batch
Gambar 1. Alat Utama Proses Batch
Keterangan :
1. Reaktor Batch 2. Stirer
Untuk percobaan batch, percobaan dilakukan dengan menyiapkan reagen etil asetat 0,1 N, HCl 0,05 N, dan NaOH 0,1 N. Kemudian memasukkan etil asetat dan NaOH ke dalam reaktor batch sampai ketinggian 10 cm. Sampel diambil pada t ke-0 sebanyak 5 ml, kemudian ditambahkan indikator MO 3 tetes dan dititrasi dengan HCl sampai warna merah orange. Setelah itu, dilakukan pengadukan lambat, sedang, dan cepat, dan pengambilan sampel tiap 3 menit kemudian dititrasi, begitu terus menerus sampai volume titran 3 kali konstan.
2. Percobaan Kontinyu
Gambar 2. Alat Utama Proses Kontinyu
Keterangan :
1. Reaktor Kontinyu 2. Stirrer
3. Statif
4. Tangki NaOH 5. Tangki etil asetat 6. Pompa
Untuk percobaan kontinyu, percobaan dilakukan dengan menyiapkan reagen etil asetat 0,1 N, HCl 0,05 N, dan NaOH 0,1 N. Kemudian memasukkan etil asetat dan NaOH ke dalam tangki umpan masing-masing. Masing-masing reaktan dalam tangki umpan dipompa ke dalam CSTR yang kosong dan menjaga konstan laju alirnya serta mereaksikannya. Sampel diambil pada t ke-0 sebanyak 5 ml, kemudian ditambahkan indikator MO 3 tetes dan dititrasi dengan HCl sampai warna merah orange. Setelah itu, dilakukan pengadukan lambat, sedang, dan cepat, dan
pengambilan sampel tiap 3 menit kemudian dititrasi, begitu terus menerus sampai volume titran 3 kali konstan.
3. HASIL DAN PEMBAHASAN Hubungan waktu vs konsentrasi tiap variabel
a. Batch
Dari gambar 3, dapat dilihat bahwa konsentrasi NaOH sisa baik pada saat tanpa pengadukan, pengadukan lambat dan pengadukan cepat, semakin waktu semakin berkurang. Hal ini terjadi karena reaksi yang terjadi pada reaktor batch belum tercapai kondisi steady atau tunak. Kondisi steady yaitu kondisi dimana tidak ada perubahan baik energi maupun massa dalam sistem. Sesuai dengan rumus:
1/Ca=k.t+1/Cao dimana Ca : konsentrasi NaOH sisa k : konstanta kecepatan reaksi t : waktu
Cao : konsentrasi NaOH mula-mula Dari persamaan di atas diketahui bahwa t ≈1/Ca yang berarti bahwa semakin lama waktu reaksi maka Ca akan semakin kecil karena akan bereaksi dengan etil asetat dan mencapai kesetimbangan saat Ca konstan (Binus, 2000). NaOH sisa paling rendah yaitu pada pengadukan cepat,kemudian lambat dan terakhir tanpa pengadukan. Hal tersebut disebabkan karena pengadukan
dapat meningkatkan intensitas
tumbukan,sehingga reaksi lebih cepat berlangsung. 0,05 0,052 0,054 0,056 0,058 0,06 0,062 0 3 6 9 12 Ca t (menit)
Gambar 3 Grafik Hubungan t vs Ca pada Reaktor Batch tanpa pengadukan pengadukan lambat pengadukan cepat
Reaksi yang terjadi:
NaOH + CH3COOC2H5 CH3COONa + C2H5OH
b. Kontinyu
Dari gambar 4, dapat dilihat bahwa konsentrasi NaOH sisa baik pada saat tanpa pengadukan,pengadukan lambat dan pengadukan cepat, mengalami penurunan Ca seiring dengan bertambahnya waktu. Hal ini dikarenakan semakin lama waktu reaksi maka semakin banyak NaOH yang bereaksi dengan etil asetat yang menyebabkan jumlahnya berkurang, reaksi yang terjadi:
NaOH + CH3COOC2H5CH3COONa + C2H5OH
NaOH bereaksi dengan etil asetat dan menghasilkan produk berupa etanol dan natrium asetat. Semakin lama waktu, jumlah produk akan bertambah dan jumlah reaktan berkurang sampai terjadi keseimbangan dimana konsentrasi NaOH sisa tetap (Yuniati. 2010).
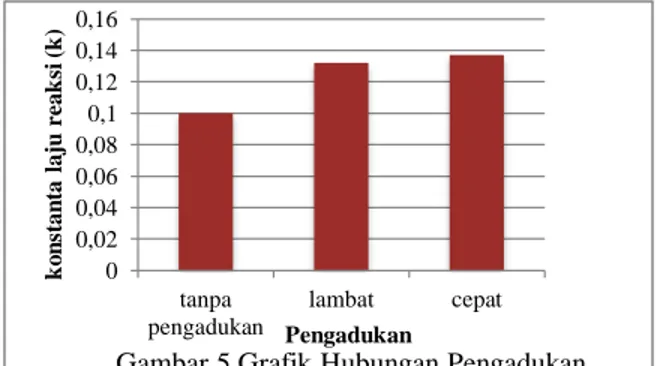
Hubungan pengadukan dengan konstanta laju reaksi (k)
Dari gambar 5, dapat dilihat bahwa semakin cepat pengadukan, nilai konstanta laju reaksi (k) semakin besar. Hal ini dikarenakan semakin cepat pengadukan akan memperbesar frekuensi tumbukan antara molekul zat pereaksi dengan zat yang bereaksi sehingga mempercepat reaksi. Sesuai dengan persamaan Archenius :
) ( RT Ea e A k
Semakin besar tumbukan maka semakin besar pula harga konstanta lajureaksi (k) (Arief, 2008).
Hubungan orde reaksi terhadap k Pada percobaan, reaksi yang terjadi adalah: CH3COOC2H5 + NaOH CH3COONa + C2H5OH
Jika reaksi di atas adalah reaksi elementer, maka orde reaksinya adalah 2. Orde reaksi dicari dari persamaan:
-ra= k[CH3COOC2H5][NaOH] -ra= k[Ca][Cb] dimana [Ca]=[Cb] -ra = k[Ca]2
Pada reaksi elementer, orde reaksi dicari dengan melihat pangkat konsentrasi reaktan sedangkan untuk reaksi non elementer, orde reaksi dicari melalui perhitungan data hasil percobaan. Dari perhitungan, orde reaksi pada pengadukan lambat, sedang, cepat berturut-turut adalah 2,017; 1,950; 1,879. Sesuai persamaan:
Dari persamaan di atas, diketahui bahwa semakin besar nilai Ca dan k maka orde reaksi akan semakin kecil. Hal ini sesuai dengan hasil percobaan, yaitu semakin besar nilai k, orde reaksi semakin kecil (Levenspiel, 1999, 18). 0 0,02 0,04 0,06 0,08 0,1 0,12 0,14 0,16 tanpa pengadukan lambat cepat k o n st an ta la ju r eak si (k ) Pengadukan
Gambar 5 Grafik Hubungan Pengadukan dengan Konstanta Laju Reaksi
0,056 0,058 0,06 0,062 0,064 0,066 0,068 0,07 0,072 0 3 6 9 12 15 18 Ca t (menit)
Gambar 4 Grafik Hubungan t vs Ca pada Reaktor CSTR tanpa pengadukan pengadukan lambat pengadukan cepat
0 0,02 0,04 0,06 0,08 0 3 6 9 12 15 18 Ca t (menit)
Gambar 7 Grafik Perbandingan Ca Model dengan Ca Percobaan pada Pengadukan Lambat
Ca percob aan
Ca model Perbandingan Ca model dengan Ca percobaan
Berdasarkan gambar 6-8, dapat dilihat bahwa pada variabel pengadukan lambat, sedang, dan cepat Ca percobaan lebih besar dari Ca model. Hal ini dikarenakan Ca model yang diperoleh dari perhitungan matematis menggunakan metode Runge Kutta. Dipilih metode ini karena Runge Kutta dianggap metode yang memberikan keakuratan tinggi.Perhitungan model matematis ini tidak dipengaruhi oleh variabel-variabel percobaan yaitu pengadukan.Sehingga diperoleh Ca model yang merupakan Ca ideal. Sedangkan Ca percobaan diperoleh dari percobaan dengan
variabel pengadukan sehingga
keakuratannya lebih rendah dari Ca model. Ca model diperoleh dari data hasil percobaan yang kemudian diaplikasikan ke dalam perhitungan teoritis metode Runge Kutta. Karena hasil perhitungan k1,k2,k3,k4 adalah negatif, maka nilai Ca bertanda negatif, sehingga Ca model lebih kecil daripada Ca percobaan (Supriyanto, 2006). KESIMPULAN
Pada percobaan ini dapat disimpulkan bahwa adalah konsentrasi reaktan semakin berkurang seiring dengan bertambahnya waktu, semakin cepat pengadukan, nilai konstanta laju reaksi (k) semakin besar, semakin besar nilai k, orde reaksi semakin kecil, Ca percobaan lebih besar dari Ca model. Saran dari kami adalah teliti dalam pengamatan TAT dan pengaturan pengadukan harus sesuai variabel.
DAFTAR PUSTAKA
Arief, Rahman Hakim dan Sutra Irawan. 2008. Kajian Awal Sintesis Biodiesel Dari Minyak Dedak Pada ProsesEsterifikasi. Semarang Levenspiel. O., “Chemical Reaction
Engineering” 2nd ed, Mc. Graw Hill Book Kogakusha Ltd, Tokyo, 1999
Prasetyo. 2000. “Perpindahan panas”. Universitas Bina Nusantara Jakarta.
Supriyanto. 2006. Runge-Kutta Orde Empat. Vol Universitas Indonesia Jakarta Y. Yuyun, Sumarno, Mahfud. 2010.
Pemanfaatan Gliserol sebagai Hasil Samping Biodiesel Menjadi Produk Kimia Lain dalam Media Air Subkritis hingga Superkritis. Vol A-13-6. Institut Teknologi Sepuluh Nopember Surabaya
0 0,02 0,04 0,06 0,08 0 3 6 9 12 Ca t (menit)
Gambar 6 Grafik Perbandingan Ca Model dengan Ca Percobaan Saat Tanpa Pengadukan
Ca percob aan Ca model 0,05 0,055 0,06 0,065 0,07 0 3 6 9 12 15 18 Ca t (menit)
Gambar 8 Grafik Perbandingan Ca Model dengan Ca Percobaan pada Pengadukan Cepat
Ca percob aan Ca model