I.
I. Judul Judul PercobaaPercobaan n ::Kinetika Reaksi Saponifikasi Etil AsetatKinetika Reaksi Saponifikasi Etil Asetat
II.
II. Hari Hari dan dan Tanggal Tanggal Percobaan Percobaan :: Selasa, 15 April Selasa, 15 April 2014 pukul 13.00 WIB2014 pukul 13.00 WIB
III.
III. Selesai Selesai Percobaan Percobaan :: Selasa, 15 April Selasa, 15 April 2014 pukul 15.00 WIB2014 pukul 15.00 WIB
IV.
IV. Tujuan Percobaan:Tujuan Percobaan: 1.
1. Untuk memberikan gambaran bahwa reaksi penUntuk memberikan gambaran bahwa reaksi penyabunan hidroksida adalahyabunan hidroksida adalah reaksi orde dua.
reaksi orde dua. 2.
2. Menentukan konstanta kecepatan reaksi pada reaksi tersebut.Menentukan konstanta kecepatan reaksi pada reaksi tersebut.
V.
V. Dasar Teori:Dasar Teori:
Kinetika kimia merupakan bagian dari ilmu Kimia Fisika yang mempelajari Kinetika kimia merupakan bagian dari ilmu Kimia Fisika yang mempelajari tentang kecepatan reaksi-reaksi kimia dan mekanisme reaksi-reaksi yang tentang kecepatan reaksi-reaksi kimia dan mekanisme reaksi-reaksi yang bersangkutan. Tidak semua
bersangkutan. Tidak semua reaksi kimia reaksi kimia dapat dipelajari dapat dipelajari secara kinetik. secara kinetik. Reaksi-reaksiReaksi-reaksi yang berjalan sangat cepat seperti reaksi-reaksi ion atau pembakaran dan reaksi-reaksi yang berjalan sangat cepat seperti reaksi-reaksi ion atau pembakaran dan reaksi-reaksi yang sangat lambat seperti pengkaratan, tidak dapat dipelajari secara kinetik. Diantara yang sangat lambat seperti pengkaratan, tidak dapat dipelajari secara kinetik. Diantara kedua jenis ini, banyak reaksi-reaksi yang kecepatannya dapat diukur.
kedua jenis ini, banyak reaksi-reaksi yang kecepatannya dapat diukur. Ditinjau dari fase zat
Ditinjau dari fase zat yang bereaksi, dikenal dua macam reaksi, yaitu :yang bereaksi, dikenal dua macam reaksi, yaitu : a. Reaksi homogen, yaitu reaksi dimana tidak terjadi perubahan fase. a. Reaksi homogen, yaitu reaksi dimana tidak terjadi perubahan fase. b. Reaksi heterogen, yaitu reaksi dimana terjadi perubahan fase. b. Reaksi heterogen, yaitu reaksi dimana terjadi perubahan fase.
Kecepatan reaksi adalah kecepatan perubahan konsentrasi terhadap waktu, Kecepatan reaksi adalah kecepatan perubahan konsentrasi terhadap waktu, jadi
jadi
, tanda negatif menunjukkan bahwa konsentrasi berkurang bila waktu, tanda negatif menunjukkan bahwa konsentrasi berkurang bila waktu bertambah.bertambah.
Laju reaksi merupakan laju berkurangnya konsentrasi pereaksi atau Laju reaksi merupakan laju berkurangnya konsentrasi pereaksi atau bertambahnya hasil reaksi persatuan waktu. Bila laju reaksi dengan persamaan:
bertambahnya hasil reaksi persatuan waktu. Bila laju reaksi dengan persamaan: aA + bB
aA + bB cC cC + + dDdD
Semakin besar konsentrasi zat-zat pereaksi cenderung akan mempercepat laju reaksi, Semakin besar konsentrasi zat-zat pereaksi cenderung akan mempercepat laju reaksi, tetapi seberapa cepat menemukan orde reaksi merupakan salah satu cara tetapi seberapa cepat menemukan orde reaksi merupakan salah satu cara memperkirakan sejauh mana konsentrasi zat pereaksi mempengaruhi laju reaksi
memperkirakan sejauh mana konsentrasi zat pereaksi mempengaruhi laju reaksi tertentu.
bentuk diferensial. Orde reaksi adalah ukuran konstribusi setiap konsentrasi pereaksi bentuk diferensial. Orde reaksi adalah ukuran konstribusi setiap konsentrasi pereaksi
atau zat yang berperan dalam laju reaksi. Pada umunya orde reaksi merupakan atau zat yang berperan dalam laju reaksi. Pada umunya orde reaksi merupakan bilangan bulat dan
bilangan bulat dan kecil namun dalam kecil namun dalam beberapa hal pecahan beberapa hal pecahan atau nol. atau nol. Penentuan ordePenentuan orde reaksi adalah hal yang essensial daripada penelitian-penelitian terhadap proses kimia reaksi adalah hal yang essensial daripada penelitian-penelitian terhadap proses kimia yang menyangkut analisis hubungan konsentrasi dan waktu.
yang menyangkut analisis hubungan konsentrasi dan waktu.
Menurut Hukum Kegiatan Massa, kecepatan reaksi pada temperatur tetap, Menurut Hukum Kegiatan Massa, kecepatan reaksi pada temperatur tetap, berbanding lurus dengan kon
berbanding lurus dengan konsentrasi pengikut-pengikutnya dan masing-masingsentrasi pengikut-pengikutnya dan masing-masing berpangkat sebanyak molekul dalam persamaan reaksi.
berpangkat sebanyak molekul dalam persamaan reaksi.
Orde reaksi 1 : Orde reaksi 1 : A A hasil hasil Rate = k1.CA. Rate = k1.CA. Orde reaksi 2 : Orde reaksi 2 : 2A 2A hasil hasil Rate = k2. C2A. Rate = k2. C2A. A + B A + B hasil hasil Rate = k2.CA.CB Rate = k2.CA.CB Orde reaksi 3 : Orde reaksi 3 : A + 2B A + 2B hasil hasil Rate = k3.CA.C2B. Rate = k3.CA.C2B. 2A + B 2A + B hasil hasil Rate = k3.C2A.CB. Rate = k3.C2A.CB.
Untuk memberikan gambaran bahwa reaksi penyabunan etilasetat oleh ion Untuk memberikan gambaran bahwa reaksi penyabunan etilasetat oleh ion hidroksi adalah orde dua yaitu reaksi dibawah ini :
hidroksi adalah orde dua yaitu reaksi dibawah ini : CH
CH33COOCCOOC22HH55 + OH + OH-- CH CH33COOCOO-- + C + C22HH55OHOH t t = = 0 0 A A b b - - --X X x x X X XX t t = = t t (a-x) (a-x) (b-x) (b-x) X X XX
Reaksi bimolekuler tingkat dua dapat dinyatakan sebagai berikut : Reaksi bimolekuler tingkat dua dapat dinyatakan sebagai berikut :
A + B A + B Hasil Hasil t t = = 0 0 A A b b --t t = = t t a-x a-x b-x b-x XX
= k (a
= k (a
– –x)(b
x)(b
– –x)
x)
Dimana : Dimana :a = konsentrasi awal ester (mol/L) a = konsentrasi awal ester (mol/L) b = konsentrasi awal ion OH- (mol/L) b = konsentrasi awal ion OH- (mol/L)
x = jumlah mol/L ester atau basa
x = jumlah mol/L ester atau basa yang telah bereaksiyang telah bereaksi k2 = tetapan laju reaksi (mmol
k2 = tetapan laju reaksi (mmol-1-1.menit.menit-1-1))
integrasi: integrasi:
((
))
((
((
))
))
()
()
()
()
()
()
Untuk dapat menentukan apakah suatu reaksi orde dua atau bukan dapat Untuk dapat menentukan apakah suatu reaksi orde dua atau bukan dapat diselidiki seperti pada reaksi tingkat satu yaitu :
diselidiki seperti pada reaksi tingkat satu yaitu : 1.
1. Dengan memasukkan harga a, b, t dan x pada persamaan :Dengan memasukkan harga a, b, t dan x pada persamaan :
()
()
()
()
()
()
Bila harga-harga k2 tetap maka reaksi orde dua. Bila harga-harga k2 tetap maka reaksi orde dua. 2.
2. Secara grafikSecara grafik
Bila harga-harga k2 tetap maka reaksi orde dua. Bila harga-harga k2 tetap maka reaksi orde dua.
()
()
()
()
()
()
()
()
Bila reaksi orde dua maka grafik t terhadap log Bila reaksi orde dua maka grafik t terhadap log
merupakan garis lurus tangen merupakan garis lurus tangen atau slope :atau slope :
()
()
()
()
Untk konsentrasi sama Untk konsentrasi sama
()
()
()
()
Jadi grafikJadi grafik
()
()
harus lurus bila orde reaksi adalah orde dua. harus lurus bila orde reaksi adalah orde dua. 3.konsentrasi A dan B berbeda, karena A dan B akan mempunyai waktu berbeda untuk bereaksinya setengah jumlah zat tersebut.
Reaksi-reaksi orde I adalah reaksi-reaksi yang lajunya berbanding langsungdengan konsentrasi reaktan, yaitu:
Yang pada integrasi memberikan ln [C]= ln [C]o
atau [C]= [C]o
atau
[C]0 adalah konsentrasi reaktan pada t = 0. Untuk reaksi-reaksi orde I, plot ln [C] (atau log [C]) terhadap t merupakan suatu baris lurus. Intersep memberikan konsentrasi pada t = 0 dan k dapat dihitung dari kemiripan tersebut.
Dalam reaksi orde II, laju reaksi berbanding langsung dengan kuadrat konsentrasi dari satu reaktan atau dengan hasil kali konsentrasi yang meningkat sampai pangkat satu atau dua
Saponifikasi adalah suatu reaksi yang menghasilkan sabun dan gliserol, dengan menghidrolisa dengan basa, suatu lemak atau minyak. Sabun merupakan garam logam alkali dengan rantai asam monocarboxylic yang panjang. Larutan Alkali yang digunakan dalam pembuatan sabun bergantung pada jenis sabun tersebut. Larutan alkali yang biasanya digunakan pada sabun keras adalah natrium hidroksida dan alkali yang biasanya digunakan pada sabun lunak adalah kalium hidroksida.
Sabun berfungsi untuk mengemulsi kotoran – kotoran berupa minyak ataupun
zat pengotor lainnya. Sabun dibuat melalui proses saponifikasi lemak minyak dengan larutan alkali membebaskan gliserol. Lemak minyak yang digunakan dapat berupa lemak hewani, minyak nabati, lilin, ataupun minyak ikan laut.
VI. Alat dan Bahan
Alat
- Corong kaca 1 buah
- Stopwatch 1 buah
- Gelas kimia 1 buah - Erlenmeyer 6 buah
- Buret 1 buah
- Statif dan klem 1,1 buah - Gelas ukur 10 mL 1 buah - Gelas ukur 50 mL 1 buah - Termometer 1 buah Bahan - Etil asetat 0,02N - Indikator PP secukupnya - Larutan NaOH 0,02N - Aquades - Larutan HCl 0,02 N
VII. Alur Percobaan
125 mL etil asetat 0,02 N
Etil asetat dan NaOH mencapai suhu thermostat
(suhu yang sama)
- Dimasukkan ke dalam labu
- Diletakkan dalam thermostat untuk mencapai suhu yang sama
100 mL NaOH 0,02 N
- Kedua larutan dicampurkan dengan cepat - Dikocok dengan baik
- Dijalankan stopwatch saat kedua larutan telah bercampur
Hasil percobaan
(campuran larutan etil asetat+ NaOH)
10 mL HCl 0,02 N
- Dimasukkan ke dalam 7 buah labu erlemeyer
Hasil percobaan
5 mL campuran larutan etil asetat + NaOH
- Diambil setelah didiamkan selama 3 menit
- Dimasukkan ke dalam salah satu labu yang berisi 10 mL larutan HCl 0,02 N
- Diaduk dengan baik
- Segera dititrasi dengan larutan standar NaOH 0,02 N
- Percobaan diulangi dengan pengambilan campuran larutan pada menit ke 8, 15, 25, 40 dan 65
Hasil percobaan (vlarutan NaOH 0,02 N)
Sisa larutan campuran etil asetat + NaOH
- Dibiarkan selama ± 2 hari
- Dilakukan pemanasan agar reaksi sempurna
- Didinginkan
- Dimasukkan ke dalam labu yang berisi 10 mL larutan HCl 0,02 N
- Diaduk dengan baik
- Segera dititrasi dengan larutan standar NaOH 0,02 N
Hasil percobaan (v larutan NaOH 0,02 N)
Laporan resmi kimia fisika III 8 VIII. Hasil Pengamatan
No.
Perc. Prosedur Percobaan Hasil Pengamatan Dugaan / Reaksi Kesimpulan
1. Sebelum:
Etil asetat 0,02 N= larutan tidak berwarna
NaOH 0,02 N= larutan tidak berwarna
HCl 0,02 N= larutan tidak berwarna
Sesudah:
NaOH + etil asetat= larutan tidak berwarna
Larutan campuran + HCl + indikator PP= larutan tidak berwarna
Setelah dititrasi dengan NaOH= larutan berwarna merah muda
CH3COOC2H5(aq) + NaOH(aq) CH3COONa(aq) + C2H5OH(aq) NaOH(aq) + HCl(aq) NaCl(aq) +H2O(l ) 125 mL etil asetat 0 02 N
Etil asetat dan NaOH mencapai suhu thermostat (suhu yang sama)
- Dimasukkan ke dalam labu
- Diletakkan dalam thermostat untuk mencapai suhu yang sama
100 mL NaOH
0,02 N
- Kedua larutan dicampurkan dengan cepat
- Dikocok dengan baik
- Dijalankan stopwatch saat kedua larutan telah bercampur
Hasil percobaan (campuran larutan etil
Laporan resmi kimia fisika III 9 Volume NaOH saat dititrasi:
t = 3 menit →V1 = 9,1 mL t = 8 menit →V2 = 9,2 mL t = 15 menit →V3 = 9,4 mL t = 25 menit →V4 = 9,6 mL t = 40 menit →V5 = 9,7 mL t = 65 menit →V6 = 9,8 mL t = 2 hari →V7 = 9,9 mL 10 mL HCl 0,02 N
- Dimasukkan ke dalam 7 buah labu erlemeyer
Hasil percobaan
(7 buah erlenmeyer berisi 10 mL
5 mL campuran larutan etil asetat + NaOH
- Diambil setelah didiamkan selama 3 menit
- Dimasukkan ke dalam salah satu labu yang berisi 10 mL larutan HCl 0,02 N
- Diaduk dengan baik
- Segera dititrasi dengan larutan standar NaOH 0,02 N
- Percobaan diulangi dengan pengambilan campuran larutan pada menit ke 8, 15, 25, 40 dan
65
Hasil percobaan
Laporan resmi kimia fisika III 10
Sisa larutan campuran etil asetat + NaOH
- Dibiarkan selama ± 2 hari
- Dilakukan pemanasan agar reaksi sempurna
- Didinginkan
- Dimasukkan ke dalam labu yang berisi 10 mL larutan HCl 0,02 N
- Diaduk dengan baik
- Segera dititrasi dengan larutan standar NaOH 0,02 N
Hasil percobaan
IX. Analisis dan Pembahasan
Percobaan kinetika reaksi saponifikasi etil asetat dengan NaOH ini bertujuan untuk memberikan gambarana bahwa reaksi penyabunan hidroksida adalah reaksi orde dua dan untuk menentukan konstanta kecepatan reaksi pada reaksi tersebut.
Pada percobaan ini prosedur yang dilakukan adalah 125 ml etil asetat 0,02 N yang merupakan larutan yang tidak berwarna dimasukkan ke dalam erlenmeyer 1. Pada erlenmeyer 2 dimasukkan 100 ml larutan NaOH 0,02 N yang merupakan larutan tidak berwarna. Kemudian diukur suhu pada masing-masing erlenmeyer dan disamakan suhunya dengan cara meletakkan dalam thermostat. Dalam percobaan ini, sebelum dicampurkan, kedua larutan harus mempunyai suhu yang sama, karena suhu merupakan salah satu faktor yang mempengaruhi laju reaksi. Jika suhu dinaikkan maka laju reaksi semakin besar karena kalor yang diberikan akan menambah energi kinetik partikel pereaksi, sehingga jumlah dari energi tumbukan bertambah besar, begitu pun sebaliknya. Dalam percobaan yang telah dilakukan, setelah larutan etil asetat dan larutan NaOH dimasukkan ke dalam erlenmeyer, telah mencapai suhu yang sama yaitu 29oC, sehingga larutan tersebut tidak diletakkan dalam thermostat. Setelah suhu kedua larutan mencapai suhu yang sama, maka kedua larutan dicampur sambil dinyalakan stopwatch. Pencampuran pada suhu yang sama agar laju reaksi yang dihasilkan tidak mengalami perubahan besar. Dalam hal ini, terjadi reaksi penyabunan atau hidrolisis etil asetat yang bertindak sebagai asam lemak dengan basa kuat NaOH yang akan menghasilkan etil asetat dan gliserol.
Selain itu, disiapkan 7 buah erenmeyer yang masing-masing diisi 10 ml HCl 0,02 N. Pada tiga menit pertama setelah larutan dicampurkan, larutan tersebut dipipet 5 ml dan dimasukkan ke dalam erlenmeyer yang telah berisi HCl. Kemudian ditambahkan 3 tetes indikator PP. Larutan HCl ini berfungsi untuk mengetahui banyaknya NaOH yang tersisa dalam proses saponifikasi tersebut. Selain itu penambahan HCl juga untuk memberikan suasana asam, karena hasil mula-mula dari reaksi saponifikasi adalah berupa karboksilat. Oleh karena itu, dengan adanya penambahan HCl, karboksilat diubah menjadi asam karboksilat. Setelah penambahan HCl dilanjutkan dengan menitrasi campuran larutan tersebut dengan NaOH 0,02 N untuk mengetahui banyaknya HCl yang masih tersis a, sehingga dengan diketahuinya HCl sisa juga dapat diketahui banyaknya NaOH yang tersisa dalam reaksi saponifikasi tersebut.
Penambahan indikator PP bertujuan untuk mengetahui titik akhir titrasi yaitu titik dimana mol NaOH sama dengan mol HCl yang ditandai dengan perubahan warna larutan dari
tidak berwarna menjadi merah muda. Berdasarkan hasil percobaan diketahui bahwa semakin lama waktu pencampuran, maka semakin banyak larutan NaOH yang digunakan. Hal tersebut berarti semakin banyak NaOH yang bereaksi dengan etil asetat.
Pada percobaan ini, pengambilan sampel diulangi pada menit ke 8, 15, 25, 40, dan 65 dan dititrasi dengan NaOH. Sisa larutan dibiarkan selama 2 hari kemudian dilakukan pengambilan sampel dan titrasi seperti langkah sebelumnya
Persamaan reaksi yang terjadi:
() ()
()
()
()()
()
()
()
NaOHsisa + 2 HCl NaCl + H2O + HCl sisa HClsisa + NaOHtitrasi NaCl + H2O
Dari percobaan yang dilakukan didapatkan data berupa volume titrasi sebagai berikut:
No t (menit) Volume titrasi
(mL) 1. 3 9,1 2. 8 9,2 3. 15 9.4 4. 25 9.6 5. 40 9,7 6. 65 9,8 7. 2 hari 9,9
Berdasarkan data diatas dapat dilihat bahwa semakin lama waktu pencampuran larutan maka semakin banyak volume NaOH yang dibutuhkan untuk titrasi. Hal tersebut terjadi karena semakin lama waktu pembentukan produk etil asetat, maka volume NaOH yang bereaksi semakin banyak sehingga saat ditambahkan HCl, maka hanya sedikit HCl yang digunakan untuk menetralkan NaOH bereaksi. Sehingga HCl sisa dan HCl yang bereaksi dapat dicari menggunakan rumus laju reaksi metode integral.
Untuk mencari orde reaksi metode integral perlu dicari konsentrasi zat mula-mula dan yang bereaksi dengan rumus sebagai berikut:
()
()
Menentukan orde 1
Menentukan orde 2
( )
( )
Berdasarkan persamaan diatas diperoleh hasil sebagai berikut :
t (s) V NaOH (mL)
x (a-x) (b-x) Orde 1 Orde 2
180 9,1
0,00042 0,0135033 480 9,2 0,184 2,316 1,816 0,00016 0,0050556 900 9.4 0,188 2,312 1,812 0,0000869 0,0026876 1500 9.6 0,192 2,308 1,808 0,0000533 0,0016073 2400 9,7 0,194 2,306 1,806 0,0000337 0,0010029 3900 9,8 0,196 2,304 1,804 0,0000209 0,0006162 172800 9,9 0,198 2,302 1,802 0,0000005 0,0000139Berdasarkan data tersebut, dapat dilihat bahwa harga k dari orde 2 cenderung mendekati konstan, harga k pada orde 2 mempunyai selisih yang relatif kecil dibandingkan dengan orde 1. Sehingga dapat disimpulkan, pada metode non grafik diperoleh orde 2 untuk kinetika reaksi saponifikasi etil asetat. Hal tersebut telah sesuai dengan teori, bahwa reaksi saponifikasi etil asetat dengan NaOH berorde 2. Sehingga, diperoleh nilai konstanta kecepatan rata-rata reaksi saponifikasi etil asetat dengan NaOH sebesar 0,0067544
Metode grafik
Sedangkan dengan menggunakan metode grafik, diperoleh grafik orde 1 dan orde 2 sebagai berikut :
Pada grafik orde 1 didapakan persamaan regresi = -0.0000016x + 0.8400501 dan nilai regresi linier sebesar 0, 8561.
Pada grafik orde 2 didapakan persamaan regresi = 0.0000004x + 0.2431475 dan nilai regresi linier sebesar 0.85672.
y = -0.0000016x + 0.8400501 R² = 0.8561 0.833 0.834 0.835 0.836 0.837 0.838 0.839 0.840 0.841 0.842 0 1000 2000 3000 4000 5000 l n ( a - x ) t (s)
GRAFIK ORDE 1
Series1 Linear (Series1) y = 0.0000004x + 0.2431475 R² = 0.85672 0.243 0.243 0.244 0.244 0.245 0.245 0 1000 2000 3000 4000 5000 l n ( a - x ) / ( b - x ) t (s)GRAFIK ORDE 2
Series1 Linear (Series1)Berdasarkan grafik di atas dapat dilihat bahwa nilai regresi grafik orde 2 lebih besar dari pada grafik orde 1 dimana nilai regresi grafik orde 1 sebesar 0.85612 sedangkan nilai regresi orde 2 sebesar 0.85672 (nilai regresi orde 2 lebih mendekati 1), sehingga dapat disimpulkan bahwa kinetika reaksi saponifikasi etil asetat dengan NaOH berorde 2. Hal tersebut telah sesuai dengan teori, bahwa reaksi saponifikasi etil asetat dengan NaOH berorde 2.
X. KESIMPULAN
Berdasarkan percobaan yang kami lakukan dapat disimpulkan bahwa
1. Kinetika reaksi saponifikasi etil asetat dengan NaOH berdasarkan metode grafik dan non grafik merupakan reaksi berorde 2.
2. Nilai konstanta kecepatan rata-rata reaksi saponifikasi etil asetat dengan NaOH 0,0067544.
XI. Jawaban Pertanyaan
1) Kenyataan apakah yang membuktikan bahwa reaksi penyabunan etil asetat ini adalah reaksi orde dua?
Jawaban:
Reaksi penyabunan etil asetat adalah reaksi orde dua yang dapat dibuktikan dengan metode grafik dan non grafik.
Dengan menggunkan metode grafik diperoleh grafik di bawah ini
Pada grafik orde 1 didapakan persamaan regresi = -0.0000016x + 0.8400501 dan nilai regresi linier sebesar 0, 8561.
y = -0.0000016x + 0.8400501 R² = 0.8561 0.833 0.834 0.835 0.836 0.837 0.838 0.839 0.840 0.841 0.842 0 1000 2000 3000 4000 5000 l n ( a - x ) t (s)
GRAFIK ORDE 1
Series1 Linear (Series1) y = 0.0000004x + 0.2431475 R² = 0.85672 0.243 0.243 0.244 0.244 0.245 0.245 0 1000 2000 3000 4000 5000 l n ( a - x ) / ( b - x ) t (s)GRAFIK ORDE 2
Series1 Linear (Series1)Pada grafik orde 2 didapakan persamaan regresi = 0.0000004x + 0.2431475 dan nilai regresi linier sebesar 0.85672.
Berdasarkan grafik di atas dapat dilihat bahwa nilai regresi grafik orde 2 lebih besar dari pada grafik orde 1 dimana nilai regresi grafik orde 1 sebesar 0.85612 sedangkan nilai regresi orde 2 sebesar 0.85672 (nilai regresi orde 2 lebih mendekati 1), sehingga dapat disimpulkan bahwa kinetika reaksi saponifikasi etil asetat dengan NaOH berorde 2. Hal tersebut telah sesuai dengan teori, bahwa reaksi saponifikasi etil asetat
dengan NaOH berorde 2.
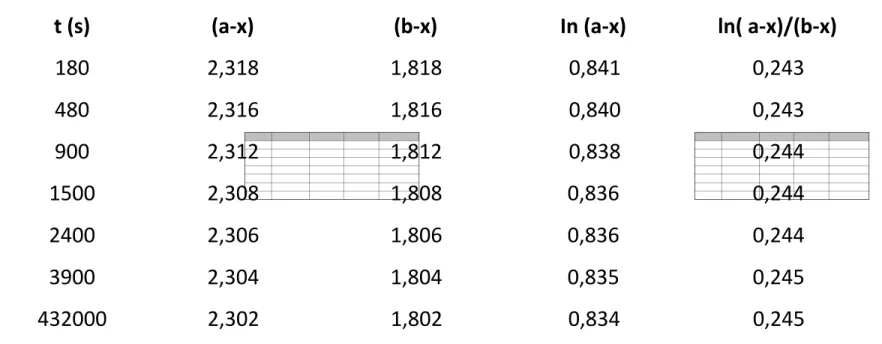
Grafik di atas dibuat berdasarkan data sebagai berikut:
t (s) (a-x) (b-x) In (a-x) ln( a-x)/(b-x)
180 2,318 1,818 0,841 0,243 480 2,316 1,816 0,840 0,243 900 2,312 1,812 0,838 0,244 1500 2,308 1,808 0,836 0,244 2400 2,306 1,806 0,836 0,244 3900 2,304 1,804 0,835 0,245 432000 2,302 1,802 0,834 0,245
Metode Non grafik
t (s) V NaOH
(mL) x (a-x) (b-x) Orde 1 Orde 2
180 9,1
0,00042 0,0135033 480 9,2 0,184 2,316 1,816 0,00016 0,0050556 900 9.4 0,188 2,312 1,812 0,0000869 0,0026876 1500 9.6 0,192 2,308 1,808 0,0000533 0,0016073 2400 9,7 0,194 2,306 1,806 0,0000337 0,0010029 3900 9,8 0,196 2,304 1,804 0,0000209 0,0006162 432000 9,9 0,198 2,302 1,802 0,0000002 0,0000056Berdasarkan data tersebut, dapat dilihat bahwa harga k dari orde 2 cenderung mendekati konstan, harga k pada orde 2 mempunyai selisih yang relatif kecil dibandingkan dengan orde 1. Sehingga dapat disimpulkan, pada metode non grafik diperoleh orde 2 untuk kinetika reaksi saponifikasi etil asetat. Hal tersebut telah sesuai dengan teori, bahwa reaksi saponifikasi etil asetat dengan NaOH berorde 2. Sehingga, diperoleh nilai konstanta kecepatan rata-rata reaksi saponifikasi etil asetat dengan NaOH sebesar 0,0067544
2) Apakah perbedaan antara orde reaksi dengan kemolekulan reaksi?
Jawaban:
a. Orde reaksi adalah banyaknya faktor konsentrasi zat reaktan yang mempengaruhi kecepatan reaksi.
b. Kemolekulan reaksi merupakan banyaknya molekul zat pereaksi (reaktan) dalam sebuah persamaan stoikiometri reaksi yang sederhana. Kemolekulan reaksi selalu berupa bilangan bulat positif.
Contoh:
Reaksi: a A + b B c C + d D
Kemolekulan reaksinya = a + b
Reaksi: 2 A + B 3 C + 2 D
3) Apakah yang mempengaruhi laju reaksi? Jelaskan!
Jawaban:
Laju reaksi dipengaruhi oleh beberapa faktor, antara lain:
a. Luas permukaan sentuh
Luas permukaan sentuh memiliki peranan yang sangat penting dalam banyak, sehingga menyebabkan laju reaksi semakin cepat. Begitu juga, apabila semakin kecil luas permukaan bidang sentuh, maka semakin kecil tumbukan yang terjadi antar partikel, sehingga laju reaksi pun semakin kecil. Karakteristik kepingan yang direaksikan juga turut berpengaruh, yaitu semakin halus kepingan itu, maka semakin cepat waktu yang dibutuhkan untuk bereaksi; sedangkan semakin kasar kepingan itu, maka semakin lama waktu yang dibutuhkan untuk bereaksi.
b. Suhu
Suhu juga turut berperan dalam mempengaruhi laju reaksi.Apabila suhu pada suatu reaksi yang berlangusng dinaikkan, maka menyebabkan partikel semakin aktif bergerak, sehingga tumbukan yang terjadi semakin sering, menyebabkan laju reaksi semakin besar.Sebaliknya, apabila suhu diturunkan, maka partikel semakin tak aktif, sehingga laju
reaksi semakin kecil.
c. Katalis
Katalis adalah suatu zat yang mempercepat laju reaksi kimia pada suhu tertentu, tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri.Suatu katalis berperan dalam reaksi tapi bukan sebagai pereaksi ataupun produk.Katalis memungkinkan reaksi berlangsung lebih cepat atau memungkinkan reaksi pada suhu lebih rendah akibat perubahan yang dipicunya terhadap pereaksi.Katalis menyediakan suatu jalur pilihan dengan energi aktivasi yang lebih rendah.Katalis mengurangi energi yang dibutuhkan untuk berlangsungnya reaksi. Katalis dapat dibedakan ke dalam dua golongan utama: katalis homogen dan katalis heterogen. Katalis heterogen adalah katalis yang ada dalam fase berbeda dengan pereaksi dalam reaksi yang dikatalisinya, sedangkan katalis homogen berada dalam fase yang sama. Satu contoh sederhana untuk katalisis heterogen yaitu bahwa katalis menyediakan suatu permukaan di mana pereaksi-pereaksi (atau substrat) untuk sementara terjerat.Ikatan dalam substrat-substrat menjadi lemah sedemikian sehingga memadai terbentuknya produk baru.Ikatan atara produk dan katalis lebih lemah, sehingga akhirnya terlepas. Katalis homogen umumnya bereaksi dengan satu atau lebih pereaksi untuk membentuk suatu perantarakimia yang selanjutnya bereaksi
membentuk produk akhir reaksi, dalam suatu proses yang memulihkan katalisnya. Berikut ini merupakan skema umum reaksi katalitik, di mana C melambangkan katalisnya:
Meskipun katalis (C) termakan oleh reaksi 1, namun selanjutnya dihasilkan kembali oleh reaksi 2, sehingga untuk reaksi keseluruhannya menjadi :
Beberapa katalis yang pernah dikembangkan antara lain berupa katalis Ziegler-Natta yang digunakan untuk produksi masal polietilen dan polipropilen. Reaksi katalitis yang paling dikenal adalah proses Haber, yaitu sintesis amonia menggunakan besi biasa sebagai katalis. Konverter katalitik yang dapat menghancurkan produk emisi kendaraan yang paling sulit diatasi, terbuat dari platina dan rodium.
d. Molaritas
Molaritas adalah banyaknya mol zat terlarut tiap satuan volum zat pelarut.Hubungannya dengan laju reaksi adalah bahwa semakin besar molaritas suatu zat, maka semakin cepat suatu reaksi berlangsung. Dengan demikian pada molaritas yang rendah suatu reaksi akan berjalan lebih lambat daripada molaritas yang tinggi.
e. Konsentrasi
Karena persamaan laju reaksi didefinisikan dalam bentuk konsentrasi reaktan maka dengan naiknya konsentrasi maka naik pula kecepatanreaksinya. Artinya semakin tinggi konsentrasi maka semakin banyak molekulreaktan yang tersedia dengan demikian kemungkinan bertumbukan akansemakin banyak juga sehingga kecepatan reaksi meningkat.
4) Apakah yang dimaksud dengan tetapan laju reaksi?
Jawaban:
Tetapan laju reaksi (k) adalah perbandingan antara laju reaksi dengan konsentrasi reaktan. Nilai k akan semakin besar jika reaksi berlangsung cepat, walaupun dengan konsentrasi reaktan dalam jumlah kecil. Nilai k hanya dapat diperoleh melalui analisis data eksperimen, tidak berdasarkan stoikiometri maupun koefisien reaksi.
XII. Daftar Pustaka
Anonim. 2011. Saponifikasi. (http://id.wikipedia.org/wiki/Saponifikasi (diakses pada 18 April 2014 pukul 16.45 WIB)
Azizah, Utiyah. 2004. LAJU REAKSI . Jakarta : Direktur Jenderal Pendidikan Dasar dan Menengah.
Endah, Soepi dan Suyono. 1990. Kinetika Kimia.Surabaya. Surabaya: University Press IKIP.
Sahrun.2010. Laporan Tetap Praktikum Kimia Fisika II . Mataram: Jurusan Kimia Fakultas MIPA, Universitas Mataram.
Suyono dan Bertha Yonata. 2014. Panduan Praktikum Kimia Fisika III . Surabaya: Kimia FMIPA UNESA.
LAMPIRAN
A. Gambar percobaan
t = 3 menit
t = 8 menit
t = 15 menit
Hasil titrasi yang menghasilkan larutan berwarna merah muda pada variabel waktu t=3 menit, t=8 menit dan t=15 menit
t = 25 menit t = 40 menit
t = 65 menit
Hasil titrasi yang menghasilkan larutan berwarna merah mudaHasil titrasi yang menghasilkan larutan berwarna merah muda pada variabel waktu t=2 hari
B. Lampiran perhitungan
PERHITUNGAN KINETIKA REAKSI SAPONIFIKASI ETIL
ASETAT DENGAN NaOH
Dari percobaandiperoleh data sebagaiberikut:
t (menit) Volume titrasi (mL)
3 9,1 8 9,2 15 9.4 25 9.6 40 9,7 65 9,8 2 hari 9,9
Metode Integral secaraGrafik
()
( )
()
( )
Untuk t = 180 sekon
( ) ( )
()
( ) ()
( )
( )
Menentukan orde 1
Menentukan orde 2
( )
( )
()
( )
Untuk t = 480 sekon
( ) ( )
()
( ) ()
( )
( )
Menentukan orde 1
Menentukan orde 2
( )
( )
( )
( )
Untuk t = 900 sekon
( ) ( )
( ) ()
( )
( )
Menentukan orde 1
Menentukan orde 2
( )
( )
()
()
Untuk t = 1500 sekon
( ) ( )
()
( ) ()
( )
( )
Menentukan orde 1
Menentukan orde 2
( )
( )
()
()
Untuk t = 2400 sekon
( ) ( )
( ) ()
( )
( )
Menentukan orde 1
841284
Menentukan orde 2
( )
( )
()
()
Untuk t = 3900 sekon
( ) ( )
( ) ()
( )
( )
Menentukan orde 1
Menentukan orde 2
( )
( )
()
()
Untuk t = 172800 sekon
( ) ( )
( ) ()
( )
( )
Menentukan orde 1
Menentukan orde 2
( )
( )
()
()
Berdasarkan perhitungan diperoleh hasil sebagai berikut:
t (s) V NaOH (mL) x (a-x) (b-x) Orde 1 Orde 2
180 9,1
0,00042 0,0135033 480 9,2 0,184 2,316 1,816 0,00016 0,0050556 900 9.4 0,188 2,312 1,812 0,0000869 0,0026876 1500 9.6 0,192 2,308 1,808 0,0000533 0,0016073 2400 9,7 0,194 2,306 1,806 0,0000337 0,0010029 3900 9,8 0,196 2,304 1,804 0,0000209 0,0006162 172800 9,9 0,198 2,302 1,802 0,0000005 0,0000139Dari data di atas, dapat dilihat bahwa harga k dari orde 2 cenderung mendekati konstan, harga k dari orde 2 mempunyai selisih yang relative kecil dibandingkan dengan orde 1, sehingga dapat disimpulkan, pada metode non grafik diperoleh orde 2 untuk kinetika reaksi saponifikasi etil asetat.
Metode Grafik
t (s) (a-x) (b-x) In (a-x) ln( a-x)/(b-x)
180 2,318 1,818 0,841 0,243 480 2,316 1,816 0,840 0,243 900 2,312 1,812 0,838 0,244 1500 2,308 1,808 0,836 0,244 2400 2,306 1,806 0,836 0,244 3900 2,304 1,804 0,835 0,245 172800 2,302 1,802 0,834 0,245 y = -0.0000016x + 0.8400501 R² = 0.8561 0.833 0.834 0.835 0.836 0.837 0.838 0.839 0.840 0.841 0.842 0 1000 2000 3000 4000 5000 l n ( a - x ) t (s)