Bab IV
Analisa dan Pembahasan
4.1. Pendahuluan
Bab ini berisi pembahasan mengenai proses karbonatasi mineral emisi CO2,
hasil analisa limbah las karbid yang terdiri atas analisa komposisi serta kelarutanya dalam air distilasi. Bagian inti dalam bab ini adalah pembahasan mengenai hasil penelitian yang diperoleh. Pada pembahasan hasil penelitian terdiri atas pengaruh dari setiap variasi yang dilakukan serta hasil perhitungan koefisien transfer massa untuk setiap variasi.
4.2. Karbonatasi Mineral Emisi CO2
Karbonatasi mineral emisi CO2 adalah suatu proses pengolahan emisi CO2
dimana dalam proses tersebut CO2 akan diubah ke dalam bentuk padatan karbonat
anorganik melalui suatu proses kimia. Selama ini proses karbonatasi mineral emisi CO2 pada umumnya memanfaatkan senyawa alkali yang terdapat di alam seperti
sepertine dan olivine. Walaupun keberadaan senyawa-senyawa ini sangat berlimpah, namun untuk memperolehnya dibutuhkan proses penambangan terlebih dahulu. Berdasarkan pertimbangan tersebut, sudah dilakukan beberapa penelitian untuk memanfaatkan limbah industri yang kaya akan senyawa alkali.
Keuntungan dari proses karbonatasi mineral menggunakan bahan baku limbah industri selain dapat menanggulangi sejumlah emisi CO2 serta stabilisasi dari limbah
industri itu sendiri adalah proses solidifikasi yang terjadi secara cepat lewat proses karbonatasi dapat mengikat dan memerangkap logam berbahaya. Selain itu material limbah alkali berdasarkan beberapa hasil penelitian menunjukan reaktivitas yang lebih tinggi dibandingkan mineral silikat alam (Huijgen et al., 2004). Keuntungan utama dari seluruh proses karbonatasi mineral adalah pembentukan mineral karbonat seperti calcite (CaCO3) dan magnesite (MgCO3) sebagai produk akhir yang diketahui bersifat
stabil melebihi skala waktu geologis sehingga akan aman dalam penimbunannya, selain itu produk akhir tersebut dapat pula dimanfaatkan sebagai material konstruksi.
Pada pelaksanaan tugas akhir ini, dilakukan penelitian untuk melihat potensi pemanfaatan limbah las karbid dalam proses karbonatasi mineral emisi CO2. Secara
garis besar, terdapat dua pilihan mekanisme dalam melakukan proses karbonatasi mineral yaitu karbonatasi mineral langsung dan tidak langsung. Yang membedakan kedua mekanisme ini adalah pada proses karbonatasi mineral tidak langsung, senyawa alkali yang akan dimanfaatkan dalam proses karbonatasi mineral diekstraksi terlebih dahulu dari senyawa pembawanya. Dengan mengasumsikan cukup tingginya konsentrasi senyawa alkali pada limbah las karbid yang akan dimanfaatkan sebagai bahan baku, maka dalam pelaksanaan penelitian dilakukan mekanisme karbonatasi mineral secara langsung.
Proses karbonatasi mineral secara langsung yang akan dilakukan adalah reaksi karbonatasi mineral dalam bentuk larutan. Pada proses ini, limbah las karbid yang merupakan bahan baku dalam proses karbonatasi mineral akan dilarutkan terlebih dahulu dalam air distilasi. Pada proses perlarutan tersebut, senyawa-senyawa alkali terutama kalsium hidroksida akan terlarut dalam air distilasi. Senyawa-senyawa alkali inilah yang kemudian akan bereaksi dengan ion karbonat yang merupakan hasil dari terlarutnya gas CO2 dalam air dan membentuk senyawa mineral karbonat seperti
kalsium karbonat.
Dengan dilakukanya proses karbonatasi mineral dalam bentuk larutan limbah las karbid, maka prinsip yang diterapkan dalam proses ini adalah absorpsi gas dengan melibatkan reaksi kimia. Gas CO2 terlebih dahulu harus dapat terlarut dalam air
distilasi, dan begitu pula senyawa alkali dari limbah las karbid sebelum keduanya dapat bereaksi membentuk senyawa mineral karbonat. Keseluruhan reaksi yang terjadi dalam proses karbonatasi mineral dengan memanfaatkan limbah las karbid adalah sebagai berikut:
Proses hidrasi Kalsium Hidroksida :
2H+ + Ca(OH)2→ Ca2+(aq) + 2H2O (1a)
Proses Pelarutan gas CO2 :
(1) CO2(g) → CO2 (aq) (1b)
(2) CO2 (aq) + H2O ‹═› H2CO3(aq) ‹═› H+ + HCO3-(aq) (1c)
(3) HCO3-(aq) ‹═› H+ + CO32- (aq) (1d)
Proses Karbonatasi :
Berdasarkan mekanisme reaksi diatas dapat dilihat bahwa pada akhir reaksi, gas CO2 yang tersisihkan akan berada dalam bentuk senyawa karbonat sebagai hasil
akhir reaksi, namun dapat pula dalam bentuk senyawanya yang telah terlarut dalam air (CO2 terlarut, ion bikarbonat, ion karbonat).
4.3. Analisa Limbah Las Karbid
Limbah las karbid yang digunakan dalam penelitian ini diambil dari sebuah usaha pengelasan yang berlokasi di Cimahi. Sebelum dimanfaatkan dalam pelaksanaan penelitian, dilakukan terlebih dahulu analisa limbah las karbid tersebut. Analisa yang dilakukan pada limbah las karbid tersebut terdiri atas analisa komposisi serta analisa kelarutan limbah las karbid.
4.3.1 Analisa komposisi limbah las karbid
Analisa ini dilakukan dengan tujuan untuk mengetahui komposisi utama dari limbah las karbid yang digunakan. Analisa komposisi menggunakan metode AAS (Atomic Absorption Spectophotometry) dan dilakukan di Lab Kimia P3GL Bandung. Parameter-parameter yang diperiksa merujuk pada komposisi utama dari limbah las karbid yang terdapat di literatur. Hasil analisa komposisi dapat dilihat pada Tabel 4.1. Secara teoritis, komposisi utama dari limbah las karbid adalah senyawa kalsium hidroksida karena limbah ini merupakan hasil dari reaksi antara kalsium karbid dengan air dalam proses pembuatan gas asetilen. Reaksi tersebut selengkapnya adalah:
CaC2(s) + 2 H2O(l)→ C2H2(g)+ Ca(OH)2(s/l) (2)
Pada literatur dikatakan bahwa kandungan kalsium hidroksida pada limbah las karbid dapat sangat bervariasi antara kisaran 70-95% serta kalsium karbonat sekitar 5-25% berat kering (Bunger, 2004). Sedangkan dari hasil analisa komposisi kimia sampel limbah las karbid diperoleh kandungan berat basah kalsium hidroksida dari sampel adalah sebesar 50,28%. Nilai tersebut menunjukan bahwa sampel limbah las karbid tersebut memiliki kemurnian yang relatif tidak terlalu besar. Hal tersebut juga terlihat dengan membandingkan komposisi sampel limbah las karbid yang dimiliki dengan dua data komposisi limbah las karbid lainnya. Namun demikian, penelitian ini bertujuan untuk melihat apakah dengan komposisi tersebut, limbah las karbid yang diambil sampelnya ini memiliki potensi untuk dimanfaatkan dalam proses karbonatasi
Dari data hasil analisa kimia pada Tabel 4.1., dapat dilihat bahwa sampel limbah las karbid tersebut mengandung senyawa magnesium sebagai magnesium hidroksida. Keberadaan magnesium tersebut secara teoritis dapat menambah kapasitas penyisihan CO2 karena magnesium hidroksida dapat bereaksi dengan CO2
membentuk magnesium karbonat. Kandungan uap air yang cukup tinggi pada sampel limbah las karbid menunjukan proses yang dilakukan pada pembuatan gas asetilen adalah proses basah dimana kalsium karbid direaksikan dengan air berlebih.
Selain itu sampel limbah las karbid tersebut juga memiliki persen berat karbon yang cukup tinggi, yaitu sebesar 23,32%. Hal ini menunjukan bahwa proses pembuatan gas asetilen yang menghasilkan limbah las karbid tersebut belum cukup optimal. Dapat dikatakan demikian karena karbon yang terukur, kemungkinan besar berasal dari kalsium karbid yang tidak bereaksi atau karbon yang berasal dari batu bara yang digunakan dalam proses pembuatan kalsium karbid (Bunger, 2004). Selain itu, keberadaan karbon ini juga dapat berasal dari sisa proses kalsinasi yang tidak maksimal dalam tahap pembuatan batu kapur yang merupakan bahan baku pembuatan kalsium karbid itu sendiri. Hal ini berarti apabila kedua proses tersebut dapat dilakukan secara lebih baik, maka tingkat kemurnian limbah las karbid yang dihasilkan akan bisa lebih tinggi dari nilai 50,28% sehingga dengan begitu akan meningkatkan potensinya untuk dimanfaatkan sebagai sumber bahan baku pembuatan larutan penyerap kalsium hidroksida.
Tabel 4.1. Komposisi limbah las karbid (% berat basah)
Parameter Sumber a b c Ca(OH)2 80.5 92.5 50.280 CaCO3 - 1.8 - Mg(OH)2 - - 0.236 SiO2 3.4 1.5 2.415 Al2 O3 1.9 1.6 0.489 Fe2 O3 0.2 0.157 Na2 O 0.7 - 0.007 P2 O5 0.7 - <0.01 Mineral lain 1 -
Karbon (sebagai coke) 3.6 - 15.646
Kandungan air 8 - 32.908
TOTAL 100 97.4 102.138
Sumber : a) United States Patent 5997833 b) International Industrial Gas Ltd. c) Hasil analisa sampel limbah las karbid
Dalam proses karbonatasi mineral, senyawa yang paling berperan penting adalah senyawa alkali. Dengan memanfaatkan limbah sebagai bahan baku proses tersebut, maka alasan utama pemilihan sumber limbah adalah kandungan senyawa alkali di dalam limbah tersebut. Beberapa penelitian sudah pernah dilakukan dengan memanfaatkan jenis limbah lain sebagai bahan baku dari proses karbonatasi mineral ini antara lain debu kiln dari industri semen serta slag dari industri baja. Perbandingan komposisi antara kedua limbah tersebut dengan limbah las karbid yang digunakan dalam penelitian ini dapat dilihat pada Tabel 4.2. Komposisi utama yang harus diperhatikan diantara ketiga jenis limbah tersebut adalah kandungan senyawa alkalinya baik senyawa kalsium maupun magnesium.
Pada Tabel 4.2 kita dapat melihat dari ketiga jenis limbah tersebut, persen komposisi terbesar adalah senyawa kalsium baik dalam bentuk kalsium hidroksida maupun kalsium oksida. Kandungan kalsium yang cukup besar ini disebabkan dalam proses penghasilnya memanfaatkan batu kapur baik secara langsung maupun produk olahan dari batu kapur tersebut (seperti kapur karbid). Batu kapur sendiri merupakan salah satu bahan baku industri yang tersedia dalam jumlah yang sangat besar di permukaan bumi dengan komposisi utamanya adalah senyawa kalsium dan magnesium (untuk jenis dolomite).
Tabel 4.2. Perbandingan komposisi limbah las larbid dengan jenis limbah alkali lainnya
Komposisi Limbah las karbid a)c) Debu kiln semen a)d) Slag baja b)e)
Ca(OH)2 50.280 - CaCO3 - - CaO - 34.5 41.182 Mg(OH)2 0.236 - MgO - 2.08 10.417 SiO2 2.415 13.17 35.368 Al2 O3 0.489 3.41 9.448 Fe2 O3 0.157 2.89 0.630 Na2 O 0.007 0.52 - P2 O5 <0.01 0.05 - SO3 - 4.78 1.938 K2O - 5.84 -
Komposisi Limbah las karbid a)c) Debu kiln semen a)d) Slag baja b)e)
SrO - 0.02 -
Mn2O3 - 0.04 -
Mineral lain - - -
Karbon (sebagai coke) 15.646 - -
Kandungan air 32.908 31.2 -
TOTAL 102.138 98.69 100
Ket : a) Berat basah
b) Berat kering
Sumber : c) Hasil analisa limbah las karbid
d) Deborah N. Huntzinger, D. N.: Carbon Dioxide Sequestration in Cement Kiln Dust Through Mineral Carbonation, 2006
e) Teir, S.: Reduction of CO2 Emissions by Producing Calcium
Carbonates from Calcium Silicates and Steelmaking Slag, 2006
Jika dibandingkan antara ketiga jenis limbah tersebut, komposisi senyawa alkali pada limbah las karbid sebesar 50,516% sedangkan untuk debu kiln semen dan slag baja berturut-turut adalah 30,91% dan 51,6%. Dengan perbandingan seperti itu bisa dikatakan limbah las karbid memiliki potensi yang sama atau bahkan lebih besar jika dibandingkan dengan debu kiln semen sebagai alternatif bahan baku senyawa alkali dalam proses karbonatasi mineral.
Selain itu, disamping kandungan karbon yang cukup tinggi, sampel limbah las karbid relatif tidak memiliki pengotor lain yang cukup besar komposisinya. Pada debu kiln semen dan slag baja kita menemukan persen berat SiO2 yang cukup tinggi jika
dibandingkan pada limbah las karbid yang hanya sebesar 2,415%. Keberadaan unsur-unsur lain dalam limbah harus diperhatikan apakah dapat mempengaruhi proses karbonatasi yang akan dilakukan dengan memanfaatkan limbah tersebut. Selain itu juga keberadaan unsur lain menjadi pertimbangan dalam pemilihan alternatif proses karbonatasi mineral yang akan dilakukan. Apabila unsur pengotor lain terdapat dalam variasi yang cukup besar dan jumlah yang cukup banyak (seperti pada debu kiln semen) maka proses karbonatasi mineral secara tidak langsung dengan terlebih dahulu mengekstraksi senyawa kalsium yang terdapat di limbah tersebut tidak dianjurkan karena akan timbul masalah dalam pengolahan materi pengekstraksi yang biasanya menggunakan asam dimana pada mendia pengekstraksi tersebut kemungkinan unsur-unsur lain untuk terlarut di dalamnya cukup besar (Teir S., 2006). Hal inilah yang menyebabkan pada proses karbonatasi mineral dengan memanfaatkan limbah, metode
tidak langsung dengan terlebih dahulu mengekstraksi senyawa yang dibutuhkan jarang dilakukan.
Setelah memutuskan proses karbonatasi mineral dilakukan dengan metode langsung, maka terdapat dua mekanisme yang dapat dipilih, mekanisme padatan atau larutan. Dalam kasus sampel limbah las karbid yang diambil, karena kandungan air yang cukup tinggi mencapai hampir 40% maka mekanisme padatan tidak mungkin dilakukan sehingga mekanisme yang dipilih adalah larutan. Dalam mekanisme larutan ini limbah las karbid akan dilarutkan terlebih dahulu kedalam air distilasi. Bisa dikatakan jika dibandingkan dengan kedua jenis limbah lainnya, pemanfaatan limbah las karbid cenderung lebih aman dari segi aspek lingkungan dikarenakan variasi komposisi yang tidak terlalu besar dan persen komposisi dari unsur-unsur lain selain senyawa kalsium dan magnesium juga tidak setinggi yang lainnya.
4.3.2 Analisa kelarutan limbah las karbid 4.3.2.1. Konsentrasi ion Ca2+ terlarut
Selain dilakukan analisa komposisi limbah las karbid, dilakukan pula analisa kelarutan dari sampel limbah las karbid di dalam air distilasi. Hal ini perlu dilakukan dikarenakan proses karbonatasi mineral akan dilakukan dalam bentuk larutan dari limbah las karbid yang awalnya berbentuk semi padat (slurry). Dengan ketidakmurnian yang dimiliki oleh limbah las karbid tersebut, maka data kelarutan dari senyawa kalsium hidroksida murni tidak dapat digunakan sebagai patokan. Dengan dilakukan analisa kelarutan limbah las karbid, diharapkan dapat diperkirakan nilai kelarutan maksimum dari limbah las karbid tersebut pada air distilasi.
Dalam analisa kelarutan ini, analisa yang dilakukan adalah analisa ion Ca2+ terlarut serta analisa asidi-alkalinitas untuk mengetahui komposisi CO2 terlarut, ion
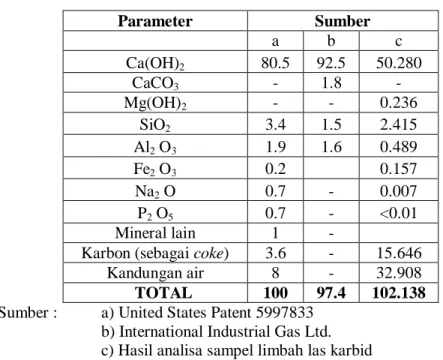
bikarbonat dan ion karbonat dari hasil pelarutan limbah las karbid tersebut. Analisa dibatasi hanya pada pengukuran konsentrasi ion Ca2+ serta analisa asiditas-alkalinitas dikarenakan pada proses karbonatasi mineral nantinya diperkirakan senyawa yang berperan penting adalah kalsium hidroksida khususnya ion kalsium terlarut. Larutan limbah las karbid diperoleh dengan melarutkan sejumlah massa limbah las karbid ke dalam 100 mL air distilasi. Hasil dari analisa kelarutan limbah las karbid dapat dilihat pada Gambar 4.1.
diperoleh tampilan grafik seperti pada Gambar 4.1. Dapat dilihat pada gambar tersebut pada dua variasi massa terakhir, besarnya peningkatan ion Ca2+ yang terlarut tidak terlalu signifikan dengan peningkatan jumlah limbah las karbid yang dilarutkan. Pada variasi ke-12, pelarutan limbah las karbid sebesar 8100,35 mg/100 mL air distilasi menghasilkan jumlah ion Ca2+ terlarut sebanyak 1392,429 mg/L. Sedangkan untuk variasi terakhir, dengan melarutkan 10800,7 mg limbah las karbid kedalam 100 mL air distilasi diperoleh nilai ion Ca2+ terlarut sebesar 1408,714 mg/L. Berdasarkan hal tersebut disimpulkan bahwa pada pelarutan 8100,35 mg limbah las karbid kedalam 100 mL air distilasi, jumlah ion Ca2+ terlarut yang dapat diperoleh sudah optimum karena dengan melarutkan limbah las karbid dalam jumlah yang lebih banyak lagi ternyata memberikan hasil yang tidak terlalu signifikan.
Sumber : Hasil penelitian
Gambar 4.1. Kelarutan limbah las karbid
Selain untuk mengetahui tingkat kelarutan optimum dari limbah las karbid, dari analisa kelarutan kita dapat mengetahui proporsi dari Kalsium hidoksida yang terlarut dari keseluruhan kalsium hidroksida yang terdapat pada seluruh limbah las karbid yang dilarutkan. Dengan mengetahui proporsi ini, kita dapat mengetahui apakah seluruh dari kalsium hidroksida pada limbah las karbid terlarut ketika dilakukan penambahan 100 mL air distilasi. Perbandingan antara besarnya kalsium
0 150 300 450 600 750 900 1050 1200 1350 1500 80 880 1680 2480 3280 4080 4880 5680 6480 7280 8080 8880 9680 10480 11280
mg Limbah Las Karbid / 100 ml air distilasi
m g/ L sa m pe l
mg Ca2+/L mg OH-/L mg CO3 2-/L
1408.71 1392.43 1337.46 1310 1335 1360 1385 1410 5400 8100 10800
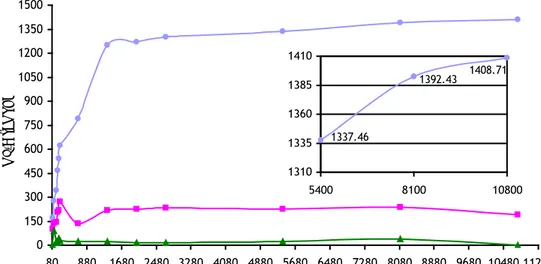
hidroksida yang terlarut dengan kalsium hidroksida tersedia dari proses pelarutan limbah las karbid dapat dilihat pada Gambar 4.2.
Pada Gambar 4.2. dapat dilihat bahwa sampai pada penambahan 2705 mg limbah las karbid kedalam 100 mL air distilasi, hampir seluruh kalsium hidroksida yang terdapat di dalam limbah las karbid tersebut terlarut. Berarti sampai batas 2705 mg, pelarutan limbah las karbid terjadi secara optimal. Hal ini dimungkinkan karena nilai kelarutan dari senyawa kalsium hidroksida jauh lebih besar jika dibandingkan dengan nilai kelarutan dari senyawa-senyawa lain yang terdapat pada limbah las karbid tersebut.
Ketika sudah melewati nilai 2705 mg, perbandingan antara kalsium hidroksida terlarut dengan kalsium hidroksida yang terdapat pada limbah las karbid yang dilarutkan semakin kecil berarti semakin banyak kalsium hidroksida yang tidak terlarut. Hal ini dikarenakan proses pelarutan kalsium hidroksida dalam air dibatasi oleh nilai kelarutan maksimum dari kalsium hidroksida tersebut. Walaupun dengan variasi massa limbah las karbid yang lebih besar masih terlihat kenaikan konsentrasi kalsium hidroksida, namun proporsinya dengan kalsium hidroksida total yang dilarutkan semakin kecil. Akhirnya seperti yang terlihat pada Gambar 4.1. ketika dilarutkan limbah las karbid sebanyak 8100,35 mg dan 10800 mg dalam 100 mL air distilasi, banyaknya ion Ca2+ terlarut yang terukur tidak jauh berbeda.
316.00 5316.00 10316.00 15316.00 20316.00 25316.00 30316.00 35316.00 40316.00 45316.00 50316.00 900 10900 20900 30900 40900 50900 60900 70900 80900 90900 100900
mg Limbah Las Karbid / 1000 ml air distilasi
m g/ L Ca (O H )2
Ca(OH)2 pada limbah las karbid Ca(OH)2 terlarut 1360.07 2705.00, 1152.42 300 1300 2300 3300 900 2900 4900 6900
Sumber : Hasil penelitian
Gambar 4.2. Proporsi kalsium hidroksida terlarut dengan total kalsium hidroksida pada limbah las karbid
Merujuk pada Tabel 2.7, nilai teoritis kelarutan maksimun dari kalsium hidroksida dalam air murni untuk temperatur 25˚C diperoleh sekitar 1,57 g/L. Nilai ini diperoleh dari hasil interpolasi dari grafik kelarutan maksmimum kalsium hidroksida pada variasi temperatur yang dapat dibentuk dari data-data pada tabel tersebut. Pada tabel tersebut dapat dilihat bahwa kelarutan dari kalsium hidroksida menurun seiring dengan peningkatan temperatur.
Jika dibandingkan dengan nilai kelarutan maksimum, maka hasil analisa kelarutan maksimum limbah las karbid sebesar 1,39 – 1,4 g ion Ca2+ terlarut / L air distilasi (sebanding dengan 2,58 – 2,6 g/L Ca(OH)2) jauh melampaui batas kelarutan
maksimum dari kalsium hidroksida. Ada beberapa hal yang diperkirakan menjadi penyebab hal tersebut, pertama ketika dilakukan pelarutan limbah las karbid terdapat senyawa-senyawa lain yang mungkin saja ikut terlarut dalam air distilasi tersebut. Menurut teori sebagian besar dari senyawa garam dapat meningkatkan kelarutan dari Ca(OH)2 sekitar 10-15% pada larutan dengan 0,1-0,2% garam (Boynton, 1966).
Selain keberadaan beberapa garam, beberapa jenis senyawa seperti K2O dan Na2O
juga dapat meningkatkan kelarutan dari Kalsium hidroksida dalam air hingga 7% (Boynton, 1966).
Nilai kelarutan kalsium hidroksida diperoleh dari hasil analisa kesadahan kalsium. Pada analisa kesadahan kalsium, nilai yang diperoleh adalah banyaknya ion kalsium terlarut dalam sampel yang dianalisa (dalam mg/L CaCO3). Dari nilai jumlah
ion Ca2+ terlarut inilah kemudian dikonversikan ke dalam nilai kalsium hidroksida terlarut dalam sampel. Ketika dilakukan konversi, berarti diasumsikan keseluruhan ion Ca2+ berasal dari kalsium hidroksida terlarut. Pada kenyataanya, mungkin saja ion Ca2+ tersebut berasal dari senyawa kalsium lain yang terdapat dalam limbah las karbid dan juga ikut terlarut seperti CaO dan CaSO4. Hal ini juga dapat menjadi salah satu
penyebab mengapa konsentrasi dari kalsium hidroksida pada larutan limbah las karbid bisa lebih tinggi dari nilai maksimum teoritisnya. Hal ini dapat terlihat dari hasil analisa perbandingan mol kation dan anion dari proses pelarutan limbah las karbid.
Dari hasil perbandingan pada Gambar 4.3. dapat terlihat bahwa dari seluruh mol Ca2+ yang terlarut di dalam air, hanya sebagian saja yang kemungkinan berasal dari senyawa kalsium hidroksida, sedangkan sebagian lainya berasal dari senyawa kalsium lainya. Dapat dilihat pula bahwa secara perhitungan terdapat ion Ca2+ terlarut yang berasal dari kalsium karbonat, sedangkan dari hasil analisa komposisi limbah las
dari hasil reaksi antara kalsium hidroksida yang terdapat dalam limbah las karbid dengan CO2 yang berada di atmosfer ketika dilakukan proses pelarutan.
0 0.005 0.01 0.015 0.02 0.025 0.03 0.035 0.04 0 20000 40000 60000 80000 100000 120000
mg limbah las karbid/ 1000 ml air distilasi
m
ol
/
L
Ca 2+ total Ca(OH)2 CaCO3 Ca( )
Sumber : Hasil penelitian
Gambar 4.3. Perbandingan mol untuk setiap senyawa kalsium dari proses pelarutan limbah las karbid
Namun walaupun ternyata proporsi dari kalsium hidroksida bukan yang terbesar, unsur yang memainkan peranan penting dalam proses karbonatasi mineral nantinya adalah ion Ca2+ terlarut, sedangkan kalsium hidroksida hanya salah satu sumber dari keberadaan ion Ca2+ terlarut tersebut. Keberadaan ion Ca2+ terlarut ini selain berasal dari kalsium hidroksida, bisa berasal dari kalsium oksida, kalsium karbonat dan senyawa kalsium lainya yang mungkin saja terdapat dalam limbah las karbid tersebut walaupun mungkin dalam jumlah yang relatif kecil. Untuk lebih jelasnya nilai kelarutan dari beberapa senyawa yang terdapat pada limbah las karbid disajikan pada Tabel 2.6.
Pada Tabel 2.6. dapat dilihat nilai molaritas dari senyawa kalsium hidroksida relatif lebih besar dibandingkan beberapa senyawa lain yang terdapat di limbah las karbid yaitu sebesar 1,26 x 10-2 M atau dengan nilai kelarutan sebesar 1,57 g/L. Berdasarkan hal tersebut kita dapat mengasumsikan bahwa ketika dilakukan pelarutan limbah las karbid dilarutkan, maka senyawa yang akan terlebih dahulu terlarut atau yang terlarut dalam proporsi paling besar adalah senyawa kalsium hidroksida. Namun apabila terdapat senyawa kalsium selain kalsium hidroksida, dalam hal ini kalsium
sulfat maka terdapat kemungkinan bahwa ion Ca2+ yang terlarut tersebut sebagian berasal dari kalsium sulfat yang terlarut. Hal ini dimungkinkan karena nilai kelarutan dari kalsium sulfat lebih besar di air jika dibandingkan dengan nilai kelarutan kalsium hidroksida. Tidak dilakukannya analisa parameter sulfat dalam limbah las karbid menyebabkan perkiraan komposisi kalsium sulfat pada sampel limbah las karbid tidak dapat dilakukan. Jika memang terdapat senyawa kalsium sulfat pada limbah las karbid tersebut, kemungkinan besar berasal pemanfaatan batu bara dari proses pembuatan kapur karbid.
Senyawa dari unsur lainnya yang memiliki kelarutan lebih besar dari kalsium hidrosksida hanya natrium oksida yang di dalam air akan membentuk natrium hidroksida yang terlarut. Natrium hidroksida ini nantinya juga dapat bereaksi dengan CO2 membentuk Natrium karbonat menurut reaksi :
2NaOH + CO2→ Na2CO3 + H2O (3)
4.3.2.2 pH dan kelarutan limbah las karbid
Selain terlihat dari jumlah ion Ca2+, peningkatan jumlah kalsium hidroksida yang terlarut dari pelarutan limbah las karbid juga dapat terlihat dari peingkatan derajat keasaman (pH) larutan. Hal ini dikarenakan kalsium hidroksida merupakan jenis basa kuat, dengan begitu sedikit saja penambahan kalsium hidroksida pada air distilasi yang pH-nya relatif netral, akan segera meningkatkan pH dari air tersebut.
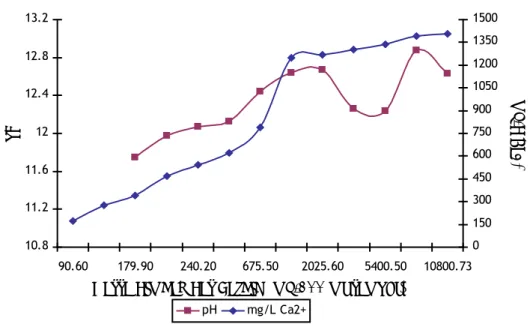
Pada Gambar 4.4. dapat dilihat bahwa pada data-data kelarutan awal, peningkatan pH berbanding lurus dengan peningkatan jumlah ion Ca2+ terlarut dalam larutan. Hal tersebut menunjukan bahwa baik nilai pH maupun jumlah ion Ca2+ terlarut pada larutan sangat dipengaruhi oleh banyaknya limbah las karbid yang dilarutkan sebagai sumber dari unsur alkali dalam hal ini kalsium. Namun ternyata untuk data-data penambahan massa limbah las karbid sebesar 2,7; 5,4 dan 10,8 garam, terjadi penurunan nilai pH dari kecenderungan yang terjadi. Kemungkinan besar hal ini dikarenakan pengukuran dari keseluruhan data pH tersebut tidak dilakukan pada waktu yang sama, sehingga terjadi ketidak akuratan dalam pembacaan nilai pH. Ketidakakuratan disini dapat disebabkan oleh kurang terkalibrasinya pH meter yang digunakan pada saat pengukuran data pH untuk variasi tersebut. Kalibrasi pH meter memang tidak dilakukan setiap saat akan digunakan untuk pengukuran, namun dilakukan secara periodik.
10.8 11.2 11.6 12 12.4 12.8 13.2 90.60 179.90 240.20 675.50 2025.60 5400.50 10800.73
Massa Limbah Las Karbid (mg/100 ml sampel)
pH 0 150 300 450 600 750 900 1050 1200 1350 1500 m g/L C a2 + pH mg/L Ca2+
Sumber : Hasil penelitian
Gambar 4.4. Pengaruh variasi massa limbah las karbid terhadap pH akhir larutan serta jumlah ion Ca2+
Nilai pH yang mencapai lebih besar dari 12 dapat menjadi indikasi baik kalsium hidroksida maupun senyawa kalsium lain yang terdapat di limbah las karbid tersebut membentuk kalsium hidroksida dalam fasa larutanya. Dapat dianggap demikian karena berdasarkan analisa komposisi, senyawa yang memiliki potensi untuk menciptakan suasana basa ketika limbah las karbid tersebut dilarutkan adalah kalsium hidroksida. Selain itu berdasarkan teori, larutan jenuh kalsium hidroksida murni dapat mencapai pH 12,53 pada temperatur 25˚C (Boynton, 1966).
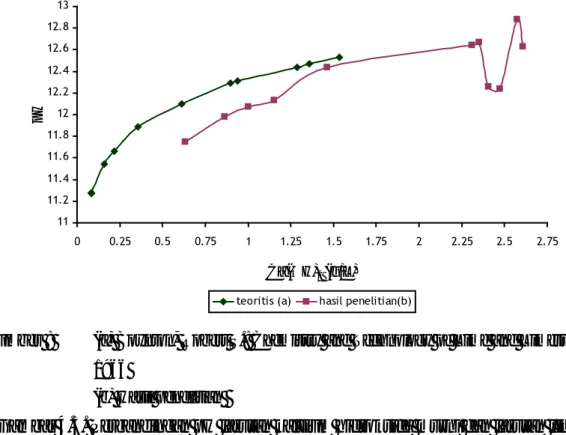
Jika kita menbandingkan nilai pH larutan kalsium hidroksida yang diperoleh dari pelarutan limbah las karbid dengan pH dari larutan kalsium hidroksida murni untuk berbagai variasi konsentrasi pada temperatur 25˚C, akan diperoleh hasil seperti yang terlihat pada Gambar 4.5.
11 11.2 11.4 11.6 11.8 12 12.2 12.4 12.6 12.8 13 0 0.25 0.5 0.75 1 1.25 1.5 1.75 2 2.25 2.5 2.75 Ca(OH)2 (g/L) p H
teoritis (a) hasil penelitian(b)
Sumber : (a) Boynton, Robert S.: Chemistry and Technology of Lime and Limestone, 1966
(b) Hasil penelitian
Gambar 4.5. Perbandingan pH larutan kalsium hidroksida murni dan larutan limbah las karbid dalam berbagai variasi konsentrasi pada temperatur 25˚C.
Berdasarkan Gambar 4.5. dapat dilihat bahwa untuk nilai-nilai yang dapat dibandingkan, pH larutan limbah las karbid cenderung selalu lebih rendah jika dibandingkan dengan pH larutan kalsium hidroksida murni. Hal yang dicurigai menjadi penyebab dari fenomena ini adalah keberadaan garam-garam yang ketika bereaksi dengan air menghasilkan asam dan basa. Asam yang dihasilkan ini kemudian sedikit memberikan efek menetralkan kalsium hidroksida terlarut. Dikarenakan kalsium hidroksida adalah basa kuat kemungkinan besar garam yang dimaksud adalah garam yang terbentuk dari asam kuat serta cenderung terlarut di dalam air. Hal ini dikarenakan dengan komposisinya yang jauh lebih kecil jika dibandingkan dengan komposisi kalsium hidroksida, namun sudah dapat memberikan efek menurunkan pH. Namun jika melihat analisa komposisi dari limbah las karbid, senyawa yang kemungkinan besar dapat memberikan sifat asam ketika limbah las karbid tersebut dilarutkan ke dalam air adalah phospat pentoksida yang ketika terlarut di dalam air akan membentuk H3PO4 menurut reaksi :
Tapi karena asam yang terbentuk adalah asam lemah, maka dibutuhkan phospat pentoksida dalam jumlah yang cukup banyak agar dapat menurunkan pH dari larutan limbah las karbid, sedangkan dari analisa komposisi diketahui persen massa dari senyawa ini sangat kecil (kurang dari 0,01%). Hal ini berarti terdapat senyawa lain yang dapat sedikit menekan nilai pH dari larutan penyerap yang dibuat dari limbah las karbid. Apabila asumsi bahwa dalam limbah las karbid tersebut terdapat kalsium sulfat (CaSO4), jka memang terdapat kalsium sulfat dalam limbah las karbid
tersebut, maka terjadinya penurunan nilai pH dari nilai teoritisnya dapat dijelaskan dengan pembentukan asam sulfat ketika kalsium sulfat tersebut terlarut. Keberadaan asam sulfat akan dapat sedikit menetralkan suasana basa yang diciptakan oleh terlarutnya kaslium hidroksida. Namun dikarenakan tidak dilakukanya pengukuran parameter sulfat dalam larutan limbah las karbid, dugaan ini tidak dapat dibuktikan sehingga mungkin saja terdapat faktor lain yang dapat menyebabkan terjadinya penurunan pH dari larutan limbah las karbid tersebut. Rekapitulasi data hasil analisa kelarutan limbah las karbid dapat dilihat pada Tabel 4.3.
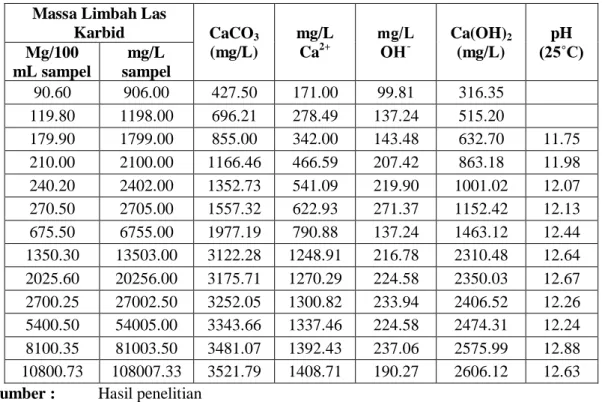
Tabel 4.3. Rekapitulasi hasil analisa kelarutan limbah las karbid dalam 100 mL air distilasi (25˚C)
Massa Limbah Las
Karbid CaCO3 (mg/L) mg/L Ca2+ Ca(OH)2 (mg/L) pH (25˚C) Mg/100 mL sampel mg/L sampel 90.60 906.00 427.50 171.00 99.81 316.35 119.80 1198.00 696.21 278.49 137.24 515.20 179.90 1799.00 855.00 342.00 143.48 632.70 11.75 210.00 2100.00 1166.46 466.59 207.42 863.18 11.98 240.20 2402.00 1352.73 541.09 219.90 1001.02 12.07 270.50 2705.00 1557.32 622.93 271.37 1152.42 12.13 675.50 6755.00 1977.19 790.88 137.24 1463.12 12.44 1350.30 13503.00 3122.28 1248.91 216.78 2310.48 12.64 2025.60 20256.00 3175.71 1270.29 224.58 2350.03 12.67 2700.25 27002.50 3252.05 1300.82 233.94 2406.52 12.26 5400.50 54005.00 3343.66 1337.46 224.58 2474.31 12.24 8100.35 81003.50 3481.07 1392.43 237.06 2575.99 12.88 10800.73 108007.33 3521.79 1408.71 190.27 2606.12 12.63
4.4. Emisi CO2 Dari Unit CO2Removal
Pada penelitian ini, sumber emisi gas CO2 berasal dari unit CO2 removal PT
Pertamina EP Region Jawa field Cilamaya. Alasan pemilihan sumber emisi CO2 dari
unit CO2 removal ini dikarenakan secara teoritis konsentrasi gas CO2 dari unit ini
akan sangat tinggi (> 90%), selain itu setelah melewati unit reflux drum maka temperatur gas CO2 akan turun hingga mendekati temperatur kamar serta tekanannya
tidak terlalu besar. Setelah melewati unit reflux drum, temperatur gas buang unit CO2
removal akan turun menjadi 28,89˚C dengan tekanan sebesar 8 psi (0,544 atm).
Dengan proses karbonatasi mineral yang dilakukan pada kondisi standar (1 atm, 25˚C)
diharapkan tidak terjadi perubahan komposisi dan karakteristik gas yang terlalu signifikan selama proses penelitian dilakukan.
Pada unit CO2 removal, CO2 yang terdapat pada flue gas disisihkan dengan
menggunakan suatu pelarut/absorbent Methylethylamine (MEA). Ketika terjadi kontak antara flue gas dengan MEA tersebut, gas CO2 akan bereaksi dengan amine. Setelah
terjadi proses penyisihan CO2, tahap selanjutnya adalah proses regenerasi MEA
dengan cara pemanasan. Ketika terjadi proses pemanasan tersebut, gas CO2 dengan
tingkat kemurnian yang cukup tinggi akan terlepas dari senyawa amine (MEA). Senyawa amine yang sudah terbebas dari gas CO2 kemudian digunakan kembali
dalam proses penyisihan gas CO2 dari flue gas. Pada unit CO2 removal di field
Cilamaya ini, CO2 yang sudah dipisahkan dari senyawa amine lalu dimasukan ke
dalam unit reflux drum untuk didinginkan lalu sebagian dialirkan ke dalam kompressor untuk dimampatkan. CO2 yang sudah dimampatkan tersebut kemudian
dimanfaatkan oleh sebuah industri bahan kimia sebagai bahan baku gas CO2. Gas CO2
yang tidak dialirkan ke dalam kompresor akan dilepaskan ke atmosfer. Pada Tabel 4.4. dapat dilihat banyaknya gas CO2 yang dihasilkan tiap harinya serta proporsi
antara yang dimanfaatkan serta dlepaskan ke atmosfer.
Jika dilihat data pada Tabel 4.4. banyaknya gas CO2 yang dilepas ke atmosfer
memang lebih sedikit jika dibandingkan dengan yang dimanfaatkan untuk keperluan industri. Hal ini sudah merupakan suatu langkah maju di bidang pengelolaan emisi gas CO2 mengingat karakteristik gas CO2 yang merupakan salah satu Gas Rumah
Kaca utama penyebab fenomena pemanasan global yang terjadi saat ini. Pemanfaatan oleh sektor industri memungkinkan dikarenakan konsentrasi CO2 yang sangat tinggi
Tabel 4.4. Rekapitulasi gas
Keterangan MSCFD
Gas Produksi 9581,61
Gas masuk CO2removal 8790,01
Gas keluar CO2removal 6122,07
CO2 hasil penyisihan unit CO2 removal 2667,94
Pemanfaatan CO2 untuk sektor industri 1846,12
CO2 ke atmosfer 821,82
Keterangan : MSCFD = Milion Standard Cubic Feet per Day
Sumber : Laporan harian Gas Plant field Cilamaya (tanggal 27 Desember 2007)
Data komposisi gas buang unit CO2 removal dapat dilihat pada Tabel 4.5.
Pengukuran komposisi gas dilakukan dengan menggunakan auto emission analyzer yang menerapkan prinsip non-dispersive infrared absorption (NDIR) untuk HC/CO/CO2.
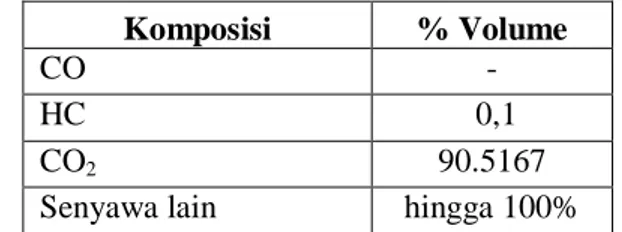
Tabel 4.5. Komposisi gas buang unit CO2 removal
Komposisi % Volume
CO -
HC 0,1
CO2 90.5167
Senyawa lain hingga 100%
Sumber : Hasil Pengukuran
Data pengukuran dengan Auto Emission Analyzer inilah yang nantinya akan dijadikan data perhitungan dalam penelitian karbonatasi mineral. Tidak digunakannya data komposisi dari laboratorium Gas Plant field Cilamaya untuk tujuan konsistensi pengggunaan metode analisa dalam pengukuran konsentrasi gas CO2 selama
penelitian karena penurunan konsentrasi gas CO2 selama dilakukannya proses
karbonatasi mineral akan diukur dengan auto emission analyzer yang sama.
Berdasarkan hasil pengukuran diperoleh nilai konsentrasi gas CO2 sebesar
90,5167 % volume. Nilai ini diperoleh dari hasil perhitungan terhadap sampel gas yang telah diencerkan. Pengenceran harus dilakukan karena keterbatasan dari auto emission analyzer yang hanya dapat membaca konsentrasi CO2 maksimal sebesar
20% volume. Pengenceran dilakukan dengan udara ambien. Dikarenakan gas CO2
juga terdapat di udara ambien, oleh karena itu terlebih dahulu harus dilakukan pengukuran konsentrasi CO2 di udara ambien. Mekanisme pengenceran dapat dilihat
dilakukan penelitian untuk menjaga apabila terjadi perubahan konsentrasi CO2 pada
sampel gas. Dari hasil pengukuran tersebut diperoleh nilai yang tidak terlalu berbeda jauh, sehingga untuk perhitungan digunakan nilai 90,5167%.
Gambar 4.6. Skema pengukuran konsentrasi gas CO2 dengan pengenceran
Perhitungan konsentrasi gas CO2 sebagai berikut:
Berdasarkan kesetimbangan : Q1C1 + Q2C2 = Q3C3 C1 = (Q3C3 – Q2C2) / Q1 ( 3500 mL/mnt x 0,41%) – (3488 mL/mnt x 0,1%) 12 mL/mnt = 90,5167 % 4.5. Penelitian Pendahuluan
Tujuan dari penelitian pendahuluan ini adalah untuk memastikan terlebih dahulu dapat terjadinya penyisihan gas CO2 pada larutan yang terbuat dari limbah las
karbid. Pada penelitian pendahuluan ini, gas CO2 yang direaksikan berasal dari emisi
kendaraan bermotor. Spesifikasi dari kendaraan bermotor yang dijadikan sumber emisi tersebut dapat dilihat pada Lampiran E. Sedangkan limbah las karbid yang digunakan sama dengan limbah las karbid yang akan digunakan dalam penelitian inti. Selain tujuan tersebut, penelitian pendahuluan ini juga dimaksudkan untuk
Q1 : Debit gas sampel
: 12 mL/menit
C1 : Konsentrasi CO2 di gas Sampel (%)
Q2 : Debit gas pengencer (udara ambien) = Q3 – Q1
: 3488 mL/menit
C2 : Konsentrasi CO2 di gas pengencer
: 0,1 % (nilai ini diatas konsentrasi rata-rata CO2 di
ambien, tapi masih di bawah standar indoor air quality sebesar 0,5% , IPCC 2000)
Q3 : Debit hisapan auto emission analyzer
: 3500 mL/menit
C3 : Konsentrasi CO2 terbaca rata-rata di auto
emission analyzer untuk durasi pengukuran selama 1 menit : 0,41% : 0,41% Q2, C2 Q1, C1 Q3, C3
Sebelum dilakukan penelitian dengan gas emisi tersebut, terlebih dahulu dilakukan analisa konsentrasi dari beberapa parameter gas yang diperkirakan terkandung pada emisi kendaraan tersebut. Tabel 4.6. menunjukan hasil analisa dari gas emisi tersebut serta metode / alat yang digunakan.
Dari hasil pengukuran terhadap komposisi emisi kendaraan bermotor di atas, dapat dilihat konsentrasi gas CO2 pada emisi tersebut sekitar 46,28 % volume.
Dikarenakan nilai konsentrasinya yang diatas 20%, maka sama halnya dengan pengukuran konsentrasi CO2 pada sampel gas CO2 removal, dalam pengukuran
konsentrasi CO2 pada gas emisi kendaraan tersebut juga dilakukan pengenceran gas.
Tabel 4.6. Hasil pengukuran komposisi emisi kendaraan bermotor
Sumber : Hasil Pengukuran
Selanjutnya gas emisi ini akan dialirkan kedalam larutan yang terbuat dari limbah las karbid untuk mengetahui apakah akan terjadi reaksi karbonatasi antara gas CO2 yang terdapat pada emisi gas dengan kalsium hidroksida yang terdapat pada
larutan limbah las karbid. Indikasi terjadinya reaksi karbonatasi mineral ini adalah perubahan warna pada larutan limbah las karbid menjadi putih keruh. Larutan penyerap limbah las karbid yang digunakan dalam penelitian pendahuluan ini dibuat dengan melarutkan 0,271 gram limbah las karbid kedalam 100 mL air distilasi.
Selain dialirkan kedalam larutan dari limbah las karbid, gas emisi kendaraan bermotor tersebut juga dialirkan ke dalam air distilasi sebagai kontrol (blanko) dengan volume yang sama yaitu 100 mL. Tujuan dialirkan ke dalam air distilasi ini adalah untuk mengetahui seberapa besar pengaruh terlarutnya gas emisi CO2 terhadap
penurunan emisi dan sebagai dasar pembanding seberapa besar signifikansi dimanfaatkanya limbah las karbid dalam penurunan emisi CO2.
Secara teoritis, kapasitas penyisihan pada larutan limbah las karbid baik yang disaring maupun tidak disaring seharusnya lebih tinggi. Perbandingan mekanisme
Parameter Kons.(ppm) Kons.(%) Metoda
CO 1300 0.1300 Rieken Portable
HC 64 0.0064 Auto Emission Analyzer
CO2 462800 46.2800 Auto Emission Analyzer
NO 50 0.0050 Rieken Portable
NO2 5 0.0005 Rieken Portable
penyisihan gas CO2 untuk larutan blanko dan larutan penyerap dapat dilihat lebih jelas
pada Tabel 4.7 (a) dan (b). Pada tabel tersebut dapat dilihat bahwa untuk larutan blanko, mekanisme penysisihan CO2 yang terjadi hanyalah pelarutan gas CO2 ke
dalam air sehingga akan terjadi penysihan CO2 walaupun dalam jumlah yang tidak
terlalu besar. Sedangkan pada larutan penyerap limbah las karbid, mekanisme penyisihan tersebut juga dilengkapi dengan reaksi kimia antara gas CO2 terlarut
dengan ion-ion alkali yang terdapat di dalam larutan penyerap yang umumnya adalah ion Ca2+. Dengan kombinasi mekanisme penyisihan tersebut, secara teoritis maka tingkat penyisihan pada larutan penyerap akan lebih tinggi jika dibandingkan pada blanko. Reaksi absorpsi dimana gas emisi tidak hanya berdifusi ke dalam abosrbernya, tetapi dilanjutkan dengan reaksi kimia antara gas emisi tersebut dengan senyawa yang terdapat di dalam larutan penyerapnya biasanya dikenal sebagai proses absorpsi dengan reaksi kimia
Tabel 4.7.(a) Mekanisme penyisihan gas CO2 pada blanko
Sebelum reaksi Input Setelah reaksi
H+, OH- CO2 (g) CO2 (aq), H2CO3, HCO3 -, CO3 2-, dan ion-ion lain
Tabel 4.7.(b) Mekanisme penyisihan gas CO2 pada larutan penyerap
Sebelum reaksi Input Setelah reaksi Komponen CO2 terlarut Komponen ion alkali terlarut Endapan karbonat H+, OH-, Ca2+, Mg2+&Na+ (sedikit) CO2 (g) CO2 (aq), H2CO3, HCO3 -, CO3 2-, , dan ion-ion lain
Ca2+, Mg2+,dan ion-ion lain
CaCO3,
MgCO3&Na2CO3
(sedikit)
Pada penelitian pendahuluan dan penelitian inti, terdapat batasan operasi dimana proses karbonatasi mineral dilakukan sampai batas CO2 di outlet reaktor
mencapai konsentrasi 20%. Hal ini dikarenakan mempertimbangkan daya pengukuran maksimun dari Auto Emission Analyzer yang memiliki batas maksimum pengukuran CO2 sebesar 20% volume. Hasil dari percobaan pengaliran gas emisi kendaraan
bermotor kedalam larutan penyerap limbah las karbid dibandingkan dengan air distilasi dapat dilihat pada Gambar 4.7. Yang dimaksud dengan durasi dalam gambar tersebut adalah waktu yang dibutuhkan untuk mencapai konsentrasi CO di
outlet reaktor sebesar 20%. Setiap penelitian dilakukan pada temperatur 25˚ C dan tekanan 1 atm dengan debit aliran udara sebesar 1,759 Lpm.
Dari Gambar 4.7. di bawah dapat terlihat bahwa air juga memiliki kemampuan untuk menyerap gas CO2. Namun dapat dilihat pula bahwa air akan cepat
jenuh oleh gas CO2 tersebut sehingga akan terjadi penurunan absorpsi gas yang cukup
signifikan dalam selang waktu yang lebih singkat. Sedangkan pada Gambar 4.7. tersebut juga dapat dilihat bahwa walaupun tingkat absorpsi dari larutan limbah las karbid tanpa saring tidak setinggi tingkat absorpsi dari air, namun proses penyisihan gas CO2 dapat berlangsung lebih lama dengan tingkat penyisihan yang relatif lebih
stabil.
Apabila dilihat pola grafiknya, pada detik-detik awal terjadi penurunan efisiensi penyisihan gas CO2 yang cukup signifikan pada larutan limbah las karbid.
Hal tersebut kemungkinan dikarenakan keberadaan limbah las karbid tidak terlarut dalam bentuk slurry yang sedikit menghambat terciptanya turbulensi di dalam larutan. Namun setelah terjadi penurunan efisiensi di awal, sempat terjadi peningkatan efisiensi lalu kemudian efisiensi penyisihan gas CO2 mengalami penurunan yang
relatif lebih stabil dan bertahap jika dibandingkan pada larutan blanko. Rekapitulasi dari hasil pelaksanaan penelitian ini dapat dilihat pada Tabel 4.8.
55 59 63 67 71 75 79 83 87 91 95 99 0 10 20 30 40 50 60 70 80 90 100 110 120 durasi (detik) Ef is ie ns i p en yi si ha n (% )
Blanko Larutan LLK tanpa saring Keterangan : LLK : Limbah las karbid
Sumber : Hasil penelitian
Gambar 4.7. Perbandingan efisiensi penyisihan gas CO2 pada larutan limbah las
Berdasarkan hasil penelitian pada Tabel 4.8. dapat dilihat bahwa penambahan limbah las karbid kedalam 100 mL air distilasi dapat memperpanjang waktu reaksi antara larutan tersebut dengan gas CO2 hingga mencapai konsentrasi CO2 di outlet
reaktor sebesar 20%. Untuk kapasitas penyerapannya sendiri, sebagaimana yang terlihat pada Tabel 4.8.,
Walaupun ternyata dengan penambahan limbah las karbid, besarnya peningkatan penyerapan gas CO2 tidak terlalu signifikan, hanya sekitar 26,7%.
Namun peningkatan kapasitas penyerapan sebesar 26,7% ini dihasilkan oleh larutan limbah las karbid dengan penambahan massa yang relatif kecil dibandingkan dengan variasi penambahan massa yang dilakukan dalam peneltian inti, yaitu hanya sebesar 0,271 gram dalam 100 ml air distilasi dengan jumlah ion Ca2+ terlarut sebesar 619,875 mg/L. Dengan hasil analisa kelarutan dimana masih didapatkan peningkatan jumlah ion Ca2+ untuk variasi massa limbah las karbid yang lebih besar, berarti masih besar kemungkinan diperoleh peningkatan kapasitas penyerapan gas CO2 yang cukup
signifikan.
Pada penelitian pendahuluan ini, dialkuakn juga beberapa variasi lainya, namun dikarenakan ketidaksamaan debit aliran gas, maka hasil dari penelitian tersebut tidak dapat dibandingkan dengan kedua variasi diatas.
Tabel 4.8. Hasil penelitian dengan larutan penyerap limbah las karbid tanpa saring dan blanko CO2 total (g) durasi (detik) Blanko 1.6905 79
Larutan limbah las
karbid tanpa saring 2.1399 118
4.6. Penelitian Inti
Pada pelaksanaan penelitian inti ini, dilakukan beberapa variasi untuk melihat pengaruh dari masing-masing variasi tesebut terhadap proses karbonatasi mineral. Pada Tabel 4.9. dapat dilihat keseluruhan variasi yang dilakukan dalam penelitian ini. Sebagai kontrol, untuk setiap variasi debit dilakukan pengaliran gas emisi CO2 ke
dalam rangkaian reaktor karbonatasi mineral dimana pada fritted bubbler impinger hanya diisi dengan air distilasi murni. Hal ini bertujuan sebagai pembanding penyisihan gas CO2 pada air murni.
Tabel 4.9. Variasi dalam penelitian karbonatasi mineral emisi CO2
Massa limbah las karbid (mg/100 mL) Penyaringan Debit (Lpm) 2,7 Saring 1,292 Tanpa saring 1,292 5,4 Saring 1,292 Tanpa saring 1,292 8,1 Saring 0,496 dan 1,292
Tanpa saring 0,496 dan 1,292
10,8 Saring 0,496 dan 1,292
Tanpa saring 0,496 dan 1,292
Variasi penambahan massa limbah las karbid bertujuan untuk mendapatkan variasi konsentrasi ion Ca2+ terlarut dalam larutan penyerap yang akan direaksikan dengan gas emisi CO2. Karena pada proses karbonatasi mineral nantinya diharapkan
terjadi reaksi antara gas CO2 yang terlarut dengan ion Ca2+, maka diharapkan akan
dapat diperoleh korelasi antara banyaknya ion Ca2+ terlarut dengan total gas CO2 yang
diserap.
Sedangkan perlakuan dengan penyaringan serta tanpa penyaringan bertujuan untuk memperoleh karakteristik fisik yang berbeda antara larutan yang disaring dengan yang tidak disaring. Ketika larutan disaring, maka jumlah ion Ca2+ yang terdapat dalam larutan tersebut hanya dalam bentuk terlarut saja, sedangkan pada larutan yang tidak disaring keseluruhan unsur kalsium yang terdapat pada limbah las karbid yang ditambahkan akan tetap berada dalam larutan penyerap tersebut. Walaupun ketika tidak disaring, fraksi limbah las karbid yang tidak terlarut akan mengendap di bagian bawah larutan, namun diharapkan ketika dilakukan reaksi karbonatasi mineral endapan tersebut akan teraduk dikarenakan turbulensi yang
disebabkan oleh aliran gas yang mengalir masuk dari bagian bawah fritted bubler impinger.
Dalam proses absorpsi gas dengan mekanisme dispersi, aliran gas yang akan direaksikan sangat mempengaruhi jalannya reaksi. Hal ini dikarenakan besarnya aliran gas menentukan pembentukan gelembung didalam kolom absorpsi, selain itu aliran gas yang lebih lambat juga memberikan waktu kontak yang lebih lama antara gas yang akan direaksikan dengan larutan penyerapnya. Pada penelitian tugas akhir ini dilakukan dua variasi aliran gas yang dioperasikan pada variasi massa limbah las karbid 8,1 gram serta 10,8 gram.
4.6.1. Kesetimbangan CO2 terlarut
Pada proses karbonatasi mineral emisi CO2, tahapan pertama yang terjadi
adalah proses terlarutnya gas CO2 ke dalam air. Proses pelarutan CO2 di air melalui
beberapa tahap mekanisme reaksi yang melibatkan gas dan CO2 terlarut, asam
karbonat (H2CO3), ion bikarbonat (HCO3−) dan ion karbonat (CO32−). Sebagaimana
diketahui, ketiga bentuk diatas dan termasuk juga CO2 merupakan penyebab utama
dari alkalinitas air. Tahapan reaksi dapat dilihat di bawah ini:
CO2(g) → CO2 (aq) (5a)
CO2 (aq) + H2O ‹═› H2CO3(aq) ‹═› H+ + HCO3-(aq) (5b)
HCO3-(aq) ‹═› H+ + CO32- (aq) (5c)
Berdasarkan tahapan reaksi di atas jelas terlihat bahwa karbon dioksida dan tiga bentuk terlarutnya merupakan bagian dari suatu sistem yang memiliki kesetimbangan karena melibatkan ion HCO3-. Pada Gambar 2.4. dapat dilihat
hubungan antara karbon dioksida dan tiga bentuk alkalinitas lainnya lainnya di air dengan alkalinitas total sebesar 1 mol dalam rentang pH 4 – 11.
Merujuk pada Gambar 2.4. dapat dilihat kondisi dimana komposisi utama dari sistem tersebut adalah ion karbonat terjadi pada rentang nilai pH diatas 10. Hal ini berarti, rentang nilai pH yang optimal untuk terjadinya proses karbonatasi mineral yang diharapkan adalah pada nilai pH tersebut. Pada awal proses karbonatasi mineral, larutan berada pada nilai pH diatas 12 sebagai akibat dari pelarutan limbah las karbid, dengan direaksikannya larutan limbah las karbid tersebut dengan gas emisi CO2, pH
Besarnya penurunan nilai pH ini dipengaruhi oleh konsentrasi awal kalsium hidroksida pada larutan limbah las karbid serta waktu pengaliran gas CO2. Adanya
perubahan nilai pH ini disebabkan adanya perubahan konsentrasi CO2 dalam sistem
yang terus-menerus ditambahkan sehingga menyebabkan pergeseran kesetimbangan yang menjadi penyebab terjadinya perubahan nilai pH. Jika melihat perubahan pH larutan pada awal reaksi dan akhir reaksi yang cukup signifikan, hal ini memungkinkan telah terjadinya perubahan komposisi utama antara gas CO2 dan
ketiga komponen lainya didalam larutan tersebut. Tabel 4.10. menunjukan penurunan nilai pH untuk setiap variasi masa limbah las karbid untuk dua variasi debit yang dilakukan. Sebagai pembanding, untuk masing-masing variasi debit juga disertakan penurunan nilai pH pada larutan kontrol. Penurunan nilai pH hanya dapat diamati pada larutan limbah las karbid dengan penyaringan. Hal ini karena pada larutan limbah las karbid tanpa penyaringan, pembacaan pH akan menjadi kurang akurat dikarenakan keberadaan fraksi massa limbah las karbid yang tidak terlarut.
Tabel 4.10. menunjukan hampir semua variasi larutan mengalami penurunan pH dari yang awalnya berkisar 12 menjadi nilai antara 6,5 – 7,5. Dari Tabel 4.10. dapat terlihat bahwa untuk masing-masing variasi debit, peningkatan penambahan massa limbah las karbid ke dalam larutan dapat memperlambat proses penurunan pH. Hal ini dapat terlihat bahwa untuk nilai pH awal dan akhir yang tidak terlalu jauh berbeda untuk masing-masing variasi, waktu yang dibutuhkan untuk mencapai nilai pH tersebut relatif lebih lama untuk larutan dengan massa limbah las karbid yang lebih besar. Hal ini dikarenakan pada larutan dengan massa limbah las karbid yang lebih tinggi, terdapat lebih banyak senyawa basa, dalam hal ini kalsium hidroksida , di dalam larutan yang dapat bereaksi dengan CO2 terlarut dan mencegah penurunan nilai
pH yang lebih cepat. Kalaupun terdapat perbedaan nilai pH itu tidak terlalu besar perbedaanya dan dapat dijelaskan bahwa waktu reaksi yang lebih lama akan memberikan nilai pH akhir yang cenderung lebih rendah karena semakin banyak gas CO2 yang bereaksi.
Selain pengaruh penambahan massa limbah las karbid, penurunan nilai pH juga dipengaruhi oleh debit aliran, untuk debit aliran yang lebih rendah penurunan nilai pH cenderung terjadi lebih lama, hal ini tentu saja dengan debit yang lebih rendah, maka waktu yang dibutuhkan untuk mencapai jumlah CO2 tertentu dalam
berdasarkan reaksi yang terjadi, pH larutan akan sangat dipengaruhi oleh keberadaan CO2 terlarut, ion Ca2+ (dari kalsium hidroksida), serta reaksi antara keduanya.
Tabel 4.10. Penurunan nilai pH untuk setiap variasi penelitian
Debit (Lpm) Massa limbah las karbid (g/100 mL) Durasi (detik) Penyisihan CO2 (mg) pH Larutan penyerap awal Larutan penyerap akhir 0,496 0 92 1363 6.68 4.48 8.1 148 2362,19 12.9 6.6 10.8 159 2634,03 12.63 6.71 1,292 0 29 1119 6.78 5.48 2.7 63 2395,73 12.26 7.39 5.4 71 2600,98 12.24 7.22 8.1 91 3545,20 12.88 6.95 10.8 112 4181,99 12.63 7.04
Sumber : Hasil penelitian (Lampiran G)
Pada kondisi pH 12, ketika terjadi pelarutan gas CO2, maka kesetimbangan
dari sistem akan bergeser ke kanan, sehingga komposisi utamanya adalah ion karbonat. Namun pada akhir reaksi karbonatasi mineral, dengan nilai pH dalam rentang 6,5-7,5 secara teoritis komponen utama dalam kesetimbangan terdiri atas ion bikarbonat (Gambar 2.4.). Menurut literatur (Spanos, 1998), proses karbonatasi mineral sendiri optimal terjadi pada kisaran pH 9-10. Pada nilai pH diatas 9, memang sudah terjadi pembentukan ion karbonat dan pada pH diatas 10, komposisi utama dari sistem kesetimbangan CO2 terlarut akan dalam bentuk ion karbonat tersebut. Dari
hasil analisa larutan penyerap setelah reaksi karbonatasi mineral, diperoleh pada sebagian besar larutan penyerap, komposisi utama dari kesetimbangan pelarutan gas CO2 dalam air adalah ion bikarbonat. Pada Tabel 4.11. dapat dilihat rekapitulasi hasil
analisa asiditas-alkalinitas dari larutan penyerap setelah proses karbonatasi mineral. Pada Tabel 4.11. dapat dilihat khusus untuk blanko pada debit 0,496 Lpm, pada analisa larutan akhir diperoleh komposisi utama dari kesetimbangan adalah CO2
terlarut. Dengan nilai pH yang mencapai 4,48 secara teoritis memang komposisi utama dari sistem kesetimbangan tersebut adalah CO2 terlarut. Dengan begitu dapat
dikatakan bahwa dari hasil analisa asiditas-alkalinitas larutan penyerap akhir menunjukan bahwa adanya hubungan antara nilai pH dengan komposisi utama CO2
Tabel 4.11. Analisa asiditas-alkalinitas larutan penyerap setelah reaksi karbonatasi mineral Massa limbah las karbid (mg/100 mL) Penyaringan Debit (Lpm) Asiditas-Alkalinitas mg/L CO2 mg/L CO3 2-mg/L HCO3 -mg//L H+ 2,7 Saring 1,292 168.08 - 438.5168 - - Tanpa saring 1,292 16.808 295.67798 5,4 Saring 1,292 97.6965 536.093925 Tanpa saring 1,292 294.14 123.8483 8,1 Saring 0,496 432.806 1260.69005 1,292 42.02 515.34935 Tanpa saring 0,496 96.646 845.338 1,292 79.838 840.6593 10,8 Saring 0,496 480.0785 859.384775 1,292 63.03 458.24115 Tanpa saring 0,496 155.474 819.7424 1,292 - 82.566 - 467.874 Blanko 0,496 357.17 - 78.43685 - 1,292 7.3535 17.786075
Sumber : Hasil penelitian (Lampiran G)
4.6.2. Pengaruh konsentrasi Ion Ca2+ terlarut (CCa2+)
Pada proses karbonatasi mineral yang dilakukan, setelah gas CO2 terlarut ke
dalam air melalui difusi, sebagian dari CO2 tersebut akan bereaksi dengan ion alkali
terutama ion Ca2+ dan membentuk kalsium karbonat. Terjadinya reaksi antara CO2
dengan ion Ca2+ tersebut secara umum akan meningkatan kapasitas penyisihan CO2
dari larutan limbah las karbid. Dikarenakan keberadaan ion Ca2+ berpengaruh terhadap kapasitas total peyerapan gas CO2, maka konsentrasi ion Ca2+ tersebut
berperan penting terhadap keseluruhan proses absorpsi gas CO2. Dengan dilakukan
variasi penambahan limbah las karbid ke dalam volume air distilasi yang sama (100 mL), diharapkan dapat diperoleh variasi konsentrasi ion Ca2+ dalam larutan penyerap yang dibuat.
Pada Gambar 4.8. dapat dilihat pola penurunan efisiensi penyisihan gas CO2
selama durasi penelitian berlangsung. Pada gambar tersebut dapat dilihat adanya hubungan antara massa limbah las karbid yang ditambahkan dengan durasi penelitian hingga mencapai konsentrasi di outlet reaktor sebesar 20% volume. Penelitian dilakukan dengan melarutkan limbah las karbid dalam berbagai variasi massa ke dalam 100 mL air distilasi dan kemudian disaring. Tujuan dari penyaringan ini adalah
untuk memastikan bahwa jumlah ion Ca2+ yang berperan dalam proses karbonatasi mineral nantinya hanya yang terdapat dalam bentuk terlarut. Dari gambar tersebut dapat dilihat semakin banyak massa limbah las karbid yang ditambahkan, maka durasi penelitian juga akan semakin lama, dan hal ini berlaku untuk kedua variasi debit yang dilakukan. Penambahan limbah las karbid kedalam air distilasi kembali terbuktikan dapat meningkatkan kapasitas penyisihan CO2. Dapat dilihat untuk variasi debit 1,292
Lpm, durasi dari larutan blanko hanya sebesar 29 detik, namun ketika dilakukan penambahan limbah las karbid untuk massa sebanyak 2,7 gram terjadi peningkatan durasi menjadi 63 detik dan selanjutnya berturut-turut menjadi 71, 91 dan 112 detik untuk variasi massa 5,4; 8,1; 10,8 gram. Sedangkan untuk debit 0,496 Lpm durasi blanko sebesar 92 detik dan untuk masing-masing variasi massa sebesar 148 dan 159 detik untuk variasi massa 8,1 dan 10,8 gram.
76 80 84 88 92 96 100 0 20 40 60 80 100 120 140 160 durasi (detik) ef is ie ns i pe ny is ih an ( % )
Blanko 2,7 gram 5,4 gram 8,1 gram 10,8 gram 0,496 Lpm 1,292 Lpm
0 20 40 60 80 100 120 140 160
Sumber : Hasil penelitian
Gambar 4.8. Penurunan efisiensi penyisihan selama durasi penelitian untuk larutan penyerap dengan penyaringan. Dapat dilihat pada grafik pada debit 1,292 Lpm
pnurunan efisiensi penyisihan terjadi lebih cepat
Secara teoritis, pada suatu sistem pengolahan semi kontinue seperti yang dilakukan dalam penelitian karbonatasi mineral ini (kontinu untuk sistem gas CO2 dan
batch untuk larutan penyerap), semakin lama durasi proses karbonatasi mineral maka akan berdampak kepada kapasitas penyisihan gas CO2 dimana semakin lama durasi
proses maka akan semakin besar jumlah total CO2 yang tersisihkan karena semakin
banyak gas CO2 yang bereaksi sebelum tercapainya konsentrasi di outlet reaktor
sebesar 20%. Pada Gambar 4.9. dapat dilihat korelasi antara durasi penelitian dengan jumlah total CO2 yang tersisihkan. Pada Gambar 4.9. kita dapat melihat total
penyisihan gas CO2 akan meningkat seiring dengan peningkatan durasi reaksi.
Dengan hasil ini, dapat ditarik kesimpulan bahwa kapasitas penyisihan total gas CO2
akan meningkat seiring dengan peningkatan penambahan massa limbah las karbid dalam pembuatan larutan penyerap. Dengan dilakukan variasi penambahan massa limbah las karbid, diharapkan akan dapat diperoleh konsentrasi ion Ca2+ yang bervariasi.
Dari tampilan grafik pada Gambar 4.9. dapat dilihat bahwa masih terdapat peningkatan kapasitas penyisihan gas CO2 dari variasi massa limbah 8,1 gram ke
variasi 10,8 gram. Hal ini berarti walaupun dengan kondisi kelarutan dari ion Ca2+ yang sudah menunjukan jenuh pada variasi massa 10,8 gram, terdapat kemungkinan masih akan terjadi peningkatan kapasitas penyisihan gas CO2 pada larutan yang
dibuat dengan penambahan massa limbah las karbid yang lebih besar dari 10, 8 gram. Dengan begitu belum bisa dikatakan bahwa panambahan massa limbah las karbid sebesar 10,8 gram adalah penambahan massa limbah las karbid yang dapat memberikan kapasitas penyisihan paling tinggi.
Tidak dilakukan variasi penambahan massa limbah las karbid yang lebih besar dari 10,8 gram dikarenakan asumsi awal bahwa faktor yang paling berpengaruh dalam proses karbonatasi dari pihak larutan penyerap adalah konsentrasi dari ion Ca2+. Dengan hasil dimana pada peningkatan konsentrasi ion Ca2+ yang tidak signifikan ternyata masih dapat memberikan peningkatan kapasitas penyisihan gas CO2 yang
cukup signifikan, kemungkinan besar terdapat faktor lain yang juga berpengaruh terhadap proses karbonatasi mineral ini.
60 80 100 120 140 160 2.7 5.4 8.1 10.8
massa limbah las karbid (g) / 100 ml air distilasi
du ra si ( de ti k) 0.00 1.00 2.00 3.00 4.00 CO2 (g)
durasi CO2 tersisihkan
0,496 Lpm 0 1 2 3 4 2.7 5.4 8.1 10.8 60 80 100 120 140 160 du ra si (d et ik ) 1,292 Lpm
Sumber : Hasil perhitungan (Lampiran F)
Gambar 4.9. Hubungan antara durasi penelitian dan kapasitas total penyisihan CO2.
Untuk masing-masing debit, durasi penelitian yang lebih lama memberikan kapasitas penyisihan yang lebih besar.
Berdasarkan teori tumbukan pada reaksi kimia, konsentrasi memainkan peranan penting dalam terjadinya reaksi. Hal ini karena molekul-molekul harus saling bertumbukan terlebih dahulu agar dapat terjadi reaksi diantara mereka. Ketika konsentrasi dari pereaksi meningkat, frekuensi tumbukan dari molekul-molekul tersebut akan meningkat juga. Ketika konsentrasi pereaksi semakin besar, hal ini berarti semakin banyak jumlah molekul dari pereaksi tersebut, jarak pemisah antara molekul-molekul akan semakin sempit, hal ini menyebabkan kecenderungan untuk semakin sering terjadinya tumbukan antara molekul-molekul tersebut. Hal tersebut dapat terlihat pada data hasil analisa konsentrasi ion Ca2+ pada sebelum dan setelah reaksi untuk masing-masing variasi massa yang disajikan dalam Tabel 4.12. Terjadinya peningkatan persen selisih ion Ca2+ pada peningkatan penambahan massa limbah las karbid menunjukan bahwa semakin tinggi konsentrasi ion Ca2+ dalam larutan, maka akan memperbesar kemungkinan terjadinya reaksi antara ion Ca2+ tersebut dengan gas CO2.
Tabel 4.12. Konsentrasi ion kalsium sebelum dan sesudah reaksi karbonatasi mineral Massa limbah las karbid (mg/100 mL) mg/ 100 mL Ca2+ 1,292 Lpm 0,496 Lpm Larutan penyerap awal Larutan penyerap akhir Selisih % Ca 2+ bereaksi Larutan penyerap awal Larutan penyerap akhir Selisih % Ca 2+ bereaksi 2.70 130.08 36.03 94.05 72.30 5.40 133.75 39.09 94.66 70.78 8.10 139.24 31.15 108.10 77.63 138.63 71.15 67.48 48.68 10.80 140.87 26.26 114.61 81.36 140.77 49.47 91.30 64.86
Sumber : Hasil penelitian (Lampiran G)
Walaupun ada peningkatan, namun banyaknya ion Ca2+ terlarut diantara keempat variasi tersebut relatif hampir sama. Hal itu berarti kelarutan ion Ca2+ pada ketiga variasi tersebut sudah pada kondisi kelarutan maksimumnya sehingga penambahan limbah las karbid lebih banyak lagi tidak akan terlalu mempengaruhi banyaknya ion Ca2+ yang akan terlarut. Berbanding lurusnya kapasitas penyisihan gas CO2 dengan banyaknya penambahan limbah las karbid dengan penyaringan
menunjukan bahwa kapasitas penyisihan CO2 dipengaruhi oleh ketersediaan ion-ion
alkali terlarut sebagai unsur yang akan membentuk mineral karbonat dengan gas CO2
tersebut.
4.6.3. Pengaruh karakteristik fisik penyerap dan debit aliran gas (Qg)
Selain dilakukan variasi konsentrasi ion Ca2+ dengan cara variasi penambahan massa limbah las karbid, juga dilakukan variasi karakteristik fisik dari larutan penyerap yang dibuat serta varisai debit aliran gas (Qg). Variasi karakteristik fisik
larutan penyerap yang dilakukan dalam peneltitian ini adalah larutan penyerap terdapat dalam bentuk lime water dan dalam bentuk milk of lime. Yang membedakan dalam pembuatan kedua jenis larutan penyerap ini adalah pada larutan penyerap dalam bentuk lime water, setelah dilakukan pelarutan limbah las karbid dengan massa tertentu ke dalam 100 mL air distilasi, kemudian dilakukan penyaringan untuk menyisihkan fraksi limbah las karbid yang tidak terlarut. Sedangkan pada larutan penyerap dalam bentuk milk of lime, tidak dilakukan penyaringan sehingga seluruh fraksi limbah las karbid akan tetap terdapat di dalam larutan penyerap ketika proses karbonatasi mineral dilakukan dengan menggunakan larutan penyerap tersebut. Tidak dilakukan penyaringan terhadap limbah las karbid yang tidak terlarut bertujuan agar
terjadi proses pelarutan secara bertahap ketika ion Ca2+ yang berasal dari limbah las karbid terlarut bereaksi dengan CO2. Dengan begitu diharapkan kapasitas penyisihan
CO2 akan meningkat seiring dengan terus terlarutnya ion Ca2+ dari limbah las karbid
menggantikan ion Ca2+ yang membentuk endapan kalsium karbonat setelah bereaksi dengan ion karbonat yang berasal dari disosiasi gas CO2 dalam air.
Pada larutan limbah las karbid dengan penyaringan, terdapat korelasi positif antara jumlah ion Ca2+ terlarut dengan durasi proses. Sedangkan pada larutan penyerap tanpa saring semakin banyak limbah las karbid yang ditambahkan, kecenderungan yang terjadi adalah waktu reaksi hingga konsentrasi outlet mencapai 20% akan menjadi semakin singkat. Hal tersebut terlihat dari hasil penelitian pada Gambar 4.10. dimana dengan penambahan limbah las karbid paling tinggi yaitu sebanyak 8,1 gram limbah las karbid dalam 100 mL air distilasi, waktu penyisihan hingga mencapai konsentrasi CO2 di outlet reaktor sebesar 20% adalah selama 52
detik, sedangkan untuk penambahan sebesar 5,4 gram selama 54 detik dan untuk penambahan sebesar 2,7 gram selama 59 detik.
Hal tersebut dapat dikarenakan keberadaan fraksi tidak larut dari limbah las karbid menghambat poses karbonatasi mineral itu sendiri. Namun terjadi pengecualian ketika dilakukan penambahan limbah las karbid pada variasi keempat yaitu sebanyak 10,8 gram. Untuk variasi ini, durasi penelitian meningkat sampai 62 detik. Hal ini kemungkinan besar dikarenakan pada variasi ini, fraksi limbah las karbid yang tidak terlarut dan membentuk slurry di bagian dasar impinger ikut teraduk ketika terdapat aliran gas yang menciptakan turbulensi di dalam larutan, Dengan begitu walaupun tidak banyak, tetapi terjadi proses terlarutnya ion Ca2+ yang tadinya terdapat pada fraksi slurry yang tidak larut menggantikan ion Ca2+ yang terendapkan sebagai kalsium arbonat setelah bereaksi dengan ion karbonat. Sedangkan untuk variasi debit 0,496 Lpm, durasi proses untuk variasi massa 8,1 gram lebih singkat dibandingkan durasi blanko. Hal ini kemungkinan dikarenakan karena tidak maksimalnya turbulensi yang terjadi karena debit aliran gas yang kecil sehingga idak dapat terjadinya reaksi antara larutan penyerap dan gas CO2 secara
Sumber : Hasil penelitian
Gambar 4.10. Penurunan efisiensi penyisihan selama durasi penelitian untuk larutan penyerap tanpa saring
Pada Gambar 4.11. kita dapat melihat perbandingan durasi proses antara larutan penyerap dengan penyaringan dan tanpa saring untuk setiap penambahan massa limbah las karbid. Pada larutan penyerap dengan penyaringan, jumlah kalsium yang tersedia secara kuantitas jauh lebih sedikit jika dibandingkan dengan larutan penyerap tanpa saring. Namun dengan jumlah yang jauh lebih sedikit tersebut, ternyata proses penyisihan gas CO2 dapat terjadi lebih lama. Seperti yang terlihat pada
Gambar 4.11., untuk setiap variasi massa penambahan limbah las karbid, durasi proses untuk larutan penyerap dengan penyaringan selalu lebih tinggi dibandingkan larutan penyerap tanpa saring. Sehingga dapat kita simpulkan bahwa walaupun secara kuantitas jumlah ion kalsium jauh lebih sedikit, namun proses penyisihan CO2 dapat
lebih optimal pada larutan limbah las karbid dengan penyaringan. Hal ini juga dikarenakan reaksi karbonatasi mineral sangat dipengaruhi oleh keberadaan air di dalam sistem. Kandungan air akan mengkatalis proses karbonatasi mineral sehingga dapat terjadi secara lebih optimal (Huntzinger, 2006). Dengan begitu, pada larutan penyerap dengan kandungan air cukup tinggi namun tetap dengan kadungan ion kalsium terlarut yang maksimal, proses karbonatasi mineral dapat terjadi secara lebih optimal. 76 80 84 88 92 96 100 0 20 40 60 80 100 durasi (detik) ei si en si p en yi si ha n (% )
Blanko 2,7 gram 5,4 gram 8,1 gram 10,8 gram
0,496 Lpm
0 20 40 60 80 100