WATER ADSORPTION FORM MIXTURE ETHANOL-WATER BY ZEOLITE SYNTHESIZED NAA FROM COAL BOTTOM ASH PLTU TARAHAN
LAMPUNG
Nico I Ginting1), Aulizar Mario1), Nur Rohman Simparmin br. Ginting1) dan Darmansyah1)
1)Jurusan Teknik Kimia Fakultas Teknik Universitas Lampung
Jl. Prof. Dr. Soemantri Brodjonegoro No. 1 Bandar Lampung 35145 Surel: [email protected]
ABSTRACT
This research aimed to determine the isothermal adsorption of mixture ethanol-water by zeolite synthesized NaA. Zeolite synthesized NaA which is have a different % crystalinity was tested its ability of adsorption to the mixture of ethanol-water. The results showed that adsorben 2 was able to adsorp water up to 93,293% for 35 minutes. Each of adsorben 1 and adsorben 3 respectively 90,63% and 88,58% at the same time 35 minutes. The results indicate that isoterm adsorption of ethanol-water by zeolite synthesized NaA followed Freundlich isotherm, which is its adsorption capacity kf = 1,367 and adsorption intensity n = 7,874 .
Keywords : adsorption, ethanol-water, isoterm zeolit. ABSTRAK
Penelitian ini bertujuan mengetahui pola isoterm adsorpsi air dari campuran etanol-air oleh adsorben zeolit NaA hasil sintesis. Zeolit sintesis NaA yang masing-masing berbeda % kristlanitasnya diuji kemampuan adsorpsinya terhadap dehidrasi etanol-air. Hasil yang diperoleh menunjukkan bahwa adsorben 2 mampu mengadsorpsi air hingga 93,293% selama 35 menit. Adsorben 1 dan adsorben 3 masing-masing 90,63% dan 88,58% dengan waktu yang sama 35 menit. Hasil yang diperoleh mengindikasikan bahwa adsorpsi isoterm dari zeolit NaA mengikuti model Freundlich. Dengan nilai kapasitas adsorpsi kf =1,367 dan intesitas adsorpsi n = 7,874.
Kata kunci : adsorpsi, etanol-air , isoterm zeolit.
PENDAHULUAN
Krisis energi saat ini menyebabkan manusia untuk lebih mengintensifkan penelitian dan penggunaan dar ienergi yang tidak terbaharu energi terbaharui. Salah satu energi terbarui tersebut berasal dari biomassa yang di proses menjadi bioetanol. Bioetanol adalah etanol yang dihasilkan dari fermentasi glukosa (gula) yang dilanjutkan
dengan proses destilasi. Proses destilasi hanya mampu menghasilkanetanol dengan persentase 95% atau secara teoritis < 97,20% (Onuki, 2006). Proses produksi bioetanol berbeda dengan proses produksi etanol yang umum digunakandalam industri etanol. Etanol skala industri dihasilkan melalui hidrasi senyawaalkena dengan uap air menggunakan katalis SiO padat yang dilapisi dengan asamfosfat (Clark, 2007). Proses pembuatan dilakukan dengan mengalirkan pereaksi diatas sebuah katalis secara terus-menerus. Proses ini sangat cepat dan menghasilkan etanol dengan kemurnian tinggi, namun terbatas pada ketersediaan sumber bahan baku. Sementara itu, pada proses produksi bioetanol tidak mengalami kendala terhadap ketersediaan sumber bahan baku. Sumber bahan baku untuk produksi bioetanol berasal dari material tanaman yang
renewable. Hampir semua tanaman yang mengandung karbohidrat dapat digunakan
sebagai sumber bahan baku pada proses produksi bioetanol. Proses pembuatan bioetanol dilakukan dengan mencampurkan semua bahan ke dalam sebuah wadah dan kemudian dibiarkan sampai fermentasi selesai. Kumpulan bahan ini kemudian dikeluarkan dan sebuah reaksi baru dilangsungkan. Bioetanol yang dihasilkan memiliki kadar 10% dengan kandungan air yang cukup banyak, sehingga memerlukan pengolahan lebih lanjut (Clark, 2007). Jika bioetanol ingin digunakan sebagai bahan bakar (biofuel) perlu dimurnikan hingga mencapai 99% yang lazim disebut fuel grade ethanol (FGE).
Permasalahan utama pada proses pembuatan bioetanol adalah proses pemisahan air dengan etanol untuk mendapatkan etanol absolut (99,5 %). Salah satu metode pemurnian etanol-air yang lebih murah dan mudah adalah metod eadsorps idengan media berpori. Dalam proses adsorpsi tersebut digunakan adsorben, salah satu jenis adsorben yang sering digunakan adalah zeolit, karena memiliki kandungan silika dan alumina serta volume pori yang memadai sebagai adsorben yaitu 0,29 cm3/gr (Khaidir,
2011). Pada industry sendiri sering digunakan zeolite sintesis, karena zeolite sintesis memiliki kemurnian dan kristalinitas yang lebih tinggi dibandingkan dengan zeoli talam.
BAHAN DAN METODE
Penelitian ini dilakukan di Laboratorium Penelitian Teknik Kimia Universitas Lampung pada Bulan Februari 2015- Maret 2015. Alat dan bahan yang digunakan adalah Erlenmeyer 100 ml, gelas beaker 25 ml, piknometer, aluminium foil, refraktometer, neraca digital, larutan etanol-air dengan kadar 72%, 67% dan 63%, zeolit sintesis NaA dengan persen kristalinitas 6,2 %; 6,8 %; 5,7%.Proses ini dilakukan dengan langkah-langkah sebagai berikut
1. Uji adsorpsi
Adsorben (zeolit sintesis NaA) yang divariasikan yaitu adsorben 1 (% kristalinitas 6,2%), adsorben 2 (% kristalinitas 6,8%), dan adsorben 3 (% kristalinitas 5,7%) sebanyak 1 gr masing-masing pada gelas beaker 25 ml. Lalu ditambahkan campuran etanol-air 72% sebanyak 10 ml dan diisolasi dengan aluminium foil selama 5 menit. Setelah itu hitung indeks bias dari campuran tersebut dengan refraktometer. Selanjutnya saring campuran tersebut dengan kertas saring, untuk memisahkan adsorben dan campuran etanol air dan dimasukkan ke dalam piknometer. Setelah itu timbang dalam neraca digital. Lalu tentukan kemurnian/kadar (%berat) dari etanol hasil dehidrasi tersebut menggunakan tabel perry’s. Hitung pula kadar (% berat air) didalam campuran etanol-air tersebut. Lakukan langkah-langkah tadi untuk kadar etanol 67% dan 63%.
2. Penentuan Persamaan Adsorpsi Freundlich dan Langmuir
Penentuan isoterm adsorpsi dilakukan dengan menganalisis linearitas kurva hubungan sesuai dengan persamaan isoterm Freudlich dan Langmuir. Langkah pertama dalam penentuan isoterm adsorpsi adalah dengan merubah persamaan Langmuir dan Freundlich menjadi persamaan garis lurus. Dalam menentukan pola adsorpsi Freundlich dari data adsorpsi dapat dibuat kurva log Qe terhadap log C maka akan diperoleh persamaan linear dengan intersep log Kf e dan kemiringan 1/n, Begitu juga dalam penentuan pola adsorpsi Langmuir dari suatu data adsorpsi maka persamaan Langmuir disusun dalam bentuk persamaan linier yaitu
...(1)
pola isoterm adsorpsi Langmuir dapatditentukan dengan membuat kurvahubungan antara 𝐶𝑒
𝑄𝑒dengan Ce (Bird,1985).
HASIL DAN PEMBAHASAN
Pada penelitian ini dilakukan uji adsorpsi terhadap air dalametanol dengan kadar72%, 67% dan 63%. Salah satu komponen zeolit adalah air yang merupakan fasater adsorpsi. Air bersifat polar dan sangat mudah teradsorpsi pada permukaan zeolit. Air mengisi rongga-rongga di dalam kristalzeolit. Begitu pula dengan zeolit NaA mengandung saluran terbuka yang besar sehingga memudahkan air untuk bergerak keluar masuk struktur kristal. Data adsorpsi sampel diperoleh dari karakterisasi menggunakan pikno meter untuk mengetahui densitasetanol setelah mengadsorp air setiap 5 menit. Data densitas yang diperoleh digunakan untuk menghitung kadar etanol
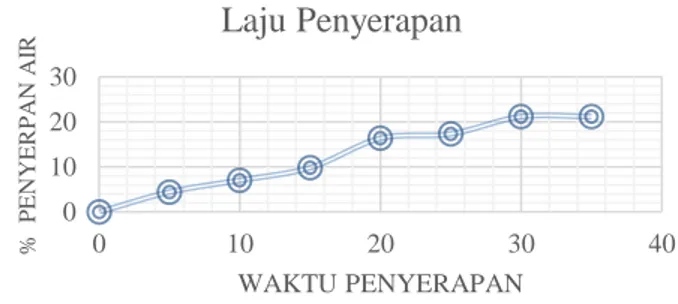
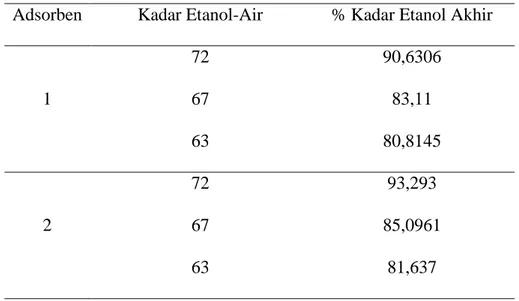
akhir. Kadar etanol inilah yang dapat menunjukkan seberapa banyak air yang diserap oleh zeolit NaA. Setelah melakukan percobaan adsorpsi ini diketahui bahwa waktu yang dibutuhkan untuk menyerap air dalam etanol tidak terlalu lama. Waktu yang dibutuhkan untuk mendapatkan kadar etanol murni, yakni selama 35 menit. Hasil adsorpsi zeolit sintesis terhadap air dalam etanol ditampilkan pada Gambar 4.1. Berdasarkan Gambar 4.1 dapat diketahui bahwa semakin lama waktu adsorpsi, maka semakin meningkat pula persentase sekadar air yang terserap. Dengan meningkatnya kadar air yang terserap, maka kemurnian etanol akan semakin tinggi. Waktu adsorpsi yang digunakan adalah setiap 5 menit, dimana hasil terbaik adsorpsi dilakukan selama 35 menit dengan menghasilkan kadar etano l93,293 %. Maka, dapat diketahui bahwa zeolit sintesis pada adsorben 2 ini dapat menyerap air dengan baik. Hasil adsorpsi pada adsorben 1 dan adsorben 3 pada masing-masing kadar etanol dapat dilihat pada Tabel 4.1. Pada penelitian ini juga dilakukan perbandingan kemampuan tiap zeolit dalam mengadsorp air dengan kadar yang sama. Hasilnya dapat dilihat pada Gambar 4.2. Dari Gambar 4.2 dapat terlihat bahwa pada kadar 72%, adsorben 2 menyerap paling banyak air hingga konstan. Gambar 4.2 juga menampilkan kecenderungan penyerapan yang sama oleh ketiga zeolit NaA yaitu meningkatnya persen penyerapan air terhadap waktu. Pada kadar etanol 63%, adsorben 2 memberikan nilai persentase penyerapan air terbesar yaitu 17,85%, sementara adsorben 1 dan adsorben 3 berturut-turut masing-masing menyerap sebanyak 17,03% dan 13,03% air. Penelitian ini juga memperlihatkan bahwa, adsorben 2 selalu memberikan nilai persentase penyerapan yang lebih besar daripada adsorben 1 dan adsorben 3. Hal ini berhubungan dengan persen kristalnitas ketiga adsorben (zeolit sintesis NaA). Semakin besar persen kristalinitas semakin selektif dan polar pula zeolit NaA tersebut. Dari Gambar 4.2 dapat disimpulkan bahwa persen penyerapan akan
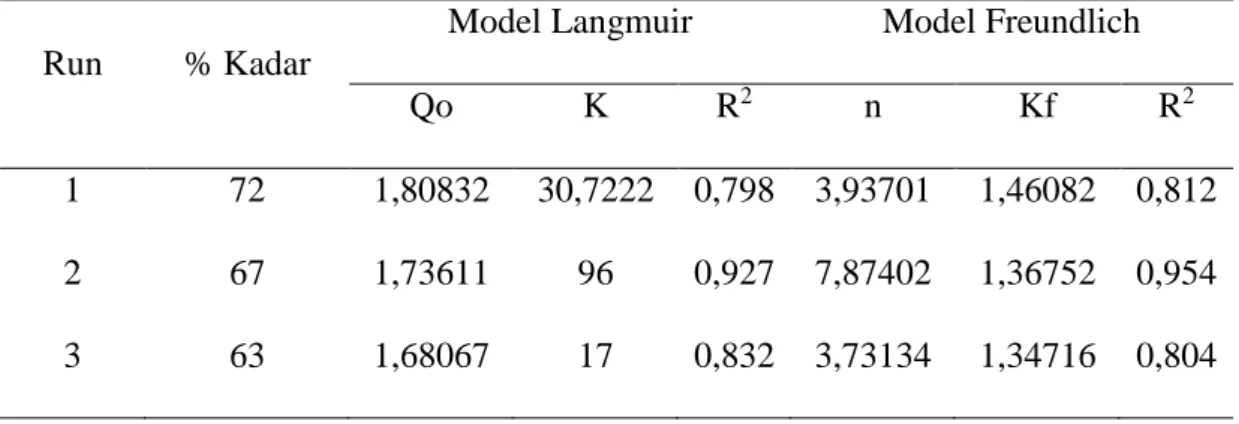
semakin meningkat seiring dengan meningkatnya persen kristalinitas zeolit tersebut. Dari hasil perhitungan adsorpsi, dilanjutkan dengan penentuan model isoterm yang sesuai dengan proses adsorpsi. Kurva linierisasi isoterm langmuir dan Freundlich ditampilkan pada Gambar 4.3. Dari Gambar 4.3 terlihat proses adsoprsi pada adsorben 1 dan adsorben 2 mengikuti model adsorpsi isoterm Freundlich. Namun, adsorben 3 mengikuti model isoterm Langmuir. Hal iniditentukan berdasarkan nilai R2, dimana
nilai R2 yang lebih mendekati 1 menyatakan bahwa persamaan tersebut akan mengikuti
model isoterm adsorpsi tersebut. Dari persamaan linierisasi model adsorpsi Langmuir dan Freundlich yang ditampilkan pada Gambar 4.3, dapat ditentukan nilai Qo dan k. Qo
merupakan kapasitas adsorpsi dan k merupakan nilai intensitas adsorpsi untuk model isoterm Langmuir. Sementara pada model isoterm Freundlich, dengan menggunakan nilai slope dan intercept, nilai n dan Kf dapat ditentukan. Kf merupakan nilai dari
kapasitas adsorpsi dan n merupakan nilai intensitas adsorpsi. Dari Gambar 4.3 terlihat bahwa proses adsorpsi terbaik diberikan oleh adsorben 3, yang mengikuti model adsorpsi Freundlich, dengan nilai R2 yang paling mendekatiangka 1 yaitu sebesar 0,954.
Dari Tabel 4.4 dapat ditentukan persamaan yang sesuai dengan kondisi Freundlich ini adalah
Qe = 1,36752C 1/7,87402
Persamaan Langmuir untuk adsorben 2(6,8% kristalinitas) juga dapat ditentukan, yaitu:
Cre Cre C C . 96 1 . 96 379 , 2
Nilai intensitas adsorpsis ebesar 7,87402 pada model adsorpsi isoterm Freundlich telah masuk rentang antara 1-10 sehingga adsorpsi ini layak untuk diaplikasikan dalam dehidrasi etanol-air. Dari hasil ini dapat disimpulkan bahwa
semakin besar persen kristalinitas dari zeolit semakin besar pula kemampuan zeolit untuk menyerap air, dan proses adsorpsi pada penelitian ini lebih mengikuti model adsorpsi isoterm Freundlich.
KESIMPULAN DAN SARAN
Hasil terbaik adsorpsi dilakukan selama 35 menit dengan menghasilkan kadar etano l93,293% pada adsorben 2 dengan kadar etanol-air (v/v) 72%. Dari perhitungan yang telah dilakukan, adsorpsi etanol air, oleh zeolit NaA mengikuti model isoterm Freundlich dan persamaannya adalah Qe=1,36752C 1/7,87402 dengan nilai kapasitas
adsorpsi Kf=1,36752mmol/gram adsorben dan intensitas adsorpsi n = 7,87402.
DAFTAR PUSTAKA
Bird T. 1985.Phsycal Chemistry Jakarta. Gramedia.
Clark J. 2007.Pembutan Alkohol dalam Skala Produksi. http://www.chem-is-try.org. (28 Juli 2015).
Ika Widiastuti, Yanik., Nurul Widiastuti, Didik Prasetyoko, Fahimah Martak, Nurlailis Handayani. 2011. Adsorpsi Amonium (NH4+) menggunakan metode batch dan
kolom pada zeolit Akarbon yang disintesis dari Abu dasar Batubara. Tesis. Institut Teknologi Sepuluh Nopember Surabaya.
Khaidir. 2011. Modifikasi Zeolit Alam sebagai Material Molecular Sieve dan Aplikasinya pada Proses DehidrasiBioetanol. Tesis. Institut Pertanian Bogor. Londar.,Hamzah Fansuri Dan Nurul Widiastuti. 2009. Pengaruh Karbon Terhadap
Pembentukan Zeolit Dari Abu Dasar Dengan Metode Hidrotermal Langsung.
Surabaya:Laboratorium Anorganik, FMIPA Institut Teknologi Sepuluh November.
Onuki, S.2006. Bioethanol : Industrial production process and recent studies.
www.public.iastate.edu/~tge/courses/ce521/sonuki.pdf. (20 Agustus 2015). Ma’ruf, A,S.T.,M.T.2009. Penggunaan Zeolit Alam sebagai Adsorben pada Pembuatan
Sholicah, Fitriani, Arnelli, Ahmad Susseno. 2013. Pengaruh Waktu Hidrotermal Pada Sintesis Zeolit Pada Abu Sekam Padi Serta Aplikasinya Sebagai Builder Deterjen. Penelitian. UniversitasDiponegoro Semarang.
Wahyuni, S dan Widiastuti, N.. 2010. Adsorpsi Ion Logam Zn(II) pada Zeolit A yang Disintesis dari Abu Dasar Batubara PT. Ipmomi Paiton dengan Metode
Batch. Prosiding: FMIPA Institut Teknologi Sepuluh November Surabaya.
Daftar Gambar
Gambar 4.1. Kurva Adsorpsi etanol-air pada zeolit NaA pada adsorben 2 (% kristalinitas 6,8%) dengan kadar etanol 72 %
0 10 20 30 0 10 20 30 40 % P EN Y ER P A N A IR WAKTU PENYERAPAN Laju Penyerapan 0 5 10 15 20 25 0 20 40 % Pen yer apan A ir Waktu Penyerapan Adsorben 1 Adsorben 2 Adsorben 3 a
Gambar 4.2 . Kurva Adsorpsi Etanol-Air(v/v) pada tiap Zeolit NaA{(a) Kadar 72 % ; (b) Kadar 67 % (c) Kadar 63 %} (a) 0 5 10 15 20 0 20 40 % Pe n ye rap an A ir Waktu Penyerapan Adsorben 1 Adsorben 2 Adsorben 3 0 5 10 15 20 0 10 20 30 40 % Pe n ye rap an A ir Waktu Penyerapan Adsorben 1 Adsorben 2 Adsorben 3 y = 0,018x + 0,553 R² = 0,798 0 0.2 0.4 0.6 0.8 1 0 10 20 1/ C ae 1/θ y = 0,254x + 0,379 R² = 0,812 0 0.05 0.1 0.15 0.2 0.25 -1.5 -1 -0.5 0 log C ae log θ Linierisasi Freundlich Linierisasi Langmuir
Linierisasi Langmuir Linierisasi Freundlich b
(b)
(c)
Gambar 4.3. Grafik model isoterm Langmuir dan Freunlich tiap zeolit pada beragam rasio etanol-air(v/v) {(a) adsorben 1 (b) adsorben 2 (c) adsorben 3
Daftar Tabel
Tabel 4.1. Hasil adsorpsi pada masing-masing zeolit NaA
Adsorben Kadar Etanol-Air % Kadar Etanol Akhir
1 72 90,6306 67 83,11 63 80,8145 2 72 93,293 67 85,0961 63 81,637 y = 0,006x + 0,576 R² = 0,927 0.6 0.65 0.7 0.75 0 10 20 1/ C ae 1/θ y = 0,127x + 0,313 R² = 0,954 0 0.1 0.2 0.3 -2 -1 0 log C ae log θ y = 0,035x + 0,595 R² = 0,832 0.75 0.8 0.85 0.9 0.95 0 5 10 1/C ae 1/θ y = 0,268x + 0,298 R² = 0,804 0 0.05 0.1 0.15 -1 -0.5 0 log C ae log θ Linierisasi Freundlich Linierisasi Langmuir
3
72 88,5849
67 82,7096
63 77,3805
Tabel 4.2. Nilai Kapasitas dan Intensitas adsorpsi zeolit NaA pada variasi Adsorben
Run % Kadar
Model Langmuir Model Freundlich
Qo K R2 n Kf R2
1 72 1,80832 30,7222 0,798 3,93701 1,46082 0,812 2 67 1,73611 96 0,927 7,87402 1,36752 0,954 3 63 1,68067 17 0,832 3,73134 1,34716 0,804