LAPORAN PRAKTIKUM OTK 2 LAPORAN PRAKTIKUM OTK 2
Oleh : Oleh : SAPTHA FRYSTIA SAPTHA FRYSTIA (153141009(1531410097)7) TEKNIK KIMIA TEKNIK KIMIA
POLITEKNIK NEGERI MALANG POLITEKNIK NEGERI MALANG
2016/2017 2016/2017
ABSORPSI BATCH ABSORPSI BATCH
I.
I. Tujuan PraktikumTujuan Praktikum a.
a. Melihat perbandingan kelarutan gas tertentu (seperti COMelihat perbandingan kelarutan gas tertentu (seperti CO22, dan sebagainya) dengan, dan sebagainya) dengan
membuat variasi beberapa variable seperti : membuat variasi beberapa variable seperti :
Laju alir cairan
Konsentrasi gas terlarut
Waktu pengontakan
b. Membandingkan kurva kesetimbangan hasil dari operasi dengan kurva kesetimbangan pada literature
II. Dasar Teori
Absorpsi adalah proses pemisahan bahan dari suatu campuran gas dengan cara pengikatan bahan tersebut pada permukaan absorben cair yang diikuti dengan pelarutan. Kelarutan gas yang akan diserap dapat disebabkan hanya oleh gaya-gaya fisik (pada absorpsi fisik) atau selain gaya tersebut juga oleh ikatan kimia (pada absorpsi kimia). Komponen gas yang dapat mengadakan ikatan kimia akan dilarutkan lebih dahulu dan juga dengan kecepatan yang lebih tinggi. Peralatan absorpsi gas terdiri dari sebuah kolom berbentuk silinder atau menara yang dilengkapi dengan pemasukan gas dan ruang
distribusi pada bagian bawah, pemasukan zat cair dan distributornya pada bagian atas, pengeluaran gas dan zat cair masing-masing diatas dan dibawah
Gas yang mengandung zat terlarut, disebut gas kaya (rich gas), masuk ke ruang pendistribusian melalui celah isian, berlawanan arah dengan zat cair. Isian itu memberikan permukaan yang luas untuk kontak antara zat cair dan gas sehingga membantu terjadinya kontak yang maksimal antara kedua fase, dan terjadi penyerapan zat terlarut yang ada di dalam rich gas oleh zat cair yang masuk ke dalam menara dan gas encer ( lean gas) keluar dari atas. Sambil mengalir kebawah, zat cair makin kaya zat terlarut, dan keluar dari bawah menara sebagai cairan pekat ( strong liquor ). Operasi transfer massa umumnya dilakukan dengan menggunakan manara yang dirancang sedemikian sehingga diperoleh kontak yang baik antara kedua fase. Alat transfer massa yang berupa menara secara umum dapat dibagi ke dalam 4 golongan, yaitu : menara sembur, menara gelembung, menara pelat dan menara paking.
Pada absorbsi sendiri ada dua macam proses yaitu :
a. Absorbsi fisik
Absorbsi fisik merupakan absorbsi dimana gas terlarut dalam cairan penyerap tidak disertai dengan reaksi kimia. Contoh absorbsi ini adalah absorbsi gas H2S dengan
air, metanol, propilen, dan karbonat. Penyerapan terjadi karena adanya interaksi fisik, difusi gas ke dalam air, atau pelarutan gas ke fase cair. Dari asborbsi fisik ini ada beberapa teori untuk menyatakan model mekanismenya, yaitu :
1. Teori model film 2. Teori penetrasi
3. teori permukaan yang diperbaharui
b. Absorbsi kimia
Absorbsi kimia merupakan absorbsi dimana gas terlarut didalam larutan penyerap disertai dengan adanya reaksi kimia. Contoh absorbsi ini adalah absorbsi dengan adanya larutan MEA, NaOH, K 2CO3, dan sebagainya. Aplikasi dari absorbsi kimia dapat dijumpai pada proses penyerapan gas CO2 pada pabrik amoniak. Penggunaan absorbsi kimia pada fase kering sering digunakan untuk mengeluarkan zat terlarut secara lebih sempurna dari campuran gasnya. Keuntungan absorbsi kimia adalah meningkatnya koefisien perpindahan massa gas, sebagian dari perubahan ini disebabkan makin besarnya luas efektif permukaan. Absorbsi kimia dapat juga berlangsung di daerah yang hampir stagnan disamping penangkapan dinamik.
Hal-hal yang mempengaruhi dalam prsoses adsorbsi :
Zat yang diadsorbsi
Luas permukaan yang diadsorbsi
Temperature
Tekanan
Absorben
Absorben adalah cairan yang dapat melarutkan bahan yang akan diabsorpsi pada permukaannya, baik secara fisik maupun secara reaksi kimia. Absorben sering juga
disebut sebagai cairan pencuci. Persyaratan absorben :
Memiliki daya melarutkan bahan yang akan diabsorpsi yang sebesar mungkin
Selektif
Memiliki tekanan uap yang rendah
Tidak korosif. dan harganya murah
Mempunyai viskositas yang rendah
Kolom Absorpsi
Adalah suatu kolom atau tabung tempat terjadinya proses pengabsorbsi penyerapan/penggumpalan) dari zat yang dilewatkan di kolom/tabung tersebut. Proses ini dilakukan dengan melewatkan zat yang terkontaminasi oleh komponen lain dan zat tersebut dilewatkan ke kolom ini dimana terdapat fase cair dari komponen tersebut.
Prinsip Absorbsi
Udara yang mengandung komponen terlarut (misalnya CO 2) dialirkan ke dalam kolom pada bagian bawah. Dari atas dialirkan alir. Pada saat udara dan air bertemu dalam kolom isian, akan terjadi perpindahan massa. Dengan menganggap udara tidak larut dalam air (sangat sedikit larut),maka hanya gas CO2 saja yang berpindah ke dalam fase air (terserap). Semakin ke bawah, aliran air semakin kaya CO2. Semakin ke atas ,aliran udara semakin miskin CO2. Faktor-faktor yang berpengaruh pada operasi absorpsi adalah sebagai berikut :
Laju alir air. Semakin besar,penyerapan semakin baik.
Komposisi dalam aliran air. Jika terdapat senyawa yang mampu beraksi dengan CO2 (misalnya NaOH) maka penyerapan lebih baik.
Suhu operasi.Semakin rendah suhu operasi,penyerapan semakin baik.
Tekanan operasi.Semakin tinggi tekanan operasi, penyerapan semakin baik sampai pada batas tertentu. Diatas tekanan maksimum (untuk hidrokarbon biasanya 4000-5000 kPa), penyerapan lebih buruk.
Laju alir gas. Semakin besar laju alir gas, penyerapan semakin buruk.
III. Daftar Alat dan Bahan
1. Bahan dan zat kimia yang diperlukan
a). Untuk Pengoperasian :
Gas CO2 murni.
Udara (dari kompressor).
Isi tangki cairan dengan 30 L air. Hidupkan pompa cairan b). Untuk analisa sampel :
Natrium hidroksida (NaOH) : 0,1 N.
Aquadest.
Indikator phenolphtalin.
2. Peralatan yang diperlukan
a). Untuk pengoperasian :
Absorption column 1 unit.
CO2 bottle dan regulator.
Kompressor.
Termometer.
Beaker glass 500 ml dan 1000 ml.
Stopwatch. b). Untuk analisa :
Buret 50 ml.
Erlenmeyer 100 ml.
Beaker glass 250 ml dan 1000 ml.
Pipet volume 10 ml dan 25 ml.
Karet sedot
Statif untuk buret.
Corong kaca. Deskripsi Peralatan
Peralatan praktikum absorber terdiri dari suatu rangkaian kolom berpaking, yang terdiri dari :
1. Kolom absorber kaca (kolom paking). 2. Tangki umpan.
3. Rangkaian perpipaan dan alat ukur laju alir / tekanan. 4. Sumber gas murni (missal CO2) dan regulator.
IV. Prosedur percobaan A. Kalibrasi Orificemeter.
Catat waktu yang dibutuhkan hingga manometer cairan air menunjukkan pembabaan. Biarkan sistem beroperasi hingga mencapai keadaan konstan.
Catat perbadaan tekanan pada manometer
Ulangi langkah diatas dengan mengubah laju alir udara menjadi 90 L/min Atur laju alir udara sebesar 45 L/min
Bersihkan tangki penampung cairan, gantikan air dengan NaOH 0,1 N
Lakukan pengambilan sampel 100 ml masing
–
masing dari inlet maupun outlet untuk dianalisa den an titrasiHidupkan pompa cairan, buka valve pengatur laju cairan NaOH dengan laju alir 2 L/min, 4 L/min, dan 6 L/min. Atur laju alir CO2 2 L/min, dan
laju alir udara 45 L/min
Ambil 100 ml cairan sampel masing-masing dari inlet maupun outlet. Kemudian ambil 50ml letakkan pada erlenmeyer 1 dan 50 pada erlenmeyer
2 (perlakuan yang sama pada cairan inlet maupun outlet) .
Perlahan - lahan buka keran pengatur laju alir cair an hingga cairan mengalir ke kolom.Atur laju cairan dengan variasi 2L/min, 4L/min, dan 6L/min
B. Pengujian daya serap gas terhadap cairan NaOH (absorpsi) dengan variasi laju alir NaOH dan variasi waktu.
Pada erlenmeyer 1 tambahkan dengan setetes indikator PP dan titrasi dengan larutan HCl hingga warna merah muda menghilang.
Tambahkan 2 tetes indikator PP dan titrasi dengan HCl hingga mencapai mencapai titik akhir titrasi (T3)
Pada erlen meyer ke- 2 tambahkan sekitra 10% lebih dari hasil perhitungan (T2-T1) larutan BaCl2 dan kocok.
Catat jumlah titran yang dibutuhkan sebagai T1. Lalu tambahkan indikator metil orange dan lanjutkan titrasi dengan HCl hingga tercapai titik akhir
titrasi. Catata total penambahan asam yang digunaka sebagai T2
V. Data Pengamatan
Laju alir udara = 20L/min Laju alir CO2 = 2L/min
Absorber = NaOH 0,1 N (30 L) Larutan penitrasi = HCl 0,1 M Volume sampling = 50 ml a. Kalibrasi
20 40 60 80 100 0 0.2 0.3 2.2 4 4.3 2 0.4 1.2 2 5.2 13.1 4 1.9 3.6 7.5 22.2 28.4 6 6.2 17 25.5 - -8 20 75 32 - -10 40 - - -
- b. Analisa gas CO2 dalam NaOH/Na2CO3
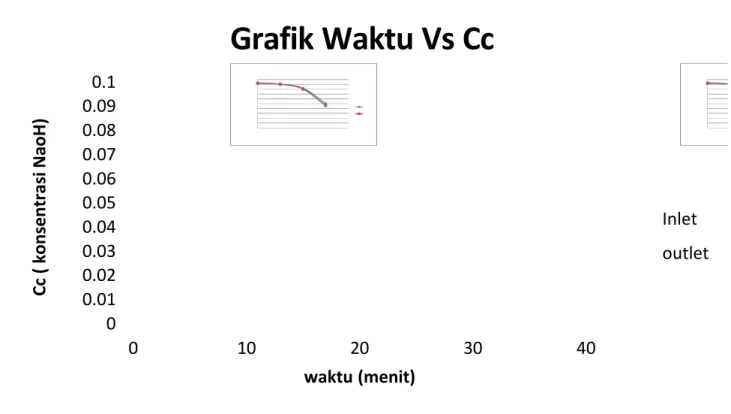
Waktu (menit) Inlet T1 T2 T3 CC C N 0 33.2 47 46.7 0.0934 0.0003 10 19.9 46 45.2 0.0904 0.0008 20 12.2 46.1 41 0.082 0.0051 30 6 27.2 25.2 0.0504 0.02
VI. Analisa Data Waktu (menit) Outlet T1 T2 T3 CC C N 0 21.3 46.6 46.2 0,0924 0,0004 10 17.8 46.2 45 0,09 0,0012 20 13.5 46.1 40.1 0,0802 0,006 30 5.6 26.7 23 0,046 0,0037 Waktu (menit)
Laju alir cairan CO2(L/menit)
Inlet Outlet CO2 yang terserap (gmol/menit) C N C N 0 2 0.0003 0.0004 0.0002 10 2 0.0008 0.0012 0.0008 20 2 0.0051 0.006 0,0018 30 2 0.02 0.0037 0,0034
Perhitungan Konsentrasi Sampel
a. Konsentrasi NaOH dalam sampel inlet (t= 5 menit) Cc = x 0,1M =,7 0,1 = 0,0934gmol/L (t= 10 menit) Cc = x 0,1M =, 0,1 = 0,0904gmol/L (t= 20 menit) Cc = x 0,1M = 0,1 = 0,082gmol/L (t= 30 menit) Cc = x 0,1M =, 0,1 = 0,0504 gmol/L
b. Konsentrasi NaOH dalam sampel outlet (t= 0 menit) Cc = x 0,1M =, 0,1 = 0,0924gmol/L (t= 10 menit) Cc = x 0,1M = 0,1 = 0,09 gmol/L (t= 20 menit) Cc = x 0,1M =, 0,1 = 0,0802gmol/L (t= 30 menit) Cc = x 0,1M = 0,1 = 0,046gmol/L
(t= 0 menit) C N = − x 0,1M x 0,5 =7−,7 0,1 0,5 = 0,0003gmol/L (t= 10 menit) C N = − x 0,1M x 0,5 =−, 0,1 0,5 =0,0008 gmol/L (t= 20 menit) C N = − x 0,1M x 0,5 =,− 0,1 0,5 =0,0051 gmol/L (t= 30 menit) C N = − x 0,1M x 0,5 =7,−, 0,1 0,5 = 0,002 gmol
d. Konsentrasi Na2CO3 dalam sampel outlet
(t= 0 menit) C N =− x 0,1M x 0,5 =,−, 0,1 0,5 = 0,0004 gmol/L (t= 10 menit) C N = − x 0,1M x 0,5 =,− 0,1 0,5 = 0.0012 gmol/L (t= 20 menit) C N = − x 0,1M x 0,5 =,−, 0,1M 0,5 = 0,006 gmol/L (t= 30 menit)
C N = − x 0,1M x 0,5 =,7− 0,1M 0,5 = 0,0037 gmol/L Perhitungan CO2 terserap a. Waktu 0 menit
CO2 terserap = laju alir cairan x [(C N)o-(C N)i]
= 2 x [(0,0004)-(0,0003)] = 0,0004 gmol/menit b. Waktu 10 menit
CO2 terserap = laju alir cairan x [(C N)o-(C N)i]
= 2 x [(0,0012)-(0,0008)] = 0,0008 gmol/menit c. Waktu 20 menit
CO2 terserap = laju alir cairan x [(C N)o-(C N)i]
= 2 x [(0,006)-(0,0051)] = 0,0018 gmol/menit d. Waktu 30 menit
CO2 terserap = laju alir cairan x [(C N)o-(C N)i]
= 2 x [(0,0037)-(0,002)] = 0,0034 gmol/menit
a. Grafik Kalibrasi Laju Air Udara 20 L/menit b. Grafik Analisa y = 1.45x - 2.9667 R² = 0.9279 -1 0 1 2 3 4 5 6 7 1 2 3 4 5 6 7 L a j u A l i r A i r
Kalibrasi
ΔP VS Laju Alir Air
0 0.0005 0.001 0.0015 0.002 0.0025 0.003 0.0035 0.004 0 5 10 15 20 25 30 35 C O 2 y a n g t e r s e r a p ( g m o l / m e n i t ) waktu (menit)
VII. Pembahasan
Pada praktikum kali ini dilakukan analisa gas CO2 dalam NaOH atau Na2CO3
melalui proses absorbsi batch dimana terlebih dahulu dilakukan kalibrasi dengan absorber air dengan laju alir udara 45 L/menit dan laju alir air 2,4,6 L/menit dan didapatkan grafik antara laju alir air vs perubahan tekanan dimana semakin dinaikkan laju alir air semakin tinggi nilai perubahan tekanannya. Setelah dilakukan kalibrasi dilakukan analisa gas CO2dengan absorber berupa NaOH dengan laju alir
udara 45 L/menit dan laju alir NaOH 2 L/menit dengan interval waktu 5 menit sampai 20 menit dimana gas CO2dan NaOH dikontakkan melalui kolom absorber
dengan mengalirkan gas CO2dari bagian bawah kolom dan NaOH dialirkan dari
bagian atas kolom, kolom dilengkapi packing yang bertujuan untuk memperluas kontak antara NaOH dan gas CO2. Sampel diambil sebanyak 100 ml melalui umpan
(inlet) dan keluaran dari kran (outlet) dititrasi untuk mengetahui gas CO2 yang
terserap. Titrasi dilakukan 2 kali yaitu titrasi asidimetri yang bertujuan untuk mengetahui konsentrasi NaOH dengan titran HCl 0,1N dengan indikator pp dari bewarna merah jambu menjadi tak bewarna, lalu dilakukan titrasi alkalimetri
dengan menggunakan HCl 0,1N dan indikator metil orange yang akan memberikan warna jingga pada garam NaCl yang terbentuk hingga berwarna merah jambu setelah mencapai titik ekivalen, Setelah dititrasi didapatkan sampel inlet hasil titrasi yang mengalami penurunan dari setiap waktunya ini berpengaruh pada hasil perhitungan konsentasi NaOH menunjukkan bahwa dari waktu kewaktu konsentrasi NaOH mengalami penurunan akan tetapi pada menit ke 5, 10, dan 15 hampir konstan yaitu 0,03 sedangkan pada perhitungan konsentrasi Na2CO3 tidak konstan.
Pada sampel outlet hasil titrasi juga mengalami penurunan sehingga pada perhitungan hasil konsentrasi NaOH juga mengalami penurunan ini disebabkan pada semakin lama waktu pengontakan NaOH dan gas CO2 semakin banyak NaOH
0 0.01 0.02 0.03 0.04 0.05 0.06 0.07 0.08 0.09 0.1 0 10 20 30 40 C c ( k o n s e n t r a s i N a o H ) waktu (menit)
Grafik Waktu Vs Cc
Inlet outletyang bereaksi dengan NaOH sebaliknya konsentrasi Na2CO3 mengalami
peningkatan, sehingga jumlah CO2 yang terserap semakin banyak dari waktu
kewaktu ini menunjukkan bahwa semakin lama pengontakan semakin optimal NaOH menyerap CO2 sesuai dengan grafik yang ditunjukkan.
VIII. Kesimpulan
Dari percobaan hanya dilakukan variabel waktu untuk mengetahui kelarutan CO2
yaitu 5,10,15,20 menit dan didapatkan semakin lama waktu semakin banyak CO2
yang larut karena semakin lama waktu semakin lama pengontakkan dan NaOH dapat mengabsorb CO2secara optimal.
IX. Daftar Pustaka
http://alexschemistry.blogspot.co.id/2013/03/laporan-operasi-teknik-kimia-absorbsi.html http://astrid273.blogspot.co.id/2013/06/laporan-praktikum-satuan-operasi-ii.html http://depisatir.blogspot.co.id/2013/06/absorpsi-ii-absorpsi-co2-dalam-air.html