PEMANFAATAN DAN KARAKTERISASI ABU VULKANIK GUNUNG SINABUNG SEBAGAI BAHAN DASAR
PEMBUATAN ADSORBEN SILIKA UNTUK MENGIKAT LOGAM BERAT Pb(II)
Devy Putri Oktavia
Jurusan Kimia FMIPA Universitas Negeri Medan, Medan 20221 E-mail: devyputrioktavia11@gmail.com
ABSTRAK
Sintesis silika gel telah dilakukan dengan memanfaatkan abu vulkanik Gunung Sinabung yang diambil dari Desa Berastepu, Simpang Empat, Kabupaten Karo yang berjarak 1,5 km dari puncak Gunung Sinabung. Abu vulkanik merupakan salah satu sumber penghasil silika terbesar, berpotensi sebagai bahan pembuatan silika gel. Sintesis silika gel pada penelitian ini dilakukan dengan metode sol-gel. Abu vulkanik didekstruksi dengan larutan NaOH 4M dan pembentukan gel dengan larutan HCl 3M. Silika yang dihasilkan dikarakterisasi dengan AAS, FTIR dan XRD. Kadar silika yang diperoleh dalam penelitian ini sebesar 17,85%. Berdasarkan hasil analisis menggunakan FTIR menunjukkan adanya gugus Si-O-Si dan Si-O-Si-OH yang menyatakan bahwa adsorben silika berhasil dibuat. Karakterisasi menggunakan XRD menunjukkan bahwa silika yang dihasilkan memiliki derajat kekristalan yang rendah (berbentuk amorf). Silika gel hasil sintesis digunakan sebagai adsorben untuk mengikat logam berat Pb(II). Metode yang digunakan dalam interaksi adsorben dengan larutan yaitu metode batch. Pada penentuan massa optimum adsorben silika diperoleh 0,25 gram sebagai massa optimum. Waktu kontak optimum adsorpsi ion logam Pb(II) oleh silika gel yaitu 40 menit. pH optimum adsorpsi ion logam Pb(II) oleh silika gel yaitu pH 7. Dan konsentrasi optimum adsorpsi ion logam Pb(II) oleh silika yaitu 110 ppm.
Kata kunci: sintesis, silika gel, abu vulkanik, sol-gel, karakterisasi, AAS, FTIR,
XRD, amorf, adsorpsi, batch, logam berat Pb(II).
ABSTRACT
Synthesis of silica gel has been done by utilizing the volcanic ash Sinabung Mountain taken Berastepu Village, Simpang Empat, Karo within 1,5 km from the top of the Sinabung Mountain. Volcanic ash is one of the biggest source of silica, potentially as materials for synthesis of silica gel. Synthesis of silica gel in this study conducted by sol-gel method. Volcanic ash in the destruction carried out with NaOH 4M solution and establishment of gel with HCl 3M solution. The result of synthesis of silica was characterized with AAS, FTIR, and XRD. The levels of silica obtained in this study amounted to 17,85%. Based on the results of analysis by FTIR pointed to the existence of the siloxane (Si-O-Si) and silanol
(Si-OH) functional groups stating that the silica adsorbent was successfully formed. The XRD analysis showed amorphorus stucture of silica. The silica gel was result of synthesis used as adsorbent to bind heavy metal Pb(II). The method used in interaction adsorbent with a solution is batch method. On determining the optimum mass of silica adsorbents obtained with 0,25 grams as an optimum mass. The optimum contact time of metal ion Pb(II) adsorption by silica gel which is about 40 minutes. The optimum pH of metal ion Pb(II) adsorption by silica gel is pH 7. The optimum concentration of metal ion Pb(II) adsorption by silica is 110 ppm.
Keywords: synthesis, silica gel, volcanic ash, sol-gel, characterization, AAS,
FTIR, XRD, amorphorus, adsorption, batch, heavy metals Pb(II).
PENDAHULUAN
Gunung Sinabung merupakan salah satu gunung berapi aktif yang terdapat di dataran tinggi Kabupaten Karo, Sumatera Utara, Indonesia. Koordinat puncak Gunung Sinabung adalah 03° 10’ LU dan 98° 23’ BT dengan puncak tertinggi gunung ini adalah 2.460 meter dari permukaan laut yang menjadi puncak tertinggi di Sumatera Utara (Global Volcanism Program, 2008).
Data BNPB menyebutkan, semenjak letusan akhir Agustus tahun 2010, Gunung Sinabung meletus beberapa kali, termasuk salah satu letusan terbesar. Dan hingga saat ini, Gunung Sinabung terus-menerus mengalami erupsi. Hasil dari erupsi Gunung Sinabung tersebut mengeluarkan kabut asap yang tebal berwarna hitam disertai hujan pasir, dan debu vukanik yang menutupi ribuan hektar tanaman para petani yang berjarak dibawah radius enam kilometer tertutup debu tersebut (Alexander, 2010).
Abu vulkanik adalah fragmen yang berukuran kurang dari 2 mm hingga ukuran debu. Abu vulkanik atau pasir vulkanik adalah bahan material vulkanik jatuhan yang disemburkan ke udara saat terjadi suatu letusan. Jenis-jenis mineral hadir dalam abu vulkanik tergantung pada kimia magmanya. Unsur yang paling berlimpah ditemukan dalam magma adalah silika (SiO2) dan oksigen (O2).
Letusan basal energi rendah (basal: batuan beku berwarna gelap, berbutir halus yang merupakan pembekuan lava dari gunung api) menghasilkan abu berwarna gelap khas yang mengandung 45-55 % silika yang umumnya kaya akan zat besi (Fe) dan magnesium (Mg). Letusan riolit paling eksplosif menghasilkan abu felsic
yang tinggi silika (> 69%), sedangkan abu jenis lain dengan komposisi menengah (misalnya, andesit atau dasit) memiliki kandungan silika antara 55-69 %. Berdasarkan penelitian Nakada dan Yoshimoto (2014) menyatakan kandungan silika dalam abu vulkanik Gunung Sinabung adalah 58,10%. Tingginya kandungan silika dalam abu vulkanik Gunung Sinabung merupakan suatu hal yang menarik untuk diteliti lebih lanjut, khususnya tentang pemanfaatan abu vulkanik tersebut sebagai bahan dasar pembuatan adsorben silika untuk mengikat logam berat timbal (Sukarman dan Dariah, 2014).
Silika adalah senyawa kimia dengan rumus molekul SiO2 (silicon
dioxida) yang dapat diperoleh dari silika mineral, nabati dan sintesis kristal. Semua modifikasi kristalin silika berupa senyawa polimerik tiga dimensi dengan jaringan ikatan kovalen Si-O membentuk suatu molekul raksasa, jaringan ini mengandung spesies “penghubung” tetrahedral SiO4, dengan tiap atom Si diikat
oleh empat atom O dan tiap atom O diikat oleh dua atom Si (Rapierna, 2012). Silika gel merupakan silika amorf yang terdiri atas globula-globula SiO4
tetrahedral yang tersusun secara tidak teratur dan beragregasi membentuk kerangka tiga dimensi yang lebih besar. Rumus kimia silika gel secara umum adalah SiO2.xH2O. Struktur satuan mineral silika pada dasarnya mengandung
kation Si4+ yang terkoordinasi secara tetrahedral dengan anion O2-. Namun demikan, susunan tetrahedral SiO4 pada silika gel tidak beraturan (Oscik, 1982).
Silika gel banyak digunakan dalam proses adsorpsi karena stabil pada kondisi asam, non swelling, memiliki pertukaran massa yang tinggi, porositas dan luas permukaan spesifik serta memiliki daya tahan tinggi terhadap panas. Selain itu silika gel memiliki situs aktif berupa gugus silanol (-Si-OH) dan siloksan (O-Si-O) di permukaan. Gugus siloksan ada dua macam, yaitu Si-O-Si rantai lurus dan gugus siloksan yag membentuk struktur lingkar dengan empat anggota. Jenis yang pertama tidak reaktif dengan pereaksi pada umumnya, tetapi sangat reaktif terhadap senyawa logam alkali. Jenis gugus siloksan yang membentuk lingkar dengan empat anggota mempunyai reaktivitas yang tinggi, dapat mengadakan kemisorpsi dengan air, amoniak dan metanol.
Sifat silika gel ditentukan oleh orientasi dari ujung tempat gugus hidroksil berkombinasi. Oleh karena ketidak-teraturan susunan permukaan SiO4
tetrahedral, maka jumlah distribusinya per unit area bukan menjadi ukuran kemampuan adsorpsi silika gel, meskipun gugus silanol dan siloksan terdapat pada permukaan silika gel. Kemampuan adsorpsi ternyata tidak sebanding dengan jumah gugus silanol dan gugus siloksan yang ada pada permukaan silika gel, tetapi tergantung pada distribusi gugus OH per unit area adsorben (Oscik, 1982).
Salah satu logam berat yang sangat populer bagi masyarakat adalah timbal. Hal ini disebabkan oleh banyaknya timbal yang digunakan di industri nonpangan dan paling banyak menimbulkan keracunan pada makhluk hidup. Pencemaran Pb dapat terjadi di udara, air, maupun tanah. Pencemaran Pb merupakan masalah utama, tanah dan debu sekitar jalan raya pada umumnya telah tercemar bensin bertimbal selama bertahun-tahun (Sunu, 2001). Karena itulah perlu dilakukan upaya untuk menguragi pencemaran lingkungan oleh logam berat timbal.
Salah satu teknik pengolahan limbah yang diharapkan dapat digunakan untuk menurunkan konsentrasi logam berlebihan pada lingkungan adalah dengan proses adsorpsi. Teknik ini mempunyai keunggulan dibandingkan dengan teknik lain. Keuntungan utamanya adalah biayanya sedikit serta tidak ada efek samping zat beracun (Blais, dkk., 2000).
Adsorpsi merupakan suatu proses penyerapan oleh padatan tertentu terhadap zat tertentu yang terjadi pada permukaan zat padat karena adanya gaya tarik atom atau molekul pada permukaan zat padat tanpa meresap ke dalam (Atkins, 1999).
METODE PENELITIAN Alat dan Bahan
Peralatan yang digunakan dalam penelitian ini dibedakan menjadi dua bagian yaitu peralatan penunjang dan peralatan analisis.
Peralatan penunjang meliputi: oven, neraca analitik, tanur, lumpang dan alu, ayakan 200 mesh, desikator, kertas saring whatman 42, hot plate lengkap
dengan pengaduk magnet, indikator universal, corong buchner, peralatan gelas dan peralatan plastik.
Peralatan analisis meliputi: XRD Shimadzu 6100, FTIR Shimadzu tipe IRPrestige 21, AAS Hitachi Z2000.
Bahan-bahan yang digunakan dalam penelitian ini adalah abu vulkanik Gunung Sinabung dari Desa Berastepu Kabupaten Karo (radius 1,5 km), NaOH (Merck), HCl (Merck), HNO3 (Merck), akuades, Pb(NO3)2.
Prosedur Kerja
Pembuatan Larutan Natrium Silikat
Abu vulkanik digerus kemudian diayak dengan ayakan 200 mesh untuk menghomogenkan ukuran abu dan memperluas permukaan abu sehingga sintesis natrium silikat efektif.
Sebanyak 20 gram abu vulkanik berukuran 200 mesh direndam dalam HNO3 pekat sebanyak 120 mL selama 24 jam. Setelah itu abu dinetralkan dengan
akuades kemudian dikeringkan dalam oven pada temperatur 120°C selama 6 jam. Abu vulkanik kering ditimbang beratnya kemudian dilarutkan dengan 156 mL NaOH 4M (stoikiometri) dan dididihkan sambil diaduk sampai mengental. Setelah hampir kering, larutan dimasukkan ke dalam furnace pada suhu 500°C selama 30 menit. Setelah dingin ditambahkan dengan 200 mL akuades dan didiamkan semalaman. Kemudian disaring dengan kertas saring whatman 42. Filtrat kemudian dikarakterisasi menggunakan Spektrofotometer Serapan Atom untuk mengetahui kadar silika yang terkandung dalam larutan tersebut.
Pembuatan Silika Gel
Pembuatan silika gel dilakukan dengan metode sol gel. Sebanyak 20 mL larutan natrium silikat dimasukkan ke dalam gelas plastik kemudian ditetesi HCl 3M sambil diaduk dengan pengaduk magnet sampai terbentuk gel berwarna putih dan dilanjutkan sampai pH netral. Gel yang terbentuk didiamkan semalaman. Kemudian silika gel disaring dan dibilas dengan akuades sampai pH netral. Kemudian dikeringkan dalam oven pada suhu 120°C selama 6 jam. Silika yang
dihasilkan digerus dan diayak dengan ayakan 200 mesh untuk menghomogenkan ukurannya.
Karakterisasi Silika
Analisa menggunakan FTIR dilakukan untuk mengetahui gugus fungsional dari silika yang dihasilkan. Setiap ikatan mempunyai frekuensi vibrasi yang khas sehingga absorpsi infra merah dapat digunakan untuk identifikasi gugus-gugus yang ada dalam suatu senyawa. Karakterisasi menggunakan XRD dilakukan untuk mengetahui kristalinitas silika yang dihasilkan. Data yang diperoleh dari analisis XRD berupa grafik hubungan antara sudut difraksi sinar-x pada sampel dengan intensitas sinar yang dipantulkan oleh sampel. Data yang didapatkan berupa difraktogram yang selanjutnya dibandingkan dengan data JCPDS yang sudah ada pada data base.
Pembuatan Larutan Baku Pb 1000 ppm dari Padatan Pb(NO3)2
Sebanyak 1,5990 gram Pb(NO3)2 dilarutkan dengan akuades, kemudian
dimasukkan dalam labu ukur 1000 mL dan diencerkan dengan akuades hingga tanda batas.
Pembuatan Kurva Kalibrasi
Pembuatan kurva kalibrasi larutan standar dimaksudkan untuk mencari hubungan antara absorbansi dengan konsentrasi larutan standar Si dan Pb(II). Kurva kalibrasi Si dibuat dengan seri larutan Si mulai dari 0; 20; 40; dan 60 ppm. Kurva kalibrasi Pb(II) dibuat dengan seri larutan Pb(II) mulai dari 0; 2; 4; dan 6 ppm. Setelah didapatkan data absorbansi selanjutnya dibuat grafik hubungan antara konsentrasi terhadap absorbansi dan diperoleh persamaan regresi.
Penentuan Massa Optimum Adsorben Silika
Silika ditimbang masing-masing 0,25; 0,5; 0,75; dan 1,00 gram. Masing-masing variasi ditambahkan 10 mL larutan ion Pb(II) dengan konsentrasi 60 ppm
dan diaduk dengan pengaduk magnet selama 30 menit. Setelah itu larutan disaring dan filtrat yang diperoleh dianalisis dengan AAS.
Penentuan Waktu Kontak Optimum
Silika ditimbang sesuai hasil penentuan massa optimum. Lalu ditambahkan 10 mL larutan ion Pb(II) dengan konsentrasi 60 ppm. Kemudian diaduk dengan pengaduk magnet dengan variasi waktu kontak 20, 40, 60, 80, dan 100 menit. Setelah itu larutan disaring dan filtrat yang diperoleh dianalisis dengan AAS.
Penentuan pH Optimum
Silika ditimbang sesuai hasil penentuan massa optimum. Lalu ditambahkan 10 mL larutan ion Pb(II) dengan konsentrasi 60 ppm. Kemudian diaduk dengan pengaduk magnet sesuai waktu kontak optimum dengan variasi pH larutan 3, 4, 5, 6, dan 7. Setelah itu larutan disaring dan filtrat yang diperoleh dianalisis dengan AAS.
Penentuan Konsentrasi Optimum
Silika ditimbang sesuai hasil penentuan massa optimum. Lalu ditambahkan 10 mL larutan ion Pb(II) dengan variasi konsentrasi 70, 90, 110, dan 130 ppm. Kemudian diaduk dengan pengaduk magnet selama waktu kontak optimum dan pH optimum. Setelah itu larutan disaring dan filtrat yang diperoleh dianalisis dengan AAS.
HASIL DAN PEMBAHASAN
Penentuan Kadar Silika dalam Larutan Natrium Silikat
Perendaman abu vulkanik Gunung Sinabung dengan HNO3 pekat
bertujuan untuk mengurangi kadar pengotor berupa oksida-oksida logam selain SiO2 yang terkandung dalam abu vulkanik Gunung Sinabung seperti MgO, K2O,
karena sifat kimia SiO2 yang tidak reaktif terhadap asam kecuali asam fluorida
dan asam posfat, sehingga tidak mengurangi rendemen silika yang terbentuk. Selanjutnya abu vulkanik Gunung Sinabung yang bersih dan kering ditimbang, dan diperoleh beratnya sebesar 18,6849 gram. Kemudian abu dilarutkan dengan larutan NaOH 4M sebanyak 156 mL (stoikiometri). Pelarutan ini dilakukan diatas pemanas sambil diaduk sampai mengental dan berwarna coklat. Pelarutan dengan pemanasan bertujuan agar natrium silikat yang diperoleh optimal. Larutan yang sudah mengental dilebur dalam furnace pada temperatur 500°C selama 30 menit. Peleburan dengan furnace pada suhu 500°C didasarkan pertimbangan titik leleh NaOH, yaitu 323°C sehingga pada suhu tersebut NaOH terdisosiasi sempurna membentuk ion natrium dan ion hidroksida. Pada SiO2,
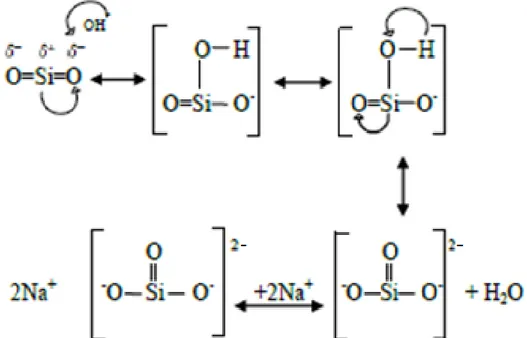
elektronegativitas atom O yang tinggi menyebabkan Si lebih elektropositif dan terbentuk intermediet [SiO2OH]- yang tidak stabil sehingga terjadi dehidrogenasi.
Ion OH- yang kedua akan berikatan dengan hidrogen membentuk molekul air dan dua ion Na+ akan menyeimbangkan muatan negatif ion SiO32- sehingga terbentuk
natrium silikat (Na2SiO3), menurut mekanisme sebagai berikut (gambar 1).
Gambar 1. Model mekanisme rekasi pembentukkan natrium silikat (Trivana, dkk, 2015)
Hasil peleburan berwujud padatan berwarna putih kehijauan dengan tekstur mengembang berbentuk rongga-rongga. Padatan didinginkan kemudian
ditambah dengan 200 mL akuades dan didiamkan selama satu malam agar terbentuk larutan Na2SiO3. Pelarutan Na2SiO3 dalam akuades menghasilkan
sistem hidrosol Na2SiO3. Pada sistem ini terdapat anion silikat (≡Si-O-) sebagai
gugus reaktif, dengan ion natrium sebagai penyeimbang muatan. Kemudian larutan disaring dengan kertas saring whatman 42 dan filtratnya diambil. Residu berupa padatan dimungkinkan adalah silika dan oksida-oksida yang tidak terdekomposisi. Larutan natrium silikat yang dihasilkan berwarna kecoklatan dan indikator awal terbentuknya natrium silikat adalah apabila disentuh larutan akan terasa licin dikulit. Filtrat kemudian dilakukan uji kandungan silika menggunakan Spektrofotometer Serapan Atom pada panjang gelombang 251,6 nm.
Berdasarkan penelitian yang dilakukan Nakada dan Yoshimoto (2014), kadar silika yang terkandung dalam abu vulkanik Gunung Sinabung sebesar 58,10%. Tetapi kadar Si hasil sintesis yang diperoleh berdasarkan uji AAS sebesar 7782,5 ppm. Dari data tersebut dapat dihitung kadar silika dalam 200 mL larutan Na2SiO3 yaitu sebesar 3,3353 gram atau sebesar 17,85% dari berat awal
sampel abu vulkanik. Hal ini disebabkan oleh teknik pengambilan sampel abu vulkanik yang kurang benar, dimana saat pengambilan abu banyak tanah yang terambil juga sehingga dalam sampel yang dikumpulkan lebih banyak tanah daripada abu vulkanik Gunung Sinabung.
Sintesis Silika Gel
Penambahan HCl 3M pada 20 mL larutan Na2SiO3 yang dilakukan tetes
demi tetes membentuk gel berwarna putih disebabkan adanya reaksi kondensasi. Penambahan HCl ke dalam larutan natrium silikat menyebabkan terjadinya pertukaran ion Na+ dengan H+ membentuk asam silikat bebas (H2SiO3), dimana
asam silikat bebas ini tidak larut dalam asam kuat seperti HCl (Mori, 2003). Rekasi yang terjadi:
Na2SiO3(aq) + 2HCl(aq) → H2SiO3(s) + 2NaCl(aq)
Asam silikat bebas yang terbentuk kemudian akan mengalami reaksi polikondensasi membentuk dimer, trimer hingga polimer disertai pelepasan
molekul air. Reaksi tersebut akan terus berlangsung sampai terbentuk produk berupa silika gel.
H2SiO3(s) → SiO2(s) + H2O(aq)
Berdasarkan penelitian Ayu, dkk (2013) pada kondisi pH 7 ini, silika gel yang dihasilkan memiliki rendemen dan luas permukaan yang paling besar. Endapan yang diperoleh pada pH kurang dari 7 semakin sedikit, hal ini terjadi karena pada kondisi pH tersebut endapan yang telah terbentuk larut kembali. Sedangkan endapan yang diperoleh pada pH lebih dari 7 juga sedikit, karena pada kondisi pH tersebut larutan HCl yang digunakan untuk bereaksi dengan natrium klorida hanya sedikit sehingga pertukaran antara ion Na+ dan H+ yang terjadi juga sedikit.
Selanjutnya gel yang terbentuk didiamkan selama satu malam agar pembentukan gel sempurna kemudian disaring dengan kertas saring whatman 42 sambil dicuci dengan akuades untuk menghilangkan garam sisa. Pemilihan kertas saring whatman 42 karena kertas saring ini mempunyai ukuran pori yang lebih rapat dibandingkan kertas saring biasa, sehingga adanya endapan yang lolos pada proses penyaringan dapat diminimalisir. Selanjutnya endapan dikeringkan dalam oven pada suhu 120°C selama 6 jam. Pemanasan pada suhu 120°C mengakibatkan dehidrasi silika hidrosol sehingga terbentuk silika gel.
Gel kering atau xerogel yang diperoleh dari sintesis ini sebanyak 3,48 gram. Sedangkan berdasarkan perhitungan teori kadar silika sebesar 3,3353 gram. Persen kesalahan sebesar 4,43% ini disebabkan karena saat pencucian silika gel hasil sintesis yang kurang bersih sehingga masih adanya NaCl yang ada dalam silika hasil sintesis. Xerogel yang berwarna putih ini kemudian digerus dan diayak dengan ayakan 200 mesh untuk menghomogenkan ukurannya. Penggerusan dan pengayakan ini juga bertujuan untuk memperlebar luas permukaan silika gel sehingga penyerapan logam akan lebih optimal.
Karakterisasi dengan FTIR
Silika yang diperoleh dari abu vulkanik Gunung Sinabung dengan metode sol gel dianalisis dengan FTIR untuk mengetahui adanya gugus fungsi
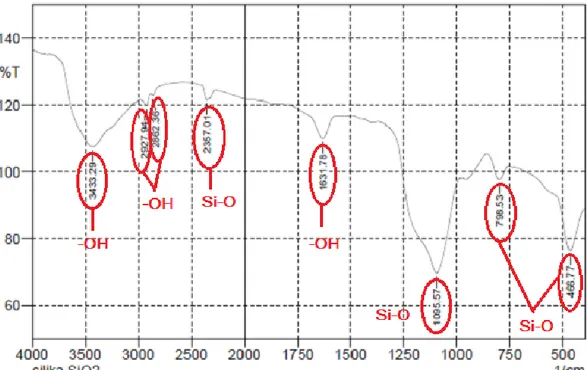
yang berkaitan dengan silika, dimana sumbu-x merupakan bilangan gelombang dan sumbu –y merupakan persentase transmitan (T). Spektrumnya dapat dilihat pada Gambar 2. Spektrum menunjukkan beberapa puncak yang menunjukkan adanya beberapa gugus fungsi dalam sampel, baik yang dimiliki oleh silika atau gugus fungsi yang berasal dari pengotor yang tidak dapat dibersihkan seluruhnya. Puncak yang diyakini berkaitan dengan gugus fungsi pada silika yaitu pada bilangan gelombang 3433,29 cm-1. Serapan dengan pita lebar pada daerah 3000-4000 cm-1 merupakan puncak yang khas untuk vibrasi ulur gugus –OH (gugus hidroksil). Dengan demikian, dalam silika yang diperoleh dari abu vulkanik Gunung Sinabung ini diyakini terdapat gugus hidroksil, yang menunjukkan ikatan Si-OH atau silanol, meskipun sumbangan gugus hidroksil dari molekul air yang terhidrasi juga tidak dapat diabaikan (Daifullah, dkk, 2003). Puncak pada daerah 400-1200 cm-1 merupakan puncak yang khas untuk vibrasi ulur asimetri Si-O-Si. Sedangkan serapan pada daerah 430-470 cm-1 menunjukkan vibrasi tekuk Si-O-Si. Serapan yang kuat dan tajam pada bilangan gelombang 1095,57 cm-1 merupakan vibrasi ulur asimetri dari gugus Si-O pada gugus siloksan (Si-O-Si). Adanya gugus fungsi Si-O-Si diperkuat dengan adanya puncak pada bilangan gelombang 466,77 cm-1 dan 2357,01 cm-1 yang merupakan vibrasi tekuk dari gugus siloksan (Si-O-Si) dan puncak pada 798,53 cm-1 yang merupakan vibrasi ulur Si-O-Si. Vibrasi tekuk gugus –OH dari molekul air ditunjukkan oleh serapan pada bilangan 1631,78 cm-1 (Silverstein, 2006). Pita serapan di 2862,36 cm-1 dan 2927,94 cm-1 menunjukkan gugus –OH silanol dan H2O yang diserap (Kalapathy, 2000).
Gambar 2. Spektrum FTIR Silika yang Diperoleh dari abu vulkanik Gunung Sinabung
Karakterisasi dengan XRD
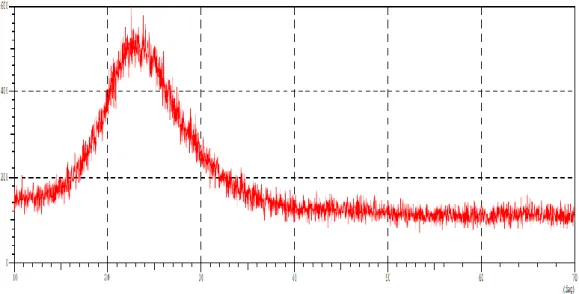
Analisis struktur kristal silika dilakukan dengan menggunakan difraksi sinar-X. Spektrum yang diperoleh disajikan pada Gambar 3. Terlihat bahwa silika gel yang disintesis dari abu vulkanik Gunung Sinabung memiliki pola difraksi dengan puncak melebar pada 2θ = 22,7200°; 2θ = 23,9400°; 2θ = 21,8800°, dengan puncak tertinggi pada 2θ = 22,7200°. Menurut Kalapathy, dkk (2000) silika dengan puncak melebar di sekitar 2θ = 20-22° menunjukkan struktur amorf (kristalinitas yang rendah).
Silika dalam bentuk amorf adalah yang paling reaktif dan cocok diaplikasikan sebagai adsorben. Selain itu silika berstruktur amorf dengan kemurnian yang tinggi, ukuran partikel yang kecil serta permukaan yang luas akan cocok digunakan sebagai adsorben (Chandrasekhar, dkk, 2003).
Gambar 3. Difaktogram silika gel
Penentuan Massa Optimum Adsorben
Tujuan penentuan massa optimum adsorben silika adalah untuk mengetahui massa silika yang paling sesuai dimana penyerapan logam Pb(II) oleh silika mencapai kondisi optimal. Variasi massa adsorben silika yang digunakan dalam penentuan ini adalah 0,25; 0,5; 0,75 dan 1,00 gram yang diinteraksikan dengan 10 mL larutan ion Pb(II) dengan konsentrasi 60 ppm dan diaduk dengan pengaduk magnet selama 30 menit. Kemudian larutan disaring dan filtrat diukur menggunakan AAS pada panjang gelombang 283,3 nm untuk mengetahui konsentrasi logam Pb(II) sisa.
Proses adsorpsi dilakukan pada suhu ruang, yaitu 27°C. Pemilihan suhu ruang ini karena proses adsorpsi pada suhu yang semakin tinggi menyebabkan ion logam berat yang terserap oleh adsorben semakin sedikit. Hal ini terjadi karena semakin tinggi suhu pada proses adsorpsi, maka pergerakan ion semakin cepat sehingga jumlah ion logam berat yang terserap oleh adsorben semakin berkurang (Kundari, dkk, 2008).
Kurva kalibrasi dibuat dengan mengukur absorbansi larutan ion Pb(II) dengan konsentrasi 0; 2; 4; dan 6 ppm. Kurva kalibrasi yang diperoleh memiliki persamaan regresi y = 0,00948x + 0,00016 dengan R2 = 1. Persamaan regresi ini digunakan untuk mengetahui konsentrasi logam Pb(II) sisa yang terdapat dalam
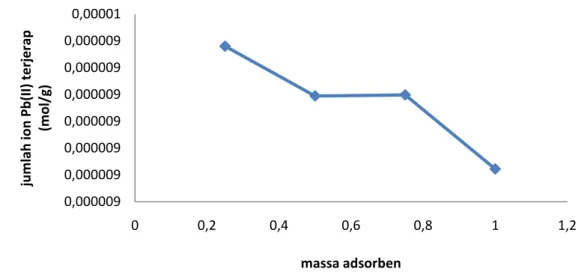
larutan setelah diinteraksikan dengan adsorben silika. Data yang diperoleh setelah melakukan optimasi massa silika pada logam Pb(II) disajikan pada gambar 4.
Gambar 4. Kurva penentuan massa optimum adsorben silika
Penyerapan ion logam Pb(II) secara maksimum terjadi pada massa silika 0,25 gram dengan jumlah ion logam Pb(II) yang terjerap sebesar 9,8801x10-6 mol/g. Semakin besar massa silika gel yang digunakan ternyata tidak sebanding dengan peningkatan jumlah ion logam Pb(II) yang terjerap. Hal ini disebabkan karena sifat silika gel ditentukan oleh orientasi dari ujung tempat gugus hidroksil berkombinasi. Oleh karena ketidak-teraturan susunan permukaan SiO4 tetrahedral,
maka jumlah distribusinya per unit area bukan menjadi ukuran kemampuan adsorpsi silika gel, meskipun gugus silanol dan siloksan terdapat pada permukaan silika gel. Kemampuan adsorpsi ternyata tidak sebanding dengan jumah gugus silanol dan gugus siloksan yang ada pada permukaan silika gel, tetapi tergantung pada distribusi gugus OH per unit area adsorben (Oscik, 1982). Penyerapan ion logam juga terjadi secara fisik dimana ion logam Pb(II) terperangkap dalam pori-pori silika sehingga banyaknya pori-pori per unit area menentukan banyaknya ion logam Pb(II) yang dapat diadsorpsi oleh silika.
Pada penelitian ini, massa optimum adsorben silika yaitu 0,25 gram dan kemampuan adsorpsi terus menurun jika massa silika ditingkatkan sehingga perlu dilakukan penelitian lanjutan tentang optimasi massa adsorben silika dengan variasi massa yang lebih sedikit dari 0,25 gram agar dapat diperoleh massa optimum adsorben silika yang lebih akurat.
0,000009 0,000009 0,000009 0,000009 0,000009 0,000009 0,000009 0,00001 0 0,2 0,4 0,6 0,8 1 1,2 ju m lah io n Pb (II) t e rjer ap (m ol/g ) massa adsorben
Penentuan Waktu Kontak Optimum
Waktu kontak merupakan waktu yang dibutuhkan adsorben untuk menyerap logam. Larutan logam Pb(II) dengan konsentrasi 60 ppm dengan volume masing-masing 10 mL diinteraksikan dengan 0,25 gram adsorben silika dan diaduk dengan pengaduk magnet selama variasi waktu kontak 20; 40; 60; 80; dan 100 menit. Kemudian larutan disaring dan filtrat diukur menggunakan AAS pada panjang gelombang 283,3 nm untuk mengetahui konsentrasi logam Pb(II) sisa.
Kurva kalibrasi dibuat dengan mengukur absorbansi larutan ion Pb(II) dengan konsentrasi 0; 2; 4; dan 6 ppm. Kurva kalibrasi yang diperoleh memiliki persamaan regresi y = 0,00948x + 0,00016 dengan R2 = 1. Persamaan regresi ini digunakan untuk mengetahui konsentrasi logam Pb(II) sisa yang terdapat dalam larutan setelah diinteraksikan dengan adsorben silika. Data yang diperoleh setelah melakukan optimasi waktu kontak disajikan pada gambar 5.
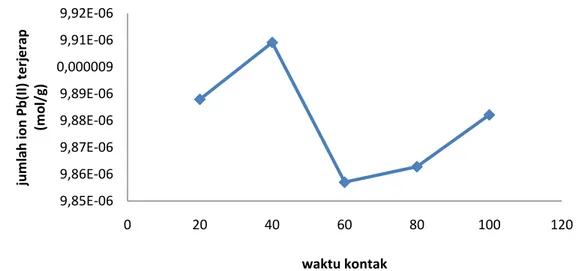
Gambar 5. Kurva penentuan waktu kontak optimum
Berdasarkan gambar, dapat dilihat bahwa waktu kontak optimum adalah 40 menit, dimana banyaknya ion logam Pb(II) yang terjerap sebanyak 9,9091x10-6 mol/g. Hal tersebut dapat dilihat dari pengurangan konsentrasi Pb(II) sebelum dan sesudah proses adsorpsi. Pada waktu kontak 40 menit jumlah ion logam Pb(II) yang terkontak dengan permukaan silika gel telah maksimal sehingga tidak
9,85E-06 9,86E-06 9,87E-06 9,88E-06 9,89E-06 0,000009 9,91E-06 9,92E-06 0 20 40 60 80 100 120 ju m lah io n Pb (II) t e rjer ap (m ol/g ) waktu kontak
diperlukan waktu yang lama untuk mengontakkan logam Pb(II) pada permukaan silika gel.
Pada waktu kontak 60 menit, ion logam Pb(II) yang terjerap sebanyak 9,8570x10-6 mol/g. Pada waktu kontak ini adalah adsorpsi logam Pb(II) yang paling kecil, kemudian meningkat kembali pada waktu kontak 80 dan 100 menit dengan ion logam Pb(II) yang terjerap masing-masing 9,8628x10-6 mol/g dan 9,8821x10-6 mol/g. Hal ini disebabkan karena penyerapan ion logam terjadi secara fisik dimana ion logam Pb(II) terperangkap dalam pori-pori silika sehingga pada saat waktu kontak optimum 40 menit adsorben sudah jenuh dan peningkatan waktu kontak menyebabkan adsorbat terlepas kembali dari pori dan kembali ke arus fluida.
Menurut Wijayanti (2009) bila permukaan sudah jenuh atau mendekati jenuh terhadap adsorbat, dapat terjadi dua hal yaitu terbentuk lapisan adsorpsi kedua dan seterusnya di atas adsorbat yang telah terikat di permukaan, gejala ini disebut adsorpsi multilayer, atau tidak terbentuk lapisan kedua dan seterusnya sehingga adsorbat yang belum teradsorpsi berdifusi keluar pori dan kembali ke arus fluida.
Nuryono et al. (2003) membedakan kinetika adsorpsi ion logam pada adsorben menjadi tiga jenis. Jenis yang pertama, adsorpsi berlangsung dalam satu tahap cepat kemudian mencapai kesetimbangan. Pada adsorpsi jenis ini, laju desorpsi relatif lambat dan dapat diabaikan. Jenis kedua, adsorpsi berlangsung lambat kemudian mencapai kesetimbangan. Pada adsorpsi ini laju desorpsi relatif cepat dan tidak dapat diabaikan. Dengan kata lain, adsorpsi berlangsung secara reversibel. Jenis ketiga, adsorpsi berlangsung dalam dua tahap, tahap cepat dan lambat, kemudian mencapai kesetimbangan. Dari gambar 5 terlihat bahwa adsorpsi Pb(II) oleh silika gel termasuk jenis kedua, dimana adsorpsi berlangsung secara reversibel.
Pada waktu kontak 60-100 menit terjadi peningkatan adsorpsi kembali sehingga perlu dilakukan penelitian lanjutan tentang optimasi waktu kontak pada adsorpsi logam Pb(II) oleh adsorben silika dengan variasi waktu kontak yang lebih lama.
Penentuan pH Optimum
Tujuan penentuan pH optimum adalah untuk mengetahui harga pH yang paling sesuai dimana penyerapan logam Pb(II) oleh silika mencapai kondisi optimal. Variasi pH yang digunakan dalam penentuan ini adalah pH 3; 4; 5; 6 dan 7. Larutan logam Pb(II) dengan konsentrasi 60 ppm dengan volume masing-masing 10 mL diinteraksikan dengan 0,25 gram adsorben silika dan diaduk dengan pengaduk magnet selama 40 menit. Kemudian larutan disaring dan filtrat diukur menggunakan AAS pada panjang gelombang 283,3 nm untuk mengetahui konsentrasi logam Pb(II) sisa.
Kurva kalibrasi dibuat dengan mengukur absorbansi larutan ion Pb(II) dengan konsentrasi 0; 2; 4; dan 6 ppm. Kurva kalibrasi yang diperoleh memiliki persamaan regresi y = 0,00948x + 0,00016 dengan R2 = 1. Persamaan regresi ini digunakan untuk mengetahui konsentrasi logam Pb(II) sisa yang terdapat dalam larutan setelah diinteraksikan dengan adsorben silika. Data yang diperoleh setelah melakukan optimasi massa silika pada logam Pb(II) disajikan pada gambar 6.
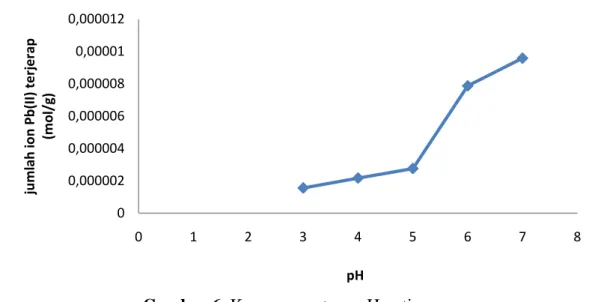
Gambar 6. Kurva penentuan pH optimum
Kemampuan penyerapan suatu adsorben dapat dipengaruhi oleh pH larutan. Hal ini berhubungan dengan protonasi atau deprotonasi permukaan sisi aktif dari adsorben (Nurhasni, 2002). Menurut Riapanitra (2006), pH akan mempengaruhi muatan permukaan adsorben, derajat ionisasi dan spesi apa saja
0 0,000002 0,000004 0,000006 0,000008 0,00001 0,000012 0 1 2 3 4 5 6 7 8 ju m lah io n Pb (II) t e rjer ap (m ol/g ) pH
yang dapat terserap dalam adsorpsi tersebut. Nilai pH juga dapat mempengaruhi kesetimbangan kimia, baik pada adsorbat maupun adsorben. Dalam variasi pH ini kemungkinan ikatan kimia antara adsorben dengan adsorbat dapat terjadi (Refilda, 2001).
Berdasarkan gambar 4.6, dapat dilihat bahwa pH optimum adalah pH 7, dimana banyaknya ion logam Pb(II) yang terjerap sebanyak 9,5845x10-6 mol/g. Pada pH 3-5 penyerapan ion logam Pb(II) rendah. Hal ini dikarenakan pada pH rendah permukaan adsorben dikelilingi oleh ion H+ (karena gugus fungsi yang terdapat pada adsorben terprotonasi) sehingga terjadi persaingan antara ion logam Pb(II) dengan ion H+ dalam berikatan dengan gugus aktif yang ada pada silika. Dalam kondisi asam permukaan adsorben juga bermuatan positif, yang akan menyebabkan terjadi tolakan antara permukaan adsorben dengan ion logam, sehingga adsorpsinya pun menjadi rendah (Sembiring, 2009).
Peningkatan penyerapan yang besar terjadi pada pH 6, hal ini disebabkan karena jumlah ion H+ mulai berkurang sehingga persaingan dengan H+ mulai berkurang sehingga jumlah logam teradsorpsi makin besar. Pada pH 7 masih terjadi peningkatan penyerapan meskipun tidak besar, hal ini dikarenakan logam Pb(II) memiliki harga Ksp sebesar 2,8 x 10-16 yang akan mengendap menjadi Pb(OH)2 pada pH 8-13 (Vogel, 1995).
Penentuan Konsentrasi Optimum
Tujuan penentuan konsentrasi optimum adalah untuk mengetahui kemampuan optimal silika dalam menyerap ion logam Pb(II). Variasi konsentrasi larutan Pb(II) yang digunakan dalam penentuan ini adalah 70; 90; 110; dan 130 ppm dengan volume masing-masing 10 mL yang diinteraksikan dengan 0,25 gram adsorben silika dan diaduk dengan pengaduk magnet selama 40 menit. Kemudian larutan disaring dan filtrat diukur menggunakan AAS pada panjang gelombang 283,3 nm untuk mengetahui konsentrasi logam Pb(II) sisa.
Volume larutan ion logam yang digunakan dalam penelitian ini sebanyak 10 mL. Pemilihan volume ini berdasarkan pada asumsi Refilda et al., (2001), yaitu
jika digunakan jumlah ion logam yang lebih banyak akan meyebabkan permukaan adsorben menjadi lebih cepat jenuh.
Kurva kalibrasi dibuat dengan mengukur absorbansi larutan ion Pb(II) dengan konsentrasi 0; 2; 4; dan 6 ppm. Kurva kalibrasi yang diperoleh memiliki persamaan regresi y = 0,00948x + 0,00016 dengan R2 = 1. Persamaan regresi ini digunakan untuk mengetahui konsentrasi logam Pb(II) sisa yang terdapat dalam larutan setelah diinteraksikan dengan adsorben silika. Data yang diperoleh setelah melakukan optimasi konsentrasi larutan Pb(II) disajikan pada gambar 7.
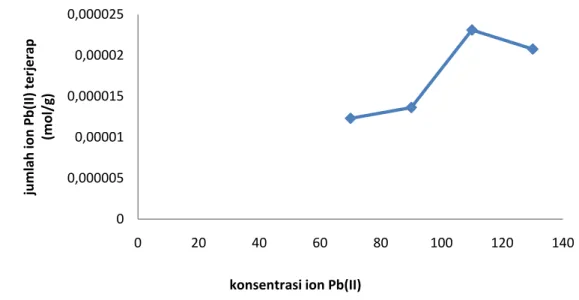
Gambar 7. Kurva penentuan konsentrasi optimum
Pada gambar 7 terlihat bahwa adsorpsi mengalami peningkatan pada konsentrasi awal larutan 70-110 ppm dan mengalami penurunan mulai konsentrasi 110-130 ppm sehingga konsentrasi optimum adsorpsi logam Pb(II) terjadi pada konsentrasi larutan 110 ppm dimana banyaknya ion logam Pb(II) yang terjerap sebanyak 2,3103x10-5 mol/g. Pada saat konsentrasi larutan dibawah 110 ppm, jumlah ion logam Pb(II) yang ada dalam larutan lebih sedikit bila dibandingkan jumlah gugus pengikat pada silika sehingga adsorpsi masih mengalami peningkatan. Sedangkan pada konsentrasi larutan di atas 110 ppm, jumlah ion logam Pb(II) yang ada dalam larutan lebih banyak dibandingkan dengan jumlah gugus pengikat pada silika sehingga silika sudah mengalami kejenuhan dalam menyerap logam Pb(II) dan mengakibatkan adsorpsi berhenti. Menurut Lestari dan Sanova (2011) pada kondisi kesetimbangan, permukaan adsorben telah jenuh
0 0,000005 0,00001 0,000015 0,00002 0,000025 0 20 40 60 80 100 120 140 ju m lah io n Pb (II) t e rjer ap (m ol/g )
oleh ion-ion logam sehingga penambahan konsentrasi tidak akan berpengaruh pada proses adsorpsi.
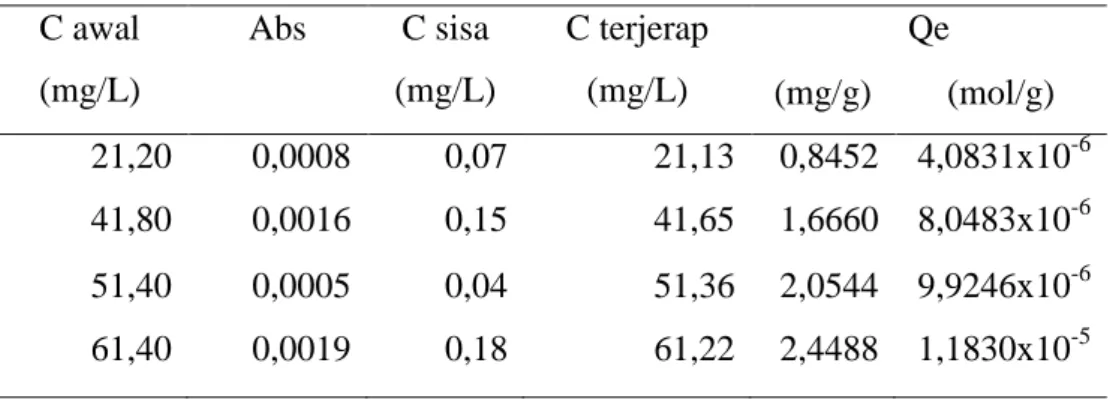
Pemilihan konsentrasi larutan Pb(II) yang digunakan ini berdasarkan percobaan awal yang dilakukan dimana konsentrasi yang digunakan 20, 40, 50, 60 ppm. Pada percobaan ini belum diperoleh konsentrasi optimum larutan Pb(II) yang diadsorpsi oleh adsorben silika seperti terlihat pada tabel 1. Sehingga untuk memperoleh konsentrasi optimum maka variasi konsentrasi Pb(II) ditingkatkan menjadi 70; 90; 110; dan 130 ppm.
Tabel 1. Penentuan konsentrasi optimum larutan Pb(II) C awal (mg/L) Abs C sisa (mg/L) C terjerap (mg/L) Qe (mg/g) (mol/g) 21,20 0,0008 0,07 21,13 0,8452 4,0831x10-6 41,80 0,0016 0,15 41,65 1,6660 8,0483x10-6 51,40 0,0005 0,04 51,36 2,0544 9,9246x10-6 61,40 0,0019 0,18 61,22 2,4488 1,1830x10-5 PENUTUP Kesimpulan
Berdasarkan hasil penelitian ini maka dapat disimpulkan bahwa:
1. Kadar silika hasil sinesis dari abu vulkanik Gunung Sinabung yang diambil dari Desa Berastepu, Karo (radius 1,5 km) yang dianalisis dengan AAS sebesar 17,85%.
2. Hasil karakterisasi menggunakan FTIR menunjukkan bahwa pada silika gel hasil sintesis dari abu vulkanik Gunung Sinabung terdapat gugus fungsi –OH dari Si-OH dan Si-O dari Si-O-Si. Hasil karakterisasi menggunakan XRD diketahui bahwa silika gel hasil sintesis memiliki struktur amorf.
3. Massa optimum adsorben silika untuk penyerapan ion logam Pb(II) yaitu 0,25 gram dengan jumlah ion logam Pb(II) yang terjerap sebesar 9,8801x10-6 mol/g. Waktu kontak optimum adsorpsi ion logam Pb(II) oleh silika hasil sintesis yaitu 40 menit dengan jumlah ion logam Pb(II)
yang terjerap sebanyak 9,9091x10-6 mol/g. pH optimum adsorpsi ion logam Pb(II) oleh silika yaitu pada pH 7 dengan jumlah ion logam Pb(II) yang terjerap sebanyak 9,5845x10-6 mol/g. Dan konsentrasi optimum adsorpsi ion logam Pb(II) oleh silika yaitu pada konsentrasi 110 ppm dengan jumlah ion logam Pb(II) yang terjerap sebanyak 2,3103x10-5 mol/g.
Saran
1. Perlu dilakukan penelitian lebih lanjut mengenai kemampuan silika gel dari abu vulkanik Gunung Sinabung untuk penyerapan logam lain.
2. Perlu dilakukan penelitian lebih lanjut mengenai karakterisasi silika gel untuk mengetahui luas pori dan bentuk permukaan silika.
3. Perlu dilakukan penelitian lebih lanjut tentang optimasi massa adsorben silika dan waktu kontak adsorpsi dengan variasi yang berbeda.
DAFTAR PUSTAKA
Alexander, (2010), Waspada Gunung Sinabung, http://www.medanmagazine.com Atkins, P., W., (1999), Kimia Fisika 2, Penerbit Erlangga, Jakarta
Ayu, Annisa M., Wardhani S., Darjito, (2013), Studi Pengaruh Konsentrasi NaOH dan pH terhadap Sintesis Silika Xerogel Berbahan Dasar Pasir Kuarsa,
Kimia Student Journal 2(2): 517-523
Blais, J. F., Dufresne, B., Mercier, G., (2000), State of The Art of Technologies for Metal Removal from Industrial Effluents, Rev. Sci. Eau 12(4): 687-711 Candrasekhar, S., Satyanarayana, K. G., Pramada, P. N., dan Raghavan, P.,
(2003), Review Processing, Properties and Applications of Reactive Silica from Rice Husk An Overview, Journal of Materials Science 38: 3159-3168 Daifullah, A. A. M., Girgis B. S., Gad, H. M. H., (2003), Utilization of
Agro-Residues (Rice Husk) in Small Waste Water Treatment Plans, Material
Letters 57: 1723-1731
Kalapathy, U., Proctor, A., dan Shultz, J., (2000), A Simple Method for Production of Pure Silica From Rice Hull Ash, Bioresource Technology 73: 257-262
Kundari, N. A., Slamet, Wiyuniati, (2008), Tinjauan Kesetimbangan Adsorpsi Tembaga dalam Limbah Pencuci PCB dengan Zeolit, Seminar Nasional IV
SDM Teknologi Nuklir
Lestari, I., dan Sanova, A., (2011), Penyerapan Logam Berat Kadmium (Cd) Menggunakan Kitosan Hasil Transformasi Kitin dari Kulit Udang (Penaeus sp), ISSN 0852-8349 13(1): 9-14
Mori, H., (2003), Extraction of Silicon Dioxide from Waste Colored Glasses by Alkali Fusion Using Sodium Hydroxide, Journal of the Ceramic Society of
Japan 111(6): 376-381
Nakada, S., dan Yoshimoto, M.,. (2014), Eruptive Activity of Sinabung Volcano in 2013 and 2014, Earthquake Research Institute, The University of Tokyo Oscik, J., (1982), Adsorption, John Wiley and Sons, New York
Nurhasni, (2002), Penggunaan Genjer (Limnocharis Flava) Untuk Menyerap Ion
Kadmium, Kromium, dan Tembaga Dalam Air Limbah, Tesis, Universitas
Andalas, Padang
Nuryono, Susanti V. V. H., Narsito, (2003), Kinetic Study on Adsorption of Chromium (III) to Diatomaceous Earth Pre-Treated with Sulfuric and Hydrochloric Acids, Indo J. Chem 3: 32-38
Rapierna, A., (2012), Sintesis dan Pemanfaatan Membran Kitosan-Silika Sebagai
Membran Pemisah Ion Logam Zn2+ dan Fe2+, Tugas Akhir II, FMIPA, UNNES, Semarang
Refilda, Zein, R., Rahmayeni, (2001), Pemanfaatan Ampas Tebu Sebagai Bahan
Alternatif Pengganti Penyerap Sintetik Logam-logam Berat Pada Air Limbah, Skripsi, Universitas Andalas, Padang
Riapanitra, A., Setyaningtyas, T., Riyani, K., (2006), Penentuan Waktu Kontak dan pH Optimum Penyerapan Metilen Biru Menggunakan Abu Sekam Padi,
J. Molekul 1(1): 41-44
Sembiring, Z., Buhani, Suharso, Surnadi, (2009), Isoterm Adsorpsi Ion Pb(II), Cu(II), dan Cd(II) pada Biomassa Nannochloropsis, sp yang Dienkapsulasi Akuagel Silika, Indo J. Chem 9(1): 1-5
Sukarman dan Dariah, A., (2014), Tanah Andosol di Indonesia. Karakteristik,
Potensi, Kendala, dan Pengelolaannya untuk Pertanian, Balai Besar
Penelitian dan Pengembangan Sumberdaya Lahan Pertanian, Bogor
Sunu, P., (2001), Melindungi Lingkungan dengan Menerapkan ISO 14001, Penerbit PT. Grasindo, Jakarta
Trivana, L., Sugiarti, S., Rohaeti, E., (2015), Sintesis dan Karakterisasi Natrium Silikat (Na2SiO3) dari Sekam Padi, Jurnal Sains dan Teknologi Lingkungan
7(2): 66-75
Wijayanti, Ria., (2009), Arang Aktif dari Ampas Tebu Sebagai Adsorben pada