Jurnal Agrista Vol. 23 No. 2, 2019 100
RESPON DIFERENSIAL FISIOLOGIS TANAMAN TEBU (
Saccharum officinarum
) PADA
KONDISI CEKAMAN KEKURANGAN AIR
Physiological Differential Response of Sugarcane on Under Stress Conditions Lacking
Water
Jamsari
1), Rhenly Danis
1), Ishak Manti
2), Renfiyeni
3) 1)Prodi Agriekoteknologi, Fakultas Pertanian Universitas Andalas Padang. 2)
Balai Pengkajian dan Penerapan Teknologi Sumatera Barat. 3)
Fakultas Pertanian, Universitas Mahaputra Muhammad Yamin, Solok Sumatera Barat.
ABSTRAK
Tebu adalah pabrik penghasil gula utama di dunia dan juga memainkan peran penting sebagai bahan baku untuk produksi bioetanol. Peningkatan produktivitas tanaman terkena tekanan lingkungan yaitu: kekurangan air yang saat ini merupakan masalah serius yang terkait dengan fenomena perubahan iklim global. Memahami respons tanaman terhadap tekanan lingkungan adalah salah satu kunci untuk dapat menyelesaikan masalah tersebut. Dalam hal ini, studi mendasar terkait dengan respons tanaman tebu terhadap tekanan air sangat penting. Penelitian ini terdiri dari kombinasi dua faktor, yaitu jenis klon yang terdiri dari PS.864, PSJT.941, dan VMC.76-16, 851 sebagai klon kelompok toleran, PS.862, PS.882 dan PS.851 sebagai non. kelompok klon toleran dan kurangnya penanganan tekanan air selama 5 hari. Data dianalisis lebih lanjut menggunakan DNMRT pada tingkat signifikansi 5%. Pengamatan menunjukkan bahwa klon toleran serta klon non-toleran PS.862 menunjukkan respons resistensi yang lebih baik daripada kelompok yang tidak toleran. Indikasinya ditunjukkan oleh nilai Relative Water Content (RWC), area daun spesifik (SLA) dan Nilai Defisit Air (WDV). Total protein profil tebu yang tumbuh di bawah defisit air dan mitranya dibedakan secara berbeda oleh penekanan ekspresi protein sekitar 35 kDa di semua klon. Sementara dalam kondisi defisit air ekspresi protein dengan ukuran 25 kDa sangat luar biasa diekspresikan.
Kata kunci: Saccharum officinarum, respon differensial, stress kekeringan, respon fisiologis
Abstract
Sugarcane is the main sugar-producing plant in the world and also plays an important role as a raw material for bioethanol production. Productivity improvement of the plant is exposed to environmental stress ie: water shortage which is currently a serious problem associated with the global climate change phenomenon. Understanding of plant responses to environmental stress is one of the keys to be able to resolve the issue. In this regard, the fundamental studies related to the sugarcane plant responses to water stress is very important. This study consists of a combination of two factors, namely the type of clones consisting of PS.864, PSJT.941, and VMC.76-16, 851 as tolerant group clones, PS.862, PS.882 and PS.851as non tolerant clones group and lack of water stress treatment for 5 days. The data were analyzed further using DNMRT at 5% significance level. Observations showed that tolerant clones as well as non-tolerant clones PS.862 showed better resistance response than non non-tolerant groups. The indication was shown by the value of the Relative Water Content (RWC), Specific leaf area (SLA) and Water Deficit Value (WDV). Total protein profiling of sugarcane grown under water deficit and its counterpart differentially distinguished by suppression of protein expression of about 35 kDa in all clones. While in the water deficit condition expression of a protein with a size of 25 kDa is remarkable expressed.
Keyword: Saccharum officinarum, differential response, drought stress, physiological response
PENDAHULUAN
Tanaman tebu (Saccharum officinarum L.) merupakan sumber utama bahan baku
gula di dunia yang ditanam dari mulai daerah tropik sampai sub tropik (Waclawovsky, et al., 2010) termasuk Indonesia. Disamping itu tanaman tebu saat
Jurnal Agrista Vol. 23 No. 2, 2019 101 ini menjadi pilihan utama sebagai sumber
bahan baku bioenergi (bioethanol) sebagaimana dilakukan oleh Brazil (da Graça, et al., 2010), Amerika Serikat (FAOSTAT, 2008), India (Suprasanna, 2010) dan Thailand (Ngamhui, et al., 2012). Di Indonesia sendiri, luas areal pertanaman tebu sampai tahun 2011 mencapai 473,923 hektar dengan total produksi mencapai 3,159,836 ton (Dirjen Perkebunan, 2011).
Secara nasional produktivitas tebu sampai saat ini masih sangat rendah. Meskipun berbagai klon unggul tebu telah banyak yang berhasil dikembangkan, akan tetapi capaian rendemen yang diperoleh masih di bawah potensi yang semestinya. Kondisi tersebut, menjadi salah satu kendala terhadap upaya pencapaian Program Swasembada Gula Nasional Tahun 2014 yang merupakan salah satu Program Nasional dari Kementrian Pertanian. Salah satu faktor yang dianggap memiliki peran penting dalam hal ini adalah perubahan kondisi agroklimat dan anomali cuaca sebagai salah satu cekaman abiotik yang berkembang akhir-akhir ini dalam skala global (Bray, et al., 2000), sehingga mengakibatkan terjadinya “leveling off” produktifitas tanaman tebu.
Diantara berbagai persoalan agroklimat yang memiliki pengaruh sangat besar terhadap produktifitas tanaman tebu adalah ketersediaan air (Sugiharto, et al. 2002; Prabu, et al. 2011). Meskipun tanaman tebu termasuk golongan tanaman C4 yang diketahui memiliki sistem fotosintesis yang tergolong efisien (Lopes, et al., 2011), namun laju fotosintesis pada tanaman tebu tetap mengalami penurunan dengan adanya cekaman kekeringan (Carmo-Silva, et al., 2008). Gardner, et al., (1984) mengemukakan bahwa sejumlah proses fisiologis yang akan terganggu antara lain adalah konduktansi stomata, laju transpirasi, temperatur daun, transportasi elektron fotokimiawi, fotosintesis, respirasi dan partisi asimilat. Beberapa peneliti lain, seperti Ramesh and Mahadevaswamy, (2000); Robertson, et al., (1999); Da Silva and Da Costa, (2004); Singh
and Reddy, (1980) dan Soares, et al., (2004) menyatakan, bahwa beberapa karakter agronomis penting yang akan teramati pada pertumbuhan tanaman tebu bila menghadapi cekaman kekeringan air antara lain adalah penurunan diameter ruas (Da Silva and Da Costa, 2004), tinggi batang (Inman-Bamber and Smith, 2005; Ramesh and Mahadevaswamy, 2000; Da Silva and Da Costa, 2004; Singh and Reddy, 1980; Soares, et al., 2004). Ditekankan oleh Domaingue (1995) dan Soares, et al., (2004), bahwa tinggi batang merupakan parameter yang paling akan terpengaruh jika tanaman tebu berada dalam kondisi kekurangan air. Dengan dasar tersebut maka biasanya upaya pencarian genotipe toleran terhadap kekurangan air sering dilandasi atas dasar karakter ketahanan tinggi batang.
Meskipun penelitian tentang respon tanaman tebu terhadap cekaman air telah banyak dilakukan, akan tetapi studi tentang aspek fisiologis dan morfologis yang terkait dengan perbaikan hasil, dan kandungan sukrosa sampai saat ini masih sedikit difahami (Edmeades et al., 2004; Inman-Bamber et al., 2005; Zhao, et al., 2010). Padahal pemahaman yang komprehensif terhadap aspek-aspek tersebut sangat penting dalam pengembangan program seleksi dan sekaligus dam rangka perbaikan ketahanan tanaman tebu terhadap cekaman kekurangan air. Dalam kaitan tersebut, maka penelitian dilaksanakan.
Dalam manuskrip ini dideskripsikan hasil-hasil awal studi terkait respon diferensial morfologis dan fisiologis 3 klon toleran dan 3 klon non toleran.
METODE PENELITIAN
Bahan Tanaman dan Waktu PenelitianBahan tanaman yang digunakan dalam studi ini adalah 6 klon tanaman tebu yang diperoleh dari Pusat Penelitian dan Pengembangan Gula Indonesia (P3GI) Pasuruan. Klon-klon terdiri dari tiga klon tanaman toleran yakni PS.864, PSJT.941, dan VMC.76-16 dan tiga klon tanaman yang
Jurnal Agrista Vol. 23 No. 2, 2019 102 tidak toleran yang terdiri dari PS.862,
PS.882 dan PS.851. Penelitian dilaksanakan di Rumah Kaca Fakultas Pertanian Universitas Andalas Padang, sejak Mei sampai Oktober 2014.
Metodologi Penelitian dan Analisis Statistika
Dua faktor percobaan yang digunakan dalam penelitian ini adalah: A- faktor cekaman kekurangan air. Faktor ini terdiri dari 2 taraf yaitu: A1, Pemberian air pada kapasitas lapang dan A2, tanpa pemberian air selama 5 hari, . Sedangkan faktor kedua adalah jenis klon yang terdiri dari 6 taraf (6 klon), yakni: PS.864, PSJT.941, VMC.76-16 dan PS.862, PS.882 serta PS.851. Tiga klon pertama dideskripsikan sebagai klon toleran sedangkan tiga klon terakhir adalah klon peka terhadap kekeringan menurut klaim P3GI. Kedua faktor yang digunakan dikombinasikan dan dianggap sebagai kombinasi perlakuan. Dengan demikian terdapat 12 kombinasi perlakuan. Masing-masing satuan percobaan diulang sebanyak 5 kali. Dengan demikian digunakan 60 satuan percobaan. Data hasil pengamatan dianalisis secara statistik dengan menggunakan uji F. Jika nilai F perlakuan lebih besar dari F tabel 5%, maka dilanjutkan dengan uji Duncan’s New Multiple Range Test (DMNRT) pada taraf 5%.
Penanaman dan Pemeliharaan Tanaman Bibit yang digunakan disemaikan terlebih dahulu. Jumlah bibit dari masing-masing klon sebanyak 25 buah. Sebelum disemaikan bibit direndam selama satu jam dengan larutan pupuk ZA dengan konsentrasi 25 gr/liter. Persemaian dilakukan pada wadah datar berisi media campuran tanah dan pasir dengan komposisi 1:1 selama satu minggu. Bibit dengan ketinggian sekitar 20 cm dipilih untuk dipindahkan ke tempat penanaman. Bibit yang ditanam berjumlah 60 bibit terdiri dari 10 bibit per masing-masing klon. Bibit kemudian ditanam di dalam ember yang telah diisi media tanam pasir, tanah dan pupuk kandang dengan perbandingan masing-masing 1:2:1. Tanaman dipelihara
sesuai rekomendasi dengan melakukan penyiraman, penyiangan gulma dan anakan saat awal penanaman sampai sebelum pemberian perlakuan. Pada umur 3 bulan dilakukan pemupukkan dengan dosis 33 gram/tanaman pupuk NPK ke dalam pot melingkari tanaman tebu.
Perlakuan Cekaman
Perlakuan cekaman terhadap seluruh satuan percobaan diberikan setelah tanaman berumur 3 bulan. Perlakuan diberikan dengan dua taraf yaitu taraf A1 (penyiraman dengan kapasitas lapang) dan taraf A2 (tanpa penyiraman selama 5 hari). Akibat pemberian perlakuan dapat diamati berupa kelayuan daun bagian atas tanaman dan menggulung (Widyasari et al., 2004). Pengamatan Parameter Pendukung
Dua parameter fisiologis yakni kadar air relatif (KAR) dan luas daun spesifik (LDS) diamati menggunakan sampel daun dari 3 daun terbawah. Sampel diambil pada hari ke 3 dan 5 setelah perlakuan cekaman. Pengukuran kadar air relatif (KAR) dilakukan dengan menimbang potongan daun segar dengan ukuran 1 cm × 1 cm sebanyak 10 potong sebagai bobot segar (BS), kemudian dijenuhkan dengan aquadest selama 24 jam untuk mendapatkan bobot turgid (BT) lalu dikeringkan dengan oven selama 2 × 24 jam pada suhu 70ºC sebagai bobot kering (BK). Nilai kadar air relatif dihitung dengan rumus :
Pengukuran luas daun spesifik (LDS) dihitung dengan mengukur luas potongan daun (LPD) yaitu 1 cm x 1 cm dikalikan dengan jumlah potongan daun (JPD) sebanyak 10 potong dan dibagi dengan bobot kering (BK) dengan rumus :
Hasil yang didapatkan dicatat dengan satuan m²/gr. Sedangkan pengukuran defisit air (DA) dilakukan dengan menggunakan data berat turgid, berat segar dan berat kering, dan dihitung dengan rumus :
Jurnal Agrista Vol. 23 No. 2, 2019 103
Isolasi Protein Tanaman Tebu
Isolasi protein dilakukan dengan modifikasi metode TCA (Almaraj et al., 2010). Sampel daun tanaman tebu diambil dari 3 daun teratas. Daun ditimbang sebanyak 500 mg, lalu diiris, kemudian dimasukkan ke dalam mortar dan dicampur dengan nitrogen cair untuk dihaluskan. Hasil gerusan dipindahkan ke dalam tabung falcon dan ditambahkan 2 ml asam trikloroasetat (TCA) lalu didiamkan selama satu jam pada suhu -20ºC. Selanjutnya sampel disentrifugasi selama 20 menit pada suhu -4ºC dengan kecepatan 12.000 g. Setelah disentrifugasi, supernatan dibuang. Pelet ditambah dengan 2 ml aceton dingin yang tercampur dengan 0,014 gram DTT. Kemudian campuran tersebut disentrifugasi selama 20 menit dengan kecepatan 12.000 g pada suhu -4ºC. Setelah disentrifugasi supernatan dibuang. Proses pencucian dengan aceton dan DTT diulang sebanyak 3 kali sampai pelet berwarna putih. Selanjutnya pelet dikeringkan lalu disimpan pada suhu -80ºC sampai digunakan pada tahap selanjutnya.
Sebelum dianalisis, pelet terlebih dahulu dilarutkan pada pelarut protein. Sebanyak 100 mg pelet protein kering ditimbang dan dimasukkan ke dalam tabung eppendorf 2 ml. Selanjutnya ditambahkan 1 ml pelarut protein buffer saline (PBS) dan diinkubasi selama 1 jam pada suhu 37oC. Setiap 10 menit sekali sampel dihomogenkan dengan menggunakan vortex. Kemudian sampel disentrifugasi selama 20 menit dengan kecepatan 12.000 g pada suhu -4ºC. Lalu supernatan dipindahkan kedalam eppendorf 1,5 ml dan siap untuk dianalisis. Visualisasi Profil Protein dengan
SDS-PAGE
Visualisasi protein dilakukan menggunakan stacking gel yang terdiri dari Buffer B, 2,5 ml; Acrylamid 30%, Aquabidest, 10% APS, dan2,5 µl TEMED. Gel untuk pemisahan (Separating gel) terdiri dari: Buffer A, Acrylamid 30%; Aquabidest , 10% APS, dan 5 µl TEMED. Campuran
bahan dimasukkan ke dalam cetakan dan dibiarkan hingga mengeras. Selanjutnya gel diletakkan ke dalam bak elektroforesis. Sebanyak 100 ml SDS running buffer dimasukkan ke dalam bak elektroforesis. Kemudian, 20 µl sampel protein dimasukkan ke dalam eppendorf 1,5 ml, dan ditambah dengan SDS 5µl dan lalu dipanaskan selama 5 menit pada suhu 95oC. Sampel kemudian dimasukkan ke dalam sumur gel. Selanjutnya SDS-PAGE dijalankan dengan pengaturan kuat arus sebesar 100 Ampere selama 30 menit. Gel selanjutnya diletakkkan di dalam kotak plastik, diisi aquadest dan dipanaskan dalam oven dengan suhu medium high selama 1 menit. Aquadest dibuang dan kotak diisi kembali dengan aquadest dan shaker pada kecepatan 75 rpm selama 15 menit. Proses tersebut diulang sebanyak 2 kali untuk menghilangkan sisa buffer SDS. Selanjutnya aquadest dibuang dan gel direndam dengan larutan pewarna coommassie dan shaker dengan kecepatan 75 rpm selama semalam. Setelah diinkubasi semalam, larutan coommassie dibuang dan gel dicuci kembali dengan aquadest sebanyak 3 kali. Gel kemudian didokumentasi dengan menggunakan scanner.
HASIL DAN PEMBAHASAN
Kadar Air Relatif (KAR)Pengujian kadar air relatif dilakukan untuk mengetahui persentase kadar air relatif pada daun keenam klon yang diuji selama cekaman yakni pada hari ke-3 dan ke-5 setelah perlakuan diberikan. Data hasil pengamatan disajikan pada Tabel 1.
Cekaman kekeringan selama 5 hari yang diaplikasikan memberikan pengaruh yang berbeda nyata. Pengukuran KAR pada hari ke-3 menunjukkan bahwa klon PS.882 (non toleran) mengalami penurunan KAR sampai 74,21%. Nilai tersebut berbeda nyata dengan kelima klon lainnya yang rata-rata masih memiliki nilai KAR diatas 80%, termasuk kedua klon non toleran lainnya yakni PS.862 dan Klon PS 851. Bahkan Klon PS.862 yang diklaim sebagai klon non
Jurnal Agrista Vol. 23 No. 2, 2019 104 toleran pada hari ketiga setelah perlakuan
cekaman masih memiliki nilai kadar air yang paling tinggi yakni sebesar 88,90%. Nilai KAR Klon PS.882 pada pengamatan hari ke 5 bahkan hanya mencapai 69,21%. Angka tersebut berbeda nyata dibandingkan
dengan kelima klon lainnya. Klon PS.862 ternyata juga masih memperlihatkan angka KAR yang paling tinggi dibandingkan kelima klon lainnya meskipun diklaim sebagai klon non toleran terhadap cekaman kekeringan.
Tabel 1. Kadar air relatif 6 klon tanaman tebu setelah diberi perlakuan cekaman kekeringan pada hari ke 3 dan ke 5.
Klon Kadar air relatif (%)
Hari ke-3 Hari Ke-5
PS.864 (T) PSJT.941 (T) VMC.76-16 (T) PS.862 (NT) PS.882 (NT) PS.851 (NT) 84,81 a 86,47 a 81,94 a 88,90 a 74,21 c 81,17 b 78,82 a 80,27 a 75,65 a 81,93 a 69,21 c 74,43 b KK = 5,14% KK = 6,42%
Keterangan : Angka-angka yang diikuti oleh huruf yang sama pada kolom yang sama berbeda tidak nyata menurut uji Duncan 5%.
Penurunan kadar air relatif mulai terjadi sejak hari ke-3 dan semakin menurun pada hari ke-5 sejak pemberian perlakuan cekaman pada semua klon yang diperlakukan. Penurunan kadar air terendah terjadi pada klon PS 862 sebesar 18,07% sedangkan penurunan kadar air tertinggi terjadi pada PS.882 yang mencapai 31,79%. Klon-klon lainnya PSJT.941, PS.864, dan VMC.76-16 mengalami penurunan kadar air masing-masing sebesar 20,73%, 21,18 % dan 24,35%.
Klon yang digunakan pada penelitian ini terdiri dari klon toleran (PS 864, PSJT 941, dan VMC 76-16) dan klon tidak toleran (PS 862, PS 882 dan PS 851). Hal yang menarik terjadi pada klon PS 862 yang diklaim sebagai klon tidak toleran tetapi masih memiliki KAR yang paling tinggi pada hari ke 3 dan ke 5 setelah pemberian cekaman kekeringan. Data yang disampaikan oleh Khozin, (2013) mengindikasikan bahwa klon PS 862 memang rentan terhadap cekaman abiotik, tetapi kerentanannya lebih cenderung terhadap cekaman genangan sehingga pada cekaman kekeringan klon tersebut dapat lebih tahan. Klon PS 864 dan PSJT 941 memiliki nilai ketahanan terhadap cekaman yang lebih baik pada jenis tanah Ultisol, Vertisol, dan Inceptisol.
Kemampuan klon PS 864 juga teramati sama baiknya dalam pertumbuhan kalus dibandingkan klon PS 862 pada kondisi cekaman (Fiah, et al., 2014). Klon PS 851 tidak memiliki ketahanan terhadap cekaman dari hasil pengujian beberapa karakter pertumbuhan, kandungan sukrosa dan prolin (Rinanto, 2010). Klon VMC 76-16 memiliki nilai toleran dan juga memiliki nilai ketahanan cekaman kekeringan (Direktorat Perbenihan dan Sarana Produksi, 2010). Pada penelitian yang sama juga diteliti klon PS 864 dan VMC 76-16. Dua klon tersebut terlihat memiliki ketahanan yang baik terhadap cekaman genangan (Khozin, 2013). PS klon 851 pada penelitian sebelumnya juga diteliti ketahanannya terhadap cekaman kekeringan. Hasilnya klon PS 851 disimpulkan tidak toleran terhadap cekaman kekeringan.
Penurunan kadar air merupakan respon alami yang ditunjukkan oleh tanaman saat menghadapi cekaman kekeringan. Penurunan kadar air terjadi akibat penguapan proses transpirasi yang tidak diiringi dengan pasokan jumlah air. Klon yang memiliki ketahanan terhadap cekaman kekeringan memiliki cara untuk mempertahankan kadar air dalam turgor sel guna menjaga keberlangsungan
Jurnal Agrista Vol. 23 No. 2, 2019 105 metabolisme. Klon tahan yang baik akan
mampu menjaga jumlah kadari air dalam tubuhnya jika dibandingkan dengan klon yang tidak tahan.
Saat tanaman mengalami cekaman kekeringan respon adaptasi yang dilakukan adalah mengatur status air dalam tubuhnya. Kemampuan pengaturan status air sangat ditentukan oleh sifat toleransi tanaman terhadap cekaman kekeringan tersebut salah satunya melalui penyesuaian tekanan osmotik dalam sel tanaman (Kirkham, 1990). Tanaman melakukan beberapa perubahan sebagai respon adaptasi saat kehilangan air akibat cekaman kekeringan. Perubahan-perubahan tersebut diantaranya dengan menutup stomata,
penggulungan daun, pengguguran daun, mengurangi laju pertumbuhan atau dengan mempertahankan suplai air dengan penyesuaian osmotik dan peningkatan nisbah akar/tajuk (Levitt, 1980).
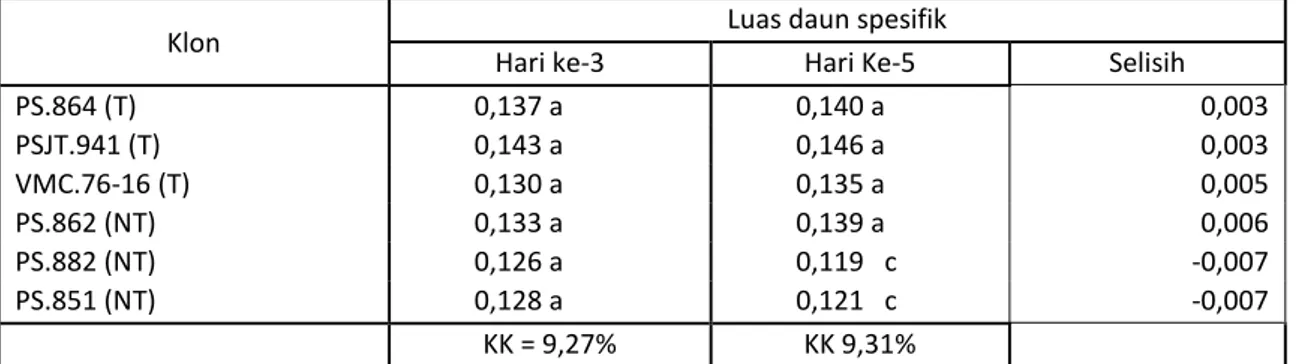
Luas Daun Spesifik
Pengukuran luas daun spesifik digunakan untuk mengetahui penurunan pembentukan dan perluasan daun selama perlakuan cekaman. Pengukuran luas daun spesifik dilakukan pada hari ke-3 dan ke-5 setelah perlakuan diberikan. Hasil pengamatan menunjukkan pengaruh yang berbeda nyata, sebagaimana ditampilkan pada tabel 2.
Tabel 2. Luas daun spesifik (m2/g bk) pada 6 klon tanaman tebu setelah pemberian cekaman kekeringan pada hari ke 3 dan ke 5.
Klon Luas daun spesifik
Hari ke-3 Hari Ke-5 Selisih
PS.864 (T) 0,137 a 0,140 a 0,003 PSJT.941 (T) 0,143 a 0,146 a 0,003 VMC.76-16 (T) 0,130 a 0,135 a 0,005 PS.862 (NT) 0,133 a 0,139 a 0,006 PS.882 (NT) 0,126 a 0,119 c -0,007 PS.851 (NT) 0,128 a 0,121 c -0,007 KK = 9,27% KK 9,31%
Keterangan : Angka-angka yang diikuti oleh huruf yang sama pada kolom yang sama berbeda tidak nyata menurut uji Duncan 5%.
Karakter morfologi daun berperan sebagai indikator utama kelompok tanaman toleran dan tidak toleran terhadap cekaman kekurangan air. Hasil pengukuran LDS pada hari ke-3 menunjukkan perbedaan yang tidak nyata dengan kisaran LDS antara 0,126 m2/g bk (PS.882) sampai 0,143.m2/g bk (PSJT.941). Meskipun scara statistik LDS antara kelompok toleran dan tidak toleran berbeda tidak nyata, akan tetapi secara umum kelompok toleran pada hari ke 3 setelah pemberian cekaman memiliki angka LDS yang masih tinggi dibandingkan dengan kelompok non toleran.
Pengukuran LDS pada hari ke-5 setelah pemberian cekaman mengindikasikan adanya diferensiasi pertambahan nilai LDS
dari klon-klon yang diuji. Klon-klon toleran PS.864, PSJT.941, dan VMC.76-16 serta klon non toleran PS.862 masih memperlihatkan adanya pertambahan LDS dengan kisaran antara 0,003 sampai 0,006. m2/g bk Sedangkan dua klon non toleran PS.882, PS.851 telah mengalami penurunan sebesar 0,007 m2/g bk.
Salah satu klon toleran yakni klon PSJT 941 memiliki sel buliform yang deretan selnya lebih bervariasi daripada klon-klon lainnya (Cholid, et al., 2014). Sel buliform merupakan sel yang ukurannya lebih besar dibandingkan sel epidermis, fungsi sel tersebut untuk beradaptasi dengan cara menggulung daun pada saat tanaman mengalami cekaman kekeringan (Price dan Courtois, 1991). Sedangkan klon-klon PS
Jurnal Agrista Vol. 23 No. 2, 2019 106 864 dan PS 882 mempunyai lamina yang
lebih tebal daripada varietas lainnya. Menurut Shield (1950) dalam Sulistyaningsih (1994) lamina yang tebal merupakan indikasi tanaman yang bersifat xerofit. Klon-klon VMC 76-16 mempunyai trikoma non glandular yang lentur, tidak mudah patah, dan ukuran yang lebih panjang dibandingkan klon-klon yang lain. Kebede et al., (1994) dalam Sulistyaningsih (1994) menjelaskan bahwa hasil penelitian pada genus Lycopersicon menunjukkan bahwa Lycopersicon pennelii yang bersifat lebih tahan terhadap kekeringan daripada Lycopersicon esculentum ternyata memiliki trikoma yang lebih sedikit tetapi ukurannya lebih panjang. Ukuran trikoma berperan dalam mengurangi transpirasi. Dari teori tersebut maka klon-klon PSJT 941, PS 862, VMC 76-16 juga memiliki kecenderungan bersifat tahan terhadap kekeringan. Dengan pertimbangan tersebut maka dapat dijelaskan bahwa klon PS 862 mempunyai kecenderungan untuk beradaptasi terhadap cekaman kekeringan.
Perkembangan tajuk, sangat peka terhadap cekaman kekeringan, yang mengakibatkan penurunan dalam pembentukan dan perluasan daun. Nilai luas daun spesifik yang lebih tinggi menandakan bahwa klon toleran memiliki adaptasi yang lebih baik dengan gejala kelayuan yang lebih rendah dibandingkan dengan klon yang non toleran (Mathius et al., 2001). Abayomi (2002) melaporkan bahwa pada tanaman tebu yang mengalami cekaman kekeringan terjadi penurunan pada pertumbuhan daun, laju penambahan luas daun, luas daun, dan indek luas daun. Nilai Defisit Air
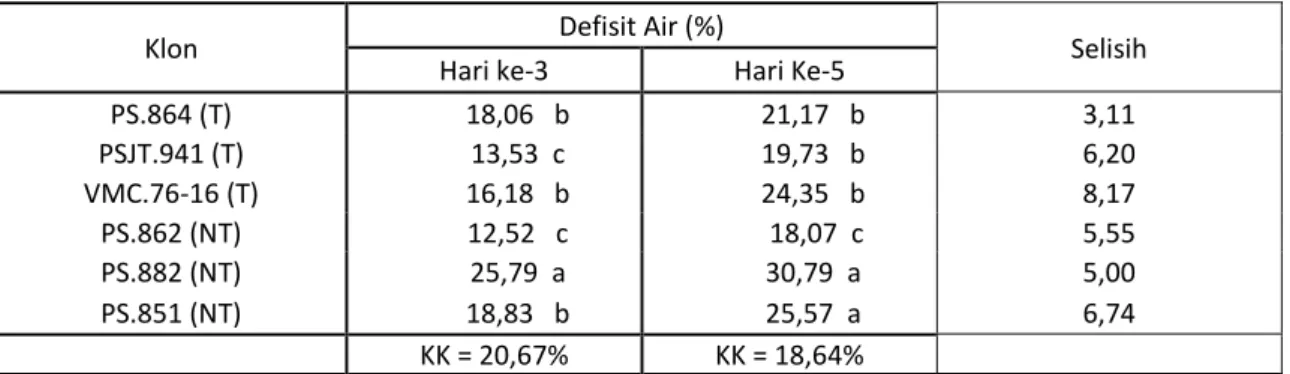
Pengujian defisit air digunakan untuk mengetahui penurunan kandungan air tanaman akibat cekaman. Parameter ini akan memberikan gambaran kemampuan tanaman dalam menahan ketersediaan air selama mengalami masa cekaman kekurangan air. Hasil pengukuran defisit air ditampilkan pada Tabel 4.
Tabel 3. Defisit air pada 6 klon tanaman tebu setelah diberi perlakuan cekaman kekeringan pada hari ke-3 dan ke-5.
Klon Defisit Air (%) Selisih
Hari ke-3 Hari Ke-5
PS.864 (T) 18,06 b 21,17 b 3,11 PSJT.941 (T) 13,53 c 19,73 b 6,20 VMC.76-16 (T) 16,18 b 24,35 b 8,17 PS.862 (NT) 12,52 c 18,07 c 5,55 PS.882 (NT) 25,79 a 30,79 a 5,00 PS.851 (NT) 18,83 b 25,57 a 6,74 KK = 20,67% KK = 18,64%
Keterangan : Angka-angka yang diikuti oleh huruf yang sama pada kolom yang sama berbeda tidak nyata menurut uji Duncan 5%.
Pengamatan defisit air pada hari ke 3 dan ke 5 menunjukkan pengaruh yang berbeda nyata.. Defisit air paling rendah pada hari ke 3 dialami oleh klon PS.862 yakni sebesar 12,88%. Angka tersebut berbeda tidak nyata dengan klon toleran PSJT.941 sebesar 13,53 %. Klon tidak toleran PS.882 memiliki nilai defisit air paling besar tinggi sebesar 25,79% yang
secara statistik berbeda nyata dengan klon-klon lainnya.
Hasil pengujian pada hari ke-5 memperlihatkan adanya diferensiasi dalam menahan defisit air. Defisit air terendah diperlihatkan oleh klon PS.862 (18,07%), sedangkan defisit air tertinggi masih diperlihatkan oleh kelompok klon tidak toleran yakni PS.882 dan PS.851 dengan angka 30,79 dan 25,57 berturut-turut.
Jurnal Agrista Vol. 23 No. 2, 2019 107 Sementara kelompok klon-klon yang
tergolong tahan memiliki nilai defisit air dengan kisaran antara 19,73 sampai 24,35. Jika dihitung peningkatan nilai defisit air, secara umum seluruh klon yang diuji mengalami peningkatan nilai defisit air tersebut. Jika dilihat secara detail klon VMC.76-16 adalah klon yang mengalami peningkatan nilai defisit air paling tinggi yakni 8,17 sedangkan klon dengan peningkatan nilai defisit air paling rendah adalah klon PS.864. Nilai defisit air (DA) menunjukkan banyaknya air dalam jaringan yang hilang dibandingkan dengan kandungan air pada kondisi turgor penuh. Semakin besar defisit air semakin rendah air yang tersedia untuk metabolisme. Peranan air yang sangat penting tersebut menimbulkan konsekuensi secara langsung atau tidak langsung bahwa defisit air tanaman akan mempengaruhi semua proses metabolisme dalam tanaman yang mengakibatkan terganggunya proses pertumbuhan (Gardner et al, 1991). Ditambahkan oleh Prawiranata et al. (1992) bahwa nilai DA yang besar, terutama pada tanaman yang kurang toleran, akan secara
nyata mempengaruhi semua proses metabolik, sehingga laju pertumbuhan tanaman menurun dan jika berlangsung lama dapat mengakibatkan kematian. Profil Protein
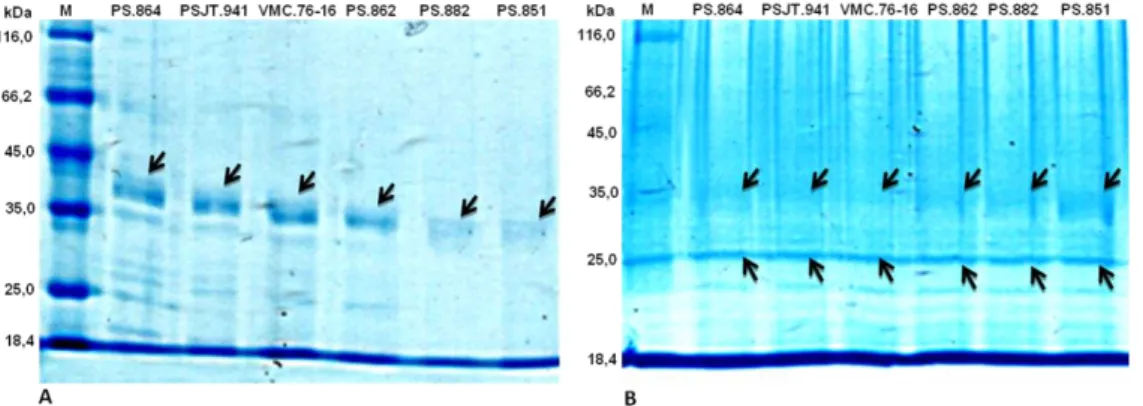
Untuk mendapatkan profil protein, maka isolasi protein total daun tanaman tebu dilakukan dengan metode TCA (Almaraj et al., 2010) yang dimodifikasi sebagaimana dideskripsikan dalam metodologi. Gambaran profil protein diperoleh melalui pemisahan menggunakan gel acrylamid dengan konsentrasi 12% (Gambar 1). Hasil visualisasi memperlihatkan adanya diferensiasi pola antara protein-protein daun tanaman tebu dari klon-klon yang tidak diperlakukan dengan cekaman kekurangan air dengan klon-klon yang diperlakukan dengan cekaman kekurangan air. Diferensiasi ditandai dengan kehadiran pita protein berukuran 25 kDa yang muncul pada klon-klon tanaman yang diperlakukan dengan cekaman kekeringan, dimana pita tersebut tidak muncul pada klon-klon yang tidak diperlakukan dengan
cekaman kekurangan air.
Gambar 1. Profil protein differensial antara klon-klon yang tidak diperlakukan (A) dan klon-klon yang diperlakukan (B).
Disisi lain, pada kelompok tanaman yang tidak diperlakukan dengan cekaman kekeringan terlihat kemunculan pita protein dengan ukuran sekitar 35 kDa. Pita tersebut mengalami penurunan konsentrasi yang terlihat dari menipisnya pita pada saat diperlakukan dengan cekaman kekeringan air. Rendahnya konsentrasi tersebut
diartikan sebagai terjadinya penurunan ekspresi protein-protein pada ukuran tersebut, atau dengan kata lain mengalami down regulated. Pita protein dengan ukuran sekitar 25 kDa justru sebaliknya mengalami peningkatan ketika diperlakukan dengan cekaman kekurangan air. Dengan demikian dapat diartikan
Jurnal Agrista Vol. 23 No. 2, 2019 108 bahwa kelompok protein-protein tersebut
mengalami peningkatan ekspresi pada saat mengalami cekaman kekurangan air (up regulated)
Kemungkinan kedua pita-pita protein tersebut merupakan kelompok protein yang terlibat dalam metabolisme yang merespon saat tanaman tebu mengalami cekaman kekurangan air. Sayangnya hasil sementara studi ini tidak bisa mengidentifikasi lebih detail jenis-jenis dan identitas protein yang terekspresi pada kedua kondisi tersebut.
Pada kondisi tanpa cekaman kekurangan air, klon-klon PS.864, PSJT.941, VMC.76-16 dan PS.862 menghasilkan pita protein berukuran 35 kDa dengan konsentrasi yang lebih tinggi dibandingkan kedua klon non toleran yaitu PS.882 dan PS.851. Almaraj et al. (2010) menyatakan dari protein-protein yang dihasilkan pada isolasi protein tebu jika dianalisis akan didapatkan beberapa macam jenis protein. Pertama sebanyak 23% protein merupakan protein yang berfungsi sebagai mekasisme pertahanan diri dari gangguan baik dari sesama makhluk hidup ataupun lingkungannya. Kemudian 23.33% yang lain merupakan protein yang berperan sebagai katalisator metabolisme posphat dan gula. Golongan paling penting yaitu sebanyak 20% merupakan protein protein penghasil gula. Sedangkan 13.33% adalah berperan dalam metabolisme asam nukleat serta 10% yang lain berperan sebagai pemrakarsa pertumbuhan dan perkembangan sel ditambah 6,67% masing-masing sebagai struktutural dasar sel dan metabolik sekunder. Sedangkan sisanya sebesar 16,67% lainya merupakan protein yang belum diketahui.
Pada umumnya cekaman kekeringan memberikan pengaruh lain terhadap aktivitas fisiologis tanaman tebu seperti degradasi protein, fotosintesis, metabolisme dan aktivitas antioksidan. Hal tersebut ditandai dengan terjadinya peningkatan dan penurunan ekspresi protein pada kondisi cekaman kekeringan yang menunjukkan bahwa adanya upaya
adaptasi dan perubahan yang dilakukan oleh tanaman tebu dalam menghadapi cekaman kekeringan (Xiang et al., 2010).
Zhou et al. (2012) menyatakan bahwa protein ATP dan Isoflavone reductase-like (IRL) merupakan beberapa contoh protein terkait metabolisme yang mengalami penurunan ekspresi akibat cekaman kekeringan. Perubahan tersebut terkait adaptasi tanaman tebu dalam menghadapi cekaman kekeringan. Sabehat et al. (1998) menyatakan bahwa secara umum protein total pada suatu tanaman akan mengalami penurunan apabila tanaman mengalami cekaman kekeringan. Hal tersebut merupakan akibat dari keadaan yang kurang mendukung untuk metabolisme tanaman secara optimum. Namun, umumnya ditemukan adanya peningkatan akumulasi protein dengan bobot molekul rendah.
KESIMPULAN
Respon klon-klon tanaman tebu kelompok toleran: PS.864, PSJT.941, VMC.76-16 dan PS.862 terbukti memiliki ketahanan terhadap cekaman kekeringan lebih baik dibandingkan kelompok cekaman tidak toleran PS.882 dan PS.851 secara signifikan. Terdapat perbedaan profil protein 6 klon tanaman tebu saat kondisi normal dan saat mengalami cekaman kekeringan. Perbedaan tersebut terlihat pada ekspresi pita protein berukuran 25 kDa yang tidak muncul pada kondisi normal.
UCAPAN TERIMAKASIH
Diucapkan terimakasih kepada Badan Penelitian dan Pengembangan Pertanian Kementrian Pertanian Republik Indonesia yang telah membiayai penelitian ini sepenuhnya melalui skim hibah penelitian KKP3N tahun anggaran 2013 dengan nomor kontrak: 726/LB.620/I.1/2/2013, Tanggal 25 Pebruari 2013.
Jurnal Agrista Vol. 23 No. 2, 2019 109
DAFTAR PUSTAKA
Abayomi, Y.A. 2002. Sugarbeet Leaf Growth and Yield Response to Soil Water Deficit. African Crop Science Journal 10(1).
Amalraj, R.S., Selvaraj, N. Veluswany, G.K., Rakwal, R., dan Viswanathanl, R. 2010. Sugarcane Proteomics: Establishment of Protein Extraction Method For 2-DE in Stalk Tissue and Initiation of Sugarcane Proteome Reference Map. Electrophoresis 31:1959-1974.
Bray, E.A., J. Bailey-Serres, and E. Weretilnyk, 2000. “Responses to abiotic stresses,” in Biochemistry and Molecular Biology of Plants, W. Gruissem, B. Buchannan, and R. Jones, Eds., pp. 1158–1249, American Society of Plant Physiologists, Rockville, MD, USA. Carmo-Silva, A.E, S.J. Powers, A.J. Keys,
M.C. Arrabacxa. 2008. Photorespiration in C4 grasses remains slow under drought conditions. Plant, Cell and Environment, Vol. 31: 925–940. Cholid, I. Ramadhan, Taryono, dan
Wulandari, R. 2014. Keragaan Pertumbuhan dan Rendemen Lima Klon Tebu (Saccharum officinarum L.) di Ultisol, Vertisol, dan Inceptisol. Vegetalika Vol.3 No.4 : 77 - 87 .
da Graça, J.P, F.A. Rodrigues, J.R.B. Farias, M.C. Neves. de Oliveira, C.B. Hoffmann-Campo and S.M. Zingaretti. 2010. Physiological parameters in sugarcane cultivars submitted to water deficit. Braz. J. Plant Physiol., Vol. 22: 189-197. Da Silva, A.L.C. and W.A.J.M. Da Costa.
2004. Varietal variation in growth, physiology and yield of sugarcane under two contrasting water regimes. Tropical Agricultural Research, 16: 1-12.
Direktorat Jenderal Perkebunan. 2011. Luas Areal Dan Produksi Perkebunan
Seluruh Indonesia Menurut Pengusahaan. Laporan Dirjen Perkebunan Republik Indonesia, Tahun 2011.
Direktorat Perbenihan dan Sarana Produksi. 2010. Klon tebu harapan VMC 76-16 sebagai varietas unggul baru. Forum Komunikasi Pengawas Benih Tanaman Perkebunan No 5. Vol 4. Hal 13-14.
Domaingue, R.1995. Family and varietal adaptation of sugarcane to dry conditions and relevance to selection procedures. In: International Society Of Sugar Cane Technologists Congress, 21., Bangkok, 1995. Proceedings. Bangkok: ISSCT, 1995. p.418-435. FAOSTAT. 2008. Sugar cane production.
Access in March 2008.
http://faostat.fao.org.
Fiah, R.L., Taryono, dan Toekidjo. 2014. Kemampuan Regenerasi Kalus Empat Klon Tebu (Saccharum officinarum L.). Vegetalika Vol.3 No.1: 91-101
Gardner, F.P., Pearce R.B., dan Mitchel R.L. 1991. Fisiologi Tanaman Budidaya. Penerbit UI Press, Jakarta. 428p. Inman-Bamber, NG and D.A. Smith. 2005.
Water relations in sugarcane and response to water deficits. Field Crop Research. 92: 185-202.
Kebede, E., Mariam, Z.G., Ahlgren, I., 1994. The Ethiopian Rift Valley lakes: chemical characteristics of a salinity-alkalinity series. Hydrobiology 288: 1-12.
Khozin, Mohammad Nur. 2013. Respon Ketahanan Beberapa Varietas Tebu
(Saccharum officinarum) terhadap Lama Waktu Penggenangan pada Fase Pembibitan. Jember: FP Universitas Jember.
Kirkham, M.B. 1990. Plant responses to water deficits.. In B.A. Stewart and D.R. (Ed). Irrigation of Agricultural Crops. Madison, Wisconsin USA. p.323-342
Jurnal Agrista Vol. 23 No. 2, 2019 110 Levitt, J. 1980. Responses of Plants to
Environmental Stresses: Water, Radiation, Salt, and Other Stresses. Vol. II. New York, Academic Press. Lopes, M.S., J.L. Araus, P.D.R. van Heerden
and C.H. Foyer. 2011. Enhancing drought tolerance in C4 crops. Journal of Experimental Botany, Vol. 62, No. 9: 3135–3153, doi:10.1093/jxb/err105.
Mathius, T.N., Wijana, G., Guharja, E., Aswidinnoor, H., Yahya, S., dan Subronto. 2001. Respons Tanaman Kelapa Sawit (Elaeis guineensis Jacq) Terhadap Cekaman Kekeringan. Menara Perkebunan, 69: 29-45.
Ngamhui, N., Akkasaeng, C., Zhu Y.J., Tantisuwichwong, N., Roytrakul, S., dan Sansayawichay, T. 2012. Differentially Expressed Proteins in Sugarcane Leaves in Response to Water Deficit Stress. Plant Omics Jurnal POJ 5(4):365-371.
Prabu, G.R., Kawar, P.G., Pagaria, M.C., dan Theertha, P.D. 2011. Identification of Water Deficit Stress Upregulated Genes in Sugarcane. Plant Mol Biol Rep 29:291-304.
Prawiranata, W., S. Harran, P. Tjondronegoro. 1992. Dasar-dasar Fisiologi Tumbuhan Jilid I. Jurusan Biologi. FMIPA IPB. Bogor. 341 hal. Price, A, and B. Courtois. 1991. Mapping
QTLs Associated with Drought Resistance in Rice; Progress Problem and Prospect. Los Banos: International Rice Research Institute.
Ramesh, P. and M. Mahadevaswamy. 2000. Effect of formative phase drought on different classes of shoots, shoot mortality, cane attributes, yield and quality of four sugarcane cultivars. Journal of Agronomy & Crop Science, Vol.185: 249-258.
Rinanto, Y. 2010. Kandungan Sukrosa dan Prolin Kultivar Tebu (Saccharum officinarum L.) Selama Cekaman
Kekeringan. Jember: STP. jurnal Ipi152983.
Robertson, M.J., N.G. Inmam-Bamber, R.C. Muchow, A.W. Wood. 1999. Physiology and productivity of sugarcane with early and midseason water deficit. Field Crops Research. 64: 211–227. Sabehat, A.D., Weiss., dan Lurie, S. 1998.
Heatshock Proteins and Cross-Tolerance in Plants. Physiol Plant., 103:437-441
Shields, L. M. 1950. Leaf xeromorphy as related to physiological and structural influences.Botanical Reviews (16): 399–447.
Singh, S.;M.S. Reddy. 1980. Growth, yield and juice quality performance of sugarcane varieties under different soil moisture regimes in relation to drought resistance. In: International Society Of Sugar Cane Technologists Congress, 17., Manila, 1980. Proceedings. Manila: ISSCT, 1980. p.541-555.
Soares, R.A.B.; P.F.M. Oliveira, H.R. Cardoso, A.C.M. Vasconcelos, M.G.A. Landell, U. Rosenfeld. 2004. Efeito da irrigação sobre o desenvolvimento e a produtividade de duas variedades de cana-de-açúcar colhidas em início de safra. STAB Açúcar, Álcool e Subprodutos, v.22: 38-41.
Sugiharto, B., Ermawati, N., Mori, H., Aoki, K., Yonekura-Sakakibara, K., Yamaya, T., Sugiyama, T., dan Sakakibara, H. 2002. Identification and Caracterization of a Gene Encoding Drought-Inducible Protein Localizing in the Bundle Sheath Cell Of Sugarcane. Plant Cell Physiol 43:350-354.
Sulistyaningsih, Y.C., Dorly, dan H. Akmal, 1994, Studi Anatomi Daun Saccharum spp. Sebagai Induk dalam Pemuliaan Tebu, Jurnal BerkalaPenelitian Hayati, 1(2): 32-36.
Jurnal Agrista Vol. 23 No. 2, 2019 111 Suprasanna P. 2010. Biotechnological
interventions in sugarcane improvement: Strategies, methods and progress. BARC Newsletter 316: 7 pp.
Waclawovsky, A.J., P. M. Sato, C. G. Lembke, P. H. Moore,and. M. Souza, 2010. “Sugarcane for bioenergy production: an assessment of yield and regulation of sucrose content,” Plant Biotechnology Journal, 8: 263–276. Widyasari, W.B., Sugiharto, B., Ismayadi C.,
Wahjudi, K., dan Murdiyatmo U. 2004. Isolasi dan Analisis Gen yang Responsif Terhadap Cekaman
Kekeringan pada Tebu Berk. Penel. Hayati: 9 (69-73).
Xiang, X., Ning, S., Jiang, X., Gong, X., Zhu, R., Zhu, L., dan Wei, D. 2010. Protein Extraction From Rice (Oryza sativa) Root for Two-Dimensional Electrophoresis. Front Agric. China 4: 416-421.
Zhou, G., Tao, L., Yang, R.L., Zou, C.L., Huang, L.P., Qiu, H.L., Huang, X., dan Kumar, M. 2012. Proteomic Analysis of Osmotic Stress-Responsive Proteins in Sugarcane Leaves. Plant Mol Biol Rep (30): 349–359.