BAB II
TINJAUAN PUSTAKA
A. Peran Guru dalam Proses Belajar Mengajar
Pengetahuan adalah abstraksi dari apa yang dapat diketahui dalam jiwa orang yang mengetahuinya. Pada dasarnya pengetahuan tidak bersifat spontan, melainkan pengetahuan harus diajarkan dan dipelajari (Majid, 2005).
Kegiatan belajar mengajar melibatkan fase transformasi pengetahuan dari yang mengajarkan kepada yang diajarkan. Transformasi dalam proses belajar mengajar tersebut tidak terlepas dari peran seorang guru. Menurut Burner (Nasution, 2005), dalam proses belajar pada fase transformasi, informasi harus dianalisis, diubah atau ditransformasi ke dalam bentuk yang lebih konseptual agar dapat digunakan untuk hal-hal yang lebih luas. Dalam hal ini bantuan guru sangat diperlukan. Menurut Arikunto (2005) guru adalah orang yang paling penting statusnya di dalam kegiatan belajar-mengajar karena guru memegang tugas yang amat penting, yaitu mengatur dan mengemudikan bahtera kehidupan kelas.
Dalam proses belajar mengajar (PBM), posisi guru sangat penting dan strategis, meskipun gaya dan penampilan mereka bermacam-macam. Menurut Claife (Syah, 1995), guru adalah: ...an authority in the disciplines
relevant to education, yakni pemegang hak otoritas atas cabang-cabang ilmu
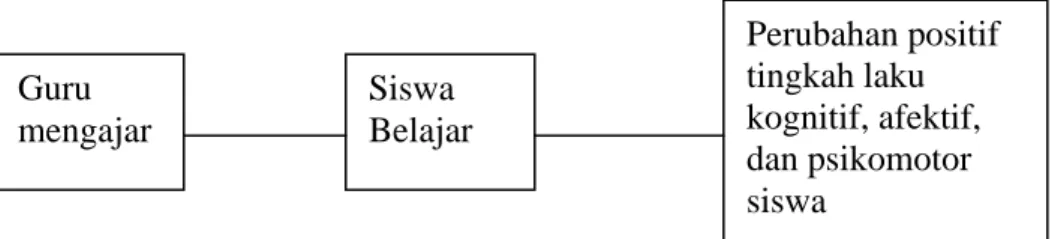
Gambaran secara lebih jelas mengenai posisi guru yaitu sebagai berikut. (Syah, 1995) Siswa Belajar Perubahan positif tingkah laku kognitif, afektif, dan psikomotor siswa Guru mengajar
Gambar 2.1 Posisi Guru dalam PBM
Model ini menunjukkan bahwa kegiatan belajar siswa merupakan akibat hasil kegiatan guru mengajar dalam konteks PBM. Namun demikian tidak tertutup kemungkinan adanya proses belajar siswa tanpa melibatkan kegiatan guru. Setiap guru mengajar membutuhkan murid belajar, tetapi tidak setiap murid belajar memerlukan guru mengajar (Syah, 1995).
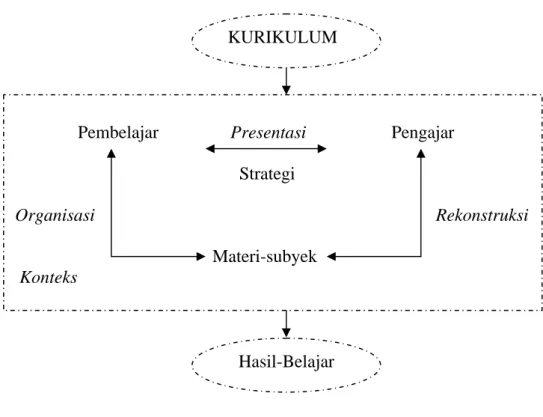
Menurut Siregar (1998), dalam proses belajar mengajar terdapat interaksi antara tiga komponen yaitu guru, siswa dan materi subyek. Hubungan ketiga komponen tersebut dapat dilihat pada Gambar 2.2.
KURIKULUM
Pembelajar Presentasi Pengajar Strategi
Organisasi Rekonstruksi
Materi-subyek
Konteks
Hasil-Belajar
Gambar 2.2 Antar Hubungan Komponen-Komponen Mengajar Guru sebagai pengajar mempunyai peranan penting dalam mendefinisikan dan mengendalikan bentuk wacana yang wajar selama pembelajaran. Guru memerlukan strategi dalam proses pengajarannya agar lebih mudah dipahami oleh pembelajar. Pada Gambar 2.2 di atas dapat terlihat adanya hubungan antara pengajar, materi-subyek, dan pembelajar untuk memperoleh hasil belajar. Untuk menjalankan proses mengajar tersebut diperlukan adanya kurikulum.
Menurut Arifin, et al. (2000) pembelajaran merupakan kegiatan belajar-mengajar ditinjau dari sudut kegiatan siswa berupa pengalaman belajar siswa (PBS) yaitu kegiatan siswa yang direncanakan guru untuk dialami siswa selama kegiatan belajar-mengajar.
Seorang pendidik dalam melaksanakan kegiatan belajar mengajar harus dapat menumbuhkan motivasi peserta didik, karena motivasi tersebut dapat mempengaruhi hasil belajarnya. Salah satu faktor yang dapat memotivasi siswa dalam kegiatan belajar adalah kemampuan guru dalam menyampaikan isi materi, sehingga dapat mempermudah dalam proses belajar.
B. Representasi Ilmu Kimia
Ben-zvi, Eylon, Silberstein, dan Gabel dalam Wu, J. S. Krajcik, E. Soloway (2000) mengemukakan bahwa pemahaman konseptual para siswa terhadap representasi kimia merupakan area penelitian terkemuka dalam pendidikan kimia. Gabel dalam Wu, J. S. Krajcik, E. Soloway (2000) menyatakan bahwa selama satu dasawarsa, para peneliti dan pendidik ilmu kimia telah mendiskusikan tiga level representasi dalam ilmu kimia yaitu makroskopis, mikroskopis, dan simbol.
Representasi kimia pada level makroskopis menunjukan fenomena yang dapat diamati, contohnya perubahan wujud zat. Kimia mikroskopis menunjukkan pergerakan molekul yang digunakan untuk menjelaskan keadaan senyawa atau fenomena alam. Kimia pada level simbol menunjukkan representasi simbolis dari atom, molekul dan senyawa, contohnya seperti simbol-simbol kimia, rumus dan struktur (Wu, J. S. Krajcik, E. Soloway, 2000).
Menurut Johnstone (Chittleborough, D. F. Treagust, M. Mocerino, 2002) ketiga level representasi tersebut saling berhubungan dan
berkontribusi terhadap pembentukan pemahaman para siswa, yang terefleksikan dalam model mental dari fenomena. Model mental tersebut diperlihatkan pada Gambar 2.3.
Makroskopis
Model mental
Mikroskopis Simbolis Gambar 2.3 Representasi Ilmu Kimia
Studi empirik Ben-Zvi, Eylon & Silberstein dalam Wu, J. S. Krajcik, E. Soloway (2000) menunjukkan bahwa pembelajaran representasi mikroskopis dan simbolis menyulitkan siswa karena kedua representasi tersebut tidak kasat mata dan bersifat abstrak. Di sisi lain pemahaman siswa terhadap kimia sangat bersandar pada informasi yang dapat diindera.
Ben-Zvi mengemukakan bahwa walaupun representasi memainkan peranan penting dalam ilmu kimia akan tetapi literatur mengindikasikan bahwa kebanyakan siswa mempunyai kesulitan dalam memvisualisasikan representasi-representasi tersebut (Wu, J. S. Krajcik, E. Soloway, 2000). Dalam penyelidikan yang dilakukan oleh Ben-Zvi, Eylon, dan Silberstein (Wu, J. S. Krajcik, E. Soloway, 2000), mereka mengeksplorasi level apa yang digunakan siswa ketika beberapa simbol dan rumus kimia digunakan, seperti Cu(s), H2O(l), dan Cl2(g). Respon dari siswa menandakan
bahwa mayoritas dari mereka kebingungan mengenai atom dan molekul. Banyak pelajar, meskipun telah mempelajari ilmu kimia, tidak memahami peran dari sebuah rumus, sebagian dari mereka berpikir bahwa rumus merupakan singkatan belaka untuk sebuah nama.
Kozma (Wu, J. S. Krajcik, E. Soloway, 2000) menyatakan bahwa kebanyakan siswa mempunya kesulitan dalam menginterpretasikan persamaan kimia. Ketika mereka melihat sebuah persamaan seperti C(s) + O2(g) → CO2(g), mereka menginterpretasikannya sebagai komposisi huruf, jumlah dan garis daripada sebuah proses pembentukan dan pemecahan ikatan.
Sebagai penjelasan tambahan, studi Keig dan Rubba (1993) dalam Wu, J. S. Krajcik, E. Soloway (2000) menunjukkan bahwa sangat banyak siswa yang tidak dapat membuat terjemahan diantara rumus, konfigurasi elektron, dan model ”ball and stick”. Dengan demikian walaupun ahli kimia melihat simbol dan huruf-huruf sebagai molekul dan tanda panah sebagai arah reaksi, banyak pelajar tidak dapat memvisualisasikan representasi tersebut.
C. Intertekstualitas
Menurut semiotik sosial, arti dari suatu teks tidak berdiri sendiri tetapi dihubungkan dengan teks lain yang sama atau relevan. Lemke mengemukakan bahwa “segala sesuatu akan bermakna hanya jika dipertentangkan dengan latar belakang hal lain yang sama dengannya” (Wu, 2002).
Menurut Haliday dan Hasan dalam Wu (2002), teks didefinisikan sebagai bahasa fungsional yang bisa berupa percakapan atau tulisan, atau medium apapun lainnya untuk mengekspresikan apa yang kita pikirkan. Dari sudut pandang ini, representasi kimia pada level yang berbeda-beda (yaitu level makroskopis, mikroskopis, dan simbol), pengalaman sehari-hari dan kejadian-kejadian dalam kelas dapat dipandang sebagai suatu teks (Santa Barbara Classroom Discourse Group, 1992, dalam Wu, 2002). Ketika siswa mengkonstruk pemahaman mengenai konsep-konsep kimia, mereka mungkin mengkoordinasikan representasi yang berbeda-beda dengan pengalamannya sehari-hari. Pertautan diantara representasi, pengalaman kehidupan sehari-hari, dan kejadian-kejadian di kelas yang dilakukan pembelajar dapat dipandang sebagai hubungan intertekstual
Pendapat yang sama dikemukakan oleh Bloome dan Egan-Robertson (Wu, 2002) bahwa pertautan antara representasi, pengalaman kehidupan sehari-hari, dan kejadian-kejadian di kelas yang dilakukan siswa dapat dipandang sebagai hubungan intertekstual. Dengan demikian, intertekstualitas dalam ilmu kimia yang dimaksud yaitu kaitan antara representasi kimia, pengalaman hidup sehari-hari, serta kejadian-kejadian di dalam kelas yang dibangun siswa untuk memahami ilmu kimia.
Diilhami oleh pandangan konstruktivis sosial dalam pembelajaran, Vygotsky dan Kozma (Wu, 2002) menyatakan bahwa untuk mengembangkan pemahaman siswa mengenai kimia, kurikulum kimia harus membimbing mereka untuk menggunakan representasi majemuk dalam
hubungannya dengan fenomena fisik. Lingkungan belajar, termasuk guru, material kurikulum, atau peralatan teknologi, harus secara eksplisit memperlihatkan hubungan diantara level-level makroskopis, mikroskopis dan simbol dalam konteks inkuiri. Melalui praktik sosial dan diskursif, siswa secara konseptual bergerak maju dan mundur diantara ketiga level tersebut dan memiliki kesempatan secara kognitif berinteraksi dengan beragam jenis representasi dalam cara yang bermakna. Berdasarkan pandangan Kozma mengenai pembelajaran kimia, diperlukan kajian intertekstualitas untuk membangun teori mengenai hubungan diantara representasi kimia pada level yang berbeda.
Tautan intertekstual dapat dibuat diantara pengalaman sehari-hari dan level makroskopis kimia. Meskipun proses kimia pada level makroskopis dapat dilihat dan relatif lebih mudah untuk dipahami, akan tetapi umumnya dalam kurikulum kimia proses ini dipisahkan dari situasi nyata di kehidupan sehari-hari dan biasanya didesain sebagai kegiatan laboratorium. Pada kegiatan tersebut siswa diminta untuk mengikuti prosedur yang telah diberikan, sehingga tidak mengherankan apabila kebanyakan siswa tidak mampu mengaplikasikan pengetahuan ilmiah yang telah mereka peroleh di sekolah ke dalam kehidupan sehari-hari.
Untuk menjembatani “jurang pemisah” di antara pengalaman sehari-hari dengan pengalaman belajar siswa di sekolah, hubungan intertekstual yang pertama kali harus dibangun yaitu antara situasi nyata siswa dalam kehidupan sehari-hari dengan aspek makroskopis kimia, sehingga
memberikan kesempatan bagi siswa untuk melihat bagaimana sains di sekolah dihubungkan dengan kehidupannya serta bagaimana pengetahuan sains tersebut diaplikasikan.
Interaksi sosial juga merupakan aspek penting pada intertekstualitas ilmu kimia. Melalui interaksi sosial siswa dapat mengkonstruk pemahaman kimianya bukan hanya mengikuti makna individualnya saja, akan tetapi mengkonstruk pemahaman dari makna sosial juga (Wu, 2002). Guru memainkan peranan penting dalam menciptakan interaksi sosial yang menunjang proses pertautan antara representasi ilmu kimia pada level makroskopis, mikroskopis, dan simbol dengan pengalaman sehari-hari siswa. Melalui interaksi sosial juga guru dapat melihat sejauh mana pemahaman yang telah dibangun siswa, sehingga dengan adanya interaksi tersebut guru dapat langsung mengevaluasi pembelajaran yang telah dan sedang berlangsung di kelas.
C. Model Representasi Teks
Analisis yang digunakan pada proses belajar mengajar termasuk ke dalam analisis wacana. Dalam menganalisis representasi ilmu kimia pada pengajaran guru ini, digunakan model representasi teks dari Siregar. Model tersebut digunakan untuk mengkonstruk ilmu yang dipetakan dari hasil transkripsi kegiatan belajar mengajar.
Model representasi teks menjelaskan hubungan antara unit-unit teks dan ketepatan struktur materi subyek ilmu yang mewakilinya pada berbagai
tingkatan. Dalam model representasi tersebut, dimensi progresi berlangsung di bawah kendali dimensi elaborasi, sedangkan dimensi elaborasi itu sendiri mengendalikan ketepatan pengembangan materi subyek selama pengembangan wacana terpusat pada produksi pengetahuan materi subyek.
E L A B O R A S I P-I P-IV P-III P-II TOPIK S-1 P R O G R E S I S-2 S-3 S-4 S-5 S-6 S-7 S-8 S-9 S-10 S-11 S-12
Gambar 2.4 Model Representasi Mengajar (Dahar dan Siregar, 2000)
Van Dijk dan Kintsch dalam Siregar (1999) mengemukakan bahwa pengorganisasian wacana dilakukan menggunakan unit wacana yang dalam
hal ini adalah proposisi, karena hubungan wacana dan materi-subyek yang tidak dapat dipisahkan. Dari Gambar 2.4, P melambangkan proposisi makro dan S melambangkan proposisi dengan abstraksi rendah. Proposisi merupakan pernyataan pengukuhan antara hubungan konsep dibedakan menurut tingkat abstraksinya.
Tugas utama dalam analisis wacana adalah mengorganisasi unit terkecil, proposisi-mikro (pengukuhan yang mewakili struktur permukaan teks) menjadi unit yang lebih besar, proposisi-makro secara berulang-ulang dapat digabung menjadi proposisi-makro pada berbagai tingkat abstraksi yang akhirnya menjadi proposisi-global.
Berikut ini disajikan tahapan-tahapan untuk memperoleh struktur global dan struktur mako pengajaran guru.
1. Penghalusan Transkripsi Menjadi Teks Dasar
Transkripsi diperhalus menjadi teks dasar untuk memperoleh data yang mudah untuk dianalisis. Penghalusan ini dilakukan berdasarkan kriteria ketepatan dan kejelasan, dengan cara penghapusan dan penyisipan kata. Penghapusan dilakukan terhadap kata-kata yang dirasa tidak berperan atau berlebihan dalam membentuk struktur yang diinginkan. Sedangkan penyisipan dilakukan untuk mempertajam atau mengganti peranan kata yang dihapus.
2. Penurunan Proposisi dari Teks Dasar
Teks dasar yang diperoleh dari penghalusan transkripsi selanjutnya dibuat proposisinya. Sebelum proposisinya diturunkan, dilakukan
segmentasi terlebih dahulu terhadap teks dasar. Satu segmentasi tersebut mengandung satu tema atau satu tindakan utama. Proposisi biasanya mempunyai rumusan yang lebih singkat dari teks dasar.
Menurunkan proposisi dari suatu teks dasar diwujudkan dengan cara menggunakan aturan makro. Aturan makro tersebut terdiri atas tiga cara, yaitu dengan menghapus, dengan menggeneralisasi dan dengan membangun (Siregar, tanpa tahun). Aturan makro tersebut bersifat rekursif, artinya proposisi yang dihasilkan dapat digunakan kembali untuk penurunan proposisi yang lebih umum.
3. Struktur Makro dan Struktur Global Pengajaran Guru
Penurunan struktur global harus memperhatikan keterpaduan hubungan antar unit tema. Tindakan makro dalam alur progresi memungkinkan penampilan yang lebih kontinu dan dalam dimensi elaborasi menghendaki keutuhan hubungan hirarki antara unit materi subyek.
Pada struktur global pengajaran terdapat makro utama yang dapat dijabarkan kembali menjadi struktur makro pengajaran. Struktur makro ini digunakan untuk mempermudah proses pemilihan representasi ilmu kimia pada level makroskopis, mikroskopis, dan simbol.
D. Tinjauan Materi Kelarutan dan Hasil Kali Kelarutan 1. Kelarutan (s)
Kelarutan (solubility) suatu zat dalam suatu pelarut menyatakan jumlah maksimum zat yang dapat larut dalam sejumlah tertentu pelarut pada suhu tertentu. Kelarutan umumnya dinyatakan dalam gram L-1 atau mol L-1.
Bila sejumlah NaCl dilarutkan ke dalam air dan ada sebagian yang tidak larut, maka larutan yang dihasilkan merupakan larutan jenuh. Bila ke dalam larutan jenuh NaCl ditambahkan lagi sedikit NaCl maka NaCl yang ditambahkan tersebut tidak bisa melarut namun tetap sebagai endapan NaCl. Konsentrasi zat terlarut di dalam larutan jenuh dinyatakan sebagai kelarutannya.
2. Tetapan Hasil Kali Kelarutan (Ksp)
Perak kromat (Ag2CrO4) merupakan contoh garam yang sukar larut dalam air. Jika Ag2CrO4 dimasukkan sedikit saja ke dalam segelas air kemudian diaduk, maka akan terlihat bahwa sebagian besar dari garam itu tidak larut (mengendap di dasar gelas). Larutan perak kromat mudah sekali jenuh. Setelah mencapai keadaan jenuh proses melarut ternyata tidak berhenti. Dalam larutan jenuh tetap terjadi proses melarut, tetapi pada saat yang sama terjadi pula proses pengkristalan dengan laju yang sama. Dengan kata lain, dalam keadaan jenuh terdapat kesetimbangan antara zat padat tak larut dengan larutannya. Kesetimbangan dalam larutan jenuh perak kromat adalah sebagai berikut.
Ag2CrO4(s) 2Ag+(aq) + CrO42-(aq)
Dari kesetimbangan dalam keadaan jenuhnya tersebut dapat ditentukan hasil kali kelarutannya. Hasil kali kelarutan adalah hasil kali konsentrasi molar ion-ion dalam larutan jenuhnya dipangkatkan koefisiennya masing-masing. Harga hasil kali kelarutan dilambangkan dengan Ksp (solubility product constant) atau tetapan hasil kali kelarutan. Ksp ini merupakan tetapan untuk reaksi kesetimbangan antara padatan terlarut dengan ion-ionnya. Garam-garam atau basa-basa tertentu memiliki harga Ksp yang berbeda-beda.
Pada reaksi kesetimbangan antara ion-ion yang melarut dan padatan Ag2CrO4, rumusan tetapan hasil kali kelarutannya (Ksp) adalah:
Ksp = [Ag+]2 [CrO42-].
Konsentrasi kesetimbangan ion Ag+ dan ion CrO42- dalam larutan jenuh dapat dikaitkan dengan kelarutan Ag2CrO4, yaitu sesuai dengan stoikiometri reaksi (perbandingan koefisien reaksinya). Jika kelarutan Ag2CrO4 dinyatakan dengan s, maka konsentrasi ion Ag+ dalam larutan itu sama dengan 2s dan konsentrasi ion CrO42- sama dengan s.
Ag2CrO4(s) 2Ag+(aq) + CrO42-(aq) s 2s s
Dengan demikian, tetapan hasil kali kelarutan (Ksp) Ag2CrO4 dapat dikaitkan dengan kelarutannya (s) sebagai berikut.
Ksp = [Ag+]2 [CrO42-] = (2s)2 (s)
3. Pengaruh Ion Senama Terhadap Kelarutan
Dalam larutan jenuh Ag2CrO4 terdapat kesetimbangan antara Ag2CrO4 padat dengan ion-ion Ag+ dan CrO42- dalam larutannya.
Ag2CrO4(s) 2Ag+(aq) + CrO42-(aq)
Sesuai dengan azas Le Chatelier tentang pergeseran kesetimbangan, penambahan konsentrasi ion CrO42- atau ion Ag+ akan menggeser kesetimbangan ke kiri. Akibat dari pergeseran tersebut, jumlah Ag2CrO4 yang larut berkurang. Jadi, dapat disimpulkan bahwa ion senama akan memperkecil kelarutan. Akan tetapi, ion senama tidak mempengaruhi harga tetapan hasil kali kelarutan, asal suhu tidak berubah.
4. Pengaruh pH Terhadap Kelarutan
Jika ke dalam larutan suatu senyawa yang mengandung anion dari asam lemah, ditambahkan ion H3O+ dari asam kuat, maka akan memperbesar harga kelarutan dari senyawa tersebut. Hal tersebut dapat dijelaskan dengan azas Le Chatelier tentang pergeseran kesetimbangan. Contohnya dalam larutan jenuh CaCO3 yang memiliki kesetimbangan sebagai berikut.
CaCO3(s) Ca2+(aq) + CO32-(aq)
Dalam larutan asam, ion H3O+ akan mengikat ion CO32- yang merupakan anion dari asam lemah, membentuk HCO3- atau H2CO3. H2CO3 selanjutnya akan terurai membentuk CO2 dan H2O. Hal ini akan menggeser kesetimbangan reaksi di atas ke kanan. Dengan kata lain, menyebabkan CaCO3 melarut.
Berbeda halnya pada saat penambahan ion H3O+ ke dalam larutan jenuh suatu senyawa yang mengandung anion dari asam kuat, seperti perak klorida. Hal tersebut tidak akan mempengaruhi proses kesetimbangan dalam reaksinya.
AgCl(s) Ag+(aq) + Cl-(aq)
Karena ion Cl- merupakan basa konjugasi dari asam kuat (HCl), maka ion Cl- akan ada di dalam larutannya bersama-sama dengan ion H3O+. Ion Cl- tidak meninggalkan sistem, sehingga tidak mempengaruhi posisi kesetimbangan dalam reaksi tersebut.
5. Tetapan Hasil Kali Kelarutan dan Pengendapan
Harga Ksp suatu senyawa dapat memberikan informasi tentang kelarutan senyawa tersebut dalam air. Semakin besar harga Ksp suatu zat, semakin mudah larut senyawa tersebut.
Harga Ksp suatu zat dapat digunakan untuk meramalkan terjadi tidaknya endapan suatu zat jika dua larutan yang mengandung ion-ion dari senyawa sukar larut dicampurkan.
Untuk mengendapkan ion Cl- dari air laut dapat dilakukan dengan cara menambahkan larutan AgNO3. Ion Cl- dari air laut akan bergabung dengan ion Ag+ yang berasal dari AgNO3 membentuk AgCl yang sukar larut.
Ag+(aq) + Cl-(aq) AgCl(s)
Pada saat larutan yang mengandung ion Cl- ditetesi sedikit demi sedikit dengan larutan Ag+, endapan AgCl tidak akan langsung
terbentuk. AgCl dapat larut dalam air, meskipun dengan jumlah yang sangat sedikit. Artinya, ion Ag+ dan ion Cl- dapat berada bersama-sama dalam larutan hingga larutan jenuh, yaitu sampai hasil kali [Ag+] [Cl-] = nilai Ksp AgCl. Apabila penambahan ion Ag+ dilanjutkan hingga hasil kali [Ag+] [Cl-] > Ksp AgCl, maka kelebihan ion Ag+dan ion Cl- akan bergabung membentuk endapan AgCl. Jadi, pada penambahan larutan Ag+ ke dalam larutan Cl- dapat terjadi tiga hal sebagai berikut:
Jika [Ag+] [Cl-] < Ksp AgCl, larutan belum jenuh Jika [Ag+] [Cl-] = Ksp AgCl, larutan tepat jenuh
Jika [Ag+] [Cl-] > Ksp AgCl, terjadi pengendapan dan larutan yang terbentuk bersifat jenuh
6. Kelarutan dan Hasil Kali Kelarutan dalam Kehidupan Sehari-hari Berikut ini merupakan beberapa contoh fenomena dalam kehidupan
sehari-hari yang menggunakan prinsip kelarutan dan hasil kali kelarutan. 1) Proses Mendapatkan Sidik Jari
Sewaktu tangan memegang suatu benda, salah satu zat yang ditinggalkan pada benda tersebut adalah NaCl yang berasal dari keringat. Benda yang dipegang tadi disapu dengan larutan AgNO3. AgNO3 akan bereaksi dengan NaCl membentuk endapan AgCl berwarna putih jika hasil kali konsentrasi Ag+ dan Cl- nya telah melebihi harga Ksp AgCl . Di bawah sinar, endapan AgCl putih ini akan berubah menjadi endapan Ag yang berwarna hitam. Endapan ini akan menampilkan sidik jari.
NaCl(aq) + AgNO3(aq) AgCl(s) + NaNO3(aq)
Putih
Terbentuknya endapan AgCl tersebut terkait dengan kelarutan AgCl yang rendah dalam pelarut air. Harga Ksp dari AgCl adalah sebesar 1,8×10-10.
Gambar 2.5 Sidik Jari Manusia 2) Terbentuknya Batu Karang
Gambar 2.6 Gugusan Batu Karang
Gugusan batu karang yang ada sekarang ini berasal dari CaCO3 yang terbentuk selama 65-100 juta tahun yang lalu. Pembentukan CaCO3 berawal dari karbondioksida yang berada di atmosfer bereaksi dengan air laut membentuk asam karbonat melalui reaksi di bawah ini:
CO2(g) + H2O(l) H2CO3(aq)
Ketika asam karbonat yang terbentuk larut dalam air laut, maka asam karbonat akan terurai menjadi ion bikarbonat atau karbonat dan H+. H CO (aq) H+(aq) + HCO -(aq)
HCO3-(aq) H+(aq) + CO32-(aq)
Beberapa organisme yang hidup di air laut mereaksikan ion bikarbonat dengan Ca2+ untuk membentuk kalsium karbonat (CaCO3).
Ca2+(aq) + 2HCO3-(aq) CaCO3(s) + CO2(g) + H2O(l)
Gugusan batu karang yang terbentuk di dasar lautan terjadi karena kelarutan CaCO3 tersebut rendah dalam air. Harga Ksp dari CaCO3 yaitu sebesar 2,8×10-9. Dengan harga Ksp yang kecil, maka harga kelarutannya pun kecil. Dengan memiliki harga kelarutan yang kecil, maka makin lama akan terjadi proses pengendapan di dasar laut dan akhirnya akan terbentuk gugusan batu karang.
3) Menghilangkan Kesadahan Air
Air sadah mengandung ion Mg2+ dan Ca2+ yang cukup tinggi, disamping anion seperti HCO3-. Jika air sadah digunakan dengan sabun, maka ion Ca2+ atau Mg2+ pada air sadah akan mensubstitusikan ion Na+ dan atau ion K+ yang dikandung sabun, sehingga air sabun tidak berbuih dan kehilangan daya pembersihnya. Pada mesin, alat rumah tangga, pipa dan sebagainya, air sadah membentuk kerak atau endapan yang menempel pada mesin atau alat lain, dan oleh karena kerak itu bukan penghantar panas maka hal ini menyebabkan pemborosan bahan bakar. Jika air sadah itu hanya mengandung garam Ca(HCO3)2 atau Mg(HCO3)2, maka air sadah dikatakan mempunyai kesadahan sementara. Ion Ca2+ atau Mg2+ dalam larutan dapat dipisahkan dengan cara pemanasan. Jika air sadah tersebut
mengandung garam sulfat (CaSO4, MgSO4) atau garam klorida (CaCl2, MgCl2), maka air sadah itu dikatakan mempunyai kesadahan tetap Untuk mengatasi hal ini, ke dalam air sadah dapat ditambahkan garam yang mengandung ion CO32-, contohnya Na2CO3 untuk mengendapkan Ca2+ dan Mg2+.
CaCl2(aq) + Na2CO3(aq) CaCO3(s) + 2NaCl(aq) MgSO4(aq) + Na2CO3(aq) MgCO3(s) + Na2SO4(aq) 4) Penambahan Senyawa Fluorida ke dalam Pasta Gigi
Email terdiri dari senyawa hidroksiapatit, Ca5(PO4)3OH yang memiliki harga Ksp 2,34 × 10-59.
Kerusakan gigi terjadi karena suasana di dalam mulut bersifat asam. Suasana asam dapat terjadi karena pengaruh bakteri dalam mulut ketika menguraikan sisa-sisa makanan yang terselip di gigi. Hal ini akan menyebabkan terjadi demineralisasi email, dan email akan rusak. Kerusakan ini dapat dicegah dengan menyikat gigi secara teratur. Salah satu cara yang lain adalah menambahkan senyawa fluorida ke dalam pasta gigi. Menyikat gigi dengan pasta gigi yang mengandung fluorida (F-) dapat mengubah senyawa hidroksiapatit menjadi fluoroapatit. Senyawa fluoroapatit, Ca5(PO4)3F(s) memiliki Ksp 3,16×10-60, dengan demikian harga kelarutannya akan lebih kecil dari harga kelarutan hidroksiapatit. Ketika menggosok gigi dengan pasta gigi yang berfluorida terjadi pergantian ion OH- oleh ion F- sehingga membentuk fluoroapatit yang lebih sukar larut dalam suasana asam
dibandingkan dengan hidroksiapatit. Proses tersebut dapat mencegah kerusakan gigi.
5) Terbentuknya Stalaktit dan Stalakmit pada Gua Batu Kapur
Pembentuk utama batu kapur adalah CaCO3, yang merupakan senyawa ionik dengan kelarutan yang rendah, harga Ksp nya sebesar 2,8×10-9. Batuan tersebut mulai terakumulasi di dalam tanah lebih dari 400 juta tahun yang lalu. Berikut ini akan diuraikan mengenai terjadinya gua batu kapur hingga terbentuknya stalaktit dan stalakmit.
Gas CO2 berkesetimbangan dengan larutan CO2 dalam air: H2O(l)
CO2(g) CO2(aq) (1)
Konsentrasi CO2 dalam air sebanding dengan tekanan parsial gas CO2 yang larut dalam air (Hukum Henry).
[CO2(aq)]
∝
PCO2Selanjutnya air permukaan tanah yang mengalir melalui celah-celah di tanah bereaksi dengan CO2 yang terkandung dalam tanah:
CO2(aq) + 2H2O(l) H3O+(aq) + HCO3-(aq) (2) Ketika asam yang terbentuk dari CO2 dengan air bereaksi dengan kapur, maka CaCO3 melarut. Persamaan reaksinya yaitu:
CaCO3(s)+CO2(aq)+H2O(l) Ca2+(aq)+2HCO3-(aq) (3) Maka, reaksi kesetimbangan pada persamaan (3) bergeser ke kanan. Akibatnya, semakin banyak batu yang terkikis membentuk lubang dan dalam ratusan tahun gua mulai terbentuk.
Dalam terowongan bawah tanah, Ca(HCO3)2 melarut. Melalui langit-langit dari gua yang terbentuk, larutan tersebut menetes, bereaksi dengan udara yang mengandung PCO2 lebih rendah dari yang di tanah sehingga CO2(aq) berkurang dari larutan (persamaan 1 bergeser ke kiri). Dari tetesan pada langit-langit tersebut akan membentuk endapan CaCO3 (persamaan 3 bergeser ke kiri). Dalam waktu satu dasawarsa, dari proses tetesan pada langit-langit akan menghasilkan stalaktit, sedangkan yang pertumbuhannya ke atas gua dinamakan stalakmit. Dalam waktu yang lama stalaktit dan stalakmit bertemu membentuk kolom lapisan endapan batu kapur, sehingga lama-lama akan membentuk tiang gua.