IDENTIFIKASI SIFAT AROMA TANAMAN PADI
MENGGUNAKAN MARKA BERBASIS GEN AROMATIK
BAMBANG PADMADI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
ABSTRAK
BAMBANG PADMADI. Identifikasi Sifat Aroma Tanaman Padi Menggunakan
Marka Berbasis Gen Aromatik. Dibimbing oleh DJAROT SASONGKO
HAMISENO dan TRI JOKO SANTOSO.
Padi sebagai komoditi dasar dapat dibedakan menjadi padi aromatik dan
nonaromatik. Perbedaan tersebut didasarkan pada delesi gen pada kromosom 8.
Metode konvensional seperti pengecapan merupakan metode yang sering
digunakan untuk mendeteksi sifat aroma padi. Marka molekuler berbasis gen
merupakan metode baru untuk identifikasi padi aromatik secara akurat dan
mempersingkat waktu analisis. Tujuan penelitian ini untuk membedakan jenis
padi varietas aromatik dan nonaromatik menggunakan marka molekuler berbasis
gen aromatik. Materi genetik padi berupa DNA diisolasi menggunakan metode
CTAB dengan cara memecah dinding sel dan mengeluarkan isi sel serta
mengendapkan bagian DNAnya. Amplifikasi DNA dilakukan dengan mesin PCR
menggunakan primer yang spesifik terhadap sekuen DNA padi aromatik dan
hasilnya diperiksa dengan elektroforesis gel agarosa 1.5 %. Amplifikasi
menggunakan primer Bradbury menghasilkan ukuran pita 580 bp dan 355 bp
untuk padi nonaromatik serta 580 bp dan 257 bp untuk padi aromatik. Hasil
penelitian menunjukkan bahwa pola pita DNA padi aromatik dan nonaromatik
menggunakan primer Bradbury tidak seluruhnya dapat dibedakan. Pola pita yang
dapat dibedakan adalah varietas Mentik Wangi dan Gunung Perak. Sedangkan
hasil amplifikasi menggunakan primer RM223 dapat membedakan pola pita padi
aromatik dan nonaromatik dengan ukuran pita sebesar 120 bp-160 bp.
ABSTRACT
BAMBANG PADMADI. Identification of Rice Aromatic Properties Using
Molecular Aromatic Gene-based Marker. Under the direction of DJAROT
SASONGKO HAMISENO and TRI JOKO SANTOSO.
Rice as a basic commodity can be distinguished between aromatic and
nonaromatic. Its different based on gene deletion at chromosom 8. Conventional
methods like assessment was method which frequently uses to detect aromatic
characteristic of rice. Molecular gene based marker was new method to identify
aromatic rice accurately and shorthen analyzing time. The purpose of this research
is to distinguish the type of aromatic and nonaromatic variety using aromatic
gene-based marker. DNA as rice genetic material was isolated from leaves using
CTAB method which broke the cell wall and release the components thus
precipitated the DNA. DNA amplification conducted by PCR machine using
specific aromatic primer and the result verified by 1.5 % gel agarose
electrophoresis. The result of Bradbury primer obtained size of band about 580
bp and 355 bp for nonaromatic, also 580 bp and 257 bp for aromatic. Mentik
Wangi and Gunung Perak variety could distinguish to band pattern. Furthermore,
RM223 primer can be differentiate both of patterns of aromatic and nonaromatic
rice by the band size about 120 bp to 160 bp.
IDENTIFIKASI SIFAT AROMA TANAMAN PADI
MENGGUNAKAN MARKA BERBASIS GEN AROMATIK
BAMBANG PADMADI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
Jud
ul: Identifikasi Sifat Aroma Tanaman Padi Menggunakan Marka
Berbasis Gen Aromatik
Nama
:
Bambang
Padmadi
NRP
:
G84053003
Disetujui
Komisi Pembimbing
Drs. Djarot Sasongko H.S., M.S.
Dr. Tri Joko Santoso
Ketua
Anggota
Diketahui
Dr. drh. Hasim, DEA
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
PRAKATA
Puji syukur penulis panjatkan ke hadirat Allah SWT atas segala nikmat dan
karunia Nya, sehingga penulis dapat menyelesaikan usulan penelitian ini.
Penelitian ini telah dilaksanakan di Laboratorium Biologi Molekuler, Kelompok
Peneliti Biologi Molekuler, Balai Besar Penelitian dan Pengembangan
Bioteknologi dan Sumber Daya Genetik Pertanian (BB Biogen) dari bulan Maret
sampai Juni dengan judul Identifikasi Sifat Aroma Tanaman Padi Menggunakan
Marka Berbasis Gen Aromatik.
Terima kasih penulis ucapkan kepada Drs. Djarot Sasongko HS, MS. dan
Dr. Tri Joko Santoso atas bimbingan dan saran-saran yang diberikan. Terima
kasih juga penulis sampaikan kepada dosen-dosen biokimia, staf biokimia dan
peneliti BB Biogen atas semua bantuannya. Ucapan terima kasih disampaikan
kepada Kartika Findy yang selalu membantu pencarian pustaka untuk penulisan
skirpsi ini. Ucapan terima kasih disampaikan pula kepada Aderama Ilhami dan
Nurani Pertiwi sebagai rekan kerja yang banyak membantu dalam kegiatan
penelitian.
Penghargaan setinggi-tingginya penulis sampaikan kepada kedua orang tua
dan kakak tercinta atas perhatian, kasih sayang dan doanya. Semoga karya ilmiah
ini bermanfaat bagi para pembaca dan bagi ilmu pengetahuan khususnya bidang
biokimia.
Bogor, Agustus 2009
RIWAYAT HIDUP
Penulis dilahirkan di Wonogiri, Jawa Tengah pada tanggal 29 Desember
1986 dari ayahanda Martoswito dan ibunda Sakem. Penulis merupakan anak ke
empat dari empat bersaudara. Tahun 2005 penulis lulus dari SMU Negeri 1
Wonogiri dan pada tahun yang sama lulus seleksi masuk Institut Pertanian Bogor
(IPB) melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) pada
Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam
(FMIPA).
Selama mengikuti perkuliahan, penulis pernah mengikuti kegiatan Praktik
Lapangan di Laboratorium Mikrobiologi PT Frisian Flag Indonesia (PT FFI)
Jakarta selama periode Juli sampai dengan Agustus 2008 dengan judul Kontrol
Mutu Susu Bubuk terhadap Bakteri
Staphylococcus aureus
. Disamping itu penulis
aktif menjadi pengurus himpunan profesi (Himpro) Biokimia,
Community of
Research and Education in Biochemistry
(CREBs), pada Departemen
Pengembang Sumber Daya Mahasiswa (PSDM) periode 2006/2007 dan periode
2007/2008. Penulis juga pernah menjadi asisten praktikum Biokimia Umum untuk
Mahasiswa S1 departemen Biologi dan Teknologi Hasil Perikanan, serta asisten
praktikum mata kuliah Biokimia Klinis untuk mahasiswa S1 Biokimia tahun
ajaran 2008/2009. Penulis juga aktif sebagai pengajar (I-Smart) bimbingan belajar
PRIMAGAMA
TMuntuk mata pelajaran Matematika SD, SMP, dan SMA dari
tahun 2007 sampai sekarang.
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ...
1
TINJAUAN PUSTAKA
Padi Aromatik dan Nonaromatik.
... 1
Metode deteksi Padi Aromatik dan Nonaromatik
... 3
Marka
Molekuler
... 4
Polymerase Chain Reaction
(PCR) ... 5
Elektroforesis
... 6
BAHAN DAN METODE
Bahan
dan Alat
... 7
Metode
Penelitian
... 7
HASIL DAN PEMBAHASAN
Uji Kualitas DNA Padi
... 9
Amplifikasi DNA Menggunakan Primer Bradbury ... 10
Amplifikasi DNA dengan Kombinasi Primer
... 11
Amplifikasi DNA dengan Primer RM223 ... 11
SIMPULAN DAN SARAN ... 11
DAFTAR PUSTAKA ... 12
DAFTAR TABEL
Halaman
1 Perbandingan sifat-sifat morfologik dan fisiologik ras padi ... 2
2 Sekuen dan nama primer ... 6
3 Pengukuran konsentrasi dan kemurnian DNA ... 9
DAFTAR GAMBAR
Halaman
1 Contoh varietas padi aromatik dan nonaromatik ...
2
2 Perbandingan sekuen DNA padi aromatik dan nonaromatik ... 3
3 Tahapan amplifikasi DNA ...
6
4 DNA belum dimurnikan ... 10
5 DNA sudah dimurnikan . ... 10
6 Pola amplifikasi, kombinasi primer, dan ukuran ... 10
7 Pola pita DNA menggunakan primer Bradbury ... 11
8 Pola pita DNA menggunakan kombinasi primer ... 12
9 Pola pita DNA menggunakan primer RM223 ... 12
DAFTAR LAMPIRAN
Halaman
1 Tahapan alur penelitian ... 15
2 Isolasi DNA Daun Padi Menggunakan Metode CTAB ... 16
1
PENDAHULUAN
Padi merupakan tanaman pangan penting yang ditanam hampir sepertiga dari jumlah total bahan pangan di dunia. Padi juga menyediakan bahan pangan pokok dan 35-60% kalorinya dikonsumsi lebih dari 2.7 milyar penduduk dunia. Sekitar 80% total jumlah padi yang ditanam, 55% merupakan padi lahan sawah irigasi dan 25% sisanya adalah padi tadah hujan yang berada pada dataran rendah (Gorantla et al 2005). Kebutuhan beras nasional pada tahun 2007 mencapai 30,91 juta ton dengan asumsi konsumsi per kapita rata-rata 139 kg per tahun. Indonesia dengan rata-rata pertumbuhan penduduk 1,7 persen per tahun dan luas areal panen 11,8 juta hektar dihadapkan pada ancaman rawan pangan pada tahun 2030 (Pasaribu 2006).
Ketahanan pangan merupakan program utama pemerintah untuk mencukupi kebutuhan pangan seluruh penduduk. Program tersebut meliputi ketersediaaan dan keterjangkauan pangan dalam jumlah cukup serta bermutu. Target dari program ketahanan pangan adalah meningkatkan produksi padi nasional agar seluruh kebutuhan beras dapat dipenuhi dari dalam negeri. Usaha peningkatan produksi padi dilakukan dengan peningkatan produktivitas padi di daerah yang belum optimal. Kendala yang ditemui dalam usaha peningkatan produktivitas padi tersebut adalah terbatasnya terobosan teknologi baru khususnya varietas unggul serta alih fungsi lahan subur untuk kepentingan industri, perumahan dan penggunaan lahan non pertanian lainnya (Krisnamurthi 2006).
Kualitas jenis padi akan berpengaruh pada selera makan masyarakat. Secara umum masyarakat akan berusaha memilih kualitas jenis padi yang baik. Salah satu parameter yang menjadi tolak ukur pemilihan kualitas jenis padi adalah sifat aroma pada padi. Sifat aroma ini merupakan salah satu keunggulan jenis padi. Namun demikian, masyarakat masih merasa kesulitan dengan terbatasnya jenis padi aromatik pada pasaran. Hal tersebut disebabkan oleh mahalnya padi aromatik karena padi tersebut hanya bisa ditanam pada kondisi tanah tertentu atau hanya dapat ditanam pada daerah tertentu (Bradburyet al
2005).
Perkembangan teknik biologi molekuler yang semakin pesat dapat menjadi solusi terhadap kendala pengembangan
produktivitas padi serta mempermudah pekerjaan analisis sampai pada tahap molekuler. Marka molekuler (penanda molekuler) merupakan salah satu contoh perkembangan teknik biologi molekuler. Bradbury et al. (2005) telah berhasil mengidentifikasi padi aromatik dan nonaromatik berdasarkan marka molekuler berbasis gen badh2. Gen badh2 merupakan gen penyandi aroma wangi yang terdapat pada padi aromatik. Deteksi dini untuk membedakan jenis padi aromatik dan nonaromatik sangat diperlukan pada pembibitan. Hal tersebut sangat membantu peneliti dan petani dalam menentukan jenis padi yang akan ditanam secara tepat. Adanya perbedaan gen pada sekuen padi aromatik dan nonaromatik dapat digunakan untuk deteksi jenis padi tersebut.
TINJAUAN PUSTAKA
Padi Aromatik dan NonaromatikMenurut Tjitrosoepomo (1923), tanaman padi (Oryza sativa L.) diklasifikasikan dalam Divisi Spermatophyta, Sub Divisi Angiospermae, Class Monocotyledone, Ordo Poales/Glumiflorae, Famili Graminae, Genus Oryza, dan Spesies Oryza sativa.
Menurut Manurung dan Ismunadji (1999), akar tanaman padi digolongkan ke dalam tipe akar serabut. Akar primer (radikula) yang tumbuh sewaktu berkecambah selanjutnya akan digantikan oleh akar adventif. Menurut Harahap et al. (1993) daun tanaman padi tumbuh berselang-seling pada batang, satu daun pada tiap buku. Tiap daun terdiri atas (1) helai daun; (2) pelepah daun yang membungkus ruas.; (3) telinga daun (auricle); (4) lidah daun (ligule). Daun teratas disebut daun bendera. Batang terdiri atas beberapa ruas yang dibatasi oleh buku. Daun dan tunas (anakan) tumbuh pada buku. Pada permulaan stadia tumbuh hanya terdiri atas pelepah-pelepah daun dan ruas yang tertumpuk padat.
Secara umum padi dapat tumbuh di daerah tropis/subtropis pada 45° LU sampai 45° LS dengan curah hujan yang baik adalah 200 mm/bulan atau 1500-2000 mm/tahun. Di dataran rendah padi tumbuh pada ketinggian 0-650 m dpl dengan temperatur 22-27 °C sedangkan di dataran tinggi 650-1500 meter dpl dengan temperatur 19-23 °C. Tipe pertumbuhan padi adalah tegak dan merumpun. Umur berbunganya beragam
2
antara 70-75 hari setelah tanam (HST) tergantung varietasnya. Pembungaan dipengaruhi oleh lama penyinaran dan suhu. Biasanya terjadi pada hari cerah antara jam 10-12 dengan suhu berkisar antara 30-32 °C. Waktu pemasakan kariopsis menjadi benih dan siap untuk dipanen hasilnya ± 25 hari setelah penyerbukan dan tergantung varietas. Umur padi antar varietas beragam, rata-rata umur padi 100-150 HST. Padi yang berumur 100 HST tergolong genjah, 116-125 HST tergolong setengah genjah, 126-135 HST tergolong setengah dalam, 135-150 HST tergolong dalam dan lebih dari 150 HST tergolong dalam sekali (Siregar 1981).
Dari sekian banyak spesies padi,
Oryza sativaL merupakan salah satu spesies yang dibudidayakan di Asia sedangkan
Oryza glaberrima steund adalah salah satu yang dibudidayakan di Afrika (Manurung & Ismunadi 1999). Berdasarkan pengamatan dan studi yang dilakukan oleh Lu dan Chang (1980) disimpulkan bahwaOryza sativa dan
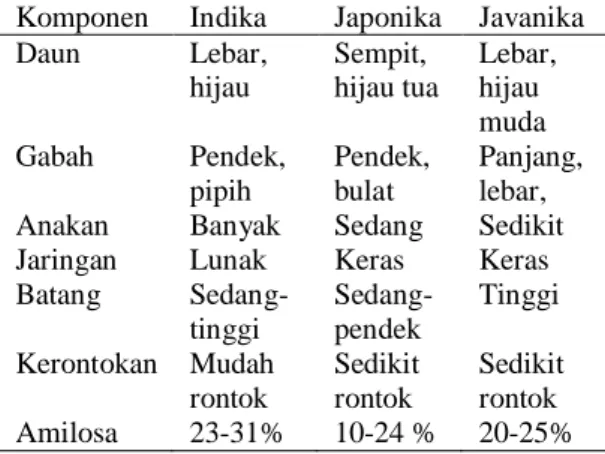
Oryza glaberrima berasal dari leluhur yang sama, yaitu Oryza perenis Moench. Proses evolusi kedua spesies tersebut berkembang menjadi tiga ras ekogeografik, yaitu Indika, Japonika, dan Javanika. Masing-masing ras memiliki beberapa varietas, di antaranya: (1) varietas Cisadane, Gajah Mungkur, Membramo, dan IR64 termasuk ke dalam ras Indika, (2) varietas Nipponbare, Tsukinohikari, Asonohikari, dan Koshikari termasuk ke dalam ras Japonika, (3) varietas Rojo lele, Ciherang, dan Pandanwangi termasuk ke dalam ras Javanika. Perbedaan ketiga ras tersebut dapat dilihat pada Tabel 1. Secara umum sifat-sifat padi tersebut berbeda pada setiap rasnya. Perbedaan tersebut meliputi warna daun, gabah, jumlah anakan, jaringan batang, kerontokan, serta kandungan amilosa.
Tabel 1 Perbandingan beberapa sifat-sifat morfologik dan fisiologik ras padi Komponen Indika Japonika Javanika Daun Lebar, hijau Sempit, hijau tua Lebar, hijau muda Gabah Pendek, pipih Pendek, bulat Panjang, lebar, Anakan Banyak Sedang Sedikit Jaringan Lunak Keras Keras Batang Sedang-tinggi Sedang-pendek Tinggi Kerontokan Mudah rontok Sedikit rontok Sedikit rontok Amilosa 23-31% 10-24 % 20-25%
Padi aromatik merupakan bagian kecil yang istimewa dari kelompok padi karena memiliki mutu beras yang baik. Mutu beras (terutama mutu kimia beras), suatu varietas sangat mempengaruhi penerimaan petani dan luas areal tanam varietas tersebut. Beras dengan mutu kimia yang baik, yaitu aromatik dan tekstur nasi pulen sangat disukai oleh konsumen dan mempunyai harga yang tinggi. Oleh karena itu, selain produksi tinggi, meningkatkan mutu beras pada varietas unggul baru merupakan salah satu tujuan utama para pemulia tanaman (Krishnan & Okita 1986). Varietas padi jenis aromatik terdiri atas varietas Sintanur, Gilirang, Pulu Mandoti, Pare Bau, Gunung Perak, Pinjan, Celebes, Pandan Wangi, Pare Kembang, Rojo Lele, Cianjur, Mentik Wangi Kristal, Mentik Wangi Susu, dan Situ Patenggang. Sedangkan untuk varietas nonaromatik contohnya adalah Ciherang, IR64, Niponbare, T309, Fatmawati, Situ Bagendit, Andel Rojo, Andel Lombok (beras merah) untuk tepung, dan Andel Lombok (beras merah) untuk konsumsi langsung. Penampakan fisik dari padi aromatik dan nonaromatik ditunjukkan oleh Gambar 1.
Aroma pada padi disebabkan oleh senyawa kimia yang mudah menguap. Hasil penelitian menunjukkan lebih dari 114 senyawa terdapat pada padi aromatik (Buterry et al. 1983). Namun demikian, senyawa utama yang menyebabkan aroma wangi pada padi adalah 2-asetil-1-pirolin (Butteryet al. 1983; Paule & Powers 1989). Hasil yang sama diperoleh Linet al. (1990) yang menyimpulkan bahwa 2-asetil-1-pirolin merupakan penyebab aroma wangi yang khas pada beras. Padi aromatik mengandung senyawa 2-asetil-1-pirolin lebih tinggi (0,04-0,07 ppm) dibanding padi nonaromatik (0,004-0,006 ppm) (Adijonoet al. 1993). Hal yang sama dikemukakan oleh Buttery et al. (1983) bahwa kandungan senyawa 2-asetil-1-pirolin padi aromatik mencapai 0,04 – 0,09 ppm, sepuluh kali jauh lebih tinggi dibanding beras nonaromatik yang hanya 0,004 – 0,006 ppm. Kandungan 2-asetil-1-pirolin padi aromatik 15 kali lebih besar dibanding dengan padi nonaromatik. Sifat aroma padi aromatik tidak hanya dapat dicium pada nasi. Seringkali aroma dapat tercium saat tanaman padi berbunga di lahan. Aroma tersebut juga dapat dicium pada butir padi yang baru dipanen, beras, daun, batang, serta bunga padi (Mittalet al. 1995).
3
Gambar 1 Contoh padi nonaromatik varietas Ciherang dan padi aromatik varietas Pandanwangi (Manurung & Ismunadi 1999)
Studi genetik awal kelompok Ahn et al. (1992) berhasil menemukan gen yang mengendalikan sifat aroma pada lengan panjang dari kromosom 8. Hasil penelitian Bradburyet al. (2005) lebih mempersempit wilayah genom untuk sifat aroma yang disandikan oleh gen resesif. Dengan kata lain, padi aromatik dan nonaromatik mempunyai perbedaan susunan gen. Perbedaan tersebut dapat dilihat pada Gambar 2. Varietas padi non aromatik Nipponbare dan 93-11 (Gambar 2) menunjukkan sekuen lengkap pada kromosom 8, sedangkan padi varietas aromatik Azucena dan Basmati terjadi delesi sebanyak 7 basa nitrogen yang diganmbarkan sebagai tanda -. Identifikasi jenis padi tersebut dilakukan dengan beberapa tahap, yaitu: isolasi DNA daun padi, karakterisasi DNA dengan spektrofotometri, amplifikasi DNA dengan PCR, serta visualisasi hasil PCR dengan elektroforesis gel agarosa.
Gambar 2 Perbandingan sekuen DNA pada tanaman padi aromatik dan nonaromatik (Bourgis et al. 2008).
Metode Deteksi Padi Aromatik dan Nonaromatik
Padi aromatik merupakan salah satu sifat istimewa dari kelompok padi karena memiliki mutu beras yang baik. Beras dengan mutu kimia yang baik, yaitu aroma dan tekstur nasi pulen sangat disukai oleh konsumen. Permintaan terhadap padi aromatik terus meningkat setiap tahunnya walaupun harganya relatif lebih mahal bila dibandingkan dengan padi nonaromatik. Oleh karena itu, selain produksi tinggi, peningkatan mutu beras pada varietas unggul baru, juga dibutuhkan metode yang dapat digunakan untuk mengidentifikasi jenis padi aromatik dan nonaromatik.
Penelitian Buttery et al. (1983) mengungkapkan bahwa rasa dan aroma yang terdapat pada jenis padi Basmati dan Jasmine dikaitkan dengan peningkatan 2-asetil-1-pirolin. Sampai saat ini sudah banyak metode yang digunakan untuk mengidentifikasi padi varietas aromatik dan nonaromatik. Metode pertama kali yang digunakan adalah metode panca indera yang meliputi pengecapan /pengunyahan. Metode tersebut telah membantu petani dalam menyeleksi padi aromatik dan nonaromatik. Seleksi padi dengan metode pengecapan memiliki keterbatasan saat memproses sampel dalam jumlah yang banyak. Sebagai contoh, seleksi padi aromatik dan nonaromatik dengan pengecapan merupakan salah satu metode asli untuk menyeleksi kualitas beras varietas aromatik di Australia dan tetap masih merupakan prinsip untuk mengidentifikasi dari berbagai aroma dalam program pemeliharaan di seluruh dunia. Sebuah panel analis digunakan untuk mendeteksi sifat aromatik pada berbagi jenis padi. Untuk setiap individu analis, kemampuan untuk membedakan antara sampel aromatik dan nonaromatik berkurang pada setiap analis karena indera menjadi jenuh atau terjadi kerusakan fisik akibat lecet pada lidah pada saat pengecapan/pengunyahan beras yang keras. Oleh sebab itu, penggunaan metode ini memiliki beberapa kelemahan seperti, pekerjaan yang dilakukan sangat intensif, sulit, subyektif/berbeda pada setiap individu yang melakukan pengujian, dan tidak dapat diandalkan (Badburyet al. 2005).
Identifikasi padi aromatik dan nonaromatik juga dapat dilakukan dengan metode kimia. Metode ini meliputi uji bau yang melibatkan jaringan daun atau butir padi bila dipanaskan dalam air atau dengan Azucena GAAACTGGTA---TATA-TTTCAGCT 22 Basmati GAAACTGGTA---TATA-TTTCAGCT 22 Nipponbare GAAACTGGTAAAAAGATTATGGCTTCAGCT 30 93-11 GAAACTGGTAAAAAGATTATGGCTTCAGCT 30 JC157 GAAACTGGTA---TATA-TTTCAGCT 22 KDM105 GAAACTGGTA---TATA-TTTCAGCT 22 Arias GAAACTGGTA---TATA-TTTCAGCT 22 JC120 GAAACTGGTA---TATA-TTTCAGCT 22 Khao_Kap_Xang_GAAACTGGTA---TATA-TTTCAGCT 22 Azucena GCTCCTATGGTTAAGGTTTGTTT 45 Basmati GCTCCTATGGTTAAGGTTTGTTT 45 Nipponbare GCTCCTATGGTTAAGGTTTGTTT 53 93-11 GCTCCTATGGTTAAGGTTTGTTT 53 JC157 GCTCCTATGGTTAAGGTTTGTTT 45 KDM105 GCTCCTATGGTTAAGGTTTGTTT 45 Arias GCTCCTATGGTTAAGGTTTGTTT 45 JC120 GCTCCTATGGTTAAGGTTTGTTT 45 Khao_Kap_Xang_GCTCCTATGGTTAAGGTTTGTTT 45 Arias and Khao Kap Xang : Tropicaljaponica
JC120:indica
JC157 : isozyme group V (Glaszmann 1987)
4
menggunakan larutan pereaksi KOH atau I2KI. Kelemahan metode ini adalah dapat mengakibatkan kerusakan pada bagian rongga nasal di hidung dan masih bersifat subyektif. Metode lain yang digunakan adalah mengidentifikasi senyawa aromatik yang terdapat pada padi yaitu 2AP (2-asetil-1- pirolin) menggunakan kromatografi gas. Metode ini tidak lagi bersifat subyektif, namun memerlukan jaringan sampel dalam jumlah besar dan memakan waktu analisis yang relatif lama (Lorieuxet al. 1996).
Metode terbaru yang digunakan untuk identifikasi padi aromatik dan nonaromatik adalah menggunakan marka molekuler. Penemuan baru dari sebuah penanda molekular yang digunakan untuk melacak adanya gen penyandi aroma. Penanda molekuler adalah alat yang kuat untuk mempelajari genetik berbagai model yang berhubungan dengan ilmu pertanian. Penanda molekuler digunakan secara luas oleh pemulia tanaman karena menyediakan informasi genetik yang sangat berguna pada tingkat molekuler (Royet al.2006). Selama ini pemanfaatan karakter morfologi masih terbatas untuk identifikasi genotipe saja. Di lain pihak, informasi jarak genetik dan hubungan kekerabatan dari genotipe-genotipe yang diuji sangat diperlukan untuk memilih calon tetua untuk program pemuliaan tanaman. Penanda isoenzim dan molekuler DNA sangat strategis dan sangat diperlukan (Sobiret al. 2008).
Marka molekuler seperti Single Nucleotide Polymorphisms (SNP) dan
Simple Sequence Repeat (SSR) memang mempunyai hubungan dengan gen aromatik dan mempunyai beberapa kelebihan seperti mudah, tidak mahal, metode deteksi cepat, dan hanya membutuhkan sampel jaringan dalam jumlah yang sedikit. Namun demikian marka tersebut hanya berhubungan dengan gen aroma, sehingga tidak dapat digunakan untuk memprediksi satu sampel padi secara akurat (Cordeiro et al 2002). Untuk mengatasi masalah tersebut, dibutuhkan marka molekuler yang dapat membedakan secara lebih spesifik. Marka lain yang digunakan untuk mengidentifikasi padi aromatik dan nonaromatik adalah marka berbasis gen badh2. Marka ini dapat langsung membedakan padi aromatik dan nonaromatik berdasarkan ukuran gen. Padi aromatik dan nonaromatik dibedakan berdasarkan delesi gen pada kromosom 8 yang menyebabkan padi mempunyai sifat aroma (Badburyet al. 2005).
Marka Molekuler
Perkembangan ilmu pengetahuan yang sangat pesat dewasa ini, memungkinkan saling menunjangnya perkembangan berbagai disiplin ilmu pengetahuan. Beberapa kemajuan tersebut antara lain adalah perkembangan ilmu biologi molekuler yang memungkinkan diperolehnya suatu marka (penanda) gen yang mengendalikan karakter target perbaikan dalam program pemuliaan tanaman. Kemajuan ilmu pengetahuan yang dicapai tersebut selanjutnya dimanfaatkan untuk meningkatkan efisiensi dan efektifitas dari seleksi. Penemuan teknik perolehan gen yang mengendalikan suatu karakter sebagai penanda atau marker molekuler, sangat membantu proses seleksi dalam hal efektifitas maupun efisiensi dari pelaksanaan seleksi yang akan dilakukan. Marka molekuler berdasarkan polimorfisme yang terdeteksi pada tingkat makro molekul di dalam sel (Gupta et al 1999). Salah satu fungsi marka molekuler (penanda molekuler) adalah untuk menyeleksi sifat yang diinginkan dari keturunan hasil persilangan. Metode ini melakukan pelacakan sifat-sifat tanaman berdasarkan DNA yang dimiliki tanaman. Salah satu kelebihan dari metode ini adalah mempersingkat pengujian tanaman. Jika dengan cara konvensional diperlukan waktu sedikitnya lima tahun, dengan cara ini hanya diperlukan waktu paling lama tiga tahun. Dengan marka molekuler, pada generasi ketiga tanaman hasil persilangan sudah stabil (Widodo 2003).
Penggunaan marka molekuler memiliki potensi untuk digunakan sebagai penanda dalam melakukan seleksi. Asumsi yang digunakan dalam penggunaan marka molekuler adalah marka molekuler yang digunakan tersebut harus berkorelasi yang sangat kuat dengan karakter yang menjadi target seleksi. Dengan demikian maka pelaksanaan seleksi dapat dilakukan lebih efisien dan efektif. Untuk mengetahui korelasi antara marka molekuler dengan karakter target seleksi, maka perlu dilakukan pengujian-pengujian sebelumnya untuk menyatakan adanya korelasi yang kuat tersebut. Disamping itu pemilihan jenis marka molekuler yang akan digunakan dalam seleksi perlu mendapatkan pertimbangan, apakah sesuai dengan fasilitas dan materi yang dimiliki untuk melakukan seleksi. Penyiapan atau purifikasi gen target juga sangat menentukan keberhasilan dari
5
seleksi yang dilakukan. Kekeliruan dalam pelaksanaan ini akan menyebabkan kekeliruan atau bias dari program seleksi yang dilakukan (Widodo 2003).
Gupta et al. (1999) mengungkapkan bahwa marka molekuler dibedakan menjadi empat kelompok. Pengelompokan tersebut berdasarkan prinsip dasar dan metodologi dari marka molekuler yang dapat digunakan. Marka molekuler kelompok pertama adalah hibridisasi berdasarkan marka. Dalam kelompok hibridisasi, metode yang dapat digunakan adalah Restriction Fragment Length Polymorphisms (RLFP) dan
Dispersed Repetitive DNA (drDNA). Teknik RFLP merupakan sebuah teknik baru untuk memonitor transfer gen dari sebuah persilangan dan memiliki kemampuan untuk mengklon gen produk yang belum diketahui.
Nearly isogenic lines (NIL) dapat digunakan untuk identifikasi daerah kromosom yang terdapat gen penyandi sifat tertentu. Bagian NIL dihasilkan oleh introgresi gen dari tetua donor ke dalam tetua lainnya secara berulang melalui silang balik. Ahn et al.
(1992) peneliti pertama yang menggabungkan pemanfaatan dari penanda molekuler RFLP dengan NIL untuk menemukan gen pengendali sifat aroma dalam padi. Mereka menemukan bahwa gen tersebut terletak di kromosom 8 dengan jarak 4,5 cM (sentimorgan) dari penanda RG28 menggunakan RFLP (Lang & Buu 2008).
Kelompok kedua adalah PCR berdasarkan marka. Marka molekuler kelompok PCR yang sering digunakan adalah metode yang menggunakan sepasang primer dan primer tunggal, Random Amplified Polymorphic DNA (RAPD),
Amplified Fragment Length Polymorphism
(AFLP),microsatellite, atau SSR, SNP, dan
Sequence Tagged Sites(STS). Teknik AFLP digunakan untuk mendeteksi polimorfisme DNA dan studi taksonomi, identifikasi varietas, pemetaan genetik dan penentuan keanekaragaman konstitusi genetik spesifik dari satu varietas yang memungkinkan untuk mendeteksi perbedaan genetik. Hubungan genetik dan keanekaragaman dapat diidentifikasi dengan penanda AFLP (Sobir
et al. 2008).
Kelompok ketiga adalah marka molekuler berdasarkan PCR yang dilanjutkan dengan hibridisasi. Marka molekuler yang diperoleh dari PCR yang dilanjutkan hibridisasi dilakukan dengan teknik fingerprinting oligonukleotida
menggunakan fragmen RAPD. Kelompok keempat adalah sekuensing dan chip DNA berdasarkan marka. Kelompok marka ini dapat dilakukan menggunakan gel sebagai dasar untuk mendapatkan hasil PCR untuk deteksi SNP dan menggunakan bukan gel sebagai dasar mendapatkan hasil PCR untuk deteksi SNP.
Polymerase Chain Reaction(PCR)
Polymerase Chain Reaction (PCR) merupakan teknik sederhana yang digunakan untuk memperbanyak molekul DNA secara invitro di dalam laboratorium. Hasil perbanyakan molekul DNA sangat banyak, karena jumlah perbanyakan molekul DNA bertambah secara eksponensial. Oleh sebab itu, ribuan molekul DNA dapat dibuat dalam waktu yang singkat. PCR dapat diaplikasikan dalam analisis genetik, seperti: diagnosis medis, dan forensik. PCR merupakan metode yang sangat sensitif sehingga dari satu pasang molekul DNA dapat diperbanyak menjadi jutaan kali lipat setelah 30-40 siklus PCR. Adapun komponen yang dibutuhkan dalam reaksi PCR adalah DNA target, primer, DNA polimerase, dinukleotida (dNTP), dan bufer PCR (Mullis 1990). PCR banyak digunakan untuk banyak keperluan, karena memiliki beberapa keuntungan diantaranya cepat, memerlukan DNA dalam jumlah yang sedikit, dan dapat dilakukan pada tahap dini dengan teknik isolasi DNA sederhana. Hal-hal yang mempengaruhi keberhasilan dalam reaksi PCR adalah sekuen primer, dNTP, enzim polymerase, dan suhu annealing
(Muladno 2002; Graham 1997).
Reaksi PCR secara umum dilakukan dalam empat tahap. Molekul DNA rantai ganda akan diurai menjadi molekul tunggal dengan pemanasan. Primer akan menempel pada molekul DNA rantai tunggal pada tempat yang sudah ditentukan. Selanjutnya enzim polimerase akan memperpanjang primer dengan basa nitrogen yang tersedia. Tahapan tersebut merupakan cara untuk menggandakan molekul DNA yang diinginkan (Mullis 1990). Tahap peleburan (melting) atau denaturasi merupakan tahap awal reaksi yang berlangsung pada suhu tinggi, yaitu 94–96 °C sehingga ikatan hidrogen DNA terputus atau terdenaturasi dan DNA menjadi berutas tunggal. Biasanya pada tahap awal PCR tahap ini dilakukan agak lama (sampai 5 menit) untuk memastikan semua utas DNA terpisah.
6
Pemisahan ini menyebabkan DNA tidak stabil dan siap menjaditemplate bagi primer. Tahap kedua adalah penempelan atau
annealing. Primer menempel pada bagian DNA template yang komplementer urutan basanya. Hal ini dilakukan pada suhu antara 45–60°C. Penempelan ini bersifat spesifik. Suhu yang tidak tepat menyebabkan tidak terjadinya penempelan atau primer menempel di sembarang tempat. Tahap ketiga adalah pemanjangan atau elongasi. Suhu untuk proses ini tergantung dari jenis DNA-polimerase yang dipakai. Proses ini biasanya menggunakan Taq-polimerase dan dilakukan pada suhu 72 °C. Durasi tahap ini biasanya 1 menit. Setelah tahap 3, siklus diulang kembali mulai tahap 1. Tahap 4 menunjukkan perkembangan yang terjadi pada siklus-siklus selanjutnya. Akibat denaturasi dan renaturasi, beberapa utas baru menjadi template bagi primer lain dan akhirnya terdapat utas DNA yang panjangnya dibatasi oleh primer yang dipakai. Jumlah DNA yang dihasilkan berlimpah karena penambahan terjadi secara eksponensial. Tahapan amplifikasi DNA dapat dilihat pada Gambar 3.
PCR adalah suatu metode in vitro
untuk mengamplifikasi sejumlah fragmen DNA tertentu (Muladno 2002), dengan cara replikasi DNA dengan bantuan enzim DNA polymerase dan perubahan sifat DNA terhadap suatu suhu (Lisdayanti 1997). Dalam sistem transformasi, teknik ini dapat digunakan untuk membuktikan keberadaan gen yang diintroduksikan.
Bradbury et al. (2005) melaporkan bahwa letak amplifikasi gen padi aromatik dan nonaromatik seperti pada Gambar 4. Terlihat bahwa ukuran/panjang gen padi aromatik berbeda dengan padi nonaromatik. Dengan demikian akan terdapat pola pita yang berbeda pada visualisasi hasil PCR dengan elektroforesis gel agarosa. Panjang gen dan susunan gen yang berbeda antara padi aromatik dan nonaromatik dapat membantu amplifikasi DNA dengan primer yang spesifik. Bradbury et al. (2005) juga melaporkan bahwa primer yang berhasil digunakan untuk membedakan amplifikasi gen DNA padi aromatik dan nonaromatik adalah External Sense Primer (ESP),
External Antisense Primer (EAP), Internal Fragrant Antisense Primer (IFAP), dan
Internal Non-fragrant Sense Primer(INSP). Susunan lengkap primer yang digunakan dapat dilihat pada Tabel 2. Dari empat buah primer yang digunakan tersebut, akan
dihasilkan dua buah pita dengan ukuran yang berbeda pada setiap varietasnya. Lang dan Buu (2008) juga melaporkan primer lain yang dapat membedakan padi aromatik dan nonaromatik. Primer yang digunakan oleh Lang dan Buu (2008) adalah primer RM223.
Gambar 3 Tahapan amplifikasi DNA pada PCR (Mullis 1990)
Tabel 2 Sekuen dan nama primer yang digunakan pada analisis padi aromatik (Bradburyet al. 2005)
Elektroforesis
Elektroforesis adalah satu teknik pemisahan senyawa berdasarkan kecepatan migrasi yang bermuatan listrik di bawah pengaruh medan listrik. Elektroforesis digunakan untuk menentukan komposisi protein dari suatu produk makanan. Elektroforesis juga dapat digunakan untuk menentukan ketulenan suatu ekstrak protein. Kegunaan elektroforesis yang lainnya adalah untuk menentukan berat molekul, kemurnian molekul pada suatu bahan, mendeteksi suatu pemalsuan bahan, mendeteksi kerusakan suatu bahan seperti protein dalam pengolahan dan penyimpanan, untuk memisahkan spesies-spesies yang berbeda secara kualitatif, serta pemurnian suatu protein (Nur & Adijuwana 1987).
Elektroforesis gel merupakan salah satu teknik utama dalam biologi molekuler.
Nama Primer Sekuen Primer External Sense Primer (ESP) TTGTTTGGAGCTTG CTGATG Internal Fragrant Antisense Primer (IFAP) CATAGGAGCAGCT GAAATATATACC Internal Non-fragrant Sense Primer (INSP) CTGGTAAAAAGAT TATGGCTTCA External Antisense Primer (EAP) AGTGCTTTACAA AGTCCCGC
7
Prinsip dasar teknik ini adalah molekul DNA, RNA atau protein dapat dipisahkan berdasarkan laju perpindahannya oleh gaya gerak listrik di dalam matriks gel. Laju perpindahan tersebut bergantung pada ukuran molekulnya. Sampel molekul ditempatkan ke dalam sumur pada gel yang ditempatkan di dalam larutan penyangga yaitu TAE (Tris HCl-Acetic acid-EDTA), dan listrik dialirkan sebesar 80 Volt. Molekul-molekul sampel akan bergerak di dalam matriks gel ke arah salah satu kutub listrik sesuai muatannya. RNA dan DNA arah pergerakannya adalah menuju elektroda positif, disebabkan oleh muatan negatif pada rangka gula-fosfat yang dimilikinya (Nur & Adijuwana 1987).
Gel yang digunakan adalah agarosa yang berasal dari ekstrak rumput laut yang telah dimurnikan. Marka atau penanda (marker) yang digunakan pada proses
running merupakan campuran molekul dengan ukuran berbeda-beda yang dapat digunakan untuk menentukan ukuran molekul dalam pita sampel. Ukuran DNA dapat ditentukan dengan menyertakan marka atau penanda yang digunakan pada proses
running. Setelah tahap running selesai, dilakukan metode pewarnaan (staining) dan penghilangan warna (destaining). Metode pewarnaan pada DNA atau RNA merupakan pewarnaan gel agarosa yang dilakukan dengan menggunakan larutan etidium bromida selama 15 menit. Hal ini dilakukan dengan tujuan agar molekul sampel berpendar dalam sinar ultraviolet. Penghilangan warna dilakukan dengan cara gel dimasukkan ke dalam aquades selama 5 hingga 7 menit (Mikkelsen & Corton 1960).
Media pendukung yang digunakan dalam elektroforesis antara lain: kertas/membran selulosa, gel pati, gel poliakrilamida, dan gel agarosa. Media kertas merupakan media paling awal yang digunakan dalam teknik elektroforesis. Media ini digunakan untuk memisahkan protein. Media gel pati terbuat dari ekstrak pati kentang yang dibuat gel. Media tersebut kemudian disempurnakan menjadi gel poliakrilamid dan gel agarosa. Gel poliakrilamid dan agarosa dibedakan berdasarkan ukuran pori pada gel. Gel poliakrilamid yang mempunyai ukuran pori kecil, biasanya digunakan untuk memisahkan protein, molekul RNA, dan molekul DNA dengan ukuran yang sangat kecil. Sedangkan gel agarosa yang memiliki pori relatif lebih besar dari gel poliakrilamid,
biasanya digunakan untuk memisahkan molekul DNA yang ukurannya lebih besar (Mikkelsen & Corton 1960).
BAHAN DAN METODE
Bahan dan AlatBahan-bahan yang digunakan adalah padi (daun padi) varietas aromatik (Pandan Wangi, Pulu Mandoti, Mentik Wangi, Sintanur, Pare Kembang, Gunung Perak, Gilirang, Rojo Lele), padi varietas nonaromatik (Ciherang, IR64, Niponbare, T309, Fatmawati), bufer ekstrak yang mengandung sodium dodesil sulfat (SDS),
lauryl sarcosine, NaCl, Tris-HCl, dan etilendiamin tetraasetat (EDTA), untuk isolasi DNA. Bahan lain yang digunakan untuk isolasi DNA adalah isopropanol, etanol 70%, bufer tris-EDTA (TE) yang mengandung RNAse. Bahan yang digunakan pada reaksi PCR adalah 1x bufer PCR (10 mM Tris-HCl (pH 8,3), 50 mM KCl, 1,5 mM KCl, 1,5 mM MgCl2, 0,01% Gelatin), dNTP (dATP, dCTP, dGTP, dTTP), primer Bradbury (ESP, EAP, IFAP, dan INSP) primer RM223, DNA, dan Taq DNA polimerase. Bahan lain yang digunakan adalah gel agarosa, etidium bromida (etbr), dan DNA standar yang digunakan pada analisis elektroforesis.
Alat-alat yang digunakan untuk isolasi DNA yaitu tabung mikro, seperangkat mortar, tip pipet mikro, satu set pipet mikro, vorteks, sentrifus, dan inkubator. Alat yang digunakan untuk cek kualitas DNA adalah spektrofotometer dan seperangkat alat elektroforesis. Seperangkat alat dokumentasi gel (chemidoc gel system) digunakan untuk visualisasi hasil elektroforesis.
Metode Penelitian
Isolasi DNA Genom Padi
Bibit padi yang telah berumur 3 minggu diisolasi DNA-nya dengan metode CTAB yang mengacu pada metode Doyle dan Doyle (1987). Sebanyak lebih kurang 0.5 gr daun padi dimasukkan ke dalam mortar steril. Ke dalam mortar ditambahkan sebanyak 1000 µl (2 x 500µl) bufer ekstraksi. Sampel hasil gerusan dimasukkan ke dalam tabung mikro 2 ml, kemudian diinkubasi di dalam penangas air pada suhu 65 C selama 15 menit. Selama inkubasi sampel dibolak-balik setiap 5 menit sekali. Setelah inkubasi selesai, sampel didiamkan pada suhu ruang selama beberapa saat,
8
kemudian ditambahkan sebanyak 100 µl natrium asetat 3M dan 1000 µl pelarut kloroform isoamilalkohol (Chisam). Campuran larutan pada tabung mikro digoyang-goyang perlahan untuk menghomogenkan semua larutan.
Tabung mikro yang berisi campuran kemudian disentrifugasi pada kecepatan 10.000 g selama 5 menit. Sebanyak lebih kurang 600 µl supernatan (larutan di lapisan atas) dipindahkan ke tabung mikro 2 ml yang baru. Supernatan yang sudah dipindahkan kemudian ditambahkan dengan natrium asetat 3 M sebanyak 60 µl dan larutan isopropanol sebanyak 400 µl. Campuran larutan kemudian digoyang-goyang perlahan untuk menghomogenkan campuran larutan. Tabung disentrifuguasi pada kecepatan 10.000 g selama 5 menit. Supernatan dibuang, dan endapan DNA (pelet) dicuci dengan 50 µl ethanol 70%. Tabung disentrifugasi lagi pada kecepatan 10.000 g selama 3 menit dan kemudian supernatan dibuang. Endapan DNA dikeringkan menggunakan oven pada suhu 50 ºC selama lebih kurang 10 menit, dan dilarutkan kembali dalam 50 µl bufer TE yang mengandung RNase. Tabung diinkubasi pada 37 ºC selama 30 menit.
Pengukuran Kualitas dan Kuantitas DNA
Ekstrak DNA padi hasil isolasi dihitung konsentrasinya menggunakan alat spektrofotometer. Total volume yang digunakan untuk pengukuran pada spektrofotometer sebanyak 400 µl dan faktor pengenceran yang digunakan sebesar 200 kali. Larutan blanko yang digunakan adalah ddH2O sebanyak 400 µl. Pengukuran konsentrasi DNA dilakukan pada panjang gelombang 260 nm. Sedangkan untuk pengukuran kemurnian DNA dilakukan dengan perbandingan absorban 260/280 (A260/280). DNA yang murni mempunyai A260/280 = 1,8 hingga 2,0. Apabila nilainya kurang dari 1,8 maka sampel DNA masih mengandung kontaminan protein, dan untuk menghilangkannya ditambahkan protease. Apabila nilainya lebih dari 2,0 maka sampel DNA masih mengandung kontaminan RNA, dan untuk menghilangkannya ditambahkan ribonuklease.
Kalibrasi spektrofotometer harus dilakukan sebelum digunakan untuk pengukuran sampel DNA. Sebanyak 400 µl ddH2O dimasukkan ke dalam kuvet lalu dimasukkan ke dalam spektrofotometer dan ditekan tombol read blank untuk kalibrasi.
Sebanyak 2 µl sampel DNA dimasukkan ke dalam kuvet kemudian ditambahkan ddH2O sebanyak 398 µl. Konsentrasi DNA diukur pada panjang gelombang 260 nm dan kemurnian DNA diukur dengan perbandingan absorban 260/280 (OD 260/280). Tahap selanjutnya DNA diencerkan dengan konsentrasi akhir 50 µg/ml untuk proses amplifikasi PCR.
Amplifikasi DNA
Reaksi PCR dilakukan pada 25 µl volume yang mengandung 10 x bufer PCR (10 mM Tris-HCl (pH 8,3) sebanyak 2.5 µl, 1,5 µl MgCl250 mM, 0.5 µl masing-masing dNTP (dATP, dCTP, dGTP, dTTP) 5 mM, 1 µl masing-masing primer Bradbury (ESP, EAP, IFAP, dan INSP) 2 µM, 0.2 µl Taq DNA polimerase, template DNA 50 µg/ml sebanyak 2 µl, dan ditepatkan volumenya menjadi 25 µl dengan ddH2O sebanyak 14.3 µl. Pasangan primer yang digunakan mengikuti seperti yang diuraikan dalam Bradbury et al. (2005). Pasangan primer eksternal EAP dan ESP akan menghasilkan fragmen berukuran 580 sebagai kontrol positif untuk masing-masing sampel. Pasangan primer IFAP dan ESP akan menghasilkan fragmen alel aromatik berukuran 257 bp. Pasangan primer INSP dan EAP akan menghasilkan fragmen alel nonaromatik berukuran 355 bp. Primer lain yang digunakan adalah RM223 (GAGTGAGCTTGGGCTGAAAC dan GAAGGCAAGTCTTGGCACTG). Primer ini membedakan padi varietas aromatik dan nonaromatik berdasarkan ukuran pita DNAnya. Ukuran DNA yang diamplifikasi menggunakan primer ini adalah 120 bp-160 bp (Lang & Buu 2008).
Mesin PCR yang digunakan untuk amplifikasi DNA adalah PCR TETRAD sebanyak 30 siklus. Program PCR yang digunakan sebagai berikut: denaturasi permulaan selama 2 menit pada suhu 94 ºC, denaturasi selama 30 detik pada suhu 94 ºC, proses penempelan primer selama 30 detik pada suhu 58 ºC, dan 45 detik pada suhu 94 ºC untuk perpanjangan primer. Perpanjangan primer terakhir selama 5 menit pada suhu 72 ºC.
Elektroforesis DNA
Gel agarose 1,5 % dibuat dengan cara melarutkan sebanyak 0.45 gr agarosa dengan 30 ml bufer TAE dan dipanaskan dengan
microwave selama lebih kurang 1 menit. Setelah gel agarosa memadat, gel
9
dimasukkan ke dalam tangki elektroforesis yang berisi 1x bufer TAE. Sebanyak 10 µl produk PCR ditambahkan dengan 2 µl
loading dye dan dicampur sempurna, kemudian dimasukkan ke dalam sumur gel. Disertakan 1 kb ladder sebagai marker untuk melihat ukuran DNA. Tahap selanjutnya sampel DNA dialiri arus dengan voltase 80 volt selama 35 menit.
Gel agarosa diwarnai dengan larutan etidium bromida (10 mg/L) selama 10 menit. Tahap ini sering dikenal denganstaining gel
(pewarnaan gel). Tahap selanjutnya adalah
destaining gel (penghilangan warna gel). Tahap ini dilakukan dengan perendaman di dalam air selama lebih kurang 10 menit. Gel agarosa selanjutnya divisualisasi dengan
chemidoc gel system.
HASIL DAN PEMBAHASAN
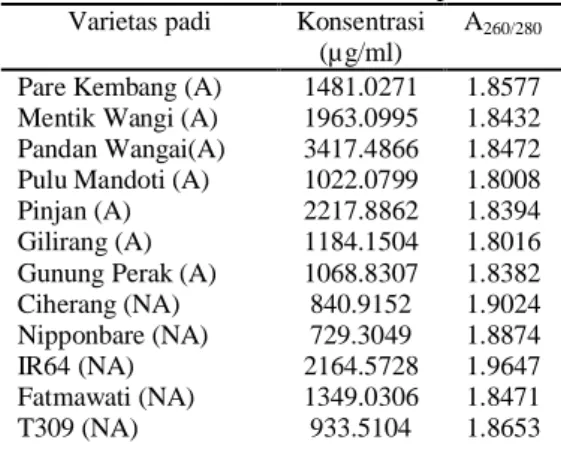
Uji Kualitas DNA PadiIsolasi DNA padi dilakukan dengan menggunakan metode CTAB. Kualitas DNA yang diisolasi tersebut diuji secara kualitatif dan kuantitatif dengan spektrofotometer dan gel agarosa. Data Tabel 3 menunjukkan hasil pengukuran kualitas DNA secara kuantitatif dan kualitatif yang meliputi konsentrasi dan kemurnian DNA. Dari seluruh sampel yang dihitung konsentrasi dan kemurniannya, secara umum konsentrasi DNA hasil isolasi menggunakan metode CTAB memiliki konsentrasi yang relatif besar. Konsentrasi DNA yang diperlukan untuk amplifikasi PCR tidak begitu besar, sehingga konsentrasi DNA yang sudah diperoleh sudah cukup digunakan untuk amplifikasi/perbanyakan DNA dengan mesin PCR. Konsentrasi DNA yang diperoleh dari hasil isolasi tidak seragam (Tabel 3). Oleh sebab itu, konsentrasi DNA yang sudah diperoleh diseragamkan dengan pengenceran. Hal tersebut dilakukan untuk menjamin bahwa jumlah DNA yang akan amplifikasi dengan PCR mempunyai konsentrasi yang sama dengan harapan jumlah amplifikasi DNA juga seragam. Konsentrasi DNA dari seluruh sampel diseragamkan menjadi 50 µg/ml dengan pengenceran. Kemurnian DNA diperoleh dari perbandingan absorban A260/280. Nilai kemurnian DNA berkisar antara 1.8-2.0 (Sambrook & Russell 1989). Nilai kemurnian DNA hasil isolasi sudah sesuai dengan batasan pada literatur.
Tabel 3 Pengukuran Konsentrasi dan Kemurnian DNA daun padi Varietas padi Konsentrasi
(µg/ml)
A260/280 Pare Kembang (A) 1481.0271 1.8577 Mentik Wangi (A) 1963.0995 1.8432 Pandan Wangai(A) 3417.4866 1.8472 Pulu Mandoti (A) 1022.0799 1.8008
Pinjan (A) 2217.8862 1.8394
Gilirang (A) 1184.1504 1.8016 Gunung Perak (A) 1068.8307 1.8382 Ciherang (NA) 840.9152 1.9024 Nipponbare (NA) 729.3049 1.8874
IR64 (NA) 2164.5728 1.9647
Fatmawati (NA) 1349.0306 1.8471
T309 (NA) 933.5104 1.8653
A: aromatik, NA: nonaromatik
Oleh sebab itu, DNA hasil isolasi sudah dapat digunakan untuk amplifikasi PCR karena sudah tidak terkontaminasi polisakarida maupun protein.
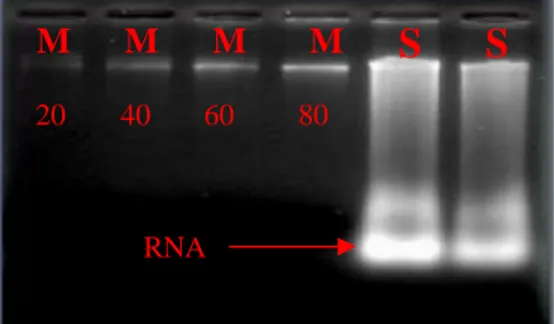
Gambar 4 dan Gambar 5 menunjukkan hasil uji kualitas DNA secara kuantitatif. Hasil tersebut diperoleh dari DNA hasil isolasi yang diuji menggunakan elektroforesis dengan gel agarosa 1.5 %. Gambar 4 menunjukkan DNA hasil isolasi belum murni/masih terkontaminasi RNA. Untuk menghilangkan kontaminasi RNA dilakukan penambahan enzim RNase yang akan mendegradasi RNA. Pola pita hasil elektroforesis yang menunjukkan DNA sudah murni ditunjukkan oleh Gambar 5. Sebagai kontrol positif atau pembanding digunakan DNA lambda yang konsentrasinya sudah diketahui. Konsentrasi DNA lambda yang digunakan adalah 20 ng/µl, 40 ng/µl, 60 ng/µl, dan 80 ng/µl. Konsentrasi DNA lambda ini dapat digunakan untuk menghitung konsentrasi DNA dengan cara membandingkan luas pita hasil elektroforesis. Namun demikian, hal tersebut tidak dilakukan karena pita DNA hasil elektroforesis yang diperoleh terdapat
smear.Smear pita DNA tersebut disebabkan oleh DNA yang diperoleh ada yang terpotong, sehingga pita-pita DNA yang tidak sama ukurannya akan menimbulkan pita smear seperti pada gambar. Dengan demikian, konversi konsentrasi DNA sampel dengan DNA pembanding tidak bisa dilakukan. Pitasmear DNA sampel (Gambar 5) bukan kontaminasi RNA, melainkan pita-pita DNA yang terpotong. Hal tersebut mungkin disebabkan oleh pemipetan berulang-ulang, sehingga DNA akan terpotong.
10
Isolasi DNA daun padi dilakukan menggunakan metode CTAB yang mengacu pada Doyle dan Doyle (1987). Metode ini merupakan protokol isolasi DNA yang paling umum digunakan karena konsentrasi DNA yang diperoleh relatif lebih banyak bila dibandingkan dengan metode yang lain. Keuntungan lain dari metode ini adalah tidak membutuhkan waktu isolasi yang lama serta tahapan metode yang relatif lebih mudah dan cepat. Uji kualitatif dilakukan dengan melihat DNA hasil isolasi pada gel agarosa, sedangkan uji kuantitatif dilakukan menggunakan spektrofotometer yang meliputi konsentrasi dan kemurnian DNA. Uji ini dilakukan untuk menjamin tidak terdapat kontaminasi protein dan polisakarida pada DNA yang diisolasi.
Gambar 4 Kontaminasi RNA pada DNA yang belum dimurnikan. M: marker DNA lambda konsentrasi dalam ng/µl, S: sampel.
Gambar 5 Hasil elektroforesis DNA yang sudah dimurnikan. Marker: DNA lambda konsentrasi dalam ng/µl, Sampel: Nipponbare, IR 64, Fatmawati, T309, Ciherang, Pandan Wangi, Gilirang, Mentik Wangi, Gunung Perak, Pinjan, Pare Kembang, Pulu Mandoti.
Amplifikasi DNA Menggunakan Primer Bradbury
Amplifikasi DNA dilakukan dengan mesin PCR TETRAD. Prinsip kerja alat ini adalah memperbanyak DNA dengan menggunakan DNA sampel sebagai cetakannya. Panjang ukuran DNA yang diamplifikasi dibatasi oleh dua buah primer
spesifik yang sudah ditentukan. Primer yang digunakan untuk ampilfikasi DNA ini diharapkan mampu membedakan secara jelas varietas padi aromatik dan nonaromatik seperti pada penelitian yang dilakukan oleh Bradbury et al. (2005). Penelitian ini menggunakan empat buah primer seperti yang dilakukan pada penelitian Bradburyet al. (2005). Primer Bradbury tersebut adalah
External Sense Primer (ESP) dan External Antisense Primer (EAP) yang merupakan primer eksternal, serta Internal Fragrant Antisense Primer (IFAP) dan dan Internal Non-fragrant Sense Primer (INSP) sebagai internal primer.
Empat buah primer yang digunakan akan menempel secara spesifik pada sekuen DNA padi. Dua primer, EAP dan ESP, akan menempel pada varietas padi aromatik dan varietas padi nonaromatik. Dua buah primer ini digunakan sebagai positif kontrol yang akan menghasilkan ukuran pita DNA kurang lebih sebesar 580 bp (Bradburyet al.
2005). Dua primer lain, IFAP dan INSP, akan menempel secara sepesifik pada salah satu varietas padi saja. Pasangan primer IFAP dan ESP akan menempel pada sekuen padi aromatik dan menghasilkan pita DNA sepanjang 257 bp, sedangkan pasangan primer INSP dan EAP akan menempel pada sekuen padi nonaromatik dan menghasilkan pita sepanjang 355 bp (Bradbury et al.
2005). Pola amplifikasi PCR dengan empat primer tersebut secara jelas digambarkan oleh Bradburyet al. (2005) pada Gambar 6. Pasangan primer ESP dan EAP yang merupakan kontrol positif, akan menghasilkan pita sepanjang kurang lebih 580 bp. Pasangan primer ESP dan IFAP hanya akan menempel pada sekuen DNA padi aromatik dan menghasilkan pita sepanjang 257 bp. Sedangkan pasangan primer EAP dan INSP hanya akan menempel pada padi nonaromatik yang menghasilkan pita sepanjang 355 bp.
Gambar 6 Pola amplifikasi, kombinasi pasangan primer, dan variasi ukuran DNA yang dihasilkan (Bradburyet al. 2005).
RNA
20 40 60 80
11
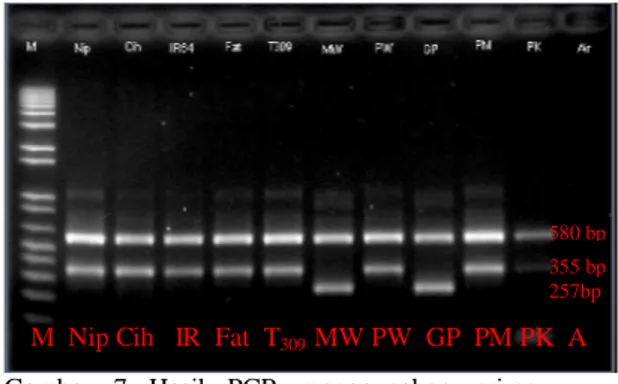
Gambar 7 menyajikan data hasil amplifikasi DNA padi aromatik dan nonaromatik. Varietas padi nonaromatik yang digunakan adalah Nipponbare, Ciherang, IR 64, Fatmawati, dan T309, sedangkan varietas padi aromatik yang digunakan adalah Mentik Wangi, Pandan Wangi, Gunung Perak, Pulu Mandoti, dan Pare Kembang. Hasil amplifikasi yang diperoleh ternyata tidak sepenuhnya sama dengan hasil pada penelitian Bradburyet al.
(2005). Dari lima sampel padi nonaromatik yang diamplifikasi, hasil yang diperoleh menunjukkan bahwa primer Bradbury yang digunakan dapat membedakan padi nonaromatik dan padi aromatik sesuai dengan penelitian yang dilakukan Bradbury
et al. (2005), meskipun tidak pada semua padi aromatik dapat dibedakan. Terdapat dua ukuran fragmen DNA yang berbeda, yaitu pita DNA dengan ukuran 580 bp hasil ampilifikasi pasangan primer ESP dan EAP serta pita yang berukuran 355 bp hasil amplifikasi primer INSP dan EAP. Sedangkan dari lima tanaman padi aromatik yang digunakan sebagai sampel hanya varietas Mentik Wangi dan Gunung Perak saja yang sesuai dengan penelitian Bradbury
et al. (2005) yaitu menghasilkan pola pita yang berukuran 580 bp hasil amplifikasi primer ESP dan EAP serta 257 bp hasil amplifikasi primer ESP dan IFAP. Sementara tiga varietas aromatik yang lain (Pandan Wangi, Pulu Mandoti, Pare Kembang) menghasilkan pola pita yang ukurannya sama dengan padi nonaromatik, yaitu 580 bp dan 355 bp (Gambar 7). Hal tersebut kemungkinan disebabkan oleh perbedaan delesi pada kromosom 8.
Gambar 7 Hasil PCR menggunakan primer Bradbury. Marker: DNA 1 kb, Sampel: Nipponbare, Ciherang, IR 64, Fatmawati, T309, Mentik Wangi, Pandan Wangi, Gunung Perak, Pulu Mandoti, Pare Kembang, Air.
Amplifikasi DNA Menggunakan Kombinasi Primer
Sifat aromatik padi disebabkan adanya senyawa 2-asetil-1-pirolin pada bagian tertentu tumbuhan padi. Senyawa tersebut terbentuk akibat delesi pada kromosom 8 (gen badh2). Fungsi gen tersebut adalah bertanggung jawab terhadap metabolisme senyawa 2-asetil-1-pirolin yang menyebabkan aroma wangi pada padi. Oleh sebab itu, padi aromatik dan nonaromatik dibedakan berdasarkan sekuen DNA yang terdelesi pada kromosom 8 (Bradburyet al.
2005). Delesi kromosom 8 pada sampel padi yang digunakan diduga mempunyai panjang yang tidak sama. Perbedaan panjang delesi tersebut diduga juga berpengaruh terhadap kemampuan gen badh2 dalam mengekspresikan sifat aromatik. Dugaan tersebut diperoleh dari sampel padi aromatik yang digunakan ternyata mempunyai intensitas aroma wangi yang berbeda-beda. Akibat yang ditimbulkan dari perbedaan panjang delesi pada kromosom 8 adalah penempelan primer menjadi tidak spesifik, sehingga ukuran DNA yang diamplifikasi tidak seperti yang diharapkan.
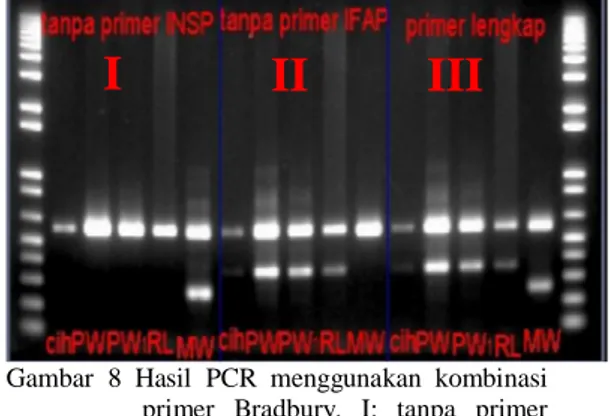
Perbedaan panjang delesi kromosom 8 pada varietas padi aromatik dibuktikan dengan amplifikasi PCR menggunakan kombinasi primer EAP, ESP, IFAP, dan INSP. Gambar 8 menunjukkan data amplifikasi DNA menggunakan kombinasi primer. Pada tahap ini, salah satu primer yang dapat membedakan padi aromatik dan nonaromatik tidak digunakan pada proses amplifikasi PCR. Kolom pertama Gambar 8 menyajikan data amplifikasi PCR tanpa primer INSP, kolom kedua amplifikasi PCR tanpa primer IFAP, dan kolom ketiga amplifikasi PCR dengan primer Bradbury lengkap (EAP, ESP, IFAP, dan INSP).
Amplifikasi PCR tanpa primer INSP seharusnya dapat mengamplifikasi DNA padi aromatik dengan ukuran 580 bp dan 257 bp. Namun demikian, hanya varietas aromatik Mentik Wangi saja yang dapat teramplifikasi, sedang varietas aromatik Pandan Wangi dan Rojo Lele tidak teramplifikasi sama seperti varietas nonaromatik Ciherang. Amplifikasi PCR tanpa primer IFAP, seharusnya tidak dapat mengaplifikasi padi aromatik dan hanya mengamplifikasi padi nonaromatik dengan ukuran 580 bp dan 355 bp. Hasil pada Gambar 8 kolom kedua menunjukkan bahwa padi aromatik varietas Pandan Wangi dan Rojo Lele teramplifikasi sama seperti padi M Nip Cih IR Fat T309MW PW GP PM PK A
580 bp 355 bp 257bp
12
nonaromatik varietas Ciherang, sedangkan padi aromatik varietas Mentik Wangi tidak teramplifikasi. Data Gambar 8 kolom ketiga, memperlihatkan hasil amplifikasi dengan pola yang sama seperti pada Gambar 7.
Gambar 8 Hasil PCR menggunakan kombinasi primer Bradbury. I: tanpa primer INSP, II: tanpa primer IFAP, III: menggunakan primer lengkap, Sampel: Ciherang, Pandan Wangi, Rojo Lele, dan Mentik Wangi.
Amplifikasi DNA Menggunakan Primer RM223
Gambar 9 menunjukkan hasil PCR menggunakan primer RM223. Amplifikasi DNA menggunakan primer ini, dapat membedakan pola pita padi aromatik dan nonaromatik. Primer ini membedakan padi aromatik dan nonaromatik berdasarkan ukuran DNA padi penyandi gen aromatik. Ukuran DNA yang diamplifikasi menggunakan primer ini tidak seragam pada tiap varietasnya. DNA yang diamplifikasi pada padi varietas aromatik mempunyai ukuran DNA yang berbeda-beda, begitu juga pada varietas padi nonaromatik. Namun demikian, primer RM223 dapat digunakan untuk membedakan padi aromatik dan nonaromatik secara jelas. Hal ini sesuai dengan penelitian sebelumnya bahwa ukuran fragmen DNA hasil amplifikasi pada padi aromatik dan nonaromatik oleh primer ini mempunyai variasi panjang fragmen DNA antara 120 bp-160 bp (Lang & Buu 2008). Padi nonaromatik mempunyai ukuran DNA 160 bp (Ciherang) dan 150 bp (IR64 dan Fatmawati), sedangkan pada padi aromatik mempunyai ukuran fragmen DNA hasil amplifikasi sebesar 140 bp (Pandanwangi, Rojolele, Gilirang dan Pulumandoti) dan 120 bp (Sintanur, Mentik Wangi dan Gunung Perak).
Panjang ukuran pita DNA yang diamplifikasi menggunakan primer RM 223 tersebut memperkuat dugaan perbedaan panjang delesi pada kromosom 8 yang telah
diteliti sebelumnya (Lang & Buu 2008). Padi varietas nonaromatik tidak mengalami delesi pada kromosom 8 (Ciherang) atau mengalami delesi namun delesi tersebut tidak sampai merubah sifat nonaromatik menjadi aromatik (IR64 dan Fatmawati). Jadi delesi yang terjadi pada IR64 dan Fatmawati hanya beberapa basa saja (kemungkinan 10 basa), hal ini berdasarkan pada perbedaan ukuran fragmen DNA hasil amplifikasi PCR yang hanya sekitar 10 basa (Gambar 9) dibandingkan dengan padi Ciherang. Sedangkan pada padi-padi aromatik dibedakan dengan padi nonaromatik karena delesi yang terjadi telah merubah sifat nonaromatik menjadi aromatik yaitu sekitar 21 basa atau 7 asam amino (Pandanwangi, Rojolele, Gilirang dan Pulu Mandoti) atau 42 basa/14 asam amino (Sintanur, Mentik wangi dan Gunungperak). Dengan demikian dua kelompok primer yang digunakan pada penelitian ini dapat digunakan untuk membedakan padi varietas aromatik dan nonaromatik walaupun panjang delesi pada kromosom 8 tidak sama.
Gambar 9 Hasil PCR menggunakan primer RM223. Marker: DNA 1 kb, Sampel: Ciherang, IR 64, Fatmawati, Pandan Wangi, Rojo Lele, Sintanur, Mentik Wangi, Gunung Perak, Gilirang, Air.
SIMPULAN DAN SARAN
SimpulanKonsentrasi DNA yang diisolasi dari daun padi menggunakan metode CTAB mempunyai konsentrasi yang relatif besar. Primer Bradbury tidak sepenuhnya dapat membedakan padi aromatik dan nonaromatik. Varietas padi aromatik yang mempunyai pola pita DNA yang berbeda dengan padi varietas nonaromatik adalah Mentik Wangi dan Gunung Perak, sedangkan varietas Pandan Wangi, Pulu Mandoti dan Pare Kembang pola pitanya sama dengan padi nonaromatik. Primer
I
II III
M Cih IR Fat PW RL Sin MW GP Gil PM A
13
RM223 dapat membedakan padi varietas aromatik dan nonaromatik berdasarkan ukuran pita DNA padi tersebut. Perbedaan pola pita padi aromatik dan nonaromatik disebabkan oleh panjang delesi pada kromosom 8 yang tidak sama.
Saran
Perlu dilakukan penelitian lanjutan dengan menggunakan primer yang lain yang dapat membedakan pola pita DNA padi aromatik dan nonaromatik. Kajian lain seperti sekuensing DNA padi aromatik dan nonaromatik varietas asli Indonesia juga perlu dilakukan, sehingga dapat menentukan primer yang lebih spesifik untuk padi aromatik dan nonaromatik.
DAFTAR PUSTAKA
Adijono P, Bambang K, Allidawati, Suwarno. 1993. Pemuliaan Padi Aromatik dan Ketan. Dalam: Mahyudin Syam, Hermanto, A. Musadad dan Sunihaardi (eds.). Kinerja Penelitian Tanaman Pangan. Pusat Penelitian Tanaman Pangan. Bogor. hal 422-428. Ahn SN, Bollisch CN, Tanksley SD. 1992.
RFLP tagging of a gene for aroma in rice.Theor Appl Genet 84:825–828. Bradbury LMT, Henry RJ, Jin Q, Reinke
RF, Waters DLE. 2005. A perfect marker for fragrance genotyping in rice.
Mol Breed 16:279–283.
Bradbury LMT, Fitzgerald TL, Henry RJ, Jin Q, Waters DLE. 2005. The gene for
fragrance in rice. Plant Biotechnology
3: 363–370.
Bourgis FRet al. 2008. Characterization of the major fragance gene from an aromaticjaponica rice and analysis of its diversity in Asian cultivated rice.
Theor Appl Genet 117: 353–368. Buttery RG, LC Ling, BO Juliano, JG
Turnbaugh. 1983. Cooked rice aroma and 2-asetil-1-pirolin. Agric. Food Chem 31: 823-826.
Cordeiro GM, Christopher MJ, Henry RJ, and Reinke RF.2002. Identification of microsatellite markers for fragrance in rice by analysis of the rice genome sequence.Mol. Breed 9:245–250.
Doyle JJ, Doyle JL. 1987. A rapid DNA
isolation from small amount of fresh leaf tissue.Phytochem Bull 19:11-15.
Gorantla Met al.2005. Functional genomics of drought stress response in rice: transcript mapping of annoted unigenes of an indica rice (Oryza sativa L. cv. Nagina 22). Current Science 89:469-514.
Graham A, Newton CR. 1997. PCR (PolymeraseChain Reaction). Ed Ke-2. New York: Springer Verlag.
Gupta PK, Varshney RK, Sharma, PC, Ramesh B. 1999. Molecular markers and their application in wheat breeding. Plant Breeding 118:369-390. Harahap Z, Suwarno, Lubis E, Susanto TW. 1995.Padi unggul Toleran Kekeringan dan Naungan. Bogor : Pusat Penelitian dan Pengembangan Tanaman Pangan, Badan Litbang Pertanian.
Krishnan HB, Okita TW. 1986. Structure relationship among the rice glutelin polypeptides.Pant Physiol 88:649-655. Krisnamurthi B. 2006. Produksi padi
nasional naik minimum sama dengan kenaikan penduduk 1,5 %. Sinar Tani . [14 Maret 2006]
Lang NT, Buu BC. 2008. Development of PCR based markers for aroma (fgr) gene in rice (Oryza sativa L.).
Omonrice 16:16-23.
Lin CF, Hsieh RCY, Hoff BJ. 1990. Indentification and quantification of the popcorn-like aroma in lousiana aromatic della rice (Oryza sativa).Food Science 35:1466-1467.
Lisdayanti P. 1997. Polymerasee chain reaction: cara mudah memperbanyak DNA.Warta Biotek.3: 1-3.
Lorieux M, Petrov M, Huang N, Guiderdoni E, Ghesquière A. 1996. Aroma in rice: genetic analysis of a quantitative trait.
Theor App Genet 93:1145–1151. Lu JJ, Chang TT. 1980. Rice in Temporal
and Spatialprospective. In Rice Production and Utilization. Bor s. Luh (ed). West Port: AVI Pb.
Manurung SO, Ismunadji M. 1999. Padi: Buku Padi 1. Bogor: Badan Penelitian dan Pengembangan Pertanian.
14
Mikkelsen SR, Corton E. 1960.
Bioanalytical Chemistry. New Jersey: John Wiley & Sons.
Mittal, UK, Preet K, Singh D, Shukla KK, Saini RG. 1995. Variability of aroma in some land races and cultivars of scented rice.Crop Improv. 22:109-122. Muladno. 2002. Teknologi Rekayasa
Genetika. Bogor: Pustaka Wirausaha Muda.
Mullis KB. 1990. The unusual origin of the polmerase chain reaction. Scientific American 3:56-65.
Nur M, Adijuwana H. 1987. Teknik separasi dalam analisis pangan [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Pasaribu B. 2006. Rancangan undang-undang lahan pangan abadi. Tidak memperkenankan konversi lahan pangan.Sinar Tani 3:8-14.
Roy et al. 2006. Association analysis of agonomically important traits using SSR, SAMPL, and AFLP markers in bread wheat. Current Science 90:683-689.
Sambrook J, Russell DW. 1989. Molecular Cloning: A Laboratory Manual 3rd edition.New York: Laboratory Pr. Siregar H. 1981.Budidaya Tanaman Padi di
Indonesia.Jakarta : Rineka
Shure MS, Wessler, Fedorrof N. 1983. Molecular identification and isolation of the Waxy locus in maize. Cell
35:225-233.
Sobir et al. 2008. Komparasi keanekaragaman genetik tanaman manggis (Garcinia mangostana L.) Indonesia dan kerabat dekatnya dengan penanda isoenzim dan AFLP.
Biodiversitas10:1-6.
Tjitrosoepomo G. 1923. Taksonomi Tumbuhan (Spermathopyta).
Yogyakarta: Gajah Mada University Pr. Widodo I. 2003. Penggunaan marka molekuler pada seleksi tanaman [Tesis]. Bogor: Sekolah Pasca Sarjana, Fakultas Pertanian Institut Pertanian Bogor.