IDENTIFIKASI AKTINOMISET ENDOFIT ASAL
TANAMAN PADI BERDASARKAN ANALISIS
GEN 16S rRNA DAN
nif
H
WAHYU EKA SARI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Identifikasi Aktinomiset Endofit Asal Tanaman Padi Berdasarkan Analisis Gen 16S rRNA dan nifH adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor
Bogor, Mei 2014
RINGKASAN
WAHYU EKA SARI. Identifikasi Aktinomiset Endofit Asal Tanaman Padi Berdasarkan Analisis Gen 16S rRNA dan nifH. Dibimbing oleh YULIN LESTARI dan DEDY DURYADI SOLIHIN.
Aktinomiset indigenos dikenal memiliki keragaman yang tinggi dan berpeluang untuk mendapatkan novel spesies. Aktinomiset endofit diketahui dapat menjadi pelaku pemfiksasi nitrogen selain mampu menghasilkan senyawa bioaktif dengan beragam fungsi seperti antimikrob, penghasil enzim dan inhibitor enzim, serta hormon pemacu pertumbuhan. Identifikasi molekuler dan peran aktinomiset endofit tanaman padi masih jarang dilakukan, sehingga perlu dikaji. Oleh karena itu penelitian ini bertujuan mengidentifikasi aktinomiset endofit tanaman padi berdasarkan analisis gen 16S rRNA dan nifH serta mengkaji aktivitasnya dalam memfiksasi nitrogen.
DNA genom dari tujuh isolat aktinomiset endofit diisolasi menggunakan Genomic DNA Mini Kit, selanjutnya gen 16S rRNA diamplifikasi menggunakan PCR. Analisis kemampuan fiksasi nitrogen dilakukan berdasarkan uji produksi amonia, pertumbuhan di media bebas nitrogen, dan amplifikasi gen nifH melalui PCR. Produk PCR disekuensing dan dianalisis menggunakan software bioinformatika MEGA 5.05 untuk mengkonstruksi pohon filogenetik yang mengindikasikan kekerabatan antar isolat.
Analisis sekuen gen 16S rRNA menunjukkan bahwa tujuh isolat (IPBCC.b.14.1531, IPBCC.b.14.1532, IPBCC.b.14.1533, IPBCC.b.14.1534, IPBCC.b.14.1535, IPBCC.b.14.1536, dan IPBCC.b.13.1530) berkerabat dekat dengan Streptomyces spp. Sekuen 16S rRNA dari enam isolat berkerabat dengan S. albolongus, S. cavourensis subsp. cavourensis, S. anulatus, dan S. bungoensis dengan identitas maksimum < 97%, dan satu isolat lainnya berkerabat dekat dengan S. misionensis, dengan identitas maksimum 99%.
Berdasarkan analisis sekuen gen nifH, tiga isolat berhasil diamplifikasi menggunakan PCR dan menunjukkan kekerabatannya dengan gen nifH Herbaspirillum sp., dengan nilai kemiripan 93 hingga 99%. Analisis keragaman jarak genetik berdasarkan p-distance, antara tiga isolat dengan Frankia sp., Rhizobium sp., L. ferrooxidans, dan K. pneumonia menunjukkan adanya perbedaan sekuen gen nifH sebesar 18-28% dan lebih dari 59% jika dibandingkan dengan sekuen gen nifH B. japonicum. Hal tersebut mengindikasikan keragaman yang tinggi gen nifH pada isolat aktinomiset endofit padi. Berdasarkan uji in vitro, isolat IPBCC.b.13.1530, IPBCC.b.14.1531, dan IPBCC.b.14.1536 juga mampu tumbuh di media bebas nitrogen dan memproduksi amonia berturut-turut sebesar 0.065 ppm, 0.014 ppm, dan 0.076 ppm pada media bebas nitrogen. Hasil tersebut mengindikasikan bahwa tiga isolat tersebut menjanjikan dalam perannya sebagai bakteri pemfiksasi N2 pada tanaman padi.
SUMMARY
WAHYU EKA SARI. Identification of Endophytic Actinomycetes from Rice Plant Based on 16S rRNA and nifH Genes Analyses. Supervised by YULIN LESTARI and DEDY DURYADI SOLIHIN.
Indigenous actinomycetes are known to have high biodiversity and chance to acquire a novel species. Endophytic actinomycetes have been reported to fix N2 in rice plant, beside their ability to produce bioactive compound with several
function such as antimicrobes, produce enzyme and enzymes inhibitor, also plant growth promotion. Molecular identification and the role of rice endophytic rRNA and nifH genes. Indication of their nitrogen fixing activities were examined based on their capability to grow in N-free medium, ammonia production, and presence of nifH gene. PCR products were sequenced and analyzed by bioinformatics software (MEGA 5.05) to construct phylogenetic tree that indicate relationship among isolates.
An analysis of 16S rRNA gene sequences demonstrated that the seven isolates (IPBCC.b.14.1531, IPBCC.b.14.1532, IPBCC.b.14.1533, IPBCC.b.14.1534, IPBCC.b.14.1535, IPBCC.b.14.1536, and IPBCC.b.13.1530) were most closely related to Streptomyces spp. The 16S rRNA gene sequences of the six isolates were closed related with S. albolongus, S. cavourensis subsp. cavourensis, S. anulatus, and S. bungoensis with < 97% maximum identity, and another isolate was closed related with S. misionensis, with 99% maximum identity.
Based on nifH gene sequences analysis, three isolates of endophytic actinomycetes showed that they were closely related to nifH from Herbaspirillum sp., the similarity was 93 to 99%. An analysis of phylogenetic tree with p-distance, the diversity of genetic distances between three isolates and Frankia sp., Rhizobium sp., L. ferroxidans, also K. pneumonia showed the different sequences of nifH gene which were 18-28% and more than 59% when compared with B. japonicum. That data indicated high diversity of rice endophytic actinomycetes nifH gene. Based on in vitro assay, IPBCC.b.13.1530, IPBCC.b.14.1531, and IPBCC.b.14.1536 isolates were also capable to grow in N-free medium and produced 0.065 ppm, 0.014 ppm, and 0.076 ppm ammonia in N-free medium, respectively. The results indicated that the three isolates had promising role as a N2 fixing bacteria on rice plant.
Keywords: endophytic actinomycetes, nifH gene, rice plant, Streptomyces, 16S rRNA
©
Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
IDENTIFIKASI AKTINOMISET ENDOFIT ASAL
TANAMAN PADI BERDASARKAN ANALISIS
GEN 16S rRNA DAN
nif
H
WAHYU EKA SARI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Identifikasi Aktinomiset Endofit Asal Tanaman Padi Berdasarkan Analisis Gen 16S rRNA dan nifH Nama : Wahyu Eka Sari
NIM : G351110201
Disetujui oleh Komisi Pembimbing
Dr Ir Yulin Lestari Ketua
Dr Ir Dedy Duryadi Solihin, DEA Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi
Prof Dr Anja Meryandini, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga penyusunan karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2013 sampai November 2013 ini ialah identifikasi aktinomiset endofit asal lima varietas tanaman padi di Indonesia, dengan judul Identifikasi Aktinomiset Endofit Asal Tanaman Padi Berdasarkan Analisis Gen 16S rRNA dan nifH.
Terima kasih penulis ucapkan kepada Ibu Dr Ir Yulin Lestari sebagai ketua komisi pembimbing dan Bapak Dr Ir Dedy Duryadi Solihin, DEA sebagai anggota komisi pembimbing, yang telah banyak memberikan nasehat, saran, motivasi, waktu konsultasi, serta solusi dari setiap permasalahan yang dihadapi penulis selama melaksanakan penelitian dan penyusunan karya ilmiah ini. Selain itu penulis ucapkan terima kasih kepada penguji luar komisi Ibu Dr Suryani, SP MSc dan Ibu Prof Dr Anja Meryandini, MS selaku Ketua Program Studi Mikrobiologi IPB, yang telah memberikan motivasi selama studi dan masukan pada saat ujian sidang tesis. Kepada I-MHERE B2c. IPB 2011/2012 terima kasih atas kepercayaannya untuk memberikan beasiswa kuliah selama menempuh pendidikan pascasarjana di IPB, dan terima kasih atas hibah penelitian I-MHERE B2c. IPB a.n. Dr Ir Yulin Lestari sehingga penelitian yang penulis lakukan dapat terlaksana dengan baik.
Penulis juga mengucapkan terima kasih kepada Ibu Heni dan Bapak Jaka selaku staf Laboratorium Mikrobiologi IPB, kepada Ibu Retnowati selaku staf Laboratorium Terpadu Biologi IPB, Ibu Alina, Kak Sipri, Kak Yessy, Andri, Mbak Lena, Fadhil, Ayu, Mas Mafri, Aar, Munjiati, Nia, dan Mbak Lisma, serta seluruh teman-teman di Laboratorium Mikrobiologi IPB, atas dukungan, motivasi, dan bantuannya selama penelitian ini. Ucapan terima kasih tak terhingga juga penulis ucapkan kepada bapak, ibu, dan adikku tercinta Wahyu Tri Sulistianto, serta sahabat-sahabatku tersayang, atas doa, dukungan, kasih sayang, dan semangat yang diberikan. Terima kasih untuk kebersamaan yang singkat, penuh makna, dan sangat indah teruntuk teman-teman seperjuangan di Pascasarjana Mikrobiologi IPB angkatan 2011. Kepada adik-adik di wisma Bintang (Dini, Nisa, Ulya, dan sebagainya), teman-teman di Pascasarjana Mikrobiologi IPB 2010, 2012, dan 2013, teman-teman di Biologi IPB, serta seluruh pihak yang telah memberikan doa dan dukungannya, penulis ucapkan terima kasih.
Semoga karya ilmiah ini bermanfaat.
Bogor, Mei 2014
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR x
DAFTAR LAMPIRAN x
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
TINJAUAN PUSTAKA 3
Mikrob Endofit dan Interaksinya dengan Tanaman Inang 3
Aktinomiset Endofit 3
Analisis Gen 16S rRNA 4
Fiksasi Nitrogen (N2) 5
Potensi Mikrob Endofit sebagai Pemfiksasi N2 6
Gen nifH 7
Polymerase Chain Reaction (PCR) 8
METODE 9
Kerangka Penelitian 9
Waktu dan Tempat Penelitian 10
Pengamatan Karakteristik Morfologi Isolat Aktinomiset Endofit Padi 10
Isolasi DNA Aktinomiset Endofit Padi 10
Amplifikasi Gen 16S rRNA dan Gen nifH Menggunakan PCR 11 Sekuensing Gen 16S rRNA dan Gen nifH, Analisis Bioinformatika, dan
Konstruksi Pohon Filogenetik 12
Uji in vitro Potensi Aktinomiset Endofit Padi sebagai Pemfiksasi N2 12
HASIL DAN PEMBAHASAN 13
Hasil 13
Karakteristik Morfologi Aktinomiset Endofit Padi 13
Kemampuan Fiksasi Nitrogen oleh Aktinomiset Endofit Padi 19
Pembahasan 20
Karakterisasi Morfologi Koloni Aktinomiset Endofit Padi 20 Identitas Molekuler Gen 16S rRNA Aktinomiset Endofit Padi 21 Identitas Molekuler Gen nifH Aktinomiset Endofit Padi 23 Kemampuan Aktinomiset Endofit Padi dalam Fiksasi N2 secara In Vitro 24
SIMPULAN DAN SARAN 25
Simpulan 25
Saran 26
DAFTAR PUSTAKA 26
LAMPIRAN 33
DAFTAR TABEL
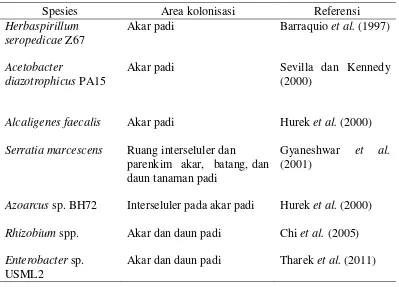
1 Mikrob diazotrof endofit dan area kolonisasinya pada tanaman padi 7
2 Kuantitas DNA genom aktinomiset endofit padi 14
3 Persentase kemiripan sekuen gen 16S rRNA aktinomiset endofit
padi dengan strain pembanding GenBank 15
4 Matriks jarak genetik (p-distance) sekuen gen 16S rRNA enam
isolat aktinomiset endofit padi 16
5 Persentase kemiripan sekuen gen nifH aktinomiset endofit padi
dengan strain pembanding GenBank 18
6 Matriks jarak genetik (p-distance) sekuen gen nifH aktinomiset endofit
padi 18
DAFTAR GAMBAR
1 Proses fiksasi N2 5
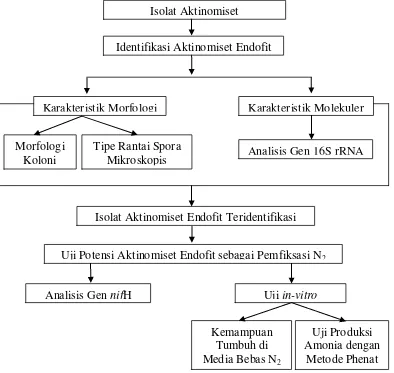
2 Diagram alur penelitian 9
3 Keragaman koloni Streptomyces sp. endofit padi umur 10 hari pada media YSA (Gb. atas) dan tipe rantai spora Streptomyces sp. endofit
dilihat dengan mikroskop cahaya perbesaran 400x (Gb. bawah) 13 4 DNA genom aktinomiset endofit padi hasil elektroforesis pada 1%
gel agarosa 14
5 Hasil amplifikasi PCR gen 16S rRNA aktinomiset endofit padi (~1480 pb)
menggunakan primer 20F dan 1500R 14
6 Pohon filogenetik gen 16S rRNA aktinomiset endofit padi sepanjang 1532
nukleotida 16
7 Pohon filogenetik berdasarkan matriks jarak genetik (p-distance) sekuen gen 16S rRNA antara enam aktinomiset endofit padi 17 8 Hasil amplifikasi PCR gen nifH aktinomiset endofit padi (~320 pb)
menggunakan primer PolF dan AQER 17
9 Pohon filogenetik gen nifH aktinomiset endofit padi sepanjang 336
nukleotida 19
10 Pertumbuhan koloni aktinomiset endofit padi pada media BNF padat umur inkubasi 10 hari (Gb. atas) dibandingkan dengan pertumbuhan
koloni pada media YSA umur 10 hari (Gb.bawah). 19 11 Produksi amonia dari aktinomiset endofit padi setelah inkubasi
selama 10 hari. B. japonicum sebagai kontrol positif dan E. coli
sebagai kontrol negatif 20
DAFTAR LAMPIRAN
1 Karakteristik morfologi koloni dan mikroskopis aktinomiset padi 35 2 Hasil sekuensing gen 16S rRNA tujuh isolat aktinomiset endofit padi 36 3 Hasil sekuensing gen nifH tujuh isolat aktinomiset endofit padi 43 4 Pengukuran produksi amonia dan bobot biomassa sel aktinomiset
endofit padi 45
PENDAHULUAN
Latar Belakang
Setiap tanaman tingkat tinggi mengandung mikrob endofit yang mampu menghasilkan beragam senyawa bioaktif yang diduga berhubungan dengan tanaman inangnya (Tan dan Zou 2001). Mikrob endofit merupakan mikrob yang hidup mengkolonisasi jaringan tanaman pada periode tertentu serta memperoleh nutrisi dan perlindungan dari tanaman inangnya (Hasegawa et al. 2006). Mikrob ini berpotensi dalam bidang pertanian sebagai pemacu pertumbuhan tanaman (Hallman et al. 1997; Compant et al. 2005) dan pemfiksasi N2 (Phillips et al.
2000), bidang obat-obatan, serta industri (Strobel dan Daisy 2003). Beragam mikroorganisme, termasuk aktinomiset, fungi, dan bakteri telah dijumpai di dalam jaringan tanaman dan didefinisikan sebagai endofit (Mano dan Morisaki 2008).
Aktinomiset endofit merupakan bakteri Gram positif dengan kandungan G+C tinggi yang diketahui memiliki keragaman hayati yang tinggi dan berpeluang untuk mendapatkan novel spesies (Otoguro et al. 2009), serta mampu menghasilkan beragam senyawa bioaktif yang dapat berfungsi antara lain sebagai antimikrob, hormon pemacu pertumbuhan, dan enzim inhibitor (Hasegawa et al. 2006; Lestari 2006). Penelitian sebelumnya melaporkan tingginya keragaman aktinomiset yang diisolasi dari tanah tropis di Indonesia (Sembiring dan Goodfellow 2001). Selain itu, sejumlah aktinomiset endofit dilaporkan berhasil diisolasi dari bagian akar, batang, dan daun tanaman padi asal lima varietas padi di Indonesia yaitu IR64, Inpago 4, Inpari 9 Elo, Ciherang, dan Inpara 2 (Jelita 2012). Salah satu cara untuk mengetahui identitas spesies aktinomiset endofit asal tanaman padi tersebut adalah dengan mengetahui karakteristik morfologi dan mengidentifikasi secara molekuler berdasarkan gen 16S rRNA. Gen 16S rRNA merupakan gen yang dijumpai pada semua prokariotik dan umumnya digunakan untuk keperluan identifikasi bakteri, termasuk aktinomiset.
Nitrogen merupakan unsur penting yang diperlukan suatu tanaman untuk pertumbuhan vegetatifnya. Proses fiksasi nitrogen dapat dilakukan oleh mikroorganisme yang berasosiasi dengan tanaman inangnya. Nitrogenase merupakan enzim yang berperan dalam proses fiksasi nitrogen, dan dalam prosesnya protein yang merupakan komponen penting dari enzim tersebut disandikan oleh gen nifHDK. Berdasarkan penelitian sebelumnya, Streptomyces endofit diketahui mampu memfiksasi N2 pada tanaman padi melalui
2
Perumusan Masalah
1. Setiap tanaman tingkat tinggi mengandung mikrob endofit yang mampu mengkolonisasi jaringan tanaman pada periode tertentu.
2. Aktinomiset merupakan mikrob endofit yang memiliki keragaman hayati yang tinggi dan berpeluang untuk mendapatkan novel spesies.
3. Sejumlah aktinomiset endofit berhasil diisolasi dari bagian akar, batang, dan daun tanaman padi asal lima varietas padi di Indonesia yaitu IR64, Inpago 4, Inpari 9 Elo, Ciherang, dan Inpara 2.
4. Aktinomiset endofit dapat menjadi pelaku pemfiksasi N2 disamping
keistimewaannya dalam menghasilkan beragam senyawa bioaktif seperti antimikrob, hormon pemacu pertumbuhan tanaman, dan enzim inhibitor. 5. Penelitian mengenai identifikasi molekuler aktinomiset endofit asal tanaman
padi berdasarkan analisis gen 16S rRNA dan nifH belum banyak dilakukan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengidentifikasi aktinomiset endofit tanaman padi berdasarkan karakteristik morfologi dan gen 16S rRNA, serta mengkaji potensinya sebagai pemfiksasi N2 berdasarkan analisis gen nifH dan uji
secara in vitro yang meliputi kemampuan tumbuh dan produksi amonia pada media bebas nitrogen.
Manfaat Penelitian
Identifikasi terhadap tujuh isolat aktinomiset endofit tanaman padi dalam penelitian ini, diharapkan mampu memberikan informasi tentang keragaman dan membuka peluang novel spesies, sehingga mampu memperkaya koleksi plasma nutfah mikrob indigenos asal tanaman padi di Indonesia. Hasil penelitian ini juga diharapkan dapat memberikan informasi mengenai peran mikrobiologi khususnya potensi aktinomiset endofit tanaman padi dalam bidang pertanian yaitu melalui kemampuannya dalam memfiksasi N2, sebagai salah satu upaya peningkatan
produksi padi untuk mendukung ketahanan pangan yang dicanangkan pemerintah.
Ruang Lingkup Penelitian
Ruang lingkup dalam penelitian ini meliputi identifikasi aktinomiset endofit tanaman padi berdasarkan karakteristik morfologi dan gen 16S rRNA, serta analisis kemampuannya dalam memfiksasi N2. Karakteristik morfologi
meliputi morfologi koloni dan tipe rantai spora aktinomiset secara mikroskopis, sedangkan analisis gen 16S rRNA meliputi isolasi DNA genom, amplifikasi, hingga konstruksi pohon filogenetik. Untuk mengetahui kemampuannya dalam memfiksasi N2, dilakukan dengan mengidentifikasi secara molekuler berdasarkan
3
TINJAUAN PUSTAKA
Mikrob Endofit dan Interaksinya dengan Tanaman Inang
Mikrob endofit merupakan mikrob yang hidup di dalam jaringan tanaman pada periode tertentu tanpa menimbulkan bahaya, serta dapat diisolasi dari jaringan tanaman yang sudah disterilisasi permukaannya atau diekstrak dari jaringan tanaman bagian dalam (Hallmann et al. 1997). Mikrob ini merupakan sumber alamiah potensial yang dapat dikaji manfaatnya dalam bidang pertanian, obat-obatan, dan industri. Berbagai jenis senyawa bioaktif dengan beragam fungsi yang terkandung di dalam tumbuhan, diduga dapat pula dihasilkan oleh mikrob endofit pada tumbuhan tersebut (Strobel dan Daisy 2003). Adanya kemampuan mikrob endofit menghasilkan senyawa metabolit sekunder sesuai dengan tanaman inangnya, merupakan peluang yang dapat dioptimalkan untuk memproduksi metabolit sekunder secara efisien dan cepat. Mikrob endofit telah berhasil diisolasi dari berbagai jenis jaringan dari berbagai tumbuhan baik bakteri Gram negatif maupun Gram positif, termasuk aktinomiset. Produk pupuk hayati berbasis mikrob endofit dalam hal ini aktinomiset dilaporkan sebanyak 200 g ha-1 aplikasi di lapangan, mampu meningkatkan 4% tinggi tanaman padidibandingkan dengan kontrol (Husniyah 2013).
Umumnya mikrob endofit dalam tanaman dapat terlokalisasi pada titik masuk atau menyebar ke seluruh bagian tanamannya. Mikrob ini dapat berada dalam sel, ruang antar sel, atau dalam sistem vaskuler. Mikrob endofit memasuki jaringan tanaman melalui akar, stomata, bunga, batang, maupun kotiledon. Secara spesifik, mikrob dapat melakukan penetrasi akar melalui perkecambahan radikula akar maupun akar sekunder. Sharma et al. (2005) menyatakan bahwa akar lateral merupakan bagian tumbuhan yang paling banyak dihuni oleh mikrob endofit. Hal ini dikarenakan mikrob endofit masuk ke dalam jaringan tanaman melalui akar lateral kemudian menyebar ke dalam ruang interseluler dan berkas pembuluh. Menurut Zinniel et al. (2002) juga dilaporkan bahwa populasi mikrob endofit paling banyak ditemukan di daerah akar dan semakin menurun di daerah batang dan daun.
Aktinomiset Endofit
Aktinomiset merupakan bakteri Gram positif berfilamen, dengan kandungan (G+C) tinggi (>55 %) di dalam genomnya (Miyadoh 1997). Aktinomiset diklasifikasikan sebagai berikut (Stackebrandt et al. 1997):
Domain : Bacteria Filum : Actinobacteria Kelas : Actinobacteria Subkelas : Actinobacteridae Ordo : Actinomycetales
4
(Lachevalier et al. 1977). Secara morfologi, koloni aktinomiset yang tergolong Streptomyces spp. dapat membentuk miselia aerial dan secara mikroskopis memiliki rantai spora seperti kait, spiral, atau heliks (Kudo 1997). Adanya perbedaan pembentukan miselia dan penataan rantai spora tersebut menunjukkan karakter unik yang dimiliki oleh Streptomyces spp. Aktinomiset yang tidak membentuk miselia aerial atau hanya membentuk miselia dalam substrat tergolong ke dalam kelompok non-Streptomyces. Genus yang digolongkan ke dalam non-Streptomyces antara lain Mycobacterium, Nocardia, Micromonospora, Microbispora, Actinoplanes, dan Actinomadura (Miyadoh 1997). Keberadaan aktinomiset di lingkungan sangat melimpah terutama di rizosfer. Aktinomiset endofit berasosiasi dengan tanaman inang dengan cara hidup mengkolonisasi pada jaringan tanaman dan dapat memberikan efek yang menguntungkan, serta tidak membahayakan bagi tanaman inangnya. Menurut Hasegawa et al. (2006) aktinomiset endofit dapat berperan sebagai antibiotik, promotor pemacu pertumbuhan tanaman, inhibitor pertumbuhan, penghasil enzim, agen biokontrol dalam bidang pertanian, pemfiksasi nitrogen, dsb. Dalam bidang pertanian, beberapa penelitian di Indonesia melaporkan bahwa aktinomiset endofit padi dapat menghasilkan hormon IAA dan melakukan penetrasi akar pada tanaman padi (Yusepi 2011), memfiksasi N2 dengan cara mereduksi asetilen dan
memproduksi amonia (Pratyasto 2012), diaplikasikan sebagai pupuk hayati untuk pertumbuhan tanaman padi (Rahayu 2012), serta dapat mengendalikan penyakit hawar daun bakteri (HDB) (Hastuti et al. 2012). Penelitian di India yang dilakukan oleh Gangwar et al. (2012) melaporkan bahwa Streptomyces endofit asal padi India juga dapat menghasilkan hormon IAA dan bersifat antagonis terhadap fungi patogen tanaman padi.
Analisis Gen 16S rRNA
5 nukleotida tersebut diterjemahkan ke dalam susunan asam amino dari rantai polipeptida protein (Jusuf 2001), sehingga diperoleh produk 16S rRNA.
Gen 16S rRNA dijadikan sebagai penanda molekuler karena memiliki beberapa keunggulan yang memperkuat penggunaannya sebagai alat identifikasi yaitu (a) bersifat ubikuitas dengan fungsi identik pada seluruh organisme, (b) dapat berubah sesuai jarak evolusinya, sehingga dapat digunakan sebagai kronometer evolusi yang baik, (c) memiliki beberapa daerah dengan urutan basa yang relatif konservatif untuk mengkonstruksi pohon filogenetik universal, karena mengalami perubahan relatif lambat dan mencerminkan kronologi evolusi bumi, (d) memiliki beberapa daerah variatif yang dapat digunakan untuk melacak keragaman dan menempatkan galur-galur dalam satu spesies (Pangastuti 2006). Identifikasi gen 16S rRNA dari suatu mikrob dimulai dengan tahap isolasi DNA genom, amplifikasi menggunakan teknik PCR, dan dilanjutkan ke tahap sekuensing untuk diperoleh urutan basa nukleotida yang kemudian dianalisis lebih lanjut untuk konstruksi pohon filogenetik. Patel et al. (2004) melaporkan bahwa sekuen parsial gen 16S rRNA dapat digunakan untuk mengidentifikasi kelompok aktinomiset endofit aerobik.
Fiksasi Nitrogen (N2)
Nitrogen merupakan unsur utama yang diperlukan tanaman, termasuk tanaman padi, yang ketersediannya terbatas di sebagian besar lingkungan. Fiksasi N2 merupakan proses pengubahan N2 menjadi NH4+ yang berguna secara biologi.
Fiksasi N2 melibatkan penggunaan ATP dan proses reduksi ekuivalen yang berasal
dari metabolit primer, serta reaksi yang terjadi dikatalis oleh enzim nitrogenase (White 2000).
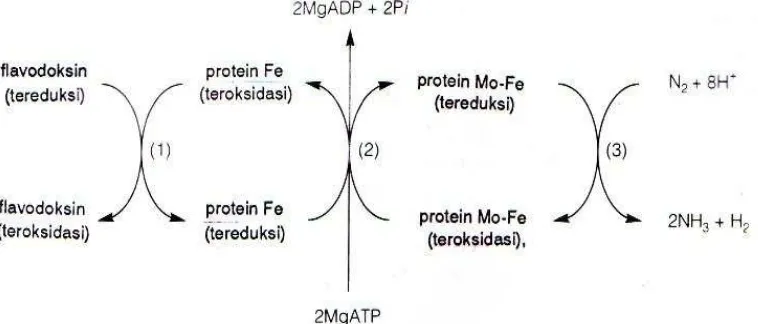
Gambar 1 Proses fiksasi N2 (Salisbury dan Ross 1992)
Nitrogenase (EC 1.18.6.1) merupakan enzim yang berperan penting dalam proses fiksasi N2, terdiri atas dua protein sensitif O2 yaitu komponen I
(dinitrogenase) merupakan protein Fe-Mo yang mengandung dua subunit dan komponen II (dinitrogenase reduktase) merupakan protein Fe(Moat et al. 2002). Berdasarkan Salisbury dan Ross (1992) mekanisme fiksasi N2 dimulai dengan
6
atau flavodoksin, dan berikatan dengan dua molekul MgATP. Selanjutnya elektron tersebut ditransfer menuju ke dinitrogenase, kemudian dinitrogenase reduktase dan dinitrogenase membentuk kompleks, elektron ditransfer dan dua MgATP dihidrolisis menjadi dua molekul MgADP+Pi. Kompleks nitrogenase tersebut kemudian berdisosiasi dan dilakukan pengulangan proses. Ketika dinitrogenase telah mengumpulkan cukup elektron, senyawa tersebut mengikat molekul N2, mereduksinya kemudian melepaskan amonia. Dinitrogenase
selanjutnya menerima tambahan elektron dari dinitrogenase reduktase untuk mengulangi proses tersebut. Reaksi fiksasi N2 dapat dituliskan berdasarkan
persamaan berikut (Moat et al. 2002):
N2 + 8 H+ + 8 e- + 16 ATP + 12 H2O 2 NH3 + H2 + 16 ADP + 16 Pi
Serapan hidrogenase akan dikembalikan dalam bentuk H dalam sistem fiksasi N2, kemudian serapan yang dihasilkan tersebut dapat digunakan juga pada
jalur konsumsi oksigen untuk membantu menjaga kondisi lingkungan dalam kondisi anaerobik. Lingkungan anaerobik sangat penting bagi aktivitas nitrogenase diakibatkan karena kedua kompleks protein nitrogenase yang memiliki sensitivitas tinggi terhadap oksigen, sehingga kehadiran oksigen dapat menekan sistem serapan hidrogen dalam proses nitrogenase. Hubungan antara fiksasi N2 dan produksi H2 dapat ditunjukkan dengan persamaan reaksi sebagai
berikut (Moat et al. 2002):
N2 + 8 H+ + 8 e- 2 NH3 + H2
Potensi Mikrob Endofit sebagai Pemfiksasi N2
Dalam proses fiksasi N2, cadangan utama nitrogen di dalam biosfer diubah
menjadi nitrogen molekuler dari atmosfer. Nitrogen molekuler tidak dapat diasimilasi secara langsung oleh tanaman, sehingga ketersediaannya bagi tanaman harus melalui proses fiksasi nitrogen secara biologi, yaitu dengan bantuan sel prokariot seperti bakteri rhizobia dan aktinomiset (Franche et al. 2009). Bagi mikrob sendiri, nitrogen merupakan nutrien esensial untuk mensintesis asam amino yang diperlukan untuk menyusun protein sel mikrob (White 2000). Mikrob yang dapat melakukan fiksasi N2 secara biologi disebut mikrob diazotrof, dengan
peranan utama dari enzim kompleks dinitrogenase. Mikrob diazotrof terdiri atas aerob (Azotobacter, Beijerinckia, Derxia), fakultatif anaerob (Clostridium, Pseudomonas, Rhizobium), heterotrof (Klebsiella, Enterobacter), dan fototrof (Anabaena, Azospirillum, Nostoc) (Shenoy et al. 2001). Shrestha dan Maskey (2005) melaporkan bahwa pada tanaman padi, nitrogen yang berhasil ditambat oleh mikrob endofit melalui fiksasi N2 berkisar antara 0-35 % N2.
Hallmann et al. (1997) juga melaporkan bahwa mikrob endofit dapat berperan sebagai pemfiksasi N2 di udara. Selain itu, Yu et al. (2011) melaporkan
bahwa Stenotrophomonas maltophilia yang merupakan bakteri asal tanah persawahan padi di Myanmar, yang diketahui mampu menambat N2 di udara.
Beberapa penelitian juga melaporkan mengenai sistem fiksasi N2 secara biologis
7 Silvester 1993) dan tanaman legum (Franche et al. 2009). Beberapa penelitian melaporkan mengenai mikrob diazotrof endofit pada tanaman padi yang memiliki kemampuan sebagai pemfiksasi N2 (Tabel 1).
Untuk mengetahui adanya aktivitas fiksasi N2 yang dilakukan oleh suatu
mikrob, dapat dikaji baik secara in vitro (seperti kemampuan tumbuh pada media bebas nitrogen, reduksi asetilen, pengukuran produksi amonia, teknik 15N-isotop) maupun secara in-planta dengan mengombinasi inokulasi suatu mikrob dengan beberapa dosis pupuk anorganik. Selain itu, adanya potensi pemfikasi N2 dari
suatu mikrob dapat dikaji melalui identifikasi secara molekuler berdasarkan analisis gen nif (nifH,D, atau K).
Tabel 1 Mikrob diazotrof endofit dan area kolonisasinya pada tanaman padi
Spesies Area kolonisasi Referensi
Herbaspirillum seropedicae Z67
Akar padi Barraquio et al. (1997)
Acetobacter
Nitrogenase merupakan enzim yang mengkatalis perubahan dinitrogen menjadi amonia, yang disandikan oleh gen nifHDK dalam satu operon, dan umumnya dijumpai pada mikrob diazotrof. Enzim dinitrogenase memiliki dua komponen protein penting yaitu FeMo-protein (dinitrogenase) yang disandikan oleh gen nifK dan nifD, serta Fe-protein (dinitrogenase reduktase) yang disandikan oleh gen nifH (Moat et al. 2002). Beragam mikrob bersama-sama dalam satu operon menyandikan gen nifH untuk subunit protein Fe pada proses nitrogenase (Poly et al. 2001).
8
pengambilan sampel yang berbeda. Akan tetapi Zehr dan McReynolds (1989) melaporkan bahwa ketika digunakan primer turunan universal Zf dan Zr, produk gen nifH yang diharapkan tidak dapat diamplifikasi dengan baik. Oleh karena itu, banyak penelitian setelah itu yang mengembangkan desain primer baru yang mampu mengamplifikasi produk gen nifH. Chelius dan Lepo (1999) melaporkan adanya keragaman nifH pada komunitas rizosfer tanaman, yang berhasil diamplifikasi menggunakan primer yang dirancang untuk sianobakter. Poly et al. (2000) mengkaji mengenai keragaman gen nifH pada komunitas mikroorganisme pemfiksasi N2 di tanah dengan menguji beberapa primer nifH yang berbeda.
Mevarech et al. (1980) melaporkan bahwa ukuran sekuen lengkap gen nifH pada sianobakter adalah ~ 900 pb, hal tersebut juga bersifat konservatif pada Clostridium sp. dan Azotobacter.
Young (1992) melaporkan bahwa banyak analisis gen nifH berdasarkan pohon filogenetiknya yang bersifat konsisten terhadap pohon filogenetik gen 16S rRNA dari bakteri pemfiksasi N2. Akan tetapi seiring perkembangan teknologi,
Gaby dan Buckley (2014) melaporkan bahwa keragaman gen nifH tidak dapat dibandingkan secara langsung dengan keragaman gen 16S rRNA. Adanya keragaman gen nifH mampu merepresentasikan adanya keragaman bakteri pemfiksasi N2 (Ueda et al. 1995), dan dapat digunakan untuk mempelajari
keragaman komunitas bakteri yang dapat memfiksasi N2.
Polymerase Chain Reaction (PCR)
PCR merupakan suatu metode untuk membuat salinan segmen spesifik dari suatu DNA. Materi awal untuk PCR adalah suatu larutan DNA utas ganda yang mengandung urutan nukleotida yang ditargetkan untuk disalin. Primer yang digunakan untuk proses PCR merupakan molekul DNA utas tunggal sintetik yang pendek, yang komplementer terhadap ujung-ujung DNA target sehingga menentukan segmen DNA tertentu yang akan diperkuat (Campbell et al. 2002).
9 berjalan berulang-ulang, hingga urutan target telah terduplikasi berulang kali. Hampir semua molekul DNA yang dihasilkan akan terdiri atas urutan target yang tepat, hingga 20 siklus (Campbell et al. 2002). Oleh karena berlangsung secara berulang dan terus-menerus, maka akan dihasilkan DNA yang berlimpah sesuai dengan jumlah primer, yang pada akhirnya akan dihasilkan amplikon, yaitu produk PCR, yang selanjutnya dapat digunakan untuk berbagai keperluan dalam bidang molekuler. Analisis 16S rRNA diawali dengan cara isolasi DNA (Hapwood et al. 1985) dan amplifikasi gen penyandi 16S rRNA menggunakan teknik PCR (Sivakumar 2001).
METODE
Kerangka Penelitian
Kerangka penelitian (Gambar 2) meliputi identifikasi isolat aktinomiset endofit padi berdasarkan karakteristik morfologi dan molekuler, serta uji in vitro.
Gambar 2 Diagram alur penelitian
Uji in-vitro Isolat Aktinomiset
Karakteristik Morfologi Karakteristik Molekuler
Morfologi Koloni
Tipe Rantai Spora
Mikroskopis Analisis Gen 16S rRNA
Analisis Gen nifH
Identifikasi Aktinomiset Endofit
Isolat Aktinomiset Endofit Teridentifikasi
Uji Potensi Aktinomiset Endofit sebagai Pemfiksasi N2
Kemampuan Tumbuh di Media Bebas N2
Uji Produksi Amonia dengan
10
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Maret 2013 hingga November 2013 di Laboratorium Mikrobiologi & Laboratorium Biologi Terpadu, Departemen Biologi, FMIPA IPB.
Pengamatan Karakteristik Morfologi Isolat Aktinomiset Endofit Padi
Sampel isolat aktinomiset endofit padi yang digunakan antara lain varietas Inpara 2 (IPBCC.b.14.1531), IR64 (IPBCC.b.14.1532, IPBCC.b.14.1533, IPBCC. b.14.1534), Inpago 4 (IPBCC.b.14.1535), Ciherang (IPBCC.b.14.1536), dan Inpari 9 Elo (IPBCC.b.13.1530) diperoleh dari kultur koleksi Dr. Ir. Yulin Lestari. Lima varietas padi tersebut berasal dari Kebun Percobaan Padi, di Muara Bogor, Jawa Barat. Ketujuh isolat tersebut diremajakan pada media Yeast Starch Agar (YSA) dengan penambahan antibiotik asam nalidiksat (1 mg/mL) dan griseofulvin (5 mg/mL). Kultur biakan diinkubasi selama 10 hari pada suhu ruang. Selanjutnya tipe spora dari masing-masing isolat aktinomiset endofit diamati menggunakan mikroskop cahaya (Olympus dilengkapi Optilab) dengan perbesaran 400X.
Isolasi DNA Aktinomiset Endofit Padi
Isolasi DNA aktinomiset endofit pada penelitian ini menggunakan Genomic DNA Mini Kit (Blood/Cultured Cell) Geneaid, yang dimodifikasi. Isolat aktinomiset endofit umur 10 hari yang telah tumbuh dengan baik pada media YSA diambil sejumlah koloninya, kemudian dimasukkan ke dalam tabung mikro yang berisi 200 L bufer TE (20 mM Tris-HCl, 2 mM EDTA, 1% Triton X-100, pH 8.0), selanjutnya suspensi disentrifugasi pada kecepatan 10000 rpm selama 1 menit hingga sel mengendap. Supernatan hasil sentrifugasi kemudian dibuang, sedangkan pelet ditambahkan dengan 200 L bufer TE dan 3 butir glass beads, lalu tabung mikro divortex hingga pelet terlihat lisis. Setelah itu, tahapan isolasi DNA dimulai dengan pra-lisis yaitu ditambahkan 200 L bufer lisozim segar (20 mg/mL lisozim, 20 mM Tris-HCl, 2 mM EDTA, 1% Triton X-100, pH 8.0) ke dalam tabung mikro, kemudian diinkubasi pada suhu ruang selama 10 menit. Selama waktu inkubasi, tabung dibolak-balik setiap 2-3 menit sekali. Selanjutnya tahap lisis yaitu ditambahkan 200 µL bufer GB ke dalam tabung mikro dan dikocok selama 5 detik. Larutan sampel dan bufer elusi kemudian diinkubasi secara bersamaan pada suhu 70 °C selama 10 menit. Selama inkubasi, tabung dikocok setiap 3 menit.
11 menit dengan kecepatan 13000 rpm. Supernatan yang terdapat pada tabung kolektif dibuang. Selanjutnya pelet ditambahkan 600 µL bufer penyuci dan disentrifugasi selama 5 menit pada kecepatan 13000 rpm, kemudian disentrifugasi kembali selama 3 menit. Berikutnya adalah tahap elusi DNA, yang dimulai dengan kolom GD yang berisi pelet dipasangkan dengan tabung mikro steril dan ditambahkan 50 µL bufer elusi ke dalam matriks kolom, kemudian didiamkan selama 15 menit. Selanjutnya larutan disentrifugasi selama 2 menit dengan kecepatan 12000 rpm. Tahap terakhir yaitu hasil isolasi DNA dielektroforesis pada 1% gel agarosa selama 45 menit pada 80 V dengan perbandingan sampel yang dimasukkan ke dalam sumur elektroforesis (1 L loading dye μ 5 L sampel). Setelah proses migrasi selesai, gel agarosa direndam dalam EtBr (Ethidium Bromide) selama 20 menit, lalu direndam dalam akuades selama 10 menit, dan langkah terakhir gel agarosa dilihat di atas paparan sinar UV transilluminator, dan didokumentasi menggunakan Geldoc 1000 (BIO RAD). Keberhasilan isolasi DNA ditandai dengan adanya pita DNA yang tebal dan utuh (tidak terfragmentasi). Konsentrasi DNA hasil isolasi diketahui dengan menggunakan alat Nano drop (Thermo Scientific, USA).
Amplifikasi Gen 16S rRNA dan Gen nifH Menggunakan PCR
Komponen reaksi PCR pada proses amplifikasi gen 16S rRNA terdiri atas 100 ng DNA aktinomiset endofit, 5 U/µL ex Taq DNA polimerase, primer selama 30 detik, elongasi 72ºC selama 1 menit, dan elongasi akhir 72ºC selama 7 menit. DNA diamplifikasi sebanyak 30 siklus (Tamura dan Hatano 2001). Produk PCR dielektroforesis pada gel agarosa 1%, dan diamati pita tunggal DNA di atas sinar UV transilluminator untuk memastikan fragmen DNA yang diamplifikasi pada ukuran ~1480 pb.
Proses amplifikasi gen nifH dilakukan dengan dua tahap PCR. Komponen reaksi PCR pada proses amplifikasi gen nifH terdiri atas 100 ng DNA aktinomiset endofit, 5 U/µL ex Taq DNA polimerase, tahap I: primer forward IGK (5’ -TACGGYAARGCBGGYATCGG-3’) (Poly et al. 2001), primer reverse NDR-1 (5’-TTGGAGCCGGCRTANGCRCA-3’) (Valdes et al. 2005), tahap II: primer forward POL-F (5’-TGCGAYCCSAARGCBGACTC-3’) (Poly et al. 2001), primer reverse AQER (5’-GACGATGTAGATYTCCTG-3’) (Poly et al. 2001) 10 pmol untuk masing-masing primer, 10 mM dNTP mix, 5x bufer PCR, 25 mM MgCl2, 5 µL bufer enhancer dan akuabides steril. Untuk proses PCR tahap II,
12
72ºC selama 5 menit. Baik tahap I maupun tahap II, DNA diamplifikasi sebanyak 35 siklus (Valdes et al. 2005). Produk hasil PCR dielektroforesis pada 1.5% gel agarosa, dan diamati pita tunggal yang terbentuk di atas paparan sinar UV transilluminator untuk memastikan fragmen DNA yang diamplifikasi pada ukuran pasang basa yang tepat ~1200 pb daerah nifH-D (hasil tahap I) dan ~320 pb daerah internal nifH untuk hasil amplifikasi tahap II.
Sekuensing Gen 16S rRNA dan Gen nifH, Analisis Bioinformatika, dan Konstruksi Pohon Filogenetik
Sekuensing DNA dilakukan di perusahaan jasa sekuensing First Base Co., sesuai dengan protokol standar DNA sekuenser (ABI PRISM 3100). Hasil sekuen nukleotida dibandingkan dengan GenBank database melalui program Basic Local Alignment Search Tool Nucleotide (BLAST.N) yang terdapat di NCBI (http://www.ncbi.nlm.nih.gov). Untuk pensejajaran nukleotida serta konstruksi pohon filogenetik gen 16S rRNA dan gen nifH dilakukan dengan piranti lunak MEGA 5.05 (Tamura et al. 2011) berdasarkan neighbor-joining tree (NJT) (Saitou dan Nei 1987), dan mengacu pada best model TN93+G (Tamura-Nei) untuk analisis 16S rRNA dan model T92 (Tamura-3 parameter) untuk analisis gen nifH dengan nilai bootstrap 1000x.
Uji in vitro Potensi Aktinomiset Endofit Padi sebagai Pemfiksasi N2
Kemampuan Tumbuh pada Media Bebas Nitrogen (Phillips et al. 2000)
Uji potensi aktinomiset endofit padi dalam memfiksasi nitrogen dapat dilakukan dengan cara menumbuhkan isolat pada media bebas nitrogen yaitu media Biological N2 Fixation (BNF) yang terdiri atas 1 g K2HPO4, 3 g KH2PO4,
0.065 g MgSO4, 0.01 g FeCl3.6H2O, 0.07 g CaCl2.2H2O, 5 g dekstrosa, 240 µg
Na2MoO4.2H2O, 3 µg H3BO4, 1.83 µg MnSO4.H2O, 290 µg ZnSO4.7H2O, 130 µg
CuSO4.5H2O, dan 120 µg CoCl2.6H2O, per 1 L media (Phillips et al. 2000).
Pengukuran Produksi Amonia Menggunakan Metode Phenat (Eaton et al. 2005)
13
HASIL DAN PEMBAHASAN
Hasil
Karakteristik Morfologi Aktinomiset Endofit Padi
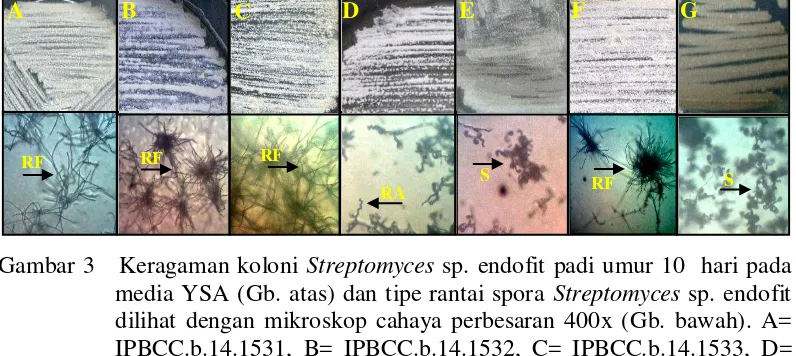
Sebanyak tujuh isolat aktinomiset endofit padi dapat tumbuh dengan baik pada media YSA dengan morfologi koloni yang beragam (Lampiran 1). Koloni aktinomiset sebagian besar tampak keras seperti tumbuh mengakar ke dalam agar-agar, berbeda dengan koloni mikrob lainnya yang tampak lunak di atas media agar-agar. Isolat IPBCC.b.14.1531, IPBC.b.14.1532, IPBCC.b.14.1533, IPBCC.b.14.1534, IPBCC.b.14.1535, IPBCC.b.14.1536, dan IPBCC.b.13.1530 mampu membentuk miselia aerial dan substrat yang beragam dari putih, krem, cokelat, hingga abu-abu, sehingga ketujuh isolat tersebut tergolong ke dalam genus Streptomyces sp. Keseluruhan isolat aktinomiset endofit di atas juga memiliki karakter percabangan miselia yang luas menyerupai cendawan serta menunjukkan penataan rantai spora yang tersusun keriting, seperti kait hingga spiral (Gambar 3).
Gambar 3 Keragaman koloni Streptomyces sp. endofit padi umur 10 hari pada media YSA (Gb. atas) dan tipe rantai spora Streptomyces sp. endofit dilihat dengan mikroskop cahaya perbesaran 400x (Gb. bawah). A= IPBCC.b.14.1531, B= IPBCC.b.14.1532, C= IPBCC.b.14.1533, D= IPBCC.b.14.1534, E= IPBCC.b.14.1535, F= IPBCC.b.14.1536, G= IPBCC.b.13.1530.
Identitas Molekuler Aktinomiset Endofit Padi
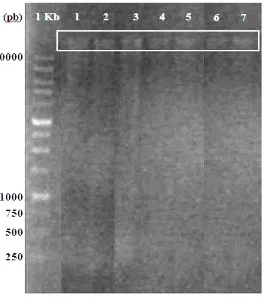
Adanya pita tunggal DNA yang tampak di atas sinar UV dengan ukuran di atas 10000 pasang basa (marker 1 Kb), menandakan bahwa isolasi DNA genom berhasil dilakukan pada ketujuh isolat aktinomiset endofit tanaman padi (Gambar 4). Konsentrasi DNA yang diperoleh dari hasil Nanodrop pada ketujuh isolat aktinomiset endofit tersebut beragam, berkisar antara 20 hingga 98 ng/µL (Tabel 2). Kuantitas DNA tertinggi yang diperoleh ditunjukkan oleh isolat IPBCC.b.14.1531 sebesar 97.7 ng/µL, sedangkan konsentrasi DNA terendah
14
ditunjukkan oleh isolat IPBCC.b.14.1535 sebesar 20 ng/µL. Kemurnian DNA yang diperoleh berdasarkan rasio 260/280, dari ketujuh isolat aktinomiset endofit menunjukkan nilai kemurnian yang berkisar antara 0.82 hingga 3.23.
Gambar 4 DNA genom aktinomiset endofit padi hasil elektroforesis pada 1% gel agarosa
Tabel 2 Kuantitas DNA genom aktinomiset endofit padi
Gambar 5 Hasil amplifikasi PCR gen 16S rRNA aktinomiset endofit padi (~1480 pb) menggunakan primer 20F dan 1500R. Marker 1 Kb, sumur ke- 1-7: IPBCC.b.14.1531, IPBCC.b.14.1532,
IPBCC.b.14.1533, IPBCC.b.14.1534, IPBCC.b.14.1535, IPBCC.b.14.1536, dan IPBCC.b.13.1530.
Kode isolat OD (Optical Density) 260/280 Konsentrasi DNA (ng/µL) 260 nm 280 nm
IPBCC.b.14.1531 1.955 0.605 3.23 97.7
IPBCC.b.14.1532 1.655 1.410 1.17 82.7
IPBCC.b.14.1533 0.588 0.546 1.08 29.4
IPBCC.b.14.1534 0.806 0.797 1.01 40.3
IPBCC.b.14.1535 0.401 0.341 1.18 20.0
IPBCC.b.14.1536 1.253 1.537 0.82 62.6
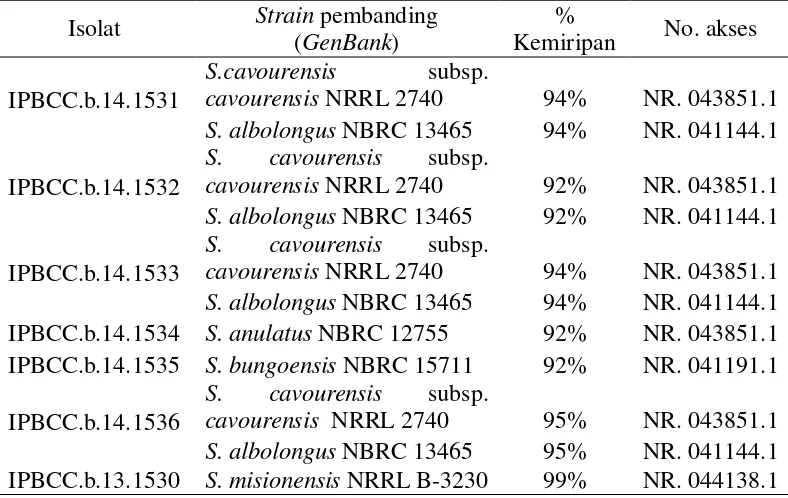
15 Tujuh isolat aktinomiset endofit padi berhasil diamplifikasi gen 16S rRNA menggunakan primer 20F dan 1500R dengan ukuran fragmen DNA yang diharapkan ~1480 pb (Gambar 5). Hasil sekuensing tujuh isolat aktinomiset endofit padi menunjukkan hasil yang baik, dapat dilihat pada dendogram sekuen nukleotida gen 16S rRNA yang tidak saling tumpang tindih (Lampiran 2). Hasil sekuen nukleotida gen 16S rRNA yang disejajarkan menggunakan program BLAST.N sebelumnya telah dilakukan pengoreksian terhadap primer yang digunakan dan dilakukan pensejajaran antara sekuen forward dan reverse. Sekuen tujuh isolat aktinomiset endofit padi yang disejajarkan dengan strain pembanding di GenBank menunjukkan bahwa IPBCC.b.14.1531 (1320 pb) memiliki kemiripan sekuen dengan Streptomyces albolongus NBRC 13465 dan S. cavourensis subsp. cavourensis NRRL 2740 sebesar 94%, begitu pula dengan isolat IPBCC.b.14.1532 (1424 pb), IPBCC.b.14.1533 (1398 pb), dan IPBCC.b.14.1536 (1386 pb) yang memiliki kemiripan sekuen dengan kedua spesies tersebut berturut-turut sebesar 92%, 94%, dan 95%. Isolat IPBCC.b.14.1534 (1478 pb) memiliki kemiripan sekuen dengan S. anulatus NBRC 12755 sebesar 92%, isolat IPBCC.b.14.1535 (1118 pb) memiliki kemiripan dengan S. bungoensis sebesar 92%, sedangkan isolat IPBCC.b.13.1530 (1410 pb) memiliki kemiripan dengan S. misionensis NRRL B-3230 sebesar 99% (Tabel 3). Isolat IPBCC.b.14.1531, IPBCC.b.14.1532, IPBCC.b.14.1533, IPBCC.b.14.1534, IPBCC.b.14.1535, dan IPBCC.b.14.1536 memiliki nilai identitas maksimum <97% dengan E-value 0.0, sehingga keenam isolat tersebut diduga merupakan novel spesies, dengan kesamaan morfologi koloni dan mikroskopis, serta kedekatan sekuen gen 16S rRNA dengan strain pembanding.
Tabel 3 Persentase kemiripan sekuen gen 16S rRNA aktinomiset endofit padi dengan strain pembanding GenBank
*Keterangan: NRRL= National Research Center for Agricultural Utilization Research, USA. NBRC= NITE Biological Resource Center, National Institute o Technology and Evaluation,
cavourensis NRRL 2740 94% NR. 043851.1 S. albolongus NBRC 13465 94% NR. 041144.1 IPBCC.b.14.1532
S. cavourensis subsp.
cavourensis NRRL 2740 92% NR. 043851.1 S. albolongus NBRC 13465 92% NR. 041144.1 IPBCC.b.14.1533
S. cavourensis subsp.
cavourensis NRRL 2740 94% NR. 043851.1 S. albolongus NBRC 13465 94% NR. 041144.1 IPBCC.b.14.1534 S. anulatus NBRC 12755 92% NR. 043851.1 IPBCC.b.14.1535 S. bungoensis NBRC 15711 92% NR. 041191.1 IPBCC.b.14.1536
S. cavourensis subsp.
16
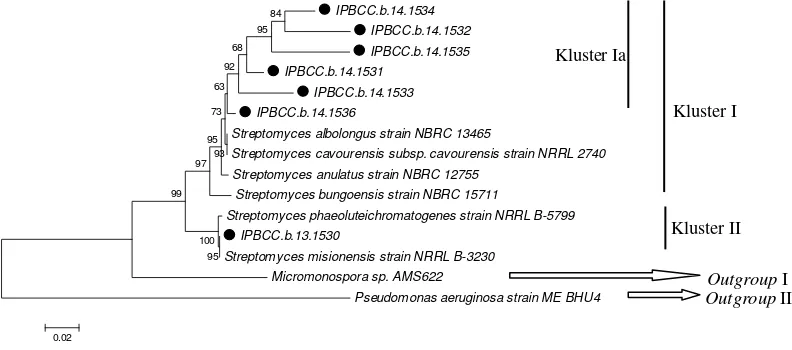
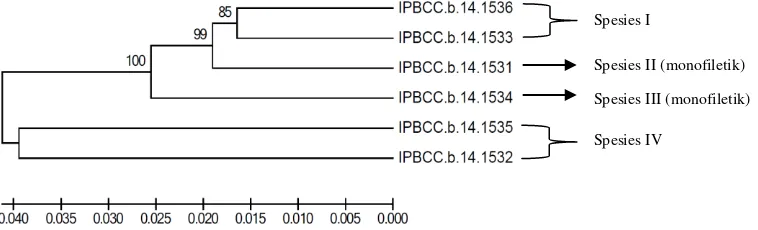
Hasil analisis konstruksi pohon filogenetik juga menunjukkan konsistensi bahwa isolat IPBCC.b.14.1531, IPBCC.b.14.1532, IPBCC.b.14.1533, IPBCC.b.14.1534, IPBCC.b.14.1535, dan IPBCC.b.14.1536 diduga merupakan novel spesies. Keenam isolat tersebut berada pada kluster yang sama dengan S. albolongus, S. cavourensis subsp. cavourensis, S. anulatus, dan S. bungoensis (kluster I), sedangkan isolat IPBCC.b.13.1530 berada pada kluster II yang memiliki hubungan kekerabatan dengan S. misionensis. Kluster I dan kluster II merupakan kluster genus Streptomyces. Terlihat pada pohon filogenetik bahwa kedua kluster tersebut terpisah dari kluster outgroup Micromonospora (aktinomiset non-Streptomyces) dan P. aeruginosa (bakteri Gram negatif) (Gambar 6). Berdasarkan analisis p-distance diketahui bahwa komparasi internal keenam isolat (kluster Ia) tersebut juga menunjukkan keragaman spesies, tampak jelas pada matriks jarak genetik berdasarkan perbedaan sekuen nukleotida (Tabel 4). Pohon filogenetik 16S rRNA berdasarkan matriks jarak genetik menunjukkan bahwa sekuen IPBCC.b.14.1536 memiliki kedekatan dengan IPBCC.b.14.1533, IPBCC.b.14.1535 memiliki kedekatan dengan IPBCC.b.14.1532, sedangkan sekuen IPBCC.b.14.1531 dan IPBCC.b.14.1534 menunjukkan pohon filogenetik yang bersifat monofiletik, keduanya terpisah dari isolat lainnya (Gambar 7). Dengan demikian, dari keenam isolat aktinomiset endofit padi yang diduga novel spesies, dapat dikelompokkan menjadi empat spesies.
Gambar 6 Pohon filogenetik gen 16S rRNA aktinomiset endofit padi sepanjang 1532 nukleotida
Tabel 4 Matriks jarak genetik (p-distance) sekuen gen 16S rRNA enam isolat aktinomiset endofit padi
Isolat 1 2 3 4 5 6 7
S. albolongus NBRC 13465 0.000 IPBCC.b.14.1531 0.026
IPBCC.b.14.1532 0.086 0.077
IPBCC.b.14.1533 0.031 0.042 0.082
IPBCC.b.14.1534 0.054 0.040 0.068 0.057
17
Gambar 7 Pohon filogenetik berdasarkan matriks jarak genetik (p-distance) sekuen gen 16S rRNA antara enam isolat aktinomiset endofit padi
Gen nifH Aktinomiset Endofit Padi
Sebanyak tiga isolat (IPBCC.b.13.1530, IPBCC.b.14.1531, dan IPBCC.b.14.1536) berhasil diamplifikasi sekuen gen nifH menggunakan primer IGK dan NDR-1 (tahap I) serta PolF dan AQER (tahap II). Amplifikasi tahap I menghasilkan ukuran fragmen DNA yang merupakan daerah nifH-nifD yaitu ~1.2 Kb dengan beberapa pita yang tampak beragam, seperti halnya tampak pada kontrol positif. Produk PCR tahap II ketiga isolat aktinomiset endofit, termasuk B. japonicum USDA 110 sebagai kontrol positif menunjukkan adanya pita tunggal gen nifH dengan ukuran fragmen DNA yang diharapkan yaitu ~320 pb, sedangkan E. coli sebagai kontrol negatif tidak menunjukkan pita tunggal DNA (Gambar 8).
Gambar 8 Hasil amplifikasi PCR gen nifH aktinomiset endofit padi (~320 pb) menggunakan primer PolF dan AQER. a) Marker 100 pb, sumur
ke-1-7: IPBCC.b.14.1531,IPBCC.b.14.1532, IPBCC.b.14.1533, IPBCC.b.14.1534, IPBCC.b.14.1535,IPBCC.b.14.1536, dan IPBCC.b.13.1530; b) Marker 1 Kb, sumur ke-1: B. japonicum
sebagai kontrol positif, sumur ke-2: E.coli sebagai kontrol negatif. Hasil sekuensing dari tiga isolat IPBCC.b.13.1530, IPBCC.b.14.1531, dan IPBCC.b.14.1536 ditunjukkan dengan grafik dendogram yang menggambarkan letak nukleotida yang diamplifikasi secara hulu dan hilir (Lampiran 3). Sekuen
(a)
(b) Spesies I
Spesies IV
Spesies II (monofiletik)
18
nukleotida ketiga isolat tersebut menunjukkan hasil yang baik, ditunjukkan dengan adanya puncak yang tidak saling tumpang tindih. Berdasarkan pensejajaran dengan sekuen gen nifH di GenBank, diperoleh hasil yang menunjukkan bahwa sekuen parsial ketiga isolat tersebut memiliki kemiripan sekuen nifH dengan Herbaspirillum sp. B501 sebesar 95%-99%, Uncultured bacterium clone BN-A6 nifH sebesar 95%-98%, Uncultured bacterium clone IPA64 nifH sebesar 94%-99%, dan Uncultured bacterium clone IPA100 nifH sebesar 93%-98% (Tabel 5).
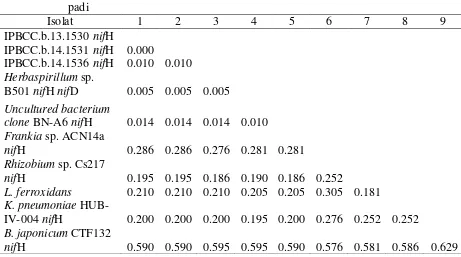
Hasil analisis pohon filogenetik gen nifH menunjukkan konsistensi bahwa ketiga isolat Streptomyces endofit (IPBCC.b.13.1530, IPBCC.b.14.1531, dan IPBCC.b.14.1536) memiliki kedekatan dengan gen nifH Herbaspirillum sp. yang berada pada kluster I, dan terpisah dari kluster outgroup. Analisis keragaman jarak genetik antara tiga isolat dengan Frankia sp., Rhizobium sp., L. ferrooxidans, dan K. pneumonia menunjukkan adanya perbedaan sekuen gen nifH sebesar 18-28% dan lebih dari 59% jika dibandingkan dengan sekuen gen nifH B. japonicum (Tabel 6).
Tabel 5 Persentase kemiripan sekuen gen nifH aktinomiset endofit padi dengan strain pembanding GenBank
*Keterangan: A= IPBCC.b.13.1530, B= IPBCC.b.14.1531, C= IPBCC.b.14.1536
Tabel 6 Matriks jarak genetik (p-distance) sekuen gen nifH aktinomiset endofit padi
19
Gambar 9 Pohon filogenetik gen nifH aktinomiset endofit padi sepanjang 336 nukleotida
Kemampuan Fiksasi Nitrogen oleh Aktinomiset Endofit Padi
Data uji in vitro aktivitas fiksasi N2 pada penelitian ini menunjukkan
bahwa terjadi konsistensi dengan hasil analisis gen nifH, dari tujuh isolat aktinomiset endofit, tiga isolat diantaranya yaitu IPBCC.b.13.1530, IPBCC.b.14.1531, dan IPBCC.b.14.1536 dinyatakan mampu memfiksasi nitrogen. Ketiga isolat tersebut mampu tumbuh dengan baik pada media bebas nitrogen (BNF) padat dengan karakteristik pertumbuhan koloni yang lebih tipis dibandingkan dengan pertumbuhan koloni pada media YSA (Gambar 10), sedangkan keempat isolat lainnya tidak tumbuh dengan baik.
Gambar 10 Pertumbuhan koloni aktinomiset endofit padi pada media BNF padat umur inkubasi 10 hari (atas) dibandingkan dengan pertumbuhan
koloni pada media YSA umur 10 hari (bawah).
A= IPBCC.b.13.1530, B= IPBCC.b.14.1531, C= IPBCC.b.14.1536. Melalui uji pengukuran produksi amonia, isolat IPBCC.b.13.1530, IPBCC.b.14.1531, dan IPBCC.b.14.1536 juga mampu memproduki amonia dengan konsentrasi masing-masing berturut-turut sebesar 0.065 ppm, 0.014 ppm, dan 0.076 ppm, sedangkan keempat isolat lainnya (IPBCC.b.14.1532, IPBCC.b.14.1533, IPBCC.b.14.1534, dan IPBCC.b.14.1535) menghasilkan rata-rata produksi amonia sebesar nol ppm atau tidak memproduksi amonia (Gambar 11). Dengan demikian dapat dinyatakan bahwa keempat isolat dari tujuh isolat
20
aktinomiset endofit tidak dapat memfiksasi N2 dari udara. Konsentrasi amonia
ditentukan dengan menggunakan persamaan kurva standar, dengan pengukuran bobot biomassa sel juga dilakukan dalam penelitian ini (Lampiran 4). Bobot biomassa sel aktinomiset endofit berbanding lurus dengan kemampuan produksi amonia masing-masing sel. Isolat IPBCC.b.14.1536 memiliki bobot biomassa yang paling tinggi sebesar 29.80 mg berbanding lurus dengan kemampuan produksi amonia yang juga lebih tinggi (0.076 ppm) dibandingkan dengan kedua isolat lainnya (Lampiran 4).
Gambar 11 Produksi amonia dari aktinomiset endofit padi setelah inkubasi selama 10 hari pada media BNF. B. japonicum sebagai kontrol
positif dan E. coli sebagai kontrol negatif.
Pembahasan
Karakterisasi Morfologi Koloni Aktinomiset Endofit Padi
21
Identitas Molekuler Gen 16S rRNA Aktinomiset Endofit Padi
Gen 16S rRNA merupakan komponen ribosom prokariot subunit 30S, yang umum digunakan untuk tujuan karakterisasi molekuler, menentukan hubungan filogenetik antar isolat prokariot dan menganalisis kekerabatannya dalam suatu ekosistem. Homologi sekuen 16S rRNA < 97.5% dapat dinyatakan sebagai spesies yang berbeda atau novel spesies (Stackebrandt dan Goebel 1994). Primer 20F didesain untuk mengamplifikasi gen 16S rRNA pada sebagian besar bakteri Gram positif, termasuk Streptomyces, sedangkan primer 1500R didesain untuk mengamplifikasi gen 16S rRNA pada hampir sebagian besar domain bakteri (Weisburg et al. 1991). Untuk mengamati hubungan kekerabatan antar takson, pohon filogenetik dikonstruksi dari sebagian besar daerah konservatif sekuen gen 16S rRNA, yang kemudian dikonfirmasi ciri fenotip secara klasik yaitu ciri-ciri morfologi dan karakteristik isolat termasuk warna spora dan penampakan koloni di atas media padat. Metode tersebut digunakan untuk mengklasifikasi dan mengidentifikasi genus Streptomyces hingga tingkat spesies (Labeda et al. 2011). BLAST merupakan program bioinformatika pada NCBI yang menggunakan analisis statistik untuk menghasilkan nilai skor dan E-value. Berdasarkan Claverie dan Notredame (2003), nilai skor yang ditunjukkan terdiri atas maximum score, total score, query cover, dan maximum identity, yang menunjukkan tingkat keakuratan nilai pensejajaran sekuens berupa nukleotida atau protein yang tidak diketahui dengan sekuens nukleotida atau protein yang tidak diketahui yang terdapat dalam data GenBank. Nilai skor berbanding lurus dengan tingkat homologi sekuens, semakin tinggi nilai skor maka semakin tinggi tingkat homologi antara kedua sekuens. E-value merupakan suatu nilai dugaan yang menggambarkan ukuran statistik yang signifikan terhadap kedua sekuens. Jika nilai E-value semakin tinggi, maka hal tersebut menunjukkan tingkat homologi antar sekuens rendah, sebaliknya jika semakin rendah maka menunjukkan bahwa tingkat homologi antar sekuens semakin tinggi. Nilai E-value yang bernilai nol menunjukkan bahwa kedua sekuens tersebut identik. Menurut Pertsemlidis dan Fondon III (2001) menyatakan jika kedua sekuens dinyatakan homologi, maka kedua sekuens tersebut memiliki hubungan evolusi atau hubungan kekerabatan.
22
al. (2009) beberapa hal yang perlu diamati pada karakter fenotip antara lain pemanfaatan sumber karbon, pertumbuhan mikrob pada suhu 37 ºC dan pertumbuhan mikrob pada kondisi 2% NaCl, sedangkan karakterisasi biokimiawi meliputi uji kandungan asam lemak, analisis isomer A2pm (diaminopimelic acid),
analisis tipe fosfolipid dan menaquinon, serta kandungan G+C. Berdasarkan konstruksi pohon filogenetik, keenam isolat tersebut terletak pada satu kluster yang sama dengan S. albolongus, S. cavourensis subsp. cavourensis, S. anulatus, dan S. bungoensis. Akan tetapi keenam isolat Streptomyces spp. endofit padi tersebut berbeda sumber isolasinya dibandingkan dengan keempat strain pembanding di atas. Adanya perbedaan sumber isolasi Streptomyces spp. endofit dimungkinkan merupakan salah satu faktor yang menyebabkan adanya keragaman sekuen gen 16S rRNA pada aktinomiset endofit.
S. cavourensis subsp. cavourensis NRRL 2740 merupakan aktinomiset yang diisolasi dari kultur kapang di laut, memiliki miselia aerial berwarna kuning pudar dan tipe rantai spora RF, serta dapat memproduksi antibiotik chromomycin dan flavensomycin (Skarbek dan Brady 1978). S. albolongus NBRC 13465 diisolasi dari tanah, memiliki miselia aerial berwarna putih atau kuning pudar dengan permukaan spora yang halus di atas media padat, dan memiliki tipe rantai spora RF (Shirling dan Gottlieb 1972). Spesies tersebut diketahui memiliki kemampuan antimikrob Gram positif dan negatif (Uddin et al. 2013). S. anulatus NBRC 12755 diisolasi dari tanah, memiliki miselia aerial berwarna kuning pudar atau putih dengan miselia substrat berwarna kuning kecokelatan, memiliki tipe rantai spora RA (Shirling dan Gottlieb 1972), dan diketahui mampu memproduksi dihidroabikoviromisin (Holmalahti et al. 1998). S. bungoensis diisolasi dari tanah dengan karakteristik morfologi koloni berwarna abu-abu dan tipe rantai spora berbentuk spiral, serta diketahui dapat memproduksi antibiotik (Eguchi et al. 1993).
23 misionin untuk mengatasi fungi fitopatogen (Cercos et al. 1962). Kemampuan fitopatogen yang dimiliki oleh S. misionensis tersebut juga didukung oleh data penelitian sebelumnya yang melaporkan bahwa isolat IPBCC.b.13.1530 yang memiliki kemiripan dengan S. misionensis dilaporkan mampu mengatasi penyakit HDB pada tanaman padi (Hastuti et al. 2012).
Identitas Molekuler Gen nifH Aktinomiset Endofit Padi
Penelitian ini merupakan studi baru yang menggunakan data molekuler untuk menunjukkan bahwa aktinomiset endofit yang diisolasi dari lima varietas tanaman padi di Indonesia, beberapa isolat diantaranya memiliki sekuen gen nifH. Selain itu, kajian mengenai sekuen gen nifH pada aktinomiset endofit masih jarang dilakukan. Perkembangan penelitian tentang aktinomiset endofit yang mampu memfiksasi nitrogen yaitu Cournoyer et al. (1993) melaporkan bahwa interaksi antara aktinomiset genus Frankia dan 25 genus tanaman dikotil dalam perkembangannya mampu memfiksasi nitrogen dengan membentuk nodul akar dan mentransfer nitrogen terfiksasi dari mikrosimbion ke tanaman. Selain itu, pada penelitian tersebut juga dilaporkan mengenai pohon filogenetik yang diperoleh dari analisis kombinasi nifH-D, nifD parsial, dan sekuen 16S rRNA yang digunakan untuk menginvestigasi hubungan evolusi dan simbiosis mikroorganisme. Penelitian selanjutnya yaitu dilaporkan bahwa Actinobacteria, khususnya genus Micromonospora dan Thermonospora yang berhasil diisolasi dari akar Casuarina equisetifolia, berhasil diamplifikasi menggunakan primer IGK dan NDR-I serta PolF dan PolR, dan keduanya memiliki sekuen gen nifH yang memiliki kemiripan dengan sekuen gen nifH Frankia sp. (Valdes et al. 2005). Studi terbaru yaitu dilaporkan bahwa Actinobacteria yang mendominasi akar dan rizosfer tanah tanaman rumput Lasiurus sindicus, berdasarkan analisis sekuen nifH menunjukkan hubungan kekerabatan dengan mikrob diazotrof seperti Azospirillum brasilense dan Rhizobium sp. (Chowdhury et al. 2009).
24
dan Buckley (2014) yang menyatakan bahwa tingginya keragaman sekuen nukleotida pada gen nifH merepresentasikan kaitannya dengan lingkungan asalnya. Isolat IPBCC.b.13.1530 diisolasi dari akar padi Inpari 9 Elo yang berasal dari sawah irigasi, IPBCC.b.14.1531 diisolasi dari daun padi Inpara 2 yang berasal dari sawah rawa, sedangkan IPBCC.b.14.1536 diisolasi dari daun Ciherang yang berasal dari sawah biasa. Menurut Gaby dan Buckley (2014) menyatakan bahwa perbedaan genetik antara gen nifH dan 16S rRNA tidak berkorelasi dengan nilai perbedaan sekuen nukleotida yang pada umumnya digunakan untuk menentukan spesies mikrob. Spesies yang memiliki perbedaan sekuen nukleotida < 3% pada gen 16S rRNA dapat memiliki perbedaan sekuen nukleotida gen nifH hingga 23%. Hal tersebut mengindikasikan bahwa keragaman sekuen gen 16S rRNA tidak dapat dikorelasikan dengan keragaman gen nifH untuk menentukan spesies. Keragaman jarak genetik antara tiga isolat (IPBCC.b.13.1530, IPBCC.b.14.1531, dan IPBCC.b.14.1536) dengan Frankia sp. Rhizobium sp., L. ferroxidans, serta K. pneumonia mengindikasikan keragaman yang tinggi gen nifH pada isolat aktinomiset endofit (Tabel 6). Herbaspirillum sp. diisolasi dari tanaman padi liar yang diketahui mampu mengkolonisasi akar dan batang tanaman padi, memfiksasi nitrogen, serta meningkatkan pertumbuhan tanaman padi (Zakria et al. 2007).
Kemampuan Aktinomiset Endofit Padi dalam Fiksasi N2 secara In Vitro
Berdasarkan uji in vitro, dari tujuh isolat Streptomyces spp. endofit pada penelitian ini, tiga isolat diantaranya yaitu IPBCC.b.13.1530, IPBCC.b.14.1531, dan IPBCC.b.1536 berpotensi untuk meningkatkan pertumbuhan tanaman padi melalui kemampuannya dapat tumbuh dan memproduksi amonia pada media pertumbuhan bebas nitrogen. Salah satu dari ketiga isolat tersebut yaitu IPBCC.13.1530 sudah dilaporkan sebelumnya bahwa isolat tersebut mampu tumbuh pada media dan memproduksi amonia pada media bebas nitrogen. Sedangkan keempat isolat lainnya (IPBCC.b.14.1532, IPBCC.b.14.1533, IPBCC.b.14.1534, dan IPBCC.b.14.1535) tidak mampu tumbuh dan menghasilkan amonia serta keempat isolat tersebut belum pernah diketahui mampu tumbuh dan memproduksi amonia pada media bebas nitrogen. Pembentukan amonia yang dihasilkan oleh tiga isolat di atas menjadi parameter dalam penentuan aktivitas isolat aktinomiset endofit dalam melakukan fiksasi N2.
Hasil produksi amonia dengam metode Phenat yang ditunjukkan secara kuantitatif (Gambar 11). Kemampuan produksi amonia aktinomiset endofit padi juga dipengaruhi oleh bobot kering biomassa sel. Semakin besar bobot biomassa sel aktinomiset maka semakin tinggi konsentrasi amonia yang diproduksi oleh masing-masing isolat (Lampiran 4). Uji produksi amonia secara kualitatif menunjukkan bahwa tiap isolat memproduksi amonia yang beragam, hal ini ditunjukkan dengan warna biru yang dihasilkan akibat reaksi pereaksi Phenat dengan amonia yang dihasilkan, semakin pekat warna biru maka semakin tinggi konsentrasi amonia (Lampiran 5).
Kemampuan untuk tumbuh pada media bebas nitrogen dan memproduksi amonia mengindikasikan kemampuannya dalam memfiksasi N2 di udara. Hal
25 tumbuh di media bebas nitrogen. Pernyataan Pratyasto (2012) juga mendukung data penelitian ini, yaitu isolat IPBCC.b.13.1530 sebelumnya telah diketahui mampu memfiksasi N2 melalui aktivitasnya dalam mereduksi asetilen,
memproduksi amonia, dan tumbuh di media bebas N2. Adanya konsistensi antara
hasil analisis gen nifH dengan uji in vitro mengindikasikan bahwa regulasi gen nifH pada proses nitrogenase Streptomyces spp. endofit berjalan dengan baik. Adanya kemampuan untuk tumbuh pada media bebas nitrogen, positif pada uji reduksi asetilen dan dilusi isotop 15N, serta adanya gen nifH yang teridentifikasi, memperkuat kesimpulan bahwa kelompok Actinobacteria dapat memfiksasi N2
menjadi amonia (Valdes et al. 2005). Isolat IPBCC.b.13.1530 dalam perannya di bidang pertanian selain dapat memfiksasi N2, juga telah dilaporkan dapat
berfungsi menghasilkan hormon IAA (Yusepi 2011) dan sebagai pupuk hayati (Rahayu 2012; Husniyah 2013). Jika sistem fiksasi nitrogen secara biologi dapat dilakukan pada tanaman padi, maka hal tersebut dapat meningkatkan suplai nitrogen yang tersedia bagi tanaman hingga sebesar 50 Kg N/Ha lahan (Cockrell 2004).
Sistem identifikasi Streptomyces spp. berdasarkan data sekuen gen 16S rRNA memberikan informasi mengenai sistematika Streptomyces yang kemudian dapat digunakan untuk mengidentifikasi beberapa isolat Streptomyces yang baru (Hyo et al. 2006). Data morfologi koloni, rantai spora, dan sekuen gen 16S rRNA dalam penelitian ini mengindikasikan bahwa tujuh isolat aktinomiset endofit padi tergolong ke dalam Streptomyces spp. dan menunjukkan keragaman yang tinggi, serta enam isolat diantaranya diprediksi berpeluang sebagai novel spesies. Berdasarkan penelitian sebelumnya dalam satu payung penelitian, dilaporkan bahwa sejumlah aktinomiset endofit berhasil diisolasi dari tanaman padi, dan diketahui mampu menghasilkan hormon IAA, memfiksasi N2, mengatasi hama
patogen tanaman, dan sebagainya. Akan tetapi kajian mengenai identifikasi aktinomiset endofit asal tanaman padi sejauh ini di Indonesia masih jarang dilakukan dan masih terbatas pada aktinomiset endofit yang bersifat culturable berdasarkan karakteristik morfologi dan rantai spora. Data mengenai identifikasi gen nifH aktinomiset endofit padi yang diperoleh pada penelitian ini merupakan informasi awal dalam kaitannya dengan kajian molekuler aktinomiset endofit padi. Oleh karena itu, kajian mengenai identifikasi molekuler gen 16S rRNA dan gen nifH pada aktinomiset endofit padi yang bersifat unculturable perlu dikaji untuk kelanjutan penelitian ini.
SIMPULAN DAN SARAN
Simpulan
26
IPBCC.b.14.1533, IPBCC.b.14.1534, IPBCC.b.14.1535, dan IPBCC.b.14.1536 tergolong ke dalam Streptomyces spp. dan enam isolat diantaranya diprediksi berpeluang sebagai novel spesies, dengan nilai identitas maksimum < 97%. Keenam isolat tersebut memiliki kemiripan morfologi dan sekuen dengan S. albolongus, S. cavourensis subsp. cavourensis, S. anulatus, dan S. bungoensis, sedangkan isolat IPBCC.b.13.1530 memiliki kemiripan sebesar 99% dengan S. misionensis. Berdasarkan identifikasi gen nifH, isolat IPBCC.b.13.1530, IPBCC.b.14.1531, dan IPBCC.b.14.1536 memiliki homologi sekuen gen nifH dengan Herbaspirillum sp. Secara in vitro, ketiga isolat tersebut juga mampu tumbuh dan memproduksi amonia pada media bebas nitrogen berkisar antara 0.014-0.076 ppm, sehingga berpotensi untuk memacu pertumbuhan tanaman. Isolat IPBCC.b.13.1530 dan IPBCC.b.14.1536 mampu memproduksi amonia lebih besar dibandingkan dengan kontrol positif B. japonicum.
Saran
Saran penelitian ini yaitu perlu kajian lebih lanjut tentang novelty isolat yang teridentifikasi spesies berbeda berdasarkan metode polifasik yaitu karakterisasi secara fenotip dan genotip. Karakterisasi fenotip yang perlu dilakukan lebih lanjut yaitu karakterisasi biokimia, nutrisi, kemotaksonomi, serologi, dan inhibitor, sedangkan karakterisasi genotip yang perlu dilakukan yaitu karakterisasi RNA, protein, dan hibridisasi DNA. Selain itu perlu adanya analisis metagenom untuk mengetahui keragaman aktinomiset endofit padi yang tidak dapat dikulturkan, yaitu berkisar ± 99% mikrob yang terdapat di alam ini.
DAFTAR PUSTAKA
Barraquio LW, Revilla L, Ladha JK. 1997. Isolation of endophytic diazotrophic bacteria from wetland rice. Plant Soil. 194:15-24.
Benson DR, Silvester WB. 1993. Biology of Frankia strain, actinomycete symbionts of actinorhizal plants. Microbial Rev. 57:293-319.
Campbell NA, Reece JB, Mitchell LG. 2002. Biologi. Edisi Kelima. Lestari R, penerjemah. Jakarta: Erlangga. Terjemahan dari: Biology. Fifth Edition. Cercos AP et al. 1962. Misionina: antibiotic opolieni coproduce ciderofor
Streptomyces misionensis nov.sp. R Inv Agr. 17:5-27.
Chelius MK, Lepo JE. 1999. Restriction fragment length polymorphism analysis of PCR-amplified nifH sequences from wetland plant rizosphere communities. Environ Technol. 20:883–889.