IDENTIFIKASI AKTINOMISET ENDOFIT
ASAL TANAMAN OBAT BERDASARKAN 16S rRNA
AGESSTY IKA NURLITA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
2
ABSTRAK
AGESSTY IKA NURLITA. Identifikasi Aktinomiset Endofit Asal Tanaman Obat Berdasarkan 16S rRNA. Dibimbing oleh YULIN LESTARI dan DEDY DURYADI SOLIHIN.
Aktinomiset indigenus diketahui memiliki keragaman hayati yang tinggi dan berpeluang sebagai novel spesies. Berbagai jenis senyawa bioaktif dengan beragam fungsi yang terkandung dalam tanaman, diduga dapat dihasilkan oleh mikroba endofit termasuk aktinomiset endofit pada tanaman tersebut. Aktinomiset juga banyak diisolasi dari berbagai tanaman obat, namun demikian identifikasi aktinomiset endofit asal tanaman obat berdasarkan molekuler belum banyak dikaji. Tujuan penelitian ini adalah mengidentifikasi aktinomiset endofit terpilih asal tanaman temulawak (CX 10.1), jati belanda (AJB 4(1)) dan pegagan (AEP-2) berdasarkan 16S rRNA. Isolat aktinomiset endofit terpilih diremajakan pada media Yeast Starch Agar (YSA). Isolasi DNA isolat CX 10.1, AJB 4(1) dan AEP-2 menggunakan Genomic DNA Mini Kit dan dilakukan amplifikasi gen penyandi 16S rRNA dengan PCR. Produk PCR disekuensing dan dianalisis secara bioinformatika untuk mengkonstruksi pohon filogenetik. Isolat CX 10.1 secara morfologi koloni dan rantai spora tidak memiliki miselium aerial dan spora tidak tertata. Berdasarkan gen penyandi 16S rRNA isolat CX 10.1 berkerabat dengan Micromonospora aurantiaca strain DSM 43813,
Micromonospora coxensis strain 2-30-b(28), dan Micromonospora krabiensis strain MA-2 masing-masing dengan nilai tingkat identitas maksimum 97%, 96%, dan 96%. Morfologi koloni isolat AJB 4(1) dan AEP-2 masing-masing memiliki miselium aerial berwarna coklat keabu-abuan dan putih. Berdasarkan morfologi rantai spora, kedua isolat ini memiliki rantai spora berbentuk spiral. Isolat AJB 4(1) berkerabat dengan Streptomyces misionensis strain NRRL B-3230,
Streptomyces africanus strain CPJVR-H, dan Streptomyces eurythermus strain ATCC 14975dengan masing-masing nilai tingkat identitas maksimum sebesar 98% ,97%, dan 97%. Isolat AEP-2 berkerabat dengan Streptomyces galilaeus strain JCM 4757, Streptomyces flavogriseus strain CBS 101.34, dan polyantibioticus strain SPR; DSM 44925 dengan masing-masing nilai tingkat identitas maksimum sebesar 96%, 95% dan 95%, isolat AEP-2 diprediksi sebagai novel spesies karena memiliki kekerabatan dengan strain rujukan dengan nilai identitas maksimum kurang dari 97%.
Kata kunci : Tanaman obat, aktinomiset endofit, 16S rRNA
ABSTRACT
AGESSTY IKA NURLITA. Identification of Endophytic Actinomycetes from Medicinal Plants Based on 16S rRNA. Under direction of YULIN LESTARI and DEDY DURYADI SOLIHIN.
Indigenous actinomycetes are known to have high biodiversity and chance to acquire a novel species. Various plants bioactive compounds with many functions may also be produced by endophytic microbes including actinomycetes. Many actinomycetes have been isolated from various medicinal plants. The research aimed to identify selected endophytic actinomycets from
Curcuma xanthorrhiza (CX 10.1), Guazuma ulmifolia Lamk (AJB 4(1)), and Centella asiatica
(AEP-2) based on 16S rRNA. Selected isolates of endophytic actinomycetes were grown in Yeast Starch Agar (YSA). DNA genome was isolated from CX 10.1, AJB 4(1), and AEP-2 isolates respectively, using Genomic DNA Mini Kit followed by amplification of 16S rRNA with PCR. PCR product was sequenced and analyzed by bio-informatics software to construct phylogenetic tree. The morphology colony of CX 10.1 did not produce aerial mycelium and spore chain type. Based on 16S rRNA gene sequence, CX 10.1 isolate was closed related with Micromonospora aurantiaca strain DSM 43813, Micromonospora coxensis strain 2-30-b(28) and Micromonospora krabiensis strain MA-2 with maximum identity 97%, 96% and 96% respectively. Meanwhile, morphology colony of AJB 4(1) and AEP-2 produced brown grey and white aerial mycelium, respectively and both of isolates produced Spiral spore chain type. The 16S rRNA sequence of AJB 4(1) showed to have the close relationship with Streptomyces misionensis strain NRRL B-3230, Streptomyces africanus strain CPJVR-H, and Streptomyces eurythermus strain ATCC 14975, with maximum identity 98%, 97% and 97% respectively. The 16S rRNA sequence of AEP-2 showed close related with Streptomyces galilaeus strain JCM 4757,with 96% of maximum identity, while the close relatedness with both Streptomyces flavogriseus strain CBS 101.34, and
S. polyantibioticus strain SPR; DSM 44925 was 95%. The maximum identity of AEP-2 was less then 97% and with further identification approaches may indicate a novel species.
i
IDENTIFIKASI AKTINOMISET ENDOFIT
ASAL TANAMAN OBAT BERDASARKAN 16S rRNA
AGESSTY IKA NURLITA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ii
Judul : Identifikasi Aktinomiset Endofit Asal Tanaman Obat Berdasarkan
16S rRNA
Nama : Agessty Ika Nurlita
NRP : G34070037
Disetujui
Dr. Ir. Yulin Lestari
Dr. Ir. Dedy Duryadi Solihin, DEA
NIP 19620710 198803 2 002 NIP 19561102 198403 1 003
Diketahui
Ketua Departemen Biologi
Dr. Ir. Ence Darmo Jaya Supena, M.Si.
NIP 19641002 198903 1 002
Tanggal Lulus:
iii
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya, sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2011 sampai April 2012 ini ialah identifikasi aktinomiset endofit asal tanaman obat. Penelitian ini bertujuan mengidentifikasi aktinomiset endofit asal tanaman obat berdasarkan sekuen 16S rRNA.
Penulis mengucapkan terima kasih kepada Ibu Dr. Ir. Yulin Lestari dan Bapak Dr. Ir. Dedy Duryadi ,DEA selaku pembimbing yang telah banyak memberikan nasehat, saran, motivasi, dan waktu konsultasi, serta solusi dari setiap permasalahan yang dihadapi penulis selama melaksanakan penelitian dan penyusunan karya ilmiah ini. Terima kasih pula penulis ucapkan kepada Bapak Dr. Tri Atmowidi, M.Si selaku dosen penguji komisi pendidikan Departemen Biologi FMIPA IPB, atas koreksi dan sumbang sarannya terhadap perbaikan karya ilmiah ini. Disamping itu, penulis juga ingin menyampaikan terima kasih kepada Ibu Heni dan Bapak Jaka selaku staf Laboratorium Mikrobiologi IPB, Bapak Puji dan Ibu Ratih selaku mahasiswa S3 serta Kak Sipriyadi, Kak Annisa dan Kak Yessy, yang telah membantu selama penelitian berlangsung. Ungkapan terima kasih juga disampaikan kepada Ayah, Ibu , dan adik, serta keluarga, atas segala doa dan kasih sayangnya. Terima kasih pula atas dukungan, motivasi, dan bantuan yang diberikan oleh sahabat-sahabat (Anez, Raisa, Rina, Eva, Aminah,Yakub), teman-teman, kakak-kakak, dan adik-adik di Biologi IPB, teman-teman BEM KM IPB,teman-teman seperjuangan Eka, Soraya dan Anggianing, Radini Ayu, Cipta Wiraswasta dan tim Saungkuriang (Cayo, Dean, Fajar, Dayat, Ratih) serta seluruh pihak yang telah memberikan doa dan dukungannya.
Semoga karya ilmiah ini dapat bermanfaat. Amin.
Bogor, Agustus 2012
iv
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 10 Agustus 1989 dari ayah bernama Hardi Rahadian dan ibu bernama Kastini. Penulis merupakan putri pertama dari tiga bersaudara. Tahun 2007 penulis lulus dari SMA Negeri 29 Jakarta dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI) dengan memilih mayor Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti masa perkuliahan, penulis menjadi asisten praktikum Biologi Dasar TPB pada tahun ajaran 2009/2010, 2010/2011 dan 2011/2012 dan asisten pratikum Fisiologi Prokariot tahun ajaran 2011/2012. Penulis juga pernah menjuarai beberapa lomba diantaranya ialah Juara I Bidang Presentasi Program Kreativitas Mahasiswa (PKM-Pengabdian Masyarakat) tahun 2009 dengan judul Pemanfaatan Ruang Terbuka di Halaman Sekolah untuk Taman Edukatif, penerima hibah DIKTI tingkat nasional untuk Program Kreativitas Mahasiswa (PKM-Pengabdian Masyarakat tahun 2009, dan PKM-Gagasan Tertulis tahun 2010).
Penulis juga aktif dalam kegiatan organisasi yaitu Badan Eksekutif Mahasiswa Keluarga Mahasiswa (BEM KM) IPB sejak tahun 2007/2008, 2008/2009 hingga 2010/ 2011 dengan jabatan tertinggi sebagai Sekretaris Kementerian Komunikasi dan Informasi pada tahun 2010/2011. Di samping itu, penulis juga pernah aktif dalam kegiatan organisasi Himpunan Mahasiswa Biologi (HIMABIO) IPB (tahun ajaran 2009/2010) pada kepanitiaaan Seminar PKM dan turut berpartisipasi pada kegiatan Roadshow EAGLE AWARDS 2011 & 2012, IPB Youth Journalist
2011, Workshop Natural Therapy With Temulawak for Drug Addiction Treatment 2011, IPB
v
DAFTAR ISI
Halaman
DAFTAR GAMBAR... vi
DAFTAR LAMPIRAN ... vi
PENDAHULUAN ... 1
BAHAN DAN METODE Waktu dan Tempat Penelitian ... 2
Peremajaan Biakan ... 2
Isolasi DNA ... 2
Sekuensing Gen 16S rRNA dan Analisis Bioinformatika ... 3
Konstruksi Pohon Filogenetik ... 3
HASIL Morfologi koloni dan rantai spora ... 3
Profil DNA hasil amplifikasi gen 16S rRNA ... 3
Pohon Filogenetik ... 5
PEMBAHASAN ... 6
SIMPULAN DAN SARAN ... 8
DAFTAR PUSTAKA ... 8
vi
DAFTAR GAMBAR
Halaman
1 Morfologi koloni aktinomiset endofit umur 12 hari pada media YSA (atas) dan morfologi rantai spora yang diamati pada mikroskop cahaya perbesaran 400x (bawah). ... 3 2 Profil DNA hasil amplifikasi gen penyandi 16S rRNA dengan PCR pada 3 isolat (1) CX.10.1;
(2)AJB 4(1); (3) AEP-2 ... 4 3 Analisis BLAST hasil sekuensing gen penyandi 16S rRNA pada masing-masing isolat (A) CX
10.1, (B) AJB 4(1), dan (C) AEP-2. ... 4 4 Pohon filogenetik aktinomiset endofit CX 10.1, asal tanaman temulawak, AJB 4(1), asal
tanaman jati belanda, dan AEP-2, asal tanaman pegagan. ... 5
DAFTAR LAMPIRAN
Halaman
1
PENDAHULUAN
Indonesia memiliki keanekaragaman hayati terbesar kedua setelah Brazil, dan
memiliki peluang besar untuk
mengembangkan penelitian berorientasi produk obat herbal yang berbasis pada tanaman obat. Berbagai jenis senyawa bioaktif dengan beragam fungsi yang terkandung dalam tumbuhan, diduga dapat dihasilkan oleh mikroba endofit pada tumbuhan tersebut (Strobel & Daisy 2003). Tanaman Kennedia nigricans digunakan oleh suku Aborigin untuk menyembuhkan luka dan infeksi. Aktinomiset endofit yang diisolasi dari tanaman tersebut ialah
Streptomyces sp. strain NRRL 30562 yang menghasilkan antibiotik peptida berspektrum luas yang disebut munumbicins
(Castillo et al. 2002). Aktinomiset endofit juga banyak diisolasi dari beragam tanaman obat indigenus (Pujiyanto et al. 2012).
Beberapa contoh tanaman yang telah diteliti memiliki khasiat yang sama dengan mikrob endofit yang terdapat pada tanaman tersebut, diantaranya yaitu temulawak (Curcuma xanthorrhiza) yang secara tradisional digunakan sebagai obat antidiabetes dan zat kurkumin dalam ekstrak temulawak berkhasiat sebagai antimikrob dan anti inflamasi (Irawan 2009; Samsundari 2006). Contoh tanaman obat yang lain adalah jati belanda (Guazuma ulmifolia
Lamk) yang banyak digunakan masyarakat untuk menurunkan berat badan melalui aktivitas antihiperlipidemia. Selain itu jati belanda diketahui mengandung tanin, kafein,
β sitosterol, fridelin, kaueronic acid,
flavonoid dan saponin (Utomo 2008).. Tanaman pegagan telah diketahui memiliki aktivitas antimikrob terhadap Escherichia coli, digunakan sebagai antihipertensi serta memiliki kandungan senyawa kimia yang memiliki efek terapeutik yaitu Centella Asiaticosid Selected Triterpenoid (CAST) terutama asam asiatikosida (glikosida asiatikosida) (Praswitasari 2006; Martono et al. 2010).
Mikrob endofit terdapat dalam beragam jenis tanaman terutama tanaman ladang, mengkolonisasi jaringan tanaman, mendapatkan nutrisi dan perlindungan dari tanaman inangnya (Hasegawa et al. 2006). Mikrob endofit dapat menghasilkan beragam metabolit sekunder potensial dalam bidang kesehatan, pertanian dan industri (Strobel & Daisy 2003). Mikrob endofit tersebut dapat berupa cendawan, bakteri non aktinomiset
dan aktinomiset. Tanaman inang yang bersimbiosis dengan mikrob endofit yang diketahui memilki aktivitas metabolit sekunder apabila dilakukan produksi metabolit sekunder secara in vitro pada kultur jaringan tanaman (bebas mikrob) ternyata tidak menunjukkan adanya aktivitas metabolit sekunder tersebut (Sari 2011).
Aktinomiset merupakan bakteri gram positif dengan kandungan guanin dan sitosin (G+C) yang tinggi (69-78%) dan dapat ditemukan pada habitat air, tanah serta pada tanaman (Otoguro 2009; Rugthaworn 2007). Aktinomiset dapat ditemukan pada jaringan tanaman dan umumnya banyak terdapat pada akar (Hasegawa et al. 2006). Selain itu, aktinomiset juga dapat berasosiasi dengan tanaman inangnya pada saat masa awal pertumbuhan tanaman (Combs & Franco 2003). Menurut Lestari (2006), aktinomiset indigenus memiliki beragam senyawa bioaktif yang dapat berfungsi, antara lain sebagai antimikrob, enzim inhibitor, dan pemacu tumbuh tanaman. Aktinomiset indigenus diketahui memiliki keragaman hayati yang tinggi dan berpeluang sebagai novel spesies (Otoguro
et al. 2009). Isolat aktinomiset endofit asal temulawak, jati belanda, dan pegagan masing-masing diketahui memiliki potensi sebagai penghasil senyawa antidiabetes (Irawan 2010), antihiperlipidemia (Wirawan 2010) dan antihipertensi (Sari 2011). Namun demikian, identifikasi aktinomiset endofit asal beberapa tanaman obat tersebut secara molekuler belum dilakukan.
Analisis gen penyandi 16S rRNA pada prokariot merupakan salah satu cara untuk identifikasi isolat bakteri secara
molekuler, menentukan hubungan
2
dua sekuen memiliki nilai tingkat identitas maksimum kurang dari 97.5% maka dapat dikatakan spesies yang berbeda (Stakebrandt & Goebel 1994). Identifikasi berdasarkan 16S rRNA aktinomiset endofit asal tanaman obat seperti temulawak, jati belanda dan pegagan yang masing-masing diketahui memiliki potensi untuk menghasilkan senyawa antidiabetes, antihiperlipidemia, dan antihipertensi belum pernah dilakukan. Luaran yang diharapkan dari penelitian ini adalah dapat memberikan informasi mengenai jenis aktinomiset endofit yang terdapat pada ketiga tanaman obat tersebut dan kemungkinan mendapatkan spesies baru aktinomiset endofit.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Februari 2011 hingga April 2012 bertempat di Laboratorium Mikrobiologi, Departemen Biologi FMIPA IPB.
Peremajaan Biakan
Isolat terpilih yang digunakan dalam penelitian ini berasal dari tanaman obat temulawak (CX 10.1), jati belanda (AJB 4 (1)) dan pegagan (AEP-2) yang merupakan koleksi isolat dari Dr. Ir. Yulin Lestari. Ketiga isolat diremajakan pada media tumbuh Yeast Starch Agar (YSA) (Komposisi per liter media: 2 g Yeast extract, 15 g starch soluble, 15 g agar-agar, 0.5 g KH2PO4, 0.5 g MgSO4) selama 10-14
hari pada suhu ruang.
Isolasi DNA
Isolasi DNA dilakukan dengan menggunakan Genomic DNA Mini Kit (Blood/Cultured Cell) dengan modifikasi yaitu penambahan glass bite dan larutan TE (Tris HCL, EDTA dan Triton X-100) serta penambahan perlakuan sebelum tahap isolasi DNA dimulai. Inokulum aktinomiset umur 12 hari dimasukkan secukupnya ke dalam tabung ependorf steril berisi 200 µl larutan TE (20 mM Tris-HCl; 2 mM EDTA; 1% Triton X-100; pH 8.0), kemudian disentrifugasi dengan kecepatan 559 g selama 1 menit. Supernatanyang dihasilkan dibuang, sedangkan pelet ditambahkan dengan 200 µl larutan TE (20 mM Tris-HCl; 2 mM EDTA; 1% Triton X-100; pH 8.0) dan 3 butir glass bite untuk divortex.
Proses isolasi DNA terdiri dari lima tahap yaitu tahap pra-lisis, lisis, pengikatan DNA, pencucian dan DNA elusi. Tahap pra-lisis dimulai dengan penambahan 200 µl
bufer lysozyme segar (20 mg/ml lysozyme; 20 mM Tris-HCl; 2 mM EDTA; 1% Triton X-100; pH 8.0) ke dalam larutan yang kemudian diinkubasi pada suhu ruang selama 10 menit. Selama waktu inkubasi, tabung dibolak-balik setiap 2-3 menit sekali. Proses selanjutnya adalah tahap lisis yaitu larutan isolat diitambahkan dengan 200 µl larutan bufer GB, dikocok selama 5 detik dan kemudian diinkubasi pada suhu 70° C selama 10 menit bersaman dengan larutan elusi. Selama inkubasi tabung ependorf yang berisi larutan isolat dikocok setiap 3 menit.
Tahap pengikatan DNA dimulai dengan menambahkan 200 µl etanol absolut ke dalam sampel dan dikocok sehingga terbentuk endapan. Sampel tersebut kemudian dipindahkan ke dalam kolom GD yang telah dipasangkan dengan tabung kolektif. Sampel disentrifugasi selama 2 menit dengan kecepatan 559 g. Larutan yang terdapat pada tabung kolektif dibuang dan diganti dengan tabung kolektif yang baru.
Proses isolasi dilanjutkan dengan tahap pencucian yaitu sampel ditambahkan dengan 400µl larutan W1 ke dalam kolom GD dan disentrifugasi selama 30 detik dengan kecepatan 559 g. Larutan yang terdapat pada tabung kolektif dibuang dan diganti dengan tabung kolektif yang baru dan pelet yang terdapat pada kolom GD ditambahkan dengan 600 µl larutan bufer penyuci. Proses selanjutnya adalah pelet disentrifugasi selama 30 detik dengan
kecepatan 559 g dan kemudian
disentrifugasi kembali selama 3 menit. Tahap DNA elusi dimulai dengan kolom GD yang berisi pelet yang dipasangkan dengan tabung ependorf steril dan ditambahkan dengan 100 µl larutan elusi ke dalam matriks kolom. Kemudian didiamkan selama 3-5 menit supaya larutan elusi menyerap ke dalam matriks kolom dan akhirnya larutan disentrifugasi selama 30 detik dengan kecepatan 559 g.
Hasil isolasi DNA diuji menggunakan elektroforesis pada 1% gel agrosa selama 50 menit pada 70V. Gel direndam selama 20 menit dalam ethidium bromide dan dilihat dengan UV transilluminator setelah elektroforesis.
Amplifikasi Gen Penyandi 16S rRNA dengan PCR
Komponen reaksi PCR untuk 40 µl volume total terdiri dari 4 µl DNA aktinomiset endofit, primer hulu 20F (5’ -GATTTTGATCCTGGCTCAG-3’), primer
-3
GTTACCTTGTTACGACTT-3’) (Weisburg
et al. 1991) masing-masing 0.8 µl, PCR bufer sebanyak 4 µl, 5 µl MgCl2 25mM, 1.6
µl dNTP 10 mM, 0.4 µl taq polymerase, dan 23.4 µl akuabides steril. Proses PCR terdiri dari pre-denaturasi pada suhu 94º C selama 5 menit, denaturasi 94º C selama 45 detik,
annealing 57º C selama 45 detik, extension
72º C selama 1 menit, dan final extension
72ºC selama 7 menit. DNA diamplifikasi sebanyak 30 siklus (Fermentas dengan modifikasi). Produk PCR dielektroforesis pada 1% gel agarosa selama 50 menit pada 70V dan kemudian gel direndam di dalam
ethidium bromide 5 µg/ml selama 20 menit, diamati dengan UV illuminator.
Sekuensing Gen 16S rRNA dan Analisis Bioinformatika
Sekuensing DNA dilakukan di Perusahaan Jasa Sekuensing First Base. Analisis sekuens gen 16S rRNA dilakukan dengan program BLAST.N yang terdapat di NCBI (www.ncbi.nlm.nih.gov/BLAST/). Hasil sekuensing gen 16S rRNA dianalisis dengan program bioinformatika yaitu Basic Local Alignment Search Tool (BLAST). BLAST merupakan salah satu basis data dan program yang sering digunakan untuk pensejajaran sekuen. Jenis BLAST yang digunakan untuk analisis sekuens gen 16S
rRNA adalah BLAST.N (BLAST
nukleotida). BLAST menggunakan analisis statistik untuk menghasilkan skor (bits) dan
E-value.
Konstruksi Pohon Filogenetik
Sebanyak tiga isolat diamati kemiripannya dengan spesies pada kelompok aktinomiset yang terdapat pada
GenBank NCBI. Analisis kekerabatan antar isolat aktinomiset endofit dilakukan berdasarkan pohon filogeni yang dilakukan dengan metode neighbor-joining (Saitou & Nei 1987) dengan menggunakan software
MEGA 5.0 (Tamura et al. 2011). Sebagai pembanding in group adalah sebagai berikut
M. aurantiaca strain DSM 43813 (No. akses NR.026279.1), M. coxensis strain 2-30-b(28) (No. akses NR.041350.1), M. krabiensis
strain MA-2 (No. akses NR.041266.1), S. misionensis strain NRRL B-3230 (No. akses NR.044138.1), S. africanus strain CPJVR-H (No. akses NR.025722.1), S. eurythermus
strain ATCC 14975 (No. akses NR 025869.1), S. galilaeus strain JCM 4757 (No. akses NR.040857.1), S. flavogriseus
strain CBS 101.34 (No. akses
NR.028988.1), dan S. polyantibioticus strain SPR; DSM 44925 (No. akses NR.043573.1).
Sedangkan pembanding out group adalah
Pseudomonas aeruginosa strain ME BHU4 (No. akses JN033551.1). Topologi dari kontruksi pohon filogeni diperiksa kembali atau dievaluasi dengan menggunakan analisis bootstrap dengan 1000 replikasi (Felsenstein 1985).
HASIL
Morfologi koloni dan rantai spora
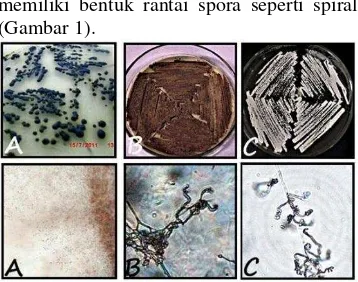
[image:11.595.331.510.384.525.2]Total aktinomiset endofit yang berhasil diremajakan terdiri 3 isolat yang berasal dari tanaman temulawak (CX 10.1), jati belanda (AJB 4(1)) dan pegagan (AEP-2). Semua isolat yang diperoleh dapat tumbuh dengan baik pada media YSA. Isolat asal tanaman temulawak CX 10.1 memiliki miselium substrat berwarna hitam dan tidak memiliki miselium aerial. Pengamatan mikrokopis koloni CX 10.1 menunjukkan spora yang tidak tersusun dalam rantai spora. Morfologi koloni isolat asal jati belanda dan pegagan yaitu AJB 4(1) dan AEP-2 masing-masing memiliki warna miselium aerial berwana coklat keabu-abuan dan putih. Isolat AJB 4(1) dan AEP-2 memiliki bentuk rantai spora seperti spiral (Gambar 1).
Gambar 1 Morfologi koloni aktinomiset endofit umur 12 hari pada media YSA (atas) dan morfologi rantai spora yang diamati pada mikroskop cahaya perbesaran 400x (bawah); (A) CX 10.1 asal tanaman temulawak , (B) AJB 4(1) asal tanaman jati belanda, dan (C) AEP-2 asal tanaman pegagan.
Profil DNA hasil amplifikasi gen 16S rRNA
Tiga isolat aktinomiset berhasil diamplifikasi gen penyandi 16S rRNA. Primer yang digunakan ialah primer spesifik yaitu 20 F dan 1500 R. Primer 20F didesain untuk mengamplifikasi gen penyandi 16S rRNA pada kelompok bakteri Gram positif termasuk genus Streptomyces, sedangkan primer 1500R didesain untuk seluruh domain bakteri (Weisburg et al. 1991). Hasil sekuensing dari tiga isolat ditunjukkan
4
menggambarkan letak nukleotida yang diampilifikasi secara hulu dan hilir. (Lampiran 1). Berdasarkan alignment
(pensejajaran) dengan sekuens 16S rRNA
[image:12.595.115.352.104.293.2]utuh dari hasil sekuensing dengan kedua primer tersebut, diperoleh pasangan basa sepanjang 1423 bp (Gambar 2.)
Gambar 2 Profil DNA hasil amplifikasi gen penyandi 16S rRNA dengan PCR pada 3 isolat (1) CX.10.1; (2)AJB 4(1); (3) AEP-2
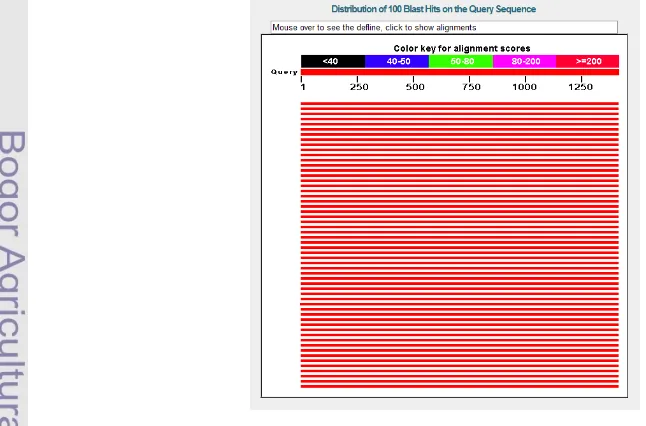
Variabilitas Gen 16S rRNA dan Hasil Analisis Bioinformatika
Tingkat kedua homologi kedua sekuens dapat ditunjukkan dengan nilai yang tertera pada warna grafik hasil BLAST. Nilai pada grafik yang berada di bawah angka 50 menunjukkan tingkat homologi kedua sekuens rendah yang dideskripsikan dengan warna hitam dan biru. Warna hijau, merah muda dan merah menunjukkan tingkat homologi yang semakin tinggi (Gambar 3). Hasil sekuensing gen 16S rRNA dari tiga isolat aktinomiset CX 10.1, AJB 4(1), dan AEP-2 memiliki identitas maksimum berkisar 95-98%. Nilai E yang dihasilkan dari semua isolat pada hasil BlastN bernilai 0 yang artinya ketiga isolat
yaitu CX 10.1, AJB 4(1) dan AEP-2
masing-masing identik dengan spesies
pembandingnya (Tabel 1). Berdasarkan hasil pensejajaran ketiga isolat dengan spesies pembandingnya menunjukkan adanya perbedaan nukleotida (Lampiran 2). Isolat CX 10.1 memiliki 29 nukleotida yang berbeda dengan spesies Micromonospora aurantiaca strain DSM 43813. Isolat AJB 4 (1) memiliki 17 nukleotida yang berbeda dengan spesies Streptomyces misionensis
strain NRRL-B3230. Isolat AEP-2 memiliki 47 nukleotida berbeda dengan spesies
Streptomyces galilaeus strain JCM 4757.
[image:12.595.112.435.516.729.2]5
Streptomyces griseoincarnatus strain LMG 19344 Streptomyces griseoflavus strain LMG 19344 Streptomyces tendae strain ATCC 19812
Streptomyces nodosus strain ATCC14899 Streptomyces eurythermus strain ATCC 14975
AJB 4(1)
Streptomyces misionensis strain NRRL-B3230
Streptomyces phaeoluteichromogenes strain NRRL B-5799 Streptomyces thermocarboxydus strain AT37
Streptomyces africanus strain CPJVR-H
Streptomyces thermocarboxydovorans strain AT52 Streptomyces thermospinosisporus strain AT10 Streptomyces koyangensis strain VK-60
Streptomyces galbus strain DSM 40089 Streptomyces capoamus strain JCM 4734
Streptomyces turgidiscabies strain ATCC 700248 Streptomyces tauricus strain JCM 4837
AEP-2
Streptomyces galilaeus stran JCM 4757 Streptomyces subrutilus strain DSM 40445
Streptomyces flavogriseus strain CBS 101.34 Streptomyces polyantibioticus strain SPR: DSM 44925 Streptomyces flavovirens strain NRRL-B 2685 Micromonospora chaiyaphumensis strain MC5-1
Micromonospora chokoriensis strain 2-19(6) Micromonospora mirobrigensis strain WA201 Micromonospora krabiensis strain MA-2
CX 10.1
Micromonospora aurantiaca DSM 43813
Micromonospora purpureochromogenes strain Antibioticos S.A. 2CG-3 Micromonospora coxensis strain 2-30-b(28)
Micromonospora halophytica DSM 43171
Pseudomonas aeruginosa strain ME BHU4
45 36 31 86 71 52 72 100 100 99 56 79 29 25 42 100 100 79 94 66 99 63 100 34 43 62 45 32 78
0 . 0 2
Tabel 1 Hasil BlastN sekuens 16S rRNA tiga isolat aktinomiset endofit sepanjang 1386 bp
Isolat asal Kemiripan Identitas
maksimum
Nilai E- value
No. Akses CX 10.1 Micromonospora aurantiaca strain DSM 43813
Micromonospora coxensis strain 2-30-b(28)
Micromonospora krabiensis strain MA-2; JSM 12869
97% 96% 96% 0.0 0.0 0.0 NR.026279.1 NR.041350.1 NR.041266.1 AJB 4 (1) Streptomyces misionensis strain NRRL B-3230
Streptomyces africanus strain CPJVR-H; NRRL B-24143
Streptomyces eurythermus strain ATCC 14975
98% 97% 97% 0.0 0.0 0.0 NR.044138.1 NR. 025722.1 NR.025869.1 AEP-2 Streptomyces galilaeus strain JCM 4757
Streptomyces flavogriseus strain CBS 101.34
Streptomyces polyantibioticus strain SPR; DSM 44925
96% 95% 95% 0.0 0.0 0.0 NR.040857.1 NR.028988.1 NR.043573.1
Catatan: DSM: Deutsche Sammlung von Mikroorganismen, NRRL: Northern Regional Research
Laboratory, CPJVR: C.E. Prince and J.M van Rooyen ,ATCC: American Type Culture Collection, JCM:
Japan Collection of Microorganism, CBS: Centraalbureau voor Schimmelcultur.
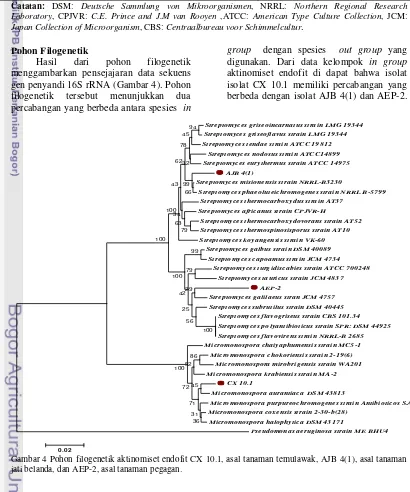
Pohon Filogenetik
Hasil dari pohon filogenetik menggambarkan pensejajaran data sekuens gen penyandi 16S rRNA (Gambar 4). Pohon filogenetik tersebut menunjukkan dua percabangan yang berbeda antara spesies in
group dengan spesies out group yang digunakan. Dari data kelompok in group
[image:13.595.94.535.104.276.2]aktinomiset endofit di dapat bahwa isolat isolat CX 10.1 memiliki percabangan yang berbeda dengan isolat AJB 4(1) dan AEP-2.
[image:13.595.103.513.277.769.2]6
PEMBAHASAN
Aktinomiset merupakan bakteri Gram positif yang berfilamen dan secara morfologi memiliki kemiripan dengan fungi (El-Nakkeb MA & Lechevalier HA 1962). Aktinomiset diketahui memiliki peranan besar yaitu menghasilkan beragam metabolit sekunder yang bermanfaat dan dapat diaplikasikan di bidang kesehatan seperti pengobatan terhadap manusia dan hewan, serta berperan penting di bidang pertanian (Janso & Carter 2010). Aktinomiset dikenal sebagai penghasil antibiotik terbesar, karena dari 16.500 antibiotik yang telah ditemukan, lebih dari setengahnya dihasilkan oleh aktinomiset (Raja & Prabakarana 2011).
Streptomyces merupakan genus terbesar dari aktinomiset yang telah diidentifikasi yaitu sebanyak 562 spesies. Kelompok ini mewakili group prokariot penghasil antibiotik dimana terdapat perbedaan secara morfologi dan genetik yang menarik (Ningthoujam et al. 2009). Genus Streptomyces memiliki ciri-ciri diantaranya adalah berfilamen dengan diameter 0.5–1 µm, aerob, bakteri Gram positif dan berproduksi seksual dengan spora yang dihasilkan miselium aerial (Holt et al.
1994). Miselium vegetatif merupakan kumpulan hifa yang tumbuh di dalam substrat. Miselium aerial merupakan kumpulan hifa yang tumbuh secara vertikal menembus substrat dan secara permanen berhubungan dengan udara. Taksonomi
Streptomyces (Stackebrandt et al. 1997) terdiri dari:
Domain : Bacteria
Filum : Actinobacteria
Kelas : Actinobacteria
Ordo : Actinomycetales
Famili : Streptomycetaceae
Genus : Streptomyces
Beberapa genus non-Streptomyces
seperti Micromonospora, Actinoplanes, Mycobacterium, Nocardia, Microbispora,
dan Actinomadura memiliki miselium substrat tetapi tidak memiliki miselium aerial (Miyadoh 1997).
Genus Micromonospora merupakan memiliki ciri-ciri diantaranya bakteri Gram positif, tidak memiliki miselium aerial, berdiameter 0.3– 0.6 µm, miselium vegetatif tidak bersekat dan memproduksi konidiospora yang berbentuk pendek dan bercabang sederhana. Kelompok ni juga memiliki aktifitas proteolitik yang kuat, sebagian besar anggotanya merupakan
termofilik dan dapat tumbuh pada suhu 65° C (Waksman 1940). Micromonospora
merupakan genus penghasil beberapa metabolit sekunder seperti antibiotik dan enzim inhibitor kedua setelah genus
Streptomyces dalam ordo Actinomycetales
(Qiu et al. 2008).
Isolat CX 10.1, AJB 4(1) dan AEP-2 merupakan aktinomiset endofit yang masing-masing diisolasi dari akar dan daun. Ketiga isolat ini merupakan mikrob endofit. Pengamatan mikrokopis koloni CX 10.1 menunjukkan spora yang tidak tersusun dalam rantai spora (Gambar 1). Karakteristik ini dimiliki anggota non-Streptomyces yang diketahui tidak memiliki miselium aerial dan
rantai spora, khususnya genus
Micromonospora dan Actinoplanes
(Miyadoh 1997). Bedasarkan pengamatan morfologi koloni, aktinomiset endofit yang merupakan genus Streptomyces adalah AJB 4(1) dan AEP-2 (Gambar 1). Kedua isolat tersebut memiliki miselium aerial masing-masing berwarna coklat keabu-abuan dan putih. Menurut Ghadin et al. (2008) miselium dari Streptomyces akan tumbuh pada substrat setelah empat hari inkubasi dan formasi miselium secara lengkap akan terjadi pada hari keenam inkubasi. Warna miselium aerial yang dihasilkan adalah putih hingga abu-abu. Morfologi rantai spora secara mikrokopis isolat AJB 4(1) dan AEP-2 menunjukkan tipe spiral yang merupakan karakteristik genus Streptomyces (Shirling & Gottlieb 1966).
7
hubungan evolusi (Pertsemlidis & Fondon III 2002).
Isolat CX 10.1 homolog dengan
Micromonospora aurantiaca DSM 43813 yang terdapat di kumpulan data NCBI dengan identitas maksimum sebesar 97%. Berbeda strain, Micromonospora aurantiaca
ATCC 27029 merupakan penghasil novel asam lemak metil ester (FAMEes). Spesies ini juga menghasilkan antibiotik yaitu aminoglikosida gentamisin (Diskchat et al.
2011). Micromonospora coxensis strain 2-30-b(28) merupakan aktinomiset yang homolog dengan isolat CX 10.1 dengan nilai identitas maksimum 96%. Micromonospora coxensis strain 2-30-b(28) merupakan bakteri yang diisolasi di daerah Chokoria, Bangladesh yang memiliki miselium vegetatif berwarna coklat terang seperti kayu manis pada media YSA (Ara & Kudo 2006). Isolat CX 10.1 berkerabat dekat dengan
Micromonospora krabiensis strain MA-2 dengan nilai identitas maksimum 96%. Isolat ini diisolasi dari tanah yang berada di perairan Thailand. Morfologi dari isolat ini adalah tidak memiliki miselium aerial dan akan berubah warna dari oranye menjadi hitam pada hari ke-21 (Jongrungruangchok 2008). Isolat CX 10.1 asal tanaman temulawak ini merupakan penghasil
inhibitor α glukosidase yang bekerja
menekan absorpsi glukosa pada penderita diabetes mellitus tipe II (Irawan 2009).
Hasil BlastN pada isolat AJB 4(1) memiliki homologi dengan Streptomyces misionensis strain NRRL B-3230 dengan identitas maksimum sebesar 98% dan memiliki homologi dengan Streptomyces africanus strain CPJVR-H dengan nilai identitas maksimum sebesar 97%.
Streptomyces africanus strain CPJVR-H ialah aktinomiset yang diisolasi dari tanah di daerah Cape Town, Afrika Selatan. Spesies ini memiliki rantai spora dengan tipe
Spirales, miselium aerial berwarna biru dan miselium vegetatif berwarna kuning (Meyers et al. 2004). Streptomyces eurythermus strain ATCC 14975 juga merupakan homologi dari isolat AJB 4(1) dengan nilai identitas maksimum sebesar 97%. Streptomyces eurythermus merupakan aktinomiset yang menyebakan penyakit pada kentang (Takeuchi 1996). Isolat AJB 4(1) berhasil diisolasi dari akar jati belanda dan memiliki senyawa antihiperlipidemia melalui aktivitas enzim lipase (Wirawan 2010). Menurut Sharma et al. (2005) akar lateral merupakan bagian tumbuhan yang
paling banyak dihuni oleh mikrob endofit. Hal ini dikarenakan mikrob endofit dari rhizosfer akan masuk ke dalam jaringan tanaman melalui akar lateral kemudian menyebar ke dalam ruang interseluler dan berkas pembuluh. Selain akar lateral, mikrob endofit masuk ke dalam jaringan tanaman melalui stomata, lentisel, trikoma dan pada saat perkecambahan. Mikrob endofit masuk ke dalam jaringan tanaman dengan menembus lapisan epidermis rambut akar atau melalui proses enzimatis dengan mendegradasi dinding sel akar tanaman inang. Mikrob endofit juga bisa memasuki tanaman pada saat tanaman mengalami luka yang disebabkan oleh faktor biotik (fungi, serangga, nematoda parasit) dan faktor abiotik (perubahan suhu, penebangan) (Siddiqui & Shaukat 2003).
Isolat AEP-2 berkerabat dengan
Streptomyces galilaeus strain JCM 4757 dengan identitas maksimum sebesar 96%.
Streptomyces galilaeus mampu menghasilkan anthracycline I (Ketelä et al.
2002). Tingkat identitas maksimum 95% didapat dari tingkat homologi AEP-2 dengan galur rujukan terdapat di GenBank yaitu
Streptomyces flavogriseus strain CBS 101.34 yang memiliki aktivitas selulosa (Wirth & Ulrich 2002). Streptomyces polyantibioticus strain SPR; DSM 44925 berkerabat dekat dengan isolat AEP-2 dengan nilai identitas maksimum sebesar 95%. Isolat ini diisolasi dari sungai di daerah Afrika Selatan. Karakteristik isolat berdasarkan morfologi rantai spora yaitu memiliki tipe Rectiflexibiles. Morfologi koloni berupa miselium vegetatif berwarna coklat dan miselium aerial berwana putih pada media ISP 4 (Hill & Meyers 2009). AEP-2 merupakan isolat aktinomiset endofit asal tanaman pegagan yang memiliki aktivitas penghambat Angiotensin Converting Enzyme (ACE) sehingga memiliki potensi untuk dikembangkan sebagai obat penurun tekanan darah tinggi (hipertensi) (Sari 2011).
Menurut Stackkebrandt dan Goebel (1994) bahwa dua sekuen homologi yang memiliki tingkat identitas maksimum kurang dari 97.5% merupakan 2 spesies yang berbeda. Seperti data matriks yang tertera dalam lampiran 2, isolat AEP-2 memiliki 47 nukleotida yang berbeda dengan spesies pembandingnya yang paling dekat homologinya yaitu Streptomyces galilaeus
8
morfologi dan molekuler untuk
membuktikan bahwa AEP-2 merupakan novel spesies yaitu melalui identifikasi berdasarkan karakter fenotipik, kimiawi dan molekuler (pendekatan polyphasic). Beberapa hal yang perlu diamati pada karakter fenotipik adalah pemanfaatan sumber karbon, pertumbuhan bakteri pada kondisi suhu 37°C dan pertumbuhan bakteri pada kondisi 2% NaCl. Karakter yang perlu diamati secara kimiawi adalah kandungan asam lemak yang dimiliki oleh bakteri tersebut, analisis isomer A2pm
(diaminopimelic acid), analisis tipe fosfolipid dan menaquinon serta kandungan G+C. Secara molekuler, karakter yang perlu dilakukan kembali adalah uji hibridisasi DNA (Otoguro et al. 2009).
Pohon filogenetik sekuens gen penyandi 16S rRNA ketiga isolat aktinomiset endofit CX 10.1, AJB 4(1) dan AEP-2 menunjukkan bahwa CX 10.1 memiliki posisi percabangan yang berbeda dengan AEP-2 dan AJB 4(1). Isolat CX 10.1 berada dalam satu kelompok dengan
Micromonospora aurantiaca DSM 43813 dengan nilai bootstrap sebesar 45. Isolat AJB 4(1) berada dalam satu kelompok dengan Streptomyces misionensis strain NRRL B-3230 dengan nilai bootstrap
sebesar 99. Isolat AEP-2 berada dalam satu kelompok dengan Streptomyces galilaeus
strain JCM 4757 dengan nilai bootstrap
sebesar 29. Dalam pohon filogenetik ini, spesies Pseudomonas aeruginosa strain ME BHU4 merupakan bakteri Gram negatif yang dijadikan sebagai out of group
sehingga memiliki cabang yang berbeda dengan ketiga isolat yang dianalisis.
SIMPULAN DAN SARAN
Simpulan
Sebanyak 3 isolat aktinomiset endofit asal tanaman obat yaitu CX 10.1, AJB 4(1) dan AEP-2 berhasil diidentifikasi berdasarkan morfologi koloni, rantai spora dan gen penyandi 16S rRNA. Berdasarkan morfologi koloni, rantai spora dan gen penyandi 16S rRNA isolat CX 10.1 merupakan anggota genus Micromonospora, sedangkan isolat AJB 4(1) dan AEP-2 merupakan anggota genus Streptomyces. Isolat AEP-2 diprediksi sebagai novel spesies karena memiliki kekerabatan dengan strain rujukan dengan nilai identitas maksimum kurang dari 97%.
Saran
Perlu dilakukan kajian lebih lanjut tentang novelty ketiga isolat tersebut berdasarkan karakter morfologi, molekuler, fenotipik dan kimiawi.
DAFTAR PUSTAKA
Ara I, Kudo T. 2007. Two new species of
the genus Micromonospora:
Micromonospora chokoriensis sp.nov.
and Micromonospora coxensis sp.nov., isolated from sandy soil. J Gen Appl Microbiol 53:29-37.
Castillo et al. 2002. Munumbicins, wide spectrum antibiotics produced by
Streptomyces NRRL 30562, endophytic on Kennedia nigriscans. Microbiology
148:2675-2685.
Claverie JM, Notredame C. 2003.
Bioinformatics for Dummies. Indianapolis: Wiley Publishing.
Coombs JT, Franco CMM. 2003. Isolation and identification of actinobacteria from surface-sterilized wheat roots. Appl Environ Microbiol 69:5603-5608. Diskchat JS, Bruns H, Riclea R. 2011. Novel
fatty acid methyl esters from the
actinomycete Micromonospora
aurantiaca. Beilstein J Org Chem
7:1697-1712.
El-Nakkeb MA, Lechevalier HA. 1962. Selective isolation of aerobic actinomycetes. Appl Microbiol 11:75-77 Felsenstein J. 1985. Confidence limits on
phylogenies: an approach using the bootsrap. Evolution 39:783-791.
Ghadin N et al. 2008. Isolation and characterization of novel endophytic
Streptomyces SUK 06 with antimicrobial activity from Malaysian plant. Asian J Plant Sci 7:189-194.
Hasegawa S, Meguro A, Shimizu M, Nishimura T, Kunoh H. 2006. Endophytic actinomycetes and their interaction with host plants.
Actinomycetologica 20:72-81.
Hill MR, Meyers PR. 2009. Streptomyces polyantibioticus sp. nov., isolated from the banks of a river. Int J Sys Evol Microbiol 59:1302-1309.
Holt JG et al. 1994. Bergey’s Manual of
Determinative Bacteriology. Ed ke-9. Philadelphia: A Wolters Kluwers Company.
Irawan D. 2009. Isolasi aktinomiset endofit tanaman obat yang berpotensi sebagai
-9
glukosidae [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Janso JE, Carter GT. 2010. Biosynthetic potential of phylogenetically unique endophytic Actinomycetes from tropical plants. Appl Environ Microbiol 76:4337-4386.
Jongrungruangchok S, Tanasupawat S, Kudo T. 2008. Micromonospora krabiensis sp. nov., isolated from marine soil in Thailand. J Gen Appl Microbiol
54:127-133.
Ketelä M.M, et al. 2002. Molecular evolution of aromatic polyketides and comparative sequence analysis of polyketide ketosyhnthase and 16S ribosomal DNA genes from various
Streptomyces species. Appl Environ Microbiol 68:4472-4479.
Lestari Y. 2006. Identification of indigenous
Streptomyces spp. producing antibacterial compounds. J Mikrobiol Indones. 11:99-101.
Martono B, Ghulamahdi M, Darusman LK, Aziz SA, Bermawie N. 2010. Kriteria penanda seleksi produktivitas terna dan antioksida pda pegagan (Cantella Asiatica (L.) Urban). J Litri. 16:12-29. Meyers PR, et al. 2004. Streptomyces
africanus sp.nov., a novel streptomycete with blue aerial mycelium. Int J Sys Evol Microbiol 54:1531-1535.
Miyadoh S. 1997. Morphology and Phylogeny of Actinomycetes. Atlas of Actinomycetes. The Society for Actinomycetes Japan.
Ningthoujam D, Sanasam S, Nimaichand S. 2009. A Streptomyces strain LSI-128 exhibiting broad spectrum antimicrobial activity. Medwell Journals 4:1085-1091. Otoguro M, et al. 2009. Streptomyces
baliensis sp. Nov., isolated from Balinese oil. Int J Sys Evol Microbiol
59:2158-2161.
Pangastuti A. 2006. Definisi spesies prokaryota berdasarkan urutan basa gen penyandi 16S rRNA dan gen penyandi protein. Biodiversitas 7:292-296.
Pertsemlidis A, Fondon III JW. 2001. Having a BLAST with bioinformatics (and avoiding BLAST phemy). Gen Biol
2:1-10.
Praswitasari R. 2006. Efek dekok daun pegagan (Centella asiatica) sebagai antimikroba terhadap Escherichia coli
[skripsi]. Malang: Fakultas Kedokteran, Universitas Muhammadiyah Malang.
Pujiyanto S, Lestari Y, Suwanto A, Budiarti S, Darusman LK. 2012. Alpha-glucosidase inhibitor activity and characterization of endophytic actinomycetes isolated from some Indonesian diabetic medicinal plant. Int J Pharm Pharm Sci 4:327-333.
Qiu D, Ruan J, Huang Y. 2008. Selective isolation and rapid identification of members of the genus Micromonospora.
Appl Environ Microbiol 74:5593-5597.
Raja A, Prabakarana P. 2011.
Actinomycetes and drug-an overview.
Am J Drug Discov Dev 1:75-84.
Rugthaworn P, Dilokkunanant U, Sangchote S, Piadang N, Kipreechavanich V. 2007. A search and improvement of actinomycete strains for biological control of plant pathogens. Kasetsart J Nat Sci 41:248-254.
Saitou N, Nei M. 1987. The neighbor-joining method: a new method for reconstructing phylogenetic trees. Mol Biol Rev 67:491-502
Samsundari S. 2006. Pengujian ekstrak temulawak dan kunyit terhadap resistensi bakteri Aeromonas hydrophilla yang menyerang ikan mas (Cyprinus caprio).
Gamma 2:71-83.
Sari WE. 2011. Aktivitas antihipertensi aktinomiset endofit asal tanaman pegagan dan belimbing wuluh [skripsi]. Bogor. Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Sharma PK, Sarita S, Prell J. 2005. Isolation and characterization of an endophytic bacterium related to Rhizobium/Agrobact erium from wheat (Triticum aestivum L.) roots. Current Sci 89:608-610.
Shirling EB, Gottlieb D.1966. Methods for characterization of Streptomyces species.
Int J Sys Bacteriol 16:313-340.
Siddiqui IA, Shaukat SS. 2003. Endophytic bacteria: prospects and opportunities for the biological control of plant-parasitic nematodes. Nematol medit 31:111-120. Stackebrandt E, Goebel B.M. 1994.
Taxonomic note: A place for DNA-DNA reassociation and 16S rRNA sequence analysis in the present species definition in bacteriology. Int J Sys Evol Microbiol
44:846-849.
Stackebrandt E, Rainey FA, Ward-Rainey NL. 1997. Proposal for a new hierarchic classification system, Actinobacteria
10
Strobel G, Daisy B. 2003. Bioprospecting for microbial endophytes and their natural product. Microbial Mol Biol Rev
67:491-502.
Takeuchi T, Sawada H, Tanaka F, Matsuda I. 1996. Phylogenetic analysis of
Streptomyces spp.causing potato scab based on 16S rRNA sequences. Int J Sys Bacteriol 46:476-479.
Tamura K et al. 2011. MEGA5 : Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Mol Biol Evol 28:2731-2739. Utomo AW. 2008. Uji toksisitas akut
ekstrak alcohol daun jati belanda (Guazuma ulmifolia Lamk) pada tikus wistar [skripsi]. Semarang, Fakultas Kedokteran, Universitas Diponegoro.
Waksman SA. 1940. On the classification of actinomycetes. J Bacteriol 39:549-558. Wirawan B. 2010. Potensi bakteri endofit
asal tanaman obat sebagai penghasil senyawa antihiperlipidemia melalui aktivitas lipase. [skripsi]. Bogor. Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Weisburg WG, Barns SM, Pelletier DA, Lane DJ. 1991. 16S ribosomal DNA amplification for phylogenetic study. J Bacteriol 173:697-703.
Wirth S, Ulrich A. 2002. Cellulose-degrading potentials andphylogenetic classification of carboxymethyl-cellulose decomposing bacteria isolated from soil.
11
12
Lampiran 1Hasil sekuensing gen penyandi 16S rRNA
CX 10.1 Sekuens 20F
13
14
15
16
18
Lampiran 2 Hasil alignment nukleotida gen 16S rRNA dari ketiga isolat aktinomiset endofit
CX 10.1 G G G G T A C T C G A G C G G C G A A C G G G T G A G T A A C A C G T G A G C A A C C T G C C C C A G G C T T T G G G A T A A C C C C G G G A A A C C G G G G C T A A T A C C G A A T A T G A C C T C
Micromonospora aurantiaca DSM 43813 . . . C . . . .
Micromonospora coxensis strain 2-30-b(28) . . . T . . . .
Micromonospora krabiensis strain MA-2 . . . T . . . T C . . . G . . . G . . . G . . . T
AJB 4(1) . . . G G A T T . . T . . . G . . . . T . . . T G C A . . C . . . C . . G . . . T . . . G . . . T . . . G . . . . - G A . C A
Streptomyces misionensis strain NRRL-B3230 . . . G G A T T . . T . . . G . . . . T . . . T G C A . . C . . . C . . G . . . T . . . G . . . T . . . G . . . . - G A . C A
Streptomyces eurythermus strain ATCC 14975 . . A . G G G A T T . . T . . . G . . . . T . . . T T C A . . C . . . C . . G . . . T . . . G . . . T . . . G . . . C - G A G C .
Streptomyces africanus strain CPJVR-H . . T . G G G A T T . . T . . . G . . . . T . . . T G C A . . C . . . C . . G . . . T . . . G . . . T . . . G . . . C - . A . C A
AEP-2 . . . . G G G G A T . T G . . G C G . . C . . . T G . . . G C . . . T T . C . . . T T C C . . . C C . . G . . . T . . . G . . . T T . . . . C . . . G G A . A T . T T . T
Streptomyces galilaeus stran JCM 4757 . . T . G G G A T T . . T . . . G . . . . T . . . T T C A . . C . . . C . . G . . . T . . . G . . . T . . . G . . . A C . . T . .
Streptomyces flavogriseus strain CBS 101.34 . . . G G A T T . . T . . . G . . . . T . . . T T C A . . C . . . C . . G . . . T . . . G . . . T . . . G . . . A C . . T C T
Streptomyces polyantibioticus strain SPR: DSM 44925 . . . G G A T T . . T . . . G . . . . T . . . T T C A . . C . . . C . . G . . . T . . . G . . . T . . . G . . . A C . . T C T
CX 10.1 T G A C C - G C A T G - G T T G G T G G T G G A A A G T T T T - - T C G G C T T G G G A T G G G C T C G C G G C C - T A T C A G C T T G T T G G T G G G G T G A T G G C C T A C C A A G G C G A C G A
Micromonospora aurantiaca DSM 43813 . . . - . . . - . . . - - . . . - . . . .
Micromonospora coxensis strain 2-30-b(28) C . . T . - . . . - . . . - - . . . C . . . - . . . .
Micromonospora krabiensis strain MA-2 C . G A . - . . . - T C . . . G . . . - - . . . C . . . - . . . .
AJB 4(1) . C T T G G . . . . C - C . . . A . . . T . . . . C . C C G G C - . . T G C A . . . A . . C . . . C . . . A . . . A . C . . . T C . . . .
Streptomyces misionensis strain NRRL-B3230 . C T T G G . . . . C - C . . . A . . . T . . . . C . C C G G C - . . T G C A . . . A . . C . . . - . . . A . . . A . . . T C . . . .
Streptomyces eurythermus strain ATCC 14975 . C C A A G . . . . C - T . G . A G . T . . . C . C C G G C - . . T G A A . . . A . . C . . . - . . . A . . . A . . . T C . . . .
Streptomyces africanus strain CPJVR-H C T . G G G . . . . C T C . . . C . C C G G C - . . T G C A . . . A . . C . . . - . . . A . . . A . . . A . . . T C . . . .
AEP-2 C . C . . T . . . - . G . . . G . . . T A . . . . C . C C C G C . . . T A A A . . . . A A C . C . C G . . . . - . . . A . . . A G . . . . T C . . . .
Streptomyces galilaeus stran JCM 4757 . . C T . - T . . . . - . G C A . G . . . T A . . . . C . C C G G C - . . T G A A . . . A . . C . . . - . . . A . . . A . . . T C . . . .
Streptomyces flavogriseus strain CBS 101.34 G T C . . - . . . - . G A C . G . . . T A . . . . C . C C G G C - . . T G A A . . . A . . C . . . - . . . .
Streptomyces polyantibioticus strain SPR: DSM 44925 G T C . . - . . . - . G A C . G . . . T A . . . . C . C C G G C - . . T G A A . . . A . . C . . . - . . . .
CX 10.1 C G G G T A G C C G G C C T G A G A G G G C G A C C G G C C A C A C T G G G A C T G A G A C A C G G C C C A G A C T C C T A C G G G A G G C A G C A G T G G G G A A T A A T T T G C A C A A T G G G C
Micromonospora aurantiaca DSM 43813 . . . - - . . . .
Micromonospora coxensis strain 2-30-b(28) . . . - - . . . .
Micromonospora krabiensis strain MA-2 . . . - - . . . .
AJB 4(1) . . . - - . . . .
Streptomyces misionensis strain NRRL-B3230 . . . - - . . . .
Streptomyces eurythermus strain ATCC 14975 . . . - - . . . .
Streptomyces africanus strain CPJVR-H . . . - - . . . .
AEP-2 . . . C . . . C . . . T . . . - - . . . . C . . . .
Streptomyces galilaeus stran JCM 4757 . . . - - . . . .
Streptomyces flavogriseus strain CBS 101.34 . . . - - . . . .
Streptomyces polyantibioticus strain SPR: DSM 44925 . . . - - . . . .
CX 10.1 G G A A G G C C C T G A T G C A G C G A C G G C C C G C G T G A G G G A T G A C G G C C T T C G G G T T G T A A A C C T C T T T C A G C A G G G A C G A A A G C G T A A G T
-Micromonospora aurantiaca DSM 43813 . . . - - . . . - . . . . . .
-Micromonospora coxensis strain 2-30-b(28) . . . - - . . . - . . . . . .
-Micromonospora krabiensis strain MA-2 . . . - - . . . - . . . . . . C . . . .
-AJB 4(1) . A . . . - - . . . - . . . A . . . . . . A . . . .
-Streptomyces misionensis strain NRRL-B3230 . A . . . - - . . . - . . . A . . . . . . A . . . .
-Streptomyces eurythermus strain ATCC 14975 . A . . . - - . . . - . . . A . . . . . . A . . . .
-Streptomyces africanus strain CPJVR-H . A . . . - - . . . - . . . A . . . . . . A . . . .
-AEP-2 . A . . . - - . . . - . . . A . . . . . . A . . . .
-Streptomyces galilaeus stran JCM 4757 . A . . . - - . . . - . . . A . . . . . . A . . . .
-Streptomyces flavogriseus strain CBS 101.34 . A . . . - - . . . - . . . A . . . . . . A . . . .
-19
CX 10.1 - - - - G A C G G T A C C T G C A G A A G A A G C G C C G G C C A A C T A C G T G C C A G C A G C C G C G G T A A G A C G T A G G G C G C G A G C G T T G T C C G G A T T T A T T G G G C G T A A A G
Micromonospora aurantiaca DSM 43813 - - - - . . . .
Micromonospora coxensis strain 2-30-b(28) - - - - . . . .
Micromonospora krabiensis strain MA-2 - - - - . . . .
AJB 4(1) - - - - . . . T . . . T . . . A . . . .
Streptomyces misionensis strain NRRL-B3230 - - - - . . . T . . . T . . . A . . . A . . . .
Streptomyces eurythermus strain ATCC 14975 - - - - . . . T . . . T . . . A . . . A . . . .
Streptomyces africanus strain CPJVR-H - - - - . . . T . . . T . . . A . . . .
AEP-2 - - - - . . . T . . . T . . . A . . . A . . . .
Streptomyces galilaeus stran JCM 4757 - - - - . . . T . . . T . . . A . . . A . . . .
Streptomyces flavogriseus strain CBS 101.34 - - - - . . . T . . . T . . . A . . . A . . . .
Streptomyces polyantibioticus strain SPR: DSM 44925 - - - - . . . T . . . T . . . A . . . A . . . .
CX 10.1 A G C T C G T A G G C G G C T T G T C G C G T C G A C C G T G A A A A C T T G G G G C T C A A C C C C A A G C C T G C G G T C G A T A C G G G C A G G C T A G A G T T C G G T A G G G G A G A C T G G
Micromonospora aurantiaca DSM 43813 . . . .
Micromonospora coxensis strain 2-30-b(28) . . . .
Micromonospora krabiensis strain MA-2 . . . .
AJB 4(1) . . . A . . . G T T . . . G . C C . . . T . . . G G . T . . . . A . . . T C . .
Streptomyces misionensis strain NRRL-B3230 . . . A . . . G T T . . . G . C C . . . T . . . G G . T . . . . A . . . T C . .
Streptomyces eurythermus strain ATCC 14975 . . . A . . . G T T . . . G . C C . . . T . . . G G . T . . . . A . . . T C . .
Streptomyces africanus strain CPJVR-H . . . A . . . G T T . . . G . C C . . . T . . . G G . T . . . . A . . . T C . .
AEP-2 . . . A . . . G G T . . . G . C C . . . T . . . G G . T . . . . A T . . . T A . . . G T . . . T C . .
Streptomyces galilaeus stran JCM 4757 . . . A . . . G G T . . . G . C C . . . T . . . G G . T . . . . A T . . . T A . . . G T . . . T C . .
Streptomyces flavogriseus strain CBS 101.34 . . . A . . . G A T . . . G . C C . . . T . . . G G . T . . . . A T . . . T A . . . G T . . . T C . .
Streptomyces polyantibioticus strain SPR: DSM 44925 . . . A . . . G A T . . . G . C C . . . T . . . G G . T . . . . A T . . . T A . . . G T . . . T C . .
CX 10.1 A A T T C C T G G T G T A G C G G T G A A A T G C G C A G A T A T C A G G A G G A A C A C C G G T G G C G A A G G C G G G T C T C T G G G C C G A T A C T G A C G C T G A G G A G C G A A A G C G T G
Micromonospora aurantiaca DSM 43813 . . . .
Micromonospora coxensis strain 2-30-b(28) . . . .
Micromonospora krabiensis strain MA-2 . . . .
AJB 4(1) . . . A . . . .
Streptomyces misionensis strain NRRL-B3230 . . . A . . . .
Streptomyces eurythermus strain ATCC 14975 . . . A . . . .
Streptomyces africanus strain CPJVR-H . . . A . . . .
AEP-2 . . . A . . . A T . . . .
Streptomyces galilaeus stran JCM 4757 . . . A . . . A T . . . .
Streptomyces flavogriseus strain CBS 101.34 . . . A . . . A T . . . .
Streptomyces polyantibioticus strain SPR: DSM 44925 . . . A . . . A T . . . .
CX 10.1 G G G A G C G A A C A G G A T T A G A T A C C C T G G T A G T C C A C G C T G T A A A C G T T G G G C G C T A G G T G T G G G G G G C C T C T C C G G T T C C C T G T G C C G C A G C T A A C G C A T
Micromonospora aurantiaca DSM 43813 . . . .
Micromonospora coxensis strain 2-30-b(28) . . . .
Micromonospora krabiensis strain MA-2 . . . .
AJB 4(1) . . . C . . . G . . . A . . . C A A . A . T C . A C . . . G T . C . . . .
Streptomyces misionensis strain NRRL-B3230 . . . C . . . G . . . A . . . C A A . A . T C . A C . . . G T . C . . . .
Streptomyces eurythermus strain ATCC 14975 . . . C . . . G . . . A . . . C A A . A . T C . A C . . . G T . C . . . .
Streptomyces africanus strain CPJVR-H . . . C . . . G . . . A . . . C A A . A . T C . A C . . . G T . C . . . .
AEP-2 . . . C . . . G . . . . A A . . . T . . C . A . A . T C . A C . . C G T . G . . . .
Streptomyces galilaeus stran JCM 4757 . . . C . . . G . . . . A A . . . T . . C . A . A . T C . A C . . C G T . G . . . .
Streptomyces flavogriseus strain CBS 101.34 . . . C . . . A A . . . T . . C . A . A . T C . A C . . C G T . G . . . .
20
CX 10.1 T A A G C G C C C C G C C T G G G G A G T A C G G C C G C A A G G C T A A A A C T C A A A G G A A T T G A C G G G G G C C C G C A C A A G C T G C G G A G C A T G C G G A T T A A T T C G A T G C A A
Micromonospora aurantiaca DSM 43813 . . . G . . . .
Micromonospora coxensis strain 2-30-b(28) . . . G . . . .
Micromonospora krabiensis strain MA-2 . . . G . . . .
AJB 4(1) . . . . T . . . G . . . T . . C . . . C . . . .
Streptomyces misionensis strain NRRL-B3230 . . . . T . . . G . . . T . . C . . . C . . . .
Streptomyces eurythermus strain ATCC 14975 . . . . T . . . G . . . T . . C . . . C . . . .
Streptomyces africanus strain CPJVR-H . . . . T . . . G . . . T . . C . . . C . . . .
AEP-2 . . . . T T . . . A . . . T . . C . . . C . . . .
Streptomyces galilaeus stran JCM 4757 . . . . T T . . . A . . . T . . C . . . C . . . .
Streptomyces flavogriseus strain CBS 101.34 . . . . T T . . . A . . . T . . C . . . C . . . .
Streptomyces polyantibioticus strain SPR: DSM 44925 . . . . T T . . . A . . . T . . C . . . C . . . .
CX 10.1 C G C G A A G A A C C T T A C C T G G G T T T G A C A T G G G C C G C A A A A A C T G T C A A A G A A T G G C A A G G T C C C T T C C G G G G G C C G G T - C A C A G G T G G T G C A T G G T T G T C
Micromonospora aurantiaca DSM 43813 . . . - . . . - . . . G . . . T - - . G C . . . T . C - - - . . . . G . . . . - . . . C . . . .
Micromonospora coxensis strain 2-30-b(28) . . . - . . . - . . C G . . G . . . T - - . T G . . . T . C - - - . . . . G . . . . - . . . C . . . .
Micromonospora krabiensis strain MA-2 . . . - . . . - . C T G . . G . . . T - - . T G G . . . T . C - - - . . . . G . . . . - . . . C . . . .
AJB 4(1) . . . A A . . C . . . A C A . . . G . . . G - - C A . T . G . . . T - - A G T G C C C . . . - - - . T . . T . . . . G T . . . C . . . .
Streptomyces misionensis strain NRRL-B3230 . . . A A . . C . . . A C A . . . G . . . G - - C A . T . G . . . T - - A G T G C C C . . . - - - . T . . T . . . . G T . . . C . . . .
Streptomyces eurythermus strain ATCC 14975 . . . A A . . C . . . A C A . . . G . . . G - - C A . T . G . . . T - - A G T G C C C . . . - - - . T . . T . . . . G T . . . C . . . .
Streptomyces africanus strain CPJVR-H . . . A A . . C . . . A C A . . . G . . . . - - C C C T G G . . . C - - A G G G T C C . . . - - - . T . . T . . . . G T . . . C . . . .
AEP-2 . . . A A . . C . . . A C A . . . G . . . C - - A C . . G G . . . C - - . G G T . C C . . . - - - . T . . T . . . . G T . . . C . . . .
Streptomyces galilaeus stran JCM 4757 . . . A A . . C . . . A C A . . . G . . . G - - C A . . . G . . . T - - . G T G C C C . . . - - - . T . . T . . . . G T . . . C . . . .
Streptomyces flavogriseus strain CBS 101.34 . . . A A . . C . . . A T A . . . G . . . G - - C A . . . G . . . T - - . G T G C C C . . . - - - . T . . T . . . . A T . . . C . . . .
Streptomyces polyantibioticus strain SPR: DSM 44925 . . . A A . . C . . . A T A . . . G . . . G - - C A . . . G . . . T - - . G T G C C C . . . - - - . T . . T . . . . A T . . . C . . . .
CX 10.1 G T C A G C T C G T G T C G T G A G A A G T T G C G G T A A G T C C C G C A A C G A G C G C A A C C C T C G T T C G A T G T T G C C A G C G C G T T - - - A T G G C G G G G A C T C A T C G A
Micromonospora aurantiaca DSM 43813 . . . T . . . . G . T . . . G . . . - - - . . . .
Micromonospora coxensis strain 2-30-b(28) . . . T . . . . G . T . . . - - - . . . .
Micromonospora krabiensis strain MA-2 . . . T . . . . G . T . . . - - - . . . .
AJB 4(1) . . . T . . . . G . T . . . T . . C . C G . . . A G . C C C T T - G T G G . . C T . . . C G . G
Streptomyces misionensis strain NRRL-B3230 . . . T . . . . G . T . . . T . . C . C G . . . A G . C C C T T - G T G G . . C T . . . C G . G
Streptomyces eurythermus strain ATCC 14975 . . . T . . . . G . T . . . T . . C . C G . . . A G . C C C T T - G T G G . . C T . . . C G . G
Streptomyces africanus strain CPJVR-H . . . T . . . . G . T . . . T . . C . C G . . . A G . C C C T T - G T G G . . C T . . . C G . G
AEP-2 . . . T . . . . G . T . . . T . . . . T G . . . A T . C C T T T C G G G G . . A T . . . C A . G
Streptomyces galilaeus stran JCM 4757 . . . T . . . . G . T . . . T . . . . T G . . . A T . C C C T T C G G G G . . A T . . . C A . G
Streptomyces flavogriseus strain CBS 101.34 . . . T . . . . G . T . . . T . . . . T G . . . A T . C C C T T C G G G G . . A T . . . C A . G
Streptomyces polyantibioticus strain SPR: DSM 44925 . . . T . . . . G . T . . . T . . . . T G . . . A T . C C C T T C G G G G . . A T . . . C A . G
CX 10.1 A G A C T G C C G G G G T C A A C T C G G A G G A A G G T G G G G A T G A C G T C A A G T C A T C A T G C C C C T T A T G T C C A G G G C T T C A C G C A T G C T A C A A T G G C C G G T A C A A T G
Micromonospora aurantiaca DSM 43813 . . . T . . . .
Micromonospora coxensis strain 2-30-b(28) . . . .
Micromonospora krabiensis strain MA-2 . . . .
AJB 4(1) . . . . C . . . T . . . C . . . T T . . . G . . A . G . . . G . . . .
Streptomyces misionensis strain NRRL-B3230 . . . . C . . . C . . . T T . . . G . . . A . G . . . .
Streptomyces eurythermus strain ATCC 14975 . . . . C . . . C . . . T T . . . G . . . A . G . . . .
Streptomyces africanus strain CPJVR-H . . . . C . . . C . . . T T . . . G . . . A . G . . . .
AEP-2 . . . . C . . . C . . . T T . . . G . . . A . G . . . .
Streptomyces galilaeus stran JCM 4757 . . . . C . . . C . . . T T . . . G . . . A . G . . . A .
Streptomyces flavogriseus strain CBS 101.34 . . . C . . . T T . . . G . . . A . G . . . .
21