BAB II
TINJAUAN PUSTAKA
2.1. Disain Kompor
Kompor bioetanol gel didesain sesuai keutuhan masarakat urban, yaitu
praktis, moderen, murah dan ramah lingkungan. Banyak software yang dapat
digunakan dalam mendisain seperti, solidwork, autocad, autodeks inventor, catia,
ansys dan banyak lagi.
2.1.1 Solidwork
Sebagai software CAD, Solidworks dipercaya sebagai perangkat lunak
untuk membantu proses desain suatu benda atau bangunan dengan mudah, di
Indonesia sendiri terdapat banyak perusahaan manufaktur yang
mengimplementasikan perangkat lunak solidworks. Keunggulan solidworks dari
software CAD lain adalah mampu menyediakan sketsa 2D yang dapat diupgrade
menjadi bentuk 3D. Selain itu pemakaiannya pun mudah karena memang
dirancang khusus untuk mendesai benda sederhana maupun yang rumit. Inilah
yang membuat solidworks menjadi populer dibandingkan dengan software CAD
lainnya.
Solidworks banyak digunakan untuk merancang roda gigi, mesin mobil,
casing ponsel dan lain-lain. Fitur yang tersedia dalam solidworks lebih
easy-to-use dibanding dengan aplikasi CAD lainnya. Solidworks cocok untuk mahasiswa
yang sedang menempuh pendidikan di jurusan tehnik sipil, tehnik industri dan
tehnik mesin, karena proses penggunaan solidworks lebih cepat dibanding
vendor-vendor software CAD lain yang lebih dulu ada. Solidworks juga dapat melakukan
simulasi pada desain yang dibuat dengan solidworks.
Analisi kekuatan desain juga dapat dilakukan secara sederhana dengan
solidworks, dan yang paling penting, solidworks dapat membuat disain animasi
2.2. Bioetanol
Bioetanol adalah etanol yang dihasilkan dari fermentasi glukosa yang
dilanjutkan dengan proses destilasi. Etanol merupakan kependekan dari etil
alkohol (C2H5OH), sering pula disebut grain alcohol atau alkohol. Wujud dari
etanol berupa cairan yang tidak berwarna, mudah menguap dan mempunyai bau
yang khas. Sifat lainnya adalah larut dalam air dan eter, berat jenisnya adalah
sebesar 0,7939 g/mL, dan titik didihnya 78,320ºC pada tekanan 766 mmHg, serta
mempunyai panas pembakaran 7093.72 kkal. Etanol digunakan dalam beragam
industri seperti sebagai bahan baku industri turunan alkohol, campuran untuk
minuman keras seperti sake, bahan baku farmasi dan kosmetik, dan campuran
bahan bakar kendaraan, peningkat oktan, dan bensin alkohol.
Pemakaian etanol sebagai sumber energi dalam industri dan kendaraan
akan sangat mengurangi pembuangan gas CO2 yang mengakibatkan pemanasan
global. Cepat atau lambat sumber minyak (fuel source) akan habis karena
depositnya terbatas. Minyak bumi merupakan sumber energi yang tidak dapat
diperbaharui. Keterbatasan itu mendorong negara industri melirik etanol (biofuel)
sebagai sumber energi altenatif. Selain terus-menerus dapat diproduksi oleh
mikroorganisme, etanol juga ramah lingkungan.
Beberapa keunggulan dari penggunaan etanol sebagai bahan bakar yaitu[1] :
1. Diproduksi dari tanaman yang dapat diperbarui (renewable).
2. Mengandung kadar oksigen sekitar 35% sehingga dapat terbakar lebih
sempurna.
3. Penggunaan bioetanol gel dapat menurunkan emisi gas rumah kaca. Salah
satu sumber penyumbang karbon dioksida adalah pembakaran bahan bakar
fosil. Pada kasus pemanasan akibat bertambahnya gas-gas rumah kaca
seperti CO2, pemanasan pada awalnya akan menyebabkan lebih
banyaknya air yang menguap ke atmosfer. Karena uap air sendiri
merupakan gas rumah kaca, pemanasan akan terus berlanjut dan
menambah jumlah uap air di udara hingga tercapainya suatu
kesetimbangan konsentrasi uap air. Gas-gas ini menyerap dan
akibatnya panas tersebut akan tersimpan di permukaan Bumi. Hal tersebut
terjadi berulang-ulang dan mengakibatkan suhu rata-rata tahunan bumi
terus meningkat. Akibat jumlah gas-gas tersebut telah berlebih di
atmosfer, pemanasan global menjadi akibatnya. Untuk mengurangi emisi
rumah kaca yaitu dengan mangganti bahan bakar fosil dengan bahan bakar
nabati yaitu bioetanol gel.
4. Pembakaran tidak menghasilkan partikel timbal dan benzena yang bersifat
karsinogenik (penyebab kanker). Timbal ditambahkan sebagai bahan aditif
pada bensin dalam bentuk timbal organik (tetraetil-Pb atau tetrametil-Pb).
Pada pembakaran bensin, timbal organik ini berubah bentuk menjadi
timbal anorganik. Timbal yang dikeluarkan sebagai gas buang kendaraan
bermotor merupakan partikel-partikel yang berukuran sekitar 0,01 µm.
Partikel-partikel timbal ini akan bergabung satu sama lain membentuk
ukuran yang lebih besar, dan keluar sebagai gas buang atau mengendap
pada kenalpot. Pengaruh Pb pada kesehatan yang terutama adalah pada
sintesa haemoglobin dan sistem pada syaraf pusat maupun syaraf tepi.
Pengaruh pada sistem pembentukkan Hb darah yang dapat menyebabkan
anemia, ditemukan pada kadar Pb-darah kelompok dewasa 60-80µg/100
ml dan kelompok anak > 40 µg/100 ml. Pada kadar Pb-darah kelompok
dewasa sekitar 40 µg/100 ml diamati telah ada gangguan terhadap sintesa
Hb, seperti meningkatnya ekskresi asam aminolevulinat. Oleh karena itu
bioetanol merupakan cara terbaik untuk mencegah hal tersebut.
5. Mengurangi emisi fine-particulates yang membahayakan kesehatan
manusia. Pembakaran didalam mesin menghasilkan berbagai bahan
pencemar dalam bentuk gas dan partikulat yang umumnya berukuran lebih
kecil dari 2 µm. Beberapa dari bahan-bahan pencemar ini merupakan
senyawa-senyawa yang bersifat karsinogenik dan mutagenik, seperti etilen,
formaldehid, benzena, metil nitrit dan hidrokarbon poliaromatik (PAH).
Mesin solar akan menghasilkan partikulat dan senyawa-senyawa yang
dapat terikat dalam partikulat seperti PAH, 10 kali lebih besar
dibandingkan dengan mesin bensin yang mengandung timbel. Untuk
pyrene dan metil nitrit, kadar di dalam emisi mesin bensin akan sama
besarnya dengan mesin solar. Emisi kendaraan bermotor yang mengandung
senyawa karsinogenik diperkirakan dapat menimbulkan tumor pada organ
lain selain paru. Untuk itu Bahan Bakar Nabati (BBN) merupakan cara
untuk mengurangi emisi fine-particulates.
6. Mudah larut dalam air dan tidak mencemari air permukaan dan air tanah.
Proses destilasi dapat menghasilkan etanol dengan kadar 95%, untuk
digunakan sebagai bahan bakar perlu lebih dimurnikan lagi hingga
mencapai 99,5% yang sering disebut Fuel Grade Ethanol (FGE).
Mengingat pemanfaatan etanol yang beraneka ragam, maka kadar etanol
yang dimanfaatkan harus berbeda sesuai dengan penggunaannya. Etanol
yang mempunyai kadar 90-96,5% dapat digunakan pada industri,
sedangkan etanol yang mempunyai kadar 96-99,5% dapat digunakan
sebagai campuran untuk miras dan bahan dasar industri farmasi. Etanol
yang dimanfaatkan sebagai campuran bahan bakar untuk kendaraan yang
harus betul-betul kering dan anhydrous supaya tidak korosif, sehingga
etanol harus mempunyai kadar sebesar 99,5-100%. Perbedaan besarnya
kadar akan berpengaruh terhadap proses pengolahan karbohidrat menjadi
glukosa larut air [4].
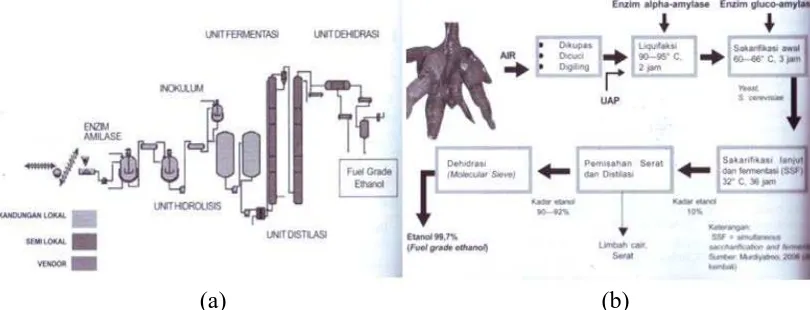
2.3. Pembuatan Bioetanol
Bioetanol adalah alkohol yang diperoleh dari fermentasi komponen gula
pada biomasa. Hingga saat ini etanol utamanya dibuat dari gula dan tepung biji
bijian. Dengan kemajuan teknologi, etanol dapat dibuat dari selulosa biomasa,
seperti pohon dan rumput. Selain biokonversi, etanol juga dapat dibuat dari
sumber lain, yaitu dengan cara sintesa. Secara umum proses produksi bioetanol
diuraikan di bawah ini. Pembuatan bioetanol yang menggunakan bahan baku
tanaman yang mengandung pati, dilakukan dengan cara mengubah pati menjadi
gula (glukosa) larut air. Konversi bahan baku tanaman yang mengandung pati atau
Tabel 2.1 Konversi bahan baku tanaman yang mengandung pati atau
karbohidrat dan tetes menjadi bioetanol [1].
Bahan Baku Kandungan
Gula dalam
Bahan Baku
Jumlah Hasil
Konversi
Bioetanol (liter)
Perbandingan
Bahan Baku
dan Bioetanol Jenis Konsumsi
( kg )
Ubi kayu 1000 250-300 166.6 6.5:1
Ubi Jalar 1000 150-200 125 8:1
Jagung 1000 600-700 200 5:1
Sagu 1000 120-160 90 12:1
Talas 1000 500 250 4:1
Pengubahan pati menjadi gula dapat dilakukan dengan dua metode yaitu
hidrolisa asam dan hidrolisa enzim. Namun, pada saat ini metode yang lebih
banyak digunakan adalah dengan hidrolisa enzim. Pada proses pengubahan pati
menjadi gula larut air yang menggunakan metode hidrolisa enzim dilakukan
dengan penambahan air dan enzim, selanjutnya dilakukan proses fermentasi gula
menjadi etanol dengan menambahkan ragi. Reaksi yang terjadi pada proses
produksi bioetanol secara sederhana ditunjukkan pada reaksi 1 dan 2 pada gambar
2.1 dibawah ini [1]:
(C6H10O5)n + H2O N C6H12O6 (1)
(pati) enzim (glukosa)
(C6H12O6)n 2 C2H5OH + 2 CO2 (2)
(glukosa) ragi (etanol)
Gambar 2.1 Reaksi Produksi Bioetanol [1].
Secara sederhana teknologi proses produksi bioetanol yang menggunakan
bahan baku ubi kayu dapat dibagi dalam tiga tahap, yaitu gelatinasi, sakharifikasi,
dan fermentasi. Pada proses gelatinasi ubi kayu dihancurkan kemudian
dihasilkan diperkirakan mencapai 27-30 %. Kemudian pati yang telah diperoleh
dari bubur ubi kayu tersebut dipanaskan selama 2 jam sehingga berbentuk gel.
Pada umumnya, proses gelatinasi dapat dilakukan dengan 2 cara, yaitu:
1. Bubur pati dipanaskan sampai 130ºC selama 30 menit, kemudian didinginkan
sampai mencapai temperatur 95ºC yang diperkirakan memerlukan waktu
sekitar 15 menit. Kemudian selama sekitar 75 menit, kondisi temperatur 95ºC
tersebut dipertahankan, sehingga total waktu yang dibutuhkan mencapai 2 jam.
2. Pati langsung ditambah enzim termamyl, kemudian dipanaskan sampai
mencapai temperatur 130ºC selama 2 jam.
Gelatinasi cara pertama, yaitu cara pemanasan bertahap mempunyai
keuntungan, yaitu pada suhu 95ºC aktifitas termamyl merupakan yang paling
tinggi, sehingga mengakibatkan ragi cepat aktif. Pemanasan dengan suhu 130ºC
pada cara pertama tersebut dimaksudkan untuk memecah granula pati, sehingga
lebih mudah terjadi kontak dengan air dan enzim serta dapat berfungsi untuk
sterilisasi bahan, sehingga bahan tersebut tidak mudah terkontaminasi. Gelatinasi
cara kedua, yaitu cara pemanasan langsung (gelatinasi dengan enzim termamyl)
pada temperature 130ºC menghasilkan hasil yang kurang baik, karena
mengurangi dapat mengurangi aktifitas dari ragi. Hal tersebut disebabkan
gelatinasi dengan enzim pada suhu 130ºC akan terbentuk tri-phenyl-furane yang
mempunyai sifat racun terhadap ragi. Gelatinasi pada suhu tinggi tersebut juga
akan berpengaruh terhadap penurunan aktifitas termamyl, karena aktifitas
termamyl akan semakin menurun setelah melewati suhu 95ºC. Selain itu,
tingginya temperature tersebut juga akan mengakibatkan half life dari termamyl
semakin pendek, sebagai contoh pada temperature 93ºC, half life dari termamyl
adalah 1500 menit, sedangkan pada temperature 107ºC, half life termamyl
tersebut adalah 40 menit. Hasil gelatinasi dari ke dua cara tersebut didinginkan
sampai mencapai temperatur 55ºC, kemudian ditambah SAN untuk proses
sakharifikasi dan selanjutnya difermentasikan dengan menggunakan ragi. Ragi
yang sering digunakan dalam fermentasi alkohol adalah Saccharomycescerevisiae,
tinggi (12-18%), tahan terhadap kadar gula yang tinggi dan tetap aktif melakukan
fermentasi pada suhu 4-32ºC [1].
Proses fermentasi dimaksudkan untuk mengubah glukosa menjadi
bioetanol. Mekanisme reaksi pada proses fermentasi dapat dilihat pada Gambar
2.2. Pada saat keadaan aerob asam piruvat diubah menjadi asetil-koenzimA.
Tetapi karena ragi Saccharomyzes ceraviseze dalam keadaan anaerob, asam
piruvat diubah menjadi etanol dengan bantuan piruvat dekarboksilase dan alkohol
dehidrogenase melalui proses fermentasi alkohol [1].
Gambar 2.2 Reaksi pengubahan piruvat menjadi alcohol [1].
Bioetanol yang dihasilkan dari proses fermentasi biasanya masih
mengandung gas-gas antara lain CO2 dan aldehyde. Gas CO2 pada hasil
fermentasi tersebut biasanya mencapai 35%, sehingga untuk memperoleh
bioetanol yang berkualitas baik, maka bioetanol tersebut harus dibersihkan dari
gas tersebut. Proses pembersihan CO2 dilakukan dengan menyaring bioetanol
yang terikat oleh CO2, sehingga dapat diperoleh bioetanol yang bersih dari gas
CO2. Pada umumnya bioetanol atau alkohol yang dihasilkan dari proses fermntasi
yang mempunyai kemurnian sekitar 30% - 40%, sehingga harus dimurnikan lagi.
Agar mendapatkan kadar bioetanol lebih dari 95% dan dapat dipergunakan
sebagai bahan bakar, alkohol hasil fermentasi yang mempunyai kemurnian sekitar
30 - 40% tersebut harus melewati proses destilasi untuk memisahkan alkohol
Destilasi merupakan pemisahan larutan berdasarkan titik didihnya. Titik
didih etanol murni adalah 78ºC sedangkan air adalah 100ºC. Dengan memanaskan
larutan pada suhu rentang 78 - 100ºC akan mengakibatkan sebagian besar etanol
menguap.
Destilasi fraksinasi merupakan pemisahan atau pengambilan uap dari
setiap tingkat yang berbeda dalam kolom destilasi. Produk yang lebih berat
diperoleh di bagian bawah, sedangkan yang lebih ringan akan keluar dari bagian
atas kolom. Dari hasil destilasi ini, kadar bioetanolnya berkisar antara 95-96%.
Namun, pada kondisi tersebut campuran membentuk azeotrope, yang artinya
campuran alkohol dan air sukar untuk dipisahkan.Untuk memperoleh bioetanol
dengan kemurnian lebih tinggi dari 99,5% atau yang umum disebut Fuel Grade
Ethanol, masalah yang timbul adalah sulitnya memisahkan hidrogen yang terikat
dalam struktur kimia alcohol dengan cara destilasi biasa, oleh karena itu untuk
mendapatkan Fuel Grade Etanol dilaksanakan pemurnian lebih lanjut dengan cara
azeotropic destilasi.
Untuk menghasilkan anhydrous alcohol, kondisi azeotrope harus
dipecahkan dengan bahan pelarut lain. Bahan pelarut yang biasa digunakan
adalah benzene atau n-hexane. Cara lain yang umum dipakai adalah desiccants
process dan molecular sieves. Pada proses desiccant, untuk mendapatkan
anhydrous alcohol digunakan bahan kimia yang sifatnya stabil yang bereaksi
hanya dengan air, dan tidak bereaksi dengan alkohol. Contohnya adalah kalsium
oksida. Reaksi antara CaO dengan air mengeluarkan panas, sehingga perlu
rancangan khusus pada kolomnya. Selain itu berbagai macam pati juga dapat
dipakai sebagai dessicant. Molecular sieves adalah kristal aluminosilikat,
merupakan bahan penyaring yang tidak mengalami hidrasi maupun dehidrasi
pada struktur kristalnya. Molekul penyaring ini secara selektif menyerap air,
karena lubang kristalnya mempunyai ukuran lebih kecil dibanding ukuran
molekul alkohol, dan lebih besar dibandingkan molekul air. Alkohol yang
berbentuk cair maupun uap dilewatkan kolom yang berisi bahan penyaring, air
akan tertahan dalam bahan tersebut dan akan diperoleh alkohol murni. Biasanya
sedangkan pada kolom pertama setelah proses dialirkan udara atau gas panas
untuk menguapkan air.
Pada industri pembuatan etanol, juga akan diperoleh hasil lain, baik yang
dapat dimanfaatkan langsung maupun harus diproses lebih lanjut. Hasil samping
tersebut antara lain stillage, karbondioksida, dan minyak fusel.Stillage adalah sisa
destilasi yang tertinggal dalam kolom bagian bawah dan masih bercampur dengan
air. Stillage tersebut masih banyak mengandung bahan-bahan organik yang tidak
terfermentasikan. Stillage dari proses destilasi jumlahnya cukup besar, yaitu
10-13 kali jumlah alkohol yang dihasilkan. Mengingat bahan yang terkandung di
dalamnya, maka stillage dapat dimanfaatkan sebagai pupuk, makanan ternak dan
biogas. Sedangkan gas karbondioksida yang dihasilkan selama proses fermentasi
biasanya diserap dan dimurnikan kemudian ditekan menjadi bentuk cair. Minyak
fosil yang pada prinsipnya merupakan campuran amyl, butyl, isobutyl,
n-propyl dan iso-n-propyl alkohol juga asam-asam, ester maupul aldehid, dapat
digunakan sebagai bahan baku kimia, bahan pelarut dan bahan bakar. Agar lebih
jelas, proses pembuatan bioetanol dapat dilihat pada gambar 2.3 di bawah ini [1].
(a) (b)
Gambar 2.3 (a) Proses pembuatan bioetanol dari bahan berpati, (b) Diagram alir
2.4. Mamfaat Bioetanol
2.4.1 Bioetanol sebagai bahan bakar kendaraan bermotor.
Pada dasarnya etanol dapat diperoleh melalui dua cara. Pertama, etanol
yang diperoleh melalui proses fermentasi dengan bantuan mikroorganisme.
Kedua, etanol diperoleh dari hasil sintesa etilen. Bioetanol dapat digunakan untuk
berbagai keperluan. Bioetanol banyak digunakan dalam industri minuman,
kosmetik dan industri farmasi seperti deterjen, desinfektan dan lain-lain. Alkohol
dari produk petroleum atau dikenal sebagai alkohol sintetis banyak dipakai untuk
bahan baku pada industri acetaldehyde, derivat acetyl dan lain-lain. Selain
bioetanol dikenal pula gasohol, yang merupakan campuran bioetanol dengan
premium yang digunakan sebagai bahan bakar. Brazil, Amerika Serikat,
Argentina, Australia, Kuba, Jepang, Selandia Baru, Afrika Selatan, Swiss dan
lain-lain telah mengunakan bahan bakar alternatif ini untuk digunakan pada
kendaraan bermotor.
Campuran bioetanol dan premium dapat divariasikan kadarnya. Misalnya
Gasohol BE-10, yang mengandung 10% bioetanol, sisanya premium.
Kualitasetanol yang digunakan tergolong fuel grade etanol yang kadar etanolnya
99%. Etanol yang mengandung 35% oksigen dapat meningkatkan efisiensi
pembakaran dan mengurangi emisi gas rumah kaca. Rendahnya biaya produksi
bioetanol karena sumber bahan bakunya merupakan limbah pertanian yang tidak
bernilai ekonomis dan berasal dari hasil pertanian budidaya yang dapat diambil
dengan mudah. Dilihat dari proses produksinya juga relatif sederhana dan murah.
Keuntungan lain dari bioetanol adalah nilai oktannya lebih tinggi dari
premium sehingga dapat menggantikan fungsi bahan aditif, seperti Metil
Tertiary Butyl Ether (MTBE) dan Tetra Ethyl Lead. Kedua zat aditif tersebut
telah dipilih menggantikan timbal pada premium. Etanol absolut memiliki angka
oktan (ON) 117, sedangkan Premium hanya 87-88. Gasohol BE-10 secara
proporsional memiliki ON 92 atau setara Pertamax. Pada komposisi ini
bioetanol dikenal sebagai octan enhancer (aditif) yang paling ramah lingkungan
dan di negara-negara maju telah menggeser penggunaan Tetra Ethyl Lead (TEL)
maupun Methyl Tertiary Buthyl Ether (MTBE). Hal tersebut terlihat pada tabel
Tabel 2.2 Sifat-sifat bahan bakar dari bioetanol, gasholine dan butyl eter [1]
Bioetanol ETBE MTBE Gasoline
Heating value [MJ/kg] 26.8 36.4 35.0 42
Heating value [MJ/I] 21.3 26.9 25.9 32
Octane number (RON) 106 115.118 113.120 92.96
Density at 15ºC [kg/I] 0.79 0.74 0.74 0.76
Visicosity at 20ºC [mm 2/
�]
1.5 1.5 0.7 0.6
Oxygen content [%] 35 16 18 0.2
Fuel Equivalent to Gasoline 0.66 0.83 0.80 1.0
2.4.2 Bioetanol untuk Kompor
Sumber energi fosil di Indonesia khususnya minyak bumi semakin langka.
Penggunaan terbesar adalah pada sektor rumah tangga dan komersial, diikuti oleh
sektor industri, transportasi, dan bahan baku. Hal ini mendorong pemerintah
untuk mulai menggunakan energi baru dan terbarukan (EBT) untuk mencegah
habisnya minyak bumi. Salah satu energi alternatif yang bisa dimanfaatkan
adalah bioetanol.
Sejak 4 tahun yang lalu pertama kali diperkenalkan hingga sekarang,
bioetanol telah mengalami peningkatan dalam penjualannya. Akan tetapi
bioetanol tersebut sebagian besar hanya dikonsumsi untuk skala industri.
Sedangkan untuk transportasi dan target sektor rumah tangga yaitu penggunaan
kompor bioetanol, masih mengalami kendala, terutama kelemahan pada desain
kompornya.
Terkait dengan masalah kompor bioethanol, pemerintah telah
mengupayakan rencana pengurangan penggunaan minyak tanah untuk keperluan
rumah tangga dengan mengeluarkan Instruksi Presiden (Inpres) No. 1 Tahun
2006 tentang penyediaan dan pemanfaatan bahan bakar nabati sebagai bahan
bakar lain.
Menindak lanjuti Inpres tersebut, masyarakat telah mengupayakan
bioetanol sebagai bahan bakar pengganti minyak tanah. Penggunaan bioetanol
bioetanol memang belum sepopuler kompor minyak tanah maupun kompor LPG,
akan tetapi sampai saat ini banyak pihak yang optimis akan kelangsungan hidup
produk tersebut di masa yang akan datang, baik itu untuk perseorangan maupun
instansi.
Salah satu keunggulan kompor bioethanol tersebut adalah bahwa kompor
ini lebih aman daripada menggunakan kompor gas LPG, karena kompor ini tidak
memerlukan tekanan, etanol cukup digantungkan di tempat yang lebih tinggi dari
posisi kompor atau dengan low-pressure. Untuk mematikan kompor ini cukup
dengan dikecilkan regulatornya dan ditiup pada saat api sudah mengecil, bahkan
disiram air pun api sudah mati persis penanganan terhadap kompor minyak tanah.
Dari aspek harga juga sangat kompetitif, dasar aturannya adalah Kepmen
ESDM No. 3784 Tahun 2014 tanggal 2 Oktober 2014 tentang HIP BBN yang
menetapkan formulasinya yaitu Argus FOB Thailand +14%. Atas dasar formulasi
itu harga jual bioetanol adalah USD 550/KL atau Rp 7000 per liter. Jika
ditambahkan biaya handling, distribusi dan marketing Rp 3000 per liter, maka
harga komersialnya Rp 10.000 perliter atau Rp 120,000 untuk 12 liter dan untuk
harga subsidinya Rp 5000 per liter atau Rp 15.000 untuk kemasan melon 3 liter.
Padahal kalori panasnya labih tinggi ketimbang LPG, karena itu mampu
memasak lebih cepat.
Seandainya kompor bioetanol ini digunakan secara masif di republik ini
maka akan menimbulkan efek berganda yang akan berimbas langsung kepada
kesejahteraan petani. Seandainya singkong digunakan sebagai bahan baku
pembuatan bioetanol, maka akan bergulir kegiatan perekonomian dari petani
sampai pengguna energi akhir yaitu para ibu rumah tangga pemakai kompor
bioetanol. Dan jika bahan baku etanol tersebut terbuat dari tetes tebu (molasses),
maka putaran dana triliunan rupiah itu akan mampu memberdayakan puluhan
pabrik gula dan petani tebu yang kini kondisinya rata-rata hidup segan mati tak
mau.
Kelemahan utama beberapa kompor bioetanol produksi lokal seperti:
kompor Bionas dari Yogyakarta, kompor Kuwatsu, serta kompor Repindo antara
lain kurang efisien, kurang nyaman dan kurang user-friendly bagi penggunanya.
masyarakat hingga saat ini. Karena itu, perlu dikembangkan kompor bioetanol
yang lebih berkualitas dan dapat memenuhi kebutuhan penggunanya. Dan itu
sangat memungkinkan karena cara kerjanya yang amat sederhana [1].
2.5. Bioetanol Gel
Bahan Bakar Minyak (BBM) sudah menjadi bagian dari kebutuhan
masyarakat. BBM menjadi kebutuhan yang sangat penting dan paling dicari oleh
masyarakat. Terutama minyak tanah, hampir semua lapisan masyarakat
menggunakan minyak tanah. Namun karena deposit minyak bumi Indonesia
hanya tinggal 20 tahun maka harus dicari bahan bakar alternatif lain yang dapat
menggantikan minyak tanah.
Bioetanol merupakan bahan bakar alternatif yang bejanaensial karena
sumbernya mudah diperbaharui. Namun ada beberapa kendala yang harus
dihadapi agar bioetanol dapat digunakan oleh masyarakat secara luas yaitu:
1. Bioetanol hanya diproduksi di daerah tertentu, tidak setiap daerah terdapat
produsen bioetanol.
2. Bioetanol yang berbentuk cair beresiko tumpah saat didistribusikan ke
daerah lain. Hal ini disebabkan biasanya bioetanol didistribusikan dalam
drum-drum yang kurang aman dalam pengangkutannya (jika dibandingkan
pengangkutan minyak tanah oleh Pertamina yang dimasukkan dalam
tangki).
3. Selain itu, bioetanol yang berwujud cair lebih beresiko mudah tumpah dan
mudah meledak karena sifatnya yang volatil. Oleh karena itu bioetanol
cair diubah menjadi bioetanol gel yang lebih aman dalam proses
pengangkutan dan penggunaannya.
Bioetanol gel memiliki beberapa kelebihan dibanding bahan bakar
alternatif lainnya yaitu selama pembakaran gel tidak berasap, tidak berjelaga,
tidak mengemisi gas berbahaya, non karsinogenik, non korosif. Bentuknya yang
gel memudahkan dalam pengemasan dan dalam pendistribusian. Bioetanol gel
Untuk membuat bioetanol gel dibutuhkan pengental berupa tepung, seperti
kalsium asetat, atau pengental lainnya seperti xanthan gum, carbopol EZ-3
polymer, dan berbagai material turunan selulosa.
Untuk pengental jenis polimer carboxy vinyl seperti carbopol dibutuhkan
air untuk membentuk struktur gel yang diinginkan. Penambahan pengental dan air
saat pembuatan bioetanol gel sangat mungkin mempengaruhi sifat fisik bioetanol
gel yang dihasilkan. Sifat fisik yang mungkin terpengaruh antara lain flash point,
nilai kalor dan viskositas.
Selain dipergunakan untuk campuran bahan bakar bensin premium,
bioetanol dapat juga dipergunakan untuk bahan bakar rumah tangga
menggantikan minyak tanah.
Pembuatan bioetanol gel dapat dilakukan sebagai berikut: (1) aduk
sebanyak 1-5% kalsium asetat yang berbentuk tepung dengan air sebanyak 20%
dari jumlah bioetanol; (2) tambahkan 1 liter bioetanol berkadar 70-90% lalu
diaduk; (3) tambahkan 5% natrium hidroksida sebagai penyeimbang pH agar
tingkat kemasaman mencapai 5-6, kemudian daya aduk diperbesar minimal
dengan kecepatan 2.500 rpm; (4) dalam waktu 5 menit bioetanol gel sudah
terbentuk.
Dengan bioetanol berbentuk gel, bagi ibu rumah tangga pekerjaan mengisi
bahan bakar kompor menjadi lebih praktis. Di samping itu, bentuk kompor untuk
bioetanol gel sangat sederhana, bentuknya mirip kompor konvensional karena
pada kompor yang tidak bersumbu ini terdapat tempat meletakkan bioetanol gel.
Ketika bioetanol gel dikompor habis, api akan padam; penambahan bioetanol gel
harus dilakukan saat api telah padam, peletakan maupun penambahan gel dapat
dilakukan dengan menggunakan sendok. Beberapa penelitian menunjukkan bahwa
pemakaian bioetanol gel lebih hemat daripada minyak tanah, daya bakar 200 gram
bioetanol gel setara dengan daya bakar 1 liter minyak tanah.
Afrika Selatan merupakan negara pertama yang telah menerapkan
pemakaian bioetanol gel secara meluas di masyarakatnya. Sejak tahun 2007
bioetanol gel sudah akrab dipakai sebagai bahan bakar rumah tangga di sana, oleh
berbagai ragam bahan baku bioetanol, sudah saatnya untuk mulai
mengembangkan bioetanol gel.
Dengan bentuk bioetanol gel dapat dibuat bentuk kompor yang sederhana,
diharapkan bioetanol dapat dimanfaatkan sebagai bahan bakar alternatif rumah
tangga oleh masyarakat luas, menggantikan minyak tanah dan gas LPG yang
keberadaannya semakin langka dan mahal[1].
Indra Triaswati dan Lani Nurhayanti, Jurusan Teknik Kimia Fakultas
Teknik, Universitas Diponegoro, Semarang, 2009, melakukan sebuah penelitian
mengenai bioetanol gel. Bahan yang digunakan dalam penelitian ini adalah
bioetanol dengan kadar 70 %, air, trietanolamine (TEA), carbopol. Peralatan
penelitian yang digunakan antara lain statif, klem, beaker glass ukuran 2 liter,
pengaduk, motor pengaduk, regulator, gelas ukur 10 ml, gelas ukur 500 ml dan
timbangan[2]. Adapun rangkaian alat dapat dilihat pada gambar 2.4
Gambar 2.4 Rangkaian alat uji Bioetanol Gel [2]
Variabel kendali dalam penelitian ini adalah bioetanol 90% massa dari
campuran bioetanol gel (400 g bioetanol = 500 ml bioetanol ) dan waktu
pengadukan 1 jam Variabel yang dipilih sebagai variabel berubah adalah %
carbopol (% massa dari campuran bioetanol gel) (level bawah=0,85%, level
tengah=1,05% dan level atas=1,25%), dan % air (% massa dari campuran
bioetanol gel) (level bawah=7,5%, level tengah=7,9%, dan level atas=8,3%).
Percobaan dirancang dengan metode Central Composite Design menggunakan
Prosedur kerja proses dimulai dengan mengaduk bioetanol dan air sambil
menambahkan carbopol dengan perlahan-lahan. Lalu menambahkan
trietanolamine setelah carbopol larut dengan jumlah yang sama dengan carbopol.
Pengadukan dilanjutkan selama 1 jam dan bioetanol gel terbentuk. Kemudian
menganalisa flash point, nilai kalor, dan viskositasnya.
Pengaruh Persentase Air dan Carbopol terhadap Flash Point sangat
berpengaruh. Bioetanol gel yang dihasilkan dianalisa nilai flash point-nya. Hasil
analisa dapat dilihat pada tabel 2.3 berikut:
Tabel 2.3 Hasil Analisa Nilai Flash Poin [2].
Run Carbopol (%massa) Air (%massa) Flash Point (ºC)
1 0.85 7.5 17.9
2 0.85 8.3 18.6
3 1.25 7.5 18.3
4 1.25 8.3 19.8
5 0.76 7.9 18.7
6 1.33 7.9 19.7
7 1.05 7.33 19.7
8 1.05 8.46 18.8
9 1.05 1.97 20.7
10 1.05 9 21.4
Aplikasi Metode Respon Permukaan menghasilkan persamaan model
matematis yang merupakan hubungan empiris nilai flash point dengan variabel
percobaan yang diberi kode X1 dan X2 ,dengan X1 adalah persentase carbopol
dan X2 adalah persentase air. Dari hasil perhitungan diperoleh persamaan model
Y = 21,050+0,37678 X1-1,06875 X12+0,11590 X2-1,04375 X22+0,200 X1X2 (2.1)
Hasil prediksi dengan persamaan model matematis dibandingkan dengan
hasil analisa tersaji dalam tabel 2.4
Tabel 2.4 Perbandingan Hasil Analisa dengan Hasil Prediksi untuk Flash Poin [2].
Run �� (%) �� (%) Yo (ºC) Yp(ºC)
1 0.85 7.5 17.9 18.6
2 0.85 8.3 18.6 18.5
3 1.25 7.5 18.3 18.9
4 1.25 8.3 19.8 19.6
5 0.76 7.9 18.7 18.4
6 1.33 7.9 19.7 19.4
7 1.05 7.33 19.7 18.8
8 1.05 8.46 18.8 19.1
9 1.05 1.97 20.7 21.1
10 1.05 9 21.4 21.1
Keterangan :
X1 = Persentase carbopol ( %)
X2 = Persentase air ( %)
Yo = Nilai flash point hasil analisa (℃)
Yp = Nilai flash point hasil prediksi (℃)
Data tersebut kemudian diolah dengan metode central composit design
dari program Statistica 6 untuk mengetahui pengaruh dari variabel - variabel yang
Gambar 2.5 Diagram Pareto untuk Analisa Flash Point[2]
Dari gambar 2.5 (Pareto Chart) variabel yang berpengaruh adalah
carbopol(Q), air(Q). Kedua variabel tersebut dicari kondisi operasi optimumnya
dengan menggunakan grafik optimasi 3 dimensi dan grafik kontur permukaan.
Grafik optimasi 3 dimensi dan grafik kontur permukaan dari ketiga variabel tersebut
bisa dilihat di gambar 2.6 dan 2.7.
Gambar 2.7 Grafik kontur permukaan untuk nilai flash point [2].
Grafik optimasi dan kontur permukaan di atas menunjukkan pengaruh
persentase carbopol dan air terhadap nilai flash point .Terlihat bahwa nilai flash
point optimum (21ºC) tercapai pada persentase carbopol 1,09 % dan persentase air
7,9 %. Carbopol merupakan polimer yang bersifat hidrofilik yang dapat menyerap
dan menahan air dalam jaringan polimernya. Carbopol akan mengembang dalam
air 1000 kali lebih besar dari volume semula dan 10 kali dari diameter semula
untuk membentuk struktur gel.
Struktur gel akan menurunkan volatilitas bioetanol sehingga nilai flash
point-nya akan naik. Air merupakan materi yang tidak bisa terbakar sehingga
keberadaannya dalam bioetanol akan menaikkan nilai flash point bioetanol. Dari
hasil ini dapat disimpulkan bahwa persentase carbopol dan persentase air
mempengaruhi flash point. Bioetanol gel yang dihasilkan dianalisa nilai kalor-nya.
Tabel 2.5 Hasil Analisa Nilai Kalor [2].
Run Carbopol (%massa) Air (%massa) Nilai Kalor (cal/g)
1 0.85 7.5 3889,815
2 0.85 8.3 4015.245
3 1.25 7.5 4060.58
4 1.25 8.3 3989.7
5 0.76 7.9 3998.025
6 1.33 7.9 3948.605
7 1.05 7.33 4049.415
8 1.05 8.46 3970.655
9 1.05 1.97 3966.7210
10 1.05 9 4041.99
Dari hasil perhitungan diperoleh persamaan model matematis sebagai berikut :
Y = 41.100+17.754 X1+1631,25 X12 + 818,93 X2 -1.49375 X22-1.900 X1X2 (2.2)
Hasil prediksi dengan persamaan model matematis dibandingkan dengan hasil analisa tersaji dalam tabel 2.6
Tabel 2.6 Perbandingan Hasil Analisa dengan Hasil Prediksi untuk Nilai Kalor [2]
Run �� (%) �� (%) Yo (cal/g) Yo (cal/g)
1 0.85 7.5 3889,815 3938.971
2 0.85 8.3 4015.245 4022.981
3 1.25 7.5 4060.58 4055.252
4 1.25 8.3 3989.7 3942.889
5 0.76 7.9 3998.025 3858.328
6 1.33 7.9 3948.605 3983.962
7 1.05 7.33 4049.415 4018.917
8 1.05 8.46 3970.655 3998.823
9 1.05 1.97 3966.7210 4004.355
Keterangan :
X1 = Persentase carbopol ( %)
X2 = Persentase air ( %)
Yo = Nilai kalor hasil analisa (cal/g)
Yp = Nilai kalor hasil prediksi (cal/g)
Data tersebut kemudian diolah dengan metode central composit design
dari program Statistica 6 untuk mengetahui pengaruh dari variabel - variabel yang
digunakan. Hasilnya dapat dilihat pada gambar 2.8
Gambar 2.8 Diagram Pareto untuk Analisa Nilai Kalor[2]
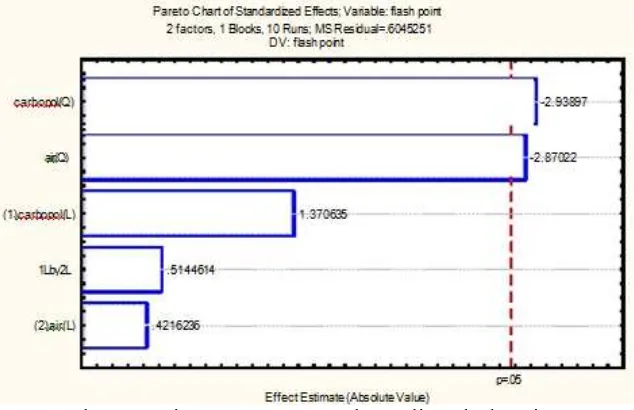
Dari gambar 2.8 (Pareto Chart) variabel yang berpengaruh adalah (1)
carbopol(L), (2)air(L), carbopol (Q), air(Q), dan 1L by 2L. Dari gambar 5 (grafik
pareto) terlihat bahwa tidak ada variabel yang paling berpengaruh terhadap nilai
kalor atau kedua variabel sama- sama memberikan pengaruh yang signifikan
terhadap nilai kalor. Oleh karena itu kedua variabel tersebut harus dicari
kecenderungannya dan kondisi operasi optimumnya dengan menggunakan grafik
optimasi 3 dimensi dan grafik kontur permukaan. Grafik optimasi 3 dimensi dan
grafik kontur permukaan dari ketiga variabel tersebut bisa dilihat digambar 2.9
Gambar 2.9 Grafik optimasi 3D % carbopol vs % air untuk nilai kalor
Gambar 2.9Grafik optimasi 3D % carbopol vs % air untuk nilai kalor[2]
Gambar 2.10 Grafik kontur permukaan untuk nilai kalor[2]
Grafik optimasi dan kontur permukaan di atas menunjukkan pengaruh
persentase carbopol dan air terhadap nilai kalor .Terlihat bahwa nilai kalor
optimum (4000 cal/g) tercapai pada persentase carbopol 1,09 % dan persentase air
7,9 %. Kandungan air pada bioetanol gel berpengaruh pada laju pembakarannya
Carbopol juga mempengaruhi nilai kalor. Hal ini disebabkan karena
carbopol sebagai gelling agent merupakan gabungan molekul-molekul dan lilitan-
lilitan dari polimer molekul yang akan berikatan melalui ikatan silang membentuk
struktur jaringan tiga dimensi dengan molekul pelarut terperangkap dalam
jaringan ini. Dengan kata lain bioetanol juga ikut terperangkap dalam ikatan
polimer molekul carbopol, sehingga kalor yang dihasilkan oleh bioetanol gel
semakin menurun, dari hasil ini dapat disimpulkan bahwa persentase carbopol,
persentase air dan interaksi keduanya mempengaruhi nilai kalor.
Pengaruh persentase air dan carbopol terhadap Flash Point. Bioetanol gel
yang dihasilkan dianalisa nilai viskositas-nya. Hasil analisa dapat diihat pada tabel
2.7
Tabel 2.7 Hasil Analisa Viskositas [2]
Run Carbopol (%massa) Air (%massa) Viskositas (cps)
1 0.85 7.5 17400
2 0.85 8.3 24900
3 1.25 7.5 55800
4 1.25 8.3 55700
5 0.76 7.9 21400
6 1.33 7.9 72900
7 1.05 7.33 41200
8 1.05 8.46 40600
9 1.05 1.97 40200
10 1.05 9 42000
Dari hasil perhitungan diperoleh persamaan model matematis sebagai berikut :
Y = 41.100+17.754 X1+1631,25 X12 + 818,93 X2 -1.49375 X22-1.900 X1X2 (2.3)
Hasil prediksi dengan persamaan model matematis dibandingkan dengan
Tabel 2.8 Perbandingan Hasil Analisa dengan Hasil Prediksi untuk Viskositas [2]
Run �� (%) �� (%) Yo (cps) Yp (cps)
1 0.85 7.5 17400 20764.57
2 0.85 8.3 24900 26202.43
3 1.25 7.5 55800 60072.57
4 1.25 8.3 55700 57910.43
5 0.76 7.9 21400 19254.55
6 1.33 7.9 72900 69470.45
7 1.05 7.33 41200 36954.35
8 1.05 8.46 40600 39270.65
9 1.05 1.97 40200 41100
10 1.05 9 42000 41100
Keterangan :
X1 = Persentase carbopol ( %)
X2 = Persentase air ( %)
Yo = Nilai viskositas hasil analisa (cps)
Yp = Nilai viskositas hasil prediksi (cps)
Data tersebut kemudian diolah dengan metode central composit design
dari program Statistica 6 untuk mengetahui pengaruh dari variabel - variabel yang
digunakan. Hasilnya dapat dilihat pada gambar 2.11
Dari gambar 2.11 (Pareto Chart) variabel yang berpengaruh(1) carbopol
(L). Kedua variabel tersebut dicari kondisi operasi optimumnya dengan
menggunakan grafik optimasi 3 dimensi dan grafik kontur permukaan. Grafik
optimasi 3 dimensi dan grafik kontur permukaan dari ketiga variabel tersebut bisa
dilihat di gambar 2.12 dan 2.13
Gambar 2.12 Grafik optimasi 3D % carbopol vs % air untuk viskositas [2]
Gambar 2.13 Grafik kontur permukaan untuk viskositas [2]
Grafik optimasi dan kontur permukaan di atas menunjukkan pengaruh
persentase carbopol dan air terhadap viskositas .Terlihat bahwa viskositas hanya
dipengaruhi oleh carbopol. Namun dari grafik optimasi dan kontur permukaan
digunakan sebagai variabel kurang besar, sehingga nilai viskositas optimum
belum tercapai. Oleh karena itu, untuk membuat bioetanol gel dengan nilai
viskositas optimum diperlukan persentase carbopol lebih dari 1,4 %. Semakin
banyak carbopol yang ditambahkan maka semakin banyak polimer yang saling
berikatan membentuk ikatan tiga dimensi yang merangkap molekul pelarut.
Carbopol akan mengembang dalam air 1000 kali lebih besar dari volume semula
dan 10 kali dari diameter semula. Semakin banyak carbopol maka viskositas
bioetanol gel yang dihasilkan akan semakin besar.
Perbandingan Nilai Kalor Bioetanol Cair dan Bioetanol Gel.
Dari hasil pengukuran dengan menggunakan bom kalorimeter didapatkan
nilai kalor bioetanol cair adalah 4918,66 cal/g dan nilai kalor bioetanol gel adalah
3992,875 cal/g. Terlihat bahwa terjadi penurunan nilai kalor pada bioetanol. Nilai
kalor bioetanol gel lebih kecil daripada nilai kalor bioetanol cair. Hal ini
disebabkan pada proses pembuatan bioetanol gel ditambahkan air. Kandungan air
pada suatu bahan bakar akan menurunkan nilai kalornya.
Selain itu ditambahkan pula carbopol sebagai gelling agent. Carbopol
merupakan gabungan molekul - molekul dan lilitan -lilitan dari polimer molekul
yang akan berikatan melalui ikatan silang membentuk struktur jaringan tiga
dimensi dengan molekul pelarut terperangkap dalam jaringan ini. Sehingga dapat
disimpulkan bahwa penurunan nilai kalor pada bioetanol gel disebabkan karena
penambahan air dan carbopol.
Flash point dipengaruhi oleh persentase air dan persentase carbopol; nilai
kalor dipengaruhi oleh persentase air, persentase carbopol, dan interaksi
keduanya; viskositas dipengaruhi oleh carbopol. Nilai flash point optimum 21 0C
dan nilai kalor optimum 4000 cal/g diperoleh pada kondisi operasi persentase air
2.6. Jenis-Jenis Kompor Bioetaol
Anil K. Rajvanshi, S.M. Patil dan B. Mendonca (2007) meneliti tentang
kompor etanol kadar 50% dengan tekanan 50–150 kPa. Gambar kompor tersebut
dapat dilihat pada gambar 2.14. Penelitian dilaksanakan di daerah pedesaan India.
Penelitian kompor etanol bertekanan ini menghasilkan efisiensi sekitar 44% -
46%. Biaya operasional dengan menggunakan kompor etanol jenis ini adalah
lebih rendah dari biaya operasioal kompor LPG dan kompor minyak tanah.
Gambar 2.14 Kompor Etanol Bertekanan [4]
Stumpf, E. dan Muhlbauer, W. (2002) meneliti tentang kompor minyak
tumbuhan. Kompor yang diteliti dapat dilihat pada Gambar 2.15 pada penelitian
ini dihasilkan bahwa penggunaan kompor minyak tumbuhan bertekanan ini sangat
menguntungkan dan dapat diterima oleh masyarakat di daerah tropis dan subtropis
karena sangat mirip dengan kompor minyak tanah.
Murren, J dan O’Brien, C (2006) meneliti tentang keamanan dan efisiensi
konsumsi bahan bakar menggunakan kompor Cleancook di daerah Addis Ababa,
Ethiopia. Gambar kompor yang digunakan dapat dilihat pada gambar 2.16 dari
penelitian ini didapatkan bahwa kompor Cleancook lebih aman digunakan dari
pada kompor dari kerosin dan penggunaan kompor ini mencapai efisiensi 61%,
dengan bahan bakar etanol kadar 90%.
Gambar 2.16 Kompor Cleancook[6].
Anil K. Rajvanshi tahun 2009 meneliti tentang penggunaan etanol kadar
58% untuk penerangan menggunakan petromak/lentera. Gambar lentera berbahan
bakar etanol 58% tersebut terlihat pada gambar 2.17 dari penelitian ini didapatkan
bahwa penggunaan etanol kadar 58% dapat digunakan sebagai bahan bakar
petromak/ lentera dengan efisiensi 27%.
James Robinson, tahun 2006 meneliti tentang perbandingan penggunaan
kompor superblue dengan bahan bakar etanol dengan kompor batubara. Gambar
kompor superblue dapat dilihat pada Gambar 2.18. Metode yang digunakan untuk
menguji efisiensi kompor adalah water boiling test dengan mendidihkan dua liter
air. Pada penelitian ini bahan bakar kompor superblue adalah etanol dengan kadar
96%. Dari penelitian ini didapatkan hasil bahwa efisiensi kompor superblue lebih
tinggi dari kompor batubara. Efisiensi kompor superblue untuk start dingin
sebesar 40% dan start panas sebesar 43%, sedangkan untuk kompor batubara
untuk start dingin 15% dan start panas sebesar 23%.
Gambar 2.18 (a) Kompor Batubara, (b) Kompor Superblue[8].
Pradana, Rizka Andika; Institut Teknologi Sepuluh Nopember (ITS)
(2012), membuat kompor bioetanol tipe side burner dengan variasi diameter 3
inci dan 2.5 inci, dapat dilihat pada gambar 2.19. Kadar bioetanol yang digunakan
dalam penelitian ini adalah 99%. Hasil penelitian ini menunjukkan bahwa kompor
uji dengan firewall 3 inci dan firewall 2.5 inci berturut-turut menghasilkan: daya
2.38 kW dan 1.6 kW; efisiensi 56.57% dan 54.91%; konsumsi bahan bakar
spesifik 0.271 kg bahan bakar/kg uap air.jam dan 0.241 kg bahan bakar/kg uap
air.jam.
2.7Proses Pembakaran
Pembakaran merupakan oksidasi cepat bahan bakar disertai dengan
produksi panas, atau panas dan cahaya. Pembakaran sempurna bahan bakar terjadi
hanya jika ada pasokan oksigen yang cukup. Pada gambar 2.16 menunjukkan
beberapa contoh pembakaran. Oksigen (O2) merupakan salah satu elemen bumi
paling umum yang jumlahnya mencapai 20,9% dari udara. Bahan bakar padat atau
cair harus diubah ke bentuk gas sebelum dibakar. Biasanya diperlukan panas
untuk mengubah cairan atau padatan menjadi gas. Bahan bakar gas akan terbakar
pada keadaan normal jika terdapat udara yang cukup.
Hampir 79% udara (tanpa adanya oksigen) merupakan nitrogen, dan
sisanya merupakan elemen lainnya. Nitrogen dianggap sebagai pengencer yang
menurunkan suhu yang harus ada untuk mencapai oksigen yang dibutuhkan untuk
pembakaran. Nitrogen mengurangi efisiensi pembakaran dengan cara menyerap
panas dari pembakaran bahan bakar dan mengencerkan gas buang. Nitrogen juga
mengurangi transfer panas pada permukaan alat penukar panas, juga
meningkatkan volum hasil samping pembakaran, yang juga harus dialirkan
melalui alat penukar panas sampai ke cerobong. Nitrogen ini juga dapat
bergabung dengan oksigen (terutama pada suhu nyala yang tinggi) untuk
menghasilkan oksida nitrogen (NOx), yang merupakan pencemar beracun.
Tujuan dari pembakaran yang baik adalah melepaskan seluruh panas yang
terdapat dalam bahan bakar. Hal ini dilakukan dengan pengontrolan pembakaran
yaitu (1) temperatur yang cukup tinggi untuk menyalakan dan menjaga penyalaan
bahan bakar, (2) turbulensi atau pencampuran oksigen dan bahan bakar yang baik,
dan (3) waktu yang cukup untuk pembakaran yang sempurna.
Bahan bakar yang umum digunakan seperti gas alam dan propan biasanya
terdiri dari karbon dan hidrogen. Uap air merupakan produk samping pembakaran
hidrogen, yang dapat mengambil panas dari gas buang. Terlalu banyak atau
sedikitnya bahan bakar pada jumlah udara pembakaran tertentu, dapat
mengakibatkan tidak terbakarnya bahan bakar dan terbentuknya karbon
monoksida. Jumlah O2 tertentu diperlukan untuk pembakaran yang sempurna
pembakaran sempurna. Walau demikian, terlalu banyak udara berlebih akan
mengakibatkan kehilangan panas dan efisiensi [11].
Gambar 2.19 (a) pembakaran sempurna, (b) pembakaran yang baik, (c) pembakaran tidak sempurna [11].
2.8 Perpindahan Panas
Perpindahan panas dapat terjadi melalui 3 cara yaitu [11]:
1. Radiasi
2. Konduksi
3. Konveksi
2.8.1 Radiasi
Radiasi yaitu perpindahan panas melalui gelombang dari zat ke zat lain.
Semua benda memancarkan kalor, hal ini terbukti setelah temperatur meningkat.
Pada hakekatnya proses perpindahan kalor radiasi terjadi dengan perantaraan
foton dan juga gelombang elektromagnet. Proses perpindahan kalor sering terjadi
secara serentak. Pada gambar 2.8 menunjukkan perpindahan panas secara radiasi.
Misalnya sekeping plat yang dicat hitam yang terkena sinar matahari. Plat akan
menyerap sebagian energi matahari yang menyebabkan temperatur permukaan
plat menjadi meningkat. Permukaan plat yang temperaturnya tinggi akan
terkonduksi kepermukaan plat bagian bawah sehingga bagian bawah plat
temperaturnya juga menjadi tinggi. Permukaan bagian atas memiliki temperatur
akan dikonveksi ke udara sekeliling dan sebagian juga disebarkan secara radiasi
[11].
Gambar 2.20 Perpindahan Panas Radiasi
(a) pada permukaan, (b) antara permukaan dan lingkungan [11]
2.8.2 Konduksi
Konduksi adalah proses perpindahan energi dari daerah bersuhu tinggi ke
daerah bersuhu rendah didalam satu medium. Dalam aliran panas konduksi,
perpindahan energi terjadi karena hubungan molekul secara langsung tanpa
adanya perpindahan molekul yang cukup besar. Menurut teori kinetik, suhu
elemen suatu zat sebanding dengan energi kinetik rata-rata molekul-molekul yang
membentuk elemen itu. Energi yang dimiliki oleh suatu elemen zat yang
disebabkan oleh kecepatan dan posisi relatif molekul-molekulnya disebut energi
dalam. Jadi semakin cepat molekul-molekul bergerak, semakin tinggi suhu
maupun energi dalam elemen zat. Bila molekul-molekul disatu daerah
memperoleh energi kinetik rata-rata yang lebih besar daripada yang dimiliki oleh
molekul-molekul didaerah yang berdekatan, sebagaimana diujudkan oleh adanya
beda suhu, maka molekul-molekul yang memiliki energi yang lebih besar itu
memindahkan sebagian energinya kepada molekul-molekul didaerah bersuhu
rendah. Perpindahan energi tersebut dapat berlagsung dengan tumbukan elastis
(misalnya dalam fluida) atau dengan pembauran (difusi) elektron-elektron yang
bergerak lebih cepat dari daerah yang bersuhu tinggi ke daerah bersuhu rendah.
Bahan yang dapat menghantar arus listrik dengan sempurna merupakan
penghantar yang baik juga untuk kalor dan sebaliknya. Pada gambar 2.9
satu ujungnya dipanaskan kedalam api maka kalor akan dipindahkan ke ujung
yang dingin [11].
Gambar 2.21 Perpindahan Panas Konduksi dan Difusi Akibat Aktivitas Molekul [11].
2.8.3 Konveksi
Konveksi adalah proses transport energi dengan kerja gabungan dari
konduksi panas, penyimpanan energi dan gerakan mencampur. Perpindahan
energi dengan cara konveksi dari suatu permukaan yang suhunya diatas suhu
fluida sekitarnya berlangsung dalam beberapa tahap. Pertama, panas akan
mengalir dengan cara konduksi dari permukaan fluida yang berbatasan. Energi
yang berpindah dengan cara demikian akan meningkatkan suhu dan energi dalam
partikel-partikel fluida ini. Kemudian partikel-partikel fluida tersebut akan
bergerak ke daerah yang bersuhu lebih rendah di dalam fluida dimana partikel-
partikel akan bercampur dan memindahkan sebagian energinya kepada partikel-
partikel lainnya. Jika suatu plat panas dibiarkan berada diudara sekitar tanpa ada
sumber gerakan dari luar, maka udara itu bergerak sebagai akibat terjadinya
gradien densitas di dekat plat itu. Peristiwa ini dinamakan konveksi alamiah,
sedangkan konveksi paksa jika udara dihembuskan dengan kipas. Beberapa
contoh perpindahan panas secara konveksi terlihat pada gambar 2.16 Pada
perpindahan panas secara konveksi, energi kalor akan dipindahkan ke
Gambar 2.22 Perpindahan Panas Konveksi
(a) konveksi paksa, (b) konveksi alamiah, (c) pendidihan, (d) kondensasi [11]
2.8.4 Teori Pembakaran
Pembakaran adalah reaksi kimia, yaitu elemen tertentu dari bahan bakar
setelah dinyalakan dan digabung dengan oksigen akan menimbulkan panas
sehingga menaikkan suhu dan tekanan gas. Elemen mampu bakar (combustable)
yang utama adalah karbon (C) dan hidrogen (H), elemen mampu bakar yang lain
namun umumnya hanya sedikit terkandung dalam bahan bakar adalah sulfur (S).
Oksigen yang diperlukan untuk pembakaran diperoleh dari udara yang merupakan
campuran dari oksigen dan nitrogen. Nitrogen adalah gas lembam dan tidak
berpartisipasi dalam pembakaran. Selama proses pembakaran, butiran minyak
bahan bakar dipisahkan menjadi elemen komponennya yaitu hidrogen dan karbon
dan masing-masing bergabung dengan oksigen dari udara secara terpisah.
Hidrogen bergabung dengan oksigen untuk membentuk air dan karbon bergabung
dengan oksigen menjadi karbon dioksida. Jika oksigen yang tersedia tidak cukup,
maka sebagian dari karbon akan bergabung dengan oksigen dalam bentuk karbon
monoksida. Pembentukan karbon monoksida hanya menghasilkan 30% panas
2.8.5 Metode Water Boiling Test
Metode Water Boiling Test (WBT) adalah suatu cara uji unjuk kerja
tungku dengan cara mendidihkan air yang berada di dalam panci, yang tujuanya
untuk mengetahui jumlah energi yang dihasilkan dari bahan bakar yang
dipindahkan ke dalam panci yang berisi air.
Pada dasarnya pengujian WBT dibagi menjadi 3 bagian penting yaitu
pengujian WBT start dingin, pengujian WBT start panas, dan pengujian WBT
simmering. diantaranya adalah [9]:
2.8.5.1Metode Start Dingin
Metode WBT start dingin, yaitu pengujian dilakukan pada saat kompor
dalam keadaan dingin, kemudian yang berada di dalam panci dipanaskan sampai
airnya mendidih, setelah airnya mendidih kompor dimatikan dan catat waktu yang
diperlukan untuk mendidihkan air, massa air yang di uapkan, temperature air
setelah mendidih, massa bahan bakar yang tersisa, dan jumlah arang yang
terbentuk [9].
Variabel yang diukur secara langsung :
f ci Berat bahan bakar sebelum diuji (gram)
P ci Berat bejana/panci dengan air sebelum tes (gram)
T ci Suhu air sebelum tes (ºC)
t ci Waktu di awal tes (min)
f cf Berat bahan bakar setelah uji (gram)
c c Berat sisa bahan bakar setelah uji (gram)
P cf Berat bejana/panci dengan air setelah uji (gram)
T cf Suhu air setelah uji (ºC)
2.8.5.2 Metode Start Panas
Metode WBT start panas: yaitu hampir mirip dengan metode WBT start
dingin tetapi pengujian dilakukan pada saat kompor dalam keadaan panas [9].
Variabel yang diukur secara langsung
f hi Berat bahan bakar sebelum ujian (gram)
P hi Berat Bejana dengan air sebelum tes (gram)
T hi Suhu air sebelum tes (ºC)
t hi Waktu di awal tes (min)
f hf Berat bahan bakar setelah uji (gram)
Variabel yang dihitung
f cm Bahan bakar yang dikonsumsi
(gram)
f
cm= f
ci- f
cf∆ c c Perubahan dalam char selama tahap
uji (gram)
∆
c
c= c
c– k
(diasumsikan sama dengan mulai dingin)
f cd Bahan bakar setara dikonsumsi
(gram)
SC c Konsumsi bahan bakar spesifik
((gram) bahan bakar / (gram) air)
SC T h Konsumsi spesifik Temp-dikoreksi
(bahan bakar gram / gram air)
c h Berat arang dan kontainer setelah uji (gram)
Bahan bakar yang dikonsumsi,
lembab (gram) f hm = f hi - f hf
∆ c h
Perubahan bersih dalam char selama tahap uji (gram) ∆
c h = c c - k (diasumsikan sama dengan
mulai dingin)
f hd
Bahan bakar kering setara dikonsumsi (gram)
w hv Air menguap (gram)
w hr
Air yang tersisa di akhir uji (gram)
∆ t h Waktu untuk merebus panci # 1 ∆ t h = t hf - t hi
∆ t T h
Temp -adjusted waktu untuk merebus panci # 1 ∆ t
Konsumsi bahan bakar spesifik (bahan bakar gram / gram air)
SC T h
Konsumsi spesifik Temp-dikoreksi (bahan bakar gram / air gram s)
FP h Firepower (W)
2.8.5.3 Metode Simmering
Metode simmering: yaitu pengujian dilakukan dengan cara menjaga suhu
air yang telah mendidih supaya konstan selama 45 menit, dan suhu tidak boleh
naik atau turun lebih dari 3ºC dari suhu air yang telah mendidihkan tadi.
Variabel yang diukur secara langsung:
f si Berat bahan bakar yang tidak terpakai saat air mendidih pertama (gram)
P si Berat Bejana dengan air ketika air pertama mendidih (gram)
T si Suhu air pada mendidih (T si = T b) (ºC)
t si Waktu di awal tes tahap didihkan (min)
f sf Berat bahan bakar terbakar yang tersisa setelah uji (gram)
c s Berat arang dan kontainer setelah uji (gram)
P sf Berat Bejana dengan air setelah uji (gram)
T sf Suhu air pada akhir uji (ºC)
t sf Waktu di akhir tes (min)
Variabel yang dihitung :
f sm
Bahan bakar yang dikonsumsi, lembab
(gram) f sm = f si - f sf
∆ c s
Perubahan bersih dalam char selama tahap
uji (gram) ∆ c s = c s - k - ∆ c c
f sd
Bahan bakar kering setara dikonsumsi (gram)
FP s Firepower (W)
TDR Mengubah-down rasio
Tidak ada konsumsi spesifik suhu-dikoreksi dalam tahap mendidih karena
tes dimulai pada T b dan perubahan suhu harus dibatasi untuk beberapa derajat.
Hal ini penting untuk diingat bahwa tujuan dari ini bagian dari tes ini
adalah untuk menjaga air pada suhu di bawah mendidih, dan salah satu harus
menginterpretasikan hasil sesuai. Sedangkan konsumsi tertentu dalam tes daya
tinggi (SC cdan SC h) menunjukkan massa bahan bakar yang dibutuhkan untuk
menghasilkan satu liter (atau kilogram) dari mendidihair, konsumsi spesifik pada
fase didihkan (SC s) menunjukkan massa bahan bakar diperlukan
untukmenjagasetiap liter (atau kilo) air tiga derajat di bawah suhu mendidih. Ini
tidak secara langsung sebanding, melainkan memberitahu dua ukuran yang
berbeda dari kinerja kompor. Hal yang sama berlaku untuk indikator lainnya,
seperti tingkat dan daya tembak terbakar.
Hal ini juga penting untuk mengakui bahwa lebih-ketergantungan pada
efisiensi termal dapat menyebabkan hasil yang menyesatkan, terutama di fase
didihkan. Karena account efisiensi termal untuk panas yang masuk akal serta
kerugian menguapkan, itu penghargaan untuk generasi uap. Dalam kebanyakan
kondisi memasak, produksi uap berlebih tidak mengurangi waktu memasak,
karena suhu di dalam bejana adalah tetap pada titik didih. Dengan demikian,
memproduksi kelebihan uap, sementara itu tidak mencerminkan energi bahan
bakar dipindahkan ke bejana memasak, tidak selalu merupakan indikator yang
baik dari kinerja kompor. Seperti kita menyatakan di tempat lain, kami berharap
untuk de-menekankan peran yang dimainkan efisiensi termal dalam diskusi
kinerja kompor dan stres lainnya, indikator yang lebih informatif seperti tingkat
pembakaran dan konsumsi spesifik pada daya tinggi dan rendah, dan rasio
turn-down, yang menunjukkan sejauh mana output daya dari kompor dapat
dikendalikan oleh pengguna [9].
2.8.6 Udara Sebagai Salah Satu Faktor Utama Pembakaran
Pembakaran yang baik diperlukan lima syarat yaitu [12]:
a. Pencampuran reaktan secara murni.
b. Suplai udara yang cukup.
c. Suhu yang cukup untuk memulai pembakaran.
d. Waktu yang cukup untuk kelangsungan pembakaran.
e. Kerapatan yang cukup untuk merambatkan nyala api.
Hal ini tidak dapat dicapai pada pembakaran yang sebenarnya (aktual)
karena itu perlu dicapai pada pembakaran yang sebenarnya (excess
air).Pembakaran yang sempurna akan menghasilkan: CO2, air, dan SO2. Pada
pembakaran yang tidak sempurna disamping produk pembakaran diatas, pada gas
asap akan terdapat sisa bahan bakar, gas CO, hidrosil (OH), aldehid (R-CHO)
dannitrogen, serta senyawa-senyawa oksida nitrat dan oksida nitrogen. Semua
produk pembakaran diatas bersifat polusi kecuali H2O dan N2.
Reaksi pembakaran bahan bakar merupakan reaksi kimia yang
berdasarkan pada hukum kekekalan massa yaitu bahwa jumlah massa setiap
elemen adalah sama selama reaksi kimia. Jumlah total massa setiap elemen di ruas
kanan (produk) dan ruas kiri (reaktan) pada reaksi kimia harus sama. Nilai
kuantitas pada analisa pembakaran untuk mengetahui jumlah udara dan bahan
bakar dinyatakan dengan Air-Fuel Ratio (AFR) yaitu perbandingan antara massa
udara dengan massa bahan bakar [11]:
���
=
����
=
(�.�)�
(�.�)� ……… (2.1) Dimana: ��� = Air-Fuel Ratio
�
� =massa udara (kg)�
� = massa bahan bakar (kg)�
� =jumlah mol udara (kmol)�
� =jumlah mol bahan bakar (kmol)�
� =massa molar udara (kg/kmol)Gambar 2.23 Reaksi Kimia Pembakaran
Pembakaran stoichiometri adalah pembakaran dimana bahan bakar
terbakar sempurna dengan jumlah udara teori, yaitu apabila [12]:
a. Tidak ada bahan bakar yang belum terbakar (semua unsur karbon C
menjadi karbondioksida CO2, dan semua unsur hidrogen H menjadi
air H2O).
a. Tidak ada oksigen di dalam produk.
Penyebab proses pembakaran menjadi tak sempurna, dimana ditandai
dengan terbentuknya C, H2, CO, OH atau yang lain dalam produk pembakaran :
a. Kekurangan oksigen (O2).
b. Kurangnya kualitas campuran.
c. Terjadi dissosiasi (peruraian gas produk karena suhu tinggi).
Pembakaran menunjukan kekurangan udara (lean mixtures) atau
pembakaran mengalami kelebihan udara (rich mixtures) pada gas buang dapat
ditunjukan dengan perbandingan antara AFRact dengan AFRst dinotasikan λ
(lambda), dirumuskan:
λ
=
AFR
actAFR
st
dimana nilai λ = rich mixtures
Prosentase kelebihan udara (excess air) adalah perbandingan antara selisih
antara perbandingan udara-bahan bakar actual (A/F)actual, dengan perbandingan
udara-bahan bakar teoritis (A/F)theory, dengan perbandingan udara-bahan bakar
teoritis (A/F)theory.
������ − ���= (�/�)��� −(�/�)�ℎ (�/�)�ℎ
Dimana nilai excess-air = 0,25-0,50 dan untuk nilai maksimal excess-air = 1,00.
Pembakaran yang optimum dapat terjadi ketika jumlah udara yang
sesungguhnya harus lebih besar daripada yang dibutuhkan secara teoritis. Analisis
kimia gas-gas merupakan metode obyektif yang dapat membantu untuk
mengontrol udara yang lebih baik dengan mengukur CO2, atau O2, dalam gas
buang menggunakan peralatan pencatat kontinyu atau peralatan Orsat.
Pengukuran kandungan gas CO2, dalam gas buang dapat digunakan untuk
menghitung udara berlebih (excess-air). Sejumlah tertentu excess-air diperlukan
untuk pembakaran sempurna bahan bakar minyak, jika terlalu banyak excess-air
mengakibatkan pembakaran yang tidak sempurna.
Penambahan excess-air dapat meningkatkan aliran udara turbulen
sehingga akan meningkatkan pencampuran udara dan bahan bakar di ruang bakar
mengakibatkan pembakaran akan sempurna. Excess-air akan mempengaruhi
jumlah gas CO pada gas buang dan kehilangan panas (heat losses) pembakaran
![Gambar 2.2 Reaksi pengubahan piruvat menjadi alcohol [1].](https://thumb-ap.123doks.com/thumbv2/123dok/1740490.1116701/7.595.139.513.275.414/gambar-reaksi-pengubahan-piruvat-menjadi-alcohol.webp)
![Tabel 2.2 Sifat-sifat bahan bakar dari bioetanol, gasholine dan butyl eter [1]](https://thumb-ap.123doks.com/thumbv2/123dok/1740490.1116701/11.595.117.521.104.300/tabel-sifat-sifat-bahan-bakar-bioetanol-gasholine-butyl.webp)
![Gambar 2.4 Rangkaian alat uji Bioetanol Gel [2]](https://thumb-ap.123doks.com/thumbv2/123dok/1740490.1116701/15.595.180.450.362.519/gambar-rangkaian-alat-uji-bioetanol-gel.webp)
![Tabel 2.3 Hasil Analisa Nilai Flash Poin [2].](https://thumb-ap.123doks.com/thumbv2/123dok/1740490.1116701/16.595.149.513.293.616/tabel-hasil-analisa-nilai-flash-poin.webp)
![Tabel 2.4 Perbandingan Hasil Analisa dengan Hasil Prediksi untuk Flash Poin [2].](https://thumb-ap.123doks.com/thumbv2/123dok/1740490.1116701/17.595.108.515.210.447/tabel-perbandingan-hasil-analisa-hasil-prediksi-untuk-flash.webp)
![Gambar 2.7 Grafik kontur permukaan untuk nilai flash point [2].](https://thumb-ap.123doks.com/thumbv2/123dok/1740490.1116701/19.595.140.487.89.338/gambar-grafik-kontur-permukaan-untuk-nilai-flash-point.webp)
![Tabel 2.6 Perbandingan Hasil Analisa dengan Hasil Prediksi untuk Nilai Kalor [2]](https://thumb-ap.123doks.com/thumbv2/123dok/1740490.1116701/20.595.106.516.490.729/tabel-perbandingan-hasil-analisa-dengan-hasil-prediksi-nilai.webp)
