1
1. TUJUAN
1.1. Mempelajari cari mengisolasi enzim. 1.2. Mengetahui aktivitas enzim.
2. DASAR TEORI
Enzim merupakan protein yang mempunyai aktivitas biologis. Bila dilakukan analisis, maka komposisi kamia suatu enzim, baik yang masih aktif maupun tidak aktif ternyata sama. Karena itu kita tidak dapat menentukan keaktfifan enzim hanya dengan analisis atau penentuan komposisi kimia saja. Keaktifan enzim dapat ditentukan secara kualitatif dengan reaksi kimia yaitu dengan substrat yang dapat dikatalisis olah enzim tersebut, dan secara kuantitatif ditentukan dengan mengukur laju reaksi karena itu jumlah enzim lebih banyak dinyatakan dalam bentuk keaktifan enzim dan dinyakatan dalam satuan unit enzim.
Amilase merupakan enzim yang berfungsi memecah pati atau glikogen. Senyawa ini banyak terdapat pada tanaman dan hewan. Aktivitas enzim amilase dapat ditentukan dengan mengukur hasil degradasi pati, biasanya dari penurunan kadar pati yang larut atau dari kadar dektrinnya dengan menggunakan substrat jenuh. Hilangnya substrat dapat diukur dengan pengurangan derajat pewarnaan Iodine terhadap substrat. Permasalahan yang didapatkan saat mengisolasi produk biokimia yaitu terdapatnya pengotor yang tercampur pada produk. Pemisahan pengotor dapat dilakukan dengan berbagai cara, salah satunya dengan pengendapan. Pengendapan dapat dilakukan dengan menambahkan garam dengan konsentrasi tertentu agar protein lain yang menjadi pengotor ekstrak dapat mengendap. Proses dialysis atau sentrifuge dapat dilakukan untuk mengendapkan pengotor sehingga didapatkan produk biokimia (protein misalnya) yang murni dan dapat digunakan untuk analisis (Holme and Peck,1998).
2
Pengaruh suhu: kecepatan katalis oleh enzim akan naik bila suhu dinaikkan, namun jika enzim sudah mencapai keadaan optimlanya suhu sudah tidak berpengaruh lagi. Penambahan suhu yang lebih tinggi pada keadaan enzim yang sudah optimal akan menyebabkan penurunan aktifitas enzim, bahkan dapat menyebabkan kerusakan enzyme (Triyono,2008).
Pengaruh pH: enzim memiliki aktifitas yang maksimum pada kisaran pH optimalnya. Enzim merupakan protein, adanya keadaan yang terlalu asam dapat menyebabkan denaturasi protein/kerusakan protein. Umumnya kisaran pH optimal dari enzim adalah 4,5-8 (Rahmayanti,2010).
Pengaruh konsentrasi enzim: kecepatan reaksi enzimatik berbanding lurus dengan konsentrasi enzim. Semakin tinggi konsentrasi enzim, semakin meningkat juga kecepatan reaksinya, namun saat kecepatan reaksi sudah mencapai keadaan konstan, penambahan konsentrasi enzim tidak mempengaruhi kecepatan reaksi (Nguyen et al.,2008)
Pengaruh konsentrasi substrat: Kecepatan reaksi akan meningkat seiring bertambahnya konsentrasi substrat. Peningkatan kecepatan reaksi akan semakin kecil sampai mencapai titik dimana penambahan substrat sudah tidak mempengaruhi kecepatan reaksi enzim lagi. Hal ini disebabkan semua molekul enzim sudah membentuk ikatan kompleks dengan substrat (Omemu et al.,2005).
Pengaruh activator dan inhibitor: Aktivator adalah senyawa atau ion yang dapat meningkatkan kecepatan reaksi enzimatik dari enzim. Komponen kimia tersebut dapat disebut kofaktor. Beberapa ion yang termasuk kofaktor antara lain Zn, Fe, Ca,Mn, Cu, dan Mg. Kofaktor dapat pula berupa molekul organik kompleks yang disebut koenzim. Ikatan yang dibentuk dengan koenzim biasanya lemah, jika ada ikatan kuat disebut gugus prostetis. Kerja enzim dipengaruhi juga dengan adanya inhibitor atau penghambat (Dincbas dan Demirkan,2010). Presipitasi protein merupakan pengendapan yang terjadi karena penggumpalan yang disebabkan berkurangnya kelarutan protein karena adanya perubahan kimia. Metode isolasi enzim yang digunakan merupakan metode salting in yang dilakukan dengan menambahkan garam tidak jenuh (konsentrasi rendah) pada sampel sehingga protein menjadi bermuatan dan larut dalam larutan garam. Kelarutan protein akan terus meningkat sejalan dengan peningkatan konsentrasi garam, maka apabila konsentrasi garam ditingkatkan terus dapat menyebabkan kelarutan protein turun sehingga pada kadar garam yang lebih tinggi, protein akan mengendap.
3 menggunakan metode kolorimetri dari ikatan kompleks amilum-iodine yang membentuk warna biru keunguan. Kepekaan warna yang terbentuk dapat diketahui dengan mengukur absorbansi pada panjang gelombang 580 nm. Proses hidrolisis amilum oleh enzim harus dihentikan agar didapatkan hubungan linear antara aktivitas enzim dengan penurunan intensitas warna pada kompleks amilum-iodine, salah satu caranya dengan mendenaturasi enzim dengan asam (pada pH rendah).
3. ALAT dan BAHAN
Rak tabung reaksi
Blender
Sodium Chloride 1%
Kecambah
4. SKEMA KERJA
4.1. Isolasi Enzim Amilase dari Kecambah
Gambar 4.1 Skema isolasi enzim amilase dari kecambah.
100 gr Kecambah
30 mL NaCl 2%
Dihancurkan dan diaduk setiap 15 menit selama 1 jam, kemudian disaring
Filtrat kotor
Disentrifugasi, diambil supernatannya, endapannya dibuang
4 4.2. Pembuatan Kurva Kalibrasi
Gambar 4.2 Skema kerja pembuatan kurva standar amilum.
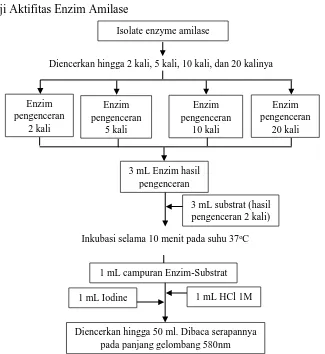
4.3. Uji Aktifitas Enzim Amilase
Gambar 4.3 Skema kerja pengujian aktivitas enzim amilase hasil isolasi dari
kecambah. 1 gram amilum
50 ml akuades
Dipanaskan hingga larut, kemudian diencerkan 2 kali, 4 kali, 8 kali, 16 kali, dan 32 kali dalam 5 labu ukur yang berbeda
1 ml hasil
Divortex hingga bercampur. Diencerkan hingga 50 ml 1 ml Iodine
Diamati dengan spektrofotometer pada panjang gelombang 580 nm
Isolate enzyme amilase
Diencerkan hingga 2 kali, 5 kali, 10 kali, dan 20 kalinya
Enzim
3 mL substrat (hasil pengenceran 2 kali)
Inkubasi selama 10 menit pada suhu 37oC
1 mL campuran Enzim-Substrat
1 mL HCl 1M 1 mL Iodine
5
Catatan:
Kontrol uji enzim dibuat dengan mencampurkan 1 ml enzim hasil pengenceran dengan 1 ml HCl dan 1 ml Iodine didalam tabung reaksi kemudian baru ditambahkan 1 ml substrat (substrat dimasukkan terakhir).
Blanko enzim dibuat dengan mengganti substrat dengan akuades mengikuti skema kerja pengujian aktivitas enzim amilase.
5. DATA HASIL PENGAMATAN dan PERHITUNGAN
5.1. Kurva Standar Amilum-I2
Pengenceran Konsentrasi
5.2. Uji Aktivitas Enzim Amilase Inkubasi selama 10 menit.
Contoh perhitungan:
Catatan: untuk perhitungan lengkap berada di lampiran.
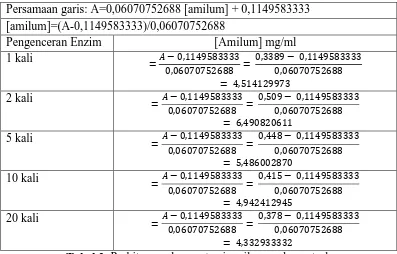
Pengenceran
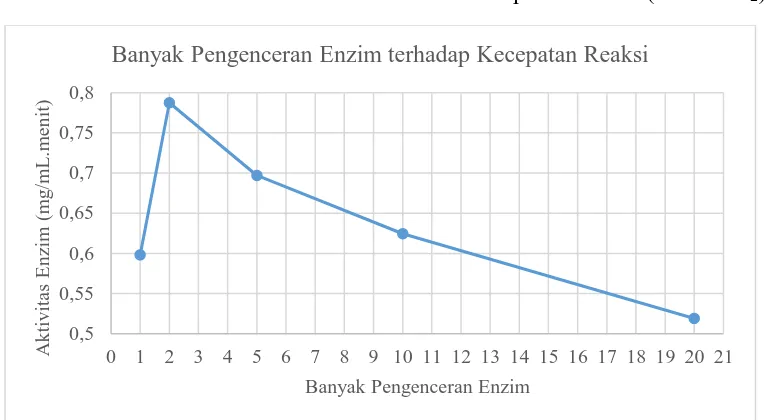
1 kali 0,389 0,026 4,514129973 -1,465359205 0,597948918 2 kali 0,509 0,031 6,490820611 -1,382997095 0,787381771 5 kali 0,448 0,025 5,486002870 -1,481831627 0,69678345 10 kali 0,415 0,036 4,942412945 -1,300634985 0,624304793 20 kali 0,378 0,063 4,332933332 -0,855879591 0,518881292
A = 0,1149583333 B = 0,06070752688 R2 = 0,9994834804
6
6. PEMBAHASAN
Isolasi enzim amilase dari kecambah dilakukan dengan proses salting in. Proses ini dilakukan menggunakan NaCl 2% sebagai agen presipitat sehingga protein lain selain enzim amilase akan mengendap. Setelah kecambah yang telah hancur di tambahkan larutan NaCl 2% sebagai agen presipitat yang mengendapkan pengotor/protein selain enzim amilase dan diaduk 15 menit sekali selama 1 jam, ekstrak diguncangkan dengan sentrigufator dan supernatant yang merupakan isolate enzim dianalisis. Penambahan NaCl menyebabkan adanya interaksi eletrolit yang menyebabkan kelarutan senyawa nonelektrolit menurun akibat kadar garam tinggi. Selain itu, NaCl juga berfungsi sebagai buffer dan merupakan activator enzim amilase. Karena protein yang menyusun amilase memiliki berat molekul lebih ringan dibandingkan dengan protein penyusun organel sel sehingga amilase akan berada dibagian atas (supernatant) sedangkan organel sel akan berada dibagian bawah dan mengendap pada hasil sentrifugasi.
Aktivitas enzim dianalisis dengan menggunakan hasil dari banyaknya amilum yang dihidrolisis selama kurun waktu tertentu. Pengukuran kadar amilum dilakukan dengan membuat kurva kalibrasi amilum. Hasil pengukuran kurva didapatkan bahwa nilai absorbansi akan meningkat seiring dengan meningkatnya kadar amilum (amilum semakin pekat). Dari hasil pembacaan absorbansi, didapati data R2 sebesar 0,9994834804 yang hamper mendekati angka 1 sehingga cukup presisi dengan persamaan linear y=0,06070752688x+0,1149583333. Factor yang mungkin dapat menyebabkan ketidakakuratan kurva adalah ikatan kompleks amilum-iodin yang tidak stabil sehingga ada kemungkinan ikatan akan terdisosiasi dalam air (Woodard,1934). Blanko yang digunakan dalam pembuatan kurva merupakan akuades yang ditambahkan dengan iodin kemudian diencerkan hingga 50 mL. Blanko digunakan sebagai larutan pembanding dan untuk mengetahui besarnya serapan oleh zat selain sampel (beberapa senyawa yang digunakan misalnya reagen maupun pelarut dapat memberikan serapan pada saat pembacaan absorbansi, sehingga penggunaan blanko bertujuan untuk menghindari error akibat adanya serapan oleh zat pereaksi, pelarut, kondisi, maupun zat lain selain sampel, misalnya pengotor).
7 digunakan merupakan enzim yang telah di inaktivasi terlebih dahulu dengan menambahkan HCl 1 M pada enzim sebelum menambahkan substrat (amilum). Hasil dari perhitungan aktivitas enzim pada berbagai pengenceran, didapatkan hasil percobaan yang tidak sesuai dengan teori. Secara teori, semakin tinggi konsentrasi enzim, maka akan semakin cepat proses hidrolisis amilum. Sedangkan dari hasil percobaan didapatkan bahwa aktivitas enzim dalam mengkatalis proses hidrolisis amilum terjadi secara acak. Namun jika dilihat dari nilai absorbansi sampel uji, dapat dikatakan bahwa semakin pekat konsentrasi enzyme amilase, didapatkan semakin kecil kadar amilum yang dapat dilihat dari nilai absorbansinya.
7. KESIMPULAN
Isolasi enzim amilase dari kecambah dilakukan dengan cara menghancurkan sel kecambah dan mengeluarkan endoenzim dan pemurnian dengan cara salting in dan sentrifugasi yang menghasilkan supernatant yang dianalisis. Isolat enzim diukur aktivitasnya dengan melihat kemampuan hidrolisis amilum dengan metode kolorimetri berdasarkan intensitas warna dari kompleks amilum-iodin dan didapatkan bahwa semakin tinggi konsentrasi enzim maka semakin tinggi pula aktivitas enzim tersebut.
8. DAFTAR PUSTAKA
Budiarti, G.I., Sumardiono, S., Kusmiyati. 2016. “Studi Konversi Pati Ubi
Kayu (Cassava Starch) menjadi Glukosa secara Enzimatik”. Chemica, 3(1), pp 7-16.
Chang, R. 2010. Chemistry, 10th Edition. New York: McGraw-Hill.
Derera, N.F. 1989. Preharvest Field Sprouting in Cereals. Florida: CRC Press. Dincbas, S. and Demirkan, E. 2010. “Comparison of Hydrolysis Abilities onto Soluble and Commercial Raw Starches of Immobilized and Free
B.amyloliquefaciens α-Amylase”. Journal Biol.Environ.Sci, 4(11), pp.87– 95.
Fuwa, H. “A New Method for Microdetermination of Amylase Activity by the
Use of Amylose as the Substrate”. The Journal of Biochemistry, 41(5), pp 583-603.
Holme, D.J., dan Peek, H. 1998. Analytical Biochemstry, 3rd Edition. London: Pearson Education Limited.
8 Umbian”. In Seminar Nasional Teknoin Bidang Teknik Kimia dan Tekstil, pp. 7–10.
Omemu, A.M., Akpan, I., Bankole, M.O., Tenida, O.D. 2005. “Hydrolisis of Raw Tuber Starches by Amylase of Aspergillus niger AMO7 Isolated from The Soil”. African Journal of Biotechnology, 4 (1), pp. 19-25.
Rahmayanti, D., 2010. Pemodelan dan Optimasi Hidrolisa Pati Menjadi Glukosa dengan Metode Artificial Neural Network-Genetic Algorithm (ANN-GA). Semarang: Universitas Diponegoro.
Indah, S. 2009. Pra Rancangan Pabrik Pembuatan Glukosa Dari Pati Jagung dengan Proses Hidrolisa Dengan Kapasitas 12000 Ton/Tahun. Medan: Universitas Sumatera Utara.
Nguyen, H.M., Ha, S.H., Koo, Y.M. 2008. “Optimization of Lipase-Catalyzed Fructose Palmitate Synthesis in Ionic Liquid”. Jurnal of Biotechnology, 136s, pp. s356-s401.
Vaseudevan, D.M., Sreekumari, S., dan Vaidyanathan, K. 2013. Textbook of Biochemistry for Medical Student, 7th Ed. New Delhi: Jaypee Brothers Medical Publisher.
Woodard, H.Q. 1934. “Colorimetric Determination of Iodine by The Starch
9
Lampiran
A. Perhitungan lengkap konsentrasi amilum hasil hidrolisis enzim Persamaan garis: A=0,06070752688 [amilum] + 0,1149583333 [amilum]=(A-0,1149583333)/0,06070752688
Pengenceran Enzim [Amilum] mg/ml
1 kali = − ,
Tabel 1. Perhitungan konsentrasi amilum hasil hidrolisis oleh enzim.
B. Perhitungan lengkap konsentrasi amilum pada control enzim Persamaan garis: A=0,06070752688 [amilum] + 0,1149583333 [amilum]=(A-0,1149583333)/0,06070752688
Pengenceran Enzim [Amilum] mg/ml
1 kali = − ,
Tabel 2. Perhitungan konsentrasi amilum pada control.
C. Perhitungan lengkap aktivitas enzim pada setiap pengenceran Aktivitas Enzim = [� � ]−[� ]
10 Pengenceran Enzim Aktivitas Enzim (mg/ml.menit)
1 kali =[ , ]− [− , ] = ,
2 kali =[ , ]− [− , ] = ,
5 kali =[ , ]− [− , ] = ,
10 kali =[ , ]− [− , ] = ,
20 kali =[ , ]− [− , ] = ,
Tabel 3. Perhitungan aktivitas enzim amilase.
Gambar 1. Kurva standar konsentrasi amilum terhadap Absorbansi (Amilum-I2).
Gambar 2. Kurva banyak pengenceran enzim terhadap kecepatan reaksi enzim. 0
Kurva Standar Konsentrasi Amilum terhadap Absorbansi
0,5
11
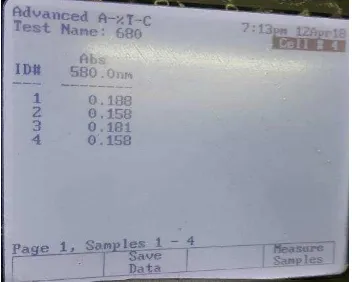
Gambar 3. Hasil pembacaan absorbansi kompleks amilum-iodine pada
konsentrasi 10 mg/ml (gambar kiri, cell 1), konsentrasi 5 mg/ml (gambar kanan, cell 2), dan konsentrasi 2.5 mg/ml (gambar kanan, cell 3).
Gambar 4. Hasil pembacaan absorbansi kompleks amilum-iodin pada konsentrasi
1.25 mg/ml (cell 1) dan konsentrasi 0,625 mg/ml (cell 2).
Gambar 5. Hasil pembacaan absorbansi control (cell 1) dan sampel uji (cell 2)
12
Gambar 6. Hasil pembacaan absorbansi control (cell 1) dan sampel uji (cell 2)
pada pengenceran 5 kali (gambar kiri) dan pengenceran 2 kali (gambar kanan) enzim amilase hasil isolasi dari kecambah.
Gambar 7. Hasil pembacaan absorbansi control (cell 1) dan sampel uji (cell 2)