commit to user
i
SINTESIS HIDROTALSIT Mg-Al-NO
3DENGAN
VARIASI pH DAN WAKTU
Disusun oleh :
RINA DWI ASTUTININGSIH DEWI SAFITRI
M0308056
SKRIPSI
Diajukan untuk memenuhi sebagian
persyaratan mendapatkan gelar Sarjana Sains
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SEBELAS MARET
SURAKARTA
commit to user
commit to user
iii
PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi saya yang berjudul “Sintesis Hidrotalsit Mg-Al-NO3 Dengan Variasi pH dan Waktu” adalah benar-benar hasil
penelitian sendiri dan tidak terdapat karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu perguruan tinggi, dan sepanjang pengetahuan saya juga tidak terdapat kerja atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu dalam naskah ini dan disebutkan dalam daftar pustaka.
Surakarta, Februari 2013
commit to user
iv
SINTESIS HIDROTALSIT Mg-Al-NO3 DENGAN VARIASI pH DAN WAKTU
RINA DWI ASTUTININGSIH DEWI SAFITRI Jurusan Kimia. Fakultas MIPA. Universitas Sebelas Maret
ABSTRAK
Sintesis hidrotalsit Mg-Al-NO3 dalam variasi pH dan waktu telah
dilakukan dengan metode kopresipitasi. Material ini dibuat dengan mencampurkan larutan Mg(NO3)2.6H2O dan Al(NO3)3.9H2O. Sintesis dilakukan
pada variasi pH 8, 9, 10 dan 11 pada suhu 70 oC selama 3 jam serta variasi waktu 2,0; 2,5; 3,0; 3,5 dan 4 jam pada pH 10 dan suhu 70 oC. Material hasil sintesis selanjutnya dikarakterisasi dengan X-Ray Diffraction danFourier Transform Infra Red.
Hasil penelitian menunjukkan bahwa hidrotalsit Mg-Al-NO3 pada pH 11
memiliki kristalinitas relatif paling tinggi serta pada waktu 2,5 jam memiliki kristalinitas relatif paling tinggi dengan kemurnian 57,63 %.
Pengaruh variasi pH dan waktu terhadap kemurnian dan kristalinitas relatif adalah semakin tinggi pH dan semakin lama waktu menyebabkan semakin meningkatnya kemurnian dan kristalinitas relatif.
Kata Kunci: Sintesis, Hidrotalsit Mg-Al-NO3, pH, Waktu reaksi, Kemurnian,
commit to user
v
SYNTHESIS Mg-Al-NO3 HYDROTALCITE WITH pH AND TIME VARIATION
RINA DWI ASTUTININGSIH DEWI SAFITRI
Department of Chemistry.Mathematic and Natural Science Faculty. Sebelas Maret Univercity
ABSTRACT
Mg-Al-NO3 hydrotalcite in the variation of the pH and time had been
synthesized by co-precipitation method. This material was made by mixing the solution Mg(NO3)2.6H2O and Al(NO3)3.9H2O. Synthesis was carried out in the
range of pH 8, 9, 10 and 11 with temperature 70 oC for 3 hours as well as reaction time 2.0; 2.5; 3.0; 3.5 and 4.0 hours with pH 10 and temperature 70 oC. The product were characterized with X-Ray Diffraction and Fourier Transform Infra Red.
Result of the research showed that Mg-Al-NO3 hydrotalcite in pH 11 had
highest relative cristallinity as well as time 2,5 hours had highest relative cristallinity with purity 57,63 %.
Effect variation of the pH and time synthesis of Mg-Al-NO3 hydrotalcite
to the purity and relative cristallinity indicated that the higher of the pH and the longer reaction time the increasing purity and relative cristallinity.
Key words: Synthesis, Mg-Al-NO3 hydrotalcite, pH, Reaction time, Purity,
commit to user
vi MOTTO
“Dan Dialah Tuhan (yang disembah) di langit dan Tuhan (yang disembah) di bumi, dan Dialah Yang Maha Bijaksana, Maha Menget ahui”. (Q.S. az-Zukhr uf:
84)
“Jadikanlah sabar dan sholat sebagai penolongmu, sesungguhnya Allah ber sama or ang-or ang yang sabar ” (Q.S. Al Baqar ah: 153)
“.... Hanya or ang-or ang yang ber sabar lah yang disempur nakan pahalanya t anpa bat as”. (Q.S. az-Zumar : 10)
Bar ang siapa yang menit i jalan unt uk memper oleh ilmu, maka Allah akan member ikan kemudahan baginya jalan menuju sur ga (H.R.Muslim dar i Abu
Hur air ah)
commit to user
vii
PERSEMBAHAN
K arya ini saya persembahkan untuk:
I bu & Bapak tercinta yang senantiasa memberikan cinta, kasih
sayang, semangat, kepercayaan dan do’anya.
Saudara-saudari tersayang I ta Sulastriningsih, W aza F athia
Qomariah, dan K autsar F adhil Akbar yang senantiasa memberikan
dukungan dan keceriaan
.
Hanaf Qowiyyul Adib, I nsyaallah kekasih dunia dan akhirat yang
selalu setia mendukung dan menemani dalam keadaan apapun
commit to user
viii
KATA PENGANTAR
Puji syukur penulis panjatkan ke hadirat Allah Subhanahu Wa Ta’ala atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi dengan judul “ Sintesis Hidrotalsit Mg-Al-NO3 Dengan Variasi pH dan Waktu”.
Sholawat dan salam senantiasa penulis haturkan kepada Rosulullah SAW sebagai pembimbing seluruh umat manusia.
Skripsi ini tidak akan selesai tanpa adanya bantuan dari berbagai pihak. Pada kesempatan ini penulis ingin menyampaikan ucapan terima kasih kepada:
1. Prof. Ir. Ari Handono Ramelan., M.Sc., Ph.D., selaku Dekan FMIPA UNS 2. Dr. Eddy Heraldy, M.Si selaku Ketua Jurusan Kimia FMIPA UNS dan
selaku Pembimbing I
3. Yuniawan Hidayat, M.Si selaku Pembimbing II
4. Nestri Handayani, M.Si., Apt selaku pembimbing akademis
5. Ketua UPT Laboratorium Pusat MIPA UNS dan Ketua Laboratorium Kimia FMIPA UNS
6. Bapak Ibu Dosen dan seluruh staff Kimia FMIPA UNS
7. Semua keluarga tercinta dan terkasih atas segala doa dan kasih sayangnya 8. Hanaf Qowiyyul Adib yang selalu di hati yang senantiasa mendukung dan
menemani dalam keadaan apapun
9. Selvie, Nurul, Nova, Fendry, Aziz, Dicky, Yudi selaku kelompok HTlc dan Ijoe millah zen yang merelakan kozt-nya untuk transit.
10.Teman-teman FMIPA Kimia UNS angkatan 2008 atas semangat dan dukungannya.
11.Semua pihak yang telah membantu penulis dalam penyusunan laporan penelitian yang tidak bisa penulis sebutkan satu-persatu.
Semoga Allah membalas jerih payah dan pengorbanan yang telah diberikan kepada penulis dengan balasan yang lebih baik.
commit to user
ix
yang membangun bagi kesempurnaan laporan penelitian ini. Penulis berharap semoga laporan penelitian ini dapat memberikan manfaat bagi semua pihak.
Surakarta, Februari 2013
commit to user
a. Sintesis HidrotalsitMenggunakan Bahan Senyawa Murni 7
b. Sintesis HidrotalsitMenggunakan Bahan Dari Alam 8
3. Karakterisasi Hidrotalsit ... 8
a. Identifikasi Material Hidrotalsit ... 9
commit to user
a. Pembuatan Larutan Prekursor ... 22
b. Sintesis Hidrotalsit Mg-Al-NO3 ... 22
c. Karakterisasi Hidrotalsit Mg-Al-NO3 ... 23
2. Teknik Pengumpulan dan Analisis Data ... 23
BAB IV. HASIL PENELITIAN DAN PEMBAHASAN A. Sintesis Hidrotalsit Mg-Al-NO3 ... ... 24
B. Identifikasi Material Hasil Sintesis 1. Identifikasi Kristal Dengan XRD ... 25
2. Identifikasi Gugus Fungsi Material Hasil Sintesis ... 26
C. Karakterisasi Hidrotalsit Mg-Al-NO3 ... 29
commit to user
xii
DAFTAR TABEL
Tabel 1. Karakteristik Fisik Senyawa Hasil Sintesis ... 24
Tabel 2. Data Puncak Hidrotalsit Mg-Al-NO3 pada variasi pH ... 26
Tabel 3. Data puncak Hidrotalsit Mg-Al-NO3 pada variasi waktu ... 26
Tabel 4. Perbandingan Gugus Fungsi Hidrotalsit Variasi pH ... 28
Tabel 5. Perbandingan Gugus Fungsi Hidrotalsit Variasi Waktu ... 28
Tabel 6. Perubahan harga d Hidrotalsit Mg-Al-NO3 pada Berbagai pH ... 30
Tabel 7. Perubahan harga d Hidrotalsit Mg-Al-NO3 pada Berbagai Waktu.... 30
Tabel 8. Tingkat Kemurnian Hidrotalsit Mg-Al-NO3 pada variasi pH... 32
Tabel 9. Tingkat Kemurnian Hidrotalsit Mg-Al-NO3 pada variasi waktu ...33
Tabel 10. Kristalinitas relatif Hidrotalsit Mg-Al-NO3 pada variasi pH ... 34
commit to user Gambar 4. Difraktogram XRD Mg/Al Hydrotalcite (a) rasio 2, (b) rasio 3, dan
(c) rasio 4 ... 10 Gambar 5. Difraktogram XRD Mg/Al Hidrotalsit(a) Sintesis (b) Komersil . .. 11 Gambar 6. Difraktogram XRD a) [Mg-Al-NO3] b) [Mg-Al-(Benzoat)]
c) [Mg-Al-(SDB)] ... 12 Gambar 7. Difraktogram XRD hidrotalsit Zn-Al-NO3 ... 13
Gambar 8. Difraktogram XRD material sintesis pH 10,1 ... 13 Gambar 9. Difraktogram LDHs Mg-Al di interkalasi dengan anion AMPS dan
ACPA ... 14 Gambar 10. Spektra FTIR Mg/Al Hidrotalsit(a) Sintesis (b) komersial ... 15 Gambar 11. Spektrum FTIR LDH dan MgCO3 ... 16
Gam bar 12. Spektra FTIR (a) [Mg-Al-NO3] (b) [Mg-Al-(Benzoat)] dan (c) [Mg- Al- (SDB)] ... 17
Gambar 13. Spektra FTIR Hidrotalsit Zn-Al-NO3 ... 18
Gambar 14. Spektra FTIR a) Mg/Al hydrotalcite b) Asam Humat (HA) c) Mg/Al hydrotalcite berisi HA... 19 Gambar 15. Difraktogram XRD Mg/Al-HTlc hasil sintesis (a) 8, (b) 9, (c) 10,
dan (d) 11 ... 25 Gambar 16. Difraktogram XRD (a) JCPDS 89-0460, (b) t=2 jam, (c) t=2,5 jam,
commit to user
xiv
Gambar 20. Difraktogram XRD a.t= 2 jam, b.t= 2,5 jam, c.t= 3 jam, d.t= 3,5 jam, e. t=4 jam, f. JCPDS Mg(NO3)2.9H2O, g. JCPDS Al(NO3)3.9H2O
commit to user
xv
DAFTAR LAMPIRAN
Lampiran 1. Perhitungan Sintesis Hidrotalsit Mg-Al-NO3 ... 41
Lampiran 2. Skema Sintesis Hidrotalsit Mg-Al-NO3darisenyawa murni ... 42
Lampiran 3. Hasil XRD Hidrotalsit Mg-Al-NO3 ... 43
Lampiran 4. Spektra FTIR Hidrotalsit Mg-Al-NO3 ... 52
Lampiran 5. Perhitungan Kemurnian Hidrotalsit Mg-Al-NO3 ... 57
Lampiran 6. Perhitungan Kristalinitas Relatif Hidrotalsit Mg-Al-NO3 ... 66
commit to user
1 BAB I
PENDAHULUAN
A. Latar Belakang Masalah
Sayur-sayuran dan buah-buahan mempunyai umur simpan pascapanen yang pendek. Proses pematangan pada buah-buahan dan kelayuan pada sayuran berperan besar terhadap berkurangnya hasil panen. Berkurangnya hasil ini akan menyebabkan meruginya petani maupun pedagang, dan rendahnya kualitas komoditi yang diterima konsumen. Salah satu faktor yang mempengaruhi penurunan hasil panen adalah etilen. Etilen adalah hormon tumbuhan pengendali utama pematangan buah dan kelayuan pada sayur-sayuran yang paling potensial dan banyak diteliti (Efendi, 2005). Adanya akumulasi etilen selama penyimpanan dapat menyebabkan cacat tertentu dan memperpendek umur hasil panen. Adapun bahan yang sudah pernah digunakan sebagai adsorben etilen adalah kalium permanganat, namun kelemahan dari kalium permanganat yaitu dapat mencemari produk makanan. Bahan lain yang memiliki kapasitas adsorpsi etilen yang banyak mendapat perhatian adalah zeolit (Patdhanagul et al., 2010).
Patdhanagul et al. (2010) menggunakan zeolit sebagai adsorben etilen
untuk menunda kematangan buah. Zeolit digunakan sebagai adsorben karena memiliki luas permukaan dan kapasitas penukar kation yang tinggi. Zeolit memiliki kemampuan yang tinggi untuk pertukaran ion karena memiliki permukaan bermuatan negatif yang diseimbangkan dengan kation. Namun, zeolit alam memiliki beberapa kelemahan, di antaranya mengandung banyak pengotor seperti Na, K, Ca, Mg dan Fe serta kristalinitasnya kurang baik. Keberadaan pengotor-pengotor tersebut dapat mengurangi aktivitas dari zeolit sebagai adsorben (Lestari, 2010). Oleh karena itu perlu mencari alternatif bahan lain yang lebih potensial sebagai adsorben. Salah satunya adalah hidrotalsit.
Hidrotalsit adalah mineral yang potensial sebagai adsorben untuk penghilangan pengotor asam dan menyerap HCl yang dihasilkan selama dekomposisi termal dari vinil klorida (Cavani et al., 1991). Fetter et al. (1999)
commit to user
mengadsorpsi asam humat dalam larutan. Isa et al. (2008) mensintesis hidrotalsit
untuk mengadsorpsi karbon dioksida. Batistella et al. (2011) mensintesis HDL
atau hidrotalsit untuk mengadsorpsi ion flourida dalam larutan air. Heraldy et al.
(2012) mensintesis Mg/Al hidrotalsit dengan menggunakan brine water tiruan
sebagai adsorben zat warna methyl orange dalam larutan.
Hidrotalsit merupakan lempung anionik yang terdiri dari lapisan bermuatan positif dengan anion dan molekul air pada daerah antar permukaan atau
interlayer (Rajamathi et al., 2001). Hidrotalsit adalah mineral yang menarik
karena dapat disintesis dengan mudah (Tong et al., 2003). Sintesis hidrotalsit
umumnya dilakukan dengan berbagai parameter, diantaranya rasio mol, suhu, pH dan waktu.
Oh et al. (2002) melakukan sintesis Mg/Al hidrotalsit dari senyawa murni
Mg(NO3)2.6H2O dan Al(NO3)3.9H2O dengan anion interlayer CO32- dalam variasi
konsentrasi ion logam, waktu pemeraman dan suhu reaksi. Hasilnya ukuran partikel meningkat sebanding dengan waktu pemeraman dan suhu reaksi. Namun, menurun karena konsentrasi logam total meningkat.
Kloprogge et al. (2004) melakukan sintesis Zn/Al hidrotalsit dengan anion interlayer CO32- pada variasi pH 6,0 - 12. Hasil analisa XRD menunjukkan
karakteristik hidrotalsitpada pH 9,0 - 12.
Tamura et al. (2006) melakukan sintesis hidrotalsit dengan anion interlayer NO3- sebagai penukar anion. Sintesis hidrotalsit dilakukan dengan 2
metode yaitu metode A pada penurunan pH 12, 10 dan 11 dan metode B pada kenaikan pH 6,5; 8,0 dan 10. Dari 2 metode tersebut diperoleh kesimpulan bahwa produk kristal murni hidrotalsit sebagai penukar anion dengan kapasitas yang baik adalah pada pH 10 pada waktu pemeraman selama 24 jam.
Kovanda et al. (2009) mensintesis hidrotalsit Mg-Al-NO3 dan Zn-Al-NO3
dengan dengan anion interlayer NO3- untuk di interkalasi dengan anion organik.
Hasilnya, semua anion organik berhasil di interkalasi dengan struktur Mg-Al dan Zn-Al.
commit to user
baik, dimungkinkan hidrotalsit dapat menyerap etilen sehingga dapat menghambat proses pematangan buah. Oleh karena itu, sebagai langkah awal perlu dipelajari sintesis hidrotalsit dengan berbagai kondisi reaksi. Sintesis dalam penelitian ini dilakukan dengan variasi pH dan waktu sintesis sehingga dapat diketahui pengaruhnya terhadap kemurnian dan persentase kristalinitas relatif.
B. Perumusan Masalah 1. Identifikasi Masalah
Kloprogge et al. (2002) mensintesis hidrotalsit dengan anion interlayer
CO32-, NO3-, SO42-, dan ClO4- dari bahan dasar senyawa murni. Bahan yang
digunakan pada sintesis tersebut adalah Mg(NO3)2.6H2O, Al(NO3)3.9H2O, SO4
-dan ClO4- dari garam Mg dan Al serta Na2CO3.
Kloprogge et al. (2004) mensintesis hidrotalsit Zn/Al hidrotalsit dengan
anion interlayer CO32- dari Zn(NO3)2.6H2O, Al(NO3)3.9H2O, dan Na2CO3 pada
pH 12 selama 1,5 jam. Sintesis dilakukan dengan variasi pada pH 6,0 – 14.
Kovanda et al. (2009) mensintesis hidrotalsit Mg-Al-NO3 dan Zn-Al-NO3
dengan anion interlayer NO3- dari Mg(NO3)2⋅6H2O atau Zn(NO3)2⋅6H2O and
Al(NO3)3⋅9H2O dengan rasio mol 2:1, pH 10 dan suhu 75 oC selama 1 jam.
Alexa et al. (2011) mensintesis hidrotalsit Mg-Al-NO3 dari
Mg(NO3)2⋅6H2O dan Al(NO3)3⋅9H2O dengan variasi rasio mol 1:1, 2:1, dan 3:1
pada pH 8 selama 3 jam.
Karakteristik hidrotalsit hasil sintesis dapat dilakukan dengan berbagai cara. X-Ray Diffaction (XRD) untuk mengidentifikasi struktur senyawa hasil
sintesis, menganalisis kemurnian dan kristalinitas relatif. Fourier Transform Infrared Spectroscopy (FTIR) untuk mengidentifikasi keberadaan gugus-gugus
fungsi dari hidrotalsit. Termo Gravimetry- Differential Thermal Analyzer
(TG-DTA) dapat digunakan untuk mengetahui keberadaan molekul H2O dalam kristal.
commit to user
2. Batasan Masalah
Berdasarkan identifikasi masalah tersebut, maka dibuat batasan masalah sebagai berikut :
a. Sintesis hidrotalsit dengan interlayer NO3- menggunakan Mg(NO3)2.6H2O dan
Al(NO3)3.9H2O.
b. Variasi pH yang dilakukan adalah 8, 9, 10 dan 11 pada rasio mol 2:1, waktu 3 jam dan suhu 70 oC.
c. Variasi waktu yang dilakukan adalah 2,0; 2,5; 3,0; 3,5 dan 4 jam pada rasio mol 2:1, pH 10 dan suhu 70 oC.
d. Karakterisasi Mg/Al hidrotalsit sebagai material hasil sintesis dilakukan dengan X-Ray Diffractometer (XRD), Fourier Transform Infra Red (FTIR).
3. Rumusan Masalah
a. Apakah sintesis dari bahan dasar senyawa murni magnesium dan alumunium nitrat menghasilkan hidrotalsit dengan interlayer NO3-?
b. Apakah semakin tinggi pH pada sintesis hidrotalsit meningkatkan kemurnian dan kristalinitas relatif?
c. Apakah semakin lama waktu pada sintesis hidrotalsit meningkatkan kemurnian dan kristalinitas relatif?
C. Tujuan Penelitian
a. Membuat senyawa hidrotalsit Mg-Al-NO3 dari Mg(NO3)2.6H2O dan
Al(NO3)3.9H2O.
b. Mengetahui pengaruh pH terhadap kemurnian dan kristalinitas relatif pada sintesis hidrotalsit Mg-Al-NO3.
c. Mengetahui pengaruh waktu terhadap kemurnian dan kristalinitas relatif pada sintesis hidrotalsit Mg-Al-NO3.
D. Manfaat Penelitan
a. Memberi informasi tentang sintesis hidrotalsit Mg-Al-NO3 dari
Mg(NO3)2.6H2O dan Al(NO3)3.9H2O.
commit to user
Hidrotalsit merupakan lempung anionik yang terdiri dari tumpukan lapisan bermuatan positif dan mempunyai anion di antara lapisan tersebut (Rajamathi et al., 2001). Semua kelompok yang hampir serupa dengan hidrotalsit baik natural
maupun sintesis disebut senyawa yang serupa hidrotalsit (hydrotalcite-like/ HTLc). Layered double hydroxides (LDH) atau hydroxides double layered (HDL)
dikenal sebagai hidrotalsit atau lempung yang mempunyai muatan positif pada lapisannya (Nindiyasariet al., 2008).
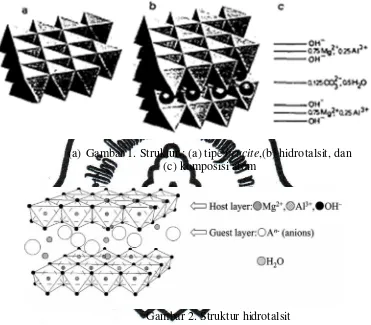
Struktur hidrotalsit mirip brucite, Mg(OH)2, dengan penggantian beberapa
ion Mg2+ oleh ion Al3+. IonMg2+ dalam struktur
brucite dikelilingi 6 ion OH
-secara oktahedral. Penggantian ion Mg2+ oleh ion Al3+ dalam struktur hidrotalsit
menyebabkan lapisan mirip brucite bermuatan positif karena ion Al3+ merupakan
kation dengan muatan yang lebih besar.
antara0,2- 0,33. KestabilanLDH atau hidrotalsitdipengaruhi oleh besar kecilnya ukuran jari-jari kation penyusunnya, sehingga struktur hidrotalsit menjadi tidak stabil apabila jari jari kation M2+ kurang dari 0,06 nm. Struktur hidrotalsit ditunjukkan oleh Gambar 1. Menurut Cavani et al. (1991) salah satu syarat dari
commit to user
(a) Gambar 1. Struktur : (a) tipe brucite,(b) hidrotalsit, dan
(c) komposisi atom
Gambar 2. Struktur hidrotalsit
Senyawa hidrotalsit sekarang ini telah banyak dikembangkan karena potensi yang dimilikinya untuk penukar anion (Nindiyasari et al., 2008), sebagai
katalis maupun penstabil polimer (Kishore and Kannan, 2004; Yang et al., 2007).
2. Sintesis Hidrotalsit
commit to user
(NaOH) yang berfungsi menjaga campuran agar bebas CO32-. Karbonat (CO32-)
merupakan anion yang membuat kisi hidrotalsit menjadi kuat. Karbonat (CO32-)
terbentuk dari CO2 yang terserap oleh larutan alkali. Karbondioksida merupakan
pengganggu utama pada pembuatan hidrotalsit. Untuk menanggulangi kontaminasi karbondioksida, digunakan gas nitrogen (N2) selama proses
kopresipitasi.Kopresipitasi ditentukan oleh kecepatan pencampuran dan pengadukan membentuk endapan.
Senyawa hidrotalsit dalam bentuk naturalnya adalah suatu hidroksikarbonat dari magnesium dan aluminium yang keberadaannya di alam sangat jarang dibandingkan dengan lempung kationik yang melimpah (Bejoy, 2001). Namun demikian, senyawa hidrotalsit merupakan mineral yang menarik karena dapat disintesis dengan mudah (Tong et al., 2003). Oleh karena itu,
beberapa peneliti telah membuat dan mengembangkan sintesis hidrotalsit dengan berbagai anion interlayer.
Ohet al. (2002) telah mensintesis Mg/Al hidrotalsit dengan anion interlayer CO32- dari Mg(NO3)2.6H2O, Al(NO3)3.9H2O dan Na2CO3. Penelitian ini
bertujuan untuk mempelajari pengaruh proses sintesis terhadap ukuran partikel hidrotalsit dengan parameter bervariasi di antaranya suhu, waktu pemeraman dan konsentrasi ion logam. Hasilnya yaitu ukuran partikel semakin meningkat seiring dengan meningkatnya waktu pemeraman dan suhu reaksi. Parameter proses sintesis tersebut mendukung pengaturan ukuran partikel hidrotalsit yang dapat di terapkan pada sintesis hidrotalsit dengan variasi ukuran partikel.
Kloprogge et al. (2004) telah mensintesis Zn/Al hidrotalsit dengan anion interlayer CO32-dari larutan Zn(NO3)2.6H2O, Al(NO3)3.9H2O dan Na2CO3pada
commit to user
terbentuk pada pH rendah. Meningkatnya stabilitas senyawa hidrotalsit dapat diamati dengan semakin meningkatnya pH.
Zhao et al. (2003) telah mensintesis hidrotalsit Mg/Al, Cu/Al dan Zn/Al
dengan interlayer CO32-. Sintesis dilakukan dengan mencampurkan larutan
Mg(NO3)2.6H2O dan Al(NO3)3.9H2O, Cu(NO3)2.6H2O dan Al(NO3)3.9H2O,
Zn(NO3)2.6H2O dan Al(NO3)3.9H2O serta Na2CO3dengan rasio mol 3:1, pH 8,5
dan suhu 65 oC. Hasilnya yaitu semakin tinggi suhu dan semakin lama waktu
pemeraman menyebabkan semakin meningkatnya kristalinitas relatif.
Kovanda et al. (2009) telah mensintesis hidrotalsit Mg-Al-NO3 dan
Zn-Al-NO3 dengan anion interlayer NO3-. Sintesis dilakukan dengan mencampurkan
larutan Mg(NO3)2.6H2O atau Zn(NO3)2.6H2O dan Al(NO3)3.9H2O pada rasio mol
2:1, pH 10 dan suhu 75 oC.Pertukaran anion menjadi metode yang paling efektif
karena semua anion organic berhasildi interkalasi dengan baik pada struktur Mg-Al dan Zn-Mg-Al.
Nindiyasari et al. (2008) telah mensintesis hidrotalsit Zn-Al-NO3 dengan
anion interlayer NO3-. Sintesis dilakukan dengan mencampurkan larutan
Zn-Al-NO3 dan Al(NO3)3⋅9H2O pada rasio mol 3:1 dan pH 8 selama 2 jam.Hidrotalsit
Zn-Al-NO3 hasil sintesis mempunyai kemampuan sebagai suatu penukar anion
yang memiliki kemampuan daya regenerasi.Alexa et al. (2011) telah mensintesis
Mg-Al-LDH dengan interlayer NO3-sebagai interkalasi captopril. Sintesis
dilakukan dari senyawa murni Mg(NO3)2.6H2Odan Al(NO3)3⋅9H2O dengan
variasi rasio mol Mg/Al 1:1, 2:1, dan 3:1 pada pH 8 selama 3 jam.
commit to user
alam maupun yang merupakan hasil sintesis adalah dengan menggunakan alat X-Ray Diffractometer (XRD) dan Fourier Transform Infrared Spectroscopy (FTIR).
a. Identifikasi Material Hidrotalsit dengan XRD
Salah satu metode yang digunakan untuk menganalisis zat padat berupa kristal secara kualitatif dan kuantitatif adalah X-Ray Difractometer (XRD) atau
difraksi sinar-X. Analisis kualitatif bertujuan untuk mengidentifikasi senyawa
utama dalam sampel, sedangkan analisis kuantitatif bertujuan mengetahui persentase kandungan senyawa utama tersebut dalam sampel.
Setiap kristal mempunyai harga d yang khas sehingga dengan mengetahui
harga d maka jenis kristalnya dapat diketahui. Referensi harga d dan intensitas
suatu senyawa dapat diperoleh dari data Joint Committee on Powder Diffraction Standars (JCPDS) yang bersumber dari International Centre for Difraction Data.
Kristalinitas material hidrotalsit Mg-Al-NO3ditentukan atas dasar posisi
(berhubungan dengan nilai sudut difraksi atau 2θ) dan intensitas garis. Sudut
difraksi ditentukan oleh jarak antara bidang kristal (d). Harga d dihitung dengan
menggunakan hukum Bragg. Hukum Bragg didefinisikan sbb:
nλ = 2dsinθ (1)
d= jarak antar bidang atom dalam kristal n= tingkat difraksi
λ= panjang gelombang sinar X θ= sudut difraksi
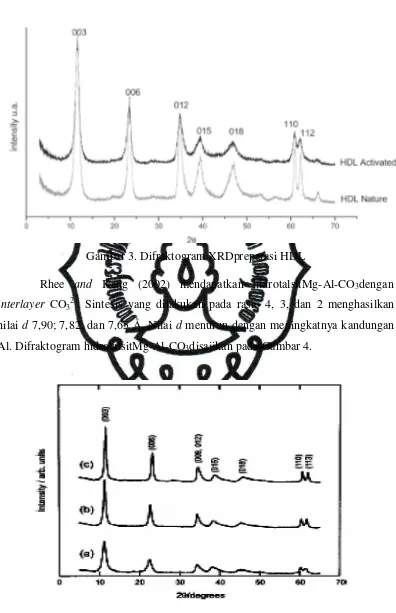
Batistella et al. (2011) menunjukkan karakteristik hidrotalsit atau
commit to user
Gambar 3. Difraktogram XRDpreparasi HDL
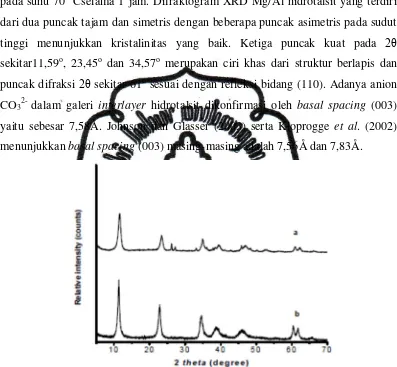
Rhee and Kang (2002) mendapatkan hidrotalsitMg-Al-CO3dengan
interlayer CO32-. Sintesis yang dilakukan pada rasio 4, 3, dan 2 menghasilkan
nilai d 7,90; 7,82; dan 7,65 Å. Nilai d menurun dengan meningkatnya kandungan
Al. Difraktogram hidrotalsitMg-Al-CO3disajikan pada Gambar 4.
commit to user
Heraldy et al. (2011) menjelaskan sintesis dan karakterisasi Mg/Al
hidrotalsit dengan interlayer CO32-. Gambar 5 menunjukkan pola XRD yang
diendapkan dari larutan yang mengandung AlCl3 dengan rasio molar Mg/Al 2:1
pada suhu 70o Cselama 1 jam. Difraktogram XRD Mg/Al hidrotalsit yang terdiri dari dua puncak tajam dan simetris dengan beberapa puncak asimetris pada sudut tinggi menunjukkan kristalinitas yang baik. Ketiga puncak kuat pada 2θ sekitar11,59o, 23,45o dan 34,57o merupakan ciri khas dari struktur berlapis dan
puncak difraksi 2θ sekitar 61o sesuai dengan refleksi bidang (110). Adanya anion
CO32- dalam galeri interlayer hidrotalsit dikonfirmasi oleh basal spacing (003)
yaitu sebesar 7,58Å. Johnson dan Glasser (2003) serta Kloprogge et al. (2002)
menunjukkan basal spacing (003) masing-masing adalah 7,56Å dan 7,83Å.
Gambar 5. Difraktogram XRD Mg/Al hidrotalsit (a) Sintesis (b) Komersil Yang et al. (2003) mensintesis hidrotalsit Mg-Al-NO3 dengan rasio 1:1,
2:1, dan 3:1 diperoleh nilai basal spacing (Å) yaitu 8,3; 8,9; dan 7,8 Å. Jarak basal spacing tergantung pada komposisi bahan baku, jarak terbesar didapatkan
pada rasio mol Mg/Al2:1. Gambar 6 menunjukkan puncak 2θ sekitar 10˚ untuk [Mg-Al-NO3] ini disebabkan oleh refleksi bidang dari kelompok (003) dari bidang
commit to user
yaitu 8,95Å untuk [Mg-Al-NO3], 15,7Å untuk [Mg-Al-(Benzoat)] dan 29,6Å
untuk [Mg-Al-(SDB)].
Gambar 6. Difraktogram XRD (a) [Mg-Al-NO3] (b) Al-(Benzoat)] (c)
[Mg-Al-(SDB)]
Nindiyasariet al. (2008) melakukan sintesis hidrotalsit Zn-Al-NO3dari
larutan zink dan larutan alumunium nitrat, sehingga diperoleh hidrotalsit dengan
interlayer berupa anion NO3-. Hasil penelitian diperoleh basal spacing (003) yaitu
8,76 pada (2θ) 10,08º yang disajikan pada Gambar 7.
commit to user
Gabrovska et al. (2008) mensintesis hidrotalsit Mg-Al-NO3dari
Mg(NO3)2.6H2O dan Al(NO3)3.9H2O dengan anion interlayer NO3-. Hasil yang
diperoleh menunjukkan puncak khas hidrotalsit Mg-Al-NO3 pada basal spacing
003, 006, 009, 015, 018, 110 dan 113 dengan basal spacing masing-masing
8,02Ǻ, 3,99Ǻ, 2,59Ǻ, 2,34Ǻ, 1,99Ǻ, 153Ǻ, dan 1,52Ǻ yang disajikan pada
Gambar 8.
Gambar 8. Difraktogram XRD material sintesis
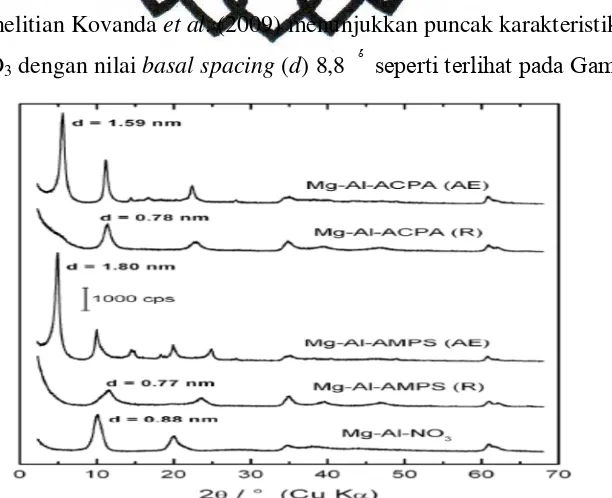
Penelitian Kovanda et al. (2009) menunjukkan puncak karakteristik LDH
Mg-Al-NO3 dengan nilai basal spacing (d) 8,8 Ǻ seperti terlihat pada Gambar 9.
commit to user
b. Penentuan Gugus Fungsi dengan FTIR
Johnson dan Glasser (2003) menunjukkan adanya puncak-puncak yang khas dari vibrasi gugus-gugus fungsi pada senyawa hidrotalsit. Bilangan gelombang 3400 cm-1 menunjukkan vibrasi ulur OH, vibrasi ulur asimetris CO3
2-pada bilangan gelombang 1400 cm-1, deformasi luar bidang CO32-pada bilangan
gelombang 800 cm-1, sementara vibrasi ulur M-Al-O dan vibrasi ulur serta tekuk
dari M-O pada bilangan gelombang 600-400 cm-1.
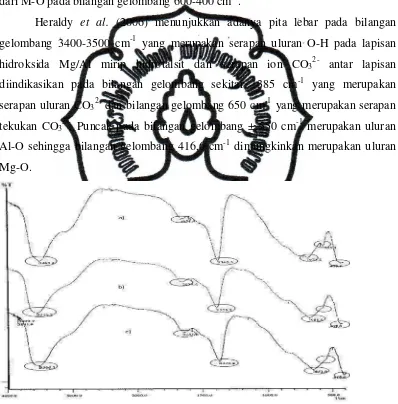
Heraldy et al. (2006) menunjukkan adanya pita lebar pada bilangan
gelombang 3400-3500 cm-1 yang merupakan serapan uluran O-H pada lapisan hidroksida Mg/Al mirip hidrotalsit dan serapan ion CO32- antar lapisan
diindikasikan pada bilangan gelombang sekitar 1385 cm-1 yang merupakan
serapan uluran CO32- dan bilangan gelombang 650 cm-1 yang merupakan serapan
tekukan CO32-. Puncak pada bilangan gelombang ± 550 cm-1 merupakan uluran
Al-O sehingga bilangan gelombang 416,6 cm-1 dimungkinkan merupakan uluran Mg-O.
Gambar 10. Spektra FTIR Mg/Al hidrotalsit (a) rasio 2,5; (b) rasio 3,0; dan (c) rasio 3,5
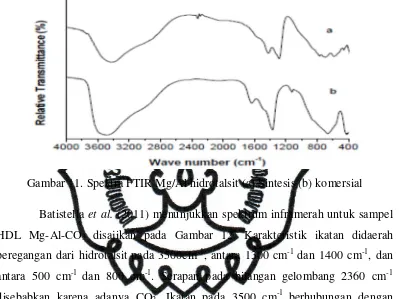
Heraldy et al. (2011) menjelaskan spektrum FTIR dari sampel Mg/Al
mirip hidrotalsit yang ditunjukkan pada Gambar 11. Serapan luas pada 3448cm-1
commit to user
lapisan. Getaran lentur dari interlayer air ditemukan pada 1496 cm-1. Getaran
asimetri dari CO32- muncul pada bilangan gelombang 1350 cm-1. Serapan di
bawah 1000 cm-1disebabkan getaran kisi Mg-O, Al-O dan Mg-O-Al.
Gambar 11. Spektra FTIR Mg/Al hidrotalsit (a) Sintesis (b) komersial Batistella et al. (2011) menunjukkan spektrum inframerah untuk sampel
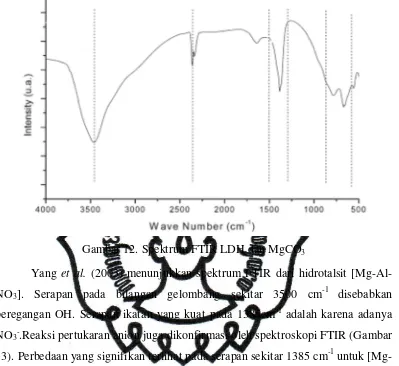
HDL Mg-Al-CO3 disajikan pada Gambar 12. Karakteristik ikatan didaerah
peregangan dari hidrotalsit pada 3500cm-1, antara 1300 cm-1 dan 1400 cm-1, dan
antara 500 cm-1 dan 800 cm-1. Serapan pada bilangan gelombang 2360 cm-1 disebabkan karena adanya CO2. Ikatan pada 3500 cm-1 berhubungan dengan
getaran peregangan ikatan OH dari karakteristik kelompok OH. Serapan antara 500 cm-1 dan 800 cm-1 merupakan ciri khas dari peregangan ikatan logam- oksigen (Al-O dan Mg-O). Ikatan antara 1300 cm-1 dan 1400 cm-1 sesuai dengan getaran khas CO32-. Hal ini dikarenakan adanya perlakuan asam yang bertujuan untuk
commit to user
Gambar 12. Spektrum FTIR LDH dan MgCO3
Yang et al. (2003) menunjukkan spektrum FTIR dari hidrotalsit
[Mg-Al-NO3]. Serapan pada bilangan gelombang sekitar 3500 cm-1 disebabkan
peregangan OH. Serapan ikatan yang kuat pada 1385cm-1 adalah karena adanya NO3-.Reaksi pertukaran anion juga dikonfirmasi oleh spektroskopi FTIR (Gambar
13). Perbedaan yang signifikan terlihat pada serapan sekitar 1385 cm-1 untuk [Mg-Al-(Benzoat)] dan [Mg-Al-(SDB)]. Pada saat yang sama serapan-serapan sekitar 2850-2950 cm-1 dan 1210-1240 cm-1 menjadi lebih menonjol. Hal ini menunjukkan bahwa anion organik telah ditukarkan dengan nitrat dalam galeri LDHs. Hasil penelitian FTIR menunjukkan bahwa [Mg-Al-NO3] benzoat bisa
mengakomodasi dan anion SDB pada intergallery untuk mendapatkan basal spacing yang lebih besar. Jadi polimer dapat dengan mudah dimasuki
commit to user
Gambar 13. Spektra FTIR (a)NO3] (b) (Benzoat)] (c) [Mg-Al-(SDB)]
Nindiyasari et al. (2008) melakukan analisis menggunakan FTIR yang
digunakan untuk mendukung pembentukan hidrotalsit Zn-Al-NO3 terlihat pada
Gambar 14. Anion NO3- pada interlayer didukung dengan adanya serapan kuat
dan tajam pada daerah bilangan gelombang 1381 cm-1 dan serapan lemah pada
daerah bilangan gelombang 601 cm-1. Vibrasi
stretching gugus OH pada lapisan
hidrotalsit dan air pada daerah interlayer ditunjukkan pada daerah bilangan
gelombang 3456 cm-1. Keberadaan molekul air pada daerah interlayer hidrotalsit
commit to user
Gambar 14. Spektra FTIR Hidrotalsit Zn-Al-NO3
Santosoet al. (2008) menunjukkan karakteristik Mg/Al hidrotalsit pada
bilangan gelombang 3442 cm-1 mengindikasikan adanya gugus OH. Serapan bilangan gelombang 1630 cm-1 mencirikan adanya molekul air pada interlayer
hidrotalsit. Serapan tajam pada 1364 cm-1 mengindikasikan CO32- pada interlayer
commit to user
Gambar 15. Spektra FTIR (a) Mg/Al hidrotalsit (b) Asam Humat (HA) (c) Mg/Al hidrotalsit berisi HA
B. Kerangka Pemikiran
Struktur hidrotalsitterdiri dari tumpukan lapisan mirip brucite yang
bermuatan positif karena beberapa ion Mg2+ digantikan oleh ion Al3+. Muatan
positif ini diseimbangkan oleh anion yang berada didaerah antar lapisan atau anion interlayer berupa NO3-. Hidrotalsit disintesis menggunakan metode
kopresipitasi (pengendapan) dengan mencampurkan larutan Mg(NO3)2.6H2O dan
Al(NO3)3.9H2O dengan penambahan NaOH.
Berbagai variasi telah dilakukan oleh para peneliti terdahulu dalam sintesis baik hidrotalsit maupun senyawa mirip hidrotalsituntuk memperoleh produk kristal hidrotalsit yang terbaik. Dalam penelitian ini dilakukan variasi pH dan waktu sintesis. Variasi-variasi tersebut berpengaruh pada kemurnian dan kristalinitas relatif. Semakin tinggi pH dan lama waktu sintesis maka semakin meningkatkan kemurnian dan kristalinitas relatif. Kemurnian dan kristalinitas relatif yang meningkat disebabkan pembentukan hidrotalsit yang bagus dan mempunyai susunan atom-atom yang teratur.
commit to user
(003, 006, 012, 015, 018, 110 dan 113). Karakterisasi dengan spektra inframerah digunakan untuk mendeteksi gugus-gugus fungsi penyusun suatu molekul. Spektra inframerah hidrotalsit Mg-Al-NO3memiliki memiliki serapan-serapan
yang khas.Hasil identifikasi dengan XRD dan FTIR dapat digunakan untuk membuktikan bahwa senyawa yang disintesis merupakan hidrotalsit Mg-Al-NO3.
C. Hipotesis
1. Senyawa hidrotalsit dengan anion interlayer NO3- dapat di sintesis dari
Mg(NO3)2.6H2O dan Al(NO3)3.9H2O.
2. Semakin tinggi pH maka semakin meningkatkan kemurnian dan kristalinitas relatif.
commit to user
21 BAB III
METODOLOGI PENELITIAN
A. Metode Penelitian
Penelitian ini dilakukan dengan metode eksperimental laboratorium. Tahapan yang dilakukan adalah sintesis hidrotalsit Mg-Al-NO3 yang dilakukan
dengan metode kopresipitasi, karakterisasi senyawa hasil sintesis pada d (basal spacing) karakteristik khas hidrotalsit menggunakan XRD dan gugus fungsi M-O,
N-O, dan O-H menggunakan FTIR.
B. Tempat dan Waktu Penelitian
Penelitian ini dilakukan dari bulan April 2012 sampai dengan Oktober 2012 di Laboratorium Kimia Dasar FMIPA UNS dan Laboratorium Pusat FMIPA UNS.
C. Alat dan Bahan
1. Alat
a. Fourier Transform Infra Red (FTIR) (Shimadzu IRPrestige-21)
commit to user
4. Aqua Bidestilata Pro Injection (Pharmaceutical Laboratories)
5. Gas Nitrogen (P.T. Samator) 6. pH indikator
D. Prosedur Penelitian
1. Pembuatan Larutan Prekursor
4,6157 gram Mg(NO3)2.6H2O dan 3,3524 gram Al(NO3)3.9H2O masing-masing
dilarutkan ke dalam 180 ml aquabides sambil terus diaduk menggunakan magnetic stirrer
selama 15 menit dan dialiri gas nitrogen. Selanjutnya membuat larutan NaOH dengan menimbang sebanyak 20 gram NaOH dilarutkan ke dalam 500 ml aquabides sambil diaduk menggunakan magnetic stirrer selama 15 menit dan dialiri dengan gas
nitrogen.
2. Sintesis HidrotalsitMg-Al-NO3
Hidrotalsit Mg-Al-NO3 disintesis dengan metode kopresipitasi yaitu
dengan mereaksikan 180 ml Mg(NO3)2.6H2O dan 180 ml Al(NO3)3.9H2O. NaOH
1M ditambahkan ke dalam larutan untuk memberikan suasana basa hingga mencapai pH 10. Larutan diaduk menggunakan magnetic stirrer selama 2; 2,5; 3;
3,5 dan 4 jam pada suhu 70 oC dan dialiri gas nitrogen. Hasil sintesis kemudian didiamkan selama 24 jam untuk memperoleh endapan hidrotalsit. Endapan dipisahkan menggunakan centrifuge dengan kecepatan 2500 rpm selama 15 menit,
kemudian dikeringkan dalam oven pada suhu 100 oC selama 24 jam. Padatan putih kering yang diperoleh merupakan hidrotalsit dan digerus hingga halus. Sementara sintesis dengan variasi pH 8, 9, 10 dan 11 dilakukan pengadukan selama waktu 3 jam dengan tahapan yang sama seperti diatas. Endapan kering yang diperoleh dikarakterisasi menggunakan XRD, kisaran sudut (2θ) 10-70º dan FTIR.
3. Karakterisasi Hidrotalsit Mg-Al-NO3
Hasil sintesis dikarakterisasi menggunakan dan X-Ray Diffractometer
commit to user
E. Teknik Pengumpulan Data
1. Data difraktogram XRD Hidrotalsit Mg-Al-NO3hasil sintesis berupa 2versus
intensitas. Dari 2 dapat diperoleh besarnya jarak antara kisi kristal (d) sesuai
dengan persamaan : n = 2 d sin . Dari data d sampel dibandingkan dengan d
hidrotalsit Mg-Al-NO3 standar dari Joint Committee on Powder Diffraction
Standards (JCPDS). Munculnya puncak-puncak dengan hkl dominan
hidrotalsit Mg-Al-NO3 pada difraktogram sampel, yang sama dengan JCPDS
menunjukkan bahwa sampel yang dianalisis sama dengan senyawa pada standar JCPDS.
Dari data XRD dapat dicari kemurnian dan kristalinitas relatif dengan rumus:
%kemur nian = ( I/ I )
( I/ I ) 100%
I/I1
s : jumlah intensitas relatif puncak senyawa dalam sampel
I/I1
t : jumlah intensitas relatif total sampel%kr istalinitasr elatif = (I) ( )
( I) ster tinggi( d003) 100% (I)s (d003) : intensitas puncak senyawa pada basal spacing 003
(I)s tertinggi : intensitas tertinggi puncak senyawa pada basal spacing 003
2. Gugus-gugus fungsi yang ada di dalam hidrotalsit Mg-Al-NO3 diketahui
dengan membandingkan puncak-puncak spektra FTIR hidrotalsit Mg-Al-NO3
dengan referensi. Berdasarkan strukturnya, hidrotalsit Mg-Al-NO3 memiliki
commit to user
24 BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
A. Sintesis Hidrotalsit Mg-Al-NO3
Hidrotalsit Mg-Al-NO3 telah disintesis dengan metode kopresipitasi dalam
variasi pH (8, 9, 10, 11) dan variasi waktu (2,0; 2,5;3,0; 3,5; 4 jam). Karakterisasi dilakukan dengan XRD dan FTIR.
Kristalinitas hidrotalsit dapat diketahui dengan melakukan analisis difraksi sinar X. Analisis kualitatif bertujuan untuk mengidentifikasi senyawa utama dalam sampel.
Setiap kristal mempunyai harga d (basal spacing) yang khas sehingga
dengan mengetahui harga d maka jenis kristalnya dapat diketahui. Hidrotalsit
dengan anion interlayer berupa NO3- dicirikan oleh harga d sekitar 8,1 Å
(Kloprogge et al., 2002). Wei et al. (2006) juga menyebutkan hidrotalsit dengan
commit to user
Difraktogram hidrotalsit Mg-Al-NO3 hasil sintesis variasi pH dan waktu
berturut-turut disajikan pada Gambar 15 dan 16.
Gambar 15. Difraktogram XRD hidrotalsit Mg-Al-NO3 (a) JCPDS 89-0460, (b)
pH 8, (c) pH 9, (d) pH 10, dan (e) pH 11
Gambar 16. Difraktogram XRD hidrotalsit Mg-Al-NO3(a) JCPDS 89-0460, (b)
commit to user
Munculnya puncak-puncak basal spacing (003), (006), (012), (015), (018),
(110), dan (113) membuktikan bahwa material yang terbentuk merupakan hidrotalsit Mg-Al-NO3. Data puncak-puncak refleksi bidang tersebut disajikan
pada Tabel 2 dan Tabel 3.
Tabel 2. Data Puncak Hidrotalsit Mg-Al-NO3 Variasi pH
Basal spacing (Angstrom)
Tabel 3. Data Puncak Hidrotalsit Mg-Al-NO3 Variasi Waktu
Basal spacing(Angstrom)
2. Identifikasi Gugus Fungsi Material Hasil Sintesis Dengan FTIR
Sesuai dengan rumus umum dari hidrotalsit, maka senyawa hidrotalsit mengandung gugus fungsi O-Hdan N-Oyang apabila dideteksi dengan FTIR akan menghasilkan puncak-puncak yang khas untuk ikatan O-H, N-O dan M-O. Spektra FTIR hasil sintesis hidrotalsit Mg-Al-NO3 variasi pH dan waktu masing-masing
commit to user
Gambar 17. Spektra FTIR hidrotalsit Mg-Al-NO3(a) pH=8, (b) pH=9, (c) pH=10,
dan (d) pH=11
Gambar 18. Spektra FTIR hidrotalsit Mg-Al-NO3(a) t=2 jam, (b) t= 2,5 jam, (c) t=
3 jam, (d) t= 3,5 jam, dan (e) t= 4 jam
Hasil spektra tersebut diatas menunjukkan pola sama yang menunjukkan kesamaan gugus fungsi di dalam hidrotalsit Mg-Al-NO3. Hasil perbandingan
commit to user
gugus fungsi hidrotalsit Mg-Al-NO3variasi pH dan waktu masing-masing
disajikan pada Tabel 4 dan Tabel 5.
Tabel 4. Perbandingan Gugus Fungsi Hidrotalsit Mg-Al-NO3Variasi pH
Gugus Fungsi
Tabel 5. Perbandingan Gugus Fungsi Hidrotalsit Mg-Al-NO3Variasi Waktu
Gugus Fungsi
Sumber : aKannan (1995) dalam Johnson dan Glasser (2003), bYang
et al. (2007),
cYang
et al. (2003), dWegrzynet al. (2010)
Berdasarkan spektra FTIR hidrotalsit Mg-Al-NO3 yang ditunjukkan pada
Gambar14 dan Gambar 15, pita lebar pada bilangan gelombang serapan kuat melebar pada bilangan gelombang sekitar 3448, 3464, 3456, 3462, 3450, 3454, dan 3460 cm-1 menunjukkan vibrasi stretching gugus hidroksi pada lapisan
hidrotalsit Mg-Al-NO3. Sesuai dengan penelitian Yang et al.(2003), serapan
commit to user
pada bilangan gelombang 1637,1639, 1610, 1629, 1635, dan 1625 cm-1 merupakan tekukan O-H dari molekul air pada daerah antar lapis yang terikat dengan anion interlayer. Heraldy et al. (2011) menyebutkan bahwa pita serapan
lebar pada 3448 cm-1 dapat diidentifikasikan sebagai vibrasi ulur O-H pada gugus hidroksil yangterikat dengan Mg dan Al pada lapisan hidrotalsit.
Adanya gugus NO3- ditunjukkan dari vibrasi ulur simetris N-O pada
serapan yang kuat pada bilangan gelombang 1382, 1384, 1362 cm-1 dan serapan
ikatan lemah pada bilangan gelombang 835, 837, 839 cm-1 menunjukkan adanya
nitrat (Wegrzyn et al., 2010). Serapan dibawah bilangan gelombang 1000 cm-1
disebabkan getaran kisi Mg-O, Al-O dan Mg-O-Al (Heraldy et al., 2011).
Analisis spektra FTIR di atas menunjukkan adanya ikatan Mg-O, Al-O serta gugus OH dan NO3-. Hasil ini mengindikasikan bahwa senyawa yang
dianalisis merupakan hidrotalsit dengan anion antar lapis NO3- yang mempunyai
rumus kimia [Mg1-xAlx(OH)2]x+(NO3)x/m.nH2O.
C. Karakterisasi Hidrotalsit Mg-Al-NO3
1. Nilai d(basal spacing) Hidrotalsit Mg-Al-NO3 Hasil Sintesis
Bentuk difraktogram dari masing-masing variasi yaitu pH dan waktu yang berbeda menunjukkan pola yang sama, namun terjadi pergeseran harga d yang diakibatkan pergeseran 2θ. Pergeseran harga d (basal spacing) dari variasi pH dan
waktu yang dibandingkan dengan penelitian Gabrovska et al. (2007)
commit to user
Tabel 6. Perubahan Harga d Hidrotalsit Mg-Al-NO3Variasi pH
Basal spacing (Angstrom)
Tabel 6 menunjukkan semakin tinggi pH hidrotalsit Mg-Al-NO3 semakin
tinggi pula harga d yang diperoleh. Hal ini dikarenakan semakin tinggi pH
semakin banyak juga ion OH- yang dapat membentuk ikatan hidrogen menghasilkan molekul air yang ada pada daerah anion interlayer hidrotalsit.
Namun, pengecualian terlihat pada harga d (003) pada pH 10 dan 11 yang
menurun jika dibandingkan pada pH 9. Penurunan ini dimungkinkan karena pada basa kuat terbentuk ikatan MgO yang mengendap dan bersaing dengan pembentukan hidrotalsit.
Tabel 7. Perubahan Harga d Hidrotalsit Mg-Al-NO3 Variasi Waktu
commit to user
Tabel 7 menunjukkan semakin lama waktu maka semakin tinggi nilai d
yang diperoleh. Hal ini dikarenakan semakin lama waktu, gaya tarik menarik antar partikel semakin besar dan sering. Namun, perkecualian terlihat pada waktu sintesis 2 jam yang memiliki harga d(003) terbesar jika dibandingkan dengan
waktu lain. Hal ini dimungkinkan pada waktu 2 jam aktifnya energi permukaan partikel menyebabkan tumbukan antar partikel besar. Harga d pada waktu 3,5 jam
menurun dibandingkan pada waktu 3 jam. Hal ini dimungkinkan tumbukan antar partikel sudah cukup untuk mengendap atau sudah berada pada kondisi jenuh.
Sehubungan tidak terdapatnya standar JCPDS untuk hidrotalsit dengan anion interlayer NO3-, maka dibandingkan dengan hasil penelitian Gabrovska et
al. (2007) untuk mengetahui basal spacing karakteristik pada hidrotalsit.
Pada difraktogram tersebut di atas terlihat puncak dengan intensitas tinggi
pada range sekitar (2θ) 30o yang mengindikasikan masih terdapat
Mg(NO3)2.6H2O pada proses sintesis dikarenakan konsentrasi Mg(NO3)2.6H2O
lebih tinggi dibandingkan Al(NO3)3.9H2O yakni 2:1. Rendahnya konsentrasi
larutan awal Mg(NO3)2.6H2O dan Al(NO3)3.9H2O menyebabkan peluang
terjadinya tumbukan antar molekul menjadi kecil. Konsentrasi anion nitrat yang rendah menyebabkan kemampuan NO3- sebagai anion interlayer dalam hidrotalsit
menjadi semakin lemah (Cavani et al., 1991). Fakta ini juga didukung oleh data
JCPDS Mg(NO3)2.6H2O nomor 42-0211 dan Al(NO3)3.9H2O nomor 24-0004
commit to user
2. Penentuan Kemurnian
Penentuan kemurnian dihitung dari data XRD dengan membandingkan intensitas relatif puncak-puncak hidrotalsit Mg-Al-NO3 dengan intensitas relatif
totalnya (Terinte et al., 2011). Nilai persentase kemurnian menunjukkan besarnya
fraksi hidrotalsit Mg-Al-NO3 dalam material hasil sintesis. Hasil perhitungan
variasi pH dan waktu masing-masing disajikan pada Tabel 8 dan Tabel 9. Tabel 8. Tingkat Kemurnian Hidrotalsit Mg-Al-NO3 Variasi pH
pH Kemurnian (%) kemurnian hidrotalsit Mg-Al-NO3 relatif semakin meningkat. Kemurnian yang
meningkat dimungkinkan dikarenakan banyaknya ikatan ion logam magnesium dan alumunium dengan OH- pada lapisan permukaan hidrotalsit sehingga pembentukan hidrotalsit Mg-Al-NO3 dapat maksimal. Namun, terdapat
penyimpangan pada pH 8 yang memiliki kemurnian paling tinggi. Penyimpangan yang terjadi dikarenakan penelitian yang dilakukan hanya satu kali.
Tabel 9. Tingkat Kemurnian Hidrotalsit Mg-Al-NO3 Variasi Waktu
Waktu (jam) Kemurnian (%) hidrotalsit maka kemurnian hidrotalsit Mg-Al-NO3 relatif semakin meningkat.
commit to user
larutan prekursor pada waktu 2,5 jam sehingga peluang tumbukan antar molekul semakin besar dan kemungkinan terbentuk hidrotalsit Mg-Al-NO3 besar. Namun
terdapat penyimpangan pada waktu 2,5 jam yang memiliki kemurnian paling tinggi. Penyimpangan yang terjadi dikarenakan penelitian yang dilakukan hanya satu kali.
3. Penentuan Kristalinitas Relatif
Penentuan kristalinitas relatif didasarkan pada puncak tertinggi (003) dari difraktogram XRD masing-masing kristal hidrotalsit Mg-Al-NO3. Semua puncak
tertinggi dari variasi pH dan waktu dibandingkan dengan intensitasnya. Puncak dengan intensitas tertinggi dianggap memiliki kristalinitas relatif 100% (Xie et al.,
2003). Kristalinitas kristal lain dihitung dengan memnbandingkan intensitasnya dengan intensitas tertinggi. Hasil perhitungan kristalinitas relatif variasi pH dan waktu masing-masing disajikan pada Tabel 10 dan Tabel 11.
Tabel 10. Kristalinitas Relatif hidrotalsit Mg-Al-NO3 Variasi pH
pH d (003) Intensitas (count) Kristalinitas relatif (%)
8 7,92 8036 75,27 9 8,38 8681 81,31 10 8,12 9211 86,28 11 7,84 10676 100
Data pada Tabel 10 menunjukkan semakin tinggi pH maka semakin tinggi kristalinitasnya. Kristalinitas relatif paling tinggi adalah pada pH 11. Semakin tinggi pH menyebabkan semakin banyak OH- sehingga terjadi keseragaman
distribusi pori membentuk susunan teratur yang diakibatkan oleh stabilnya ikatan antara Mg dan Al serta OH- pada lapisan permukaan hidrotalsit Mg-Al-NO
commit to user
Tabel 11. Kristalinitas Relatif Hidrotalsit Mg-Al-NO3 Variasi Waktu
Waktu (jam) d (003) Intensitas (count) Kristalinitas relatif (%)
2 8,33 7835 57,14 2,5 7,77 13712 100 3 8,16 6433 46,92 3,5 7,88 8028 58,55 4 7,88 10941 79,79
Data pada Tabel 11 menunjukkan semakin lama waktu sintesis maka kristalinitas relatif kristal relatif meningkat. Kristalinitas relatif yang semakin meningkat dimungkinkan karena teraturnya susunan atom-atom dalam hidrotalsit Mg-Al-NO3. Namun, terdapat penyimpangan pada waktu 2 jam dan 2,5 jam yang
memiliki kristalinitas relatif yang tinggi. Penyimpangan yang terjadi dikarenakan penelitian yang dilakukan hanya satu kali.
Penyimpangan-penyimpangan hasil yang terjadi baik pada variasi pH maupun variasi waktu dapat disebabkan oleh efek mekanik dari pengadukan (Lakraimi et al., 2000). Penyimpangan yang terjadi mengakibatkan hasil yang
commit to user
36 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan hasil penelitian dan pembahasan maka dapat diambil kesimpulan sebagai berikut:
1. Senyawa hidrotalsit dengan anion interlayer NO3- dapat terbentuk dari
Mg(NO3)2.6H2O dan Al(NO3)3.9H2O
2. Kemurnian tertinggi pada variasi pH yaitu pada pH 8, sedangkan kristalinitas relatif tertinggi yaitu pada pH 11 pada penelitian kali ini
3. Kemurnian dan kristalinitas relatif tertinggi pada variasi waktu yaitu pada waktu 2,5 jam pada penelitian kali ini
B. Saran
Berdasarkan hasil penelitian yang telah dilakukan, maka penulis memberikan saran yaitu perbandingan konsentrasi yang digunakan pada sintesis hidrotalsit Mg-Al-NO3 berbahan dasar murni Mg(NO3)2.6H2O dan
Al(NO3)3.9H2O lebih besar agar semua bahan awal dapat bereaksi secara

![Gambar 6. Difraktogram XRD (a) [Mg-Al-NO3] (b) [Mg-Al-(Benzoat)] (c) [Mg-Al-(SDB)]](https://thumb-ap.123doks.com/thumbv2/123dok/3010074.1712684/27.595.138.479.532.712/gambar-difraktogram-xrd-mg-al-no-benzoat-sdb.webp)
![Gambar 13. Spektra FTIR (a)[Mg-Al-NO3] (b) [Mg-Al-(Benzoat)] (c) [Mg-Al-](https://thumb-ap.123doks.com/thumbv2/123dok/3010074.1712684/32.595.115.514.111.493/gambar-spektra-ftir-mg-al-no-mg-benzoat.webp)