SKRIPSI
KHAIRISSA TRISLIANI ASMARA
120805050
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2017
PERSETUJUAN
Judul : Potensi Bakteri Asam Laktat Dari Jerok, Hasil Fermentasi Durian (Durio zibethinus L) Khas Karo Sebagai Kandidat Probiotik Dan Dalam Menghasilkan Eksopolisakarida
Kategori : Skripsi
Nama : Khairissa Trisliani Asmara Program Studi : Sarjana (S1) Biologi Nomor Induk Mahasiswa : 120805050
Fakultas : Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Disetujui di Medan, Maret 2017
Komisi Pembimbing
Pembimbing 2 Pembimbing 1
Dr. It Jamilah, M. Sc Prof. Dr. Dwi Suryanto, M. Sc NIP: 196310121991032003 NIP: 196404091994031003
Disetujui Oleh
Departemen Biologi FMIPA USU Ketua
Dr.Saleha hanum, M. Sc NIP: 19710831200012201
PERNYATAAN
POTENSI BAKTERI ASAM LAKTAT DARI JEROK, HASIL FERMENTASI DURIAN (Durio Zibethinus L) KHAS KARO SEBAGAI
KANDIDAT PROBIOTIK DAN DALAM MENGHASILKAN EKSOPOLISAKARIDA
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri. Kecuali beberapa kutipan dan ringkasan masing-masing disebutkan sumbernya
Medan, Maret 2017
Khairissa Trisliani Asmara 120805050
PENGHARGAAN
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan rahmat, hidayah serta kekuatan sehingga penulis dapat menyelesaikan skripsi ini dengan judul “ Potensi Bakteri Asam Laktat Dari Jerok, Hasil Fermentasi Durian (Durio zibethinus L) Khas Karo Sebagai Kandidat Probiotik Dan Dalam Menghasilkan Eksopolisakarida”.
Terima kasih kepada Bapak Prof. Dr. Dwi Suryanto M.Sc selaku pembimbing 1 sekaligus dosen Penasehat Akademik (PA) dan Ibu Dr. It Jamilah M.Sc selaku pembimbing 2 yang telah seperti orangtua bagi penulis dan telah banyak memberikan nasehat, bimbingan serta arahan selama pelaksanaan penelitian dan penyusunan skripsi ini. Nasehat-nasehat yang telah bapak dan ibu berikan sangat membantu dan menjadi motivasi penulis untuk terus belajar lebih giat lagi. Terima kasih kepada Bapak Prof. Dr. Erman Munir M. Sc selaku penguji 1 dan Ibu Dr. Isnaini Nurwahyuni M. Sc selaku penguji 2 yang telah banyak memberikan masukan kepada penulis demi penyempurnaan skripsi ini.
Terimakasih kepada Ibu Dr. Saleha hanum, M. Sc. Selaku Ketua Departemen Biologi serta seluruh Bapak/Ibu Dosen Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara yang telah banyak memberikan ilmu dan pengetahuan kepada penulis. Terima kasih juga kepada Buk Ipit dan kak siti selaku laboran yang banyak membantu penulis selama melakukan penelitian di laboratorium dan juga Kak Ros dan Bang Ewin yang telah memberikan kontribusi kepada penulis dalam urusan administrasi.
Semoga segala bantuan yang telah diberikan ini mendapat imbalan di sisi Allah SWT sebagai amal ibadah.
Terimakasih sebesar-besarnya penulis sampaikan kepada kedua orangtua, Ayahanda Ir. Patris Ade Remaja dan Ibunda Nina Zahara, M.AP yang selalu memberikan doa, kasih sayang, perhatian, semangat dan dukungan kepada penulis. Terimakasih juga kepada atok tercinta Alm. Zen Halim dan Alm.
Zamnuldyn juga nenek tercinta Alm. Nazariah dan Rosmiati yang telah memberikan cinta dan kasih sayang yang besar kepada penulis. Terima kasih juga kepada Adik tersayang Khalissa Aulia Arina Asmara yang senantiasa menghibur
dan menjadi penyemangat bagi penulis. Penulis juga berterima kasih kepada seluruh keluarga besar Asmara dan Halim yang menjadi motivasi bagi penulis.
Dalam Kesempatan ini penulis juga menyampaikan ucapan terimakasih kepada sahabat sahabat penulis Zuzu, Ella, Mira, Dona, Nani, Dea yang menjadi tempat berbagi suka dan duka juga Bobi, Ami, Ejak dan Ayak yang selalu memberi tawa bagi penulis. Terimakasih kepada Sahabat penulis sejak kecil Tami, Lija, Arep, Mika, Fahmi, Rani dan Frans yang sampai saat ini terus memberi dukungan kepada penulis. Terkhusus Doni Latuparisa yang telah memberikan support dan semangat kepada penulis. Terimakasih juga Kepada sahabat satu penelitian Maretta yang bersama sama berjuang dalam penelitian ini serta rekan sesama penelitian Agung, Dian, Novita, Ester, Rita, Adit yang paling mengerti susah senang suasana di laboratorium, dan juga adik adik tersayang di lab mikro jo, vina dan ira. Terima kasih kepada abang senior bang frico, bang taufik, koko steven dan kakak senior kak nurhayati, kak dila, kak poppy, kak maya dan kak virza yang telah menjadi contoh yang baik dan juga selalu menasehati penulis . Terimakasih kepada adik asuh tersayang Raysa untuk perhatiannya selama ini.
Terimakasih juga kepada rekan sesama asisten di Laboratorium Mikrobiologi dan Laboratorium Ilmu Dasar yang menciptakan senyum ditengah penatnya penelitian ini. Tak terlupakan terimakasih buat teman-teman stambuk 2012 ‘AOC’, IPKB, HIMABIO, stambuk 2010, 2011, dan 2013 yang namanya tidak dapat disebutkan satu persatu, terima kasih telah menciptakan kenangan indah di masa perkuliahan.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan, oleh karena itu kritik saran yang membangun dari berbagai pihak sangat penulis harapkan demi perbaikan-perbaikan ke depan. Amin Yaa Rabbal ‘Alamiin
Medan Maret 2017 Penulis
POTENSI BAKTERI ASAM LAKTAT DARI JEROK, HASIL FERMENTASI DURIAN (Durio zibethinus L) KHAS KARO SEBAGAI
KANDIDAT PROBIOTIK DAN DALAM MENGHASILKAN EKSOPOLISAKARIDA
ABSTRAK
Jerok merupakan produk olahan durian yang berasal dari daerah Karo, Sumatera Utara. Jerok diolah secara tradisional melalui fermentasi spontan selama 1 minggu dalam tabung bambu dan dikubur dalam tanah. Penelitian ini bertujuan untuk mengetahui potensi bakteri asam laktat yang diisolasi dari jerok sebagai penghasil eksopolisakarida dan sebagai kandidat probiotik. Eksopolisakarida dinilai penting bagi kesehatan karena dapat menempel pada mukosa usus halus, sehingga dapat meningkatkan kemampuan menekan pelekatan bakteri patogen.
Bakteri asam laktat sebagai probiotik harus tahan terhadap kondisi organ dan proses pencernaan, seperti tahan terhadap pH rendah, garam empedu, dan patogen pencernaan. Aktivitas antimikroba dilakukan dengan metode difusi agar. Produksi eksopolisakarida diukur dengan penimbangan berat kering. Isolat yang tahan asam dan garam empedu diuji dengan melihat ketahanan bakteri pada media MRSB+
HCl untuk pH 2 dan penambahan NaOH untuk pH 7,2. Untuk uji ketahanan isolat bakteri asam laktat pada garam empedu ditambahkan Oxgall 0,5% dan jumlah sel yang hidup dihitung dengan metode angka lempeng total. Sembilan belas isolat potensial bakteri asam laktat tumbuh dan membentuk zona bening pada media MRSA+CaCO3 1%. Identifikasi jenis dari isolat dilakukan berdasarkan analisis morfologi, fisiologi dan biokimia. Hasil dari uji antimikroba didapati 5 dari 19 isolat yaitu Sp 4, Sp 6, Sp 8, Sp 14 dan Sp 18 mampu menghambat 3 jenis bakteri patogen Escherichia coli, Salmonella typhii dan Staphylococcus aureus. Isolat- isolat tersebut mampu menghasilkan eksopolisakarida antara 300-2.000 mg/L. Uji potensi probiotik diketahui 5 isolat tersebut memiliki ketahanan untuk tumbuh pada pH 2 dan 7.2 dan 0.5 % oxgall.
Kata kunci : Bakteri asam laktat, Eksopolisakarida, Jerok, Probiotik
POTENTIAL OF LACTIC ACID BACTERIA ISOLATED FROM KARO DURIAN (Durio zibethinus L) FERMENTED FOOD AS A PROBIOTIC
CANDIDATES AND FOR EXOPOLYSACCHARIDE PRODUCTION
ABSTRACT
Jerok is a fermented durian from Karo, North Sumatera. It is processed traditionally by burying durian fruit in a bamboo tube in the ground for one week to get spontaneous fermentation. This study was aimed to know the potential of lactic acid bacteria in jerok as an exopolysaccharide producer and as a probiotic candidates. Exopolysaccharide has potential health-beneficial properties because it attachs to small intestines mucose to increase the potential of lactic acid bacteria to inhibit the growth of pathogenic gastrointestinal bacteria. As a probiotic, lactic acid bacteria should resist to digestive condition and process, such as to low pH, bile salt and gastrointestinal pathogen. Antimicrobial activities were measured using an agar well difussion assay method. The production of exopolysaccharides were measured by dry weight. The acid and bile salt tolerant isolates were obtained using natural selection technique after sequential exposure to MRSB + HCl for pH 2 and addition of NaOH for pH 7,2. For lactic acid bacteria ability test to growth in bile salt, the medium was added with 0,5% oxgall, cell viability was measured as total plate count. Nineteen isolates of potential lactic acid bacteria could growth and established clear zone in MRSA+CaCO3 1%. Identification species of isolates based on morphological, physiological and biochemical analysis. The results of antimicrobial test showed that 5 out of 19 isolates, Sp 4, Sp 6, Sp 8, Sp 14 and Sp 18 were able to inhibit the growth of Escherichia coli, Salmonella typhii and Staphylococcus aureus. The isolates produced exopolysaccharides from 300 to 2.000 mg/L. In vitro probiotic assay showed that 5 isolates could growth at pH 2, pH 7,2 and 0,5% oxgall.
Keywords : Exopolysaccharide, Jerok, Lactic acid bacteria, Probiotic
DAFTAR ISI
Halaman
Persetujuan i
Pernyataan ii
Penghargaan iii
Abstrak v
Abstract vi
Daftar Isi vii
Daftar Tabel ix
Daftar Gambar x
Daftar Lampiran xi
Bab 1. Pendahuluan 1
1.1. Latar Belakang 1
1.2. Permasalahan 3
1.3. Tujuan Penelitian 3
1.4. Manfaat Penelitian 3
Bab 2. Tinjauan Pustaka 4
2.1. Makanan Fermentasi 4
2.2. Bakteri Asam Laktat 5
2.3. BAL sebagai Probiotik 6
2.4. Eksopolisakarida 7
2.5. Faktor yang Mempengaruhi Produksi Eksopolisakarida 9 2.6. Manfaat dan Kegunaan Eksopolisakarida 10
Bab 3. Metode Penelitian 11
3.1. Waktu dan Tempat 11
3.2. Isolasi Bakteri Asam Laktat 11
3.3. Penyimpanan Kultur Sementara 11
3.4. Uji Morfologi dan Biokimia Isolat 11
3.5. Pembuatan Kurva Pertumbuhan 12
3.6. Seleksi BAL penghasil Eksopolisakarida 12 3.7. Kemampuan BAL dalam Menghambat Bakteri Patogen 13 3.8. Ketahanan Probiotik Potensial Terhadap Garam Empedu 13 3.9. Ketahanan Probiotik Potensial Terhadap Asam
3.10.Koagregasi (Pelekatan)
14 14
Bab 4. Hasil dan Pembahasan 15
4.1. Isolasi dan Karakterisasi BAL dari Jerok 15
4.1.1. Morfologi koloni 15
4.1.2. Pengamatan Mikroskopis dan Uji Biokimia 16 4.2. Hasil Antagonis BAL Terhadap Escherichia coli,
Staphylococcus aureus, Salmonella thypii
18
4.3. Kurva Pertumbuhan BAL Potensial 20 4.4. Produksi Eksopolisakarida Kasar 22 4.5. Ketahanan BAL terhadap pH yang Berbeda 24 4.6. Ketahanan BAL terhadap Garam Empedu 26
4.7. Persentase Koagregasi 28
Bab 5. Kesimpulan dan saran 30
5.1. Kesimpulan 30
5.2. Saran 30
Daftar Pustaka 31
DAFTAR TABEL
Nomor
Tabel Judul Halaman
1 Karakterisasi Koloni Isolat dari Jerok 15
2 Pewarnaan Gram dan uji biokimia isolat yang berasal
dari Jerok 17
3 Diameter penghambatan BAL Terhadap E. coli, S. aureus dan S. thypii
19
DAFTAR GAMBAR
Nomor
Gambar Judul Halaman
1 Isolat BAL pada media MRSA + CaCO3 1%, (a) zona bening, (b) koloni bakteri asam laktat
15 2 (a) Sp 18 menghambat E. coli, (b) Sp 4 menghambat
S. aureus, (c) Sp 14 menghambat S. thypii
19 3 Kurva pertumbuhan lima isolat BAL pada media
MRSB
21 4 Produksi kasar eksopolisakarida dari isolat BAL asal
jerok
22 5 Ketahanan BAL terhadap kondisi pH saluran
pencernaan
25 6 Ketahanan BAL terhadap oxgall (garam empedu) 0,5%
pada media MRSB
27
7 Persentase koagregasi isolat BAL 28
DAFTAR LAMPIRAN
Nomor
Lampiran Judul Halaman
1 Alur Penelitian 37
2 Isolasi BAL dari Jerok 38
3 Kurva Pertumbuhan lima Isolat BAL 39
4 Produksi Eksopolisakarida Kasar 40
5 Uji Antagonis BAL dengan Patogen Pencernaan 41 6 Ketahanan BAL Terhadap Garam Empedu 0,5% 42
7 Ketahanan BAL Terhadap pH 2 dan pH 7,2 43
8 Persentase Koagregasi 44
BAB 1 PENDAHULUAN
1.1.Latar Belakang
Indonesia memiliki banyak jenis makanan fermentasi, salah satu diantaranya adalah durian fermentasi yang umumnya dibuat dengan memanfaatkan kelebihan durian atau durian yang berkualitas kurang baik untuk dikonsumsi segar.
Pengolahan durian yang dilakukan secara fermentasi tersebut menghasilkan produk yang dikenal dengan nama asam durian. Durian fermentasi banyak digunakan sebagai bumbu masakan (Yuliana, 2007).
Makanan fermentasi tradisional Indonesia misalnya dadih, tempoyak, tempe, dan sebagainya berpotensi sebagai sumber probiotik seperti Bakteri Asam Laktat (BAL), diantaranya termasuk genus Lactobacillus, Pediococcus, Enterococcus, dan Leuconostoc. Probiotik merupakan mikroorganisme hidup yang dikonsumsi manusia dan memberikan efek baik pada tubuh, seperti sebagai antimikroba terhadap patogen pada saluran pencernaan. Salah satu sifat probiotik adalah dapat menghasilkan eksopolisakarida yang merupakan produk metabolit sekunder yang dihasilkan bakteri (Nuraida, 2015).
Eksopolisakarida (EPS) dinilai penting bagi kesehatan. Bakteri penghasil EPS dapat menempel pada mukosa usus halus, sehingga dapat meningkatkan kemampuan menekan pertumbuhan bakteri patogen pada saluran pencernaan.
Beberapa bakteri patogen menyebabkan penyakit pada saluran pencernaan, seperti paratitis, gastritis, diare, apendisitis, dan demam tifoid. Eksopolisakarida juga berperan pada kesehatan manusia karena memiliki aktivitas anti tumor, anti ulcer, anti inflamasi, anti infeksi dan meningkatkan sistem imun tubuh (imunostimulator). Eksopolisakarida juga dapat mendegradasi kolesterol menjadi cosprostanol yaitu zat yang tidak dapat diserap oleh usus halus dan kemudian dikeluarkan bersama feses, sehingga terjadi penurunan kolesterol dalam darah.
Disamping itu, eksopolisakarida yang dihasilkan mikroba juga digunakan dalam industri karena sifat fisikokimianya yang mirip dengan polisakarida yang dihasilkan tanaman (selulosa, pektin, pati) dan rumput laut (alginat dan
karagenan). Dalam industri makanan, kosmetik dan obat-obatan EPS yang diproduksi oleh probiotik jenis BAL digunakan sebagai pengental, stabilisator, pengemulsi, atau agen pembentuk gel untuk memodifikasi sifat dan tekstur produk. Kepentingan industri makanan dalam mengembangkan multifungsi bahan tambahan menyebabkan luasnya pencarian polisakarida dengan sifat tambahan sebagai probiotik (Korakli et al., 2003; Madiedo et al., 2005).
Bakteri asam laktat umumnya merupakan kelompok mikroorganisme Generally Recognized As Safe (GRAS). Kultur strain BAL menghasilkan EPS yang dapat diaplikasikan pada makanan, jika BAL dapat ditumbuhkan pada media kultur yang dapat dimakan dan aman seperti whey. Untuk mendapatkan hasil yang maksimal kondisi fermentasi harus dioptimalkan (Harutoshi, 2013).
Telah banyak penelitian yang dilakukan tentang kemampuan BAL dalam menghasilkan EPS, tetapi masih difokuskan pada produk fermentasi berbasis susu, seperti pada penelitian (Sujaya et al., 2012) yang mengisolasi BAL potensi menghasilkan EPS dari susu kuda Sumbawa, tetapi belum banyak data potensi BAL yang diisolasi dari hasil fermentasi berbasis buah-buahan, biji-bijian dan sayuran untuk memproduksi EPS.
Salah satu sumber BAL berasal dari makanan fermentasi khas Karo yang berasal dari durian yang disebut dengan istilah Jerok. Bakteri asam laktat yang diisolasi dapat memproduksi EPS. Jumlah EPS yang diproduksi oleh BAL masih tergolong rendah sehingga penggunaannya sebagai bahan tambahan pada makanan masih terbatas. Tapi eksplorasi strain dan optimalisasi kondisi fermentasi, bersama-sama dengan biologi molekuler dan rekayasa metabolik EPS, memungkinkan untuk meningkatkan produksi EPS atau memodifikasi biopolimer baru. Penelitian berkenaan dengan EPS penting untuk meningkatkan produksi biopolimer dengan fungsi yang diinginkan (Madiedo et al., 2002).
1.2. Permasalahan
Tingkat infeksi saluran pencernaan di Indonesia tergolong tinggi.
Konsumsi pangan fungsional seperti BAL yang menghasilkan EPS merupakan salah satu alternatif. Perlu dilakukan eksplorasi EPS yang dihasilkan oleh BAL yang diisolasi dari makanan fermentasi durian yang berasal dari Indonesia, sehingga dari hasil penelitian dapat diketahui manfaat konsumsi makanan fermentasi dan hasil penelitian dapat menjadi acuan untuk pengaplikasian BAL yang menghasilkan EPS.
1.2. Tujuan Penelitian
Tujuan dari penelitian ini ialah untuk:
a. Memperoleh isolat yang berpotensi sebagai probiotik
b. Memperoleh isolat yang berpotensi menghasilkan EPS kasar
1.3. Manfaat Penelitian
Manfaat penelitian ini ialah :
a. Dapat memberikan informasi tentang potensi BAL pada durian fermentasi yang dapat menghasilkan EPS
b. Data hasil produksi EPS dapat dijadikan referensi untuk dimanfaatkan pada industri pangan, kosmetik, maupun obat-obatan.
c. Hasil penelitian dapat menstimulasi masyarakat untuk rutin mengkonsumsi makanan fermentasi seperti jerok
BAB 2
TINJAUAN PUSTAKA
2.1. Makanan Fermentasi
Tuntutan konsumen untuk produk yang bernutrisi, higienis dan sehat telah membuat pengolahan dan kemasan teknologi jauh lebih inovatif dan efektif.
Kecenderungan dalam pengawetan makanan telah bergeser ke arah penggunaan karbon dioksida dan nitrogen sebagai pengawet produk makanan yang lebih murah, sehat dan segar. Saat ini, produksi makanan dan minuman fermentasi melalui fermentasi spontan merupakan metode murah dan handal yang digunakan di negara-negara berkembang, sedangkan di negara barat produksi skala besar makanan fermentasi telah menjadi cabang penting dari industri makanan. Selain itu, konsumen Barat lebih menghargai dan memperhatikan produk fermentasi tradisional untuk kesehatan saluran pencernaan dan untuk dikonsumsi sehari-hari (Leroy, 2004; Shah, 2014).
Produksi makanan fermentasi didasarkan pada penggunaan kultur starter.
Bakteri asam laktat (BAL) beberapa tahun belakangan ini dikembangkan dalam skala industri dan diharapkan dapat memberi manfaat dari segi gizi dan kesehatan.
BAL menghasilkan zat antimikroba, polimer gula, pemanis alami, senyawa aromatik, vitamin atau enzim yang memiliki sifat probiotik. Hasil dari produk fermentasi seperti tekstur dan aroma tergantung pada bahan baku dan jenis mikroba yang digunakan. Awal produksi makanan fermentasi didasarkan pada fermentasi spontan karena pengembangan mikroflora alami ada dalam bahan baku (Leroy, 2004).
Bakteri asam laktat memfermentasi gula melalui jalur yang berbeda sehingga menghasilkan homofermentasi dan heterofermentasi. Homofermentasi adalah fermentasi yang hanya menghasilkan asam laktat sebagai produk akhir, metabolisme glukosa dalam proses ini menggunakan jalur Embden-Meyerhoff- Parnas. Sedangkan pada Heterofermentasi dihasilkan asam laktat, karbondioksida dan etanol dalam jumlah molar yang seimbang melalui fosfoketolase (Hofvendahl & Hagerdal, 2000).
Makanan fermentasi sangat penting karena mereka menyediakan dan melestarikan sejumlah besar konstituen gizi dalam keanekaragaman aroma, rasa dan tekstur, yang memperkaya diet manusia. Makanan fermentasi tradisional Indonesia seperti dadih (susu kerbau fermentasi), tempoyak (durian fermentasi), bekasam (daging fermentasi) dan tape ketan (fermentasi beras gluten) telah dikonsumsi selama berabad abad, tetapi masih sedikit penelitian tentang keanekaragaan dan potensi BAL dari makanan fermentasi tradisional Indonesia (Mustopa, 2014; Shah, 2014).
2.2. Bakteri Asam Laktat
Bakteri asam laktat adalah sekelompok bakteri Gram-positif, tidak membentuk spora, berbentuk batang atau kokus. Mereka dapat memfermentasi karbohidrat untuk menghasilkan asam laktat (homofermentasi) atau campuran asam laktat, karbon dioksida dan asam asetat dan atau etanol (heterofermentasi). Senyawa lain, seperti diasetil, asetaldehida dan hidrogen peroksida, juga diproduksi. Senyawa ini berkontribusi pada rasa dan tekstur makanan fermentasi dan juga dapat berkontribusi terhadap penghambatan mikroba yang tidak diinginkan. Bakteri asam laktat seperti banyak bakteri lainnya, mampu memproduksi beberapa jenis polisakarida yang diklasifikasikan berdasarkan lokasinya pada sel. Yang disekresikan ke luar dinding sel disebut polisakarida eksoseluler atau eksopolisakarida yang dapat membentuk lapisan kohesif patuh dan disebut kapsul polisakarida (Nuraida, 2015; Torino et al., 2015).
Bakteri asam laktat adalah kelompok jenis bakteri Gram positif, berbentuk kokus (bulat) atau basil (batang), tidak membentuk spora, suhu pertumbuhan optimum ± 37 -45 oC, pada umumnya tidak motil, katalase negatif dan oksidase positif, proses fermentasi menghasilkan asam laktat. Bakteri asam laktat mampu tumbuh pada kadar gula, alkohol, dan kadar garam yang tinggi, mampu memfermentasikan monosakarida dan disakarida. Sebagian besar BAL dapat tumbuh dengan baik pada lingkungan yang memiliki atau tidak memiliki O2 (tidak sensitif terhadap O2), sehingga termasuk anaerob aerotoleran. Bakteri yang tergolong dalam BAL memiliki beberapa karakteristik tertentu yang meliputi:
tidak memiliki porfirin dan sitokrom, tidak melakukan fosforilasi transpor
elektron, dan hanya mendapatkan energi dari fosforilasi substrat. Beberapa jenis bakteri yang tergolong BAL adalah seperti pada penelitian Pato (2003) diisolasi dari dadih didapatkan jenis L. brevis, L. casei subsp. casei, L. casei subsp.
rhamnosus, S. faecalis subsp. liquefaciens, L. lactis subsp. lactis, L. lactis subsp.
cremoris, L. casei subsp. diacetylactis. Putri et al (2012) melaporkan penelitian yaitu isolasi L. rhamnosus dan L. plantarum dari ubi fermentasi.
2.3. Bakteri Asam Laktat Sebagai Probiotik
Probiotik adalah mikroorganisme yang mirip dengan simbiosis mikroorganisme yang ditemukan pada usus manusia, sedangkan prebiotik merupakan bahan makanan yang tidak dicerna tetapi bertujuan meningkatkan pertumbuhan dan aktivitas metabolik. Dalam kedua kasus, organisme target biasanya Bifidobacterium dan BAL. Probiotik juga disebut “bakteri ramah” atau “bakteri baik” yang bila diberikan dalam jumlah cukup akan memberi manfaat kesehatan pada inang serta menunjukkan efek menguntungkan pada kesehatan dengan meningkatkan keseimbangan mikroba usus. Probiotik bertujuan untuk menargetkan bakteri eksogen ke dalam mikroflora kolon. Bakteri probiotik dapat menghasilkan berbagai senyawa yang menghambat pertumbuhan bakteri patogen, yang meliputi asam organik (laktat dan asam asetat), bakteriosin, dan reuterin.
Probiotik tersedia untuk konsumen terutama dalam bentuk suplemen makanan dan makanan yang dapat digunakan sebagai pelengkap dan pengobatan alternatif.
Eksplorasi teknologi dan probiotik sangat penting untuk pengaplikasian strain baru dalam formulasi makanan fungsional (Depeint et al., 2008; Salazar et al., 2009; Prema, 2013; Pundir, 2013).
Kelangsungan hidup bakteri probiotik dipengaruhi oleh penghambatan zat seperti asam laktat yang dihasilkan selama produksi dan penyimpanan pada suhu dingin. Selama produksi yogurt, bakteri yogurt dan bakteri probiotik menghasilkan asam organik. Produk sebaiknya memiliki pH 4,5 atau lebih rendah untuk memenuhi persyaratan dan untuk menghasilkan kualitas yogurt yang baik.
Kualitas yogurt yang dihasilkan juga tergantung pada sejauh mana pertumbuhan Bifidobacterium dan konsentrasi asam asetat yang bisa bervariasi dalam produk (Korakli et al., 2003).
Peningkatan jumlah Bifidobacterium dan Lactobacillus dalam usus besar telah terbukti menimbulkan efek menguntungkan karena memperbaiki keseimbangan koloni mikroflora. Pada penelitian-penelitian terdahulu menunjukkan bahwa Eksopolisakarida (EPS) yang diproduksi oleh strain probiotik dapat mempengaruhi mukosa usus, tergantung dosis dan jenis yang digunakan. Sifat ketahanan permukaan bakteri juga bertanggung jawab terhadap adhesi strain probiotik pada mukosa usus. Sifat fisikokimia dan karakteristik struktural biopolimer berbeda yang dihasilkan beberapa jenis bakteri memberikan reaksi adhesi probiotik yang berbeda pada mukosa usus. Strain Lactobacillus dan Bifidobacterium menghasilkan protein yang dibutuhkan untuk produksi glikoprotein pengikat fimbria dan mukus dan protein fibronektin yang bisa terlibat dalam adhesi bakteri ke saluran gastrointestinal. Untuk berfungsi secara efektif, probiotik harus tahan terhadap proses pencernaan di perut dan usus kecil, sehingga dapat melakukan kontak dengan bakteri yang tumbuh di usus besar (Madiedo et al., 2006; Harutoshi, 2013).
3.4. Eksopolisakarida
Polisakarida adalah karbohidrat relatif kompleks yang terdiri dari beberapa monosakarida bergabung bersama dan sering bercabang. Polisakarida yang berasal dari tanaman dan rumput laut telah digunakan selama ribuan tahun.
Belakangan ini ditemukan polisakarida yang dihasilkan bakteri. Sel bakteri dapat mensintesis sejumlah polisakarida yang didefinisikan berdasarkan lokasi mereka terhadap sel. Beberapa terletak di sitosol dan digunakan sebagai karbon atau sumber energi, dan lainnya adalah konstituen dinding sel seperti peptidoglikan dan asam teikoik. Terdapat juga yang terletak di luar dinding sel yang memiliki dua bentuk dasar, yang pertama membentuk sebuah kapsul disekitar sel sebagai polisakarida kapsuler, atau menempel pada membran sel sebagai antigen dari lipopolisakarida dan yang kedua adalah dapat disekresikan ke lingkungan sebagai EPS (Kranenburg et al., 1999; Sharmila et al., 2014).
Eksopolisakarida adalah polimer yang terdiri dari rantai panjang residu gula dan disekresikan oleh mikroorganisme ke lingkungan sekitarnya.
Eksopolisakarida yang dihasilkan bakteri sebagai campuran kompleks dari
makromolekul polielektrolit termasuk polisakarida, protein dan asam nukleat, masing-masing terdiri dari massa molekul variabel dan sifat yang struktural Dalam beberapa kasus baik polisakarida kapsuler maupun yang tidak, diproduksi oleh mikroba yang sama. Tergantung hubungan strukturalnya pada sel bakteri, terdapat beberapa bentuk yaitu lendir, kapsuler atau kapsuler mikropolisakarida.
Nama Eksopolisakarida (EPS) seperti yang diusulkan oleh Sutherland memberikan istilah umum untuk semua bentuk-bentuk polisakarida bakteri yang ditemukan luar dinding sel (Cerning, 1990; Vijayabaskar et al., 2011).
Beberapa jenis BAL dapat mensintesis eksopolisakarida. Kemampuan untuk menghasilkan EPS oleh BAL telah dikenal luas, meskipun peran fisiologis molekul ini belum diketahui dengan jelas. Salah satu jenis EPS yang dihasilkan oleh BAL berwujud kental dan dapat dideteksi pada kultur dengan membentuk untaian panjang ketika ditarik dengan ose. Eksplorasi keanekaragaman hayati strain BAL liar dari alam saat ini merupakan pendekatan yang paling sesuai untuk mencari fenotif EPS yang diinginkan. Skrining strain, isolasi dan karakterisasi eksopolisakarida menyebabkan eksopolisakarida dapat diaplikasikan beberapa tahun belakangan ini dengan berbagai teknik dan metode (Vuyst et al., 1999;
Madiedo et al., 2005).
Eksopolisakarida ditemukan dalam variasi yang luas pada struktur yang kompleks. Eksopolisakarida sering ditemukan sebagai struktur paling luar dari sel mikroba prokariotik dan eukariotik yang berhubungan dengan sel dalam bentuk diskrit kapsul atau diekskresikan sebagai lendir terikat ke sel atau permukaan.
Eksopolisakarida sebagai bentuk yang unik dengan struktur kimia yang kompleks dan diyakini memberikan perlindungan diri terhadap zat antimikroba.
Eksopolisakarida disintesis dalam fase pertumbuhan yang berbeda dan di bawah berbagai kondisi tergantung pada organisme uji. Dua mekanisme sintesis yang dikenal untuk eksopolisakarida yaitu, Homoeksopolisakarida dan Heteroeksopolisakarida (Vijayabaskar et al., 2011).
Homoeksopolisakarida seperti dekstran dan levans diproduksi oleh Leuconostoc dan Streptococcus yang disintesis oleh proses ekstraseluler melibatkan enzim yang disekresikan dari bakteri atau terkait dengan permukaan sel. Homoeksopolisakarida disintesis di luar sel dengan enzim Glikosiltransferase
(GTF) spesifik atau Fruktosiltransferase (FTF) biasanya bernama glukansukrase atau fruktansukrase. Homoeksopolisakarida yang dihasilkan bakteri asam laktat juga menggunakan enzim GTF ekstraseluler untuk mensintesis α-glukan dari sukrosa. Proses ini menggunakan sukrosa sebagai substrat spesifik, dan energi yang dibutuhkan untuk proses hidrolisis berasal dari sukrosa. Tidak ada energi untuk produksi EPS selain untuk biosintesis enzim karena sintesis EPS oleh GTF atau FTF tidak melibatkan proses transpor aktif atau penggunaan aktivasi prekursor karbohidrat (Cerning et al., 1995; Vijayabaskar et al., 2011; Harutoshi, 2013).
Heteroeksopolisakarida disintesis oleh sistem yang lebih kompleks dan diproduksi di sitoplasma dan memanfaatkan prekursor yang terbentuk intraseluler.
Heteroeksopolisakarida tidak disintesis oleh enzim ekstraseluler, tetapi disintesis oleh urutan intraksi kompleks yang melibatkan enzim intraseluler.
Eksopolisakarida dibuat oleh polimerisasi dari unit berulang, dan unit berulang ini dibangun oleh serangkaian penambahan nukleotida gula di sitoplasma membran (Cerning et al., 1995; Vijayabaskar et al., 2011; Harutoshi, 2013).
2.5. Faktor-Faktor Yang Mempengaruhi Produksi Eksopolisakarida
Kondisi fermentasi menggunakan media terdefinisi telah ditingkatkan untuk memaksimalkan hasil. Namun, media yang mengandung sumber karbohidrat, garam mineral, asam amino, vitamin, dan basa asam nukleat lebih cocok untuk menyelidiki pengaruh nutrisi yang berbeda pada pertumbuhan bakteri asam laktat dan biosintesis eksopolisakarida. Hasil total dari EPS yang dihasilkan oleh BAL tergantung pada komposisi medium (karbon dan nitrogen) dan kondisi pertumbuhan, yaitu, suhu, pH, dan waktu inkubasi. Suhu maksimal untuk produksi EPS didasarkan pada keseimbangan densitas sel dan produksi EPS per sel. Kondisi kultur dan sumber karbon mempengaruhi tingkat pertumbuhan, hasil dan komposisi eksopolisakarida. Tingkat produksi eksopolisakarida dapat dioptimalkan dengan kondisi kultur (Sanchez et al., 2006; Harutoshi, 2013).
Glukosa, galaktosa, fruktosa, laktosa, sukrosa, dan pati digunakan untuk mengetahui pengaruh sumber karbon pada produksi EPS. Hasil tertinggi diamati ketika sukrosa disediakan sebagai sumber karbon. Pada penelitian lain glukosa
dilaporkan menghasilkan EPS dengan nilai tertinggi menggunakan strain L. casei dan S. pancimobilis. Sumber gula yang dibutuhkan berbeda sesuai dengan substrat dan jenis mikroorganisme uji yang digunakan. Nukleotida gula, berasal dari gula- 1- fosfat, memainkan peran penting dalam biosintesis heteroeksopolisakarida sebagai pengaktivasi gula, yang diperlukan untuk polimerisasi monosakarida, serta interkonversi gula (epimerisasi, dekarboksilasi, dehidrogenasi, dan sebagainya) bersamaan dengan aktivasi gula dan modifikasi enzim kation, mereka memainkan peran penting dalam pembentukan EPS (Vuyst et al., 1999; Ko et al., 2000).
2.6. Manfaat dan Kegunaan Eksopolisakarida
Eksopolisakarida dalam lingkungan aslinya diduga berperan dalam melindungi sel mikroba dari serangan masalah kekeringan, fagositosis, antibiotik, senyawa (misalnya ion logam beracun beracun, sulfur dioksida, etanol), predasi oleh protozoa, stres osmotik, adhesi permukaan padat dan pembentukan biofilm.
Eksopolisakarida yang berasal dari mikroba merupakan pengental alami yang dapat ditambahkan ke berbagai produk makanan. Beberapa EPS disintesis oleh BAL dengan komposisi, ukuran dan struktur yang berbeda (Vuyst, 1998).
Keseimbangan mikroflora berpengaruh terhadap kesehatan gastrointestinal inang seperti masalah pencernaan dan penyerapan nutrisi. Banyak faktor yang dapat mengganggu keseimbangan ini, termasuk stres, konsumsi antibiotik, infeksi, keracunan makanan, dan proses penuaan alami. Untuk memperbaiki permasalahan ini keseimbangan, pertumbuhan dan aktivitas bakteri menguntungkan dapat ditingkatkan dengan penambahan spesifik dalam makanan. Pada penelitian terdahulu EPS yang diproduksi oleh tiga strain probiotik dimurnikan dan diamati hubungan keberadaannya dengan kondisi mukosa usus. (Madiedo et al., 2006;
Harutoshi, 2013). Pertumbuhan pasar makanan fungsional meningkatkan minat potensi efek menguntungkan dari EPS pada kesehatan manusia, meskipun penelitian dalam pengertian ini adalah sebatas percobaan laboratorium. Tetapi perlu diketahui informasi terbaru berhubungan teknologi dan fisiologi untuk memproduksi EPS dari BAL untuk diaplikasikan dalam bidang pangan dan kesehatan (Madiedo et al., 2002).
BAB 3
METODE PENELITIAN
3.1. Waktu dan Tempat
Penelitian ini dilakukan pada bulan Juni sampai November 2016, di Laboratorium Mikrobiologi Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara.
3.2. Isolasi Bakteri Asam Laktat
Jerok ditimbang sebanyak 25 gram dan dimasukkan ke dalam erlenmeyer dan ditambahkan akuades sampai 225 mL. Pengenceran dilakukan pada sampel, dari masing-masing pengenceran diambil sebanyak 1 mL dengan menggunakan mikropipet dan diinokulasikan ke dalam cawan petri steril. Media deMann Rogosa Sharpe Agar (MRSA) yang dijaga suhunya (45-50 °C) dituang ke dalam cawan petri yang telah berisi inokulat dan dihomogenkan lalu diinkubasi pada suhu 35 °C selama 72 jam. Koloni yang diduga Bakteri Asam Laktat (BAL) dibuat biakan murninya.
3.3. Penyimpanan Kultur Sementara
Isolat BAL yang telah murni kemudian diremajakan dan dikulturkan. 1 ose isolat diinokulasikan ke dalam 5 mL MRSB dan diinkubasi pada suhu 35 °C selama 72 jam. 1 mL kultur dari MRSB ditambahkan gliserol 30% sebanyak 1 mL dan diinkubasi pada suhu < -20 °C. Kultur juga dibuat pada media MRSA miring dan diremajakan setiap 1 bulan sekali.
3.4. Pengamatan Morfologi dan Biokimia Isolat
Untuk dapat mengkarakterisasi bakteri dilakukan uji morfologi dan biokimia terhadap isolat bakteri. Uji sifat morfologi meliputi pewarnaan Gram dan pengamatan bentuk sel dengan mikroskop. Uji biokimia meliputi uji katalase, uji kemampuan menghasilkan gas, uji kemampuan memfermentasi karbohidrat, uji hidrogen sulfida, uji motilitas dan uji sitrat.
3.5. Kurva Pertumbuhan
Kurva pertumbuhan dibuat untuk melihat waktu optimal produksi Eksopolisakarida (EPS). Pembuatan kurva dilakukan dengan metode Cappucino
& Sherman (1987) yang telah dimodifikasi. Kurva pertumbuhan dibuat dengan melihat nilai Optical Density (OD) dengan spektrofotometer untuk menaksir berat biomassa dalam suspensi. Media yang digunakan adalah MRSB. Sebelumnya perlu dilakukan aktivasi terhadap isolat bakteri. Pertama, sebanyak 1 ose kultur kerja diinokulasi ke dalam 10 mL MRSB, diinkubasi selama 24 jam pada suhu 37 ºC. Kedua, sebanyak 1 mL kultur aktivasi pertama diinokulasikan ke dalam 9 mL MRSB dan diinkubasi selama 24 jam pada suhu 37 ºC. Ketiga sebanyak 1 mL kultur aktivasi kedua diinokulasikan ke dalam 9 mL MRSB dan diinkubasi selama 24 jam pada suhu 37 ºC.
Dari aktivasi ketiga kemudian masing masing isolat diukur OD nya, lalu diencerkan hingga mencapai nilai absorbansi setara 0,5 pada panjang gelombang 600 nm. Setelah masing-masing isolat memiliki nilai OD yang sama yaitu 0,5 lalu diambil sebanyak 1 mL dan diinokulasikan ke dalam 100 mL MRSB yang telah dimodifikasi dengan penambahan (3,5 g yeast extract, 3,5 g peptone, 10 g glukosa dalam 1 L media) dan diinkubasi pada suhu 37 ºC. Kurva pertumbuhan dibuat dengan mengukur nilai OD menggunakan spektrofotometer pada panjang gelombang 600 nm setiap 2 jam selama 48 jam. Hasil yang diperoleh dikonversi menjadi kurva pertumbuhan yang dapat dijadikan acuan untuk memproduksi EPS.
3.6. Seleksi Bakteri Penghasil Eksopolisakarida
Seleksi bakteri potensial penghasil EPS dilakukan melalui penetapan bobot kering EPS yang dihasilkan oleh bakteri di dalam media MRSB yang telah dimodifikasi dengan penambahan (3,5 g yeast extract, 3,5 g peptone, 10 g glukosa dalam 1 L media) seperti dalam Van den Berg et al., (1993) dimasukkan ke dalam tabung sebanyak 20 mL dan ditambahkan 4 ose inokulum, diinkubasi selama 3 hari pada suhu 35 °C. Sebanyak 20 mL kultur bakteri disentrifugasi dengan kecepatan 7000 rpm pada 4 °C selama 20 menit. Sebanyak 10 mL supernatan ditambah dengan 20 mL etanol dan dibiarkan semalam pada suhu 4 °C sebelum disentrifugasi 7000 rpm pada 4 °C selama 20 menit. Supernatan dibuang dan EPS di dasar tabung
dikeringkan pada suhu 60 °C hingga mencapai bobot konstan. Berat EPS kasar adalah berat tabung sentrifus dengan EPS dikurangi berat tabung sentrifus tanpa EPS (Hindersah, 2010).
3.7. Kemampuan Probiotik Dalam Menghambat Bakteri Patogen
Metode yang digunakan adalah metode spot agar (Abrams et al., 2011). Bakteri indikator yang digunakan adalah Staphylococcus aureus, Escherichia coli dan Salmonella thypii. Sebelumnya isolat BAL diremajakan di dalam media MRSB sedangkan bakteri patogen diremajakan didalam media NB. Setelah berumur 24 jam kemudian isolat BAL dan bakteri patogen diukur nilai OD nya pada panjang gelombang 600 nm hingga setara 0,5. Cawan petri yang telah berisi media MHA diinokulasikan dengan bakteri patogen menggunakan cutton bud steril. Kertas cakram dimasukkan ke dalam media MRSB yang telah berisi inokulum BAL dan diinkubasi selama 90 menit setelah itu kertas cakram diletakkan diatas media MHA yang telah berisi inokulum bakteri patogen dan diinkubasi selama 24 jam pada suhu 35 °C. Isolat yang memiliki kemampuan untuk menghambat bakteri patogen akan memberikan zona jernih disekitar cakram. Diameter zona jernih diukur dengan menggunakan jangka sorong dan dihitung indeks penghambatannya.
3.8. Ketahanan Probiotik Potensial Terhadap Garam Empedu
Pengujian ketahanan bakteri terhadap garam empedu dilakukan menggunakan metode Vinderola & Reinheimer (2003) yang telah dimodifikasi. Isolat diinokulasikan ke dalam MRSB dan diinkubasi selama 24 jam pada suhu 37 °C.
Nilai OD diukur hingga mencapai 0,5 abs. Masing-masing sebanyak 1 mL kultur diinokulasikan pada media MRSB kontrol dan MRSB + 0,5% oxgall. Kemudian diinkubasi selama 0 dan 4 jam. Dari masing-masing jam dilakukan pengenceran dan dengan metode cawan tuang kemudian dari masing-masing perlakuan diambil sebanyak 1 mL dan dimasukkan ke dalam cawan petri steril dan media MRSA dituang lalu diinkubasi selama 48 jam pada suhu 35 °C dan diamati koloni yang terbentuk. Ketahanan terhadap garam empedu dihitung dengan selisih unit log
jumlah koloni yang tumbuh pada jam ke 0 dengan jam ke 4. Persentase ketahanan pada garam empedu dihitung.
3.9. Ketahanan Probiotik Potensial Terhadap Asam
Kultur isolat bakteri di biakkan dalam MRSB dan diinkubasi selama 24 jam. Nilai OD diukur hingga mencapai 0,5 abs. Kultur isolat masing-masing sebanyak 1 mL diinokulasikan pada media MRSB kontrol dan MRSB yang telah diatur pH 2 dan pH 7,2. Perlakuan dibiarkan selama 120 menit, lalu pengenceran dilakukan.
Dengan metode cawan tuang dari masing-masing perlakuan diambil sebanyak 1 mL dan dimasukkan ke dalam cawan petri steril dan media MRSA dituang lalu diinkubasi selama 2x24 jam pada suhu 35 °C dan diamati koloni yang terbentuk.
Ketahanan terhadap asam dihitung dengan selisih unit log jumlah koloni yang tumbuh pada kontrol dan dengan perlakuan pengaturan pH. Persentase ketahanan isolat pada pH 2 dan 7,2 dihitung (Chou & weimer, 1999).
3.10. Koagregasi (Pelekatan)
Uji koagregasi dilakukan dengan menentukan besarnya kemampuan interaksi antar kultur bakteri untuk saling menempel dalam saluran pencernaan, sehingga tidak mudah tercuci keluar akibat pergerakan usus. Pada metode ini digunakan kultur tunggal dan campuran dengan perbandingan 1:1 dan koagregasi dinyatakan dalam penurunan OD relatif antara bakteri yang dicampur dengan yang tidak (tunggal). Pengujian dilakukan dengan menggunakan spektrofotometer. Kultur bakteri yang telah ditumbuhkan pada MRSB pada suhu 37 °C selama 24 jam, dipanen dengan cara mensentrifus pada 10.000 rpm selama 10 menit. Kemudian dicuci 2 kali dengan PBS steril yang mengandung NaCl 8 g/L, KH2PO4 0.34 g/L dan 1.21 g/L K2HPO4. Kultur kemudian disuspensikan kembali pada buffer yang sama, dan dimasukan ke dalam kuvet dan dilihat OD. Persentase koagregasi dihitung dengan rumus:
Koagregasi (%)
Keterangan : Ax = nilai absorbansi bakteri x
Ay = nilai absorbansi bakteri y
A(x+y) = nilai absorbansi kultur campuran (bakteri x dan y)
BAB 4
HASIL DAN PEMBAHASAN
4.1. Isolasi dan Karakterisasi Bakteri Asam Laktat dari Jerok
Karakterisasi isolat Bakteri asam laktat terpilih meliputi morfologi koloni yang terdiri dari bentuk koloni, tepi koloni, elevasi koloni dan warna koloni, dan morfologi sel yang terdiri dari bentuk sel dan pewarnaan gram dan pengamatan sifat fisiologis seperti hidrolisa pati, hidrogen sulfida, sitrat, motilitas dan katalase.
Karakterisasi ini dilakukan untuk membedakan isolat yang didapati pada kultur campuran untuk dapat dibuat biakan murninya.
4.1.1. Morfologi Koloni
Hasil isolasi Bakteri Asam Laktat (BAL) dari jerok didapatkan 19 isolat dengan morfologi koloni yang berbeda yang dapat tumbuh di media MRSA + CaCO3 1%
dan membentuk zona bening disekitar koloni (Gambar 1)
Gambar 1: Isolat BAL pada media MRSA + CaCO3 1% (A) zona bening (B) koloni bakteri asam laktat
Pada penelitian ini setiap isolat yang berbeda dikarakterisasi, meliputi bentuk, tepi, elevasi dan warna koloni. Sembilan belas isolat yang diperoleh menunjukkan ciri koloni yang beragam. Hasil yang diperoleh disajikan pada Tabel 1.
Tabel 1. Karakterisasi koloni isolat dari jerok
Isolat Bentuk koloni Tepi koloni Elevasi Koloni Warna
Sp 1 Bulat Rata Cembung Putih
Sp 2 Bulat Rata Cembung Kuning
Sp 3 Bikonveks Rata Ketinggian nyata terlihat Putih A
B
Sp 5 Bulat Rata Rata Kuning
Sp 6 Bulat Bergelombang Cembung Putih
Sp 7 Bulat Keriting Rata Putih
Sp 8 Bulat Rata Ketinggian nyata terlihat Kuning
Sp 9 Bulat Rata Rata Putih
Sp 10 Tidak beraturan Berlekuk Rata Kuning
Sp 11 Bulat Rata Cembung dibagian
tengah Putih
Sp12 Tidak beraturan Rata Rata Putih
Sp 13 Bikonveks Rata Rata Putih
Sp 14 Bulat Rata Rata Putih
Sp 15 Bulat Rata Ketinggian nyata terlihat Putih
Sp 16 Tidak beraturan Rata Rata Putih
Sp 17 Bulat Berlekuk Rata Putih
Sp 18 Bulat Rata Ketinggian nyata terlihat putih
Sp 19 Bulat Rata Cembung dibagian
tengah putih
Bentuk koloni didominasi oleh bentuk bulat yang merupakan salah satu ciri BAL.
Tepi koloni tergolong seragam yaitu rata, hanya beberapa yang berbeda seperti berlekuk dan bergelombang. Elevasi koloni terlihat beragam dan berbeda masing- masing isolat, kebanyakan isolat berwarna putih dan kuning. Yulvizar (2015) mengisolasi BAL dari Jruek Drien dan memperoleh 24 isolat yang seluruh isolat berbentuk bulat dengan koloni berwarna putih dan krem. Mustopa (2014) melaporkan BAL yang diisolasi dari tempoyak (durian fermentasi) yang berasal dari Indonesia dan Malaysia memiliki jenis yang berbeda. Pada penelitian (Issa, 2000) hasil isolasi dari tempoyak yang berasal dari Malaysia didapati jenis L.
fermentum, L. brevis, L. mali, sedangkan pada penelitian (Wirawati, 2002) hasil isolasi dari tempoyak yang berasal dari Indonesia didapati jenis L. plantarum, L.
corynebacteria. Yuliana (2005) menyatakan bakteri yang berperan dalam fermentasi durian adalah bakteri kelompok malolaktat yang memetabolisme asam malat menjadi asam laktat. Keberadaan asam organik yang diproduksi oleh BAL selama fermentasi memberi kontribusi pada aroma dan keasaman tempoyak.
Kondisi lingkungan di Indonesia yang berbeda menyebabkan kandungan pada makanan fermentasinya juga berbeda. Itu memungkinkan untuk mengkoleksi BAL dengan karakteristik yang unik.
4.1.2 Pengamatan Mikroskopis dan Uji Biokimia Isolat dari Jerok
Isolat yang diduga sebagai BAL memiliki kriteria antara lain Gram positif, sel berbentuk batang atau kokus, tidak membentuk spora, kebanyakan tidak motil, katalase negatif, memfermentasi karbohidrat dan membentuk asam laktat sebagai produk akhirnya (Aguiree & collin, 1993). Hasil pengamatan dapat dilihat pada Tabel 2
Tabel 2. Pewarnaan Gram dan uji biokimia isolat yang berasal dari Jerok
Ket : KK (Slant Kuning, Butt Kuning), MM (Slant Merah, Butt Merah), MK (Slant Merah, Butt Kuning)
Pada penelitian ini hasil pewarnaan menunjukkan keseluruhan isolat bersifat gram positif dengan sel berbentuk batang. Pada uji hidrolisa pati didapati hasil reaksi yang sama pada semua isolat yaitu tidak membentuk zona bening setelah ditetesi lugol pada media pati. Semua isolat tidak mampu menghasilkan enzim amilase sehingga tidak dapat menghidrolisis pati. Putri et al (2012) mengisolasi 63 isolat BAL dari growol, sebanyak 50 isolat diantaranya tidak mampu tumbuh pada media pati.
Isolat Uji Hidrolisis Pati
Uji Hidrogen
Sulfida Uji Sitrat Motilitas Katalase
Sp 1 Negatif KK Negatif Nonmotil Negatif
Sp 2 Negatif MM Negatif Nonmotil Positif
Sp 3 Negatif KK Negatif Nonmotil Negatif
Sp 4 Negatif KK Negatif Nonmotil Negatif
Sp 5 Negatif KK Negatif Nonmotil Negatif
Sp 6 Negatif KK Negatif Nonmotil Negatif
Sp 7 Negatif MM Negatif Motil Positif
Sp 8 Negatif KK Negatif Nonmotil Negatif
Sp 9 Negatif MK Positif Motil Positif
Sp 10 Negatif KM Negatif Nonmotil Negatif
Sp 11 Negatif MM Negatif Motil Positif
Sp12 Negatif MM Negatif Motil Positif
Sp 13 Negatif KK Negatif Nonmotil Negatif
Sp 14 Negatif KK Negatif Nonmotil Negatif
Sp 15 Negatif KK Negatif Nonmotil Negatif
Sp 16 Negatif KK Negatif Nonmotil Positif
Sp 17 Negatif KK Negatif Nonmotil Positif
Sp 18 Negatif MK Negatif Nonmotil Positif
Sp 19 Negatif KK Negatif Nonmotil Positif
Pada uji biokimia setiap isolat menunjukkan reaksi yang berbeda. Seperti pada uji hidrogen sulfida setiap isolat menunjukkan reaksi yang beragam, tetapi kebanyakan isolat mampu memfermentasi ketiga jenis gula yaitu glukosa, laktosa dan sukrosa yang dilihat dari perubahan warna media dari merah menjadi kuning seperti Sp 4, Sp 6, Sp 8 dan lainnya. Kemampuan isolat dalam memfermentasi karbohidrat berbeda. Pada uji sitrat hanya Sp 9 yang menunjukkan hasil positif, sedangkan isolat lainnya menunjukkan hasil negatif yang berarti tidak mampu menggunakan sitrat sebagai satu satunya sumber karbon. Pada uji katalase Sp 2, Sp7, Sp 9, Sp 11, Sp 12, Sp 16, Sp 17, Sp 18 dan Sp 19 menunjukkan katalase positif dan sisanya menunjukkan katalase negatif, yang artinya bakteri tidak mampu menghasilkan enzim katalase untuk mengurai H2O2 menjadi H2O dan O2. Yulvizar (2015) melaporkan 8 isolat BAL menunjukkan katalase negatif dan hanya 1 isolat yang menunjukkan katalase positif. Sanchez et al (2006) juga melaporkan dari 162 isolat yang diperoleh dari “Almagro” makanan fermentasi Spanyol, 148 isolat merupakan kelompok bakteri Gram positif, berbentuk batang atau batangkokus dan bersifat katalase negatif. Dari semua isolat hanya Sp 7, Sp 9, Sp 11 dan Sp 12 yang menunjukkan pergerakan (motil) pada media SIM.
Seperti pada penelitian Yelnetty et al (2014) diperoleh 26 isolat Gram positif dari susu kambing dengan sifat tidak motil, katalase negatif, sebanyak 16 isolat berbentuk basil dan 10 isolat berbentuk kokus.
4.2. Hasil Uji Antagonis Bakteri Asam Laktat Terhadap Escherichia coli, Staphylococcus aureus dan Salmonella thypii.
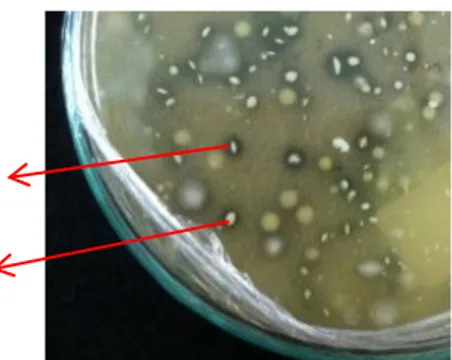
Beberapa tahun belakangan ini muncul ketertarikan penggunaan BAL sebagai pengawet alami untuk makanan. Organisme ini biasanya berperan baik sebagai mikroorganisme antagonistik pada makanan karena mereka mampu menghambat pertumbuhan bakteri patogen penyebab infeksi saluran pencernaan. Bakteri ini dapat melawan patogen dengan berbagai cara seperti memproduksi asam organik, hidrogen peroksida, dan bakteriosin (Aguiree & Collin, 1993). Dalam penelitian ini dilakukan uji kemampuan BAL dalam menekan pertumbuhan bakteri patogen (Gambar 2).
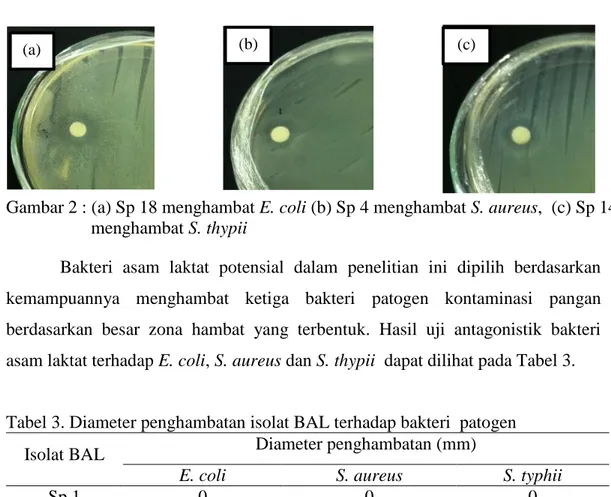
Gambar 2 : (a) Sp 18 menghambat E. coli (b) Sp 4 menghambat S. aureus, (c) Sp 14 menghambat S. thypii
Bakteri asam laktat potensial dalam penelitian ini dipilih berdasarkan kemampuannya menghambat ketiga bakteri patogen kontaminasi pangan berdasarkan besar zona hambat yang terbentuk. Hasil uji antagonistik bakteri asam laktat terhadap E. coli, S. aureus dan S. thypii dapat dilihat pada Tabel 3.
Tabel 3. Diameter penghambatan isolat BAL terhadap bakteri patogen
Isolat BAL Diameter penghambatan (mm)
E. coli S. aureus S. typhii
Sp 1 0 0 0
Sp 2 0 0 0
Sp 3 0 7 7
Sp 4 6,5 11,7 7,5
Sp 5 0 0 0
Sp 6 11,5 7,6 8
Sp 7 0 9,5 0
Sp 8 12,5 9 9,5
Sp 9 8,5 7,5 0
Sp 10 0 0 0
Sp 11 7 0 0
Sp 12 0 0 0
Sp 13 0 0 0
Sp 14 11,2 10,5 12,5
Sp 15 0 8,5 8
Sp 16 11,5 8 7
Sp 17 8 0 0
Sp 18 22 7,5 12
Sp 19 9 8 0
Dari 19 isolat hanya 5 isolat mampu menghambat tiga jenis bakteri patogen yaitu Sp 4, Sp 6, Sp 8, Sp 14 dan Sp 18, tetapi masing-masing isolat menunjukkan kemampuan yang berbeda dalam menghambat tiga jenis bakteri
(a) (b) (c)
patogen. Pada uji antagonistik terhadap bakteri E. coli isolat Sp 18 menghasilkan diameter penghambatan paling besar yaitu 22 mm. Pada bakteri S. aureus, Sp 4 menghasilkan diameter penghambatan paling besar yaitu 11,7 mm, sedangkan pada bakteri S. typhii, Sp 14 menghasilkan diameter penghambatan paling besar yaitu 12,5 mm. Lima isolat mampu menghambat tiga jenis bakteri patogen, sehingga isolat tersebut dianggap potensial untuk digunakan pada uji selanjutnya.
Berdasarkan Clinical and Laboratory Standards Institut (CLSI) standar zona hambat dikategorikan menjadi sensitif apabila terdapat diameter hambat sebesar ≥18 mm, dikategorikan intermediet apabila diameter zona hambat sebesar
≥13 sd 17 mm dan resisten apabila diameter zona hambat sebesar ≤ 12 mm (Wikler, 2006). Seperti pada penelitian Susanti et al (2007) BAL yang diisolasi dari beberapa jenis makanan menunjukkan derajat penghambatan yang berbeda.
Pada penelitiannya, isolat KJ-1 dapat menghambat S. aureus sebesar 5,5 mm sedangkan isolat KL-1 hanya menghambat sebesar 3,8 mm. Aktivitas antagonistik juga berbeda terhadap E. coli, isolat KL-3 mampu menghasilkan diameter hambat sebesar 5,8 mm. Santoso et al (2013) melaporkan bahwa L. plantarum dapat menghambat ketiga jenis bakteri patogen yaitu S. aureus dengan diameter hambat 15,3 mm, E. coli dengan diameter hambat 10 mm dan S. thypii dengan diameter hambat 10,7 mm. Lactobacillus plantarum menunjukkan penghambatan yang lebih besar pada S. aureus yang merupakan Gram positif, sedangkan pada Gram negatif L. plantarum menunjukkan penghambatan yang lebih kecil. Selanjutnya Sunaryanto (2012) yang juga melakukan pengujian aktivitas L. plantarum terhadap S. aureus dan E. coli menunjukkan bahwa L. plantarum dapat menghambat S. aureus dengan diameter hambat 16,75 mm sedangkan terhadap E.
coli dihambat dengan diameter hambatnya sebesar 13,75 mm
4.3. Kurva Pertumbuhan Bakteri Asam Laktat Potensial
Pembuatan kurva pertumbuhan bertujuan untuk mengetahui waktu yang optimal dalam memproduksi EPS, yang diperkirakan pada fase akhir logaritmik dan awal memasuki fase stasioner. Seperti pada penelitian sebelumnya oleh Malaka et al., (2005) untuk pertumbuhan populasi L. bulgaricus menunjukkan produksi EPS terjadi pada fase pertumbuhan eksponensial menuju fase stasioner.
Eksopolisakarida yang diproduksi dapat dimanfaatkan kembali oleh mikroba sebagai sumber karbon karena adanya enzim yang dihasilkan oleh bakteri itu sendiri yang dapat mendegradasi EPS.
Lima isolat yang dianggap potensial kemudian ditentukan kurva pertumbuhannya untuk mengetahui fase pertumbuhan masing-masing isolat.
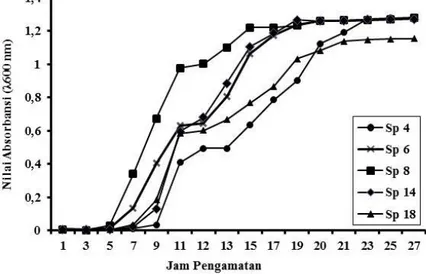
Metode yang digunakan untuk mengukur berat atau jumlah biomassa total dalam suspensi ialah mengukur kerapatan optik kultur pada media cair dengan spektrofotometer. Kultur ditumbuhkan pada media MRSB dan diinkubasi pada suhu 37 ºC dan diikuti dengan pengukuran kerapatan optik Optical Density (OD) setiap 2 jam selama 48 jam. Kurva pertumbuhan dapat dilihat pada Gambar 3.
Gambar 3. Kurva pertumbuhan lima isolat BAL pada media MRSB
Pada Gambar 3 dapat dilihat lima isolat menunjukkan pertumbuhan yang cenderung seragam. Fase adaptasi yang tergolong singkat ini mungkin terjadi karena sebelum diinkubasi, kultur telah diaktivasi pada media yang sama maka penyesuaian di lingkungan yang baru berlangsung cepat. Fase adaptasi bakteri cukup pendek yaitu Sp 6 dan Sp 8 pada 3 jam pertama. Sp 14 dan Sp 18 memasuki fase log pada jam ke- 7. Sp 4 memiliki fase adaptasi yang paling lama dibandingkan isolat yang lain yaitu memasuki fase log jam ke- 9. Isolat yang mencapai fase awal stasioner terlama adalah Sp 4 dan Sp 18 yaitu pada jam ke- 23, sedangkan Sp 6, Sp 8 dan Sp 14 telah memasuki fase awal stasioner pada jam ke 20. Sampai 35 jam pengamatan isolat tidak menunjukkan adanya pertambahan
sehingga pengamatan dihentikan. Smetankova et al (2012) juga menunjukkan kurva pertumbuhan yang berbeda dari BAL jenis L. plantarum yang ditumbuhkan pada media MRSB pada suhu 37 ºC dalam kondisi aerob memasuki fase eksponensial pada jam ke- 2 dan berakhir pada jam ke- 8. Menurut Yuliana (2008) berhentinya pertumbuhan dapat disebabkan oleh berkurangnya beberapa nutrien esensial dalam media atau karena terjadinya akumulasi autotoksin dalam media atau kombinasi dari keduanya. Dalam penelitiannya dilaporkan kurva pertumbuhan BAL isolat T5 memasuki fase eksponensial pada jam ke- 3 dan berakhir pada jam ke- 9 pada media MRSB
4.4. Produksi Eksopolisakarida Kasar
Beberapa tahun terakhir banyak penelitian yang menunjukkan kemampuan BAL dalam memproduksi EPS, penelitian EPS ini mencakup fisiologi, fermentasi, struktur kimia dan karakteristik molekul EPS, biosintesis, genetik dan rekayasa metabolik, serta sifat fungsional biomolekul ini (Madiedo et al., 2005).
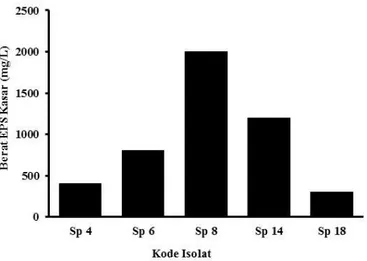
Lima isolat potensial yang telah diketahui pola pertumbuhannya kemudian dilihat kemampuannya dalam memproduksi EPS dalam media MRSB yang dimodifikasi dengan penambahan pepton dan yeast extract. Lima isolat mampu menghasilkan EPS dengan berat berkisar 300-2.000 mg/L (Gambar 4).
Gambar 4. Produksi kasar eksopolisakarida dari isolat BAL asal jerok
Eksopolisakarida yang didapatkan pada penelitian ini adalah EPS kasar karena hanya berdasarkan pengukuran gravimetri berat setelah pengeringan. Cerning
(1990) menunjukkan beberapa strain BAL yang berbeda menghasilkan EPS yang bervariasi berkisar 0,045-0,350 g/L pada kondisi media pertumbuhan yang tidak optimal. Sedangkan pada kondisi media kultur yang optimal dapat dihasilkan 0,150-0,600 g/L sesuai dengan strain bakterinya.
Dari Gambar 4 dapat dilihat bahwa Sp 8 menghasilkan EPS kasar paling tinggi yaitu 2.000 mg/L. Halim (2013) memperoleh jumlah EPS yang diproduksi oleh isolat probiotik komersial L. casei, yaitu sebesar 1.340 mg/L lebih rendah dari hasil penelitian ini. Pada penelitian ini isolat yang menghasilkan EPS kasar paling rendah adalah Sp 18 yaitu 300 mg/L. Lima isolat menunjukkan berat EPS yang berbeda walau ditumbuhkan pada media yang sama dan jumlah sel awal yang sama. Halim (2013) yang mengisolasi BAL dari sawi asin, memperoleh EPS kasar berkisar 1515-1990 mg/L sedangkan kontrol L. casei didapati EPS kasar seberat 1340 mg/L. Bukola et al (2008) juga melaporkan EPS kasar yang didapat dari BAL yang diisolasi dari makanan fermentasi Nigeria seberat 100-196 mg/L.
Seperti pada penelitian yang dilakukan oleh Nudyanto (2015) yang mengisolasi BAL dari “kimchi” makanan fermentasi Korea didapati EPS kasar berkisar 99- 427 mg/L dengan medium yang digunakan adalah MRSB yang mengandung glukosa sebagai sumber gulanya, sedangkan pada penelitian sebelumnya dilaporkan sukrosa merupakan sumber gula terbaik untuk kelompok BAL khususnya genus Lactobacillus.
Eksopolisakarida memainkan peranan penting dalam adhesi awal dan memperkokoh bakteri melekat pada permukaan yang padat, pembentukan biofilm, dan patogenisitas. Pada umumnya EPS tidak dimanfaatkan sebagai makanan oleh bakteri yang memproduksinya, tetapi S. mutans dan S. sobrinus mampu untuk mendegradasi dekstran yang dihasilkan sendiri dan menggunakan oligosakarida yang dihasilkan (Patel et al., 2012). Oleh sebab itu dengan memperpanjang waktu inkubasi dapat menurunkan jumlah EPS kasar, karena jika nutrisi pada media sudah habis digunakan oleh bakteri, EPS akan digunakan sebagai makanan.
Persiapan kultur yang berbeda akan menghasilkan viskositas yang berbeda pada masing masing kultur. Berdasarkan pada media kultur yang digunakan atau metode yang digunakan, isolasi polimer rentan terhadap berbagai kontaminasi,
sehingga perlu dilakukan purifikasi pada produksi EPS untuk menghilangkan materi asing seperti protein dan asam nukleat (Cerning, 1990).
Kebanyakan bakteri yang berlendir memproduksi EPS pada semua jenis kondisi kultur, tetapi kondisi pertumbuhan harus dioptimalisasikan untuk produksi maksimal. Produksi polisakarida umumnya akan tinggi pada kondisi aerobik.
Walaupun begitu banyak polimer yang biasanya diekskresikan selama pertumbuhan pada media padat yang mengandung sejumlah sel yang sebanding dengan pertumbuhan di media cair (Cerning, 1990). Produksi EPS dipengaruhi oleh banyak faktor salah satunya adalah media. Media dengan komposisi bahan kimia yang diketahui seperti mengandung sumber karbon, asam amino, vitamin, asam nukleat, dan garam mineral sangat cocok untuk melihat pengaruh nutrisi pada pertumbuhan, jalur metabolisme dan biosintesis EPS oleh BAL. Media ini juga akan menunjukan kuantitas dan kualitas produksi dari EPS dan komposisi yang tepat untuk produksi EPS (Degeest et al., 2001).
4.5. Ketahanan Bakteri Asam Laktat Terhadap Kondisi pH Saluran Pencernaan
Kebanyakan bakteri asam laktat tidak hanya tumbuh lebih lambat pada pH rendah tetapi mungkin juga mengalami kerusakan dan hilangnya viabilitas jika selnya berada pada kondisi pH rendah. Akan tetapi toleransi relatif dari mikroorganisme
terhadap lingkungan asam tergantung dari galur bakteri tersebut (Susanti et al., 2007)
Uji ketahanan BAL terhadap suasana asam merupakan salah satu seleksi probiotik. Pengujian ini dimaksudkan untuk melihat ketahanan BAL dalam saluran pencernaan inang. Bakteri asam laktat diharapkan mampu bertahan pada kondisi asam di lambung yaitu dengan pH sekitar 1,5-2 dan juga diharapkan dapat bertahan pada kondisi usus halus dengan pH 7-7,2 dan usus besar dengan pH 6- 7,2 selama 2- 4 jam
Lima isolat terpilih diujikan ketahanannya terhadap asam dengan menumbuhkan pada media MRSB yang telah ditambahkan HCl 1M hingga mencapai pH 2 dan NaOH 1M hingga mencapai pH 7,2. Persentase ketahanan BAL dihitung pada pH tersebut. Hasil pengujian dapat dilihat pada Gambar 5.
Gambar 5. Ketahanan bakteri asam laktat terhadap kondisi pH Saluran Pencernaan
Sp 18 menghasilkan nilai persentase ketahanan di atas 100%. Jumlah sel lebih banyak pada media perlakuan pH 2 dan 7, 2 dibandingkan dengan jumlah bakteri pada media kontrol. Empat isolat lainnya juga menunjukkan ketahanan terhadap kondisi asam. Dibandingkan isolat lainnya Sp 6 menunjukkan nilai persentase ketahanan paling rendah yaitu 79% pada pH 2 dan 82% pada pH 7,2 Semua isolat dinilai memiliki toleransi yang baik terhadap kondisi asam yaitu dengan tetap dapat tumbuh setelah diinkubasi pada pH 2 selama 2 jam dengan selisih jumlah kurang dari 2 log dan persentase ketahanan di atas 50%.
Hasil penelitian Hamida (2015) menunjukkan bahwa BAL mengalami penurunan jumlah sel sebanyak 6-7 log cfu/mL pada kondisi pH 2 dengan tingkat ketahanan hidup sebesar 41,5%, jika dibandingkan isolat BAL asal jerok memiliki ketahanan yang lebih tinggi dengan persentase ketahanan paling rendah sebesar 82%. Pada penelitian lainnya semua galur yang diujikan pada pH 2,5 selama 90 menit memiliki ketahanan yang baik untuk tumbuh (Susanti et al., 2007). Selisih log jumlah koloni pada pH rendah dibandingkan dengan kontrol kurang dari 1 unit log cfu/ml. Perbedaan ketahanan bakteri terhadap asam bergantung pada jenis bakteri yang diujikan.
Menconi et al (2014) menunjukkan BAL yang diisolasi dari kultur probiotik komersial memiliki ketahanan pada kondisi asam. Bakteri asam laktat
0 20 40 60 80 100 120
Sp 4 Sp 6 Sp 8 Sp 14 Sp 18
Ketahanan (%)
Isolat Bakteri Asam Laktat pH
7,2
Isolat sangat tahan pada pH rendah karena bakteri asam laktat bersifat asidofilik yaitu kelompok bakteri yang sangat toleransi terhadap pH rendah. Vinderolla (2003) juga melaporkan Bifidobacterium yang diinkubasi pada media MRSB dengan pH 2 memiliki ketahanan yang tinggi seperti L. acidophillus yang dapat dilihat dengan tidak adanya penurunan total mikroba jika dibandingkan dengan kontrol. Pada penelitian Argyri (2013) isolat BAL yang akan diuji ketahanannya terhadap kondisi asam disentrifugasi terlebih dahulu lalu dilarutkan pada PBS steril lalu ditumbuhkan pada media MRSB pH 2,5 dan diinkubasi selama 3 jam.
Dari 9 isolat yang diujikan seluruhnya menunjukkan ketahanan yang sangat tinggi dengan populasi akhir lebih dari 8 log cfu/mL dan selisih kurang dari 1 log cfu/mL.
Menurut Kimoto et al., (1999), toleransi terhadap asam merupakan salah satu syarat penting suatu isolat untuk dapat dikategorikan sebagai probiotik. Hal ini disebabkan apabila isolat tersebut masuk ke dalam saluran pencernaan inang, maka isolat harus mampu bertahan dari pH asam lambung yaitu sekitar 2-5.
Kebanyakan BAL tidak hanya tumbuh lebih lambat pada pH rendah, tetapi mungkin juga mengalami kerusakan dan hilangnya viabilitas jika selnya berada pada kondisi pH rendah. Akan tetapi toleransi relatif dari mikroorganisme terhadap lingkungan asam tergantung dari galur bakteri tersebut. Komposisi asam lemak dan protein penyusun membran yang beragam diantara spesies bakteri diduga mempengaruhi keragaman ketahanan bakteri terhadap suasana asam (Susanti et al., 2007)
4.6. Ketahanan Bakteri Asam Laktat Terhadap Garam Empedu
Tekanan lingkungan terhadap sel bakteri dimulai di lambung, karena lambung memiliki pH 1,5-2. Setelah bakteri lolos melewati lambung, mereka memasuki usus atas saluran tempat empedu disekresikan ke usus. Konsentrasi empedu dalam sistem pencernaan manusia sulit untuk diprediski pada saat tertentu. Setelah melewati tekanan garam empedu, organisme berkolonisasi di epitel saluran usus.
Pengujian BAL terhadap pemaparan garam empedu ini diperlukan untuk mengevaluasi kemampuan bakteri potensial probiotik untuk melawan efek garam empedu. Dengan demikian, strain yang dipilih untuk digunakan sebagai bakteri
probiotik harus mampu hidup pada kondisi asam untuk setidaknya selama 90 menit, hidup pada garam empedu, melekat pada epitel, sebelum mereka dapat memberikan manfaat kesehatan (Chou & Weimer, 1999).
Bakteri asam laktat yang mampu bertahan pada kondisi asam kemudian akan melewati usus dan bakteri harus mampu bertahan pada garam empedu yang terdapat pada usus yang disalurkan oleh usus dua belas jari. Lama bakteri berada di dalam usus berkisar 4 jam, sehingga pada perlakuan bakteri diuji tumbuhkan pada media MRSB + 0,5% oxgall (garam empedu) yang diinkubasi selama 4 jam.
Ketahanan bakteri terhadap garam empedu dapat dilihat pada Gambar 6.
Gambar 6. Ketahanan BAL terhadap oxgall (garam empedu) 0,5% pada media MRSB
Persentase ketahanan dengan nilai tertinggi diperoleh Sp 6 yaitu sebesar 99,1 %.
Nilai persentase didapatkan dari selisih jumlah bakteri yang tumbuh pada inkubasi jam ke 0 dikurang dengan jumlah bakteri yang tumbuh pada inkubasi jam ke 4.
Jika dibandingkan dengan isolat lainnya Sp 14 merupakan isolat yang memiliki nilai persentase ketahanan yang paling rendah yaitu 94,2%, sehingga dari kelima isolat, isolat Sp 14 merupakan isolat yang memiliki ketahanan terendah terhadap garam empedu. Kelima isolat dinilai memiliki ketahanan yang baik pada garam empedu karena memiliki nilai persentase ketahanan diatas 50%.
Menurut Mujnisa et al (2013) semua mikroba yang berhasil hidup setelah ditumbuhkan dalam deMan Rogosa Sharpe Agar (MRSA) yang ditambah 0,3%
Oxgall, dinyatakan bersifat tahan terhadap garam empedu. Galur-galur bakteri asam laktat dari spesies yang sama serta diisolasi dari sumber yang sama,
0 10 20 30 40 50 60 70 80 90 100 110
Sp 4 Sp 6 Sp 8 Sp 14 Sp 18
Ketahanan (%)
Isolat Bakteri Asam Laktat