1
TEORI ATOM
Tujuan Pembelajaran
Setelah mempelajari materi ini, kamu diharapkan memiliki kemampuan berikut.
1. Memahami perkembangan dari teori atom Dalton hingga teori atom mekanika kuantum.
2. Menjelaskan struktur atom berdasarkan penemuan partikel penyusun inti atom.
Para ahli di masa lampau menduga bahwa materi terbentuk dari suatu bahan dasar yang disebut atom. Oleh karena dugaan tersebut, mereka terus menerus menggali dan mengajukan teori-teori tentang model atom. Model atom hanya berupa suatu gambaran, karena para ahli tersebut tidak tahu pasti seperti apa bentuk model atom sebenarnya.
A. PERKEMBANGAN MODEL ATOM
Democritus berpendapat bahwa atom terbentuk dari partikel terkecil yang tidak dapat dibagi lagi. Pendapat Democritus ini selanjutnya disempurnakan oleh John Dalton dan terus disempurnakan oleh ilmuwan lainnya hingga terbentuk model atom modern.
a. Teori Atom Dalton 1. Model Atom Dalton
Pada tahun 1803, seorang ilmuwan berkebangsaan Inggris, John Dalton (1766 – 1844), menyampaikan gagasannya tentang model atom. Model atom menurut
kimia K
e l a s X
K-13
2
Dalton adalah sebagai berikut.
• Suatu unsur tersusun atas atom, yaitu partikel-partikel terkecil yang menyerupai bola pejal dan bersifat identik, serta tidak dapat dibagi lagi.
• Atom-atom dari unsur yang sama akan memiliki berat, ukuran, serta bentuk yang sama (identik). Atom-atom dari unsur berbeda akan memiliki sifat yang berbeda.
• Atom tidak dapat diciptakan atau dimusnahkan.
• Dua atom unsur atau lebih dapat bergabung membentuk senyawa.
2. Kelebihan Teori Atom Dalton
Teori atom Dalton dapat digunakan untuk menjelaskan hukum kekekalan massa (hukum Lavoisier) dan hukum perbandingan tetap (hukum Proust) yang berkaitan dengan massa suatu zat. Hukum Lavoisier menyatakan bahwa massa zat sebelum dan sesudah reaksi adalah sama, sedangkan hukum Proust menyatakan bahwa perbandingan massa unsur-unsur suatu zat adalah tetap.
3. Kelemahan Teori Atom Dalton
Kelemahan teori atom Dalton dapat diketahui dari munculnya penemuan-penemuan atau teori-teori berikut.
• Atom tersusun atas partikel yang lebih kecil lagi yaitu subatom yang terdiri atas proton, neutron, dan elektron.
• Atom-atom dari unsur yang sama dapat memiliki massa yang berbeda (isotop).
• Atom dari suatu unsur dapat berubah menjadi unsur lain melalui reaksi nuklir.
Gambar model atom Dalton.
b. Teori Atom Thomson 1. Model Atom Thomson
Pada tahun 1879, J.J. Thomson (1856-1940), menyampaikan gagasannya tentang model atom. Model atom menurut Thomson adalah sebagai berikut.
• Atom merupakan partikel kecil menyerupai bola pejal yang bermuatan positif
dan di dalamnya terdapat elektron-elektron bermuatan negatif yang tersebar
merata.
3
• Model atom Thomson diumpamakan seperti roti kismis. Roti diibaratkan sebagai bola pejal dan kismis yang tersebar merata sebagai elektron-elektronnya.
2. Kelebihan Teori Atom Thomson
Teori atom Thomson berhasil menyempurnakan teori atom Dalton, yaitu dalam atom terdapat partikel lain yang lebih kecil dengan muatan negatif yang disebut elektron.
3. Kelemahan Teori Atom Thomson
Kelemahan teori atom Thomson dapat diketahui dari hasil percobaan Rutherford yang menyatakan bahwa elektron-elektron dalam atom bergerak dalam lintasan tertentu. Sementara teori atom Thomson hanya mampu menjelaskan bahwa elektron-elektron tersebar merata dalam atom dan tidak bergerak.
Gambar model atom Thomson.
c. Teori Atom Rutherford
Pada tahun 1909, Ernest Rutherford (1871-1937), ilmuwan asal Selandia Baru menyampaikan gagasannya tentang model atom yang didasarkan pada percobaan penembakan sinar alfa. Hasil percobaan tersebut menghasilkan model atom Rutherford sebagai berikut.
1. Model Atom Rutherford
• Atom terdiri atas inti atom yang bermuatan positif dan dikelilingi elektron- elektron yang bergerak pada lintasannya.
• Hampir seluruh massa atom berasal dari massa intinya.
• Atom bersifat netral sehingga jumlah elektron sama dengan jumlah muatan inti atom.
2. Kelebihan Teori Atom Rutherford
Teori atom Rutherford sudah mampu menjelaskan bahwa elektron bergerak
mengelilingi inti atom pada orbit/lintasan tertentu.
4
3. Kelemahan Teori Atom Rutherford
Teori atom Rutherford bertentangan dengan teori Maxwell, yaitu jika elektron bergerak mengelilingi inti atom dan memancarkan energi, maka lama-kelamaan energi elektron akan berkurang. Hal ini mengakibatkan gaya tarik inti menguat sehingga elektron akan jatuh ke inti. Jadi, kelemahan teori atom Rutherford adalah tidak dapat menjelaskan mengapa elektron tidak tertarik dan jatuh ke inti atom.
nukleus
elektron orbit
Gambar model atom Rutherford.
d. Teori Atom Niels Bohr 1. Model Atom Niels Bohr
Pada tahun 1913, Niels Bohr (1885-1962), ilmuwan asal Denmark menyampaikan gagasannya tentang model atom. Model atom menurut Bohr adalah sebagai berikut.
• Atom terdiri atas inti atom yang bermuatan positif dan dikelilingi oleh elektron- elektron bermuatan negatif yang bergerak pada lintasannya (kulit atom).
• Pada keadaan stasioner, energi elektron bersifat konstan sehingga lintasan elektron tetap dan elektron tidak jatuh ke inti.
• Elektron dapat berpindah dari kulit yang satu ke kulit lainnya dengan pemancaran atau penyerapan energi. Jika elektron berpindah dari kulit yang lebih dalam ke kulit yang lebih luar, maka akan disertai penyerapan energi.
Sebaliknya, jika elektron berpindah dari kulit yang lebih luar ke kulit yang lebih dalam, maka akan disertai pemancaran energi.
2. Kelebihan Teori Atom Niels Bohr
Teori atom Niels Bohr telah berhasil menjelaskan mengapa elektron tidak jatuh ke
inti atom, yaitu karena energi elektron konstan sehingga lintasan elektron tetap.
5
3. Kelemahan Teori Atom Niels Bohr
Teori ini hanya dapat menjelaskan spektrum dari atom atau ion yang mengandung satu elektron, tetapi tidak dapat menjelaskan spektrum atom atau ion yang mengandung banyak elektron.
–
– –
+
Gambar model atom Niels Bohr.
e. Teori Atom Mekanika Kuantum
Teori atom mekanika kuantum diprakarsai oleh penemuan-penemuan beberapa ilmuan berikut.
1. Max Planck
Menurut Max Planck, atom-atom hanya dapat menyerap atau memancarkan energi pada paket-paket gelombang tertentu yang disebut kuanta. Energi setiap kuanta bergantung pada frekuensi radiasi yang dipancarkan atau diserap.
E = hv
Keterangan:
E = energi (J);
h = ketetapan Planck (6,63 × 10
–34Js); dan v = frekuensi radiasi (Hz).
2. Hipotesis Louis de Broglie
Louis de Broglie menyatakan bahwa elektron mempunyai dualisme sifat, yaitu sebagai partikel dan sebagai gelombang. Louis de Broglie juga telah berhasil merumuskan sebuah persamaan yang menghubungkan antara karakteristik partikel dan gelombang berdasarkan gabungan rumus Einstein dan Max Planck berikut.
• Persamaan Einstein: E = mc
2• Persamaan Max Planck: E = hv
6
Dengan demikian, diperoleh:
mc hv
mc h c
m h
c
2 2
=
=
= λ λ
Keterangan:
m = massa partikel (kg);
h = ketetapan Planck (6,63 × 10
–34Js);
λ = panjang gelombang (m); dan c = kecepatan cahaya (3 × 10
8m/s).
3. Asas ketidakpastian Heisenberg
Werner Heisenberg menyatakan bahwa posisi dan momentum elektron tidak dapat ditentukan secara pasti, yang dapat ditentukan hanyalah probabilitas menemukan elektron pada jarak tertentu dari inti atom (orbital elektron).
4. Erwin Schrödinger
• Erwin Schrödinger berhasil mengemukakan teori atom modern atau teori atom mekanika kuantum, yaitu keadaan elektron pada saat tertentu tidak dapat ditentukan secara pasti, yang ada hanyalah peluang atau probabilitasnya.
• Gerakan elektron pada lintasannya menyerupai gelombang. Erwin Schrödinger telah berhasil menyusun persamaan gelombang untuk elektron dengan menggunakan prinsip mekanika kuantum.
• Menurut Erwin Schrödinger, elektron yang mengelilingi ini terdapat pada suatu orbital, yaitu daerah dengan kemungkinan terbesar ditemukannya elektron.
Orbital digambarkan sebagai awan elektron atau pola titik-titik. Semakin rapat titik-titiknya, semakin besar kemungkinan elektron ditemukan.
Gambar model atom mekanika kuantum.
7
B. PARTIKEL PENYUSUN ATOM
Atom tersusun atas partikel-partikel subatom yaitu proton dan neutron yang berada di inti atom, serta elektron yang mengelilingi inti atom.
a. Penemuan Elektron
Elektron ditemukan oleh J.J. Thomson pada tahun 1897. Sejarah penemuan elektron tersebut diawali oleh penemuan-penemuan ilmuwan sebelumnya sebagai berikut.
1. Sir Humpry
Pada tahun 1821, seorang ahli fisika Inggris, Sir Humpry berhasil menemukan bahwa gas dapat menjadi penghantar yang lebih baik pada tekanan rendah.
2. William Crookes
Tahun 1879, William Crookes berhasil menyempurnakan susunan tabung pengawan muatan. Pada bagian ujung tabung, terdapat dua pelat logam yang berfungsi sebagai elektroda (sambungan listrik). Pada tekanan rendah dan tegangan tinggi, gas dalam tabung akan berpijar dengan warna sesuai jenis gasnya. Jika tekanan gas dikurangi, maka daerah depan katoda akan menjadi gelap, tetapi bagian depan katoda berpendar kehijauan. Hal ini disebabkan oleh adanya radiasi yang memancar dari katoda menuju anoda. Radiasi ini disebut sinar katoda.
Sinar terusan Sinar katoda
Tegangan Tinggi Anoda
+
Katoda –
Sumber: belajarkimia.com
3. Karl Ferdinand Braun
Berdasarkan penemuan Crookes, pada tahun 1897, Karl Ferdinand Braun berhasil mengembangkan osiloskop pertama dengan menggunakan tabung sinar katoda.
Tabung tersebut dibuat dari tabung kaca yang dialiri arus listrik searah, dari kutub
positif (anoda) dan dari kutub negatif (katoda).
8
Super (Solusi Quipper)
KNAP
Katoda Negatif, Anoda Positif
Pada tahun yang sama dengan penemuan Karl Ferdinand Braun, yaitu tahun 1897, J.J. Thomson berhasil menemukan elektron. Thomson memperjelas penemuan sinar katoda dengan menentukan simpangan sinar katoda dalam medan listrik. Selain itu, Thomson juga telah berhasil menentukan nilai perbandingan muatan terhadap massa ( e
m ) partikel sinar katoda yaitu sebesar 1,76 × 10
8Cg
–1. Partikel sinar katoda selanjutnya oleh Thomson disebut dengan elektron yang dilambangkan dengan e.
Untuk lebih jelasnya, berikut ini merupakan sifat-sifat dari sinar katoda/elektron.
• Bergerak lurus dari katoda menuju anoda.
• Dibelokkan oleh medan magnet dan medan listrik ke kutub positif, sehingga membuktikan sinar katoda muatannya negatif.
• Sifat sinar katoda tidak dipengaruhi oleh kawat elektroda maupun gas yang digunakan dalam tabung.
• Muatan elektron = –1,6 × 10
–19coulomb.
• Massa elektron = 9,107 × 10
–28gram (berdasarkan percobaan tetes minyak Millikan).
b. Penemuan Proton
Proton ditemukan oleh Goldstein pada tahun 1886. Goldstein memodifikasi tabung sinar katoda dengan melubangi bagian tengah lempengan katoda. Pada percobaan tersebut, ditemukan sinar yang arahnya berlawanan dengan sinar katoda dan menembus lubang kanal pada lempengan katoda. Oleh karena itu, sinar tersebut dinamakan sinar kanal/
sinar terusan/sinar positif. Sinar kanal yang bermuatan positif itu selanjutnya dinamakan proton yang dilambangkan dengan p.
• Muatan proton = +1,6 × 10
–19coulomb
• Massa proton = 1,6726 × 10
–24gram
c. Penemuan Neutron
Pada tahun 1919, Aston menemukan alat spektrometer untuk menentukan massa atom
atau molekul. Melalui alatnya, Aston mengetahui bahwa massa atom tidak sama dengan
9
jumlah protonnya sehingga diduga ada partikel tidak bermuatan (netral) dalam atom yang jumlahnya dapat berbeda meski unsurnya sama, yang kemudian disebut isotop. Dugaan Aston ini terbukti benar, karena pada tahun 1932, James Chadwick, fi sikawan asal Inggris berhasil menemukan neutron.
Dalam percobaannya, James Chadwick menggunakan inti atom berilium yang ditembak dengan partikel alfa sehingga menghasilkan radiasi partikel yang memiliki daya tembus tinggi. Radiasi dengan daya tembus tinggi membuktikan bahwa partikel tersebut tidak bermuatan (netral) dan memiliki massa yang hampir sama dengan massa proton. Partikel itulah yang selanjutnya disebut sebagai neutron (n). Neutron merupakan partikel dasar penyusun inti atom dengan karakteristik berikut.
• Muatan neutron = 0
• Massa neutron = 1,6750 × 10
-24gram
Po
Berillum Parafi n
ruang gas
Polonium sumber sinar alfa
Be
O S I L L I O G R A F
Gambar skema percobaan Chadwick.
Sumber: sinn-ess-theater.de
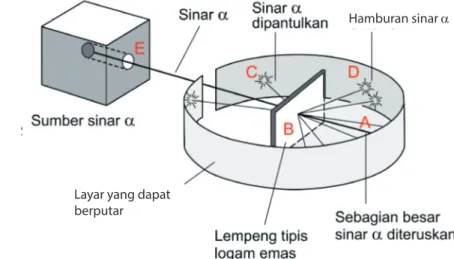
d. Penemuan Inti Atom
Inti atom ditemukan oleh Ernest Rutherford bersama dua orang asistennya, Hans Geiger dan Ernest Marsden melalui percobaan hamburan sinar alfa. Percobaan dilakukan dengan menggunakan lempeng emas tipis yang ditembaki dengan sinar alfa yang berenergi tinggi (nomor atom 2 dan nomor massa 4). Hasil percobaan tersebut sebagai berikut.
• Hampir semua partikel alfa diteruskan. Ini menunjukkan bahwa sebagian besar
bagian atom merupakan ruang hampa (kosong), bukan bola pejal.
10
• Sebagian kecil partikel alfa dibelokkan karena mengalami gaya tolak inti. Hal ini menunjukkan bahwa seluruh muatan positif dan hampir seluruh massa atom ada dalam inti atom.
• Sebagian kecil partikel alfa ada yang dipantulkan. Ini menunjukkan bahwa sebagian kecil dari bagian atom merupakan bola pejal.
Lempeng tipis logam emas
Sebagian besar sinar a diteruskan
Sinar a dipantulkan
Hamburan sinar a Sinar a
Layar yang dapat berputar Sumber sinar alfa
Gambar skema percobaan hamburan sinar alfa.
Sumber: belajarkimia.com
e. Kesimpulan
Berdasarkan penjelasan sebelumnya, dapat disimpulkan bahwa atom terdiri atas:
• inti atom yang tersusun dari neutron (netral) dan proton (bermuatan positif); dan
• elektron yang bermuatan negatif berada di sekeliling inti atom (kulit atom).
Atom
Inti atom
Kulit atom Elektron
Proton
Neutron
Nukleon
Layar yang dapatberputar
Hamburan sinar a